Способ получения производных 5-амино-1-арил-3-цианопиразола и промежуточные продукты, используемые при его осуществлении
Формула / Реферат
1. Способ получения соединения формулы (I)
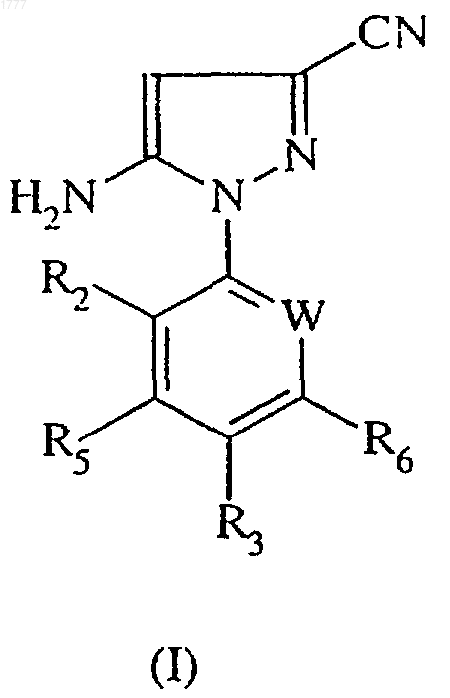
где W представляет собой атом азота или группу -CR4;
R2, R4, R5 и R6 независимо друг от друга выбираются из атомов водорода, галогена, групп C1-6алкильной, C1-6галогеналкильной, C1-6алкоксильной, C1-6галогеналкоксильной, R7S(O)n-, нитро-, циано- и -SF5;
и R3 представляет водород, галоген, группу C1-6алкильную, C1-6галогеналкильную, C1-6 алкоксильную, C1-6галогеналкоксильную, R7S(O)n-, нитро-, циано- и -SF5 или фенильную группу, имеющую от одного до пяти заместителей, выбранных из галогена, групп C1-6алкильной, C1-6галогеналкильной, C1-6алкоксильной, C1-6галогеналкоксильной, R7S(O)n-, нитро-, циано- и -SF5, которые могут быть одинаковыми или различающимися;
R7 представляет C1-6алкильную или C1-6галогеналкильную группу; и
n равно 0, 1 или 2;
который включает циклизацию в присутствии основания соединения формулы (II)
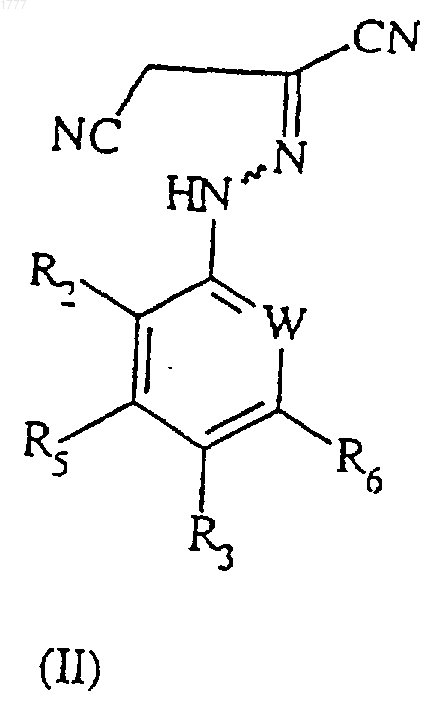
где W, R2, R3, R5 и R6 представляют собой то же, что было определено ранее.
2. Способ по п.1, в котором мольное отношение основание:соединение формулы (II) находится в пределах приблизительно 10:1.
3. Соединение формулы (II)
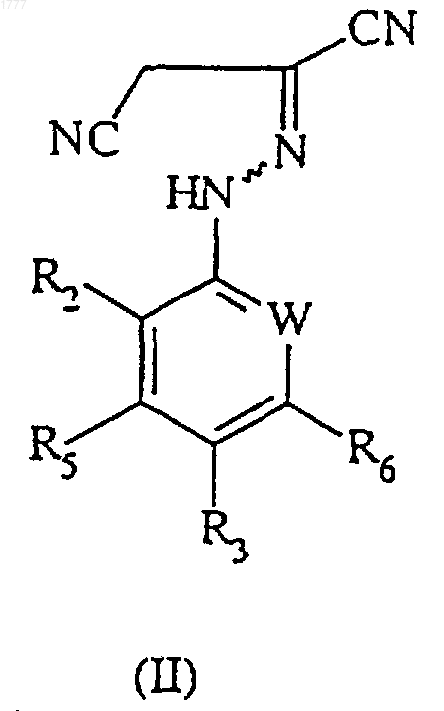
где W, R2, R3, R5 и R6 имеют значения, указанные в п.1.
4. Соединение по п.3, где
R2 представляет галоген или водород;
R3 представляет галоген, группу C1-6галогеналкильную, C1-6галогеналкоксильную, R7S(O)p-, -SF5 или фенильную, имеющую от одного до трех заместителей, выбранных из группы трифторметильной, трифторметоксильной, дифторметильной, -S(O)nСF3, дихлорфторметильной, хлордифторметильной, хлордифторметоксильной, дихлорфторметоксильной и галогена, которые могут быть одинаковыми или различающимися;
R4 представляет собой галоген, и
R5 и R6 представляют собой водород.
5. Способ получения соединения формулы (II) по п.3, включающий окисление соединения формулы (III)
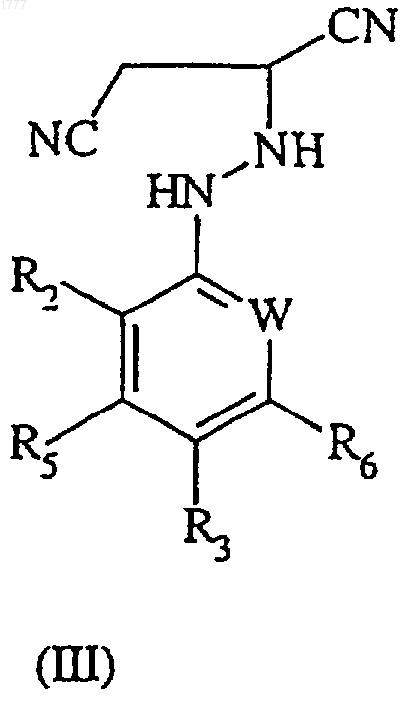
где W, R2, R3, R5 и R6 имеют значения, указанные в п.3, при использовании окислителя.
6. Способ по п.5, в котором окислитель выбирается из хинона; пероксида; гипогалогенита; гидроксида щелочного металла в присутствии воздуха; соли металла и оксида металла.
7. Способ получения соединения формулы (II) по п.3, включающий реакцию енолятной соли соединения формулы (IV)

с солью диазония формулы (V)
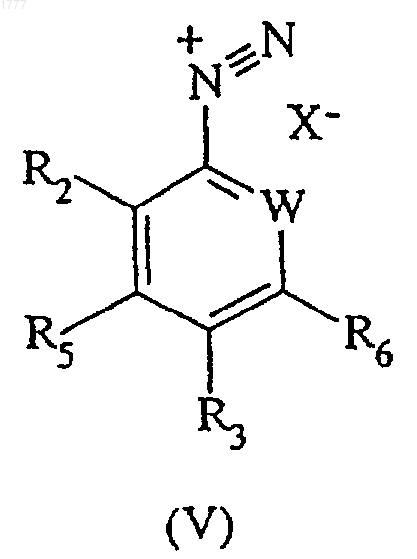
где W, R2, R3, R5 и R6 имеют значения, указанные в п.3, а Х представляет собой остаток серной кислоты или соляной кислоты.
8. Соединение формулы (III)
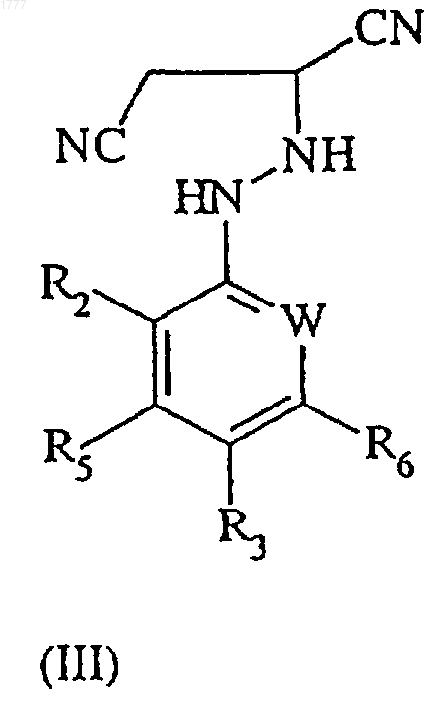
где W, R2, R3, R5 и R6 имеют значения, указанные в п.1.
9. Соединение по п.8, где
R2 представляет галоген или водород;
R3 представляет галоген, группу C1-6галогеналкильную, C1-6галогеналкоксильную, R7S(O)p-, -SF5 или фенильную, имеющую от одного до трех заместителей, выбранных из группы трифторметильной, трифторметоксильной, дифторметильной, -S(O)nСF3, дихлорфторметильной, хлордифторметильной, хлордифторметоксильной, дихлорфторметоксильной и галогена, которые могут быть одинаковыми или различающимися;
R4 представляет собой галоген; и
R5 и R6 представляют собой водород.
10. Способ получения соединения формулы (III) по п.8, включающий реакцию арилгидразина формулы (VII)
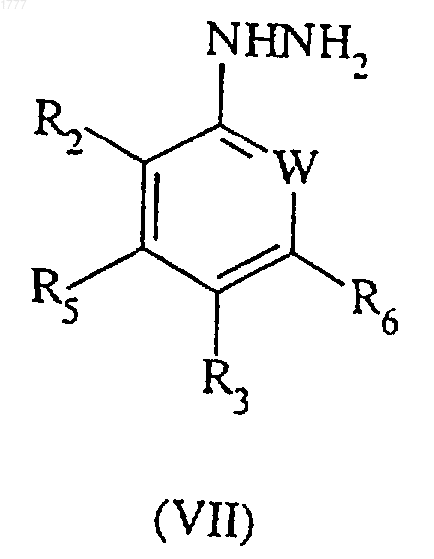
где W, R2, R3, R5 и R6 имеют значения, указанные в п.8, с соединением формулы (VIII)
CH(CN)=CH(CN) (VIII)
Текст
1 Настоящее изобретение касается способов получения пестицидных промежуточных соединений и новых соединений 2-арилгидразоносукцинонитрила и соединений 2-арилгидразиносукцинонитрила.European Patent Publication Nos. 0295117 и 0234119 описывают получение пестицидно активных соединений фенилпиразола и промежуточных соединений 5-амино-1-арил-3-цианопиразола, используемых в их синтезе. Известны различные способы получения данных соединений. Однако желательно создать улучшенные способы получения данных соединений и соединений, промежуточных для них. Известно, что арилгидразины в результате реакции Михаэля под действием электронодефицитных алкенов, таких как акрилонитрил, в полярных протоногенных растворителях, таких как спирты, и последующего окисления в щелочной среде дают 5-амино-1-арилгидразолы,как это описывается, например, в US PatentNumber 4824960. Однако заявители не имеют сведений ни о каких литературных источниках,описывающих реакцию гидразинов с фумаронитрилом. Окисление N,N1-диарилгидразинов с получением азосоединений известно. N-алкилгидразины и N-арилгидразины, которые имеют заместителя только на одном атоме азота, также окисляются с образованием азосоединений, но они обычно нестабильны и разлагаются с образованием азота и углеводородов (смотритеJ.March, Advanced Organic Chemistry, 3rd edition,page 1062). Y.H.Kim и Y.Choi описывают в Tetrahedron Letters, Vol. 37, pages 8771-4, 1996 катализируемое палладием дегидрирование альфагидразинонитрилов в присутствии циклопентена с образованием цианидов гидразонила. Однако заявители не имеют сведений о любых других ссылках, касающихся окисления гидразинов в гидразоны. Более того, публикация Kim и Choi ограничивается окислением незамещенных производных фенилгидразина и не делается никаких предположений о том, что может быть проведено окисление гидразиновых производных фумаронитрила. Первой целью настоящего изобретения является создание удобного способа получения пестицидных промежуточных соединений 5 амино-1-арил-3-цианопиразола, которые получались бы с большим выходом и с большой степенью чистоты. Еще одной целью настоящего изобретения является создание способа получения соединений 2-арилгидразоносукцинонитрила, которые могут быть использованы для получения упомянутых пестицидных промежуточных соединений 5-амино-1-арил-3-цианопиразола. И еще одной целью настоящего изобретения является создание способа получения соединений 2-арилгидразиносукцинонитрила. Кроме этого, еще одной целью настоящего изобретения является создание новых промежу 001777 2 точных соединений для производства пестицидно активных соединений. Эти и другие цели настоящего изобретения станут очевидны из последующего описания, и они достигаются целиком или частично в настоящем изобретении. В одном аспекте настоящее изобретение предлагает способ получения соединения формулы (I) циклизацией соединения формулы (II) в соответствии со схемой реакции Sc 1, приведенной ниже: где W представляет собой атом азота или группу -CR4;R2, R4, R5 и R6 независимо друг от друга выбираются из водорода, галогена, групп алкильной, галогеналкильной, алкокси, галогеналкокси, R7S(O)n-, нитро-, циано- и -SF5; и R3 представляет собой то же, что было определено для R2, или фенильную группу, необязательно имеющую от одного до пяти заместителей, выбранных из группы галогена, групп алкильной, галогеналкильной, алкокси, галогеналкокси, R7S(O)n-, нитро-, циано- и -SF5, которые могут быть одинаковыми или различающимися;R7 представляет собой алкильную или галогеналкильную группу; иn равно 0, 1 или 2. Если только другого не будет сказано в настоящем описании, "алкильная группа" представляет алкильную группу с линейной или разветвленной цепью, содержащую от одного до шести углеродных атомов (предпочтительно от одного до трех). Если только другого не будет сказано в настоящем описании, "галогеналкильная группа" и "галогеналкоксильная группа" представляют собой линейную алкильную группу или алкоксильную группу с линейной или разветвленной цепью, соответственно содержащую от одного до шести углеродных атомов (предпочтительно от одного до трех), замещенных одним или более атомами галогена,выбираемыми из фтора, хлора или брома. Предпочтительными соединениями формулы (I) являются те, которые имеют один или более из следующих признаков:R2 представляет галоген или водород;R3 представляет галоген, группу галогеналкильную (предпочтительно трифторметильную), галогеналкоксильную (предпочтительно трифторметоксильную), R7S(O)p-, -SF5 или фенильную, имеющую от одного до трех замести 3 телей, выбранных из группы, содержащей группы трифторметильной, трифторметоксильной,дифторметильной, -S(O)nСF3, дихлорфторметильной, хлордифторметильной, хлордифторметоксильной, дихлорфторметоксильной и атом галогена, которые могут быть одинаковыми или различающимися;R4 представляет собой атом галогена; иR5 и R6 представляет собой атомы водорода. В особенности предпочтительными соединениями формулы (I) являются соединения,имеющие один или более из следующих признаков:R5 и R6 представляют атомы водорода. Наиболее предпочтительно, чтобы соединением формулы (I) был 5-амино-3-циано-1(2,6-дихлор-4-трифторметилфенил)пиразол. Приведенная выше реакция Sc 1 для получения соединений формулы (I) в общем случае проводится в присутствии основания, которое может быть органическим или неорганическим. Примерами подходящих органических оснований являются амины, такие как триэтиламин или пиридин. Примерами подходящих неорганических оснований являются гидроксиды, ацетаты, карбонаты или бикарбонаты щелочных или щелочно-земельных металлов, такие как гидроксид натрия или карбонат натрия, или предпочтительно аммиак (водный или газообразный). В общем случае мольное отношение соединение формулы (I):основание находится в пределах от приблизительно 1:10 до приблизительно 10:1. Реакция, возможно, проводится в присутствии межфазного катализатора, например четвертичных аммониевых солей, таких как хлорид бензилтриметиламмония, хлорид трикаприлилметиламмония, хлорид тетраметиламмония, бромид тетра-н-пропиламмония, хлорид ндодецилтриметиламмония, хлорид тетра-нбутиламмония и бромид н-тетрадецилтриметиламмония. Реакция в общем случае проводится в растворителе, и подходящие растворители включают спирты (предпочтительно,этанол) или растворители, не смешиваемые с водой, в особенности галогенированные углеводороды, такие как дихлорэтан или дихлорметан,растворители, не смешиваемые с водой, подойдут, если будет использоваться межфазный катализатор. В качестве совместного растворителя возможно использование воды. Температура реакции в общем случае находится в диапазоне приблизительно от -20 до 50 С и предпочтительно приблизительно от 0 до 20 С. В соответствии с еще одним признаком настоящего изобретения предлагается способ получения соединения формулы (II) в результате 4 окисления соединения формулы (III), следуя приведенной ниже схеме реакции Sc 2 где W, R2, R3, R5 и R6 представляют собой то же,что было определено ранее. Предпочтительными соединениями, формулы (II) являются те, что были определены при определении W, R2, R3, R5 и R6 для приведенных выше соединений формулы (I). Наиболее предпочтительным соединением формулы (II) является 2-(2,6-дихлор-4-трифторметил-фенилгидразоно)сукцинонитрил. Соединения формулы (II) могут быть получены в качестве смеси изомеров syn и anti, и все такие формы включаются в настоящее изобретение. Подходящими окислителями для приведенной выше схемы реакции Sс 2 для получения соединений формулы (II) являются хиноны, такие как бензохинон, пероксиды, такие как перекись водорода, гипогалогениты, такие как гипохлорит натрия, или гидроксид щелочного металла, такой как гидроксид натрия, в присутствии воздуха или предпочтительно соль или оксид металла, например хлорид меди (II) или оксид ртути (II). Реакция в общем случае проводится в растворителе. Растворители, пригодные для использования, включают ароматические галогенированные или негалогенированные углеводороды, такие как толуол или хлорбензол,нитрилы, такие как ацетонитрил, или амиды,такие как N,N-диметилформамид. Температура реакции в общем случае находится в диапазоне приблизительно от 20 до 150 С и предпочтительно приблизительно от 50 до приблизительно 100 С. В соответствии с еще одним признаком настоящего изобретения предлагается способ получения соединения формулы (II) в результате реакции соединения формулы (IV), его енола или его енолятной соли с солью диазония формулы (V), следуя приведенной ниже схеме реакции Sc 3 где W, R2, R3, R5 и R6 имеют то же значение, что и определенное ранее в схеме реакции Sc 1, a X в общем случае представляет собой анионную 5 группу минеральной кислоты, такой как серная кислота или соляная кислота. Соединение (IV) в общем случае находится в форме енолятной соли, предпочтительно соли щелочного металла, например енолятная соль калия или натрия. Приведенная выше реакция Sc 3 для получения соединения формулы (II) в результате реакции соединения формулы (IV) с соединением формулы (V) протекает в результате азосочетания и деформилирования. Если использованное соединение формулы (IV) представляет собой енолятную соль металла, реакция в общем случае проводится в присутствии достаточного избытка минеральной кислоты, например серной кислоты или хлористо-водородной кислоты(которая в общем случае присутствует, если реакция диазотирования проводится в этом же реакторе), для превращения енолята металла в свободный енол. В общем случае используются такие растворители, как уксусная кислота, вода,галогенированные углеводороды, такие как дихлорметан или дихлорэтан, галогенированные ароматические соединения, такие как хлорбензол, ацетонитрил, N,N-диметилформамид или предпочтительно спирт, например этанол. Реакция может быть проведена в присутствии буфера, такого как ацетат натрия. После стадии азосочетания реакция в общем случае завершается в результате добавления слабого основания,такого как раствор гидроксида аммония, с образованием слабоосновного раствора, например,имеющего значение показателя рН, приблизительно равное 8. Температура реакции в общем случае находится в пределах приблизительно от 20 до 50 С и предпочтительно от 0 до приблизительно 20 С. Приведенная выше соль диазония формулы (V) в общем случае получается in situ в результате диазотирования соединения формулы где W, R2, R3, R5 и R6 имеют то же значение, что и определенное ранее, используя условия, известные из литературы, и в общем случае используя мольный эквивалент нитрита натрия и минеральной кислоты, такой как хлористоводородная кислота или серная кислота. В соответствии с еще одним признаком настоящего изобретения соединения формулы (II),где W, R2, R3, R5 и R6 имеют то же значение, что и определенное ранее в схеме реакции Sc 1,также могут быть получены в результате реакции соединения формулы (VI) где Ra представляет собой алкильную группу,предпочтительно этильную, с солью диазония формулы (V), где W, R2, R3, R5, R6 и Х представляют собой то же, что было определено ранее. Использованные условия реакции являются теми же, что и условия, описанные выше для приведенной выше схемы реакции Sс 3. В соответствии с еще одним признаком настоящего изобретения приведенные выше соединения формулы (III), могут быть получены в результате реакции арилгидразина формулы(VII) с соединением формулы (VIII), следуя приведенной ниже схеме реакции Sc 4 где W, R2, R3, R5 и R6 имеют то же значение, что и определенное ранее в схеме реакции Sc 1. Соединения формулы (VIII) известны и могут быть получены в форме цис-изомера малеонитрила или предпочтительно трансизомера фумаронитрила. Возможно использование смеси обоих изомеров. Арилгидразины формулы(VII) известны или могут быть получены известными способами. Предпочтительные соединения формулы(III) имеют те же самые значения W, R2, R3, R5 иR6, что и предпочтенные выше для соединений формулы (I). Наиболее предпочтительным соединением формулы (III) является 2-(2,6 дихлор-4-трифторметилфенилгидразино)сукцинонитрил. Приведенная выше реакция образования соединений формулы (III) может быть проведена в различных растворителях, при этом предпочитаются полярные растворители, например спирты. Полярные апротонные растворители,такие как N-метилпирролидон, N,N-диметилформамид или диметилсульфоксид, особенно предпочтительны. В еще одном предпочтительном аспекте реакция проводится в отсутствие растворителя в результате нагревания смеси соединений формул (VII) и (VIII). В реакции возможно присутствие также и катализатора, такого как тетраалкиламмониевая соль, например гидроксид N-бензилтриметиламмония или аланин. Температура реакции в общем случае находится в диапазоне приблизительно от 20 до 150 С и предпочтительно приблизительно от 80 до 100 С. 7 Реакция может быть проведена при использовании мольного отношения соединения формулы (VIII) к соединению формулы (VII) в пределах приблизительно от 1:10 до 10:1 и предпочтительно приблизительно от 1:1 до 5:1,а даже еще более предпочтительно приблизительно от 1,1 до 1. Приведенные выше соединения формул(II) и (III) являются новыми, и поэтому они представляют собой еще один признак настоящего изобретения. Следующие далее неограничивающие примеры иллюстрируют настоящее изобретение. Спектры ЯМР регистрировались при использовании в качестве растворителя дейтерохлороформа. Нр 1 с обозначает высокоэффективную жидкостную хроматографию (ВЖХ), m.р. обозначает температуру плавления (т.п.). Пример 1. Получение 5-амино-3-циано-1-(2,6-дихлор 4-трифторметил-фенил)пиразола (схема реакцииSc 1). Аммиак (20 миллилитров 8%-ого раствора аммиака в воде) был добавлен к смеси 2-(2,6 дихлор-4-трифторметилфенилгидразоно)сукцинонитрила (0,077 г) в этаноле (1 мл) и воде (0,2 мл) при 0 С. Спустя 10 мин смесь была проэкстрагирована (дихлорметан) и выпарена с получением целевого соединения (0,076 г, выход 97%). Чистота 98% (при анализе ВЖХ). Пример 2. Получение 5-амино-3-циано-1-(2,6-дихлор 4-трифторметил-фенил)пиразола (схема реакцииSc 1). Раствор 2-(2,6-дихлор-4-трифторметилфенилгидразоно)сукцинонитрила (1,0 г) и бикарбоната натрия (40 мл насыщенного водного раствора) и дихлорметана (915 мл) перемешивали при 20 С в течение 3 ч при рН 9. После этого добавляли раствор карбоната натрия до тех пор,пока значение показателя рН не становилось равным 11, а перемешивание производили в течение ночи. Было добавлено небольшое количество раствора гидроксида натрия до получения рН 12, после чего спустя 3 ч было добавлено небольшое количество Aliquat 336 (торговая марка, хлорид трикаприлилметиламмония), и спустя 2 ч реакция была завершена. Дихлорметановый экстракт был промыт (вода и соляной раствор), просушен (сульфат натрия) и выпарен с получением целевого соединения. Пример 3. Получение 2-(2,6-дихлор-4-трифторметилфенилгидразоно)-сукцинонитрила (схема реакции Sc 2). Смесь 2-(2,6-дихлор-4-трифторметилфенилгидразино)сукцинонитрила (0,323 г) и хлорида меди (II) (0,175 г) нагревали в хлорбензоле при 60 С в течение 6 ч. После фильтрования и выпаривания были получены целевое соединение и 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол в виде смеси 7:1. Ко 001777 8 лоночная хроматография на силикагеле с элюированием дихлорметаном дала чистое целевое соединение, полученное в виде смеси изомеровsyn) 3,56 (с, 2 Н), 7,59 (с, 2 Н), 8,27 (с, 1 Н, обмениваемый с D2O). Пример 4. Получение 2-(2,6-дихлор-4-трифторметилфенилгидразоно)-сукцинонитрила (схема реакции Sc 3). Нитрит натрия (3,9 г) добавляли к перемешиваемой концентрированной серной кислоте(12,8 мл) и нагревали при 80 С до растворения. При 30 С была добавлена уксусная кислота (25 мл). Смесь 2,6-дихлор-4-трифторметилфениланилина (10,0 г) и уксусной кислоты (25 мл) добавляли в течение 10 мин при 20 С, поддерживая температуру ниже 25 С. Смесь нагревали при 55 С в течение 50 мин и добавляли дополнительно нитрит натрия (0,65 г) и уксусную кислоту (10 мл) и спустя 20 мин нагревали до 70 С и добавляли серную кислоту (2,8 мл). Спустя 20 мин охлажденная смесь была добавлена к смеси калиевой соли 2-гидроксиметиленсукцинонитрила (7,6 г) и ацетата натрия (35,6 г) в воде и уксусной кислоте (70 мл) при 10 С. После нагревания до 20 С в течение 1 ч был добавлен дихлорметан, а после него раствор гидроксида аммония (210 мл) до получения рН 8. Органическая фаза была отделена, промыта (вода и солевой раствор), просушена (сульфат натрия) и выпарена до получения целевого соединения в виде красно-коричневой твердой фазы (18,1 г). Перекристаллизация из гексана/трет-бутилметилового эфира дала чистое титульное соединение (6,85 г), т.п. 80-82 С. ЯМР 3,6 (с, 2 Н), 7,66 (с, 2 Н), 9,03 (с, 1 Н,обмениваемый с D2O). Пример 5. Получение 2-(2,6-дихлор-4-трифторметилфенилгидразино)-сукцинонитрила (схема реакции Sc 4). Смесь 2,6-дихлор-4-трифторметилфенилгидразина (1,0 г) и фумаронитрила (1,0 г) в диметилсульфоксиде (10 мл) нагревали при 100 С в течение 7 ч. Охлажденная смесь была разбавлена водой и проэкстрагирована (простой эфир) с получением после выпаривания и кристаллизации из дихлорметана/гексана целевого соединения (0,828 г, 63%), т.п. 101-102 С. Пример 6. Получение 2-(фенилгидразино)сукцинонитрила (схема реакции Sc 4). Смесь фенилгидразина (4,29 г) и фумаронитрила (3,1 г), где фенилгидразин использовался в качестве растворителя, нагревали при 75-80 С в течение 20 ч. Очистка путем тонкослойной хроматографии на силикагеле и кристаллизация из дихлорметана/гексана дали целевое соединение (3,29 г, 45%), т.п. 97-98 С. В то время как настоящее изобретение было описано в терминах различных предпочтительных вариантов реализации, квалифицированный специалист будет осознавать, что без отклонения от духа изобретения могут быть проведены различные модификации, замещения, опущения и изменения. Соответственно этому предполагается, что объем притязаний настоящего изобретения будет ограничен исключительно объемом притязаний следующей далее формулы изобретения, включая ее эквиваленты. 2. Способ по п.1, в котором мольное отношение основание:соединение формулы (II) находится в пределах приблизительно 10:1. 3. Соединение формулы (II)R2 представляет галоген или водород;R3 представляет галоген, группу C1-6 галогеналкильную,C1-6 галогеналкоксильную,R7S(O)p-, -SF5 или фенильную, имеющую от одного до трех заместителей, выбранных из группы трифторметильной, трифторметоксильной, дифторметильной, -S(O)nСF3, дихлорфторметильной, хлордифторметильной, хлордифторметоксильной, дихлорфторметоксильной и галогена, которые могут быть одинаковыми или различающимися;R5 и R6 представляют собой водород. 5. Способ получения соединения формулы(II) по п.3, включающий окисление соединения формулы (III) 1. Способ получения соединения формулы где W представляет собой атом азота или группу -CR4;R2, R4, R5 и R6 независимо друг от друга выбираются из атомов водорода, галогена,групп C1-6 алкильной, C1-6 галогеналкильной,C1-6 алкоксильной,C1-6 галогеналкоксильной,R7S(O)n-, нитро-, циано- и -SF5; и R3 представляет водород, галоген, группуC1-6 алкильную, C1-6 галогеналкильную, C1-6 алкоксильную, C1-6 галогеналкоксильную, R7S(O)n-,нитро-, циано- и -SF5 или фенильную группу,имеющую от одного до пяти заместителей, выбранных из галогена, групп C1-6 алкильной,C1-6 галогеналкильной, C1-6 алкоксильной, C1-6 галогеналкоксильной, R7S(O)n-, нитро-, циано- и-SF5, которые могут быть одинаковыми или различающимися;n равно 0, 1 или 2; который включает циклизацию в присутствии основания соединения формулы (II) где W, R2, R3, R5 и R6 имеют значения, указанные в п.3, при использовании окислителя. 6. Способ по п.5, в котором окислитель выбирается из хинона; пероксида; гипогалогенита; гидроксида щелочного металла в присутствии воздуха; соли металла и оксида металла. 7. Способ получения соединения формулы(II) по п.3, включающий реакцию енолятной соли соединения формулы (IV) с солью диазония формулы (V) где W, R2, R3, R5 и R6 представляют собой то же,что было определено ранее. где W, R2, R3, R5 и R6 имеют значения, указанные в п.3, а Х представляет собой остаток серной кислоты или соляной кислоты. 8. Соединение формулы (III)R2 представляет галоген или водород;R3 представляет галоген, группу C1-6 галогеналкильную,C1-6 галогеналкоксильную,R7S(O)p-, -SF5 или фенильную, имеющую от одного до трех заместителей, выбранных из группы трифторметильной, трифторметоксильной, дифторметильной, -S(O)nСF3, дихлорфторметильной, хлордифторметильной, хлордифторметоксильной, дихлорфторметоксильной и галогена, которые могут быть одинаковыми или различающимися;R5 и R6 представляют собой водород. 10. Способ получения соединения формулы (III) по п.8, включающий реакцию арилгидразина формулы (VII)
МПК / Метки
МПК: C07C 251/76, C07D 231/38
Метки: продукты, осуществлении, производных, 5-амино-1-арил-3-цианопиразола, получения, способ, промежуточные, используемые
Код ссылки
<a href="https://eas.patents.su/7-1777-sposob-polucheniya-proizvodnyh-5-amino-1-aril-3-cianopirazola-i-promezhutochnye-produkty-ispolzuemye-pri-ego-osushhestvlenii.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 5-амино-1-арил-3-цианопиразола и промежуточные продукты, используемые при его осуществлении</a>
Предыдущий патент: Громкоговоритель
Следующий патент: Косметическая композиция в аэрозольной упаковке и способ косметической обработки кератиновых волокон
Случайный патент: Способ разделения газов











