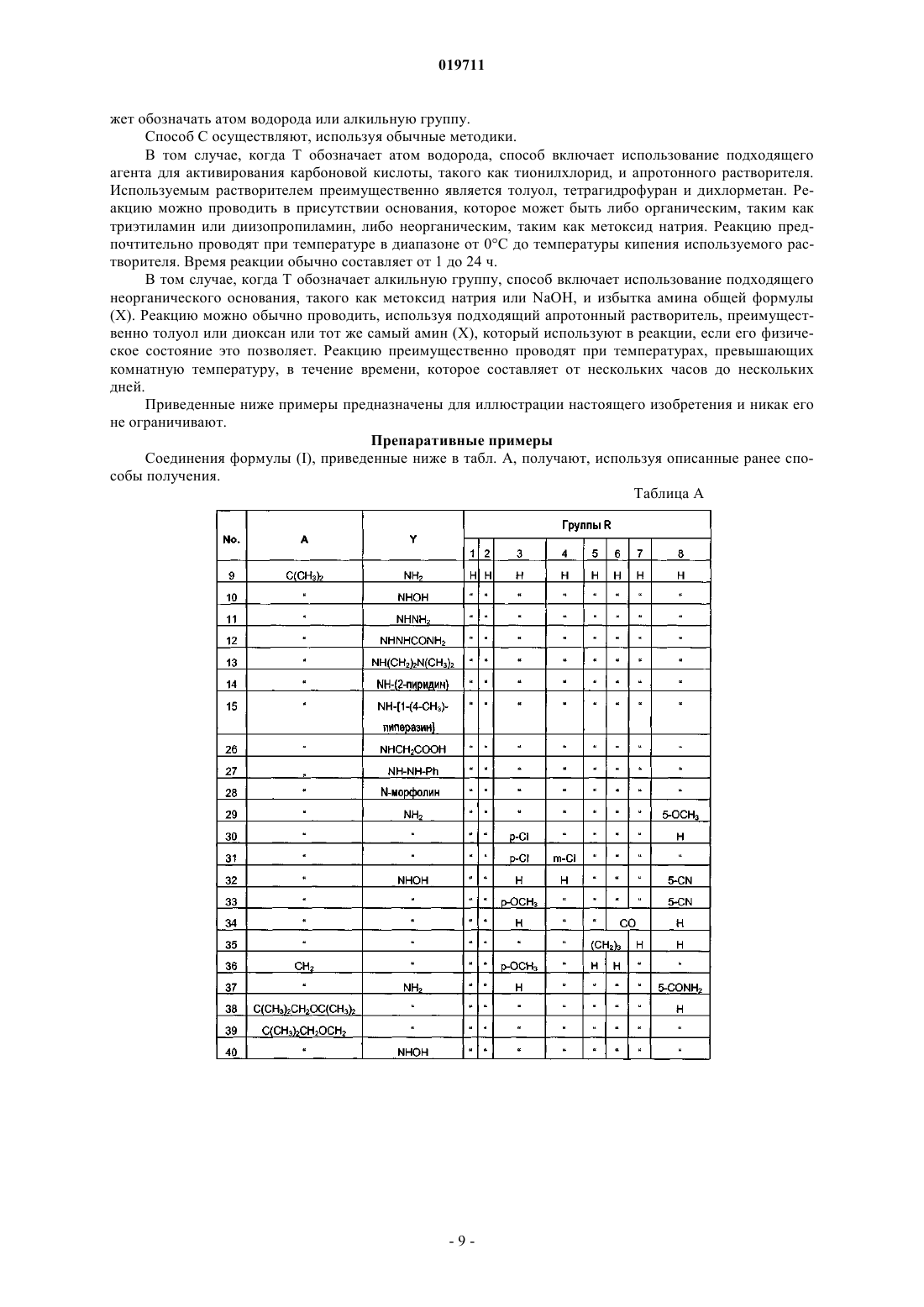
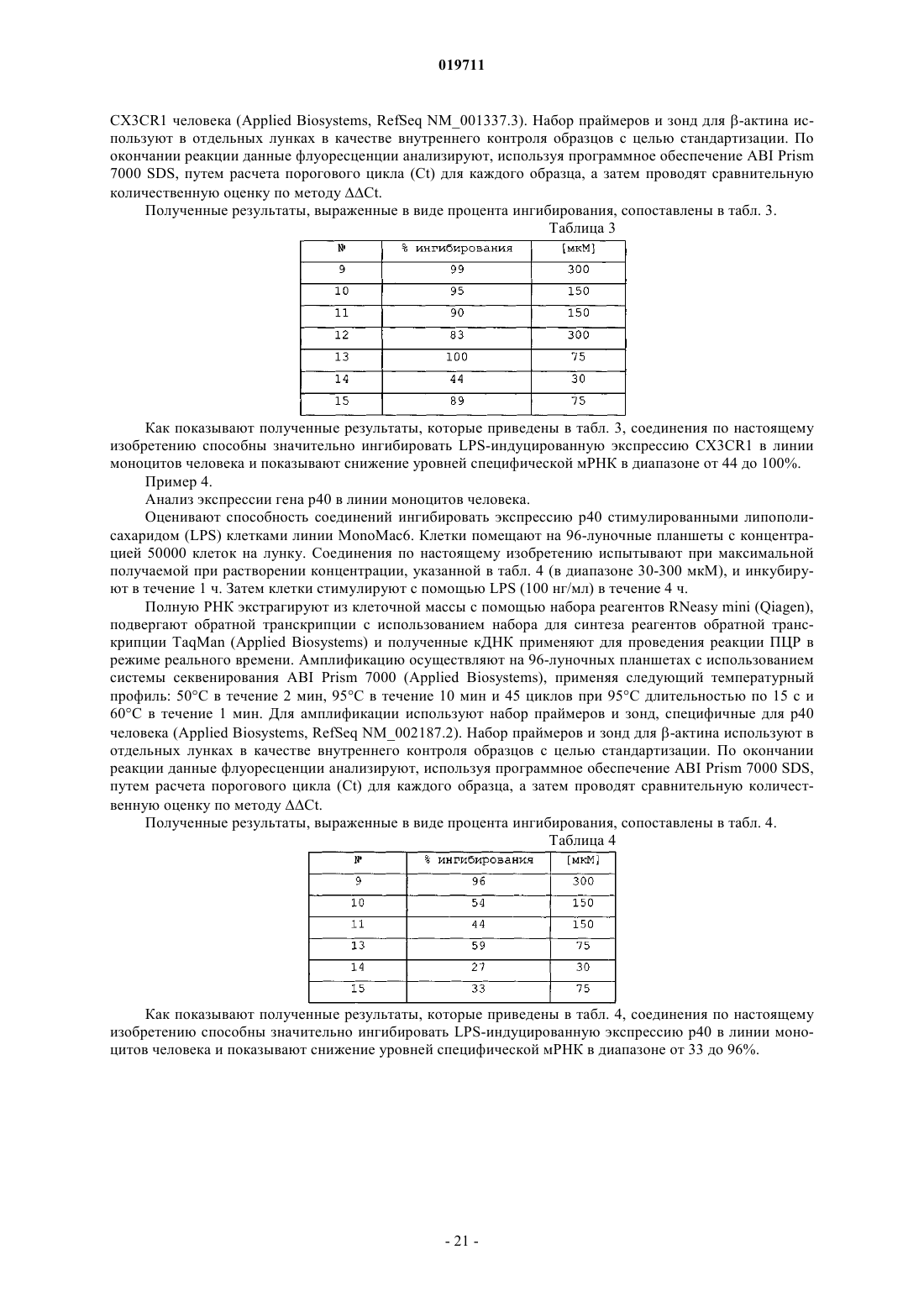
Производные 1-бензил-3-гидроксиметилиндазола, содержащая их фармацевтическая композиция и их применение при лечении заболеваний, обусловленных экспрессией мср-1, сх3cr1 или р40
Номер патента: 19711
Опубликовано: 30.05.2014
Авторы: Фурлотти Гвидо, Гульельмотти Анджело, Гарофало Барбара, Мангано Джорджина, Каццолла Никола
Формула / Реферат
1. Соединение формулы (I)
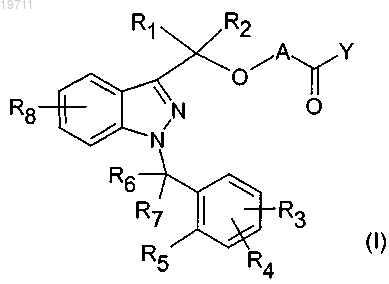
где A может обозначать -X1- или -X1-OC(R9)(R10)-, где
X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;
R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;
Y может обозначать N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, где
R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;
R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;
R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;
R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), где
R' и R" представлены атомом водорода;
X2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;
X3 обозначает ОН;
R1 и R2 обозначают атом водорода;
R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", где
R' и R" представлены атомом водорода;
R5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;
R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода.
2. Соединение по п.1, отличающееся тем, что Х1 обозначает алкиленовую группу, имеющую от 1 до 3 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 3 атомов углерода.
3. Соединение по п.1, отличающееся тем, что X1 выбран из группы, которая включает группу CH2, группу CH2CH2 или группу C(CH3)2, a R9 и R10, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода или группу CH3.
4. Соединение по п.1, отличающееся тем, что остаток A выбран из группы, которая включает группу СН2, группу СН2СН2, группу C(CH3)2.
5. Соединение по п.1, отличающееся тем, что R11 обозначает атом водорода или R11 вместе с R12 образует 5- или 6-членный гетероцикл, представляющий собой морфолинил или пиперазинил.
6. Соединение по п.1, отличающееся тем, что R12 обозначает атом водорода, гетероарильную группу, содержащую 6 членов и по меньшей мере один N атом.
7. Соединение по п.1, отличающееся тем, что R13 и R15, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода.
8. Соединение по п.1, отличающееся тем, что R14 обозначает алкильную группу, содержащую от 1 до 3 атомов углерода, арильную группу, содержащую 6 членов, CON(R')(R"), где R' и R" представлены атомом водорода.
9. Соединение по п.1, отличающееся тем, что X2 обозначает алкиленовую группу, имеющую от 1 до 3 атомов углерода.
10. Соединение по п.1, отличающееся тем, что X3 обозначает ОН.
11. Соединение по п.1, отличающееся тем, что R1 и R2 обозначают атом водорода.
12. Соединение по п.1, отличающееся тем, что R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, выбраны из группы, которая включает атом водорода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом Br, Cl или F, -CN, -CONR'R", где R' и R" представлены атомом водорода.
13. Соединение по п.1, отличающееся тем, что R5 обозначает атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода.
14. Соединение по п.1, отличающееся тем, что R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода.
15. Фармацевтическая композиция для лечения или предупреждения заболеваний, обусловленных экспрессией, по меньшей мере, MCP-1, CX3CR1 или p40, содержащая соединение формулы (I) по любому из пп.1-14 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что указанной фармацевтически приемлемой солью является аддитивная соль с физиологически приемлемыми органическими или неорганическими кислотами и основаниями.
17. Фармацевтическая композиция по п.16, отличающаяся тем, что указанные физиологически приемлемые кислоты выбраны из группы, которая включает хлористо-водородную, бромисто-водородную, серную, фосфорную, азотную, уксусную, аскорбиновую, бензойную, лимонную, фумаровую, молочную, малеиновую, метансульфоновую, щавелевую, паратолуолсульфоновую, бензолсульфоновую, янтарную, дубильную и винную кислоты.
18. Фармацевтическая композиция по п.16, отличающаяся тем, что указанные физиологически приемлемые основания выбраны из группы, которая включает гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия, аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2-гидроксиэтил)пиперидин, N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин.
19. Фармацевтическая композиция по любому из пп.15-18, отличающаяся тем, что указанный фармацевтически приемлемый носитель выбран из группы, которая включает глиданты, связующие, разрыхлители, наполнители, разбавители, отдушки, красители, флюидизаторы, лубриканты, консерванты, увлажнители, абсорбенты и подсластители.
20. Применение соединения формулы (I)

где A может обозначать -X1- или -X1-OC(R9)(R10)-, где
X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;
R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;
Y может обозначать N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, где
R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;
R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;
R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;
R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), где
R' и R" представлены атомом водорода;
X2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;
X3 обозначает OH;
R1 и R2 обозначают атом водорода;
R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", где
R' и R" представлены атомом водорода;
R5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;
R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода,
для получения фармацевтической композиции, предназначенной для лечения заболеваний, которые обусловлены экспрессией MCP-1, CX3CR1 или р40.
21. Применение по п.20, отличающееся тем, что указанные заболевания выбраны из группы, включающей заболевания суставов, почечные заболевания, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет, инсулинорезистентность, аутоиммунные заболевания, хронические дегенеративные воспалительные заболевания и рак.
22. Применение по п.21, отличающееся тем, что указанные заболевания, которые обусловлены экспрессией MCP-1, выбраны из группы, включающей ревматоидный артрит, артрит, вызываемый вирусными инфекциями, псориатический артрит, артроз, волчаночный нефрит, диабетическую нефропатию, гломерулонефрит, поликистозное почечное заболевание, интерстициальное заболевание легких, фиброз, рассеянный склероз, болезнь Альцгеймера, ВИЧ-ассоциированную деменцию, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардию, острые коронарные болезни сердца, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после хирургических вмешательств.
23. Применение по п.21, отличающееся тем, что указанные заболевания, которые обусловлены экспрессией CX3CR1, выбраны из группы, включающей ревматоидный артрит, волчаночный нефрит, диабетическую нефропатию, болезнь Крона, язвенный колит, коронарные заболевания, рестеноз, атеросклероз, инфаркт миокарда, стенокардию и осложнения после хирургических вмешательств.
24. Применение по п.21, отличающееся тем, что указанные заболевания, которые обусловлены экспрессией p40, выбраны из группы, включающей ревматоидный артрит, псориаз, гломерулонефрит, диабет, красную волчанку, диабет, болезнь Крона и опухоли.
25. Способ лечения или предупреждения заболеваний, обусловленных экспрессией MCP-1, CX3CR1 или p40, который отличается введением нуждающемуся в этом человеку эффективного количества соединения формулы (I)
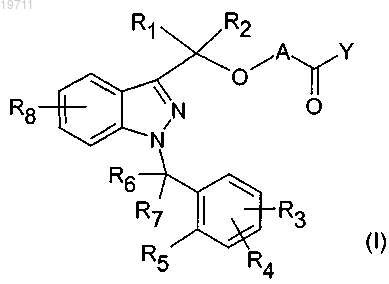
где A может обозначать -X1- или -X1-OC(R9)(R10)-, где
X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;
R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;
Y может обозначать N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, где
R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;
R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;
R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;
R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), где
R' и R" представлены атомом водорода;
X2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;
X3 обозначает OH;
R1 и R2 обозначают атом водорода;
R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", где
R' и R" представлены атомом водорода;
R5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;
R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода.
Текст
ПРОИЗВОДНЫЕ 1-БЕНЗИЛ-3-ГИДРОКСИМЕТИЛИНДАЗОЛА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ ЭКСПРЕССИЕЙ МСР-1, СХ 3CR1 ИЛИ р 40 Настоящее изобретение относится к новым производным 1-бензил-3-гидроксиметилиндазола в соответствии с приведенной в формуле изобретения формулой (I) и к фармацевтическим композициям, содержащим их вместе с фармацевтически приемлемым носителем. Кроме того,настоящее изобретение относится к применению производных 1-бензил-3-гидроксиметилиндазола для приготовления фармацевтической композиции, которая активна при лечении заболеваний,обусловленных экспрессией МСР-1, CX3CR1 или р 40, и к их применению в способе лечения или предупреждения заболеваний, обусловленных экспрессией МСР-1, CX3CR1 или р 40.(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО Область техники, к которой относится изобретение Настоящее изобретение относится к производным 1-бензил-3-гидроксиметилиндазола, к содержащим их терапевтическим композициям и их применению при лечении заболеваний, обусловленных экспрессией MCP-1, CX3CR1 или р 40. В частности, настоящее изобретение относится к новым производным 1-бензил-3 гидроксиметилиндазола в соответствии с приведенной ниже формулой (I) и к фармацевтическим композициям, содержащим их вместе с фармацевтически приемлемым носителем. Кроме того, настоящее изобретение относится к применению производных 1-бензил-3-гидроксиметилиндазола для приготовления фармацевтической композиции, которая активна при лечении заболеваний, обусловленных экспрессиейMCP-1, CX3CR1 или p40, и к их применению в способе лечения или предупреждения заболеваний, обусловленных экспрессией MCP-1, CX3CR1 или р 40. Уровень техники Как известно, MCP-1 (моноцитарный хемотактический белок-1) представляет собой белок, относящийся к -подсемейству хемокинов. MCP-1 оказывает мощное хемотактическое действие на моноциты, а также воздействует на Т-лимфоциты, мастоциты и базофилы (Rollins B.J., Chemokines, Blood 1997; 90: 909-928; М. Baggiolini, Chemokines and leukocyte traffic, Nature 1998; 392: 565-568). Другими хемокинами, относящимися к -подсемейству, являются, например, МСР-2 (моноцитарный хемотактический белок-2), МСР-3, МСР-4, MIP-1 и MIP-1, RANTES.-подсемейство отличается от -подсемейства тем, что структурно первые два цистеина соседствуют в -подсемействе, в то время как в -подсемействе они разделены промежуточной аминокислотой.MCP-1 продуцируется клетками различного типа (лейкоцитами, тромбоцитами, фибробластами,клетками эндотелия и клетками гладких мышц). Среди всех известных хемокинов MCP-1 проявляет наивысшую специфичность к моноцитам и макрофагам, для которых он является не только хемотактическим фактором, но и оказывает активирующее управляющее воздействие, тем самым вызывая процессы, с целью продуцирования многочисленных воспалительных факторов (сверхкислоты, арахидоновая кислота и производные, цитокины/хемокины), а также усиливая активность фагоцитов. Секреция хемокинов в целом, и MCP-1 в частности, как правило, индуцируется различными провоспалительными факторами, например интерлейкином-1 (IL-1), интерлейкином-2 (IL-2), TNF (фактором некроза опухолей ), интерфероном- и бактериальным липополисахаридом (LPS). Предупреждение воспалительного ответа путем блокирования системы хемокин/рецептор хемокина является одной из основных целей фармакологического воздействия (Gerard С. and Rollins B.J., Chemokines and disease. Nature Immunol. 2001; 2: 108-115). Существует множество доказательств в пользу того, что MCP-1 играет ключевую роль в воспалительных процессах и его рассматривают как новую и обоснованную цель при различных патологиях. Свидетельства значительного физиопатологического воздействия MCP-1 получены для пациентов с воспалительными заболеваниями суставов и почек (ревматоидный артрит, волчаночный нефрит, диабетическая нефропатия и отторжение после трансплантации). Тем не менее, совсем недавно MCP-1 был установлен среди факторов, вовлекаемых в воспалительные патологии ЦНС (рассеянный склероз, болезнь Альцгеймера, ВИЧ-обусловленная деменция) и другие патологии и состояния, сопровождающиеся и не сопровождающиеся явной воспалительной компонентой, включая атопический дерматит, колит, внутритканевые патологии легких, рестеноз, атеросклероз,осложнения после хирургического вмешательства (например, при пластической операции на сосудах,артерэктомии, трансплантации, замене органов и/или тканей, имплантации протезов), рак аденомы, карциномы и метастазы и даже метаболические заболевания, такие как инсулинорезистентность и ожирение. Кроме того, несмотря на тот факт, что система хемокинов участвует в контролировании и преодолении вирусных инфекций, последние исследования показывают, что ответ некоторых хемокинов, в частности MCP-1, может играть вредную роль в случае взаимодействий хозяин-патоген. В частности, MCP1 был указан среди хемокинов, которые вносят вклад в поражение органов и тканей при патологиях, опосредованных альфа-вирусами, которые характеризуются инфильтрацией моноцитов/макрофагов в суставы и мышцы (Mahalingam S. et al. Chemokines and viruses: friend or foes Trends in Microbiology 2003; 11: 383-391; Rulli N. et al. Ross River Virus: molecular and cellular aspects of disease pathogenesis. 2005; 107: 329-342). Моноциты являются основными предшественниками макрофагов и дендритных клеток и играют критическую роль в качестве медиаторов в воспалительных процессах. CX3CR1 с его лигандом CX3CL1(фракталкин) представляет собой ключевой фактор при регулировании миграции и адгезионных свойств моноцитов. CX3CR1 экспрессируется в моноцитах, в то время как CX3CL1 является трансмембранным хемокином в клетках эндотелия. Генетические исследования на моделях человека или животных показали важную роль CX3CR1 и CX3CL1 в физиопатологии воспалительных заболеваний. Фактически, многочисленные свидетельства заставляют предположить важный вклад CX3CR1 и его лиганда в патогенез и развитие воспалительных заболеваний суставов, почек, желудочно-кишечного тракта и сосудов (например, при ревматоидном артрите, волчаночном нефрите, диабетической нефропатии, болезни Крона,язвенном колите, рестенозе и атеросклерозе). Экспрессия CX3CR1 избыточно регулируется в Т-клетках, которые, как полагают, накапливаются в синовиальной оболочке пациента, страдающего от ревматоидного артрита. Кроме того, экспрессияCX3CL1 чрезмерно регулируется в клетках эндотелия и фибробластах, присутствующих в синовиальной оболочке указанных пациентов. Система CX3CR1/CX3CL1 играет важную роль при регулировании типа клеток и способа инфильтрации синовиальной оболочки и вносит свой вклад в патогенез ревматоидного артрита (Nanki T. et al., "Migration of CX3CRl-positive T cells producing type 1 cytokines and cytotoxic molecules into the synovium of patients with rheumatoid arthritis", ArthritisRheumatism (2002), vol. 46,11,p. 2878-2883). У пациентов, страдающих от почечного поражения, большинство воспалительных лейкоцитов, которые проникают в почки, экспрессируют CX3CR1 и, в частности, он экспрессируется в двух из основных клеточных типов, вовлекаемых в наиболее общие воспалительные почечные патологии и отторжения после трансплантации почек, Т-клеток и моноцитов (Segerer S. et al., Expression of the fractalkine receptor (CX3CR1) in human kidney diseases, Kidney International (2002), 62, p. 488-495). Было высказано предположение о вовлечении системы CX3CR1/CX3CL1 в воспалительную болезнь кишечника (IBD). Фактически, в случае пациентов, страдающих от IBD (в частности, при болезни Крона, язвенном колите), показано значительное усиление продукции CX3CL1 капиллярной системы кишечника и значительное увеличение CX3CR1-позитивных клеток как на уровне кровотока, так и в слизистой оболочке (Sans M. et al., "Enhanced recruitment of CX3CR1 + T cells by mucosal endothelial cellderived fractalkine in inflammatory bowel diseases", Gastroenterology, 2007, vol. 132,1, p. 139-153). Еще более интересным является доказательство ключевой роли, которую система CX3CR1/CX3CL1 играет в поражении сосудов и, в частности, в патологических условиях, например, при атеросклерозе и рестенозе. Показано, что CX3CR1 является критическим фактором в процессе инфильтрации и накопления моноцитов в стенке сосуда, а полиморфизм CX3CR1 у человека связан со сниженным распространением атеросклероза, коронарных заболеваний и рестеноза (Liu P. et al., "Cross-talk among Smad, MAPKIL-12 и IL-23 являются членами небольшого семейства провоспалительных гетеродимерных цитокинов. Оба цитокина имеют общую субъединицу, p40, которая ковалентно связана либо с субъединицей р 35 с получением зрелой формы IL-12, либо с р 19 с получением зрелой формы IL-23. Рецептор для IL-12 образован субъединицами IL-12R 1 и IL-12R 2, в то время как рецептор для IL-23 образован субъединицами IL-12R 1 и IL-23R.IL-12 и IL-23 в основном экспрессируются активированными дендритными клетками и фагоцитами. Рецепторы для двух цитокинов экспрессируются Т-клетками и природными киллерными клетками, а также природными киллерными Т-клетками, однако низкие уровни комплексов рецепторов для IL-23 присутствуют также в моноцитах, макрофагах и дендритных клетках. Несмотря на указанные сходства, существует множество доказательств в пользу того, что IL-12 иIL-23 контролируют различные иммунологические цепи. Фактически, в то время как IL-12 контролирует развитие клеток Th1, которые способны продуцировать гамма-интерферон (IFN-), и усиливает цитотоксический, антимикробный и антиопухолевый ответ, IL-23 регулирует цепь, которая приводит к генерации CD4+ клеток, которые способны продуцировать IL-17. Осуществление IL-23-зависимых процессов приводит к мобилизации различных типов воспалительных клеток, например Тн-17, и, как было показано, является критическим для патогенеза многочисленных воспалительных патологий, опосредованных иммунологической ответной реакцией. Типичными примерами патологий, связанных с экспрессией p40, являются хронические воспалительные заболевания системы суставов (например, ревматоидный артрит), системы кожи (например,псориаз) и желудочно-кишечной системы (например, болезнь Крона). Тем не менее, IL-23 играет также определенную роль в увеличении частоты распространения и развития опухолей. Фактически, IL-23 регулирует серию цепей в окружении опухоли, стимулируя развитие кровеносных сосудов и продукцию воспалительных медиаторов. Псориаз является хроническим воспалительным заболеванием кожи, которое поражает 3% населения мира (Koo J., Dermatol. Clin. 1996; 14: 485-96; Schon M.P. et al., N. Engl. J. Med. 2005; 352: 1899-912). Отклоняющийся от нормы иммунный ответ типа 1 коррелирует с патогенезом псориаза, и цитокины,которые индуцируют указанный ответ, такие как IL-12 и IL-23, могут представлять собой подходящие терапевтические объекты. Экспрессия IL-12 и IL-23, которые имеют общую субъединицу p40, значительно повышается в псориатических бляшках, и преклинические исследования доказали роль указанных цитокинов в патогенезе псориаза. Совсем недавно было показано, что лечение страдающих от псориаза пациентов с использованием моноклональных антител против IL-12 и IL-23 эффективно для улучшения признаков развития и серьезности указанного заболевания, что значительно усилило роль IL-12 и IL-23 в физиопатологии псориаза. Болезнь Крона представляет собой хроническую воспалительную патологию пищеварительной системы и может поражать любую ее область - от рта до анального отверстия. Как правило, она причиняет страдания конечному участку подвздошной кишки и вполне определенным областям толстой кишки. Она часто связана с системными аутоиммунными заболеваниями, такими как язвы рта и ревматоидный артрит. Болезнью Крона поражено более 500000 людей в Европе и более 600000 людей в Соединенных Штатах. Болезнь Крона представляет собой патологию, связанную с опосредованной Th1-клетками избыточной активностью цитокинов. IL-12 является ключевым цитокином при инициировании воспалительного ответа, опосредованного Th1-клетками. Болезнь Крона характеризуется повышенной продукциейIL-12 клетками, презентирующими антиген в тканях кишечника, и гамма-интерферона (IFN-) и TNF лимфоцитами и макрофагами кишечника. Указанные цитокины индуцируют и поддерживают воспалительный процесс и утолщение стенки кишечника, которое является характерными признаком патологии. Полученные преклинические и клинические данные показывают, что ингибирование IL-12 эффективно для регулирования воспалительного ответа в моделях воспаления кишечника и/или у пациентов, страдающих от болезни Крона. Связь между раком и воспалением в настоящее время является доказанным фактом. Многие формы опухолей возникают на месте воспаления, и в опухолях часто продуцируются медиаторы воспаления.IL-23 идентифицирован как цитокин, связанный с раком, и, в частности, экспрессия IL-23 значительно выше в образцах саркомы человека по сравнению с примыкающими нормальными тканями. Кроме того, отсутствие значимой экспрессии IL-23 в примыкающих нормальных тканях свидетельствует о чрезмерном регулировании IL-23 в опухолях, усиливающем его роль в развитии опухоли. В европейском патенте EP-B-0382276 описан ряд производных 1-бензил-3-гидроксиметилиндазола,обладающих болеутоляющей активностью. В свою очередь, в европейском патенте EP-B-0510748, с другой стороны, описано использование указанных производных для приготовления фармацевтической композиции, которая активна при лечении аутоиммунных заболеваний. Наконец, в европейском патентеEP-B-1005332 описывается применение указанных производных для приготовления фармацевтической композиции, которая активна при лечении заболеваний, обусловленных продукцией MCP-1. Как полагают, 2-метил-2-[1-(фенилметил)-1 Н-индазол-3-ил]метоксипропановая кислота в зависимости от дозы способна ингибировать продукцию MCP-1 и TNF-, индуцированную в условиях in vitro в моноцитах под действием LPS и Candida albicans, в то время как те же самые соединения не показывают эффекта на продукцию цитокинов IL-1 и IL-6 и хемокинов IL-8, MIP-1 и RANTES (Sironi M. et al., "A small syntheticmolecule capable of preferentially inhibiting the production of the CC chemokine monocyte chemotactic protein1", European Cytokine Network. Vol. 10,3, 437-41, September 1999). Европейская патентная заявка EP-A-1185528 относится к использованию производных триазина для ингибирования продукции IL-12. Европейские патентные заявки EP-A-1188438 и EP-A-1199074 относятся к применению ингибиторов фермента PDE4, например Rolipram, Ariflo и диазепининдольных производных при лечении и предупреждении заболеваний, связанных с избыточной продукцией IL-12. Европейская патентная заявка EP-A-1369119 относится к использованию гиалуронана с молекулярной массой в диапазоне от 600000 до 3000000 Дальтон (Да) для регулирования и ингибирования экспрессии IL-12. Европейская патентная заявка EP-A-1458687 относится к использованию производных пиримидина при лечении заболеваний, связанных с избыточной продукцией IL-12. Европейская патентная заявка EP-A1819341 относится к использованию азотсодержащих гетероциклических соединений, например, производных пиридина, пиримидина и триазина, для ингибирования продукции IL-12 (или других цитокинов,таких как IL-23 и IL-27, которые стимулируют продукцию IL-12). Европейская патентная заявка EP-A1827447 относится к использованию производных пиримидина для лечения заболеваний, относящихся к избыточной продукции IL-12, IL-23 и IL-27. В европейских патентных заявках EP-A-1869055, EP-A-1869056 и EP-A-1675862 описываются производные 1,3-тиазоло-4,5-пиримидина, которые способны действовать как антагонисты рецептораCX3CR1. Несмотря на проявленную вплоть до настоящего времени активность, все еще ощущается потребность в новых фармацевтических композициях и соединениях, которые эффективны при лечении заболеваний, обусловленных экспрессией MCP-1, CX3CR1 или р 40. Авторы настоящего изобретения неожиданно обнаружили новые производные 1-бензил-3 гидроксиметилиндазола, обладающие фармакологической активностью. Авторы настоящего изобретения неожиданно обнаружили, что новые производные 1-бензил-3 гидроксиметилиндазола в соответствии с формулой (I) по настоящему изобретению способны снизить продукцию хемокина MCP-1. Что удивительно, авторы настоящего изобретения неожиданно обнаружили, что новые производ-3 019711 ные 1-бензил-3-гидроксиметилиндазола в соответствии с формулой (I) по настоящему изобретению способны уменьшить экспрессию хемокина MCP-1. Что еще более удивительно, авторы настоящего изобретения неожиданно обнаружили, что новые производные 1-бензил-3-гидроксиметилиндазола в соответствии с формулой (I) по настоящему изобретению способны уменьшить экспрессию субъединицы p40, принимающей участие в продукции цитокинов IL-12 и IL-23, и экспрессию рецептора CX3CR1. Таким образом, в качестве первого аспекта настоящее изобретение включает соединения формулыX1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), гдеX2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", гдеR5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода. В соответствии со вторым аспектом настоящее изобретение относится к фармацевтической композиции, содержащей новые производные 1-бензил-3-гидроксиметилиндазола согласно формуле (I) или их фармацевтически приемлемую соль вместе по меньшей мере с одним фармацевтически приемлемым носителем. Чрезмерное регулирование и/или усиление экспрессии вышеуказанных MCP-1, CX3CR1 или p40,при этом последнее, как следствие, приводит к экспрессии/продукции IL-12 и/или IL-23, что ведет к развитию патологии и/или заболевания, в области техники часто обозначаемыми термином "сверхэкспрессия". В настоящем изобретении предполагают, что термин "экспрессия" включает сверхэкспрессию, известную из области техники. Неожиданно авторами настоящего изобретения было обнаружено, что новые производные 1 бензил-3-гидроксиметилиндазола могут применяться для приготовления фармацевтической композиции,которая активна в случае заболевания, обусловленного экспрессией хемокина MCP-1, или субъединицы Таким образом, в соответствии с еще одним аспектом настоящее изобретение относится к использованию соединения формулы (I)X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), гдеX2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", гдеR5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода,для получения фармацевтической композиции, предназначенной для лечения заболеваний, которые обусловлены экспрессией MCP-1, CX3CR1 или р 40. Кроме того, в соответствии с еще одним аспектом настоящее изобретение относится к способу лечения или предупреждения заболеваний, обусловленных экспрессией MCP-1, CX3CR1 или p40, который отличается введением нуждающемуся в этом человеку эффективного количества ранее описанного соединения формулы (I). Подробное описание изобретения В ранее описанной формуле (I) предпочтительно остаток А представлен группой Х 1 или X1OC(R9)(R10), где X1 обозначает алкиленовую группу, имеющую от 1 до 3 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 3 атомов углерода, a R9 и R10, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода. Более предпочтительно остаток А представлен группой X1 или X1-OC(R9)(R10), где X1 обозначает группу CH2, группу CH2CH2 или группу C(CH3)2, a R9 и R10, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода или группу CH3. Преимущественно, остаток А выбран из группы, которая включает группу СН 2, группу СН 2 СН 2,группу C(CH3)2, группу CH2CH2OCH2, группу CH2CH2OC(CH3)2 и группу CH2CH2CH2OC(CH3)2. В ранее описанной формуле (I) предпочтительно остаток Y представлен группой N(R11)(R12),N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15) или N(R13)-X2-CO-X3. Более предпочтительно в ранее описанной формуле (I) остаток Y представлен группой N(R11)(R12),N(R13)N(R14)(R15) или N(R13)-X2-N(R14)(R15). Преимущественно R11 представлен атомом водорода или R11 вместе с R12 образует 5- или 6-членный гетероцикл. Предпочтительно R12 представлен атомом водорода, гетероарильной группой. Предпочтительно R13 и R15, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода, алкильную группу, содержащую от 1 до 3 атомов углерода. Предпочтительно R14 обозначает алкильную группу, содержащую от 1 до 3 атомов углерода, ариль-5 019711 ную группу, CON(R')(R"), где R' и R" представлены атомом водорода. Более предпочтительно R14 обозначает атом водорода, алкильную группу, содержащую 1 или 2 атома углерода, арильную группу или CON(R')(R"), где R' и R" представлены атомом водорода. Предпочтительно X2 представлен алкильной группой, имеющей от 1 до 3 атомов углерода. Предпочтительно X3 представлен группой OH. Предпочтительно R1 и R2 обозначают атом водорода. Предпочтительно R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом Br, Cl или F, нитрогруппу или группу -CONR'R", где R' и R" представлены атомом водорода. Предпочтительно R5 обозначает атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода. Предпочтительно R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода. В случае некоторых заместителей соединение формулы (I) по настоящему изобретению может содержать асимметрический атом углерода и в таком случае оно может быть в форме стереоизомеров и энантиомеров. В зависимости от типа заместителей соединение формулы (I) может образовывать аддитивные соли с физиологически приемлемыми органическими или неорганическими кислотами и основаниями. Типичными примерами подходящих физиологически приемлемых неорганических кислот являются хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота и азотная кислота. Типичными примерами подходящих физиологически приемлемых органических кислот являются уксусная кислота, аскорбиновая кислота, бензойная кислота, лимонная кислота, фумаровая кислота, молочная кислота, малеиновая кислота, метансульфоновая кислота, щавелевая кислота, паратолуолсульфоновая кислота, бензолсульфоновая кислота, янтарная кислота, дубильная кислота или винная кислота. Типичными примерами подходящих физиологически приемлемых неорганических оснований являются гидроксиды, карбонаты и гидрокарбонаты аммония, кальция, магния, натрия и калия, например гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия и гидрокарбонат калия. Типичными примерами подходящих физиологически приемлемых органических оснований являются аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2 диметиламиноэтанол,этаноламин,этилендиамин,N-этилморфолин,N-этилпиперидин,Nметилглюкамин,глюкамин,глюкозамин,гистидин,N-(2-гидроксиэтил)пиперидин,N-(2 гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин,теобромин, триэтиламин, триметиламин, трипропиламин и трометамин. В зависимости от типа заместителей соединение формулы (I) может быть в форме сложных эфиров с физиологически приемлемыми органическими кислотами и основаниями. Соединения по настоящему изобретению могут также включать пролекарства, стереоизомеры,энантиомеры и фармацевтически приемлемые соли или сложные эфиры соединений, представленных формулой (I), которые описаны в формуле изобретения. Пролекарством соединения формулы (I) является соединение в практически неактивной форме, которое после введения живому существу в результате метаболизма превращается в соединение формулы (I). Следует понимать, что термины "фармацевтически приемлемый" и "физиологически приемлемый" означают, без каких-либо ограничений, любое вещество, подходящее для приготовления фармацевтической композиции, предназначенной для введения живому существу. Соединения формулы (I) по настоящему изобретению могут применяться для приготовления фармацевтической композиции, которая активна при лечении заболеваний (или патологий), обусловленных экспрессией хемокина MCP-1, цитокина p40, субъединицы p40 (участвующей в продукции цитокинов IL12 и IL-23) и рецептора CX3CR1. Патологиями, связанными с экспрессией MCP-1 и CX3CR1, преимущественно, являются заболевания суставов, почечные заболевания, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет, инсулинорезистентность и рак. В частности, патологиями, связанными с экспрессией MCP-1, являются ревматоидный артрит, артрит, вызываемый вирусными инфекциями, псориатический артрит, артроз, волчаночный нефрит, диабетическая нефропатия, гломерулонефрит, поликистозная почечная болезнь, интерстициальное заболевание легких, фиброз, рассеянный склероз, болезнь Альцгеймера, ВИЧ-ассоциированная деменция, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардия, острые коронарные болезни сердца, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после хирургических вмешательств, таких как, например, пластическая операция на сосудах, артэроктомия, методы восстановления нормального кровотока, трансплантации, замены органов, замены тканей и имплантации протезов. В частности, патологиями, связанными с экспрессией CX3CR1, являются ревматоидный артрит,волчаночный нефрит, диабетическая нефропатия, болезнь Крона, язвенный колит, коронарные заболева-6 019711 ния, рестеноз, атеросклероз, инфаркт миокарда, стенокардия и осложнения после хирургических вмешательств, таких как, например, пластическая операция на сосудах, артэректомия и методы восстановления нормального кровотока. Патологиями, связанными с экспрессией p40 и, таким образом, IL-12 и IL-23, преимущественно являются аутоиммунные заболевания, такие как хронические дегенеративные воспалительные заболевания,и рак. В частности, патологиями, связанными с экспрессией p40, являются ревматоидный артрит, псориаз,гломерулонефрит, диабет, красная волчанка, диабет, болезнь Крона, и опухоли, такие как, например,карцинома толстого кишечника, карцинома груди, карцинома легкого и карцинома предстательной железы, неоплазии кожи и ЦНС. Фармацевтические композиции по настоящему изобретению преимущественно готовят в виде подходящих лекарственных форм, содержащих эффективную дозу по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли, сложного эфира или пролекарства и по меньшей мере один фармацевтически приемлемый носитель. Примерами фармацевтически приемлемых носителей, известных из области техники, являются, например, глиданты, связующие, разрыхлители, наполнители, разбавители, отдушки, красители, флюидизаторы, лубриканты, консерванты, увлажнители, абсорбенты и подсластители. Практическими примерами фармацевтически приемлемых наполнителей являются сахара, такие как лактоза, глюкоза или сахароза, крахмалы, такие как кукурузный крахмал и картофельный крахмал, целлюлоза и ее производные, например натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы, смола трагаканта, солод, желатин, тальк, кокосовое масло, воски, масла, такие как арахисовое масло,хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло, гликоли, такие как пропиленгликоль, полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль, сложные эфиры, такие как этилолеат и этиллаурат, агар-агар и т.п. Примерами пригодных лекарственных форм являются таблетки, капсулы, таблетки в оболочке, гранулы, растворы и сиропы для перорального введения; медицинские пластыри, растворы, пасты, кремы и мази для чрескожного введения; суппозитории для ректального введения и стерильные растворы для инъекций или для введения в виде аэрозолей. Другими подходящими лекарственными формами являются формы с пролонгированным высвобождением и формы на основе липосом как для перорального введения, так и для введения в виде инъекций. Лекарственные формы могут также содержать другие обычные ингредиенты, такие как консерванты, стабилизаторы, поверхностно-активные вещества, буферные добавки, регуляторы осмотического давления, эмульгаторы, подсластители, красители, отдушки и т.п. Если необходимо для проведения конкретного лечения, фармацевтические композиции по настоящему изобретению могут содержать другие фармацевтически активные ингредиенты, одновременное введение которых является целесообразным. Количество соединения формулы (I) или его фармацевтически приемлемой соли, сложного эфира или пролекарства в фармацевтической композиции по настоящему изобретению может варьировать в широком диапазоне значений как функция известных факторов, например типа патологии, лечение которой проводится, тяжести заболевания, массы тела пациента, лекарственной формы и выбранного пути введения, количества ежедневных введений и эффективности выбранного соединения формулы (I). Тем не менее, специалист легко сможет определить оптимальное количество обычными способами. Как правило, количество соединения формулы (I) или его фармацевтически приемлемой соли,сложного эфира или пролекарства в фармацевтической композиции по настоящему изобретению может быть таким, что оно обеспечивает уровень введения в диапазоне от 0,001 до 100 мг/кг/день. Предпочтительно уровень введения составляет в диапазоне от 0,05 до 50 мг/кг/день и еще более предпочтительно составляет в диапазоне от 0,1 до 10 мг/кг/день. Лекарственные формы фармацевтической композиции по настоящему изобретению могут быть приготовлены в соответствии с методиками, хорошо известными химикам-фармацевтам, включая смешивание, гранулирование, прессование, растворение, стерилизацию и т.п. Активность соединений по настоящему изобретению по отношению к MCP-1 и CX3CR1 была показана в условиях in vitro в моноцитах человека посредством методов анализа генной экспрессии посредством ПЦР в режиме реального времени и анализа продукции белков посредством иммуноферментного теста. Как известно специалистам, вышеуказанные экспериментальные модели считаются пригодными для проверки активности соединений по отношению к экспрессии и продукции MCP-1 и экспрессииCX3CR1. Таким образом, вышеуказанные модели можно выбрать для прогнозирования активности для человека при лечении патологий, характеризующихся экспрессией и продукцией MCP-1, экспрессиейCX3CR1 и воспалительными состояниями в присутствии инфильтратов, обогащенных моноцитами и макрофагами. Активность соединений по настоящему изобретению по отношению к p40 продемонстрирована в условиях in vitro в моноцитах человека посредством методов анализа генной экспрессии посредством ПЦР в режиме реального времени. Как известно специалистам, вышеуказанная экспериментальная модель пригодна для проверки активности соединений по отношению к экспрессии p40 и ее можно выбрать для прогнозирования активности для человека при лечении патологий, характеризующихся экспрессиейp40. Получение соединений общей формулы (I) можно осуществить в соответствии со следующими методиками. Способ А В способе А соединения общей формулы (III) вводят во взаимодействие с соединениями формулы(IV). Заместители R1-R8, A и Y имеют значения, приведенные ранее для соединений формулы (I), a Q обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, CH3SO3- и pCH3PhSO3-. Способ А осуществляют, используя обычные методики. Например, спирты формулы (III) вводят во взаимодействие, соответственно, с производными формулы (IV), где Q обозначает уходящую группу,преимущественно выбранную из группы, которая включает атом хлора, атом брома и метансульфонильную группу. Реакцию проводят в присутствии подходящего основания и подходящего растворителя. Основаниями, которые можно с успехом применять, являются NaH, бутиллитий и диизопропиламид лития,а растворителями, которые пригодны для данного типа реакций, преимущественно являются полярные апротонные растворители, такие как тетрагидрофуран, диэтиловый эфир или 1,4-диоксан. Температура реакции предпочтительно составляет от комнатной температуры до температуры кипения используемого растворителя. Реакции данного типа могут длиться от нескольких часов до нескольких дней. Способ В В способе В соединения общей формулы (V) вводят во взаимодействие с соединениями формулы(VI). Заместители R1-R8, A и Y имеют значения, приведенные ранее для соединений формулы (I), a Q обозначает уходящую группу, которая выбрана из группы, включающей атом галогена, CH3SO3- и pCH3PhSO3-. Способ В осуществляют, используя обычные методики. Например, спирты формулы (VI) вводят во взаимодействие, соответственно, с производными формулы (V), где Q обозначает уходящую группу,преимущественно выбранную из группы, которая включает атом хлора, атом брома и метансульфонильную группу. Реакцию проводят в присутствии подходящего основания и подходящего растворителя. Основаниями, которые можно с успехом применять, являются NaH, бутиллитий и диизопропиламид лития,а растворителями, которые пригодны для данного типа реакций, преимущественно являются полярные апротонные растворители, такие как тетрагидрофуран, диэтиловый эфир или 1,4-диоксан. Температура реакции предпочтительно составляет от комнатной температуры до температуры кипения используемого растворителя. Реакции данного типа могут длиться от нескольких часов до нескольких дней. Способ С В способе С соединения общей формулы (IX) вводят во взаимодействие с соединениями формулы(X). Заместители R1-R8, A и Y имеют значения, приведенные ранее для соединений формулы (I), a T мо-8 019711 жет обозначать атом водорода или алкильную группу. Способ С осуществляют, используя обычные методики. В том случае, когда Т обозначает атом водорода, способ включает использование подходящего агента для активирования карбоновой кислоты, такого как тионилхлорид, и апротонного растворителя. Используемым растворителем преимущественно является толуол, тетрагидрофуран и дихлорметан. Реакцию можно проводить в присутствии основания, которое может быть либо органическим, таким как триэтиламин или диизопропиламин, либо неорганическим, таким как метоксид натрия. Реакцию предпочтительно проводят при температуре в диапазоне от 0C до температуры кипения используемого растворителя. Время реакции обычно составляет от 1 до 24 ч. В том случае, когда Т обозначает алкильную группу, способ включает использование подходящего неорганического основания, такого как метоксид натрия или NaOH, и избытка амина общей формулы(X). Реакцию можно обычно проводить, используя подходящий апротонный растворитель, преимущественно толуол или диоксан или тот же самый амин (X), который используют в реакции, если его физическое состояние это позволяет. Реакцию преимущественно проводят при температурах, превышающих комнатную температуру, в течение времени, которое составляет от нескольких часов до нескольких дней. Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения и никак его не ограничивают. Препаративные примеры Соединения формулы (I), приведенные ниже в табл. А, получают, используя описанные ранее способы получения. Таблица А Ниже приведены детали получения большинства соединений, указанных в табл. А. Остальные соединения получают по аналогичным методикам, используя подходящие исходные вещества и реагенты. Получение соединения 9. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропанамид. 9 а) Метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноат. Суспензию 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты (20 г; 0,062 моль)[получают, как описано в патентной заявке EP 382276] в метаноле (300 мл) при 0C в течение 4 ч обрабатывают газообразным HCl. Затем смесь выливают в воду (500 мл) и продукт экстрагируют диэтиловым эфиром (3250 мл). Органические фазы объединяют, промывают 5%-ным раствором бикарбоната натрия(2100 мл), а затем водой (50 мл). Растворитель упаривают при пониженном давлении и сырой остаток очищают кристаллизацией из гексана. Получают 18,5 г метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2 метилпропаноата; т.пл.=66-67C. 1H-ЯМР (CDCl3,м.д.): 1,56 (с, 6H), 3,77 (с, 3H), 4,87 (с, 2H), 5,54 (с, 2H), 7,0-7,4 (м, 8H), 8,03 (д,J=7,61 Гц, 1H). 9b) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропанамид. Раствор метилового эфира 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты(15 г; 0,044 моль) в метаноле (250 мл) при перемешивании при комнатной температуре обрабатывают газообразным NH3 в течение 48 ч. Затем растворитель отгоняют при пониженном давлении и сырой остаток очищают кристаллизацией из этилацетата. Получают 7,3 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропанамида; т.пл.=111-112C. 1H-ЯМР (CDCl3,м.д.): 1,58 (с, 6H), 4,88 (с, 2H), 5,57 (с, 2H), 5,64 (ушир.с, 1H), 6,94 (ушир.с, 1H),7,08-7,43 (м, 8H), 7,77 (д, J=8,04 Гц, 1H). Получение соединения 10. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-N-гидрокси-2-метилпропанамид. 10 а) Метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноат. Суспензию 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты (20 г, 0,062 моль) в метаноле (300 мл) при 0C в течение 4 ч обрабатывают газообразным HCl. Затем смесь выливают в воду(500 мл) и продукт экстрагируют диэтиловым эфиром (3250 мл). Органические фазы объединяют, промывают 5%-ным раствором бикарбоната натрия (2100 мл), а затем водой (50 мл). Растворитель упаривают при пониженном давлении и сырой остаток очищают кристаллизацией из гексана. Получают 18,5 г метилового эфира 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты; т.пл.=66-67C. 1 Н-ЯМР (CDCl3,м.д.): 1,56 (с, 6H), 3,77 (с, 3H), 4,87 (с, 2H), 5,54 (с, 2H), 7,0-7,4 (м, 8H), 8,03 (д,J=7,61 Гц, 1H). 10b) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-N-гидрокси-2-метилпропанамид. Раствор KOH (9,7 г, 0,173 моль) в метаноле (25 мл) при комнатной температуре добавляют к раствору гидрохлорида гидроксиламина (8,0 г, 0,115 моль) в метаноле (45 мл). Полученную смесь перемешивают при 0C в течение 30 мин, а затем фильтруют и полученный раствор добавляют к раствору метилового эфира 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты (19 г, 0,057 моль) в метаноле (30 мл) и CHCl3 (15 мл). Смесь перемешивают при комнатной температуре в течение 72 ч. Реакцию прерывают, концентрируя растворитель при пониженном давлении, остаток растворяют в воде(100 мл) и промывают диэтиловым эфиром (350 мл). Водную фазу подкисляют 2 н. раствором HCl и продукт экстрагируют диэтиловым эфиром (3100 мл). Органическую фазу концентрируют при пониженном давлении и полученный сырой остаток очищают двукратной кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 6 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-N-гидрокси-2-метилпропанамида; т.пл.=115-116C. 1 7,72 (д, J=8,09 Гц, 1H), 10,05 (ушир.с, 1H). Получение соединения 11. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропангидразид. К 1 М раствору гидразин-гидрата (100 мл, 0,100 моль) при перемешивании при 80C порциями добавляют метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноат (20 г, 0,060 моль). По окончании добавления смесь перемешивают при той же температуре в течение 30 мин, а затем нагревают до 120C в течение 2 ч. Реакцию прекращают, разбавив смесь водой (600 мл), и экстрагируют продукт диэтиловым эфиром (4200 мл). Органические фазы объединяют и экстрагируют 2 н. раствором HCl (4200 мл). Кислотные фазы затем подщелачивают с помощью 10 н. раствора NaOH и вновь экстрагируют диэтиловым эфиром (4200 мл). Органические фазы объединяют и концентрируют при пониженном давлении, а затем сырой продукт очищают кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 16 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаногидразида; т.пл.=92-93C. 1H-ЯМР (ДМСО-d6,м.д.): 1,41 (с, 6H), 4,30 (с, 2H), 4,73 (с, 2H), 5,62 (с, 2H), 7,15 (ддд, J=8,00; 6,98; 0,80 Гц, 1H), 7,20-7,34 (м, 5H), 7,38 (ддд, J=8,37; 6,98; 1,17 Гц, 1H), 7,66 (д, J=8,48 Гц, 1H), 7,90 (дт,J=8,11; 0,91 Гц, 1H), 8,84 (с, 1H). Получение соединения 12. 2-2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноилгидразинкарбоксамид. К раствору 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропангидразида (7,0 г, 0,021 моль) в воде (100 мл) и 3 н. HCl (15 мл) при перемешивании при комнатной температуре медленно добавляют раствор KOCN (1,8 г, 0,022 моль) в воде (30 мл). Смесь перемешивают при той же температуре в течение 30 мин, а затем реакцию прерывают, отфильтровав образовавшееся твердое вещество. Выделенное твердое вещество кристаллизуют из 95 этанола. Получают 6 г 2-2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноилгидразинкарбоксамида; т.пл.=174-175C. 1H-ЯМР (ДМСО-d6,м.д.): 1,43 (с, 6H), 4,80 (с, 2H), 5,62 (с, 2H), 5,90 (с, 2H), 7,14 (т, J=7,45 Гц, 1H),7,20-7,43 (м, 6H), 7,66 (д, J=8,48 Гц, 1H), 7,77 (с, 1H), 7,96 (д, J=8,04 Гц, 1H), 9,37 (с, 1H). Получение соединения 13. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-N-[2-(диметиламино)этил]-2-метилпропанамида гидрохлорид. К раствору 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты, которую получают, как описано в EP 382276 (19,5 г, 0,060 моль), в толуоле (150 мл) при перемешивании при комнатной температуре добавляют триэтиламин (8,4 мл, 0,060 моль). Затем смесь охлаждают до 0C и добавляют раствор этилхлорформиата (7,0 мл, 0,073 моль) в толуоле (30 мл). По окончании добавления смесь перемешивают при указанной температуре в течение 30 мин и затем добавляют N,N-диметилэтан-1,2-диамин(7,0 мл, 0,064 моль), растворенный в толуоле (30 мл). По окончании добавления смесь перемешивают при комнатной температуре в течение 24 ч. Затем смесь разбавляют диэтиловым эфиром (500 мл) и экстрагируют 1 н. раствором HCl (4150 мл). Объединенные кислые фазы промывают диэтиловым эфиром(350 мл) и подщелачивают 10 н. раствором NaOH, а затем вновь экстрагируют диэтиловым эфиром(4150 мл). Органические фазы затем промывают водой (250 мл) и насыщенным раствором NaCl (250 мл). Раствор сушат с помощью безводного Na2SO4, после чего растворитель упаривают при пониженном давлении. Полученный остаток растворяют в этилацетате (150 мл) и при комнатной температуре обрабатывают раствором HCl в этаноле (приблизительно 5 н.). Образовавшееся твердое вещество отфильтровывают и очищают кристаллизацией из смеси 9/1 этилацетат/этанол. Получают 12,1 г гидрохлорида 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-N-[2-(диметиламино)этил]2-метилпропанамида; т.пл.=136-137C. 1(ушир.с, 1H). Получение соединения 14. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метил-N-пирид-2-илпропанамид. 8 г (0,024 моль) 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты при комнатной температуре обрабатывают 30%-ным метоксидом натрия (4,33 мл, 0,024 моль) в течение 5 мин. Затем растворитель отгоняют при пониженном давлении и полученный остаток суспендируют в толуоле(160 мл), а затем к полученной суспензии при комнатной температуре добавляют 2-аминопиридин (6,8 г,0,072 моль). К полученной смеси при перемешивании при комнатной температуре медленно добавляют раствор тионилхлорида (2,1 мл, 0,029 моль) в толуоле (40 мл). По окончании добавления смесь перемешивают в течение 24 ч. Образовавшееся твердое вещество отфильтровывают и растворитель упаривают при пониженном давлении. Полученный сырой остаток очищают кристаллизацией из изопропанола.(ушир.с, 1H). Получение соединения 15. 1-Бензил-3-[1,1-диметил-2-(4-метилпиперазин-1-ил)-2-оксоэтокси]метил-1 Н-индазол. 50 мл 1-метилпиперазина (0,452 моль) при комнатной температуре обрабатывают 30%-ным метанольным раствором метоксида натрия (9 мл, 0,045 моль) в метаноле (5 мл). К полученному раствору при перемешивании при комнатной температуре добавляют 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2 метилпропановую кислоту (15 г, 0,045 моль). Полученную смесь кипятят с обратным холодильником в течение 18 ч. Реакцию прерывают, выливая смесь в воду (500 мл), и продукт экстрагируют диэтиловым эфиром (3150 мл). Органические фазы объединяют и экстрагируют 3 н. раствором HCl (3100 мл). Затем кислую фазу подщелачивают 10 н. раствором NaOH и экстрагируют диэтиловым эфиром (3150 мл). Органические фазы объединяют и концентрируют при пониженном давлении. Полученный остаток очищают кристаллизацией из смеси 1/3 гексан/этилацетат. Получают 6 г 1-бензил-3-[1,1-диметил-2-(4-метилпиперазин-1-ил)-2-оксоэтокси]метил-1 Ниндазола; т.пл.=97-98C. 1N-2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноилглицин. 4,17 г этилового эфира глицина (0,040 моль) при комнатной температуре обрабатывают 30%-ным раствором метоксида натрия в метаноле (0,46 мл), а затем растворитель отгоняют при пониженном давлении. Полученный остаток при перемешивании при комнатной температуре добавляют к раствору 2-[(1 бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты (10 г, 0,04 моль) в дихлорметане (DCM)(100 мл). Затем смесь охлаждают до 0C и к ней добавляют раствор N,N'-дициклогексилкарбодиимида(6,73 г, 0,033 моль) в DCM (25 мл). Полученную смесь перемешивают при комнатной температуре в течение 24 ч. Реакцию прерывают, отфильтровав образовавшийся осадок, а растворитель концентрируют при пониженном давлении. Сырой остаток очищают флэш-хроматографией на силикагеле, используя смесь 1/1 гексан/этилацетат в качестве элюента. Полученный продукт суспендируют в воде (100 мл) и добавляют к нему NaOH (1,28 г, 0,032 моль). Полученную смесь перемешивают при 50C в течение 16 ч, а затем охлаждают и подкисляют концентрированной HCl. Образовавшееся в результате твердое вещество очищают кристаллизацией из этанола. Получают 5,2 г N-2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропаноилглицина; т.пл.=157-158C. 1H-ЯМР (CDCl3,м.д.): 1,55 (с, 6H), 3,95 (д, J=5,74 Гц, 2H), 4,89 (с, 2H), 5,52 (с, 2H), 7,0-7,4 (м, 8H),7,6 (ушир.т, 1H), 7,77 (д, J=7,82 Гц, 1H), 10,38 (ушир.с, 1H). Получение соединения 27. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метил-N'-фенилпропангидразид. 24 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты (0,074 моль) при комнатной температуре в течение 10 мин обрабатывают 30%-ным раствором метоксида натрия в метаноле (13 мл, 0,074 моль), затем растворитель упаривают при пониженном давлении, а остаток суспендируют в толуоле (240 мл), и к полученной смеси добавляют фенилгидразин (29,1 мл, 0,296 моль). К указанной смеси при той же температуре при перемешивании медленно добавляют раствор тионилхлорида (6,3 мл,0,088 моль) в толуоле (50 мл). По окончании добавления смесь перемешивают в течение 24 ч. Образовавшееся твердое вещество отфильтровывают, а растворитель упаривают при пониженном давлении. Сырой остаток промывают гексаном (3100 мл) и смесью 10/1 гексан/этилацетат (30 мл). Сырой остаток очищают многократной кристаллизацией из изопропанола. Получают 11 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метил-N'-фенилпропангидразида; т.пл.=124-125C. 1(м, 3H), 7,1-7,4 (м, 13H), 7,78 (дт, J1, J2=7,78; 1,19 Гц, 1H), 8,99 (ушир.д, J=4,70 Гц, 1H). Получение соединения 28. 1-Бензил-3-[(1,1-диметил-2-морфолин-4-ил-2-оксоэтокси)метил]-1 Н-индазол. 72 г (0,222 моль) 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты в течение 10 мин при комнатной температуре обрабатывают 30%-ным метанольным раствором метоксида натрия (39 мл; 0,222 моль), затем растворитель упаривают при пониженном давлении, а полученный остаток суспендируют в толуоле (750 мл). К полученной суспензии при перемешивании при комнатной температуре добавляют морфолин (77,6 мл; 0,888 моль), а затем медленно добавляют раствор тионилхлорида (19,3 мл; 0,266 моль) в толуоле (150 мл). Смесь перемешивают в течение 24 ч, а затем реакцию прерывают,отфильтровав образовавшийся в результате реакции осадок. Растворитель концентрируют при пониженном давлении и полученный сырой остаток очищают кристаллизацией из изопропанола. Получают 14 г 1-бензил-3-[(1,1-диметил-2-морфолин-4-ил-2-оксоэтокси)метил]-1 Н-индазола; т.пл.=135-137C. 1 Н-ЯМР (ДМСО-d6,м.д.): 1,47 (с, 6H), 3,1-4,0 (2 ушир.с, 8H), 4,73 (с, 2H), 5,83 (с, 2H), 7,0-7,9 (м,9H). Получение соединения 29. 2-[(1-Бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метипропанамид. 29 а) Бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилат. Суспензию 5-метокси-1 Н-индазол-3-карбоновой кислоты (21,5 г; 0,11 моль) и 60%-ного NaH (10,5 г; 0,44 моль) в N,N-диметилформамиде (ДМФА) (200 мл) перемешивают при температуре 70C в течение 1 ч. Затем к указанной суспензии медленно добавляют бензилхлорид (32,9 г; 0,26 моль) и полученную смесь перемешивают при 70C в течение 4 ч. Реакцию прекращают, охладив смесь до комнатной температуры, а затем выливают смесь в воду со льдом. Продукт экстрагируют этилацетатом (3250 мл). Органические вытяжки объединяют и концентрируют при пониженном давлении. Полученный сырой остаток очищают последовательной кристаллизацией из 95 этанола и получают 18 г бензил 1-бензил-5-метокси 1 Н-индазол-3-карбоксилата с температурой плавления 107-109C. 1H-ЯМР (CDCl3,м.д.): 3,78 (с, 3H), 5,51 (с, 2H), 6,9-7,6 (м, 13H). 29b) (1-Бензил-5-метокси-1 Н-индазол-3-ил)метанол. К раствору бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилата (17,7 г; 0,05 моль), диэтилового эфира (100 мл) и тетрагидрофурана (ТГФ) (170 мл) при перемешивании при комнатной температуре медленно добавляют LiAlH4 (3,8 г; 0,1 моль). По окончании добавления полученную суспензию при перемешивании кипятят с обратным холодильником в течение 24 ч. Реакцию прерывают, разложив избытокLiAlH4 добавлением воды (40 мл) и 5 н. раствора NaOH (10 мл). Органическую фазу отделяют, а растворитель упаривают при пониженном давлении. Полученный сырой остаток очищают перекристаллизацией из 95 этанола и получают 14 г (1-бензил-5-метокси-1 Н-индазол-3-ил)метанола с температурой плавления 97-98C. 1H-ЯМР (CDCl3,м.д.): 3,3 (ушир.с, 1H), 3,80 (с, 3H), 4,92 (с, 2H), 5,47 (с, 2H), 6,9-7,5 (м, 8H). 29 с) 1-Бензил-3-(хлорметил)-5-метокси-1 Н-индазол. К раствору (1-бензил-5-метокси-1 Н-индазол-3-ил)метанола (18 г; 0,07 моль) в хлороформе (200 мл) при комнатной температуре и при перемешивании медленно добавляют тионилхлорид (15,8 г; 0,13 моль). По окончании добавления полученный раствор кипятят с обратным холодильником в течение 24 ч. Реакцию прерывают, охладив смесь до комнатной температуры, и упаривают растворитель при пониженном давлении. Остаток в несколько приемов растворяют в толуоле и концентрируют при пониженном давлении. Полученный сырой остаток очищают кристаллизацией из гексана и получают 9,5 г 1 бензил-3-(хлорметил)-5-метокси-1 Н-индазола с температурой плавления 78-80C. 1H-ЯМР (CDCl3,м.д.): 3,85 (с, 3H), 4,97 (с, 2H), 5,51 (с, 2H), 6,9-7,4 (м, 8H). 29d) 2-[(1-Бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метилпропановая кислота. К раствору, содержащему 1-бензил-3-(хлорметил)-5-метокси-1 Н-индазол (2,95 г; 0,01 моль) и этил 3-гидрокси-3-метилбутаноат (1,98 г; 0,015 моль) и ДМФА (30 мл), при перемешивании при комнатной температуре медленно добавляют 60%-ный NaH (0,36 г; 0,015 моль). Затем смесь нагревают до 40C в течение 24 ч. Реакцию прекращают, охладив суспензию до комнатной температуры и добавив воду (200 мл). Растворитель упаривают при пониженном давлении, а остаток при кипячении обрабатывают раствором NaOH (0,84 г; 0,021 моль) в воде (6 мл) и 95 этаноле (6 мл) в течение 6 ч. Затем смесь охлаждают до комнатной температуры и разбавляют водой (50 мл). Щелочную фазу промывают диэтиловым эфиром(220 мл), а затем подкисляют концентрированной HCl и экстрагируют диэтиловым эфиром (330 мл). Органические фазы объединяют, концентрируют при пониженном давлении и полученный сырой остаток очищают кристаллизацией из смеси 10/1 гексан/этилацетат, получая 0,8 г 2-[(1-бензил-5 метокси-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты с температурой плавления 128-130C. 1H-ЯМР (ДМСО-d6,м.д.): 1,44 (с, 6H), 3,77 (с, 3H), 4,69 (с, 2H), 5,55 (с, 2H), 7,02 (дд, J=9,15; 2,38 Гц, 1H), 7,17-7,33 (м, 5H), 7,41 (д, J=2,38 Гц, 1H), 7,55 (д, J=9,15 Гц, 1H), 12,79 (с, 1H). 29 е) 2-[(1-Бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метипропанамид. Указанный продукт получают по методике, приведенной для получения соединения 9, используя в качестве исходного соединения 2-[(1-бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метилпропановую кислоту. Получение соединения 30. 2-[1-(4-Хлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропанамид. 30 а) [1-(4-Хлорбензил)-1 Н-индазол-3-ил]метанол. К суспензии 60%-ного NaH (2,7 г; 0,07 моль) в толуоле (200 мл) добавляют 1-бензил-3- 13019711 гидроксиметилиндазол (10 г; 0,07 моль). Смесь доводят до кипения и оставляют кипятиться с обратным холодильником при перемешивании на 1 ч. Затем добавляют 4-хлорбензилхлорид (14,4 г; 0,09 моль). Полученную смесь кипятят с обратным холодильником при перемешивании в течение 4 ч. Реакцию прекращают, охладив смесь до комнатной температуры и добавив воду (50 мл). Органическую фазу отделяют и промывают соответственно 2 н. раствором HCl (50 мл) и водой (550 мл). Растворитель отгоняют при пониженном давлении. Полученный сырой остаток очищают флэш-хроматографией на силикагеле,используя в качестве элюента смесь 3/1 гексан/этилацетат. Полученный продукт кристаллизуют из смеси 5/1 гексан/этилацетат и получают 4,4 г [1-(4-хлорбензил)-1 Н-индазол-3-ил]метанола; т.пл.=102-104C. 1 Н-ЯМР (CDCl3,м.д.): 3,5 (ушир.с, 1H), 5,01 (с, 2H), 5,37 (с, 2H), 6,8-7,5 (м, 7H), 7,81 (д, J=7,82 Гц,1H). 30b) 2-[1-(4-Хлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропановая кислота. К суспензии NaOH (15,6 г; 0,39 моль) в ацетоне (50 мл) добавляют [1-(4-хлорбензил)-1 Н-индазол-3 ил]метанол (9,1 г; 0,03 моль). К смеси медленно добавляют хлороформ (7,2 мл; 0,09 моль) и ацетон (7,2 мл; 0,1 моль). Добавление вызывает вскипание смеси растворителей. По окончании добавления смесь кипятят с обратным холодильником в течение 1 ч. Реакцию прекращают, охладив смесь до комнатной температуры, и растворитель отгоняют при пониженном давлении. Полученный сырой остаток растворяют в толуоле (100 мл) и воде (50 мл). Водную фазу отделяют от органической фазы и затем промывают толуолом (250 мл). Органические фазы объединяют и экстрагируют водой (350 мл). Водные фазы объединяют и промывают гексаном (230 мл), а затем подкисляют 2 н. раствором HCl и перемешивают при комнатной температуре. Образовавшееся твердое вещество отфильтровывают и кристаллизуют вначале из смеси 5/1 вода/уксусная кислота, а затем из толуола и получают 4,0 г 2-[1-(4-хлорбензил)-1 Ниндазол-3-ил]метокси-2-метилпропановой кислоты; т.пл.=186-188C. 1(ушир.с, 1H). 30 с) 2-[1-(4-Хлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропанамид. Указанный продукт получают по методике, приведенной для получения соединения 9, используя в качестве исходного соединения 2-[1-(4-хлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропановую кислоту. Получение соединения 31. 2-[1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропанамид. 31 а) [1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метанол. Продукт получают по методике, приведенной в примере 30 а), используя в качестве исходного вещества 3,4-дихлорбензилхлорид. Полученный продукт очищают кристаллизацией из смеси 1/1 гексан/этилацетат; т.пл.=118-120C. 1 Н-ЯМР (CDCl3,м.д.): 3,1-3,3 (м, 1H), 4,9-5,2 (м, 2H), 5,38 (с, 2H), 6,89 (дд, J1, J2=8,27; 2,05 Гц,1H), 7,1-7,5 (м, 5H), 7,82 (дт, J1, J2=8,01; 0,93, 1H). 31b) 2-[1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропановая кислота. Продукт получают по методике, приведенной в примере 30b), используя в качестве исходного вещества [1-(3,4-дихлорбензил)-1 Н-индазол-3-ил]метанол. Полученный продукт очищают кристаллизацией из толуола; т.пл.=174-176C. 1 Н-ЯМР (ДМСО-d6,м.д.): 1,44 (с, 6H), 4,76 (с, 2H), 5,64 (с, 2H), 7,12-7,22 (м, 2H), 7,41 (т, J=7,68 Гц, 1H), 7,54 (д, J=2,01 Гц, 1H), 7,58 (д, J=8,42 Гц, 1H), 7,72 (д, J=8,42 Гц, 1H), 7,95 (д, J=8,05 Гц, 1H),12,81 (ушир.с, 1H). 31 с) 2-[1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропанамид. Указанный продукт получают по методике, приведенной для получения соединения 9, используя в качестве исходного соединения 2-[1-(3,4-дихлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропановую кислоту. Получение соединения 34. 2-[(1-Бензоил-1 Н-индазол-3-ил)метокси]-N-гидрокси-2-метилпропанамид. 34 а) (1-Тритилиндазол-3-ил)метанол. К раствору, содержащему изобутил 1 Н-индазол-3-карбоксилат (280 г; 1,28 моль) в хлороформе (2 л), при перемешивании при комнатной температуре добавляют триэтиламин (300 мл; 2,16 моль) и трифенилхлорметан (400 г; 1,4 моль). Полученный раствор перемешивают при комнатной температуре в течение 4 дней, а затем добавляют воду (500 мл). Органическую фазу отделяют и концентрируют при пониженном давлении. Полученный сырой остаток без дальнейшей очистки используют на следующей стадии. К раствору неочищенного изобутил 1-тритилиндазол-3-карбоксилата (180 г; 0,39 моль) в ТГФ (1 л) при перемешивании при комнатной температуре медленно добавляют суспензию LiAlH4 (18 г; 0,48 моль) в ТГФ (100 мл). По окончании добавления смесь перемешивают при комнатной температуре в течение 30 мин, а затем реакцию прекращают, охладив смесь до 0C и добавив, в указанном порядке, воду(40 мл), 2 н. раствор NaOH (40 мл) и воду (60 мл). Образовавшееся твердое вещество отфильтровывают, а раствор концентрируют при пониженном давлении. Полученный сырой остаток очищают кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 120 г (1-тритилиндазол-3-ил)метанола; т.пл.=192-193C. 1H-ЯМР (CDCl3,м.д.): 2,51 (т, J=6,98 Гц, 1H), 4,90 (д, J=6,98 Гц, 2H), 6,2-6,5 (м, 1H), 6,9-7,4 (м,17H), 7,6-7,8 (м, 1H). 34b) 2-(1-Тритилиндазол-3-илметокси)-2-метилпропановая кислота. К суспензии (1-тритилиндазол-3-ил)метанола (78 г; 0,20 моль), ацетона (260 мл) и воды (0,5 мл) при перемешивании при комнатной температуре добавляют NaOH (76 г; 1,9 моль) и медленно смесь 1/1 хлороформ/ацетон (100 мл). Реакция экзотермична, так что скорость добавления регулируют таким образом,чтобы температура реакции была близка к температуре кипения. Через 30 мин после окончания добавления реакцию прекращают, охладив смесь до комнатной температуры, и растворитель упаривают при пониженном давлении. Остаток растворяют в воде (500 мл) и промывают диэтиловым эфиром (3100 мл). Затем водную фазу подкисляют концентрированной HCl и продукт экстрагируют толуолом (3250 мл). Органические фазы объединяют, концентрируют при пониженном давлении и полученный сырой остаток очищают кристаллизацией из смеси 3/7 гексан/этилацетат, получая 22 г 2-(1-тритилиндазол-3 илметокси)-2-метилпропановой кислоты; т.пл.=179-180C. 1(ушир.с, 1H). 34 с) 2-(1 Н-индазол-3-илметокси)-2-метилпропановая кислота. К раствору 2-(1-тритилиндазол-3-илметокси)-2-метилпропановой кислоты (83 г; 0,174 моль) в дихлорметане (DCM) (900 мл) при перемешивании при комнатной температуре добавляют паратолуолсульфоновую кислоту (PTSA) (50 г; 0,29 моль). Смесь перемешивают при комнатной температуре в течение 30 мин, а затем выливают в 5 н. раствор NaOH (400 мл). Органическую фазу отделяют и промывают водой (300 мл). Водные фазы объединяют, подкисляют концентрированной HCl, а затем экстрагируют этилацетатом (5300 мл). Органические вытяжки объединяют, упаривают при пониженном давлении,а полученный сырой остаток очищают кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 42 г 2(1 Н-индазол-3-илметокси)-2-метилпропановой кислоты; т.пл.=135-137C. 1H-ЯМР (ДМСО-d6,м.д.): 1,46 (с, 6H), 4,77 (с, 2H), 7,0-7,6 (м, 3H), 7,94 (д, J=7,88 Гц, 1H). 34d) 2-[(1-Бензоил-1 Н-индазол-3-ил)метокси]-2-метилпропановая кислота. К раствору 2-(1 Н-индазол-3-илметокси)-2-метилпропановой кислоты (6 г; 0,026 моль) в ацетоне (50 мл) при перемешивании при комнатной температуре добавляют K2CO3 (6,8 г; 0,049 моль), а затем медленно добавляют раствор бензоилхлорида (5 мл; 0,043 моль) в ацетоне (30 мл). Смесь перемешивают при комнатной температуре в течение 24 ч, а затем выливают в воду (1 л). Затем раствор подщелачивают 5 н. раствором NaOH и промывают диэтиловым эфиром (3150 мл). После этого щелочную фазу подкисляют концентрированной HCl и экстрагируют диэтиловым эфиром (3300 мл). Органические вытяжки объединяют и концентрируют при пониженном давлении, а полученный сырой остаток очищают кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 2 г 2-[(1-бензоил-1 Н-индазол-3-ил)метокси]-2 метилпропановой кислоты; т.пл.=132-135C. 1(м, 3H), 8,68 (ушир.с, 1H), 8,53 (д, J=8,42 Гц, 1H). 34 е) 2-[(1-Бензоил-1 Н-индазол-3-ил)метокси]-N-гидрокси-2-метилпропанамид. Данный продукт получают по методике, приведенной для получения соединения 10, взяв 2-[(1 бензоил-1 Н-индазол-3-ил)метокси]-2-метилпропановую кислоту в качестве исходного соединения. Получают 0,34 г 2-[(1-бензоил-1 Н-индазол-3-ил)метокси]-N-гидрокси-2-метилпропанамида. Получение соединения 35. 2-[1-(1,2,3,4-Тетрагидронафт-1-ил)-1 Н-индазол-3-ил]метокси-N-гидрокси-2-метилпропанамид. 35 а) 2-Метил-2-[1-(1,2,3,4-тетрагидронафт-1-ил)-1 Н-индазол-3-ил]метоксипропановая кислота. К раствору 2-метил-2-[(1 Н-индазол-3-ил)метокси]пропановой кислоты (26 г; 0,093 моль) в ДМФА(200 мл) добавляют 60%-ный NaH (10 г; 0,25 моль) и полученную смесь перемешивают при температуре 60C в течение 10 мин. К смеси добавляют 1-хлор-1,2,3,4-тетрагидронафталин (0,217 моль) и полученную реакционную смесь перемешивают при 60C в течение 18 ч. Реакцию прекращают, вылив смесь в воду (1 л), а затем смесь подкисляют 5 н. раствором HCl и экстрагируют продукт диэтиловым эфиром(3250 мл). Полученный остаток растворяют в 95 этаноле (100 мл) и при кипячении с обратным холодильником обрабатывают в течение 2 ч 1 н. раствором NaOH (200 мл). Раствор охлаждают до комнатной температуры и промывают диэтиловым эфиром (3200 мл). Затем щелочную фазу подкисляют концен- 15019711 трированной HCl и экстрагируют этилацетатом (3300 мл). Органические фазы объединяют, концентрируют при пониженном давлении и полученный остаток очищают кристаллизацией из этилацетата. Указанным образом получают 31 г 2-метил-2-[1-(1,2,3,4-тетрагидронафт-1-ил)-1 Н-индазол-3 ил]метоксипропановой кислоты; т.пл.=132-134C. 1H-ЯМР (CDCl3,м.д.): 1,60 (д, J=2,15 Гц, 6H), 1,84-2,02 (м, 1H), 2,03-2,18 (м, 1H), 2,23-2,46 (м, 2H),2,90 (дт, J=16,50; 4,85 Гц, 1H), 2,98-3,12 (м, 1H), 4,95 (с, 2H), 5,92 (дд, J=8,83; 6,52 Гц, 1H), 6,71 (д, J=7,76 Гц, 1H), 6,93-7,05 (м, 2H), 7,08-7,32 (м, 4H), 7,85 (д, J=8,09 Гц, 1H). 35b) 2-[1-(1,2,3,4-Тетрагидронафт-1-ил)-1 Н-индазол-3-ил]метокси-N-гидрокси-2 метилпропанамид. Указанный продукт получают по методике, приведенной для получения соединения 10, взяв 2 метил-2-[1-(1,2,3,4-тетрагидронафт-1-ил)-1 Н-индазол-3-ил]метоксипропановую кислоту в качестве исходного соединения. Получение соединения 36.[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-N-гидроксиацетамид. 36 а) [1-(4-Метоксибензил)-1 Н-индазол-3-ил]метанол. К суспензии 60%-ного NaH (2,7 г; 0,07 моль) в толуоле (200 мл) добавляют 1-бензил-3 гидроксиметилиндазол (10 г; 0,07 моль). Смесь доводят до кипения и оставляют на 1 ч кипеть с обратным холодильником при перемешивании. Затем добавляют 4-метоксибензилхлорид (14 г; 0,09 моль). Смесь при перемешивании кипятят с обратным холодильником в течение 4 ч. Реакцию прекращают, охладив смесь до комнатной температуры и добавив воду (50 мл). Органическую фазу отделяют и промывают соответственно 2 н. раствором HCl (50 мл) и водой (550 мл). Растворитель упаривают при пониженном давлении. Полученный сырой остаток очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь 3/2 гексан/этилацетат. Полученный продукт кристаллизуют из смеси 5/1 гексан/этилацетат и получают 5,1 г [1-(4-метоксибензил)-1 Н-индазол-3-ил]метанола с температурой плавления 95-97C. 1 Н-ЯМР (CDCl3,м.д.): 3,43 (т, J=6,9 Гц, 1H), 3,67 (с, 3H), 4,98 (д, J=6,9 Гц, 2H), 5,36 (с, 2H), 6,5-6,8(м, 2H), 6,9-7,4 (м, 7H), 7,80 (д, J=7,86 Гц, 1H). 36b) [1-(4-Метоксибензил)-1 Н-индазол-3-ил]метоксиуксусная кислота. Суспензию, содержащую [1-(4-метоксибензил)-1 Н-индазол-3-ил]метанол (6 г; 0,022 моль), бромуксусную кислоту (4 г; 0,03 моль) и 50%-ный NaH (3 г; 0,066 моль) в ТГФ (170 мл) кипятят с обратным холодильником при перемешивании в течение 72 ч. Реакцию прекращают, разбавив суспензию водой со льдом (300 мл), и водную фазу промывают диэтиловым эфиром (3150 мл). Водную фазу подкисляют концентрированной HCl. Образовавшийся твердый осадок отфильтровывают и очищают кристаллизацией из изопропанола. Указанным способом получают 4,5 г [1-(4-метоксибензил)-1 Н-индазол-3 ил]метоксиуксусной кислоты. 36 с) [1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-N-гидроксиацетамид. Указанный продукт получают по методике, приведенной для получения соединения 10, взяв [1-(4 метоксибензил)-1 Н-индазол-3-ил]метоксиуксусную кислоту в качестве исходного соединения. Получение соединения 39. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиацетамид. 39 а) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ол. К суспензии LiAlH4 (4,48 г; 0,118 моль) в диэтиловом эфире (100 мл) при перемешивании при комнатной температуре медленно добавляют раствор метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2 метилпропаноата, который получают по методике, приведенной в EP 0382276 (20 г; 0,06 моль), в диэтиловом эфире (200 мл) и ТГФ (50 мл). По окончании добавления смесь перемешивают при комнатной температуре в течение 30 мин и прекращают реакцию, добавив 10 н. раствор NaOH (20 мл) и воду (40 мл). Растворитель упаривают при пониженном давлении и маслянистый остаток очищают перегонкой при давлении 0,01 мм Hg при температуре 190C. Полученный твердый продукт кристаллизуют из изопропанола. Получают 11 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ола; т.пл.=52-53C. 1 Н-ЯМР (CDCl3,м.д.): 1,34 (с, 6H), 2,50 (ушир.с, 1H), 3,51 (с, 2H), 4,87 (с, 2H), 5,55 (с, 2H), 7,14(ддд, J=8,04; 6,21; 1,68 Гц, 1H), 7,17-7,38 (м, 7H), 7,78 (дт, J=8,08; 1,00 Гц, 1H). 39b) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусная кислота. К раствору 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ола (11,0 г, 0,04 моль) в сухом тетрагидрофуране (ТГФ) (100 мл) при перемешивании при комнатной температуре добавляют 60%-ный гидрид натрия (1,6 г, 0,04 моль). Смесь нагревают до температуры кипения в течение 2 ч, а затем охлаждают до комнатной температуры и медленно добавляют раствор этилбромацетата (7,4 г, 0,044 моль) в ТГФ (7 мл). По окончании добавления смесь кипятят с обратным холодильником еще в течение 2 ч. Реакцию прерывают, охладив реакционную смесь до комнатной температуры, и растворитель упаривают при пониженном давлении. Остаток растворяют в 2 н. NaOH (100 мл) и продукт экстрагируют диэтиловым эфиром (3150 мл). Органические фазы объединяют и концентрируют при пониженном давлении. Сырой остаток растворяют в растворе NaOH (1,9 г, 0,045 моль) и смеси 1/1 вода/этанол (160 мл). Затем смесь при перемешивании кипятят с обратным холодильником в течение 2 ч. Реакцию прекращают, упаривают растворитель при пониженном давлении, а остаток растворяют в воде (100 мл) и промывают диэтиловым эфиром (350 мл). Щелочной раствор подкисляют концентрированной HCl и полученный раствор отфильтровывают. Продукт очищают двукратной кристаллизацией из смеси 1/2 гексан/этилацетат. Получают 4,6 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусной кислоты. 39 с) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиацетамид. Указанный продукт получают по методике, приведенной для получения соединения 9, взяв 2-[(1 бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусную кислоту в качестве исходного соединения. Получение соединения 40. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропокси-N-гидроксиацетамид. Указанный продукт получают по методике, приведенной для получения соединения 10, взяв в качестве исходного соединения 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусную кислоту. Получение соединения 41.(2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропокси)-N-гидроксиацетамид. 41 а) [1-(4-Метоксибензил)-1 Н-индазол-3-ил]метанол. К суспензии 60%-ного NaH (2,7 г; 0,07 моль) в толуоле (200 мл) добавляют 1-бензил-3 гидроксиметилиндазол (10 г; 0,07 моль). Смесь доводят до кипения и оставляют на 1 ч перемешиваться при кипячении с обратным холодильником. Затем добавляют метоксибензилхлорид (14 г; 0,09 моль). Полученную смесь при перемешивании кипятят с обратным холодильником в течение 4 ч. Реакцию прекращают, охладив смесь до комнатной температуры и добавив воду (50 мл). Органическую фазу отделяют и промывают соответственно 2 н. раствором HCl (50 мл) и водой (550 мл). Растворитель упаривают при пониженном давлении. Полученный сырой остаток очищают флэш-хроматографией на силикагеле,используя в качестве элюента смесь 3/2 гексан/этилацетат. Продукт очищают кристаллизацией из смеси 5/1 гексан/этилацетат и получают 5,1 г [1-(4-метоксибензил)-1 Н-индазол-3-ил]метанола с температурой плавления 95-97C. 1(м, 2H), 6,9-7,4 (м, 7H), 7,80 (д, J=7,86 Гц, 1H). 41b) 2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропановая кислота. К суспензии NaOH (15,6 г; 0,39 моль) в ацетоне (50 мл) добавляют [1-(4-метоксибензил)-1 Ниндазол-3-ил]метанол (8,7 г; 0,03 моль). К полученной смеси медленно добавляют раствор хлороформа(7,2 мл; 0,09 моль) и ацетона (7,2 мл; 0,1 моль). Это добавление приводит к вскипанию смеси растворителей. По окончании добавления смесь кипятят с обратным холодильником в течение 1 ч. Реакцию прекращают, охладив смесь до комнатной температуры, и растворитель отгоняют при пониженном давлении. Полученный сырой остаток переносят в толуол (100 мл) и воду (50 мл). Водную фазу отделяют от органической фазы и затем промывают толуолом (250 мл). Органические фазы объединяют и экстрагируют водой (350 мл). Водные фазы объединяют, промывают гексаном (230 мл), а затем подкисляют 2 н. раствором HCl и перемешивают при комнатной температуре. Образовавшееся твердое вещество отфильтровывают и кристаллизуют вначале из смеси 5/1 вода/уксусная кислота, а затем из толуола и получают 4,8 г 2-[1-(4-метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропановой кислоты с температурой плавления 169-171C. 1(т, J=7,50 Гц, 1H), 7,18-7,26 (м, 2H), 7,36 (т, J=7,23 Гц, 1H), 7,66 (д, J=8,42 Гц, 1H), 7,92 (дд, J=8,14; 1,01 Гц, 1H), 12,76 (с, 1H). 41 с) 2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропан-1-ол. Указанный продукт получают по методике, приведенной для получения соединения 39 а, взяв в качестве исходного соединения 2-[1-(4-метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропановую кислоту. 41d) (2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропокси)уксусная кислота. Указанный продукт получают по методике, приведенной для получения соединения 39b, взяв в качестве исходного соединения 2-[1-(4-метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропан-1-ол. 41 е) (2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропокси)-N-гидроксиацетамид. Указанный продукт получают по методике, приведенной для получения соединения 10, взяв в качестве исходного соединения Получение соединения 42. 2-2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этокси-N-гидрокси-2-метилпропанамид. 42 а) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этанол. К раствору NaOH (2,8 г; 0,07 моль) в этиленгликоле (150 мл) при перемешивании при комнатной температуре добавляют 1-бензил-3-хлорметилиндазол, который получают, как описано в EP 0382276(17,6 г; 0,07 моль). Раствор нагревают до температуры 130C в течение 4 ч, а затем охлаждают до комнатной температуры и растворитель упаривают при пониженном давлении. Остаток растворяют в воде(100 мл) и продукт экстрагируют этилацетатом (3100 мл). Органические фазы объединяют, концентрируют при пониженном давлении и полученный сырой остаток очищают кристаллизацией из смеси приблизительно 1/1 гексан/этилацетат. Получают 13,8 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола; т.пл.=67-69C. 1H-ЯМР (CDCl3,м.д.): 2,15 (ушир.с, 1H), 3,61-3,82 (м, 4H), 4,97 (с, 2H), 5,57 (с, 2H), 7,11-7,38 (м,8H), 7,81 (дт, J=8,15; 0,97 Гц, 1H). 42b) 2-2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этокси-2-метилпропановая кислота. К смеси 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола (35 г, 0,124 моль) и NaOH (63 г, 1,57 моль) в ацетоне (180 мл) и воде (1 мл) при перемешивании при комнатной температуре медленно добавляют смесь 1/1 хлороформ/ацетон (80 мл). В процессе добавления температура поднимается до температуры кипения. По окончании добавления растворитель отгоняют при пониженном давлении, а остаток растворяют в воде (100 мл) и промывают диэтиловым эфиром (350 мл). Водную фазу подкисляют ледяной уксусной кислотой, а затем экстрагируют диэтиловым эфиром (3150 мл). Органические фазы объединяют и концентрируют при пониженном давлении. Полученный сырой остаток очищают кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 12,4 г 2-2-[(1-бензил-1 Н-индазол-3-ил)метокси]этокси-2-метилпропановой кислоты; т.пл.=94-95C. 1H-ЯМР (CDCl3,м.д.): 1,43 (с, 6H), 3,56-3,63 (м, 2H), 3,65-3,71 (м, 2H), 5,03 (с, 2H), 5,58 (с, 2H),7,13-7,39 (м, 8H), 7,83 (дт, J=8,05; 0,82 Гц, 1H), 9,60 (ушир.с, 1H). 42 с) 2-2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этокси-N-гидрокси-2-метилпропанамид. Указанный продукт получают по методике, приведенной для получения соединения 34 е), взяв в качестве исходного соединения 2-2-[(1-бензил-1 Н-индазол-3-ил)метокси]этокси-2-метилпропановую кислоту. Получение соединения 43. 2-3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропокси-N-гидрокси-2-метилпропанамид. 43 а) 3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропан-1-ол. К раствору NaOH (2,8 г; 0,07 моль) в 1,3-пропандиоле (150 мл) при перемешивании при комнатной температуре добавляют 1-бензил-3-хлорметилиндазол, который получают, как описано в EP 0382276(17,6 г; 0,07 моль). Раствор нагревают до температуры 130C в течение 4 ч, а затем охлаждают до комнатной температуры и растворитель упаривают при пониженном давлении. Остаток растворяют в воде(100 мл) и продукт экстрагируют этилацетатом (3100 мл). Органические фазы объединяют, концентрируют при пониженном давлении и полученный сырой остаток очищают флэш-хроматографией на силикагеле, используя в качестве элюента смесь 1/1 гексан/этилацетат. Получают 10,5 г 3-[(1-бензил-1 Н-индазол-3-ил)метокси]пропан-1-ола. 1H-ЯМР (CDCl3,м.д.): 1,85 (кв, J=5,83 Гц, 2H), 2,75 (ушир.с, 1H), 3,71 (т, J=7,74 Гц, 4H), 4,91 (с,2H), 5,55 (с, 2H), 7,0-7,4 (м, 8H), 7,80 (д, J=7,77 Гц, 1H). 43b) 2-3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропокси-2-метилпропановая кислота. Указанный продукт получают по методике, приведенной для получения соединения 42b), взяв в качестве исходного соединения 3-[(1-бензил-1 Н-индазол-3-ил)метокси]пропан-1-ол. Продукт очищают двукратной кристаллизацией из смеси 7/3 гексан/этилацетат; т.пл.=57-59C. 1 Н-ЯМР (ДМСО-d6,м.д.): 1,25 (с, 6H), 1,72 (квинтет, J=6,40 Гц, 2H), 3,37 (т, J=6,40 Гц, 2H), 3,53 (т,J=6,40 Гц, 2H), 4,77 (с, 2H), 5,62 (с, 2H), 7,14 (ддд, J=8,00; 7,00; 0,73 Гц, 1H), 7,19-7,33 (м, 5H), 7,38 (ддд,J=8,37; 7,00; 0,91 Гц, 1H), 7,66 (д, J=8,42 Гц, 1H), 7,79 (дт, J=8,05; 0,91 Гц, 1H), 12,46 (с, 1H). 43 с) 2-3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропокси-N-гидрокси-2-метилпропанамид. Указанный продукт получают по методике, приведенной для получения соединения 10, взяв в качестве исходного соединения 2-3-[(1-бензил-1 Н-индазол-3-ил)метокси]пропокси-2-метилпропановую кислоту. Получение соединения 46. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этоксиацетамид. 46 а) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этанол. К раствору NaOH (2,8 г; 0,07 моль) в этиленгликоле (150 мл) при перемешивании при комнатной температуре добавляют 1-бензил-3-хлорметилиндазол, который получают, как описано в EP 0382276(17,6 г; 0,07 моль). Раствор нагревают до температуры 130C в течение 4 ч, а затем охлаждают до ком- 18019711 натной температуры и растворитель упаривают при пониженном давлении. Остаток растворяют в воде(100 мл) и продукт экстрагируют этилацетатом (3100 мл). Органические фазы объединяют, концентрируют при пониженном давлении и полученный сырой остаток очищают кристаллизацией из смеси приблизительно 1/1 гексан/этилацетат. Получают 13,8 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола; т.пл.=67-69C. 1H-ЯМР (CDCl3,м.д.): 2,15 (ушир.с, 1H), 3,61-3,82 (м, 4H), 4,97 (с, 2H), 5,57 (с, 2H), 7,11-7,38 (м,8H), 7,81 (дт, J=8,15; 0,97 Гц, 1H). 46b) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этоксиуксусная кислота. К раствору 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола (11,28 г, 0,04 моль) в сухом тетрагидрофуране (ТГФ) (100 мл) при перемешивании при комнатной температуре добавляют 60%-ный гидрид натрия (1,6 г, 0,04 моль). Смесь нагревают до кипения в течение 2 ч, а затем охлаждают до комнатной температуры и медленно добавляют раствор этилбромацетата (7,4 г, 0,044 моль) в ТГФ (7 мл). По окончании добавления смесь кипятят с обратным холодильником еще в течение 2 ч. Реакцию прекращают, охладив смесь до комнатной температуры, и растворитель отгоняют при пониженном давлении. Остаток растворяют в 2 н. растворе NaOH (100 мл) и продукт экстрагируют диэтиловым эфиром (3150 мл). Органические фазы объединяют и концентрируют при пониженном давлении. Сырой остаток переносят в раствор NaOH (1,9 г, 0,045 моль) в смеси 1/1 вода/этанол (160 мл). Затем полученную смесь кипятят с обратным холодильником в течение 2 ч. Реакцию прекращают, отогнав растворитель при пониженном давлении, остаток растворяют в воде (100 мл) и промывают диэтиловым эфиром (350 мл). Затем щелочную фазу подкисляют концентрированной HCl и образовавшийся осадок отфильтровывают. Продукт очищают двукратной кристаллизацией из смеси 1/3 гексан/этилацетат. Получают 5,8 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этоксиуксусной кислоты; т.пл.=101-103C. 1H-ЯМР (CDCl3,м.д.): 3,66-3,79 (м, 4H), 4,13 (с, 2H), 5,01 (с, 2H), 5,58 (с, 2H), 7,66 (ушир.с, 1H),7,14-7,40 (м, 8H), 7,84 (дт, J=8,11; 0,99 Гц, 1H). 46 с) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этоксиацетамид. Указанный продукт получают по методике, приведенной для получения соединения 9, взяв в качестве исходного соединения 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этоксиуксусную кислоту. Получение соединения 47. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этокси-N-гидроксиацетамид. Указанный продукт получают по методике, приведенной для получения соединения 10, взяв в качестве исходного соединения 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этоксиуксусную кислоту. Получение соединения 48. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этоксиацетогидразид. Суспензию 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этоксиуксусной кислоты (19 г; 0,06 моль) в метаноле (300 мл) при 0C в течение 4 ч обрабатывают газообразным HCl. Затем смесь выливают в воду(500 мл) и продукт экстрагируют диэтиловым эфиром (3250 мл). Органические фазы объединяют, промывают 5%-ным раствором бикарбоната натрия (2100 мл), а затем водой (50 мл). Растворитель отгоняют при пониженном давлении и сырой продукт очищают кристаллизацией из гексана. Получают 16 г метил 2-[(1-бензоил-1 Н-индазол-3-ил)метокси]ацетата. К 1 М раствору гидразин-гидрата (100 мл; 0,100 моль) при температуре 80C и при перемешивании порциями добавляют метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]ацетат (19 г; 0,06 моль). По окончании добавления смесь перемешивают при той же температуре в течение еще 30 мин, а затем в течение 2 ч нагревают до 120C. Реакцию прекращают, разбавив смесь водой (600 мл), и экстрагируют продукт диэтиловым эфиром (4200 мл). Органические фазы объединяют и затем экстрагируют 2 н. растворомHCl (4200 мл). Затем кислую фазу подщелачивают с помощью 10 н. раствором NaOH и вновь экстрагируют диэтиловым эфиром (4200 мл). Органические фазы объединяют, концентрируют при пониженном давлении и сырой продукт очищают кристаллизацией из смеси 1/1 гексан/этилацетат. Получают 15 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]ацетогидразида. Пример 1. Анализ экспрессии гена MCP-1 в линии моноцитов человека. Оценивают способность соединений ингибировать экспрессию MCP-1 стимулированными липополисахаридом (LPS) клетками линии MonoMac6. Клетки помещают на 96-луночные планшеты с концентрацией 50000 клеток на лунку. Соединения по настоящему изобретению испытывают при максимальной получаемой при растворении концентрации, указанной в табл. 1 (в диапазоне 30-300 мкМ), и инкубируют в течение 1 ч. Затем клетки стимулируют с помощью LPS (100 нг/мл) в течение 4 ч. Полную РНК экстрагируют из клеточной массы с помощью набора реагентов RNeasy mini (Qiagen),подвергают обратной транскрипции с использованием набора для синтеза реагентов обратной транскрипции TaqMan (Applied Biosystems) и полученные кДНК применяют для проведения реакции ПЦР в режиме реального времени. Амплификацию осуществляют на 96-луночных планшетах с использованием системы секвенирования ABI Prism 7000 (Applied Biosystems), применяя следующий температурный профиль: 50C в течение 2 мин, 95C в течение 10 мин и 45 циклов при 95C длительностью по 15 с и 60C в течение 1 мин. Для амплификации используют набор праймеров и зонд, специфичные для MCP-1 человека (Applied Biosystems, RefSeq NM002982.3). Набор праймеров и зонд для -актина используют в отдельных лунках в качестве внутреннего контроля образцов с целью стандартизации. По окончании реакции данные флуоресценции анализируют, используя программное обеспечение ABI Prism 7000 SDS,путем расчета порогового цикла (Ct) для каждого образца, а затем проводят сравнительную количественную оценку по методу Ct. Полученные результаты, выраженные в виде процента ингибирования, сопоставлены в табл. 1. Таблица 1 Как показывают полученные результаты, которые приведены в табл. 1, соединения по настоящему изобретению способны значительно ингибировать LPS-индуцированную экспрессию MCP-1 в линии моноцитов человека и показывают снижение уровней специфической мРНК в диапазоне от 20 до 99%. Пример 2. Измерение продукции MCP-1 в линии моноцитов человека. Оценивают способность соединений ингибировать экспрессию MCP-1 стимулированными липополисахаридом (LPS) клетками линии MonoMac6. Клетки помещают на 96-луночные планшеты с концентрацией 50000 клеток на лунку. Соединения по настоящему изобретению испытывают при максимальной получаемой при растворении концентрации, указанной в табл. 2 (в диапазоне 30-300 мкМ), и инкубируют в течение 1 ч. Затем клетки стимулируют с помощью LPS (100 нг/мл) в течение 20 ч. Количество продуцированного MCP-1 измеряют в надосадочных жидкостях, подходящим образом разбавленных с помощью буфера, методом иммуноферментного анализа (ELISA), используя имеющийся на рынке набор реагентов (ELISA MCP-1/JE, RD Systems). Полученные результаты, выраженные в виде процента ингибирования, сопоставлены в табл. 2. Таблица 2 Как показывают полученные результаты, которые приведены в табл. 2, соединения по настоящему изобретению способны значительно ингибировать LPS-индуцированную экспрессию MCP-1 в линии моноцитов человека и показывают снижение уровней продуцированного белка в диапазоне от 48 до 98%. Пример 3. Анализ экспрессии гена CX3CR1 в линии моноцитов человека. Оценивают способность соединений ингибировать экспрессию CX3CR1 стимулированными липополисахаридом (LPS) клетками линии MonoMac6. Клетки помещают на 96-луночные планшеты с концентрацией 50000 клеток на лунку. Соединения по настоящему изобретению испытывают при максимальной получаемой при растворении концентрации, указанной в табл. 3 (в диапазоне 30-300 мкМ), и инкубируют в течение 1 ч. Затем клетки стимулируют с помощью LPS (100 нг/мл) в течение 20 ч. Полную РНК экстрагируют из клеточной массы с помощью набора реагентов RNeasy mini (Qiagen),подвергают обратной транскрипции с использованием набора для синтеза реагентов обратной транскрипции TaqMan (Applied Biosystems) и полученные кДНК применяют для проведения реакции ПЦР в режиме реального времени. Амплификацию осуществляют на 96-луночных планшетах с использованием системы секвенирования ABI Prism 7000 (Applied Biosystems), применяя следующий температурный профиль: 50C в течение 2 мин, 95C в течение 10 мин и 45 циклов при 95C длительностью по 15 с и 60C в течение 1 мин. Для амплификации используют набор праймеров и зонд, специфичные дляCX3CR1 человека (Applied Biosystems, RefSeq NM001337.3). Набор праймеров и зонд для -актина используют в отдельных лунках в качестве внутреннего контроля образцов с целью стандартизации. По окончании реакции данные флуоресценции анализируют, используя программное обеспечение ABI Prism 7000 SDS, путем расчета порогового цикла (Ct) для каждого образца, а затем проводят сравнительную количественную оценку по методу Ct. Полученные результаты, выраженные в виде процента ингибирования, сопоставлены в табл. 3. Таблица 3 Как показывают полученные результаты, которые приведены в табл. 3, соединения по настоящему изобретению способны значительно ингибировать LPS-индуцированную экспрессию CX3CR1 в линии моноцитов человека и показывают снижение уровней специфической мРНК в диапазоне от 44 до 100%. Пример 4. Анализ экспрессии гена p40 в линии моноцитов человека. Оценивают способность соединений ингибировать экспрессию p40 стимулированными липополисахаридом (LPS) клетками линии MonoMac6. Клетки помещают на 96-луночные планшеты с концентрацией 50000 клеток на лунку. Соединения по настоящему изобретению испытывают при максимальной получаемой при растворении концентрации, указанной в табл. 4 (в диапазоне 30-300 мкМ), и инкубируют в течение 1 ч. Затем клетки стимулируют с помощью LPS (100 нг/мл) в течение 4 ч. Полную РНК экстрагируют из клеточной массы с помощью набора реагентов RNeasy mini (Qiagen),подвергают обратной транскрипции с использованием набора для синтеза реагентов обратной транскрипции TaqMan (Applied Biosystems) и полученные кДНК применяют для проведения реакции ПЦР в режиме реального времени. Амплификацию осуществляют на 96-луночных планшетах с использованием системы секвенирования ABI Prism 7000 (Applied Biosystems), применяя следующий температурный профиль: 50C в течение 2 мин, 95C в течение 10 мин и 45 циклов при 95C длительностью по 15 с и 60C в течение 1 мин. Для амплификации используют набор праймеров и зонд, специфичные для p40 человека (Applied Biosystems, RefSeq NM002187.2). Набор праймеров и зонд для -актина используют в отдельных лунках в качестве внутреннего контроля образцов с целью стандартизации. По окончании реакции данные флуоресценции анализируют, используя программное обеспечение ABI Prism 7000 SDS,путем расчета порогового цикла (Ct) для каждого образца, а затем проводят сравнительную количественную оценку по методу Ct. Полученные результаты, выраженные в виде процента ингибирования, сопоставлены в табл. 4. Таблица 4 Как показывают полученные результаты, которые приведены в табл. 4, соединения по настоящему изобретению способны значительно ингибировать LPS-индуцированную экспрессию p40 в линии моноцитов человека и показывают снижение уровней специфической мРНК в диапазоне от 33 до 96%.X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), гдеX2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", гдеR5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода. 2. Соединение по п.1, отличающееся тем, что Х 1 обозначает алкиленовую группу, имеющую от 1 до 3 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 3 атомов углерода. 3. Соединение по п.1, отличающееся тем, что X1 выбран из группы, которая включает группу CH2,группу CH2CH2 или группу C(CH3)2, a R9 и R10, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода или группу CH3. 4. Соединение по п.1, отличающееся тем, что остаток A выбран из группы, которая включает группу СН 2, группу СН 2 СН 2, группу C(CH3)2. 5. Соединение по п.1, отличающееся тем, что R11 обозначает атом водорода или R11 вместе с R12 образует 5- или 6-членный гетероцикл, представляющий собой морфолинил или пиперазинил. 6. Соединение по п.1, отличающееся тем, что R12 обозначает атом водорода, гетероарильную группу, содержащую 6 членов и по меньшей мере один N атом. 7. Соединение по п.1, отличающееся тем, что R13 и R15, которые могут быть идентичными или отличаться друг от друга, обозначают атом водорода или алкильную группу, содержащую от 1 до 3 атомов углерода. 8. Соединение по п.1, отличающееся тем, что R14 обозначает алкильную группу, содержащую от 1 до 3 атомов углерода, арильную группу, содержащую 6 членов, CON(R')(R"), где R' и R" представлены атомом водорода. 9. Соединение по п.1, отличающееся тем, что X2 обозначает алкиленовую группу, имеющую от 1 до 3 атомов углерода. 10. Соединение по п.1, отличающееся тем, что X3 обозначает ОН. 11. Соединение по п.1, отличающееся тем, что R1 и R2 обозначают атом водорода. 12. Соединение по п.1, отличающееся тем, что R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, выбраны из группы, которая включает атом водорода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом Br, Cl или F, -CN, -CONR'R", где R' и R" представлены атомом водорода. 13. Соединение по п.1, отличающееся тем, что R5 обозначает атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода. 14. Соединение по п.1, отличающееся тем, что R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода. 15. Фармацевтическая композиция для лечения или предупреждения заболеваний, обусловленных экспрессией, по меньшей мере, MCP-1, CX3CR1 или p40, содержащая соединение формулы (I) по любому из пп.1-14 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель. 16. Фармацевтическая композиция по п.15, отличающаяся тем, что указанной фармацевтически приемлемой солью является аддитивная соль с физиологически приемлемыми органическими или неорганическими кислотами и основаниями. 17. Фармацевтическая композиция по п.16, отличающаяся тем, что указанные физиологически приемлемые кислоты выбраны из группы, которая включает хлористо-водородную, бромисто-водородную,серную, фосфорную, азотную, уксусную, аскорбиновую, бензойную, лимонную, фумаровую, молочную,малеиновую, метансульфоновую, щавелевую, паратолуолсульфоновую, бензолсульфоновую, янтарную,дубильную и винную кислоты. 18. Фармацевтическая композиция по п.16, отличающаяся тем, что указанные физиологически приемлемые основания выбраны из группы, которая включает гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия, аргинин, бетаин, кофеин, холин, N,Nдибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2 гидроксиэтил)пиперидин, N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин. 19. Фармацевтическая композиция по любому из пп.15-18, отличающаяся тем, что указанный фармацевтически приемлемый носитель выбран из группы, которая включает глиданты, связующие, разрыхлители, наполнители, разбавители, отдушки, красители, флюидизаторы, лубриканты, консерванты, увлажнители, абсорбенты и подсластители. 20. Применение соединения формулы (I)X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), гдеX2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", гдеR5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода,- 23019711 для получения фармацевтической композиции, предназначенной для лечения заболеваний, которые обусловлены экспрессией MCP-1, CX3CR1 или р 40. 21. Применение по п.20, отличающееся тем, что указанные заболевания выбраны из группы, включающей заболевания суставов, почечные заболевания, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет, инсулинорезистентность, аутоиммунные заболевания, хронические дегенеративные воспалительные заболевания и рак. 22. Применение по п.21, отличающееся тем, что указанные заболевания, которые обусловлены экспрессией MCP-1, выбраны из группы, включающей ревматоидный артрит, артрит, вызываемый вирусными инфекциями, псориатический артрит, артроз, волчаночный нефрит, диабетическую нефропатию,гломерулонефрит, поликистозное почечное заболевание, интерстициальное заболевание легких, фиброз,рассеянный склероз, болезнь Альцгеймера, ВИЧ-ассоциированную деменцию, атопический дерматит,псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардию, острые коронарные болезни сердца, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после хирургических вмешательств. 23. Применение по п.21, отличающееся тем, что указанные заболевания, которые обусловлены экспрессией CX3CR1, выбраны из группы, включающей ревматоидный артрит, волчаночный нефрит, диабетическую нефропатию, болезнь Крона, язвенный колит, коронарные заболевания, рестеноз, атеросклероз, инфаркт миокарда, стенокардию и осложнения после хирургических вмешательств. 24. Применение по п.21, отличающееся тем, что указанные заболевания, которые обусловлены экспрессией p40, выбраны из группы, включающей ревматоидный артрит, псориаз, гломерулонефрит, диабет, красную волчанку, диабет, болезнь Крона и опухоли. 25. Способ лечения или предупреждения заболеваний, обусловленных экспрессией MCP-1,CX3CR1 или p40, который отличается введением нуждающемуся в этом человеку эффективного количества соединения формулы (I)X1 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода, которая необязательно замещена одной или несколькими алкильными группами, содержащими от 1 до 5 атомов углерода;R9 и R10, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода или алкильную группу, содержащую от 1 до 5 атомов углерода;R11 может быть атомом водорода или R11 вместе с R12 образует 5-6-членный гетероцикл;R12 может быть атомом водорода, гетероарильной группой, содержащей 6 членов и по меньшей мере один N атом;R13 и R15, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкильную группу, содержащую от 1 до 5 атомов углерода;R14 может быть алкильной группой, содержащей от 1 до 5 атомов углерода, арильной группой, содержащей 6 атомов углерода, CON(R')(R"), гдеX2 может быть алкиленовой группой, имеющей от 1 до 5 атомов углерода;R3, R4 и R8, которые могут быть идентичными или отличаться друг от друга, могут обозначать атом водорода, алкоксигруппу, содержащую от 1 до 3 атомов углерода, атом галогена, -CN, -CONR'R", гдеR5 может обозначать атом водорода или же R5 вместе с одним из R6 и R7 образует кольцо, содержащее 5 или 6 атомов углерода;R6 и R7 обозначают атом водорода, или же вместе образуют группу C=O, или же один из R6 и R7 вместе с R5 образует кольцо, содержащее 5 или 6 атомов углерода. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/415, A61P 25/00, C07D 231/56, A61P 29/00, A61P 13/00
Метки: 1-бензил-3-гидроксиметилиндазола, применение, содержащая, производные, обусловленных, заболеваний, мср-1, композиция, экспрессией, сх3cr1, лечении, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/25-19711-proizvodnye-1-benzil-3-gidroksimetilindazola-soderzhashhaya-ih-farmacevticheskaya-kompoziciya-i-ih-primenenie-pri-lechenii-zabolevanijj-obuslovlennyh-ekspressiejj-msr-1-sh3cr1-ili.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-бензил-3-гидроксиметилиндазола, содержащая их фармацевтическая композиция и их применение при лечении заболеваний, обусловленных экспрессией мср-1, сх3cr1 или р40</a>
Предыдущий патент: Производные 2-арил-4-метилпентановой кислоты в качестве модуляторов γ-секретазы
Следующий патент: Комплектационное устройство для комплектации изделий в заказные контейнеры
Случайный патент: Анкерный элемент для соединения опорных конструкций