Аминоарильные сульфонамидные производные как функциональные 5-нт6 лиганды
Номер патента: 13875
Опубликовано: 30.08.2010
Авторы: Кота Сринивасулу, Вишвакарма Сантош, Ширсатх Викас Шрикришна, Камбхампати Рама Састри, Джасти Венкатесварлу, Рамакришна Венката Сатья Нироги, Кандикере Нагарадж Вишвоттам
Формула / Реферат
1. Соединение, имеющее формулу (I)
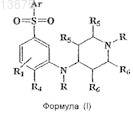
или его фармацевтически приемлемая соль,
где Ar представляет собой любую одну группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определены как R1
![]()
R представляет собой атом водорода, (C1-С3)алкильную или гало(C1-С3)алкильную группу;
R1 и R4независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С3)алкил, гало(C1-С3)алкил, (C1-С3)алкокси, гало(С1-С3)алкокси, цикло(С3-С6)алкил или цикло(С3-С6)алкокси;
R2, если присутствует, представляет собой водород, галоген, (C1-С3)алкил, гало (C1-C3)алкил, (C1-С3)алкокси или гало(С1-С3)алкокси;
R3, если присутствует, представляет собой водород, (С1-С3)алкил или гало(C1-С3)алкил;
R5 и R6представляют собой либо водород, либо метил.
2. Соединение по п.1, в котором Ar представляет собой фенил, нафтил, индолил, индазолил, пирролопиридинил, бензофуранил, бензотиенил или бензимидазолил.
3. Соединение по п.1, в котором R представляет собой атом водорода, метил или этил.
4. Соединение по п.1, в котором R1 и R4представляют собой водород, галоген, пергалоалкил, пергалоалкокси, циано, (C1-С3)алкил, гало(C1-С3)алкил, (C1-С3)алкокси, гало(C1-С3)алкокси, алкокси(C1-С3)алкокси, гидрокси(C1-С3)алкокси, цикло(С3-С6)алкил или цикло(С3-С6)алкокси.
5. Соединение по п.1, в котором R2 представляет собой водород, (C1-С3)алкил, гало(С1-С3)алкил, (C1-С3)алкокси или гало(C1-С3)алкокси.
6. Соединение по п.1, в котором R3 представляет собой водород, (C1-C3)алкил или гало(C1-С3)алкил.
7. Соединение по п.1, в котором R5 и R6представляют собой водород.
8. Соединение по п.1, выбранное из следующей группы:
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-1Н-индол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-метоксииндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-изопропоксииндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-броминдол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-4-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-6-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонилиндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-метоксииндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-изопропоксииндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-броминдол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-фториндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-4-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-6-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1H-индол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-метоксииндол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-изопропоксииндол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-броминдол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-хлориндол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-фториндол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-4-хлориндол;
1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-6-хлориндол;
1-[3-(1-метилпиперидин-4-ил)амино-4-фтор]бензолсульфонилиндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-броминдол;
1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-3-броминдол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-5-фториндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-4-хлориндол;
1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонилиндол;
1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонил-5-метоксииндол;
1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонил-5-фториндол;
1-[3-(1-метилпиперидин-4-ил)ацетамидо]бензолсульфонил-5-фториндол;
1-[3-(1-метилпиперидин-4-ил)ацетамидо]бензолсульфонилиндол;
1-[3-(1-метилпиперидин-4-ил)этиламино]бензолсульфонил-5-фториндол;
1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндола гидрохлорид;
1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1Н-индола гидрохлорид;
их стереоизомер и их соль.
9. Способ получения соединения формулы (I)
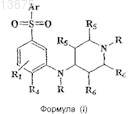
или его фармацевтически приемлемой соли,
где Ar представляет собой любую одну группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определены как R1
![]()
R представляет собой атом водорода, (C1-С3)алкильную или гало(C1-С3)алкильную группу;
R1 и R4независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С3)алкил, гало(C1-С3)алкил, (C1-С3)алкокси, гало(С1-С3)алкокси, цикло(С3-С6)алкил или цикло(С3-С6)алкокси;
R2, если присутствует, представляет собой водород, галоген, (C1-С3)алкил, гало(C1-С3)алкил, (С1-С3)алкокси или гало(С1-С3)алкокси;
R3, если присутствует, представляет собой водород, (C1-С3)алкил или гало(С1-С3)алкил;
R5 и R6 представляют собой либо водород, либо метил,
который состоит в контактировании соединения, отвечающего формуле (а), где R1, R4и Ar такие же, как определено ранее в п.1, с производным пиперидона, отвечающим формуле (b)
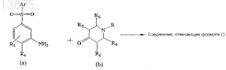
где R5, R6 и R такие же, как определено ранее, посредством восстановительного аминирования с применением подходящего восстановительного агента/катализатора в присутствии инертного растворителя при температуре окружающей среды с получением соединения формулы (I).
10. Способ получения соединения формулы (I)
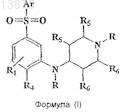
или его фармацевтически приемлемой соли,
где Ar представляет собой любую одну группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определяются как R1
![]()
R представляет собой атом водорода, (С1-С3)алкильную или гало(C1-С3)алкильную группу;
R1 и R4независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С3)алкил, гало(C1-С3)алкил, (C1-С3)алкокси, гало(С1-С3)алкокси, цикло(С3-С6)алкил или цикло(С3-С6)алкокси;
R2, если присутствует, представляет собой водород, галоген, (C1-С3)алкил, гало(C1-C3)алкил, (C1-С3)алкокси или гало(С1-С3)алкокси;
R3, если присутствует, представляет собой водород, (C1-С3)алкил или гало(C1-С3)алкил;
R5 и R6представляют собой либо водород, либо метил,
который включает проведение нуклеофильного замещения в соединении, отвечающем формуле (а), в котором R1, R4и Ar такие же, как определено ранее в п.1, с пиперидиновым галогенидом, отвечающим формуле (с)
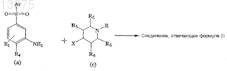
в котором R5, R6и R такие же, как определено выше; X представляет собой атом галогена, такой как фтор, хлор или иод, с применением подходящего основания и инертного растворителя при подходящей температуре.
11. Способ по п.9 или 10, необязательно включающий:
a) превращение соединения, отвечающего формуле (I), в другое соединение, отвечающее формуле (I);
b) удаление любых защитных групп или
c) образование его фармацевтически приемлемой соли, сольвата или пролекарства.
12. Способ лечения нарушений центральной нервной системы, связанных с 5-HT6рецептором или находящихся под его влиянием, у нуждающихся в таком лечении пациентов, который состоит во введении указанному пациенту терапевтически эффективного количества соединения формулы (I), как определено по любому одному из пп.1-8.
13. Способ по п.12, в котором указанное нарушение представляет собой тревогу, нарушение понимания или нейродегенеративное расстройство.
14. Способ по п.12, в котором указанное нарушение представляет собой болезнь Альцгеймера или болезнь Паркинсона.
15. Способ по п.12, в котором указанное нарушение представляет собой синдром дефицита внимания или невроз навязчивых состояний.
16. Способ по п.12, в котором указанное нарушение представляет собой удар или травму головы.
17. Способ по п.12, в котором указанное нарушение представляет собой нарушение питания или ожирение.
18. Фармацевтическая композиция, которая содержит фармацевтически приемлемый носитель и эффективное количество соединения формулы (I), как определено выше по любому одному из пп.1-8.
19. Применение соединения формулы (I) по любому одному из пп.1-8 в качестве лекарственного средства.
20. Применение соединения формулы (I) по любому одному из пп.1-8 для получения лекарственного средства для лечения нарушений центральной нервной системы, связанных с 5-HT6 рецептором или находящихся под его влиянием.
21. Способ тестирования антагонистов и антагонистов, селективных в отношении 5-HT6 рецептора, включающий введение соединения по п.1 и наблюдение за реакциями указанных животных; и сравнение указанных реакций с реакциями контрольных животных; и введение других соединений с неизвестной активностью указанным экспериментальным животным.
Текст
АМИНОАРИЛЬНЫЕ СУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ КАК ФУНКЦИОНАЛЬНЫЕ 5-НТ 6 ЛИГАНДЫ Настоящее изобретение предоставляет аминоарильные сульфонамидные производные,отвечающие формуле (I), которые могут использоваться для лечения нарушений ЦНС, связанных с 5-HT6 рецептором или находящихся под его влиянием. Фармакологический профиль этих соединений включает высокое сродство к связыванию с 5-HT6 рецептором, наряду с хорошей селективностью по отношению к указанному рецептору. Настоящее изобретение также включает стереоизомеры, соли, методы получения и медицинские препараты, содержащие указанные аминоарильные сульфонамидные производные. Рамакришна Венката Сатья Нироги, Ширсатх Викас Шрикришна, Камбхампати Рама Састри, Вишвакарма Сантош, Кандикере Нагарадж Вишвоттам, Кота Сринивасулу, Джасти Венкатесварлу (IN)(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД 013875 Область техники, к которой относится изобретение Настоящее изобретение относится к некоторым аминоарильным сульфонамидным производным, их стереоизомерам, их солям, их получению и содержащим их медицинским препаратам. Уровень техники изобретения Полагают, что различные расстройства центральной нервной системы, такие как тревога, депрессия, нарушение моторики и т.д., вызываются нарушением уровня нейромедиатора 5-гидрокситриптамина(5-НТ) или серотонина. Серотонин находится в центральной и периферической нервных системах и известно его влияние на многие типы состояний, включая, среди прочих, психические расстройства, двигательную активность, пищевое поведение, сексуальную активность и нейроэндокринную регуляцию. Подтипы 5-НТ рецептора регулируют различные эффекты серотонина. Известное семейство 5-НТ рецепторов включает семейство 5-НТ 1 (например, 5-НТ 1 А), семейство 5-НТ 2 (например, 5-НТ 2 А), подтипы 5-НТ 3, 5-HT4, 5-HT5, 5-HT6 и 5-НТ 7. Подтип рецептора 5-HT6 был впервые клонирован из тканей крыс в 1993 (Monsma, F.J.; Shen, Y.;Ward, R.P.; Hamblin, M.W., Molecular Pharmacology, 1993, 43, 320-327) и впоследствии из тканей человека(Kohen, R.; Metcalf, M.A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D.R., Journal of Neiurochemistry, 1996,66, 47-56). Данный рецептор представляет собой G-протеин связанный рецептор (GPCR), жестко связанный с аденилатциклазой (Ruat, M.; Traiffort, E.; Arrang, J.-M.; Tardivel-Lacombe, L.; Diaz, L.; Leurs, R.;Schwartz, J.-C., Biochemical Biophysical Research Communications, 1993, 193, 268-276). Данный рецептор найден практически исключительно в областях центральной нервной системы (ЦНС) как у крыс, так и у человека. Исследования гибридизации 5-НТ 6 рецептора in situ в мозге крыс с использованием мРНК показывают основную локализацию в областях 5-НТ выступа, включая полосатое тело, прилежащее ядро, обонятельный бугорок и гиппокампальная формация (Ward, R.Р.; Hamblin, M.W.; Lachowicz, J. Е.; Hoffman,В.J.; Sibley, D.R.; Dorsa, D.M., Neuroscience, 1995, 64, 1105-1111). Наивысшие уровни 5-HT6 рецепторной мРНК наблюдались в обонятельном бугорке, прилежащем ядре, зубчатой извилине, а также в СА 1, СА 2 и СА 3 участках гиппокампа. Наиболее низкие уровни 5-HT6 рецепторной мРНК наблюдались в гранулярной пластинке мозжечка, нескольких диэнцефальных ядрах, миндалевидном теле и в коре головного мозга. Нозерн-блоттинг установил, что 5-HT6 рецепторная мРНК, по всей видимости, присутствует исключительно в мозге, а свидетельства ее присутствия в периферических тканях крайне немногочисленны. Высокое сродство многих антипсихотических средств к 5-HT6 рецептору, в дополнение к локализации его мРНК в полосатом теле, обонятельном бугорке и прилежащем теле, предполагает, что некоторые из клинических эффектов этих соединений могут проявляться при посредничестве этого рецептора. Его способность связываться с широким набором терапевтических соединений, применяемых в психиатрии,дополненная его интригующим распределением в мозге, вызвала значительный интерес к новым соединениям, способным взаимодействовать с указанным рецептором или воздействовать на него. Полные селективные агонисты в настоящее время неизвестны. Прилагаются значительные усилия, направленные на понимание возможной роли 5-HT6 рецептора в психиатрии, когнитивной дисфункции, двигательной функции и контроле моторики, памяти, настроении и т.п. С этой целью, настоятельно ищутся соединения, демонстрирующие аффинность к 5-HT6 рецептору, и как вспомогательные средства для изучения 5-HT6 рецептора, и как потенциальные терапевтические средства для лечения расстройств центральной нервной системы, например см. С. Reavill and D.С. Rogers, Current Opinion in Investigational Drugs, 2001,2(1):104-109, Pharma Press Ltd. Имеется множество потенциальных терапевтических применений 5-HT6 лигандов для человека, основанных на прямых эффектах и на указаниях из имеющихся научных исследований. Эти исследования включают локализацию рецептора, сродство лигандов с известной in vivo активностью и различные проведенные к настоящему моменту исследования на животных. Предпочтительно в качестве терапевтических средств ищут соединения-антагонисты 5-h6 рецепторов. Одно потенциальное терапевтическое применение модуляторов функции 5-HT6 рецептора состоит в улучшении познания и памяти при заболеваниях человека, таких как болезнь Альцгеймера. Высокие уровни рецептора, найденные в важных структурах переднего мозга, включая хвостатое ядро/скорлупу, гиппокамп, прилежащее ядро и кору головного мозга, предполагают участие данного рецептора в процессах памяти и познания, поскольку известно, что эти области играют существенную роль в процессах памяти (Gerard, С.; Martres, M.-P.; Lefevre, K.; Miquel, М.С.; Verge, D.; Lanfumey, R.; Doucet, E.; Hamon, M.; EI Mestikawy, S., Brain Research, 1997, 746,207-219). Способность известных лигандов 5-HT6 рецептора улучшать холинергическую передачу также является подтверждением возможности применения для процессов познания (Bentey, J.С; Boursson, A.;Boess, F.G.; Kone, F.С.; Marsden, С.A.; Petit, N.; Sleight, A.J., British Journal of Pharmacology, 1999, 126 (7),1537-1542). Исследования показали, что известный селективный 5-HT6 агонист заметно повышает уровни глютамата и аспартата в лобной части коры головного мозга без повышения уровня норадреналина, допамина или 5-НТ. Это селективное повышение уровня нейрохимических соединений, известное своим вовлечением в процессы памяти и понимания, в значительной степени предполагает участие 5-HT6 лигандов в-1 013875 процессе понимания (Dawson, L.А.; Nguyen, H.Q.; Li, P., British Journal of Pharmacology, 2000, 130 (1),23-26). Исследования памяти и обучения на животных с использованием известного селективного 5-HT6 антагониста обнаружили некоторые позитивные эффекты (Rogers, D.С; Hatcher, P.D.; Hagan, J.J., Societyof Neuroscience, Abstracts, 2000, 26, 680). Родственным потенциальным терапевтическим применением 5-HT6 лигандов является лечение расстройств, связанных с дефицитом внимания (ADD, также известные как синдром дефицита внимания и гиперактивности или ADHD), у детей и взрослых. Поскольку 5-HT6 антагонисты, судя по всему, усиливают активность нигростриатального допаминового проводящего пути и поскольку ADHD связывают с аномалиями хвостатого ядра (Ernst, M.; Zametkin, A.J.; Matochik, J.H.; Jons, P.A.; Cohen, R.M., Journal ofNeuroscience, 1998, 18(15), 5901-5907), 5-HT6 антагонисты могут смягчать синдром нарушения внимания. Международный патент WO 03/066056 А 1 сообщает, что антагонизм 5-HT6 рецептора мог бы способствовать росту нейронов в центральной нервной системе млекопитающего. Другой международный патент WO 03/065046 А 2 раскрывает новый вариант 5-HT6 рецептора человека и высказывает предположение, что 5-HT6 рецептора человека связан с многочисленными другими заболеваниями. Ранние исследования, изучавшие сродство различных ЦНС лигандов с известным терапевтическим применением или имеющих сильное структурное сходство с известными лекарствами, наводят на мысль о роли 5-HT6 лигандов в лечении шизофрении и депрессии. Например, клозапин (эффективное клиническое антипсихотическое средство) имеет высокое сродство к подтипу 5-HT6 рецептора. Также, несколько клинических антидепрессантов имеют высокое сродство к данному рецептору и выступают в роли антагонистов у этого сайта (Branchek, T.A.; Blackburn, T.P., Annual Reviews in Pharmacology and Toxicology, 2000, 40, 319-334). Более того, недавние in vivo исследования на крысах показывают, что 5-HT6 модуляторы могут быть полезны в лечении нарушений движений, включая эпилепсию (Stean, Т.; Routledge, С.; Upton, N.,British Journal of Pharmacology, 1999, 127 Proc. Supplement-131P; and Routledge, C.; Bromidge, S.M.; Moss,S.F.; Price, G.W.; Hirst, W.; Newman, H.; Riley, G.; Gager, Т.; Stean, Т.; Upton, N.; Clarke, S.E.; Brown, A.M.,British Journal of Pharmacology, 2000, 30 (7), 1606-1612). Вместе взятые, вышеупомянутые исследования серьезно указывают, что соединения, представляющие собой модуляторы, т.е. лиганды, 5-HT6 рецептора, могут быть полезны для терапевтических показаний, включая лечение заболеваний, связанных с дефицитом памяти, понимания и обучения, таких как болезнь Альцгеймера и синдром нарушения внимания; лечение изменений личности, таких как шизофрения; лечение расстройств поведения, таких как тревога, депрессия и невроз навязчивых состояний; лечение нарушений движения и нарушений моторики, таких как болезнь Паркинсона и эпилепсия; лечение заболеваний, связанных с нейродегенерацией, таких как удар или травма головы; или избавление от зависимости, включая зависимость от никотина, алкоголя и злоупотребления другими веществами. Ожидается также, что такие соединения будут пригодны для лечения некоторых желудочнокишечных (GI) нарушений, таких как функциональное расстройство кишечника. Смотри, например,В.L. Roth et al., J. Pharmacol. Exp. Ther., 1994, 268, p. 1403-14120, D.R. Sibley et al., Molecular Pharmacology, 1993, 43, 320-327, A.J. Sleight et al., Neurotransmission, 1995, 11, 1-5, and A.J. Sleight et al., SerotoninID Research Alert, 1997, 2(3), 115-118. Более того, сообщалось об уменьшении потребления пищи у крыс под действием 5-HT6 антагониста и 5-HT6 антисмысловые олигонуклеотиды, таким образом, потенциально возможны для применения в лечении ожирения. Смотри, например, Bentley et al., British Journal of Pharmacology, 1999, Suppl., 126,A64: 255; Wooley et al., Neuropharmacology, 2001, 41: 210-129 и WO 02/098878. Международные патенты WO 2004/055026 A1, 2004/048331 A1, 2004/048330 A1 и 2004/048328 A2(все принадлежат Suven Life Sciences Limited) описывают соответствующий уровень техники. Эти РСТ заявки и приведенные в них ссылки включены в данный текст. Другие WO 98/27081, 99/02502, 99/37623,99/424 65 и 01/32646 (все принадлежат Glaxo SmithKline Beecham PLC) раскрывают серию арилсульфонамидных и сульфоксидных соединений как антагонистов 5-HT6 рецептора и заявляют их пригодность для лечения различных нарушений ЦНС. Хотя некоторые 5-HT6 модуляторы были описаны, продолжает ощущаться потребность в соединениях, пригодных для модулирования 5-HT6. Поэтому целью настоящего изобретения является получение соединений, пригодных в качестве терапевтических средств для лечения различных нарушений центральной нервной системы, связанных с 5-HT6 рецептором или находящихся под его влиянием. Другой целью настоящего изобретения является разработка терапевтических методов и фармацевтических композиций, пригодных для лечения различных нарушений центральной нервной системы,связанных с 5-HT6 рецептором или находящихся под его влиянием. Особенностью настоящего изобретения является то, что полученные соединения также могут использоваться для дальнейшего изучения и лучшего понимания 5-HT6 рецептора. Предпочтительной целью настоящего изобретения является синтез сильнодействующего селективного антагониста 5-HT6 рецептора.-2 013875 Сущность изобретения Был найден класс аминоарильных сульфонамидных соединений, которые демонстрируют сродство к 5-HT6 рецептору и могут использоваться в качестве эффективных терапевтических средств для лечения нарушений центральной нервной системы (ЦНС).i. Настоящее изобретение относится к соединению, отвечающему формуле (I), вместе с его стереоизомером или его солью, образованной неорганической или органической кислотой в которой Ar представляет собой любую группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определяются как R1R представляет собой атом водорода, (C1-С 3)алкильную или гало(C1-С 3)алкильную группу;R1 и R4 независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С 3)алкил, гало(C1-С 3)алкил, (C1-С 3)алкокси, гало(С 1-С 3)алкокси,цикло(С 3-С 6)алкил или цикло(С 3-С 6)алкокси;R5 и R6 представляют собой либо водород, либо метил. Настоящее изобретение также предоставляет методы получения соединений с формулой (I), содержащих их композиций и методов их использования.ii. В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения, отвечающего формуле (I), или индивидуальных стереоизомеров, рацемической или не рацемической смеси стереоизомеров или их фармацевтически приемлемых солей или сольватов в смеси по меньшей мере с одним подходящим носителем.iii. В другом аспекте настоящее изобретение относится к использованию терапевтически эффективного количества соединения, отвечающего формуле (I), в производстве медикамента для лечения или профилактики нарушений, включающих селективное сродство к 5-HT6 рецептору.iv. В другом аспекте настоящее изобретение дополнительно относится к методу получения соединений, отвечающих формуле (I).v. Частичный список таких соединений, отвечающих общей формуле (I), следующий: 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-1 Н-индол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-метоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-изопропоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-4-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-6-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-метоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-изопропоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-4-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-6-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1 Н-индол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-метоксииндол;-3 013875 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-изопропоксииндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-броминдол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-хлориндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-фториндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-4-хлориндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-6-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-фтор]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-3-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-4-хлориндол; 1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонил-5-метоксииндол; 1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)ацетамидо]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)ацетамидо]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)этиламино]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндола гидрохлорид; 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1 Н-индола гидрохлорид; их стереоизомер и их соль. Краткое описание прилагающихся чертежей На фиг. 1 изображена гистограмма, показывающая эффект лечения по примеру 6 в дозировке 10 мг/кг перорально на время изучения нового объекта у животных, в сравнении с группой, которой давали наполнитель. На фиг. 2 изображена диаграмма, показывающая значительное увеличение времени ожидания для достижения темной зоны при пероральной дозе 10 мг/кг. Подробное описание изобретения 5-Гидрокситиптамин-6 (5-HT6) рецептор находится в ряду рецепторов, которые только недавно были идентифицированы молекулярным клонированием. Его способность связываться с широким набором терапевтических соединений, применяемых в психиатрии, дополненная его интригующим распределением в мозге, вызвала значительный интерес к новым соединениям, способным взаимодействовать с указанным рецептором или воздействовать на него. Неожиданно, было обнаружено, что аминоарильные сульфонамидные производные, отвечающие формуле (I), проявляют сродство к 5-HT6 рецептору в которой Ar представляет собой любую группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определяются как R1R представляет собой атом водорода, (C1-C3)алкильную или гало(C1-С 3)алкильную группу;R1 и R4 независимо представляют собой один или несколько заместителей в бензольном кольце и включает водород, галоген, циано, (C1-С 3)алкил, гало(C1-С 3)алкил, (C1-С 3)алкокси, гало(С 1-С 3)алкокси,цикло(С 3-С 6)алкил или цикло(С 3-С 6)алкокси;R5 и R6 представляют собой либо водород, либо метил. Разъяснения по каждой группе соединения (I) даны ниже. Определение каждого термина, использованного в настоящем тексте, имеет нижеописанное значение как в случае отдельного использования, так-4 013875 и в случае совместного использования с другими терминами, если не указано иное. Термин "галоген", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает атом, такой как фтор, хлор, бром или иод. Термин "(C1-С 3)алкил", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает метил, этил, н-пропил и изопропил. Термин "(C1-С 3)алкокси", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает метокси, этокси, пропилокси и изопропилокси, которые могут быть дополнительно замещены. Термин "гало(C1-C3)алкил", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает фторметил, дифторметил, трифторметил, трифторэтил,фторэтил, дифторэтил и т.п. Термин "гало(C1-С 3)алкокси", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает фторметокси, дифторметокси, трифторметокси,трифторэтокси, фторэтокси, дифторэтокси и т.п. Термин "цикло(С 3-С 6)алкил", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от трех до шести атомов углерода, и включает циклопропил, циклобутил, циклопентил, циклогексил, циклоалкильная группа может быть замещенной. Термин "цикло(С 3-С 6)алкокси", при использовании здесь и в формуле изобретения (если в контексте не указано иное), означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие от трех до шести атомов углерода, и включает циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклоалкилоксигруппа может быть замещенной, и т.п. Термин "гетероарил" предназначается для обозначения 5- или 6-членного моноциклического ароматического или 8-10-членного конденсированного бициклического ароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы. Подходящие примеры таких моноциклических ароматических колец включают тиенил, фурил, пирролил, триазолил, имидазолил, оксазолил,тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиразолил, пиримидил, пиридазинил,пиразинил и пиридил. Подходящие примеры таких конденсированных ароматических колец включают бензоконденсированные ароматические кольца, такие как хинолинил, изохинолинил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил, индолил, изоиндолил, индазолил, пирролопиридинил, бензофуранил, изобензофуранил, бензотиенил, бензоимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензоизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил и т.п. Гетероарильные группы, как описано выше, могут быть связаны с остальной частью молекулы через атом углерода или,если присутствует, подходящий атом азота, за исключением случаев, когда выше указано иное. Следует принимать во внимание, что, когда вышеупомянутые арильные или гетероарильные группы имеют более одного заместителя, указанные заместители могут быть связаны с образованием цикла, например карбоксильная и аминная группы могут быть связаны с образованием амидной группы. Термин гетероциклическое кольцо с числом членов от 5 до 7 предназначается для обозначения неароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы. Такие кольца могут быть частично насыщенными. Подходящие примеры гетероциклических колец с числом членов от 5 до 7 включают пиперидинил, тетрагидропиридинил, пирролидинил, морфолинил, азепанил, диазепанил и пиперазинил. Гетероциклическое кольцо с числом членов от 5 до 7, как описано выше, может быть связано с остальной частью молекулы через атом углерода или подходящий атом азота. Некоторые соединения, отвечающие формуле (I), способны существовать в стереоизомерных формах (например, диастереомеров и энантиомеров), и настоящее изобретение охватывает каждую из этих стереоизомерных форм и их смеси, включая рацематы. Различные стереоизомерные формы можно отделить одну от другой с помощью обычных методов, или любой конкретный изомер может быть получен стереоспецифичным или асимметрическим синтезом. Изобретение также охватывает таутомерные формы и их смеси. Термин "стереоизомеры" является общим термином для всех изомеров индивидуальных молекул,которые отличаются только ориентацией своих атомов в пространстве. Он включает зеркальные изомеры(энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений, содержащих более одного хирального центра, которые не являются зеркальными отображениями (диастереомеры). Как правило, стереоизомеры обычно получают в виде рацематов, которые можно разделить на оптически активные изомеры известными, по своей сути, методами. В случае соединений, отвечающих общей формуле (I) и имеющих асимметрический атом углерода, настоящее изобретение относится кD-форме, L-форме и D,L-смесям, а в случае нескольких асимметрических атомов углерода к диастерео-5 013875 мерным формам, и настоящее изобретение охватывает каждую из этих стереоизомерных форм и их смеси, включая рацематы. Те соединения, соответствующие общей формуле (I), которые имеют асимметрический атом углерода и, как правило, получаются в виде рацематов, могут быть разделены одно от другого посредством обычных методов, или любой конкретный изомер может быть получен стереоспецифичным или асимметрическим синтезом. Однако возможно также использование оптически активного соединения с самого начала, при этом как конечное соединение получают соответственно оптически активное или диастереомерное соединение. Стереоизомеры соединений, отвечающих общей формуле (I), можно получить одним из ниже представленных путей:i) один или более реагентов могут использоваться в их оптически активной форме;ii) в процессе восстановления может применяться оптически чистый катализатор или хиральный лиганд в дополнение к металлическому катализатору; в процессе восстановления могут применяться металлические катализаторы; металлические катализаторы могут представлять собой родий, рутений, индий и т.п.; хиральные лиганды предпочтительно могут представлять собой хиральные фосфины (Principles of Asymmetric synthesis, J.E. Baldwin Ed., Tetrahedron series, 14, 311-316).iii) смесь стереоизомеров можно расщепить обычными методами, такими как образование диастереомерных солей с хиральными кислотами, или хиральными аминами, или хиральными аминоспиртами,хиральными аминокислотами; получающуюся смесь диастереомеров можно затем разделить такими методами, как фракционная кристаллизация, хроматография и т.п., за которыми следует дополнительная стадия выделения оптически активного продукта путем гидролиза его производного (Jacques et al., "Enantiomers, Racemates and Resolution", Wiley Interscience, 1981);iv) смесь стереоизомеров можно расщепить обычными методами, такими как микробное расщепление, расщепление диастереомерных солей, образованных с хиральными кислотами или хиральными основаниями. Хиральными кислотами, которые могут применяться, могут быть винная кислота, миндальная кислота, молочная кислота, камфорсульфокислота, аминокислоты и т.п. Хиральными основаниями, которые могут применяться, могут быть цинхоновые алкалоиды, бруцин или основная аминогруппа, такая как лизин, аргинин и т.п. В случае соединений, отвечающих общей формуле (I) и содержащих геометрический изомеризм, настоящее изобретение относится ко всем этим геометрическим изомерам. Подходящие фармацевтически приемлемые соли очевидны для квалифицированных специалистов и включают описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как соли, образующиеся при соединении с неорганическими кислотами, например соляной, бромоводородной, серной, азотной или фосфорной кислотой; и органическими кислотами, например янтарной, малеиновой, уксусной, фумаровой, лимонной,винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Настоящее изобретение включает в свои рамки все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, формирующие часть настоящего изобретения, можно получить обработкой соединения, отвечающего формуле (I), 1-6 экв. основания, такого как гидрид натрия,метоксид натрия, этоксид натрия, гидроксид натрия, т-бутоксид калия, гидроксид кальция, ацетат кальция, хлорид кальция, гидроксид магния, хлорид магния и т.п. Могут использоваться такие растворители, как вода, ацетон, эфир, ТГФ, метанол, этанол, т-бутанол,диоксан, изопропанол, изопропиловый эфир или их смеси. В дополнение к фармацевтически приемлемым солям в настоящее изобретение включены другие соли. Они могут служить интермедиатами при очистке соединений, при синтезе других солей или для идентификации и характеристики соединений или интермедиатов. Соединения, отвечающие формуле (I), могут быть получены в кристаллической или некристаллической формах и, в случае кристаллической формы, могут быть опционально сольватированы, например, в гидраты. Настоящее изобретение включает в свои рамки стехиометрические сольваты (например, гидраты), а также соединения, содержащие варьирующие количества растворителя (например, воды).-6 013875 Настоящее изобретение также предоставляет метод получения соединения, отвечающего формуле(I), или его фармацевтически приемлемой соли, который состоит в контактировании соединения, отвечающего формуле (а), в которой R1, R4 и Ar такие же, как определено ранее для соединения, отвечающего формуле (I), с производным пиперидона, отвечающим формуле (b) в котором R5, R6 и R такие же, как определено ранее для соединения, отвечающего формуле (I); посредством восстановительного аминирования с применением подходящего восстановительного агента/катализатора в присутствии инертного растворителя при температуре окружающей среды с получением соединения, отвечающего формуле (I). Приведенная выше реакция предпочтительно проводится в таком растворителе, как ТГФ, толуол,ацетон, этилацетат, ДМФА, ДМСО, диметоксиэтан, N-метилпирролидон, метанол, этанол, пропанол и т.п., и предпочтительно использование либо ацетона, либо ДМФА. Инертная атмосфера может обеспечиваться применением инертных газов, таких как N2, Ar или Не. Реакцию можно проводить в присутствии основания, такого как NaBH4, NaBCNH3, Na(триацетокси)ВН и т.п., при температуре окружающей среды, до полного завершения реакции. В этой конденсации можно использовать широкое разнообразие основных агентов. Опционально могут присутствовать другие реагенты, такие как изопропоксид титана(IV). Обычное время реакции примерно от 30 мин до 72 ч. По окончании реакции все летучие компоненты удаляют при пониженном давлении. Перед обработкой реакционную смесь можно опционально подкислить. Продукт можно выделить осаждением, промыть, высушить и очистить далее стандартными методами, такими как перекристаллизация, колоночная хроматография и т.д. Опционально соединения, отвечающие формуле (I), можно получить посредством нуклеофильного замещения в соединении, отвечающем формуле (а), в котором R1, R4 и Ar такие же, как определено ранее, с пиперидиновым галогенидом, отвечающим формуле (с), в котором R5, R6 и R такие же, как определено выше; X представляет собой атом галогена (например, фтор, хлор или иод); в присутствии подходящего основания и инертного растворителя при подходящей температуре, с получением соединения, отвечающего формуле (I). Приведенная выше реакция предпочтительно проводится в таком растворителе, как ТГФ, толуол,этилацетат, ацетон, ДМФА, ДМСО, диметоксиэтан и т.п. или их смеси, и предпочтительно использование либо ацетона, либо ДМФА. Инертная атмосфера может обеспечиваться применением инертных газов, таких как N2, Ar или He. Реакцию можно проводить в присутствии основания, такого как K2CO3,Na2CO3, NaH или их смесей. Температура реакции может находиться в интервале от 20 до 150 С в зависимости от выбора растворителя и предпочтительно при температуре в интервале от 30 до 100 С. Продолжительность реакции может находиться в интервале от 1 до 24 ч, предпочтительно от 2 до 6 ч. Промежуточное соединение (а) можно получить реакцией производного индола с сульфонилхлоридами, RSO2Cl, в присутствии инертного органического растворителя, который включает ароматические углеводороды, такие как толуол, о-, м-, п-ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир,трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран; нитрилы, такие как ацетонитрил и пропионитрил; кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и трет-бутилметилкетон; спирты,такие как метанол, этанол, н-пропанол, н-бутанол, трет-бутанол и также ДМФА (N,N-диметилформамид), ДМСО (N,N-диметилсульфоксид) и вода. Список предпочтительных растворителей включает ДМСО, ДМФА, ацетонитрил и ТГФ. Также могут использоваться их смеси в различных соотношениях. Подходящие основания представляют собой в основном неорганические соединения, такие как гидроксиды щелочных металлов и гидроксиды щелочно-земельных металлов, такие как гидроксид лития,гидроксид натрия, гидроксид калия и гидроксид кальция; оксиды щелочных металлов и оксиды щелочно-земельных металлов, оксид лития, оксид натрия, оксид магния и оксид кальция; гидриды щелочных-7 013875 металлов и гидриды щелочно-земельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; амиды щелочных металлов и амиды щелочно-земельных металлов, такие как амид лития, амид натрия, амид калия и амид кальция; а также карбонаты щелочных металлов и карбонаты щелочно-земельных металлов, такие как гидрокарбонат натрия; металлоорганические соединения, в частности алкилы щелочных металлов, такие как метиллитий, бутиллитий, фениллитий; алкилмагний галогениды, такие как метилмагний хлорид, и алкоксиды щелочных металлов и алкоксиды щелочно-земельных металлов, такие как метоксид натрия, этоксид натрия, этоксид калия, трет-бутоксид калия и диметоксимагний, а также другие органические основания, такие как триэтиламин, триизопропиламин и N-метилпиперидин, пиридин. Особенно предпочтительны гидроксид натрия, метоксид натрия, этоксид натрия,гидроксид калия, карбонат калия и триэтиламин. Реакцию можно проводить соответствующим образом в присутствии катализатора межфазного переноса, такого как гидросульфат тетра-н-бутиламмония и т.п. Инертная атмосфера может обеспечиваться применением инертных газов, таких как N2, Ar или Не. Продолжительность реакции может варьировать от 1 до 24 ч, предпочтительно от 2 до 6 ч, после чего, при желании, полученное соединение можно превратить в его соль. Сульфонилхлориды, R10SO2Cl, могут быть получены из коммерческих источников или синтезированы по общеизвестным методикам. Соединения, полученные вышеописанным методом синтеза по настоящему изобретению, могут быть переведены в другое соединение по настоящему изобретению дальнейшими химическими модификациями хорошо известной реакции, такой как окисление, восстановление, постановка защиты, снятие защиты, реакция перегруппировки, галогенирование, гидроксилирование, алкилирование, алкилтиолирование, деметилирование, O-алкилирование, О-ацилирование, N-алкилирование, N-алкенилирование,N-ацилирование, N-цианирование, N-сульфонилирование, реакции каплинга с применением переходных металлов и т.п. При необходимости, может проводиться любая одна или более из последующих стадий:ii) удаление любых защитных групп илиiii) образование его фармацевтически приемлемой соли, сольвата или пролекарства. В процессе i) фармацевтически приемлемые соли можно получить общеизвестным способом посредством реакции с подходящей кислотой или производным кислоты, как детально описано ранее. В процессе i) примеры защитных групп и путей их удаления можно найти в Т.W. Greene .ProtectiveGroups in Organic Synthesis. (J. Wiley and Sons, 1991). Подходящие защитные группы аминов включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или т-бутоксикарбонил) и арилалкил (например, бензил), которые могут быть соответствующим образом удалены гидролизом (например, с помощью кислоты, такой как соляная или трифторуксусная кислота) или восстановительно (например, гидрогенолиз бензильной группы или восстановительное удаление 2',2',2'-трихлорэтоксикарбонильной группы с помощью цинка в соляной кислоте). Другие подходящие защитные группы аминов включают трифторацетил (-COCF3), который можно удалить гидролизом,катализируемым основанием, или связанную с твердофазной смолой бензильную группу, такую как 2,6-диметоксибензильная группа, связанная со смолой Merrifield (линкер Эллмана), которую можно удалить кислотно-катализируемым гидролизом, например катализируемым трифторуксусной кислотой. Процесс iii) может проводиться с применением общепринятых методик взаимопревращения, таких как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное ароматическое замещение, гидролиз сложных эфиров или образование амидной связи. В целях использования соединений, отвечающих формуле (I), в терапии они обычно вводятся в состав фармацевтических композиций в соответствии со стандартной фармацевтической практикой. Фармацевтические композиции по настоящему изобретению могут изготавливаться общепринятым способом с помощью одного или более фармацевтических носителей. Так, активные соединения по настоящему изобретению могут вводиться в состав готовых форм для перорального, буккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения, или форм, пригодных для введения посредством ингаляции или вдувания. Для перорального введения фармацевтические композиции могут принимать форму, например,таблеток или капсул, полученных общепринятыми методами с фармацевтически приемлемыми наполнителями, такими как связующие агенты (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или силикагель); дезинтегрирующие агенты (например, картофельный крахмал или натриевый гликолат крахмала); или увлажняющие агенты (например, лаурилсульфатнатрия). На таблетки можно нанести покрытие с помощью хорошо известных методов. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут выпускаться в виде твердого продукта, предназначенного для объединения перед использованием с водой или другим подходящим переносчиком. Такие жидкие препараты могут быть получены общепринятыми методами с применением фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сироп сорбитола,-8 013875 метилцеллюлоза или пищевые гидрированные жиры); эмульгаторы (например, лецитин или гуммиарабик); неводные переносчики (например, миндальное масло, маслянистые эфиры или этиловый спирт) и консерванты (например, метил или пропил п-гидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может принимать форму таблеток или лепешек, изготавливаемых общепринятым способом. Активные соединения по настоящему изобретению могут включаться в состав готовых форм для парентерального введения посредством инъекции, включая использование общепринятых методик катетеризации или вливания. Готовые формы для инъекций могут выпускаться в форме однократных доз,например, в ампулах или в упаковках нескольких доз с добавлением консерванта. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных переносчиках, и могут содержать добавки готовых форм, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для разбавления с подходящим носителем, например стерильной апирогенной водой, перед применением. Активные соединения по настоящему изобретению могут включаться в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие общепринятые суппозиторные основы, такие как масло какао или другие глицериды. Для интраназального введения или введения посредством ингаляции активные соединения по настоящему изобретению удобно применять в виде аэрозольного спрея из находящегося под давлением контейнера или распылителя, или из капсулы с помощью ингалятора или порошковдувателя. В случае сжатого аэрозоля подходящий пропеллант, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и доза препарата могут определяться посредством клапана, обеспечивающего введение отмеренного количества. Медикамент для находящегося под давлением контейнера или распылителя может содержать раствор или суспензию активного соединения, в то время как для капсулы предпочтительно использование порошкообразной формы. Капсулы и картриджи (изготовленные, например, из желатина) для использования в ингаляторе или порошковдувателе могут содержать порошковую смесь соединения по настоящему изобретению и подходящую порошковую основу, такую как лактоза или крахмал. Аэрозольные препараты для лечения обозначенных выше состояний (например, мигрени) у среднего взрослого человека предпочтительно устроены так, что каждая мерная доза или "выпуск" аэрозоля содержит от 20 до 100 мкг соединения по настоящему изобретению. Общая дневная доза для аэрозоля будет находиться в интервале от 100 мкг до 10 мг. Введение может проводиться несколько раз в день,например 2, 3, 4 или 8 раз, с принятием, например, 1, 2 или 3 доз при каждом приеме. Эффективное количество соединения, отвечающего общей формуле (I), или его производных, как определено выше, может использоваться для производства медицинских препаратов, наряду с общепринятыми фармацевтическими вспомогательными веществами, носителями и добавками. Такая терапия включает множественные выборы: например, одновременное введение двух совместимых соединений в виде единой дозы или введение каждого соединения индивидуально в раздельных дозах; или, при необходимости, через равные промежутки времени или раздельно в целях свести к максимуму благотворный эффект или минимизировать потенциальные побочные эффекты лекарств, в соответствии с известными принципами фармакологии. Выражение "фармацевтически приемлемый" указывает на то, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, составляющими готовую форму, и/или млекопитающими, которые подвергаются лечению этими веществами. Настоящие соединения могут применяться в качестве фармацевтических средств для лечения различных состояний, при которых показано применение антагониста 5-HT6 рецептора, таких как лечение нарушений центральной нервной системы, таких как психозы, шизофрения, маниакальная депрессия,депрессия, неврологические нарушения, нарушения памяти, паркинсонизм, боковой амиотрофический склероз, болезнь Альцгеймера, синдром дефицита внимания и гиперактивности (ADHD) и болезнь Хантингтона. Термин "шизофрения" означает шизофрению, шизофреноподобное нарушение, шизоаффективное нарушение и психическое нарушение, в котором термин "психическое" относится к бредовым идеям,отчетливым галлюцинациям, дезорганизованной речи или дезорганизованному или кататоническому поведению. Смотри Diagnostic and Statistical Manual of Mental Disorder, fourth edition, American Psychiatric"Терапевтически эффективное количество" определяется как "количество соединения по настоящему изобретению, которое (i) лечит или предотвращает определенное заболевание, состояние или нарушение, (ii) смягчает, улучшает или устраняет один или более симптомов определенного заболевания,состояния или нарушения или (iii) предотвращает или замедляет наступление одного или более симптомов определенного заболевания, состояния или нарушения, описанных в данном тексте". Дозировка активного соединения может варьировать в зависимости от факторов, таких как способ-9 013875 введения, возраст и вес пациента, природа и степень излечиваемого заболевания и сходных факторов. Поэтому любое упоминание в данном тексте фармацевтически эффективного количества соединения,отвечающего общей формуле (I), отсылается к вышеуказанным факторам. Предлагаемая дозировка активного соединения по настоящему изобретению для перорального, парентерального, назального или буккального введения, для среднего взрослого человека, при лечении указанных выше состояний, составляет от 0,1 до 200 мг активного ингредиента на однократную дозу, которая может вводиться, например, от 1 до 4 раз в день. В целях иллюстрации, приведенная в данном тексте реакционная схема предоставляет потенциальные пути для синтеза соединений по настоящему изобретению, также как и ключевые интермедиаты. Более детальное описание индивидуальных стадий реакции приведено в разделе "Примеры". Для квалифицированных в данной области специалистов очевидно, что могут использоваться другие синтетические пути для синтеза изобретенных соединений. Хотя конкретные исходные материалы и реагенты указаны на схемах и обсуждены ниже, вместо них легко могут быть использованы другие исходные материалы и реагенты для обеспечения разнообразия производных и/или условий реакции. Кроме того, многие соединения, полученные описанными ниже методами, могут быть далее модифицированы в свете этого раскрытия с помощью общепринятой химии, хорошо известной квалифицированным специалистам в данной области. Коммерческие реагенты использовались без дополнительной очистки. Под комнатной температурой понимается интервал 25-30 С. Температуры плавления не корректировались. ИК спектры записывали с применением KBr и в твердом состоянии. Если не указано иное, все масс-спектры регистрировали в условиях ионизации методом электроспрея (ESI). 1 Н ЯМР спектры регистрировали при 300 МГц на приборе Bruker. В качестве растворителя использовался дейтерированный хлороформ (99,8% D). В качестве внутреннего стандарта использовался TMS. Значения химических сдвигов выражены в миллионных долях . Для обозначения мультиплетности ЯМР сигналов использовали следующие аббревиатуры:s=синглет, bs=уширенный синглет, d=дублет, t=триплет, q=квартет, qui=квинтет, h=гептет, dd=дублет дублетов, dt=дублет триплетов, tt=триплет триплетов, m=мультиплет. Фоновые пики в данных ЯМР и масс-спектрометрии были скорректированы. Удельное вращение измеряли при комнатной температуре для D-линии натрия (589 нм). Хроматография означает колоночную хроматографию, проводившуюся с использованием 60-120 меш силикагеля под давлением азота (флэш-хроматография). Все процитированные в спецификации публикации, включая патенты и патентные заявки, но не ограничиваясь только ими, включены в данный текст в виде ссылок, как если бы каждая отдельная публикация была специально отдельно обозначена как включенная в данный текст в виде полного изложения. Последующие описания и примеры иллюстрируют получение соединений по настоящему изобретению. Описание 1. 3-Нитробензолсульфонилхлорид (D1). Хлорсульфоновую кислоту (475 г) помещали в 1-л трехгорлую круглодонную колбу, снабженную защитной трубкой и воронкой для добавления жидкостей. Хлорсульфоновую кислоту охлаждали на ледяной бане до 5-10 С и медленно прибавляли к кислоте нитробензол с такой скоростью, чтобы поддерживалась температура ниже 10 С. Затем реакционную смесь нагревали до 25 С и затем медленно нагревали на масляной бане до 80-85 С. Далее реакционную смесь перемешивали при 80-85 С в течение 3 ч. После завершения реакции (ТСХ) реакционную смесь охлаждали до 10 С и выливали на смесь льда и воды при перемешивании и поддержании температуры ниже 10 С; полученную суспензию затем фильтровали на воронке Бюхнера. Твердый остаток на фильтре промывали 500 мл воды. Полученный твердый остаток высушивали над пентоксидом фосфора в эксикаторе, получая D1 в виде белого твердого вещества. Описание 2. 1-(3-Нитро)бензолсульфонилиндол (D2). К раствору индола (17,09 ммоль, 2,0 г) в 20 мл 1,2-дихлорэтана в 100-мл трехгорлой круглодонной колбе добавляли (34,19 ммоль, 3,45 г) триэтиламина при 25 С. К вышеозначенной смеси добавляли раствор 3-нитробензолсульфонилхлорида (25,64 ммоль, 5,68 г) в 25 мл дихлорметана, поддерживая температуру ниже 10 С. После этого реакционную смесь перемешивали 24 ч при 25 С. После завершения реакции (ТСХ) реакционную смесь выливали на смесь льда и воды при перемешивании и полученную смесь экстрагировали этилацетатом (230 мл). Объединенные этилацетатные экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением 5,4 г сырого продукта в виде густого масла. Это соединение очищали на колонке, используя кислый силикагель и н-гексан с переходом на 5% этилацетат-гексан в качестве элюента. Описание 3. 1-(3-Аминобензолсульфонил)индол (D3). К раствору 1-(3-нитробензолсульфонил)индола (6,62 ммоль, 2,0 г) в 10 мл этанола в 50-мл трехгорлой круглодонной колбе добавляли (33,11 ммоль, 1,85 г) железного порошка при 25 С. К вышеозначенной смеси добавляли 2 мл воды и 1-2 капли соляной кислоты. Затем реакционную смесь перемешивали 4 ч при 75-80 С. После завершения реакции (ТСХ) реакционную смесь отфильтровывали на воронке- 10013875 Бюхнера и остаток промывали 2 порциями по 20 мл горячего этанола. Объединенные этанольные слои отгоняли в вакууме, остаток заливали 30 мл ледяной воды и подщелачивали 40% раствором гидроксида натрия. Водный слой экстрагировали дихлорметаном (50 мл 3). Объединенные дихлорметановые экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением 2,4 г сырого продукта в виде густого масла. Это соединение очищали на колонке, используя нейтральный силикагель и н-гексан с переходом на 40% этилацетат:н-гексан в качестве элюента. Описание 4. N-ацетил-2-анизидин. Ортоанизидин (0,67 моль, 82 г) помещали в 1-л круглодонную колбу, оснащенную воронкой для добавления жидкостей и защитной трубкой; в один прием добавляли триэтиламин (1,0 моль, 100 г). Вышеозначенную смесь охлаждали до 0-5 С и добавляли по каплям ацетилхлорид, поддерживая температуру ниже 10 С. После добавления ацетилхлорида охлаждающую баню убирали и полученную смесь перемешивали при 25-28 С 3 ч. После завершения реакции (ТСХ) реакционную смесь выливали на смесь льда и воды и водный слой экстрагировали дихлорметаном (2300 мл). Объединенные дихлорметановые экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением 96,5 г твердого вещества. Описание 5. 3-Ацетамидо-4-метоксибензолсульфонилхлорид. Хлорсульфоновую кислоту (475 г) помещали в 1-л трехгорлую круглодонную колбу, снабженную защитной трубкой и охлажденную до 10 С. 2-Метоксиацетанилид (95 г) добавляли небольшими порциями, поддерживая температуру ниже 10 С. После добавления всего количества 2-метоксиацетанилида охлаждающую баню убирали и реакцию нагревали до 25 С. Реакционную смесь перемешивали при 25 С в течение 24 ч. После завершения реакции (ТСХ) реакционную смесь выливали на смесь льда и воды и полученную суспензию затем фильтровали на воронке Бюхнера. Твердый остаток на фильтре промывали 500 мл воды и полученный твердый остаток высушивали над пентоксидом фосфора в эксикаторе, получая 114,5 г белого твердого вещества. Описание 6. 1-(3-Ацетамидо-4-метокси)бензолсульфонилиндол. Индол (17,09 ммоль, 2,0 г) помещали в 100-мл трехгорлую круглодонную колбу вместе сN,N-диметилформамидом (20 мл). Вышеозначенный раствор затем медленно добавляли к суспензии гидрида натрия (25,64 ммоль, 1,02 г) в ДМФА, поддерживая температуру ниже 10 С. Затем реакционную смесь перемешивали 1 ч при 25 С. К этому интенсивно перемешиваемому раствору затем медленно добавляли 3-(N-ацетил)-4-метоксибензолсульфонилхлорид (22,22 ммоль, 5,86 г) с такой скоростью, чтобы температура поддерживалась ниже 10 С. Реакционную смесь далее перемешивали 2 ч. После завершения реакции (ТСХ) реакционную смесь выливали на 100 г смеси льда и воды при перемешивании и полученную смесь экстрагировали этилацетатом (230 мл). Объединенные этилацетатные экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением 6,52 г сырого продукта в виде густого масла. Описание 7. 1-(3-Амино-4-метокси)бензолсульфонилиндол. 1-(3-ацетиламино)бензолсульфонил-1 Н-индол (18,95 ммоль, 6,52 г) помещали в 50-мл трехгорлую круглодонную колбу с 15 мл этанола. Вышеозначенный раствор нагревали на масляной бане до 50-55 С и добавляли по каплям соляную кислоту (47,38 ммоль, 5,76 г, чистота 30%). Реакционную смесь кипятили при 80-85 С 3 ч. После завершения реакции (ТСХ) реакционную смесь выливали на 60 г смеси льда и воды, подщелачивали 20% раствором NaOH и смесь экстрагировали этилацетатом (260 мл). Объединенные этилацетатные экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением сырого продукта в виде густого масла. Это соединение очищали на силикагельной колонке, используя в качестве элюента этилацетат и н-гексан (от 5 до 30%), с получением 3,2 г белого твердого вещества. Описание 8. N-ацетил-2-толуидин. Ортотолуидин (0,75 моль, 80 г) помещали в 1-л круглодонную колбу, оснащенную воронкой для добавления жидкостей и защитной трубкой. В один прием добавляли триэтиламин (1,13 моль, 113,77 г). Вышеозначенную смесь охлаждали до 0-5 С и добавляли по каплям ацетилхлорид, поддерживая температуру ниже 10 С. После добавления ацетилхлорида охлаждающую баню убирали и полученную смесь перемешивали при 25-28 С 3 ч. После завершения реакции (ТСХ) реакционную смесь выливали на 500 г смеси льда и воды и водный слой экстрагировали дихлорметаном (2300 мл). Объединенные дихлорметановые экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением 113,6 г твердого вещества. Описание 9. 3-Ацетамидо-4-метилбензолсульфонилхлорид. Хлорсульфоновую кислоту (500 г) помещали в трехгорлую круглодонную колбу, снабженную защитной трубкой и охлажденную до 10 С. N-ацетил 2-толуидин (100 г) добавляли небольшими порциями,поддерживая температуру ниже 10 С. После добавления всего количества 2-метоксиацетанилида охлаждающую баню убирали и реакцию нагревали до 25 С. Реакционную смесь перемешивали при 25 С в течение 24 ч. После завершения реакции (ТСХ) реакционную смесь выливали на смесь льда и воды и полу- 11013875 ченную суспензию затем фильтровали на воронке Бюхнера. Твердый остаток на фильтре промывали 500 мл воды и полученный твердый остаток высушивали над пентоксидом фосфора в эксикаторе, получая 113,5 г белого твердого вещества. Было обнаружено и подтверждено данными ЯМР и ВЭЖХ, что это вещество содержит смесь двух изомеров; однако желаемый изомер был выделен фракционной кристаллизацией из бензола и использован в дальнейших экспериментах после тщательной характеризации. Описание 10. 1-(3-Ацетамидо-4-метил)бензолсульфонилиндол. Индол (17,09 ммоль, 2,0 г) помещали в 100-мл трехгорлую круглодонную колбу вместе сN,N-диметилформамидом (20 мл). Вышеозначенный раствор затем медленно добавляли к суспензии гидрида натрия (25,64 ммоль, 1,02 г) в ДМФА, поддерживая температуру ниже 10 С. Затем реакционную смесь перемешивали 1 ч при 25 С. К этому интенсивно перемешиваемому раствору затем медленно добавляли 3-(N-ацетил)-4-метоксибензолсульфонилхлорид (22,22 ммоль, 5,86 г) с такой скоростью, чтобы температура поддерживалась ниже 10 С. Реакционную смесь далее перемешивали 2 ч. После завершения реакции (ТСХ) реакционную смесь выливали на 100 г смеси льда и воды при перемешивании и полученную смесь экстрагировали этилацетатом (230 мл). Объединенные этилацетатные экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении, получая 5,8 г сырого продукта в виде густого масла. Это соединение очищали на силикагельной колонке, используя в качестве элюента этилацетат и н-гексан (от 5 до 50%), с получением 1,3 г липкого твердого вещества. Описание 11. 1-(3-Амино-4-метил)бензолсульфонилиндол. 1-(3-(N-ацетамидо)-4-метил)бензолсульфонил-1 Н-индол (3,96 ммоль, 1,3 г) помещали в 50-мл трехгорлую круглодонную колбу с 3 мл этанола. Вышеозначенный раствор нагревали на масляной бане до 50-55 С и добавляли по каплям соляную кислоту (9,9 ммоль, 1,21 г, чистота 30%). Реакционную смесь кипятили при 80-85 С 3 ч. После завершения реакции (ТСХ) реакционную смесь выливали на смесь льда и воды, подщелачивали 40% раствором NaOH и смесь экстрагировали этилацетатом (260 мл). Объединенные этилацетатные экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением 1,5 г сырого продукта в виде густого масла. Пример 1. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-1 Н-индол. К раствору 1-(3-аминобензолсульфонил)индола (4,49 ммоль, 1,0 г) в 20 мл уксусной кислоты добавляли N-метил-4-пиперидон (8,99 ммоль, 1,01 г) и сульфат натрия (44,98 ммоль, 6,388 г) при 10 С. Реакционную смесь перемешивали при 25C 1 ч. Через 1 ч добавляли небольшими порциями триацетоксиборгидрид натрия (13,47 ммоль, 3,3 г) в течение 30 мин и после полного добавления триацетоксиборгидрида натрия реакцию перемешивали при 250 С 24 ч. После завершения реакции (ТСХ) реакционную смесь выливали на смесь льда и воды, подщелачивали 20% раствором NaOH и смесь экстрагировали этилацетатом (260 мл). Объединенные этилацетатные экстракты затем промывали водой, насыщенным раствором NaCl и высушивали над сульфатом магния. Летучие вещества удаляли при пониженном давлении с получением сырого продукта в виде густого масла. Это соединение очищали на силикагельной колонке, используя этилацетат и триэтиламин (от 0,2 до 1,0%) в качестве элюента, с получением 494 мг кристаллического твердого вещества. ИК-спектр (см-1): 1129, 1172, 1600, 2940, 3406; масс-спектр (m/z): 370,3 (М+Н)+; 1H-ЯМР (, ч./млн): 1,40-1,46 (2 Н, м), 1,89-1,93 (2 Н, м), 2,07-2,12 (2 Н, м), 2,30 (3 Н, с),2,76-2,79 (2 Н, д, J=11,48 Гц), 3,17-3,19 (1 Н, м), 3,77-3,79 (1 Н, д, J=7,76 Гц), 6,64-6,65 (2 Н, м), 6,95-6,96(1 Н, т, J=1,96 и 1,84 Гц), 7,12-7,13 (2 Н, м), 7,22-7,32 (2 Н, м), 7,52-7,54 (2 Н, м), 7,99-8,01 (1 Н, д, J=8,28 Гц). Пример 2. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-метоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1145, 1225, 1336, 3374; масс-спектр (m/z): 400,4 (М+Н)+; 1 Н-ЯМР (, ч./млн): 1,39-1,48 (2 Н, м), 1,90-1,97 (2 Н, м), 2,09-2,17 (2 Н, м), 2,32 (3 Н, с), 2,79-2,82 (2 Н, м),3,18-3,2 (1 Н, м), 3,75-3,77 (1 Н, д, J=7,74 Hz), 3,81 (3 Н, с), 6,57-6,58 (1 Н, д, J=3,66 Гц), 6,61-6,66 (1 Н, м),6,90-6,93 (2 Н, м), 6,97-6,979 (1 Н, д, J=2,416 Гц), 7,098-7,18 (2 Н, м), 7,482-7,491 (1 Н, д, J=3,65 Гц), 7,8817,9 (1 Н, д, J=9,1 Гц). Пример 3. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-изопропоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1147, 1455, 1601, 2936, 3403; масс-спектр (m/z): 428,4(М+Н)+; 1 Н-ЯМР (, ч./млн): 1,31-1,33 (д, 6 Н, J=6,07 Гц), 1,41-1,47 (2 Н, м), 1,9-1,93 (2 Н, д, J=12,06 Гц),2,08-2,14 (2 Н, м), 2,31 (3 Н, с), 2,79-2,81 (2 Н, д, J=11,32 Гц), 3,18-3,2 (1 Н, м), 3,76-3,78 (1 Н, д, J=7,71 Гц),4,48-4,52 (кв, 1 Н), 6,55-6,55 (1 Н, д, J=3,58 Гц), 6,63-6,66 (1 Н, дд), 6,88-6,91 (1 Н, д, J=2,43, 2,4 и 9,0 Гц),6,92-6,92 (1 Н, т, J=1,82 и 1,62 Гц), 6,97-6,98 (1 Н, д, J=2,34 Гц), 7,07-7,18 (2H, м), 7,46-7,47 (1 Н, д,J=3,6 Гц), 7,86-7,88 (1 Н, д, J=9,03 Гц). Пример 4. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-броминдол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1129, 1600, 2936, 3254; масс-спектр (m/z): 448, 450 (М+Н)+; 1J=11,52 Гц), 3,17-3,19 (1 Н, м), 3,79-3,81 (1 Н, д, J=7,84 Гц), 6,58-6,59 (1 Н, д, J=3,64 Гц), 6,65-6,69 (1 Н, дд),6,89-6,9 (1 Н, т, J=2,08 и 2,0 Гц), 7,65-7,11 (1 Н, м), 7,15-7,18 (1 Н, т, J=8,0 и 7,92 Гц), 7,38-7,41 (1 Н, дд,J=1,92 и 8,8 Гц), 7,52-7,53 (1H, д, J=3,68 Гц), 7,66-7,67 (1 Н, д, J=1,88 Гц), 7,87-7,89 (1 Н, д, J=8,8 Гц). Пример 5. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1130, 1367, 1600, 2939, 3255; масс-спектр (m/z): 404,3, 406,3(М+Н)+; 1H-ЯМР (, ч./млн): 1,39-1,48 (2 Н, м), 1,89-1,92 (2 Н, д, J=12,2 Гц), 2,08-2,14 (2 Н, м), 2,31 (3 Н, с),2,79-2,82 (2H, д, J=11,6 Гц), 3,17-3,18 (1 Н, м), 3,79-3,81 (1H, д, J=6,88 Гц), 6,58-6,59 (1H, д, J=3,72 Гц),6,67-6,68 (1H, д, J=2,2 Гц), 6,9-6,91 (1 Н, т, J=2,0 и 1,76 Гц), 7,07-7,19 (2 Н, м), 7,24-7,27 (1 Н, дд, J=2,0 и 8,8 Гц), 7,5-7,5 (1H, д, J=1,96 Гц), 7,54-7,55 (1H, д, J=3,64 Гц), 7,91-7,94 (1H, д, J=8,84 Гц). Пример 6. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1139, 1363, 1693, 2933, 3265; масс-спектр (m/z): 388,3(М+Н)+;1 Н-ЯМР (, ч./млн): 1,38-1,47 (2H, м), 1,89-1,93 (2H, м), 2,07-2,12 (2H, м), 2,3 (3 Н, с), 2,77-2,8 (2 Н,д, J=11,52 Гц), 3,17-3,22 (1 Н, м), 3,8-3,82 (1 Н, д, J=7,82 Гц), 6,6-6,61 (1 Н, д, J=3,97 Гц), 6,65-6,69 (1H, д),6,91-6,92 (1H, т, J=2 Гц), 7,09-7,19 (4H, м), 7,56-7,57 (1 Н, д, J=3,65 Гц), 7,92-7,96 (1 Н, м). Пример 7. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-4-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1135, 1475, 1600, 2935, 3252; масс-спектр (m/z): 404,3,406,3(М+Н)+; 1H-ЯМР (, ч./млн): 1,38-1,47 (2 Н, м), 1,9-1,93 (2 Н, м), 2,09-2,17 (2 Н, м), 2,32 (3 Н, с), 2,772,8 (1 Н, д, J=11,6 Гц), 3,15-3,22 (1H, м), 3,79-3,81 (1 Н, д, J=7,76 Гц), 6,66-6,68 (1H, дд, J=l,64, 1,56 и 8,0 Гц), 6,77-6,77 (1 Н, д, J=3,64 Гц), 6,92-6,93 (1 Н, т, J=l,96 и 1,88 Гц), 7,09-7,23 (4 Н, м), 7,58-7,59 (1 Н, д,J=3,72 Гц), 7,88-7,93 (1 Н, м). Пример 8. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-6-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1128, 1176, 1510, 1601, 3415; масс-спектр (m/z): 404,3, 406,3(2 Н, д, J=11,48 Гц), 3,21-3,23 (1H, м), 3,83-3,85 (1 Н, д, J=7,68 Гц), 6,6-6,61 (1H, д, J=3,6 Гц), 6,65-6,69 (1 Н,дд), 6,97-6,98 (1 Н, т, J=2,04 и 1,92 Гц), 7,08-7,22 (3 Н, м), 7,42-7,44 (1 Н, д, J=8,36 Гц), 7,51-7,52 (1 Н, д,J=3,68 Гц), 8,03-8,03 (1 Н, д, J=1,24 Гц). Пример 9. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонилиндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1133, 1170, 1365, 1516, 2933, 3428; масс-спектр (m/z): 384,3(2H, м), 7,5-7,55 (2 Н, м), 8,01-8,03 (1 Н, д, J=8,32 Гц). Пример 10. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-метоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1147, 1364, 1467, 1928, 3412; масс-спектр (m/z): 414,4(1 Н, д, J=7,88 Гц), 7,066-7,09 (1 Н, дд, J=1,68, 1,72 и 7,82 Гц), 7,477-7,486 (1 Н, д, J=3,6 Гц), 7,9-7,92 (1 Н, д,J=8,96 Гц). Пример 11. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-изопропоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. Масс-спектр (m/z): 443 (М+Н)+. Пример 12. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-броминдол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1129, 1368, 1439, 1680, 2936, 3419; масс-спектр (m/z): 462,2,464,2 (М+Н)+; 1H-ЯМР (, ч./млн): 1,38-1,49 (2H, м), 1,84-1,92 (2 Н, м), 2,05 (3 Н, с), 2,14-2,17 (2 Н, м), 2,34(3 Н, с), 2,8-2,84 (2 Н, м), 3,16-3,22 (1 Н, м), 3,49-3,55 (1 Н, м), 6,57-6,57 (1 Н, д, J=3,53 Гц), 6,83-6,84 (1 Н, д,J=1,26 Гц), 7,04-7,07 (2 Н, м), 7,37-7,4 (1 Н, дд, J=1,92 и 8,8 Гц), 7,52-7,53 (1 Н, Д, J=3,64 Гц), 7,65-7,66 (1 Н,д, J=1,87 Гц), 7,89-7,92 (1 Н, д, J=8,8 Гц). Пример 13. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. Масс-спектр (m/z): 419 (М+Н)+, 421 (М+Н)+. Пример 14. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-фториндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1138, 1170, 1367, 1459, 2940, 3422; масс-спектр (m/z): 402,3(М+Н)+; 1H-ЯМР (, ч./млн): 1,39-1,46 (2 Н, м), 1,88-1,91 (2 Н, м), 2,05 (3 Н, с), 2,11-2,16 (2H, м), 2,33 (3 Н,с), 2,78-2,8 (2 Н, д, J=11,1 Гц), 3,17-3,28 (1H, м), 3,51-3,52 (1H, д, J=7,1 Гц), 6,58-6,59 (1H, д, J=3,68 Гц),6,83-6,87 (1H, м), 6,98-7,1 (3 Н, м), 7,15-7,18 (1H, дд, J=2,5 и 8,77 Гц), 7,56-7,56 (1H, д, J=3,61 Гц), 7,947,98 (1 Н, дд, J=4,65, 4,39 и 9,06 Гц). Пример 15. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-4-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. Масс-спектр (m/z): 419 (М+Н)+, 421 (М+Н)+. Пример 16. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-6-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. Масс-спектр (m/z): 419 (М+Н)+, 421 (М+Н)+. Пример 17. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1 Н-индол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1130, 1165, 1525, 2937, 3412; масс-спектр (m/z): 398,4(2 Н, д, J=11,36 Гц), 3,15-3,2 (1H, м), 3,8 (3 Н, с), 4,2-4,22 (1H, д, J=7,92 Гц), 6,61-6,62 (1 Н, д, J=3,6 Гц),6,65-6,68 (1H, д, J=8,48 Гц), 6,86-6,87 (1H, д, J=2,24 Гц), 7,18-7,22 (2H, м), 7,26-7,28 (1 Н, м), 7,5-7,53 (2 Н,м), 8,01-8,03 (1 Н, д, J=8,2 Гц). Пример 18. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-метоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1148, 1169, 1521, 2941, 3400; масс-спектр (m/z): 430,3(2 Н, м), 3,152-3,171 (1 Н, м), 3,808-3,815 (6 Н, д), 4,2-4,22 (1 Н, д, J=7,91 Гц), 6,54-6,55 (1 Н, д, J=3,62 Гц),6,65-6,67 (1 Н, д, J=8,47 Гц), 6,82-6,83 (1 Н, д, J=2,22 Гц), 6,88-6,91 (1 Н, дд, J=2,48 и 9,02 Гц), 6,95-6,96 (1 Н,д, J=2,25 Гц), 7,15-7,18 (1 Н, дд, J=2,25 и 8,42 Гц), 7,47-7,48 (1 Н, д, J=3,59 Гц), 7,9-7,92 (1 Н, д, J=8,96 Гц). Пример 19. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-изопропоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1147, 1454, 1519, 2937, 3403; масс-спектр (m/z): 457,8(кв, 1 Н), 6,52-6,53 (1 Н, д, J=3,6 Гц), 6,65-6,67 (1 Н, д, J=8,52 Гц), 6,83-6,84 (1 Н, д, J=2,2 Гц), 6,86-6,89 (1 Н,дд, J=2,44 и 8,98 Гц), 6,95-6,96 (1 Н, д, J=2,4 Гц), 7,16-7,18 (1 Н, дд, J=2,24 и 8,4 Гц), 7,46-7,47 (1 Н, д, J=3,6 Гц), 7,88-7,9 (1 Н, д, J=9,0 Гц). Пример 20. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-броминдол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. 1 Н-ЯМР (, ч./млн): 1,39-1,45 (2 Н, м), 1,84-1,88 (2 Н, м), 2,07-2,13 (2 Н, м), 2,32(3 Н, с), 2,77-2,83 (2 Н, м), 3,13-3,15 (1 Н, м), 3,81 (3 Н, с), 4,24-4,26 (1 Н, д, J=7, 88 Гц), 6,55-6,55 (1 Н, д,J=3,76 Гц), 6,66-6,68 (1 Н, д, J=8,44 Гц), 6,79-6,8 (1 Н, д, J=2,24 Гц), 7,16-7,19 (1 Н, дд, J=2,28 и 8,4 Гц),7,36-7,39 (1 Н, дд, J=1,92 и 8,8 Гц), 7,52-7,53 (1 Н, д, J=3,68 Гц), 7,64-7,64 (1 Н, д, J=1,88 Гц), 7,89-7,92 (1 Н,д, J=8,84 Гц). Пример 21. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1129, 1166, 1519, 2940, 3418; масс-спектр (m/z): 434,4(1H, д, J=8,48 Гц), 6,8-6,81 (1 Н, д, J=2,28 Гц), 7,16-7,19 (1 Н, дд, J=2,4, 2,32 и 8,48 Гц), 7,23-7,26 (1 Н, м),7,48-7,49 (1 Н, д, J=2,04 Гц), 7,5-7,54 (1 Н, д, J=3,6 Гц), 7,94-7,96 (1 Н, д, J=8,92 Гц). Пример 22. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-фториндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1147, 1167, 1518, 2942, 3395; масс-спектр (m/z): 418,5(2 Н, д, J=11,4 Гц), 3,15-3,17 (1 Н, м), 3,82 (3 Н, с), 4,23-4,25 (1 Н, д, J=7,84 Гц), 6,57-6,58 (1 Н, д, J=3,56 Гц),6,67-6,69 (1 Н, д, J=8,48 Гц), 6,82-6,82 (1 Н, д, J=2,28 Гц), 6,99-7,05 (1 Н, м), 7,15-7,19 (2 Н, м), 7,56-7,56 (1 Н,д, J=3,6 Гц), 7,94-7,96 (1 Н, м). Пример 23. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-4-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1132, 1162, 1519, 2936, 3421; масс-спектр (m/z): 434,3- 14013875 Пример 24. 1-[(3-(1-Метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-6-хлориндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1135, 1268, 1520, 2937, 3423; масс-спектр (m/z): 434,5, 436,5(2 Н, д, J=11,2 Гц), 3,17-3,21 (1 Н, м), 3,83 (3 Н, с), 4,25-4,27 (1 Н, д, J=7,72 Гц), 6,58-6,59 (1 Н, д, J=3,56 Гц),6,66-6,71 (1 Н, д, J=8,52 Гц), 6,9-6,9 (1 Н, д, J=2,28 Гц), 7,17-7,2 (2 Н, м), 7,41-7,43 (1 Н, д, J=8,36 Гц), 7,517,52 (1 Н, д, J=3, 64 Гц), 8,05-8,06 (1 Н, д, J=1,56 Гц). Пример 25. 1-[3-(1-Метилпиперидин-4-ил)амино-4-фтор]бензолсульфонилиндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с незначительными изменениями. ИК-спектр (см-1): 1130, 1375, 1522, 2939, 3404; масс-спектр (m/z): 388,3(М+Н)+; 1H-ЯМР (, ч./млн): 1,4-1,47 (2 Н, м), 1,85-1,9 (2 Н, м), 2,1-2,15 (2 Н, м), 2,32 (3 Н, с), 2,77-2,79 (2 Н,м), 3,13-3,22 (1 Н, м), 3,92-3,95 (1 Н, м), 6,65-6,66 (1 Н, м), 6,92-6,94 (1 Н, д, J=8,4), 6,95-6,97 (1 Н, д, 8,44),7,0-7,3 (1 Н, дд, J=2,28 и 7,74 Гц), 7,09-7,13 (1 Н, м), 7,21-7,5 (1 Н, тд), 7,27-7,33 (1 Н, тд, J=0,64 и 7,36), 7,57,51 (1 Н, д, J=3,68), 7,52-7,55 (1 Н, д, 9,6), 7,99-8,22 (1 Н, дд, J=0,6 и 7,36). Пример 26. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-3-броминдол. Для синтеза данного производного 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонилиндол был подвергнут бромированию по известным в литературе методикам. Масс-спектр (m/z): 449 (М+Н)+,451 (М+Н)+. Пример 27. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-3-броминдол. Для синтеза данного производного 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонилиндол был подвергнут бромированию по известным в литературе методикам. Масс-спектр (m/z): 479 (М+Н)+, 481 (М+Н)+. Пример 28. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-5-фториндол. Для синтеза данного производного 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол был подвергнут бромированию по известным в литературе методикам. Масс-спектр (m/z): 467(М+Н)+, 469 (М+Н)+. Пример 29. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-4-хлориндол. Для синтеза данного производного 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-4-хлориндол был подвергнут бромированию по известным в литературе методикам. Масс-спектр (m/z): 484(М+Н)+, 486 (М+Н)+. Пример 30. 1-[3-(1-Метилпиперидин-4-ил)метиламино]бензолсульфонилиндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с использованием модифицированного исходного материала, 1-[3-метиламино]бензолсульфонилиндола, и с незначительными изменениями. Масс-спектр (m/z): 384 (М+Н)+. Пример 31. 1-[3-(1-Метилпиперидин-4-ил)метиламино]бензолсульфонил-5-метоксииндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с использованием модифицированного исходного материала, 1-[3-метиламино]бензолсульфонил-5-метоксииндола, и с незначительными изменениями. Масс-спектр (m/z): 414 (М+Н)+. Пример 32. 1-[3-(1-Метилпиперидин-4-ил)метиламино]бензолсульфонил-5-фториндол. Указанное производное было получено по методике, сходной с приведенной в примере 1, с использованием модифицированного исходного материала, 1-[3-метиламино]бензолсульфонил-5-фториндола, и с незначительными изменениями. Масс-спектр (m/z): 402 (М+Н)+. Пример 33. 1-[3-(1-Метилпиперидин-4-ил)ацетамидо]бензолсульфонил-5-фториндол. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол ацетилировали с использованием ацетилхлорида и дихлорметана по известным в литературе методикам. Масс-спектр (m/z): 430(М+Н)+. Пример 34. 1-[3-(1-Метилпиперидин-4-ил)ацетамидо]бензолсульфонилиндол. Проводили восстановительное ацилирование 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонилиндола ацетилхлоридом по той же методике, как в примере 33, и далее без выделения проводили восстановление боргидридом натрия в уксусной кислоте. Масс-спектр (m/z): 412 (М+Н)+. Пример 35. 1-[3-(1-Метилпиперидин-4-ил)этиламино]бензолсульфонил-5-фториндол. Указанное производное было получено по методике, сходной с приведенной в примере 34, с незначительными изменениями. Масс-спектр (m/z): 416 (М+Н)+. Пример 36. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндола гидрохлорид. 1-[3-(1-Метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол (пример 6, 100 мг) растворяли в минимальном количестве изопропилового спирта и раствор охлаждали. К охлажденному раствору медленно прибавляли насыщенный раствор соляной кислоты (13,5%) в изопропиловом спирте и оставляли перемешиваться. Выделялась белая кристаллическая соль, которую отфильтровывали и промывали холодным изопропиловым спиртом.- 15013875 Пример 37. 1-[3-(1-Метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1 Н-индола гидрохлорид. Эта соль соединения из примера 17 была получена по методике, сходной с приведенной в примере 36. Пример 38. Измерение приема пищи (поведенческая модель). Использовались мужские особи крыс Уистара (120-140 г), полученные из N.I.N. (Национальный Институт Питания, Хайдерабад, Индия). Затем определяли хронический эффект соединений, отвечающих общей формуле (I), на прием пищи у крыс, не ограниченных в питании, как описано далее. Крыс помещали в индивидуальные домашние клетки на 28 дней. В течение этого периода крысам перорально или интерперитонеально вводили композицию, содержащую соединение, отвечающее формуле (I) или соответствующую композицию (наполнитель) без указанного соединения (контрольная группа), один раз в день. Крысам предоставлялось неограниченное количество пищи и воды. На 0, 1, 7, 14, 21 и 28-й день крыс оставляли с предварительно взвешенными количествами пищи. Потребление пищи и набор веса измерялись на рутинной основе. Метод приема пищи также описан в литературе (Kask et al., European Journal of Pharmacology, 414, 2001, 215-224, Turnball et. Al., Diabetes, vol. 51, August, 2002 и некоторые внутрилабораторные модификации). Соответствующие части описаний включены в данный текст в виде ссылок, и они образуют часть раскрытия изобретения. Некоторые соединения-представители показали статистически значимое уменьшение потребления пищи при проведении эксперимента вышеописанным образом в дозировках либо 10 мг/Кг, либо 30 мг/Кг, либо в обеих. Пример 39. Таблетка, содержащая соединение, отвечающее формуле (I). Ингредиенты объединяли и гранулировали с использованием растворителя, такого как метанол. Препарат затем высушивали и формировали таблетки (содержащие примерно 20 мг активного соединения) при помощи соответствующей таблетирующей машины. Пример 40. Композиция для перорального введения. Ингредиенты смешивали и распределяли в капсулы, содержащие примерно 100 мг каждая; одна капсула приблизительно равняется общей дневной дозе.- 16013875 Пример 41. Жидкий препарат для перорального введения. Ингредиенты смешивали с образованием суспензии для перорального введения. Пример 42. Препарат для парентерального введения. Активный ингредиент растворяли в части воды для инъекций. Затем при перемешивании добавляли хлорид натрия в количестве, достаточном для получения изотонического раствора. Раствор доводили до требуемого веса добавлением оставшегося количества воды для инъекций, фильтровали через 0,2 мкм мембранный фильтр и упаковывали в стерильных условиях. Пример 43. Препарат для суппозитория. Ингредиенты расплавляли совместно, перемешивали на паровой бане и разливали в формы, содержащие 2,5 г общего веса. Пример 44. Препарат для наружного применения. Все ингредиенты, за исключением воды, объединяли и нагревали до примерно 60 С при перемешивании. Затем достаточное количество воды для эмульгирования ингредиентов добавляли примерно при 60 С при интенсивном перемешивании и затем добавляли воду до общего веса примерно 100 г. Пример 45. Моделирование задачи распознавания объекта. Свойства усиления когнитивной способности соединений по настоящему изобретению оценивались- 17013875 с помощью познавательной модели у животных: моделирование задачи распознавания объекта. В качестве экспериментальных животных использовались самцы крыс Уистара (230-280 г), полученные из N.I.N. (Национальный Институт Питания, Хайдерабад, Индия). В каждой клетке находилось четыре животных. За день до эксперимента животным уменьшали рацион пищи на 20%, давали неограниченное количество воды на протяжении всего эксперимента и содержали в условиях чередования 12-часовых циклов свет/темнота. Также, крыс приучали к индивидуальным аренам в течение 1 ч при отсутствии каких-либо объектов. Одной группе из 12 крыс давали наполнитель (1 мл/кг) перорально, а другой группе животных давали соединение, отвечающее формуле (I), перорально или интерперитонеально, за один час до знакомого (Т 1) или выборочного испытания (Т 2). Эксперимент проводился на акриловом открытом поле размером 505050 см. На стадии ознакомления (T1) крыс по отдельности помещали на 3 мин на открытое поле, на котором в двух соседних углах на расстоянии 10 см от стены находились два идентичных объекта (пластиковые бутылки, 12,5 см высоты 5,5 см в диаметре), покрытые желтой лентой (a1 и а 2). Через 24 ч (Т 1) испытания на долговременную память, те же самые крысы помещались на ту же арену, на которую их помещали в ходе T1 испытания. Крысам со стадии выбора (T2) позволяли исследовать открытое поле в течение 3 мин в присутствии одного знакомого объекта (а 3) и одного нового объекта (b) (стеклянная бутылка желтого цвета, 12 см в высоту и 5 см в диаметре). Знакомые объекты имели сходные текстуры, цвета и размеры. Во время испытаний Т 1 и Т 2 исследование каждого объекта (определяемое как обнюхивание, облизывание, жевательные движения или движения усами при направлении носа на объект с дистанции менее 1 см) измеряли по отдельности секундомером. Сидение на объекте не рассматривалось как исследовательская активность, однако это наблюдалось редко. Т 1 представляет собой общее время, потраченное на исследование знакомых объектов (a1+a2). T2 представляет собой общее время,потраченное на исследование знакомых объектов и новых объектов (а 3+b). Тест на распознавание объектов проводился по методике, описанной в Ennaceur, A., Delacour, J.,1988, A new one-trial test for neurobiological studies of memory in rats- Behavioral data, Behav. Brain Res., 31,47-59. Некоторые репрезентативные соединения показали позитивные эффекты, указывающие на улучшенное распознавание нового объекта, а именно повышенное время исследования нового объекта и повышенный индекс исключения. Данные для одного из соединений, пример 6, представлены на фиг. 1. Пример 34. Вызывание жевания/зевоты/потягивания 5HT6R антагонистами. Использовались самцы крыс Уистара весом 200-250 г. Крысам делали инъекции наполнителя и помещали в индивидуальные прозрачные камеры на 1 ч каждый день в течение двух дней перед днем проведения эксперимента для их привыкания к камерам наблюдения и процедуре эксперимента. В день эксперимента крыс помещали в камеры наблюдения сразу после введения лекарства и непрерывно наблюдали на предмет зевоты, потягивания и жевательной активности от 60 до 90 мин после инъекций лекарства или наполнителя. За 60 мин до введения лекарства животным вводили физостигмин, 0,1 мг/кг интерперитонеально. Регистрировали среднее число зеваний, потягиваний и бесцельных жевательных движений за 30-минутный период наблюдения. Репрезентативные примеры, такие как пример 1, пример 6 и пример 17, показали 40-60% рост количества зеваний, потягиваний и жевательных движений по сравнению с группой, которой давали наполнитель, при дозировках 1, 3, 10 и 30 мг/кг. Литература: 1. King М.V., Sleight A.J., Woolley M.L., and et al., Neuropharmacology, 2004, 47, 195-204. 2. Bentey J.C, Bourson A., Boess F.G., Fone K.С.F., Marsden C.A., Petit N., Sleight A.J., British Journalof Pharmacology, 1999, 126 (7), 1537-1542). Пример 35. Водный лабиринт. Блок водного лабиринта состоял из круглого бассейна (диаметр 1,8 м, высота 0,6 м), сделанного из черного плексигласа (TSE systems, Germany), наполненного водой (242 С) и расположенного под широкоугольной видеокамерой для слежения за животным. Платформу из плексигласа площадью 10 см 2, лежащую на 1 см ниже поверхности воды, помещали в центр одного из четырех воображаемых квадрантов,который оставался постоянным для всех крыс. Использование черного плексигласа для изготовления лабиринта и платформы исключало любые внутрилабиринтные подсказки правильного пути выхода. В отличие от этого, тренировочная комната содержала несколько сильных визуальных подсказок за пределами лабиринта для составления пространственной карты, необходимой для нахождения пути выхода. Применялась автоматическая система слежения [Videomot 2 (5.51), TSE systems, Germany]. Эта программа анализирует видеоизображения, полученные цифровой камерой и панелью получения изображений,которая определяла длину пути, скорость плавания, число попыток и продолжительность времени плавания, затраченного в каждом квадранте водного лабиринта. Литература: 1. Yamada N., Hattoria A., Hayashi Т., Nishikawa Т., Fukuda Н. et al., Pharmacology, Biochem. And Behaviour, 2004, 78, 787-791.- 18013875 2. Linder M.D., Hodges D.B., Hogan J.В., Corsa J.A., et al., The Journal of Pharmacology and Experimental Therapeutics, 2003, 307 (2), 682-691. Пример 35. Блок пассивного избегания. Животных тренировали в рамках парадигмы однократного пассивного избегания перешагивания границы свет-темнота. Тренировочный блок состоял из камеры длиной 300 мм, шириной 260 мм и высотой 270 мм, сделанной в соответствии с общепринятым дизайном. Передняя и верхняя стенки были прозрачные, позволяя экпериментатору наблюдать поведение животного внутри блока. Камера разделена на два отдела, разделенных центральной заслонкой, которая содержит небольшое отверстие шириной 50 мм и высотой 75 мм, расположенной близко к передней стенке камеры. Меньший из отделов имел ширину 9 мм и содержал источник освещения низкой мощности (6 В). Больший отдел имел ширину 210 мм и не был освещен. Пол темного отдела был образован решеткой из 16 горизонтальных перекладин из нержавеющей стали, которые имели диаметр 5 мм и располагались на расстоянии 12,5 мм друг от друга. Генератор постоянного тока сообщал решетчатому полу разряд в 0,75 мА каждые 0,5 с через 16 перекладин. Уровень сопротивления для контрольной группы крыс был определен равным 40-60 мкОм, и блок был соответствующим образом откалиброван. Электронная схема, определяющая сопротивление животного,обеспечивала точность разряда постоянного тока посредством автоматического изменения вольтажа через изменение сопротивления. Экспериментальная методика. Эксперимент проводился в соответствии с ранее описанной методикой (Fox et al., 1995). Использовались взрослые самцы крыс Уистара весом 200-230 г. Животных приносили в лабораторию за 1 ч до эксперимента. В день тренинга животных помещали напротив задней части освещенного отдела камеры. Секундомер включали в момент, когда животное полностью повернулось по направлению к передней поверхности камеры. Засекали период времени, проходящий до входа в темную камеру (обычно 20 с), и когда животное полностью входило в темный отдел, сообщали ему неизбежный электрический разряд в 0,75 мА продолжительностью 3 с. Затем животных возвращали в их домашние клетки. Между сеансами тренинга оба отдела камеры убирали для удаления любых обонятельных следов. Воспоминание этого ингибирующего стимула определяли через 24, 72 ч и через 7 дней после тренинга путем возвращения животного в светлую камеру и засекания периода времени, проходящего до их входа в темную камеру,при этом в качестве временного критерия было выбрано 300 с. Некоторые соединения демонстрировали значительное увеличение периода времени, проходящего до входа в темную зону, при пероральной дозировке 10 мг/кг. Репрезентативные данные для примера 6 показаны на фиг. 2 в графической форме. Данные, приведенные на фиг. 2, показывают, что соединения по настоящему изобретению улучшают познание и, конкретнее, укрепление памяти в модели разрушения с течением времени. Литература: 1. Callahan P.M., Ilch С.Р., Rowe N.В., Tehim A., Abst. 776.19.2004, Society for neuroscience, 2004. 2. Fox G.В., Connell A.W.U., Murphy K.J., Regan С.М., Journal of Neurochemistry, 1995, 65, 6, 27962799. Пример 46. Анализ связывания с рецептором 5-HT6 человека. Фармакологические данные для соединений можно протестировать в соответствии со следующими методиками. Материалы и методы. Источник рецептора: рекомбинант человека, экспрессированный в клетках HEK293. Радиолиганд: [3H]LSD (60-80 Кюри/ммоль). Окончательная концентрация лиганда - [1,5 нМ]. Неспецифический детерминант: метиотепин мезилат - [0,1 M]. Соединение-стандарт: метиотепин мезилат. Позитивный контроль: метиотепин мезилат. Условия инкубирования: реакции проводили в 50 мМ TRIS-HCl (рН 7,4), содержащем 10 мМMgCl2, 0,5 мМ EDTA, в течение 60 мин при 37 С. Реакцию заканчивали быстрым фильтрованием под вакуумом на стекловолоконных фильтрах. Определяли уловленную радиоактивность на фильтрах и сравнивали с контрольными значениями для установления каких-либо взаимодействий тестируемого(ых) соединения(ий) с клонированным серотониновым - 5 НТ 6 связывающим участком.for Tricyclic Psychotropic Drugs. Mol. Pharmacol. (43): 320-327 (1993). Пример 47. cAMP тест. Антагонистические свойства соединений по отношению к 5-НТ 6 рецепторам человека определяли тестированием их воздействия на аккумулирование сАМР в стабильно трансфицированных клеткахHEK293. Связывание агониста с 5-НТ 6 рецептором человека приводит к увеличению активности аденил циклазы. Соединение, являющееся агонистом, покажет увеличение выработки сАМР, а соединение, являющееся антагонистом, блокирует действие агониста. 5-НТ 6 рецепторы человека клонировали и стабильно экспрессировали в клетках HEK293. Эти клетки помещали в ячейки 6-ячеечного планшета в среде DMEM/F12 с 10% фетальной телячьей сывороткой(FCS) и 500 g/мл G418 и инкубировали при 37 С в CO2 инкубаторе. Клетки оставляли расти примерно до 70% слияния перед началом эксперимента. В день эксперимента среду культуры удаляли и клетки промывали один раз средой без фетальной сыворотки (SFM). Добавляли два миллилитра SFM+IBMX среды и инкубировали при 37 С 10 мин. Среду удаляли и в соответствующие ячейки добавляли свежую SFM+IBMX среду, содержащую различные соединения, и 1 мкМ серотонина (как антагониста), затем инкубировали 30 мин. После инкубирования удаляли среду и один раз промывали клетки 1 мл PBS (фосфатным буферным раствором). Каждую ячейку обрабатывали 1 мл холодного 95% этанола и 5 мМ EDTA (2:1) при 4 С в течение 1 ч. Затем клетки соскабливали и переносили в пузырьки Эппендорф. Пузырьки центрифугировали 5 мин при 4 С и супернатант хранили при 4 С до анализа. Содержание сАМР определяли методом EIA (иммуноферментный анализ) с использованием EIA набора Amersham Biotrak cAMP (Amersham RPN 225). Применяли описанную для данного набора методику. Вкратце, сАМР определялся посредством конкуренции между немеченым сАМР и точно отмеренным количеством меченного пероксидазой сАМР у связывающихся участков на анти-сАМР антителе. Антитело иммобилизовали на полистирольных микропланшетах с предварительно нанесенным вторым антителом. Реакцию начинали добавлением 50 мкл меченного пероксидазой сАМР к образцу (100 мкл),предварительно инкубированным с иммунной сывороткой (100 мкл) 2 ч при 4 С. После инкубирования в течение 1 ч при 4 С несвязанный лиганд отделяли промывкой образца. Затем добавляли энзимный субстрат, триметилбензидин (1) и инкубировали при комнатной температуре 60 мин. Реакцию останавливали добавлением 100 мкл 1,0 М серной кислоты и полученный цвет считывали микропланшетным спектрофотометром при 450 нм в течение 30 мин. При функциональном аденилатциклазном анализе было обнаружено, что некоторые соединения по настоящему изобретению являются конкурентоспособными антагонистами с хорошей селективностью по отношению ко многим другим рецепторам, включая другие серотониновые рецепторы, такие как 5-HT1A и 5-НТ 7. или его фармацевтически приемлемая соль,где Ar представляет собой любую одну группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определены как R1R представляет собой атом водорода, (C1-С 3)алкильную или гало(C1-С 3)алкильную группу;R1 и R4 независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С 3)алкил, гало(C1-С 3)алкил, (C1-С 3)алкокси, гало(С 1-С 3)алкокси,цикло(С 3-С 6)алкил или цикло(С 3-С 6)алкокси;R5 и R6 представляют собой либо водород, либо метил. 2. Соединение по п.1, в котором Ar представляет собой фенил, нафтил, индолил, индазолил, пирролопиридинил, бензофуранил, бензотиенил или бензимидазолил. 3. Соединение по п.1, в котором R представляет собой атом водорода, метил или этил. 4. Соединение по п.1, в котором R1 и R4 представляют собой водород, галоген, пергалоалкил, пергалоалкокси, циано, (C1-С 3)алкил, гало(C1-С 3)алкил, (C1-С 3)алкокси, гало(C1-С 3)алкокси, алкокси(C1 С 3)алкокси, гидрокси(C1-С 3)алкокси, цикло(С 3-С 6)алкил или цикло(С 3-С 6)алкокси. 5. Соединение по п.1, в котором R2 представляет собой водород, (C1-С 3)алкил, гало(С 1-С 3)алкил,(C1-С 3)алкокси или гало(C1-С 3)алкокси. 6. Соединение по п.1, в котором R3 представляет собой водород, (C1-C3)алкил или гало(C1-С 3)алкил. 7. Соединение по п.1, в котором R5 и R6 представляют собой водород. 8. Соединение по п.1, выбранное из следующей группы: 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-1 Н-индол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-метоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-изопропоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-4-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-6-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-метоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-изопропоксииндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-4-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метил]бензолсульфонил-6-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1H-индол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-метоксииндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-изопропоксииндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-броминдол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-хлориндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-5-фториндол; 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-4-хлориндол;- 21013875 1-[(3-(1-метилпиперидин-4-ил)амино)-4-метокси]бензолсульфонил-6-хлориндол; 1-[3-(1-метилпиперидин-4-ил)амино-4-фтор]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-3-броминдол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-3-бром-4-хлориндол; 1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонил-5-метоксииндол; 1-[3-(1-метилпиперидин-4-ил)метиламино]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)ацетамидо]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)ацетамидо]бензолсульфонилиндол; 1-[3-(1-метилпиперидин-4-ил)этиламино]бензолсульфонил-5-фториндол; 1-[3-(1-метилпиперидин-4-ил)амино]бензолсульфонил-5-фториндола гидрохлорид; 1-[3-(1-метилпиперидин-4-ил)амино-4-метокси]бензолсульфонил-1 Н-индола гидрохлорид; их стереоизомер и их соль. 9. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли,где Ar представляет собой любую одну группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определены как R1R представляет собой атом водорода, (C1-С 3)алкильную или гало(C1-С 3)алкильную группу;R1 и R4 независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С 3)алкил, гало(C1-С 3)алкил, (C1-С 3)алкокси, гало(С 1-С 3)алкокси,цикло(С 3-С 6)алкил или цикло(С 3-С 6)алкокси;R5 и R6 представляют собой либо водород, либо метил,который состоит в контактировании соединения, отвечающего формуле (а), где R1, R4 и Ar такие же, как определено ранее в п.1, с производным пиперидона, отвечающим формуле (b) где R5, R6 и R такие же, как определено ранее, посредством восстановительного аминирования с применением подходящего восстановительного агента/катализатора в присутствии инертного растворителя при температуре окружающей среды с получением соединения формулы (I).- 22013875 10. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли,где Ar представляет собой любую одну группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или более независимыми заместителями, и такие заместители определяются как R1R представляет собой атом водорода, (С 1-С 3)алкильную или гало(C1-С 3)алкильную группу;R1 и R4 независимо представляют собой один или несколько заместителей в бензольном кольце и включают водород, галоген, циано, (C1-С 3)алкил, гало(C1-С 3)алкил, (C1-С 3)алкокси, гало(С 1-С 3)алкокси,цикло(С 3-С 6)алкил или цикло(С 3-С 6)алкокси;R5 и R6 представляют собой либо водород, либо метил,который включает проведение нуклеофильного замещения в соединении, отвечающем формуле (а),в котором R1, R4 и Ar такие же, как определено ранее в п.1, с пиперидиновым галогенидом, отвечающим формуле (с) в котором R5, R6 и R такие же, как определено выше; X представляет собой атом галогена, такой как фтор, хлор или иод, с применением подходящего основания и инертного растворителя при подходящей температуре. 11. Способ по п.9 или 10, необязательно включающий:b) удаление любых защитных групп илиc) образование его фармацевтически приемлемой соли, сольвата или пролекарства. 12. Способ лечения нарушений центральной нервной системы, связанных с 5-HT6 рецептором или находящихся под его влиянием, у нуждающихся в таком лечении пациентов, который состоит во введении указанному пациенту терапевтически эффективного количества соединения формулы (I), как определено по любому одному из пп.1-8. 13. Способ по п.12, в котором указанное нарушение представляет собой тревогу, нарушение понимания или нейродегенеративное расстройство. 14. Способ по п.12, в котором указанное нарушение представляет собой болезнь Альцгеймера или болезнь Паркинсона. 15. Способ по п.12, в котором указанное нарушение представляет собой синдром дефицита внимания или невроз навязчивых состояний. 16. Способ по п.12, в котором указанное нарушение представляет собой удар или травму головы. 17. Способ по п.12, в котором указанное нарушение представляет собой нарушение питания или ожирение. 18. Фармацевтическая композиция, которая содержит фармацевтически приемлемый носитель и эффективное количество соединения формулы (I), как определено выше по любому одному из пп.1-8. 19. Применение соединения формулы (I) по любому одному из пп.1-8 в качестве лекарственного средства.- 23013875 20. Применение соединения формулы (I) по любому одному из пп.1-8 для получения лекарственного средства для лечения нарушений центральной нервной системы, связанных с 5-HT6 рецептором или находящихся под его влиянием. 21. Способ тестирования антагонистов и антагонистов, селективных в отношении 5-HT6 рецептора,включающий введение соединения по п.1 и наблюдение за реакциями указанных животных; и сравнение указанных реакций с реакциями контрольных животных; и введение других соединений с неизвестной активностью указанным экспериментальным животным.
МПК / Метки
МПК: C07D 401/12, A61K 31/4523, A61K 31/4468
Метки: функциональные, аминоарильные, лиганды, производные, сульфонамидные, 5-нт6
Код ссылки
<a href="https://eas.patents.su/25-13875-aminoarilnye-sulfonamidnye-proizvodnye-kak-funkcionalnye-5-nt6-ligandy.html" rel="bookmark" title="База патентов Евразийского Союза">Аминоарильные сульфонамидные производные как функциональные 5-нт6 лиганды</a>
Предыдущий патент: Применение антиатеротромботического соединения для получения лекарственных средств, предназначенных для лечения сосудистых нарушений
Следующий патент: Опухолеассоциированные пептиды, беспорядочно связывающиеся с молекулами класса ii человеческого лейкоцитарного антигена (hla)
Случайный патент: Биологически активная добавка к пище для нормализации уровня андрогенов и снижения ожирения у мужчин












