Сульфонамидные производные
Номер патента: 1919
Опубликовано: 22.10.2001
Авторы: Бейкер Стефен Р., Мацумото Кен, Блейш Томас Дж., Саймон Ричард Л., Маккеннон Трейси Е., Арнольд Маклин Б., Зиммерман Деннис М., Тиззано Джозеф П., Орнштейн Пол Л., Зарринмайех Хамидех, Эскрибано Ана М., Смит Эдвард К.Р., Кэнтрелл Бадди Е., Бликман Дэвид
Формула / Реферат
1. Применение соединения формулы
R1-L-NHSO2R2 I,
где R1 представляет незамещенную или замещенную ароматическую или гетероароматическую группу;
R2 представляет (C1-C6)-алкил, (С3-С6)-циклоалкил, (C1-C6)-фторалкил, (C1-С6)-хлоралкил, (C2-C6)-алкенил, (С1-С4)-алкокси-(C1-C4)-алкил, фенил, который является незамещенным или замещен галогеном, (C1-C4)-алкилом или (C1-C4)-алкокси, или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил или вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидиниль-ную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу; и
L представляет (С2-С4)-алкиленовую цепь, незамещенную или замещенную одним или двумя заместителями, выбранными независимо среди (C1-C6)-алкила, арил-(С1-С6)-алкила, (С2-С6)-алкенила, арил-(C2-C6)-алкенила и арила, или двумя заместителями, которые вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С3-C8)-карбоциклическое кольцо;
или его фармацевтически приемлемой соли для получения лечебного средства для потенцирования функции глутаматных рецепторов.
2. Применение по п.1, где R2 представляет (C1-C6)-алкил, (C1-C6)-фторалкил, (C2-C6)-алкенил или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил или, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу.
3. Применение по пп.1, 2, где L представляет группу формулы
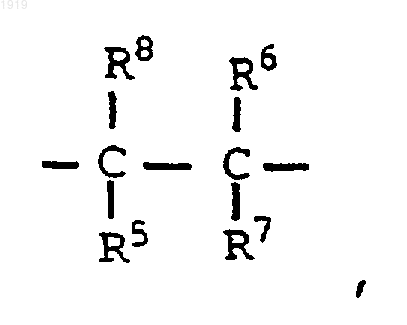
где два заместителя из числа R5, R6, R7 и R8 представляют водород, а остальные представляют независимо водород, (С1-С6)-алкил, арил-(C1-С6)-алкил, (С2-С6)-алкенил, арил-(С2-С6)-алкенил или арил или вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С3-С8)-карбоциклическое кольцо.
4. Применение по п.3, где R6 и R7 представляют водород, а каждый из R5 и R8 представляет независимо водород или (C1-C4)-алкил или вместе с атомом углерода, к которому они присоединены, образуют (С3-С8)-карбоциклическое кольцо.
5. Применение по п.4, где R8 представляет (C1-C4)-алкил или R5 и R8 вместе с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо.
6. Применение по любому из пп.1-5, где R2 представляет метил, этил, пропил, 2-пропил, бутил, 2-метилпропил, циклогексил, трифторметил, 2,2,2-трифторэтил, хлорметил, этенил, проп-2-енил, метоксиэтил, фенил, 4-фторфенил или диметиламино.
7. Применение по п.6, где R2 представляет этил, 2-пропил или диметиламино.
8. Применение по любому из пп.1-7, где R1 представляет нафтильную группу или фенильную, фурильную, тиенильную или пиридильную группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными независимо среди галогена; нитро; циано; гидроксиимино; (C1-С10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; гидрокси-(С3-С8)-циклоалкила; оксо-(С3-С8)-циклоалкила; галоген-(C1-С10)-алкила; (CH2)yX1R9, где y равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, пирролидинил, тетрагидрофурил, морфолино или (С3-C8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил, или R9 и R10, R11, R12 или R13, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; N-(C1-C4)-алкилпиперазинила; N-фенил-(C1-C4)-алкилпиперазинила; тиенила; фурила; оксазолила; изоксазолила; пиразолила; имидазолила; тиазолила; пиридила; пиридазинила; пиримидинила; дигидротиенила; дигидрофурила; дигидротиопиранила; дигидропиранила; дигидротиазолила; (C1-C4)-алкоксикарбонилдигидротиазолила; (C1-C4)-алкоксикарбонилдиметилдигидротиазолила; тетрагидротиенила; тетрагидрофурила; тетрагидротиопиранила; тетрагидропиранила; индолила; бензофурила; бензотиенила; бензимидазолила; и группы формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или СН=СН, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена, нитро, циано, гидроксиимино, (C1-С10)-алкила, (С2-С10)-алкенила, (С2-С10)-алкинила, (С3-С8)-циклоалкила, 4-(1,1-диоксотетрагидро-1,2-тиазинила), галоген-(C1-С10)-алкила, циано-(С2-С10)-алкенила, фенила и (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, СН(ОН), СОО, OCO, CONR17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 или HR19COO, R15 представляет водород, (C1-С10)-алкил, фенил-(C1-C4)-алкил, (C1-С10)-галогеналкил, (C1-C4)-алкоксикарбонил-(C1-C4)-алкил, (C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (N-(C1-C4)-алкоксикарбонил)-(C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, (С3-С8)-циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая не замещена или замещена одним или двумя заместителями из числа галогена, (C1-C4)-алкила, галоген-(C1-C4)-алкила, ди-(С1-С4)-алкиламино и (C1-C4)-алкокси, и каждый из R16, R17, R18 и R19 представляет независимо водород или (С1-С10)-алкил, или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединеэы, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу.
9. Применение по любому из пп.1-8, где R1 представляет нафтильную группу или фенильную группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными независимо среди галогена; нитро; циано; (C1-С10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; галоген-(C1-С10)-алкила; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO, OCO, CONR11, NR12CO, OCONR13, R9 представляет водород, (C1-C10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; тиенила; фурила; оксазолила; изоксазолила; пиразолила; имидазолила; тиазолила; пиридила; пиридазинила; пиримидинила; дигидротиенила; дигидрофурила; дигидротиопиранила; дигидропиранила; тетрагидротиенила; тетрагидрофурила; тетрагидротиопиранила; тетрагидропиранила; индолила; бензофурила; бензотиенила; бензимидазолила; и группы формулы R14-(La)n-Х2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, СО, CONH или NHCO, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена, нитро, циано, (C1-С10)-алкила, (С2-С10)-алкенила, (С2-С10)-алкинила, (С3-C8)-циклоалкила, галоген-(C1-С10)-алкила и (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, COO, OCO, CONR17, NR18CO, OCONR19, R15 представляет водород, (C1-C10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R16, R17, R18 и R19 представляет независимо водород или (С1-С10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу.
10. Применение по п.8, где R1 представляет 2-нафтил или группу формулы
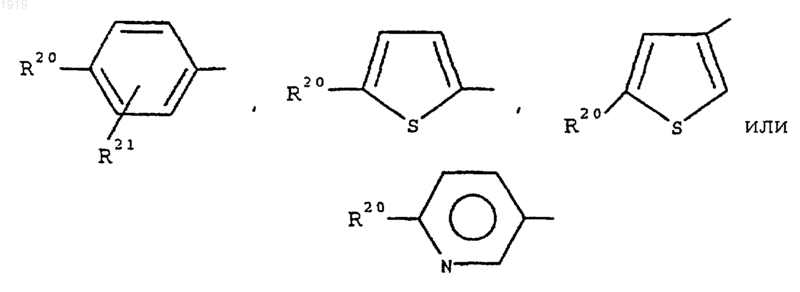
где R20 представляет галоген; нитро; циано; гидроксиимино; (C1-С10)-алкил; (С2-С10)-алкенил; (С2-С10)-алкинил; (С3-С8)-циклоалкил; гидрокси-(С3-С8)-циклоалкил; оксо-(С3-C8)-циклоалкил; галоген-(C1-С10)-алкил; (CH2)yX1R9, где y равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, пирролидинил, тетрагидрофурил, морфолино или (С3-С8)-циклоалкил, и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; N-(С1-С4)-алкилпиперазинил; N-фенил-(C1-C4)-алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (C1-C4)-алкоксикарбонилдигидротиазолил; (C1-C4)-алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SО2, СО, СН(ОН), CONH, NHCO, NHCONH, NHCOO, COCONH, ОСН2СОNН или СН=СН, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена; нитро; циано; гидроксиимино; (C1-С10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген-(C1-С10)-алкила; циано-(С2-С10)-алкенила; фенила; (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, СН(ОН), COO, OCO, CONR17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 представляет водород, (C1-С10)-алкил, фенил-(C1-C4)-алкил, (C1-С10)-галогеналкил, (C1-C4)-алкоксикарбонил-(C1-C4)-алкил, (C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (N-(C1-C4)-алкоксикарбонил)-(C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, (С3-С8)-циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая не замещена или замещена одним или двумя заместителями из числа галогена, (C1-C4)-алкила и (C1-C4)-алкокси, и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С10)-алкил, или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу;
и R21 представляет атом водорода, атом галогена, (C1-C4)-aлкильную группу или (C1-C4)-алкоксигруппу.
11. Применение по п.9, где R1 представляет 2-нафтил или группу формулы
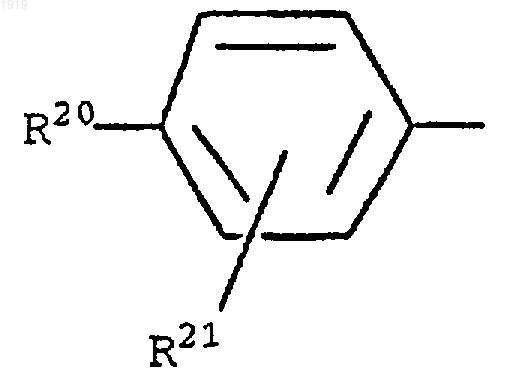
где R20 представляет галоген; нитро; циано; (C1-С10)-алкил; (С2-С10)-алкенил; (С2-С10)-алкинил; (С3-С8)-циклоалкил; галоген-(C1-С10)-алкил; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO, ОСО, CONR11, NR12CO или OCONR13, R9 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, CO, CONH или NHCO, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена; нитро; циано; (C1-С10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-C8)-циклоалкила; галоген-(C1-С10)-алкила; (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, CO, COO, OCO, CONR17, NR18CO, OCONR19, R15 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С18) -циклоалкил и каждый из R16, R17, R18 и R19 представляет независимо водород или (С1-С10)-алкил или R15 и R16, R17, R18 или R19, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; и
R21 представляет атом водорода, атом галогена, (C1-C4)-алкильную группу или (C1-C4)-алкоксигруппу.
12. Применение по п.11, где R1 представляет 2-нафтил, 4-бромфенил, 4-бензамидофенил, 4-метилфенил, 4-изопропилфенил, 4-изобутилфенил, 4-трет-бутилфенил, 4-метоксифенил, 4-изопропоксифенил, 4-циклопентилфенил, 4-циклогексилфенил, 4-(2-гидрокси-метилфенил)фенил, 4-(4-гидроксиметилфенил)фенил, 4-(2-фурил)-фенил, 4-(3-фурил)фенил, 4-(2-тиенил) фенил, 4-(3-тиенил)фенил, 4-(пирролидин-1-ил)фенил, 4-(пиперидин-1-ил)фенил, 3-хлор-4-пиперидин-1-илфенил, 4-бензилоксифенил, 4-(2-фторфенил)фенил, 4-(3-фторфенил)фенил, 4-(2-формилфенил)фенил, 4-(3-формилфенил)-фенил, 4-(4-формилфенил)фенил, 4-(4-метилфенил)фенил или 4-(2-метоксифенил)фенил.
13. Применение соединения формулы
R1-L-NHSO2R2 I,
где R1 представляет незамещенную или замещенную ароматическую или гетероароматическую группу;
R2 представляет (C1-C6)-алкил, (С3-С6)-циклоалкил, (C1-C6)-фторалкил, (C1-C6)-хлоралкил, (С2-С6)-алкенил, (C1-C4)-алкокси-(C1-C4)-алкил, фенил, который является незамещенным или замещен галогеном, (C1-C4)-алкилом или (C1-C4)-алкокси, или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил или вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу; и
L представляет (С2-С4)-алкиленовую цепь, незамещенную или замещенную одним или двумя заместителями, выбранными независимо среди (C1-C6)-алкила, арил-(C1-C6)-алкила, (C2-C6)-алкенила, арил-(С2-С6)-алкенила и арила, или двумя заместителями, которые вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С3-С8)-карбоциклическое кольцо;
или его фармацевтически приемлемой соли, исключая транс-N-метансульфонил-2-(3-циклопентилокси-4-метоксифенил) циклопропиламин, для получения лечебного средства для лечения расстройств познавательной способности; невродегенеративных расстройств, связанных с возрастом деменций; возрастного нарушения памяти; нарушений движений; реверсирования состояний, вызванных лекарственными средствами; депрессии; дефицита внимания; гиперактивного нарушения с дефицитом внимания; психоза; нарушений познавательной способности, связанных с психозом; и психоза, вызванного лекарственными средствами.
14. Применение соединения формулы
R1-L-NHSO2R2 I,
где R1 представляет незамещенную или замещенную ароматическую или гетероароматическую группу;
R2 представляет (C1-C6)-алкил, (С3-С6)-циклоалкил, (C1-C6)-фторалкил, (C1-C6)-хлоралкил, (С2-С6)-алкенил, (C1-C4)-алкокси-(C1-C4)-алкил, фенил, который является незамещенным или замещен галогеном, (C1-C4)-алкилом или (С1-С4)-алкокси, или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил или вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу; и
L представляет (С2-С4)-алкиленовую цепь, незамещенную или замещенную одним или двумя заместителями, выбранными независимо среди (C1-C6)-алкила, арил-(C1-C6)-алкила, (С2-С6)-алкенила, арил-(С2-С6)-алкенила и арила, или двумя заместителями, которые вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С3-C8)-карбоциклическое кольцо;
или его фармацевтически приемлемой соли, исключая транс-N-метансульфонил-2-(3-циклопентилокси-4-метоксифенил) циклопропиламин, для получения лечебного средства для улучшения памяти или способности к обучению.
15. Соединение формулы
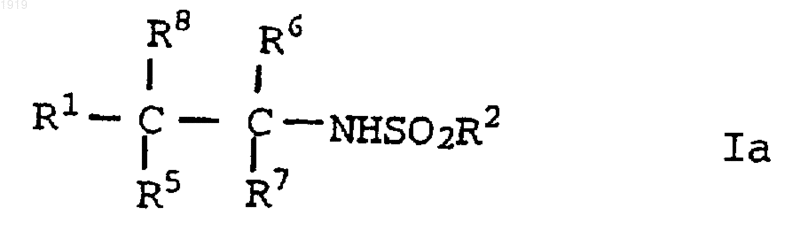
где R1 представляет нафтильную группу или фенильную, фурильную, тиенильную или пиридильную группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными, независимо, среди галогена; нитро; циано; гидроксиимино; (C1-С10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; гидрокси-(С3-С8)-циклоалкила; оксо-(С3-С8)-циклоалкила; галоген-(C1-С10)-алкила; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 представляет водорюф, (С1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, пирролидинил, тетрагидрофурил, морфолино или (С3-C8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил или R9 и R10, R11, R12 или R13, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; N-(C1-C4)-алкилпиперазинила; N-фенил-(C1-C4)-алкилпиперазинила; тиенила; фурила; оксазолила; изоксазолила; пиразолила; имидазолила; тиазолила; пиридила; пиридазинила; пиримидинила; дигидротиенила; дигидрофурила; дигидротиопиранила; дигидропиранила; дигидротиазолила; (C1-C4)-алкоксикарбонилдигидротиазолила; (C1-C4)-алкоксикарбонилдиметилдигидротиазолила; тетрагидротиенила; тетрагидрофурила; тетрагидротиопиранила; тетрагидропиранила; индолила; бензофурила; бензотиенила; бензимидазолила; и группы формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или СН=СН, каждый из L2 и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0 и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена, нитро, циано, гидроксиимино, (C1-С10)-алкила, (С2-С10)-алкенила, (С2-С10)-алкинила, (С3-С8)-циклоалкила, 4-(1,1-диоксотетрагидро-1,2-тиазинила), галоген-(C1-C10)-алкила, циано-(С2-С10)-алкенила, фенила и (СН2)zХ3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 представляет водород, (C1-С10)-алкил, фенил-(C1-C4)-алкил, (C1-С10)-галогеналкил, (C1-C4)-алкоксикарбонил-(C1-C4)-алкил, (C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (N-(C1-C4)-алкоксикарбонил)-(C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, (С3-С8)-циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая не замещена или замещена одним или двумя заместителями из числа галогена, (C1-C4)-алкила и (C1-C4 )-алкокси, и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу;
R2 представляет (C1-C6)-алкил, (С3-С6)-циклоалкил, (C1-C6)-фторалкил, (С1-С6)-хлоралкил, (C2-C6)-алкенил, (C1-C4)-алкокси-(C1-C4)-алкил или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил или вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу; и
любой из R5 и R8 представляет (C1-C6)-алкил или два из R5 и R8 вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С3-С8)-карбоциклическое кольцо; а остальные из числа R5, R6, R7 и R8 представляют водород;
или его фармацевтически приемлемая соль.
16. Соединение по п.15, где
R1 представляет нафтильную группу или фенильную группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными, независимо, среди галогена; нитро; циано; (C1-С10) -алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; галоген-(С1-С10)-алкила; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, СО, СОО, ОСО, CONR11, NR12CO, OCONR13, R9 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-C10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; тиенила; фурила; оксазолила; изоксазолила; пиразолила; имидазолила; тиазолила; пиридила; пиридазинила; пиримидинила; дигидротиенила; дигидрофурила; дигидротиопиранила; дигидропиранила; тетрагидротиенила; тетрагидрофурила; тетрагидротиопиранила; тетрагидропиранила; индолила; бензофурила; бензотиенила; бензимидазолила; и группы формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, СО, CONH или NHCO, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена, нитро, циано, (C1-C10)-алкила, (С2-С10) -алкенила, (С2-С10)-алкинила, (С3-С8)-циклоалкила, галоген-(C1-C10)-алкила и (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, СОО, ОСО, CONR17, NR18CO, OCONR19, R15 представляет водород, (C1-C10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-C10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; и
R2 представляет (C1-С6)-алкил, (C1-C6)-фторалкил, (С2-С6)-алкенил или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил или вместе с атомом азота, к которому они присоединены; образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу.
17. Соединение яю п.15, где R8 представляет метил или этил или R5 и R8 вместе с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо.
18. Соединение по любому из пп.15-17, где R1 представляет 2-нафтил или группу формулы
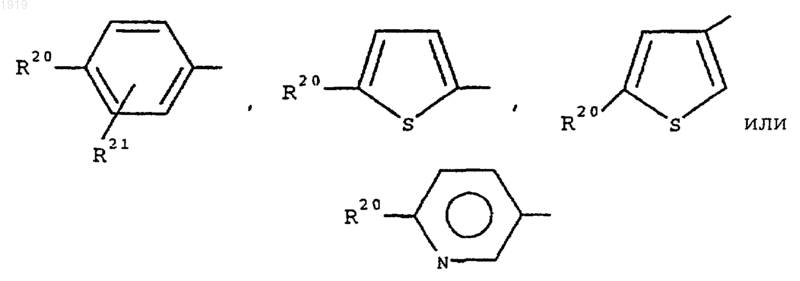
где R20 представляет галоген; нитро; циано; гидроксиимино; (C1-С10)-алкил; (С2-С10)-алкенил; (С2-С10)-алкинил; (С3-С8)-циклоалкил; гидрокси-(С3-С8)-циклоалкил; оксо-(С3-С8)-циклоалкил; галоген-(C1-С10)-алкил; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO, OCONR13, R9 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, пирролидинил, тетрагидрофурил, морфолино или (С3-C8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; N-(C1-C4)-алкилпиперазинил; N-фенил-(C1-C4)-алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (C1-C4)-алкоксикарбонилдигидротиазолил; (C1-C4)-алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2 СО, CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или СН=СН, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена; нитро; циано; гидроксиимино; (C1-C10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген-(C1-C10)-алкила; циано-(С2-С10)-алкенила; фенила; (СН2)zХ3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 представляет водород, (C1-C10)-алкил, фенил-(C1-C4)-алкил, (C1-C10)-галогеналкил, (C1-C4)-алкоксикарбонил-(C1-C4)-алкил, (C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (N-(C1-C4)-алкоксикарбонил)-(C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил, (С3-С8)-циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая не замещена или замещена одним или двумя заместителями из числа галогена, (C1-C4)-алкила или (C1-C4)-алкокси, и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; и
R21 представляет атом водорода, атом галогена, (С1-С4)-алкильную группу или (С1-С4)-алкоксигруппу.
19. Соединение по любому из пп.15-17, где R1 представляет 2-нафтил или группу формулы
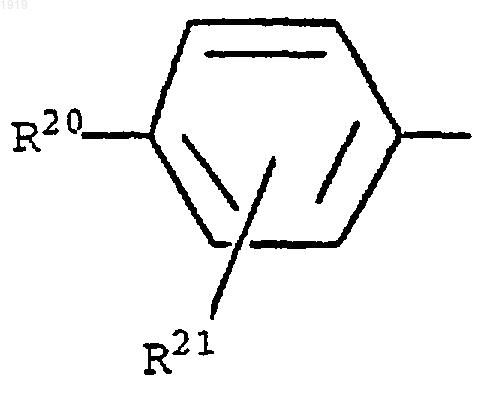
где R20 представляет галоген; нитро; циано; (C1-С10)-алкил; (С2-С10)-алкенил; (С2-С10)-алкинил; (С3-С8)-циклоалкил; галоген-(C1-С10)-алкил; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, СО, СОО, ОСО, CONR11, NR12CO, OCONR13, R9 представляет водород, (C1-C10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-С10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-Х2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, CO, CONH или NHCO, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена; нитро; циано; (C1-C10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; галоген-(C1-C10)-алкила; (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, CO, COO, ОСО, CONR17, NR18CO, OCONR19, R15 представляет водород, (С1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; и
R21 представляет атом водорода, атом галогена, (C1-C4)-алкильную группу или (C1-C4)-алкоксигруппу.
20. Соединение по п.19, где R1 представляет 2-нафтил, 4-бромфенил, 4-бензамидофенил, 4-метилфенил, 4-изопропилфенил, 4-изобутилфенил, 4-трет-бутилфенил, 4-метоксифенил, 4-изопропоксифенил, 4-циклопентилфенил, 4-циклогексилфенил, 4-(4-(гидроксиметил)фенил)фенил, 4-(2-(гидроксиметил)фенил)фенил, 4-(2-фурил)-феншы, 4-(3-фурил)фенил, 4-(2-тиенил)фенил, 4-(3-тиенил)фенил, 4-(пирролидин-1-ил)фенил, 4-(пиперидин-1-ил)фенил, 3-хлор-4-пиперидин-1-илфенил, 4-бензилоксифенил, 4-(2-фторфенил)фенил, 4-(3-фторфенил)фенил, 4-(2-формилфенил)фенил, 4-(3-формилфенил)-фенил, 4-(4-формилфенил)фенил, 4-(4-метилфенил)фенил или 4-(2-метоксифенил)фенил.
21. Соединение по любому из пп.15-20, где R2 представляет метил, этил, пропил, 2-пропил, 2-метилпропил, циклогексил, трифторметил, 2,2,2-трифторэтил, хлорметил, этенил, проп-2-енил, метоксиэтил или диметиламино.
22. Соединение по п.21, где R2 представляет этил, 2-пропил или диметиламино.
23. Соединение по п.15, выбранное из группы
N-2-(4-(3-тиенил)фенилпропил-2-пропансульфонамид;
N-2-(4-(3-тиенил)фенилпропилдиметилсульфамид;
N-2-(4-циклопентилфенил)пропил-2-пропансульфонамид;
N-2-(4-(4-(2-метансульфонамидоэтил)фенил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(5-бром[1,2,4]оксадиазол-3-ил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(5-(2-метил)тетразолил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(4-аминофенил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(3-(5-(2-гидрокси)этил)изоксазолил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(5--(3-бром)изоксазолил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(2-пиридил)фенил)пропил-2-пропансульфонамид;
N-2-(4-(4-(2-(ацетамидо)этил)фенил)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(бензамидо)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(4-этилбензамидо)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(циклобутилкарбоксамидо)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(5-изоксазолилкарбоксамидо)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(6-хлорникотинилкарбамидо)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(пикониоилкарбамидо)фенил)пропил-2-пропансульфонамид;
N-2-(4-N-(бензамидо)фенил)пропил-2-диметилсульфамид;
N-2-(2-тиен-3-ил-5-тиенил)пропил-2-пропансульфонамид;
(+)-N-2R-(4-(3-тиенил)фенил)пропил-2-пропансульфонамид,
и их фармацевтически приемлемые соли.
24. Фармацевтическая композиция, содержащая соединение по любому из п.п.15-23 и фармацевтически приемлемый разбавитель или носитель.
25. Способ получения соединения по любому из пп.15-23, включающий взаимодействие соединения формулы
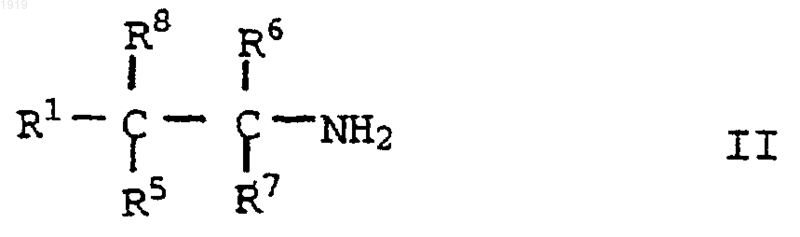
с соединением формулы
R2SO2X III,
где Х представляет отщепляющийся атом или группу с последующим, при необходимости и/или желании, образованием фармацевтически приемлемой соли.
26. Соединение, представляющее собой N-2-(4-(4-(2-метансульфонамидоэтил)фенил)фенил)пропил-2-пропансульфонамид, или его фармацевтически приемлемая соль.
27. Соединение, представляющее собой N-2-(4-(4-(2-метансульфонамидоэтил)фенил)фенил)пропил-2-пропансульфонамид.
28. Соединение формулы
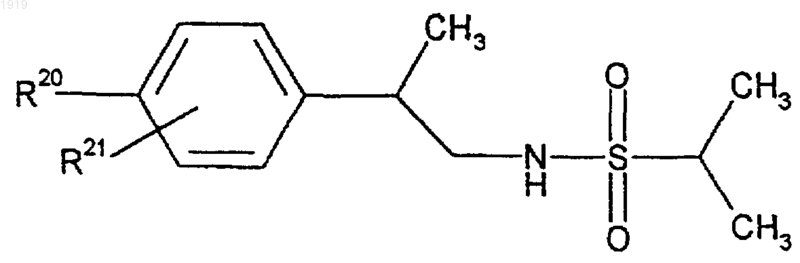
где R20 представляет галоген; нитро; циано; (C1-С10)-алкил; (С2-С10)-алкенил; (С2-С10)-алкинил; (С3-С8)-циклоалкил; галоген-(С1-C10)-алкил; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, ,NR10, СО, СОО, ОСО, CONR11, NR12CO, OCONR13, R9 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил, и каждый из R10, R11, R12 и R13 представляет независимо водород или (C1-C10)-алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-Х2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, CO, CONH или NHCO, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0 и R14 представляет фенильную группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена; нитро; циано; (C1-С10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; галоген-(C1-С10)-алкила; (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, СОО, ОСО, CONR17, NR18CO, OCONR19, R15 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-C8)-циклоалкил и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу; и
R21 представляет атом водорода, атом галогена, (C1-C4)-aлкильную группу или (C1-C4)-алкоксигруппу;
или его фармацевтически приемлемая соль.
29. Соединение по п.28, где R21 представляет водород.
30. Соединение по п.28, где R20 представляет R14-(La)n-X2-(Lb)m.
31. Соединение формулы
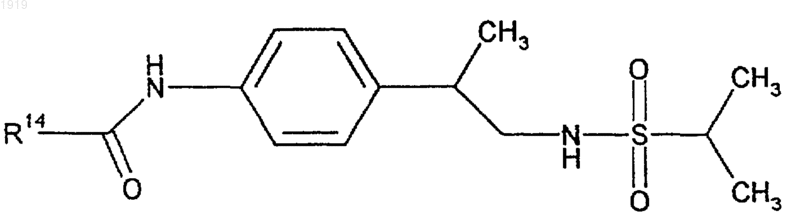
где R14 представляет фенильную группу, которая является незамещенной или замещена одним или двумя заместителями из числа галогена; нитро; циано; (C1-C10)-алкила; (С2-С10)-алкенила; (С2-С10)-алкинила; (С3-С8)-циклоалкила; галоген-(C1-С10)-алкила; (СН2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, СОО, ОСО, CONR17, NR18CO, OCONR19, R15 представляет водород, (C1-С10)-алкил, (С3-С10)-алкенил, (С3-С10)-алкинил или (С3-С8)-циклоалкил и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С10)-алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу;
или его фармацевтически приемлемая соль.
32. Соединение по п.31, где R14 представляет фенил, замещенный одним или двумя атомами галогена.
33. Соединение формулы
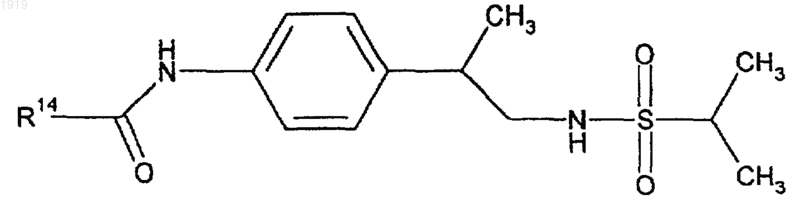
где R14 представляет фенил, замещенный двумя атомами галогена;
или его фармацевтически приемлемая соль.
34. Соединение формулы

где R14 представляет фенил, замещенный двумя атомами галогена.
Текст
1 Настоящее изобретение относится к потенцированию функции глутаматных рецепторов с применением некоторых сульфонамидных производных. Оно также относится к новым сульфонамидным производным, к способу их получения и к фармацевтическим композициям,содержащим их. В центральной нервной системе (ЦНС) млекопитающих передача нервных импульсов управляется посредством взаимодействия между нейротрансмиттером, который выделяется передающим нейроном, и рецептором поверхности на принимающем нейроне, который вызывает возбуждение этого принимающего нейрона. L-глутамат, который является наиболее распространенным нейротрансмиттером в ЦНС,опосредует главный путь возбуждения у млекопитающих и относится к возбудительным аминокислотам (ЕАА). Рецепторы, которые реагируют на глутамат, называются рецепторами возбудительных аминокислот (рецепторами ЕАА). См. WatkinsEvans, Ann. Rev. Pharmacol. Toxicol., 21, 165 (1981); Monghan, Bridges, and Cotman, Ann. Rev. Pharmacol. Toxicol., 29, 365(1989); Watkins, Krogsgaard-Larsen, and Honore,Trans. Pharm. Sci., 11, 25 (1990). Возбудительные аминокислоты имеют важное физиологическое значение, участвуя во многих физиологических процессах, таких как долговременное потенцирование (обучение и память), развитие синаптической пластичности, регуляция моторики, дыхание, сердечно-сосудистая регуляция и сенсорное восприятие. Рецепторы возбудительных аминокислот разделяются на два общих типа. Рецепторы,которые непосредственно связаны с открытием катионных каналов в клеточной мембране нейронов, называются "ионотропными". Этот тип рецепторов подразделяется, по меньшей мере,на три подтипа, которые определяются путем деполяризующего действия селективных агонистов N-метил-D-аспартата (NMDA), альфаамино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (АМРА) и каиновой кислоты(КА). Второй общий тип рецептора представляет G-протеин или вторичный мессенджерсвязанный "метаботропный" рецептор возбудительной аминокислоты. Этот второй тип соединяется со многими вторичными мессенджерсистемами, что приводит к усиленному гидролизу фосфоинозитида, активации фосфолипазыD, увеличивает или снижает образование с-АМР и изменяет функцию ионных каналов. Schoeppand Conn, Trends in Pharmacol. Sci., 14, 13 (1993). Оказывается, что оба типа рецепторов не только опосредуют нормальную синаптическую передачу по путям возбуждения, но также принимают участие в модификации синаптических связей в процессе развития и жизни организма. 2 Рецепторы для АМРА собираются из четырех белковых субъединиц, известных какGluRl-GluR4, в то время как рецепторы каиновой кислоты собираются из субъединиц GluR5GluR7 и КА-1 и КА-2. Wong and Mayer, Molecular Pharmacology 44: 505-510, 1993. Пока неизвестно, каким образом эти субъединицы объединяются в естественном состоянии. Однако выяснены структуры некоторых человеческих вариантов каждой субъединицы, и клеточные линии, экспрессирующие отдельные варианты субъединиц, клонированы и введены в тест-системы, созданные для идентификации соединений, которые связываются или взаимодействуют с ними, и, следовательно, которые могут модулировать их функцию. Так, в заявке на европейский патент, номер публикации ЕРА 2-0574257, описываются человеческие варианты субъединиц GluR1B, GluR2B, GluR3A иGluR3B. В заявке на европейский патент, номер публикации ЕР-А 1-0583917, описывается человеческий вариант субъединицы GluR4B. Одним из характерных свойств рецепторов для АМРА и каиновой кислоты является их быстрая дезактивация и десенсибилизация в отношении глутамата. Yamada and Tang, The Journalof Neuroscience, September 1993, 13(9): 39043915, и Kathryn M. Partin. J. Neuroscience, November 1, 1996, 16(21): 6634-6647. Физиологические объяснения быстрой десенсибилизации и дезактивации, если и существуют, неизвестны. Известно, что быструю десенсибилизацию и дезактивацию рецепторов АМРА и/или каиновой кислоты в отношении глутамата можно ингибировать с использованием некоторых соединений. Такое действие этих соединений часто иначе называют "потенцированием" рецепторов. Одним из таких соединений, которое селективно потенцирует функцию рецептора АМРА,является циклотиазид. Partin et al., Neuron. Vol. 11, 1069-1082, 1993. Соединения, которые потенцируют рецепторы АМРА, подобно циклотиазиду, часто относят к ампакинам. В заявке на международный патент, номер публикации WO 9625926, описывается группа фенилтиоалкилсульфонамидов, S-оксидов и гомологов, которые, как указывается, потенцируют мембранные токи, индуцированные каиновой кислотой и АМРА. В патенте Соединенных Штатов Америки за номером 3143549 описываются некоторые фенилалкилсульфамиды, в том числе, 1-метил 2-фенилэтилдиметилсульфамид. Указывается,что соединения обладают способностью воздействовать на центральную нервную систему, в частности, действием против страха и транквилизирующими свойствами. В патенте Соединенных Штатов Америки за номером 3267139 описываются некоторые N'триметилацетил-N-фенилалкилсульфамиды и-фенилциклопропилсульфамиды, обладающие способностью действовать на центральную 3 нервную систему и противосудорожным действием. Также указывается, что соединения вызывают у подопытных животных симптомы, подобные симптомам при болезни Паркинсона. В патенте Соединенных Штатов Америки за номером 3860723 описывается способ увеличения потребления кормов здоровыми животными с применением некоторых фенилалкилсульфамидов.Foye et al., J. Pharm. Sci. (1971), 60(7),1095-6, описывают некоторые фенилалкилметилсульфонамиды, в том числе, N-1-метил-2 фенилэтилметансульфонамид, обладающие гипотензивным действием. В патенте Великобритании за номером 1059360 описываются некоторые фенилалкилсульфамиды, действующие как седативные средства, наркотические средства и противосудорожные средства, в том числе, 1-(1-метил-2 фенилэтиламиносульфонил)пиперидин. В патенте Соединенных Штатов Америки за номером 4210749 описывается N-1-метил-2 фенил-3-метоксиэтилбутансульфонамид.Gualtieri et al., J. Pharm. Sci., (1973), 62(5),849-851, описывают N-1-метил-2-фенилэтилбутансульфонамид и его оценку в качестве репеллента против комаров.Foye and Sane, J. Pharm. Sci. (1977), 66(7),923-6, описывают N-метансульфонильные и Nтрифторметансульфонильные производные амфетаминов и некоторые их 4-замещенные аналоги, и оценку их действия на центральную нервную систему и при анорексии. В заявке на европейский патент, публикацияЕР-А 1-0657442, описываются некоторые производные нафтилоксиуксусной кислоты как агонисты и антагонисты PEG2. В качестве промежуточного соединения на странице 53, строка 38, описывается N-(2,2-дифенилэтил)метансульфонамид. В патенте Соединенных Штатов Америки за номером 3629332 описываются некоторые Nарил- и N-гетероарилалкилфторалкансульфонамиды как модификаторы роста растений, в том числе,N-(альфа-метилфенилэтил)трифторметансульфонамид, дифторметасульфонамид и фторметансульфонамид. Упоминается также,что некоторые из соединений обладают другим биологическим действием, в том числе, инсектицидным, акарицидным, нематицидным, аналгезирующим и противовоспалительным действием. Во многих испытаниях на животных показано, что ампакины улучшают память. Staubli et 4 Теперь обнаружено, что циклотиазид и некоторые сульфонамидные производные потенцируют агонистиндуцированную возбудимость человеческого рецептора GluR4B, экспрессированного в клетках НЕК 293. Так как известно,что циклотиазид потенцирует функцию глутаматных рецепторов in vivo, предполагается, что это открытие указывает, что сульфонамидные производные также будут потенцировать функцию глутаматных рецепторов in vivo, и, следовательно, что соединения будут демонстрировать поведение, подобное поведению ампакинов. Соответственно, настоящее изобретение относится к способу потенцирования функции глутаматных рецепторов у млекопитающего,нуждающегося в таком лечении, включающему введение эффективного количества соединения формулыR1 представляет незамещенную или замещенную ароматическую или гетероароматическую группу;R2 представляет (C1-C6)-алкил, (С 3-C6)циклоалкил, (C1-С 6)-фторалкил, (C1-С 6)-хлоралкил, (С 2-С 6)-алкенил, (C1-C4)-алкокси-(C1-C4)алкил, фенил, который является незамещенным или замещен галогеном, (C1-C4)-алкилом или(C1-C4)-алкокси, или группу формулы R3R4N,где каждый из R3 и R4 представляет, независимо, (C1-C4)-алкил или, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную, гексагидроазепинильную или октагидроазоцинильную группу; иL представляет (С 2-С 4)-алкиленовую цепь,незамещенную или замещенную одним или двумя заместителями, выбранными, независимо,из (C1-C6)-алкила, арил-(C1-C6)-алкила, (С 2-С 6)алкенила, арил-(С 2-С 6)-алкенила и арила, или двумя заместителями, которые, вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С 3-C8)-карбоциклическое кольцо; или его фармацевтически приемлемые соли. В соответствии с другим аспектом, настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, определение которым дано выше, для изготовления лечебного средства для потенцирования функции глутаматных рецепторов. В соответствии с еще одним аспектом, настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, определение которым дано выше, для потенцирования функции глутаматных рецепторов. 5 В данном описании термин "потенцирование функции глутаматных рецепторов" относится к любой повышенной отвечаемости глутаматных рецепторов, например рецепторов АМРА, на глутамат или агонист, и включает, но не ограничивается этим, ингибирование быстрой десенсибилизации или дезактивации рецепторов АМРА по отношению к глутамату. Множество состояний можно лечить или предупредить с помощью соединений формулыI и его фармацевтически приемлемых солей через их действие в качестве потенциаторов функции глутаматных рецепторов. К таким состояниям относятся состояния, связанные с гипофункцией глутамата, такие как психиатрические и неврологические расстройства, например, расстройство познавательной способности; нейродегенеративные расстройства, такие как болезнь Альцгеймера; связанные с возрастом деменции; возрастные нарушения памяти; нарушения движений, такие как поздняя дискинезия, хорея Гентингтона, миоклония и болезнь Паркинсона; реверсирование состояний, вызванных лекарственными средствами (такими как кокаин, амфетамины, состояния, вызванные алкоголем); депрессия; дефицит внимания; гиперактивное нарушение с дефицитом внимания; психоз; нарушения познавательной способности, связанные с психозом, и психоз, вызванный лекарственными средствами. Соединения формулы I также могут применяться для улучшения памяти (как кратковременного, так и длительного) и способности к обучению. Настоящее изобретение относится к применению соединений формулы I для лечения каждого из этих состояний. Следует иметь в виду, что соединения формулы I могут содержать один или несколько асимметричных атомов углерода и могут, следовательно, существовать и использоваться в форме отдельных энантиомеров. Настоящее изобретение включает в себя отдельные энантиомеры соединений формулы I. Используемый здесь термин "ароматическая группа" означает то же самое, что арил, и включает фенил и полициклическое ароматическое карбоциклическое кольцо, такое как нафтил. Термин "гетероароматическая группа" включает ароматическое 5-6-членное кольцо,содержащее от одного до четырех гетероатомов, выбранных из атомов кислорода, серы и азота, и бициклическую группу, состоящую из 5-6-членного кольца, содержащего от одного до четырех гетероатомов, выбранных из атомов кислорода,серы и азота, сконденсированного с бензольным кольцом или другим 5-6-членным кольцом, содержащим от одного до четырех атомов, выбранных среди атомов кислорода,серы и азота. Примерами гетероароматических групп являются тиенил, фурил, оксазолил, изо 001919 6 ксазолил, оксадиазолил, пиразолил, тиазолил,тиадиазолил, изотиазолил, имидазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидил, бензофурил, бензотиенил, бензимидазолил, бензоксазолил, бензотиазолил, индолил и хинолил. Термин "замещенная", используемый здесь в выражении "замещенная ароматическая или гетероароматическая группа", означает, что могут присутствовать один или несколько (например, один или два) заместителей, причем указанные заместители выбирают из атомов и групп, которые, когда присутствуют в соединении формулы I, не препятствуют соединению формулы I функционировать как потенциатору функции глутаматных рецепторов. Примерами заместителей, которые могут присутствовать в замещенной ароматической или гетероароматической группе, являются галоген; нитро; циано; гидроксиимино; (C1-C10)алкил; (С 2-С 10)-алкенил; (С 2-С 10)-алкинил; (С 3 С 8)-циклоалкил; гидрокси-(С 3-C8)-циклоалкил; оксо-(С 3-C8)-циклоалкил; галоген-(C1-С 10)алкил;(CH2)yXlR9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO, COO,OCO,CONR11,NR12CO,NR12COCOO,13 9N-(C1-C4)-алкилпиперазинил; N-фенил-(C1-C4)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (C1-C4)алкоксикарбонилдигидротиазолил; (C1-C4)-алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группа формулы R14- (La)n-X2- (Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, СО, СН(ОН),CONH, NHCO, NHCONH, NHCOO, COCONH,OCH2CONH или СН=СН, каждый из La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена; нитро; циано; (C1-С 10)алкила; (С 2-С 10)-алкенила; (С 2-С 10)-алкинила; 7 равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, CO, CH(OH), COO, OCO,CONR17,NR18CO,NHSO2,NHSO2NR17,19 19 15OCONR или NR COO, R представляет водород, (C1-С 10)-алкил, фенил-(C1-C4)-алкил, (C1C10)-галогеноалкил, (C1-C4)-алкоксикарбонил(C1-C4)-алкил, (C1-C4)-алкилсульфониламино(C1-C4)-алкил,(N-(C1-C4)-алкоксикарбонил)(C1-C4)-алкилсульфониламино-(C1-C4)-алкил,(С 3-С 10)-алкенил, (С 3-С 10)-алкинил, (С 3-С 8)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая незамещена или замещена одним или двумя заместителями, выбранными из галогена, (C1-C4)ди-(C1-C4)алкила,(C1-C4)-галогеналкила; алкиламино и (C1-C4)-алкокси, и каждый из R16,R17, R18 и R19 представляет, независимо, водород или (C1-С 10)-алкил, или R15 и R16, R17, R18 илиR19, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу. Термин "(C1-С 10)-алкил" представляет собой (C1-C8)-алкил, (C1-С 6)-алкил и (C1-C4)алкил. Особое значение имеют метил, этил,пропил, изопропил, бутил, изобутил, третбутил, пентил, гексил, гептил, октил, нонил и децил. Термин "(С 2-С 10)-алкенил" включает (С 3 С 10)-алкенил, (C1-C8)-алкенил, (C1-С 6)-алкенил и (C1-C4)-алкенил. Особое значение имеют винил и проп-2-енил. Термин "(С 2-С 10)-алкинил" включает (С 3 С 10)-алкинил, (C1-C8)-алкинил, (C1-C6)-алкинил и (С 3-С 4)-алкинил. Особое значение имеет проп 2-инил. Термин "(С 3-С 8)-циклоалкил" как таковой или в термине "(С 3-С 8)-циклоалкилокси" включает моноциклические и полициклические группы. Особое значение имеют циклопропил,циклобутил, циклопентил, циклогексил и бицикло[2.2.2]октан. Термин включает (С 3-С 6)циклоалкил: циклопропил, циклобутил, циклопентил и циклогексил. Термин"гидрокси-(С 3-С 8)-циклоалкил" включает гидроксициклопентил, например, 3 гидроксициклопентил. Термин "оксо-(С 3-C8)-циклоалкил" включает оксоциклопентил,например,3 оксоциклопентил. Термин "галоген" включает фтор, хлор,бром и йод. Термин "галоген-(C1-С 10)-алкил" включает фтор-(C1-С 10)-алкил, такой как трифторметил и 2,2,2-трифторэтил, и хлор-(C1-C10)-алкил, например, хлорметил. Термин "циано-(С 2-С 10)-алкенил" включает 2-цианоэтенил. 8 Термин "(С 2-С 4)-алкилен" включает этилен, пропилен и бутилен. Предпочтительное значение имеет этилен. Термин "тиенил" включает тиен-2-ил и тиен-3-ил. Термин "фурил" включает фур-2-ил и фур 3-ил. Термин "оксазолил" включает оксазол-2 ил, оксазол-4-ил и оксазол-5-ил. Термин "изоксазолил" включает изоксазол 3-ил, изоксазол-4-ил и изоксазол-5-ил. Термин "оксадиазолил" включает [1,2,4] оксадиазол-3-ил и [1,2,4]оксадиазол-5-ил. Термин "пиразолил" включает пиразол-3 ил, пиразол-4-ил и пиразол-5-ил. Термин "тиазолил" включает тиазол-2-ил,тиазол-4-ил и тиазол-5-ил. Термин "тиадиазолил" включает [1,2,4] тиадиазол-3-ил и [1,2,4]тиадиазол-5-ил. Термин "изотиазолил" включает изотиазол-3-ил, изотиазол-4-ил и изотиазол-5-ил. Термин "имидазолил" включает имидазол 2-ил, имидазол-4-ил и имидазол-5-ил. Термин "триазолил" включает [1,2,4] триазол-3-ил и [1,2,4]-триазол-5-ил. Термин "тетразолил" включает тетразол-5 ил. Термин "пиридил" включает пирид-2-ил,пирид-3-ил и пирид-4-ил. Термин "пиридазинил" включает пиридазин-3-ил, пиридазин-4-ил, пиридазин-5-ил и пиридазин-6-ил. Термин "пиримидинил" включает пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил и пиримидин-6-ил. Термин "бензофурил" включает бензофур 2-ил и бензофур-3-ил. Термин "бензотиенил" включает бензотиен-2-ил и бензотиен-3-ил. Термин "бензимидазолил" включает бензимидазол-2-ил. Термин "бензоксазолил" включает бензоксазол-2-ил. Термин "бензотиазолил" включает бензотиазол-2-ил. Термин "индолил" включает индол-2-ил и индол-3-ил. Термин "хинолил" включает хинол-2-ил. Термин "дигидротиазолил" включает 4,5 дигидротиазол-2-ил и термин "(C1-C4)-алкоксикарбонилдигидротиазолил" включает 4-метоксикарбонил-4,5-дигидротиазол-2-ил. В соединениях формулы I L представляет,предпочтительно, группу формулы где два заместителя из группы R5, R6, R7 и R8 представляют водород, а остальные представляют, независимо, водород, (C1-С 6)-алкил, арил(C1-С 6)-алкил, (С 2-С 6)-алкенил, арил-(C2-C6) 9 алкенил или арил, или, вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С 3-С 8)-карбоциклическое кольцо. Предпочтительно, любой один или любые два заместителя из группы R5, R6, R7 и R8 представляют (C1-C6)-алкил, арил-(C1-С 6)-алкил,(С 2-С 6)-алкенил, арил-(С 2-С 6)-алкенил или арил,или два заместителя из группы R5, R6, R7 и R8,вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С 3C8)-карбоциклическое кольцо; и остальные из(С 2-С 6)-алкенильной группы является проп-2 енил. Примером (С 3-С 8)-карбоциклического кольца является циклопропильное кольцо. Предпочтительнее R6 и R7 представляют водород. Предпочтительно каждый из R5 и R8 представляет независимо водород или (C1-С 4)-алкил,или вместе с атомом углерода, к которому они присоединены, образуют (С 3-С 8)-карбоциклическое кольцо. Предпочтительнее R8 представляет метил или этил, или R5 и R8 вместе с атомом углерода,к которому они присоединены, образуют циклопропильное кольцо. Когда R8 представляет метил или этил, R5 предпочтительно представляет водород или метил. Особенно предпочтительными являются соединения, в которых R8 представляет метил, aR5, R6 и R7 представляют водород. Предпочтительно каждый из R3 и R4 представляет метил. Примерами значений R2 являются метил,этил, пропил, 2-пропил, бутил, 2-метилпропил,циклогексил, трифторметил, 2,2,2-трифторэтил,хлорметил, этенил, проп-2-енил, метоксиэтил,фенил, 4-фторфенил или диметиламино. Предпочтительно R2 представляет этил, 2-пропил или диметиламино. Примерами значений R9 являются водород,метил, этил, пропил, изопропил, трет-бутил,этенил, циклопропил, циклобутил, циклопентил,циклогексил, 2-пирролидинил, морфолино или 2-тетрагидрофурил. Примерами значений R15 являются водород, метил, этил, пропил, изопропил, бутил,трет-бутил, бензил, 2,2,2-трифторэтил, 2 метоксикарбонилэтил, циклогексил, 10-камфорил, фенил, 2-фторфенил, 3-фторфенил, 2 трифторметилфенил, 4-трифторметилфенил, 2 метоксифенил, 3-метоксифенил, 4-метоксифенил, 1-(5-диметиламино)нафтил и 2-тиенил.R9 представляет предпочтительно (C1-C4)алкил, (С 2-С 4)-алкенил, (С 3-С 6)-циклоалкил,пирролидинил, морфолино или тетрагидрофурил. Особыми значениями групп (CH2)yX1R9 и(CH2)zX3R15 являются (C1-C10)-алкокси, в том числе (С 1-С 6)-алкокси и (С 1-С 4)-алкокси, такие как метокси, этокси, пропокси, изопропокси и изобутокси; (С 3-С 10)-алкенилокси, в том числе,(С 3-С 6)-алкенилокси, такая как проп-2-енилокси; (С 3-С 10)-алкинилокси, в том числе (С 3-С 6)алкинилокси, такая как проп-2-инилокси; и (C1C6)-алканоил, такой как формил и этаноил. Примерами особых значений у являются 0 и 1. Примерами особых значений z являются 0,1, 2 и 3. Каждый из La и Lb представляет независимо предпочтительно СН 2.NHCOR9, где R9 представляет метил, этил, изопропил, трет-бутил, этенил, циклопропил, циклобутил, циклопентил, циклогексил, 2-пирролидинил или морфолино; CONHR9, где R9 представляет циклопропил или циклопентил; NНСОСООСН 3; или 2-тетрагидрофурилметокси. Предпочтительно, группа (CH2)zX3R15 представляет NH2; CH2NH2; (CH2)2NH2;R15 СН 2 СН(СН 3)2,фенил,3-фторфенил,4 фторфенил,бензил,2-метоксифенил,4 метоксифенил, 2-тиенил, СН=СН, CH=CHCN,ОСН 3 или O(СН 2)3 СН 3. Примерами особых значений (La)n-X2bR14 представляет, предпочтительно, незамещенную или замещенную фенильную, нафтильную, фурильную, тиенильную, изоксазо 11 лильную, тиазолильную, тетразолильную, пиридильную, пиримидильную, бензотиенильную или бензотиазолильную группу. Примерами предпочтительных значений 12 до)этил)фенил,4-(2-(3-фторбензамидо)этил) фенил, 4-(2-(4-метоксибензамидо)этил)фенил, 4(2-(2-метоксибензамидо)этил)фенил, 4-(1-(2-(2 метоксикарбонилэтансульфониламино)этил) фенил,4-(1-(2-(10-камфорсульфониламино) этил)фенил,4-(1-(2-бензилсульфониламино) этил)фенил, 4-(2-фенилацетамидо)этил)фенил,4-метансульфониламиноэтаноилфенил,4-(Nтрет-бутоксикарбонил)метансульфониламиноэтаноил)фенил,4-(2-(2-тиенилкарбоксамидо) этил)фенил, тиен-2-ил, 5-гидроксиметилтиен-2 ил, 5-формилтиен-2-ил, тиен-3-ил, 5-гидроксиметилтиен-3-ил, 5-формилтиен-3-ил, 2-бромтиен-3-ил, фур-2-ил, 5-нитрофур-2-ил, фур-3-ил,изоксазол-5-ил, 3-бромизоксазол-5-ил, изоксазол-3-ил, 5-триметилсилилизоксазол-3-ил, 5 метилизоксазол-3-ил, 5-гидроксиметилизоксазол-3-ил, 5-метил-3-фенилизоксазол-4-ил, 5-(2 гидроксиэтил)изоксазол-3-ил, 5-ацетилизоксазол-3-ил,5-карбоксиизоксазол-3-ил,5-Nметилкарбамоилизоксазол-3-ил, 5-метоксикарбонилизоксазол-3-ил, 3-бром-[1,2,4]оксадиазол 5-ил, пиразол-1-ил, тиазол-2-ил, 4-гидроксиметилтиазол-2-ил, 4-метоксикарбонилтиазол-2 ил, 4-карбокситиазол-2-ил, имидазол-1-ил, 2 сульфгидрилимидазол-1-ил, [1,2,4]-триазол-1 ил, тетразол-5-ил, 2-метилтетразол-5-ил, 2 этилтетразол-5-ил, 2-изопропилтетразол-5-ил, 2(2-пропенил)тетразол-5-ил, 2-бензилтетразол-5 ил, пирид-2-ил, 5-этоксикарбонилпирид-2-ил,пирид-3-ил, 6-хлорпирид-3-ил, пирид-4-ил, 5 трифторметилпирид-2-ил, 6-хлорпиразин-3-ил,6-метил-пиридазин-3-ил, 6-метоксипиридазин 3-ил, пиримидин-5-ил, бензотиен-2-ил, бензотиазол-2-ил и хинол-2-ил. Примерами незамещенной или замещенной ароматической или гетероароматической группы, представленной R1, являются незамещенный или замещенный фенил, фурил, тиенил(такой как 3-тиенил) и пиридил (такой как 3 пиридил). Предпочтительно R1 представляет нафтильную группу или фенильную, фурильную,тиенильную или пиридильную группу, незамещенную или замещенную одним или двумя заместителями, выбранными независимо из галогена; нитро; циано; гидроксиимино; (C1-С 10)алкила; (С 2-С 10) -алкенила; (С 2-С 10)-алкинила;(C3-C8)-циклоалкила; гидрокси-(С 3-C8)-циклоалкила; оксо-(С 3-C8)-циклоалкила; галоген-(C1 С 10)-алкила; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S,NR10, CO, COO, OCO, CONR11, NR12CO,NR12COCOO, OCONR13, R9 представляет водород, (C1-С 10)-алкил, (С 3-С 10)-алкенил, (С 3-С 10)алкинил,пирролидинил,тетрагидрофурил,морфолино или (С 3-С 8)-циклоалкил, и каждый из R10, R11, R12 и R13 представляет независимо водород или (С 1-С 10)-алкил, или R9 и R10, R11,R12 или R13, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, 13 пирролидинильную, пиперидинильную или морфолиногруппу;La и Lb представляет (C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, нитро, циано, гидроксиимино, (C1-С 10)-алкила, (С 2-С 10)-алкенила,(С 2-С 10)-алкинила, (С 3-С 8)-циклоалкила, 4-(1,1 диоксотетрагидро-1,2-тиазинила), галоген-(C1 С 10)-алкила, циано-(С 2-С 10)-алкенила, фенила и(СН 2)zХ 3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, CO, CH(OH),COO, OCO, CONR17, NR18CO, NHSO2,NHSO2NR17,NHCONH,OCONR19 или 19 15NR COO, R представляет водород, (C1-С 10)(С 1-С 10)алкил,фенил-(C1-C4)-алкил,галогеналкил, (C1-C4)-алкоксикарбонил-(C1-C4)алкил, (C1-C4)-алкилсульфониламино-(C1-C4)алкил,(N-(C1-C4)-алкоксикарбонил)-(C1-C4)алкилсульфониламино-(C1-C4)-алкил, (С 3-С 10)алкенил, (С 3-С 10)-алкинил, (С 3-С 8)-циклоалкил,камфорил или ароматическую или гетероароматическую группу, которая незамещена или замещена одним или двумя заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)галогеналкила, ди-(C1-C4)-алкиламино и (C1C4)-алкокси, и каждый из R16, R17, R18 и R19 представляет, независимо, водород или (C1 С 10)-алкил, или R15 и R16, R17, R18 или R19, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную или морфолиногруппу. Предпочтительнее R1 представляет 2 нафтил или группу формулы(C1-С 10)-алкил; (С 2-С 10)-алкенил; (С 2-С 10)алкинил; (С 3-C8)-циклоалкил; гидрокси- (С 3 С 8)-циклоалкил; оксо-(С 3-С 8)-циклоалкил; галоген-(C1-С 10)-алкил; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О,S, NR10, CO, COO, OCO, CONR11, NR12CO,NR12COCOO, OCONR13, R9 представляет водород, (C1-С 10)-алкил, (С 3-С 10)-алкенил, (С 3-С 10)алкинил,пирролидинил,тетрагидрофурил,морфолино или (С 3-С 8)-циклоалкил, и каждый из R10, R11, R12 и R13 представляет, независимо,водород или (C1-С 10)-алкил, или R9 и R10, R11,R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинильную,пирролидинильную, пиперидинильную или морфолиногруппу;(C1-C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена; нитро; циано; (C1-С 10)-алкила; (С 2-С 10)-алкенила; (С 2-С 10)-алкинила; (С 3-С 8)-циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген-(C1-C10)-алкила; циано-(С 2-С 10)-алкенила; фенила; (CH2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО,СН(ОН), COO, ОСО, CONR17, NR18CO, NHSO2,NHCONH,OCONR19 илиNR COO, R представляет водород, (C1-С 10)алкил, фенил-(C1-C4)-алкил, (C1-С 10)-галогеналкил, (C1-C4)-алкоксикарбонил- (C1-C4)-алкил,(C1-C4)-алкилсульфониламино-(C1-C4)-алкил,(N-(C1-C4)-алкоксикарбонил)-(C1-C4)-алкилсульфониламино-(C1-C4)-алкил, (С 3-С 10)-алкенил, (С 3-С 10)-алкинил, (С 3-C8)-циклоалкил,камфорил или ароматическую или гетероароматическую группу, которая незамещена или замещена одним или двумя заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)галогеналкила, ди-(C1-C4)-алкиламино и (C1C4)-алкокси, и каждый из R16, R17, R18 и R19 представляет, независимо, водород или (C1 С 10)-алкил, или R15 и R16, R17, R18 или R19, вместеR21 представляет атом водорода, атом галогена, (C1-C4)-алкильную группу или (C1-C4)алкоксигруппу. Примерами особых значений R20 являются фтор, хлор, бром, циано, гидроксиимино, метил,этил, пропил, 2-пропил, бутил, 2-метилпропил,1,1-диметилэтил, циклопентил, циклогексил, 3 гидроксициклопентил, 3-оксоциклопентил, метокси, этокси, пропокси, 2-пропокси, ацетил,ацетиламино, этилкарбоксамидо, пропилкарбоксамидо, 1-бутаноиламидо, трет-бутилкарбоксамидо, акрилоиламидо, 2-пирролидинилкарбоксамидо,2-тетрагидрофурилметокси,морфолинокарбоксамидо, метилоксалиламидо,циклопропилкарбоксамидо, циклобутилкарбоксамидо, циклопентилкарбоксамидо, циклогексилкарбоксамидо, циклопропилкарбамоил, циклопентилкарбамоил, пирролидин-1-ил, морфолино, пиперидин-1-ил, N-метилпиперазинил, Nбензилпиперазинил, 2-тиенил, 3-тиенил, 2 фурил, 3-фурил, изоксазол-3-ил, тиазол-2-ил,тетразол-5-ил, пирид-2-ил, пирид-3-ил, пирид-4 ил, пиримидин-5-ил, 4,5-дигидротиазол-2-ил,4,5-дигидро-4-метоксикарбонилтиазол-2-ил, 4,5 дигидро-4-метоксикарбонил-5,5-диметилтиазол 2-ил, бензотиен-2-ил, бензотиазол-2-ил, фенил,2-фторфенил, 3-фторфенил, 2,3-дифторфенил, 4 хлорфенил, 3,4-дихлорфенил, 3,5-дихлорфенил,3-нитрофенил, 4-цианофенил, 2-метилфенил, 4 метилфенил,4-(4-(1,1,-диоксотетрагидро-1,2 тиазинил)фенил,3-трифторметилфенил,4 трифторметилфенил, 4-(2-цианоэтил)фенил, 2 формилфенил, 3-формилфенил, 4-формилфенил,3-ацетилфенил, 4-ацетилфенил, 4-карбоксифенил, 2-метоксифенил, 4-метоксифенил, 2 гидроксиметилфенил, 4-гидроксиметилфенил,3-(1-гидроксиэтил)фенил,4-(1-гидроксиэтил) фенил, 4-(1-гидроксипропил)фенил, 2-аминофенил, 4-аминофенил, 4-N,N-диэтиламинофенил,4-аминометилфенил, 4-(2-аминоэтил)фенил, 4(3-аминопропил)фенил, 4-(2-ацетиламиноэтил) фенил, 4-(трет-бутоксикарбоксиламиноэтил)фенил,4-(2-трет-бутоксикарбоксиламиноэтил) фенил), бензилсульфониламино, 4-изопропилсульфониламинофенил,4-(2-метансульфониламиноэтил)фенил, 4-(2-этилсульфониламиноэтил)фенил,4-(2-пропилсульфониламиноэтил)фенил,4-(2-бутилсульфониламиноэтил) фенил,4-(2-изопропилсульфониламиноэтил) фенил),4-(1-гидрокси-2-метансульфониламиноэтил)фенил),4-(2-диметиламиносульфониламиноэтил)фенил, 4-(1-(2-(2-пропил)сульфониламинопропил)фенил),4-(2-(2,2,-2 трифторэтил)сульфониламиноэтил)фенил, 4-(2 циклогексилсульфониламиноэтил)фенил, 4-(2 фенилсульфониламиноэтил)фенил,4-(2-(2 фторфенил)сульфониламиноэтил)фенил, 4-(2(4-фторфенил)сульфониламиноэтил)фенил, 4 001919(2-(2-трифторметилфенил)сульфониламиноэтил)фенил, 4-(2-(4-трифторметилфенил)сульфониламиноэтил)фенил, 4-(2-(4-метоксифенил) сульфониламиноэтил)фенил,4-(2-(1-(5-диметиламино)нафталинсульфониламино)этил)фенил, 4-(2-(2-тиенил)сульфониламино)этил)фенил, 4-(2-бензамидоэтил)фенил, 4-(2-(4-фторбензамидо)этил)фенил,4-(2-(3-метоксибензамидо)этил)фенил, 4-(2-(3-фторбензамидо)этил) фенил, 4-(2-(4-метоксибензамидо)этил)фенил, 4(2-(2-метоксибензамидо)этил)фенил,4-(2-(2 тиенилкарбоксамидо)этил)фенил, 4-карбамоилфенил, 4-метилкарбамоилфенил, 4-диметилкарбамоилфенил,4-(2-(2-метилпропанамидо) этил)фенил, 4-(2-(3-метилбутанамидо)этил)фенил, бензоилметил, бензамидо, 2-фторбензамидо, 3-фторбензамидо, 4-фторбензамидо, 2,4 дифторбензамидо, 3-хлорбензамидо, 4-хлорбензамидо, 4-бромбензамидо, 4-йодбензамидо,4-цианобензамидо,3-метилбензамидо,4 метилбензамидо,4-этилбензамидо,4 пропилбензамидо, 4-трет-бутилбензамидо, 4 винилбензамидо, 2-трифторметилбензамидо, 3 трифторметилбензамидо, 4-трифторметилбензамидо, 2-фтор-4-трифторметилбензамидо, 2 метоксибензамидо, 3-метоксибензамидо, 4 метоксибензамидо, 4-бутоксибензамидо, 4 фенилфенилкарбоксамидо, 4-бензилкарбоксамидо,4-феноксиметилкарбоксамидо,2 фторбензиламино, бензилокси, 2-фторбензилокси, 2-гидрокси-2-фенилэтил, 2-фторфенилкарбамоил,4-(1-(2-(2-метоксикарбонилэтансульфониламино)этил)фенил), 4-(1-(2-(10-камфорсульфониламино)этил)фенил), 4-(1-(2-(бензилсульфониламино)этил)фенил), 4-(2-фенилацетамидо)этил)фенил,4-(метансульфониламиноэтаноил)фенил, 4-(N-трет-бутоксикарбонил)метансульфониламиноэтаноил)фенил,2 тиенилкарбоксамидо, 2-фурилкарбоксамидо, 3(5-метилизоксазолил) карбоксамидо, 5-изоксазолилкарбоксамидо, 2-бензотиенилкарбоксамидо, 4-(5-метил-3-фенилизоксазолил)карбоксамидо,4-пиридилкарбоксамидо,2-(5-нитрофурил)карбоксамидо,2-пиридилкарбоксамидо,6-хлор-2-пиридилкарбоксамидо,2 тиенилсульфонамидо, 2-тиенилметиламино, 3 тиенилметиламино, 2-фурилметиламино, 3 фурилметиламино, 3-ацетилуреидо и 2-(2 тиенил)этилуреидо. Примерами особых значений R21 являются водород и хлор. Предпочтительно R21 находится в орто-положении к R20. Примерами особых значений R1 являются 2-нафтил, 4-бромфенил, 4-цианофенил, 4 бензамидофенил, 4-метилфенил, 4-изопропилфенил, 4-изобутилфенил, 4-трет-бутилфенил, 4 метоксифенил, 4-изопропоксифенил, 4-циклопентилфенил,4-циклогексилфенил,4-(2 гидроксиметилфенил)фенил, 4-(4-гидроксиметилфенил)фенил, 4-(2-фурил)фенил, 4-(3-фурил) фенил, 4-(2-тиенил)фенил, 4-(3-тиенил)фенил, 17 4-(пирролидин-1-ил)фенил, 4-(пиперидин-1-ил) фенил,3-хлор-4-пиперидин-1-илфенил,4 бензилоксифенил, 4-(2-фторфенил)фенил, 4-(3 фторфенил)фенил, 4-(2-формилфенил)фенил, 4(3-формилфенил)фенил,4-(4-формилфенил) фенил,4-(4-метилфенил)фенил и 4-(2 метоксифенил)фенил. Предполагается, что некоторые соединения формулы I являются новыми соединениями и представляют дополнительный аспект изобретения. Эти соединения можно представить формулойR1 представляет нафтильную группу или фенильную, фурильную, тиенильную или пиридильную группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными, независимо из галогена; нитро; циано; гидроксиимино; (C1-С 10)-алкила;(С 2-С 10)-алкенила; (С 2-С 10)-алкинила; (С 3-С 8)циклоалкила; гидрокси-(С 3-С 8)-циклоалкила; галоген-(C1-C10)оксо-(С 3-С 8)-циклоалкила; алкила; (CH2)yX1R9, где у равен 0 или целому числу от 1 до 4, X1 представляет О, S, NR10, CO,COO, OCO, CONR11, NR12CO, NR12 СОСОО,OCONR13, R9 представляет водород, (C1-С 10)алкил, (С 3-С 10)-алкенил, (С 3-С 10)-алкинил, пирролидинил, тетрагидрофурил, морфолино или(C1-C4)-алкоксикарбонилдигидротиазолила; (C1-C4)-алкоксикарбонилдиметилдигидротиазолила; тетрагидротиенила; тетрагидрофурила; тетрагидротиопиранила; тетрагидропиранила; индолила; бензофурила; бензотиенила; бензимидазолила; и группы формулы R14-(La)nX2-(Lb)m, где X2 представляет связь, О, NH, S,SO, SO2, CO, CH(OH), CONH, NHCO,NHCONH, NHCOO, COCONH, OCH2CONH или СН=СН, каждый из La и Lb представляет (C1C4)-алкилен, один из n и m равен 0 или 1, а другой равен 0, и R14 представляет фенильную или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, нитро,циано, (C1-С 10)-алкила, (С 2-С 10)-алкенила, (С 2 001919(СН 2)zX3R15, где z равен 0 или целому числу от 1 до 4, X3 представляет О, S, NR16, СО, СН(ОН),COO, OCO, CONR17, NR18CO, NHSO2,NHCONH,OCONR19 илиNR COO, R представляет водород, (C1-С 10)алкил,фенил-(C1-C4)-алкил,(C1-С 10)галогеналкил, (C1-C4)-алкоксикарбонил-(C1-C4)алкил, (C1-C4)-алкилсульфониламино-(C1-C4)алкил,(N-(C1-C4)-алкоксикарбонил)-(C1-C4)алкилсульфониламино-(C1-C4)-алкил, (С 3-С 10)алкенил, (С 3-С 10)-алкинил, (С 3-С 8)-циклоалкил,камфорил или ароматическую или гетероароматическую группу, которая незамещена или замещена одним или двумя заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)галогеналкила, ди-(C1-C4)-алкиламино и (C1C4)-алкокси, и каждый из R16, R17, R18 и R19 представляет независимо водород или (C1-С 10)алкил, или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены,образуют азетидинильную, пирролидинильную,пиперидинильную или морфолиногруппу.R2 представляет (C1-C6)-алкил, (С 3-С 6)(C1-С 6)циклоалкил,(C1-C6)-фторалкил,хлоралкил, (С 2-С 6)-алкенил, (C1-C4)-алкокси(C1-C4)-алкил, фенил, который является незамещенным или замещен галогеном, (C1-C4 )алкилом или (C1-C4)-алкокси, или группу формулы R3R4N, где каждый из R3 и R4 представляет независимо (C1-C4)-алкил, или вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперидинильную,морфолино- или пиперазинильную группу; и каждый из R5, R6, R7 и R8 представляет (C1C6)-алкил; арил-(C1-С 6)-алкил; (С 2-С 6)-алкенил; арил-(С 2-С 6)-алкенил или арил, или два из R5, R6, R7 и R8 вместе с атомом углерода или атомами углерода, к которым они присоединены, образуют (С 3-С 8)-карбоциклическое кольцо; а остальные из числа R5, R6, R7 и R8 представляют водород; или это будет фармацевтически приемлемая соль такого соединения, за исключением N-(2,2-дифенилэтил)метансульфонамида и тех соединений формулы I,в которых R7 представляет метил; R5, R6 и R8 представляют водород; и(в) R1 представляет 4-нитрофенил; а R2 представляет трифторметил. Соединения формулы I можно получить путем взаимодействия соединения формулыIII где Х представляет отщепляющийся атом или группу, с последующим, при необходимости и/или желании, образованием фармацевтически приемлемой соли. Отщепляющийся атом или группа, представленные X, могут представлять, например,атом галогена, такой как атом хлора или брома. Взаимодействие подходящим образом осуществляется в присутствии основания, например гидроксида щелочного металла, такого как гидроксид натрия, карбоната щелочного металла, такого как карбонат калия, третичного амина, такого как триэтиламин или 1,8 диазабицикло[5.4.0]ундец-7-ен. Подходящими растворителями являются галогенсодержащие углеводороды, такие как дихлорметан. Взаимодействие подходящим образом осуществляется при температуре в интервале от-20 до 100 С, предпочтительно - от -5 до 50 С. Соединения формулы I, в которых R1 представляет 4-бромфенильную группу, можно удобно превратить в другие соединения формулы I, в которых R1 представляет другую 4 замещенную фенильную группу, посредством взаимодействия с производным соответствующей бороновой кислоты, например, производным бензолбороновой кислоты. Взаимодействие обычно осуществляется в присутствии тетракис(триарилфосфин)палладиевого(0) катализатора, такого как тетракис(трифенилфосфин) палладий (0), и основания, такого как карбонат калия. Подходящими растворителями для реакции являются ароматические углеводороды,такие как толуол. Подходящей температурой,при которой проводится взаимодействие, является температура в интервале от 0 до 150 С,предпочтительно от 75 до 120 С. Бисароматические промежуточные соединения,полезные при получении соединений формулыI, можно получить аналогичным образом посредством взаимодействия бромароматического или бромгетероароматического соединения с ароматической или гетероароматической бороновой кислотой. Производное бороновой кислоты, используемое в качестве исходного вещества, можно получить в результате взаимодействия при пониженной температуре триалкилбората, такого как триизопропилборат, с соответствующим литийорганическим соединением. Например, 2 фторбензолбороновую кислоту можно получить путем взаимодействия 2-фторбромбензола с бутиллитием в тетрагидрофуране примерно при-78 С, с образованием 2-фторфениллития, и последующего взаимодействия этого литийорганического соединения с триизопропилборатом. С другой стороны, соединения формулы I,где R1 представляет 4-бромфенильную группу, 001919 20 можно превратить в соединения с 4-(триметилстаннил)фенильной или 4-(трет-н-бутилстаннил)фенильной группой посредством обработки соответствующего бромида катализатором на основе палладия (0), таким как тетракис(трифенилфосфин) палладий (0), и гексаалкилдистаннатом, где алкильная группа представляет метил или н-бутил, в апротонном растворителе, таком как толуол, в присутствии основания - третичного амина, такого как триэтиламин, при температурах в интервале от 80 до 140 С, предпочтительно - от 90 до 110 С. Соединения формулы I, где R1 представляет 4-(три-н-бутилстаннил)фенильную группу,затем можно ввести во взаимодействие с арилили гетероарилбромидом, таким как 2 бромтиофен-5-карбоксальдегид, в присутствии катализатора на основе палладия (0), такого как тетракис(трифенилфосфин)палладий (0), или катализатора на основе палладия (II), такого как дихлорид бис(трифенилфосфин)палладия (II), в апротонном растворителе, таком как диоксан,при температурах в интервале от 80 до 140 С,предпочтительно от 90 до 110 С, с образованием соответствующего 4-(арил)фенилзамещенного или 4-(гетероарил)фенилзамещенного соединения. Соединения формулы I, где R1 представляет 4-бромфенильную группу, можно превратить в другие соединения формулы I, где R1 представляет 4-замещенную алкил- или циклоалкилфенильную группу, такую как 4-циклопентилфенил, посредством обработки соответствующего бромида подходящим алкил- или циклоалкилсодержащим реактивом Гриньяра, таким как циклопентилмагнийбромид, в присутствии катализатора на основе палладия(II), такого как [1,1'-бис(дифенилфосфино)ферроцен] дихлорпалладий(II) (PdCl2 (dppf, в апротонном растворителе, таком как диэтиловый эфир, при температурах в интервале от -78 до 25 С. Соединения формулы I, где R1 представляет 4-бромфенильную группу, можно превратить в соединения с 4-замещенной карбосальдегидфенильной (формилфенильной) группой посредством взаимодействия соответствующего бромида с газообразным монооксидом углерода,который барботируется через реакционную смесь при атмосферном давлении в присутствии катализатора на основе палладия (II), такого как дихлорид бис(трифенилфосфин)палладия(II), и формиата натрия, в апротонном растворителе,таком как диметилформамид, при температурах в интервале от 70 до 110 С, предпочтительно при 90 С. Соединения формулы I, где R1 представляет 4-гидроксифенильную группу, можно превратить в другие соединения формулы I, где R1 представляет алкоксигруппу, посредством обработки соответствующей гидроксифенильной группы подходящим алкилгалогенидом, таким как бензилбромид, в присутствии гидрида на 21 трия, в апротонном растворителе, таком как диметилформамид, при температурах в интервале от 25 до 100 С, предпочтительно от 50 до 90 С. Соединения формулы II являются известными соединениями, или их можно получить обычными способами, например, посредством восстановления соответствующего амида или нитрила с использованием борана. Некоторые из нитрилов или амидов, используемые в качестве исходных веществ, можно получить подходящим образом путем обработки ацетонитрила формулы R1CH2CN, например, замещенного фенилацетонитрила, такого как 4-метоксифенилацетонитрил, или ацетата формулы R1CH2COOR (где R представляет, например, алкил), например, фенилацетата, такого как метил-4-трет-бутилфенилацетат, сильным основанием - амидом лития, таким как бис(триметилсилил)амид натрия или лития, и алкилгалогенидом, таким как метилйодид, в апротонном растворителе, таком как тетрагидрофуран, при температуре в интервале от -78 до 25 С. Сложные эфиры превращаются в амиды посредством гидролиза (вода, спирт и гидроксид натрия или калия) до кислоты, конверсии кислоты в хлорангидрид (SOCl2 или COCl2) с добавлением ДМФА (1 капля, и последующего превращения в амид обработкой водным аммиаком и сорастворителем, таким как тетрагидрофуран или диоксан. Некоторые нитрилы, используемые для получения соединений формулы II, также можно подходящим образом получить в результате взаимодействия соответствующего кетонопроизводного, например, соединения формулыR1COR8, такого как (2-ацетил-5-тиен-3-ил)тиофен, с тозилметилизоцианидом и третбутоксидом калия в диметиловом эфире. Способность соединений формулы I потенцировать функцию глутаматных рецепторов можно показать с использованием следующих процедур испытаний. Готовятся 96-луночные планшеты, содержащие конфлюэнтные монослои клеток НЕК,устойчиво экспрессирующих человеческийGluR4B (получены так, как описано в заявке на европейский патент, номер публикации ЕР-А 10583917). Затем среда для культивирования тканей удаляется из лунок, и каждая лунка промывается один раз 200 мкл 5 NaCa буфера (10 мМ глюкозы, 138 мМ хлорида натрия, 1 мМ хлорида магния, 5 MM хлорида калия, 10 мМ N-[2 гидроксиэтил]пиперазин-N-[2-этансульфоновой кислоты], до рН 7,1-7,3). Затем планшеты инкубируются в течение 60 мин в темноте с 20 мкМ красителя Fluo3-AM (получен от MolecularProbes Inc, Юджин, Орегон) в 5NaCa буфере в каждой лунке. После инкубации каждая лунка промывается один раз 100 мкл 5NaCa буфера,добавляется 200 мкл 5NaCa буфера, и планшеты инкубируются в течение 30 мин. 22 Также готовят растворы для применения в испытании следующим образом. Раствор испытываемого соединения (10 мМ) в ДМСО разводится до 30 мкМ, 10 мкМ, 3 мкМ и 1 мкМ испытываемого соединения с использованием 5NaCa буфера. Готовится 100 мкМ раствор циклотиазида посредством добавления 3 мкл 100 мМ раствора циклотиазида к 3 мл 5NaCa буфера. Контрольный буферный раствор готовится посредством добавления 1,5 мкл ДМСО к 498,5 мкл 5NaCa буфера. Затем каждое испытание осуществляется следующим образом. Из каждой лунки 200 мкл 5NaCa буфера удаляются и заменяются 45 мкл 5NaCa буфера. Затем осуществляется первое прочтение планшета с использованием флуориметра FLUOROSKAN II (получен от Labsystems,Needham Heights, МА, USA, a Division of LifeSciences International Plc). Затем буфер удаляется из лунок, в крайние лунки добавляется 45 мкл 5NaCa буфера, а в серединные лунки добавляется 45 мкл раствора испытываемого соединения. Затем с использованием флуориметра осуществляется второе прочтение планшета. Затем планшет оставляется во флуориметре на 5 минут, и проводится третье прочтение. Затем в каждую лунку добавляется 15 мкл 400 мкМ раствора глутамата (конечная концентрация глутамата 100 мкМ), и сразу же проводится четвертое прочтение. Приблизительно через три минуты проводится пятое прочтение планшета. Активности испытываемых соединений,контрольных растворов и растворов циклотиазида определяются посредством вычитания третьего прочтения из четвертого (флуоресценция из-за глутамата). Активность испытываемых соединений выражается относительно активности 100 мкМ циклотиазида. При другом испытании клетки НЕК 293,устойчиво экспрессирующие человеческийGluR4 (получены так, как описано в заявке на европейский патент, публикацияЕР-А 10583917), используются при определении электрофизиологических свойств потенциаторов рецепторов АМРА. Раствор для внеклеточной регистрации содержит (в мМ) 140 NCl, 5KC1, 10HEPES, 1MgCl2, 2CaCl2, 10 глюкозы, рН = 7,4, с помощью NaOH, 295 мОсм кг-1. Раствор для внутриклеточной регистрации содержит (в мМ) 140 CsCl, 1MgCl2, 10 HEPES (N-[2 гидроксиэтил]пиперазин-N1-[2-этансульфоновая кислота)], 10 EGTA (этилен-бис(оксиэтиленнитрило)тетрауксусная кислота), рН =7,2, с помощью СsОН, 295 мОсм кг-1. С этими растворами регистрирующие пипетки имеют сопротивление 2-3 МОм. С использованием приемов фиксации напряжения для целых клеток клетки фиксируются при напряжении -60 мВ, и вызываются контрольные отклики на 100 мкМ глутамата. Как только получены базисные отклики на заражение этим агонистом, во внеклеточный раствор, омывающий клетки, вводится потенциатор 23 с самой низкой концентрацией, и определяется реакция на 100 мкМ глутамата в присутствии потенциатора при этой концентрации. Концентрация потенциатора как в омывающем растворе, так и при применении вместе с агонистом, возрастает в полулогарифмических единицах до тех пор, пока не обнаружится максимальное потенцирование. Данные, полученные таким образом, вставляются в уравнение Хилла, причем получают величину EC50, показывающую эффективность потенциатора. Затем потенциатор вымывается как из контрольного раствора, так и из агонистсодержащего раствора, чтобы исследовать его реверсирование. Как только вновь установлены контрольные отклики на заражение агонистом, определяется потенцирование этих откликов 100 мкМ циклотиазида посредством его включения как в омывающий раствор, так и в агонистсодержащий раствор. Таким образом, можно определить эффективность потенциатора по сравнению с эффективностью циклотиазида. Обнаружено, что соединения, упомянутые здесь в качестве примеров, при таком испытании показывают EC50, по меньшей мере, 30 мкМ. Например, соединение примера 28 даетEC50 23059 нМ. В соответствии с другим аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы 1 а или его фармацевтически приемлемую соль, описанные выше, и фармацевтически приемлемый разбавитель или носитель. Фармацевтическая композиция готовится известными способами с использованием хорошо известных и легко доступных ингредиентов. При получении композиций настоящего изобретения активный ингредиент обычно смешивается с носителем, или разбавляется носителем,или заключается в носитель, и может находиться в форме капсулы, саше, пакетика или другой емкости. Когда носитель служит в качестве разбавителя, он может представлять твердое, полутвердое или жидкое вещество, которое действует как носитель, эксципиент или среда для активного ингредиента. Композиции могут находиться в форме таблеток, пилюль, порошков,пастилок, саше, облаток, эликсиров, суспензий,эмульсий, растворов, сиропов, аэрозолей, мазей,содержащих, например, до 10 маc.% активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильных упакованных порошков. Некоторыми примерами подходящих носителей, эксципиентов и разбавителей являются лактоза, декстроза, сахароза, сорбит, маннит,крахмалы, смола, аравийская камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза,поливинилпирролидон, целлюлоза, водный сироп, метилцеллюлоза, метил- и пропилгидрок 001919 24 сибензоат, тальк, стеарат магния и минеральное масло. Композиции могут дополнительно содержать смазывающие вещества, смачиватели,эмульгаторы и суспендирующие вещества, консерванты, подслащивающие агенты или корригенты. Композиции по изобретению можно составлять, с использованием методов, хорошо известных в технике, так, чтобы после введения пациенту получить быстрое, длительное или отсроченное высвобождение активного ингредиента. Композиции, предпочтительно, составляются в стандартной лекарственной форме, причем каждая доза содержит примерно от 1 до примерно 500 мг, предпочтительнее - примерно от 5 до примерно 300 мг (например, 25 мг), активного ингредиента. Термин "стандартная лекарственная форма" относится к физически дискретной единице, подходящей для единичных доз для людей и других млекопитающих, причем каждая единица содержит предварительно установленное количество активного вещества,рассчитанное на получение нужного терапевтического действия, в сочетании с подходящим фармацевтическим носителем, разбавителем или эксципиентом. Приведенные далее примеры композиций являются только иллюстративными и никоим образом не предназначены для ограничения объема изобретения. Композиция 1. Твердые желатиновые капсулы получают,используя следующие ингредиенты: Количество(мг/капсулу) Активный ингредиент 250 Высушенный крахмал 200 Стеарат магния 10 Всего 460 мг Вышеуказанные ингредиенты смешиваются и загружаются в твердые желатиновые капсулы в количестве 460 мг на капсулу. Композиция 2. Таблетки, каждая из которых содержит 60 мг активного ингредиента, готовятся следующим образом Активный ингредиент 60 мг Крахмал 45 мг Микрокристаллическая целлюлоза 35 мг Поливинилпирролидон 4 мг Натрийкарбоксиметилкрахмал 4,5 мг Стеарат магния 0,5 мг Тальк 1 мг Всего 150 мг Активный ингредиент, крахмал и целлюлоза просеиваются через сито 45 меш, США,и тщательно смешиваются. Смешивается раствор поливинилпирролидона с полученными порошками, которые затем просеиваются через сито 14 меш, США. Полученные таким образом гранулы сушатся при 50 С и просеиваются 25 через сито 18 меш, США. Затем натрийкарбоксиметилкрахмал, стеарат магния и тальк,предварительно просеянные через сито 60 меш, США, добавляются к гранулам, которые,после смешивания, прессуются на таблеточной машине, и получаются таблетки, каждая массой в 150 мг. Эффективная доза соединения, вводимого по данному изобретению, будет, конечно, определяться определенными обстоятельствами,сопровождающими данный случай, включая вводимое соединение, способ введения, определенное состояние, которое лечится, и подобные обстоятельства. Соединения можно вводить разными способами, в том числе, пероральным,ректальным, трансдермальным, подкожным,внутривенным, внутримышечным или интраназальным способом. С другой стороны, соединение можно вводить путем непрерывной инфузии. Типичная суточная доза будет содержать примерно от 0,01 до примерно 100 мг/кг активного соединения данного изобретения. Предпочтительно, суточные дозы будут составлять примерно от 0,05 до примерно 50 мг/кг, предпочтительнее примерно от 0,1 до примерно 25 мг/кг. Приведенные далее способы получения соединений и примеры иллюстрируют изобретение. Получение 1. 2-(4-Бромфенил)пропионитрил. Раствор 50,0 г (225,0 ммоль) 4-бромфенилацетонитрила и 1,8 г (12,8 ммоль) карбоната калия в 387 мл диметилкарбоната греют при 180 С в запаянном сосуде в течение 16 ч. Затем раствор охлаждают, разбавляют 200 мл этилацетата и промывают один раз 100 мл воды, один раз 100 мл 10% водного раствора бисульфата натрия и один раз 100 мл солевого раствора. Органическую часть сушат (МgSO4), фильтруют и концентрируют в вакууме. Остаток перегоняют в вакууме в аппарате для молекулярной перегонки, и получают 40,3 г (85%) целевого соединения. Получение 2. Гидрохлорид 2-(4-бромфенил)пропиламина. К раствору 35,2 г (167,6 ммоль) вещества из получения 1 при кипячении с обратным холодильником в 35,0 мл тетрагидрофурана постепенно, через шприц, добавляют 18,4 мл(184,3 ммоль) 10 М раствора борандиметилсульфида. После завершения добавления раствор кипятят с обратным холодильником еще в течение 1 ч. Раствор охлаждают до температуры окружающей среды, и постепенно добавляют насыщенный раствор хлористого водорода в метаноле до тех пор, пока рН не достигнет 2. Полученную суспензию концентрируют в вакууме. Остаток дважды растворяют в метаноле и концентрируют в вакууме. Полученное твердое вещество суспендируют в этиловом эфире,фильтруют, промывают этиловым эфиром, су 001919(74%) целевого соединения. Получение 3. 2-Фторбензолбороновая кислота. Раствор 50 г (285,6 ммоль) 2 фторбромбензола в 400 мл тетрагидрофурана охлаждают до -78 С, и добавляют через канюлю 200 мл (320,0 ммоль) 1,6 М н-бутиллития. Смесь перемешивают при -78 С в течение 60 мин, затем добавляют через канюлю 98,9 мл (428,4 ммоль) триизопропилбората, и продолжают перемешивание в течение 60 мин. Охлаждающую баню удаляют, и смесь перемешивают при температуре окружающей среды в течение 1,5 ч,затем добавляют 150 мл 6N соляной кислоты, и продолжают перемешивание в течение 1,5 ч. К смеси добавляют 100 мл солевого раствора, и затем органический слой отделяют, и водный слой три раза экстрагируют эфиром, каждый раз по 30 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток перекристаллизовывают из воды, и получают 25,2 г (63%) целевого соединения. Получение 4. 2-(4-Бромфенил)-N-(третбутоксикарбонил)пропиламин. К раствору 11,8 г (55,0 ммоль) вещества из получения 2 в 100 мл хлороформа и 100 мл насыщенного раствора бикарбоната натрия добавляют 12,0 г (55,0 ммоль) ди-трет-бутилдикарбоната. Раствор перемешивают при температуре окружающей среды в течение 1 ч. Органический слой отделяют, и водный слой экстрагируют три раза хлороформом, каждый раз по 30 мл. Объединенные органические экстракты сушат(МgSO4), фильтруют и концентрируют в вакууме, и получают 16,5 г (95%) целевого соединения. Получение 5. 2-(4-(2-Фторфенил)фенил)N-(трет-бутоксикарбонил)пропиламин. К обезгаженному раствору 12,5 г (39,8 ммоль) вещества из получения 4, 6,7 г (47,7 ммоль) вещества из получения 3 и 8,2 г (59,7 ммоль) карбоната калия в 140 мл толуола добавляют 2,3 г (1,9 ммоль) тетракис (трифенилфосфин)палладия (0). Смесь греют при 90 С в течение 18 ч. Затем смесь охлаждают до температуры окружающей среды, и добавляют 300 мл воды и 150 мл эфира. Органический слой отделяют, и водный слой три раза экстрагируют этилацетатом, каждый раз по 50 мл. Объединенные органические экстракты сушат (MgSО 4),фильтруют и концентрируют в вакууме. Хроматография остатка (500 г силикагеля, 10% этилацетата в гексане) дает 9,3 г (71%) целевого соединения. Получение 6. 2-(4-(2-фторфенил)фенил) пропиламин. Раствор 9,3 г вещества из получения 5 в 100 мл смеси 20% трифторуксусной кислоты с дихлорметаном перемешивают при температуре 27 окружающей среды в течение 2 ч. Смесь концентрируют в вакууме, и получают 11,7 г вещества. Это вещество растворяют в 100 мл простого эфира и дважды промывают 50 мл 1N раствора гидроксида натрия. Органический слой концентрируют в вакууме, и получают 5,48 г (85%) целевого соединения. Получение 7. 2-(4-Изопропилфенил)пропионитрил. В 250-мл колбе в атмосфере азота растворяют в тетрагидрофуране (150 мл) 8,00 г (50,2 ммоль) 4-изопропилфенилацетонитрила. Раствор охлаждают до -78 С, и добавляют 52,8 мл 1 М раствора бис(триметилсилил)амида лития(52,8 ммоль) в тетрагидрофуране. Полученную смесь перемешивают при -78 С в течение 1 ч. К этой реакционной смеси добавляют 3,29 мл(52,8 ммоль) йодметана. Полученную смесь постепенно, в течение 16 ч, нагревают до температуры окружающей среды, затем гасят 0,2 М соляной кислотой и дважды экстрагируют диэтиловым эфиром. Органические фракции объединяют, сушат (MgSO4) и концентрируют в вакууме. Хроматография (SiO2, 20% этилацетата в гексане) дает 6,32 г (73%) целевого соединения. Масс-спектр (полевая десорбция): М = 173. Элементный анализ для C12H15N. Теоретически: С 83,19; Н 8,73; N 8,08. Найдено: С 82,93; Н 8,57; N 8,02. Получение 8. Гидрохлорид 2-(4-изопропилфенил)пропиламина. В 100-мл колбе, снабженной холодильником, в атмосфере азота растворяют в тетрагидрофуране (70 мл) 1,90 г (11,0 ммоль) 2-(4 изопропилфенил)пропионитрила. К раствору добавляют боранметилсульфидный комплекс(10,0-10,2 М раствор в тетрагидрофуране, 1,20 мл, 12,1 ммоль), и смесь кипятят с обратным холодильником в течение 3 ч. Раствор охлаждают до температуры окружающей среды, и постепенно добавляют насыщенный раствор хлористого водорода в метаноле до образования белого осадка. Растворитель удаляют в вакууме,и полученное белое твердое вещество растирают в порошок (х 4) с диэтиловым эфиром. Сушка в вакууме дает 1,76 г (73%) целевого соединения. Получение 9. 2-(4-Метоксифенил)пропионитрил. По способу получения 7, но с использованием 5,00 г (34,0 ммоль) 4-метоксифенилацетонитрила, получают 6,32 г целевого соединения. Масс-спектр (полевая десорбция): М = 161. Элементный анализ для С 10 Н 11NО. Теоретически: С 74,51; Н 6,88; N 8,69. Найдено: С 74,34; Н 6,67; N 8,93. Получение 10. Гидрохлорид 2-(4-метоксифенил)пропиламина. По способу получения 8, но с использованием 2,75 г (17,1 ммоль) продукта получения 9,получают 2,77 г (81%) целевого соединения. 28 Элементный анализ для C10H16ClNO. Теоретически: С 59,55; Н 8,00; N 6,94. Найдено: С 59,33; Н 7,89; N 6,71. Получение 11. Метил-2-(4-трет-бутилфенил)пропаноат. К 4,75 г (23 ммоль) метил-4-трет-бутилфенилацетата в 100 мл сухого ТГФ при -78 С,при перемешивании, в атмосфере азота, добавляют по каплям 23,3 мл 1,0 М раствора бис(триметилсилил)амида лития (23 ммоль). Смесь перемешивают при этой температуре в течение 45 мин, затем добавляют по каплям 1,5 мл (24 ммоль) метилйодида, и раствор перемешивают еще в течение 1 ч при -78 С. Смесь выливают в 200 мл Н 2 О, и нужный продукт экстрагируют 500 мл диэтилового эфира. Органический слой один раз промывают 500 мл Н 2O обратной струй, сушат над К 2 СО 3 и концентрируют при пониженном давлении, и получают 5,12 г темного масла. Масло очищают посредством хроматографии на силикагеле с элюированием растворителем с градиентом от гексана до смеси гексана с этилацетатом, 19:1. Фракции,содержащие нужный продукт, объединяют и концентрируют при пониженном давлении, и получают 2,65 г (53%) целевого соединения. Масс-спектр: М = 220. Получение 12. Метил-2-(4-трет-бутилфенил)бутаноат. Как описано в получении 11, 4 г (19 ммоль) метил-4-трет-бутилфенилацетата, 19,5 мл 1,0 М, раствора бис(триметилсилил)амида лития (19 ммоль) подвергают взаимодействию с 3,12 г (20 ммоль) этилйодида, и получают 5,13 г коричневого масла. Хроматография с элюированием растворителем с градиентом от гексана до смеси гексана с этилацетатом, 19:1, дает 2,35 г (53%) целевого соединения. Масс-спектр: М = 234. Получение 13. Метил-2-(4-трет-бутилфенил)-2-метилпропаноат. Как описано в получении 11, 4,75 г (23 ммоль) метил-4-трет-бутилфенилацетата, 46,6 мл 1,0 М раствора бис(триметилсилил)амида лития (46 ммоль) и 6,80 г (48 ммоль) метилйодида, и получают 4,73 г неочищенного масла. Хроматография с элюированием растворителем с градиентом от гексана до смеси гексана с этилацетатом, 19:1, дает 2,0 г (37%) целевого соединения. Масс-спектр: М = 234. Получение 14. Этил-2-(2-нафтил)пропаноат. Подвергают взаимодействию как описано в получении 11, 5 г (23 ммоль) этил-2-нафтилацетата, 23,3 мл 1,0 М раствора бис(триметилсилил)амида лития (23 ммоль) и 1,5 мл (24 ммоль) метилйодида, и получают 5,71 г темного масла. Хроматография с элюированием растворителем с градиентом от гексана до смеси гексана с этилацетатом, 19:1, дает 2,85 (54%) целевого соединения. Масс-спектр: М = 228. 29 Получение 15. 2-(4-Трет-бутилфенил)пропановая кислота. В тройной растворитель, состоящий из тетрагидрофурана (189 мл), СН 3 ОН (63 мл) и Н 2 О (63 мл) помещают 2,60 г (12 ммоль) продукта получения 11 и 1,75 г (42 ммоль) гидроксида лития, и перемешивают при температуре окружающей среды в течение 16 ч. Затем смесь концентрируют при пониженном давлении, и полученное белое твердое вещество растворяют в 200 мл 1N НСl, и экстрагируют нужный продукт 250 мл этилацетата. Органический слой концентрируют при пониженном давлении, и получают 1,21 г (49%) целевого соединения. Масс-спектр: М = 206. Получение 16. 2-(4-Трет-бутилфенил)бутановая кислота. Целевое соединение (2,14 г) получают по способу получения 15, исходя из продукта получения 12, и перекристаллизовывают из гексана. Масс-спектр: М = 220. Получение 17. 2-(4-Трет-бутилфенил)-2 метилпропановая кислота. Целевое соединение (1,75 г) получают по способу получения 15, исходя из продукта получения 13, и перекристаллизовывают из гексана. Масс-спектр: М = 220. Получение 18. 2-(2-Нафтил)пропановая кислота. Целевое соединение (3,81 г) получают по способу получения 15, исходя из продукта получения 14, и перекристаллизовывают из смеси гексана с этилацетатом, 9:1. Масс-спектр: М = 214. Получение 19. 2-(4-трет-бутилфенил) пропионамид. К оксалилхлориду (10 мл) при температуре окружающей среды в атмосфере N2 добавляют по частям 900 мг (4,4 ммоль) продукта получения 15, а затем добавляют CH2Cl2 (10 мл). Инициирование реакции осуществляют посредством добавления одной капли ДМФА. Происходит выделение газа, и реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч. Раствор концентрируют при пониженном давлении, и получают масло. Добавляют для растворения диоксан (10 мл), и при перемешивании при температуре окружающей среды добавляют 28% гидроксид аммония (10 мл), и реакционную смесь перемешивают в течение 16 ч. Затем раствор концентрируют при пониженном давлении, и получают белое твердое вещество. Это твердое вещество растворяют в 50 мл этилацетата, промывают один раз обратной струй 50 мл Н 2 О, сушат над К 2 СО 3 и концентрируют при пониженном давлении, и получают 770 мг твердого вещества. Перекристаллизация из смеси гексана с этилацетатом,1:1, дает 555 мг (61%) целевого соединения. Масс-спектр: М = 205. 30 Получение 20. 2-(4-Трет-бутилфенил)бутанамид. Целевое соединение получают по способу получения 19, исходя из продукта получения 16. Очистку осуществляют посредством хроматографии на силикагеле (микронный ротор Хроматотрон-2000) с элюированием смесью гексана с этилацетатом, 1:1, и получают 471 мг(60%) указанного вещества. Масс-спектр: М = 219. Получение 21. 2-(4-Трет-бутилфенил)-2 метилпропионамид. Целевое соединение получают по способу получения 19, исходя из продукта получения 17. Сырой продукт растирают в порошок с раствором гексана с этилацетатом, 19:1, в течение 1/2 часа и фильтруют, и получают 1,16 г белого твердого вещества. Последующая перекристаллизация из этилацетата с этанолом, 1:1, позволяет извлечь вещество с выходом 80% в виде мелких пластинок. Масс-спектр: М = 219. Получение 22. 2-(2-Нафтил)пропионамид. Целевое соединение получают по способу получения 19, исходя из продукта получения 18. Перекристаллизация из гексана с этилацетатом,1:1, дает 1,65 г (90%) указанного вещества. Масс-спектр: М = 199. Получение 23. 2-(4-Трет-бутилфенил)пропиламин. Борантетрагидрофурановый комплекс (25 мл, 1,0 М, 0,025 моль) при температуре окружающей среды в атмосфере N2 добавляют с помощью шприца к 1,10 г (5,4 ммоль) продукта получения 19 (60 мл). Затем смесь греют при 6065 С в течение 16 ч. Затем при температуре окружающей среды добавляют с помощью шприца насыщенный раствор НСl в метаноле (5 мл) с образованием обильной пены, и затем раствор концентрируют при пониженном давлении. Полученное белое твердое вещество растворяют в 100 мл 1N NaOH, и выделившийся свободный амин экстрагируют один раз 200 мл диэтилового эфира. Органический слой промывают один раз обратной струей 200 мл H2O, сушат над К 2 СО 3 и концентрируют при пониженном давлении, и получают 1,21 г коричневого масла. Хроматография (микронный ротор Хроматотрон-2000) с элюированием растворителем с градиентом от этилацетата с МеОН, 9:1, до МеОН дает 856 мг(83%) указанного вещества. Масс-спектр: М = 191. Получение 24. 2-(4-Трет-бутилфенил)бутиламин. Целевое соединение (540 мг) получают в виде масла способом получения 23, исходя из продукта получения 20. Масс-спектр: М = 205. Получение 25. 2-(4-Трет-бутилфенил)-2 метилпропиламин. Целевое соединение (428 мг, 42%) получают по способу получения 23, исходя из продукта получения 21 и используя метанол в каче 31 стве растворителя для хроматографии. Массспектр: М = 205. Получение 26. 2-(2-Нафтил)пропиламин. Целевое соединение (450 мг, 44%) получают в виде масла по способу получения 23,исходя из продукта получения 22 и используя метанол в качестве растворителя для хроматографии. Масс-спектр: М = 185. Получение 27. Метил-1-(4-трет-бутилфенил)циклопропанкарбоксилат. Как описано в получении 11, 4 г (19,4 ммоль) метил-4-трет-бутилфенилацетата, 39 мл 1,0 М раствора бис(триметилсилил)амида лития(2 экв) подвергают взаимодействию с 3 г (2 экв) 1-бром-2-хлорэтана в 100 мл сухого ТГФ, за исключением того, что перед обработкой реакционную смесь перемешивают в течение одного часа при температуре окружающей среды. Эта реакция дает 4,21 г коричневого масла. Это вещество очищают посредством хроматографии на силикагеле с элюированием растворителем с градиентом от гексана до смеси гексана сEtOAc, 19:1, и получают 1,57 г (35%) целевого соединения в виде бледно-желтого твердого вещества, т.пл. 58-60 С. Элементный анализ, расчет для C15H20O2. Теоретически: С 77,37; Н 8,81. Найдено: С 77,54; Н 8,68. Получение 28. 1-(4-Трет-бутилфенил)циклопропанкарбоновая кислота. В тройной растворитель, состоящий из ТГФ (66 мл), метанола (22 мл) и Н 2 О (22 мл),помещают 1 г (4,3 ммоль) продукта получения 27 и 650 мг (15,5 ммоль) гидроксида лития, и проводят реакцию так, как описано в получении 15, и получают 840 мг твердого вещества. Это вещество очищают посредством хроматографии на силикагеле с элюированием гексаном сEtOAc, 1:1, как растворителем, и получают 600 мг (64%) целевого соединения в виде белого твердого вещества. Т.пл. - 150 С, разл. Элементный анализ, расчет для C14H18O2. Теоретически: С 77,03; Н 8,31. Найдено: С 77,08; Н 8,02. Получение 29. 1-(4-Трет-бутилфенил)циклопропанкарбоксамид. Подвергают взаимодействию так, как описано в получении 19, 580 мг (2,7 ммоль) продукта получения 27, оксалилхлорид (10 мл), метиленхлорид (10 мл) и одну каплю ДМФА, и получают 573 мг сырого хлорангидрида. Превращение в амид осуществляют с помощью 28% гидроксида аммония (10 мл) и диоксана (10 мл),как описано в получении 27, и получают 590 мг твердого вещества. Растирание в порошок со смесью гексана с EtOAc, 19:1, и последующая фильтрация дают 510 мг (87%) целевого соединения в виде белого твердого вещества. Т.пл. 178-180 С. Элементный анализ, расчет для C14H19NO. Теоретически: С 77,38; Н 8,81; N 6,45. Найдено: С 77,53; Н 8,77; N 6,39. 32 Получение 30. 1-(4-Трет-бутилфенил)циклопропилметиламин. Подвергают взаимодействию так, как описано в получении 23, 7 мл комплекса борана с тетрагидрофураном (1,0 М, 7 ммоль) и 500 мг(2,3 ммоль) продукта получения 29 в ТГФ (50 мл), и получают 510 мг масла. Очистку осуществляют посредством хроматографии на силикагеле с элюированием растворителем с градиентом от EtOAc с метанолом, 9:1, до метанола, и получают 222 мг (47%) твердого вещества. Т.пл. 39-41 С. Элементный анализ, расчет для C14H21N. Теоретически: С 82,70; Н 10,41; N 6,89. Найдено: С 81,36; Н 10,13; N 7,24. Получение 31. Гидрохлорид 2-(4-бромфенил)пропиламина. К охлажденному до -15 С раствору 50,0 г(251,2 ммоль) 4-бромацетофенона и 49,0 г (251,2 ммоль) тозилметилизоцианида в 800 мл сухого диметоксиэтана добавляют по каплям горячий раствор 50,7 г (452,2 ммоль) трет-бутоксида калия в 230 мл трет-бутилового спирта с такой скоростью, чтобы температура оставалась ниже 0 С. После завершения добавления реакционную смесь перемешивают при -5 С в течение 45 мин. Охлаждающую баню удаляют, и реакционную смесь перемешивают еще в течение 2,5 ч. Смесь концентрируют в вакууме до объема 200 мл и разбавляют 500 мл воды. Водную смесь экстрагируют четыре раза диэтиловым эфиром,и объединенные органические части сушат(МgSO4), фильтруют и концентрируют в вакууме. Остаток растворяют в 55 мл тетрагидрофурана и нагревают до образования флегмы. К кипящему, с обратным холодильником, раствору добавляют постепенно, по каплям, 27,6 мл(276,3 ммоль) 10,0 М комплекса борана с диметилсульфидом. После завершения добавления кипячение с обратным холодильником продолжают в течение 20 мин. Смесь охлаждают до температуры окружающей среды, и очень медленно добавляют метанол, насыщенный хлористым водородом, до достижения рН 2. Смесь концентрируют в вакууме, и остаток растворяют в метаноле и снова концентрируют в вакууме. Твердый остаток суспендируют в 125 мл этанола, фильтруют, промывают этанолом и затем диэтиловым эфиром. Белое твердое вещество сушат в вакууме, и получают 25,4 г (40%) целевого соединения. Фильтрат концентрируют в вакууме, и остаток суспендируют в диэтиловом эфире. Твердое вещество отфильтровывают,промывают диэтиловым эфиром и сушат в вакууме, и получают еще 15,6 г (25%) целевого соединения. Получение 32. 2-(4-Метилфенил)пропионитрил. Целевое соединение получают из 4 метилфенилацетонитрила так, как описано в получении 7. Элементный анализ для С 10 Н 11N. 33 Теоретически: С 82,72; Н 7,64; N 9,65. Найдено: С 82,75; Н 7,42; N 9,94. Получение 33. Гидрохлорид 2-(4-метилфенил)пропиламина. Целевое соединение получают из продукта получения 32 так, как описано в получении 8. Масс-спектр (полевая десорбция): М = 150(120 мл), и к этому раствору добавляют карбонат калия (23,78 г, 172,4 ммоль), бензилбромид(20,64 г, 120,6 ммоль) и йодид калия, (3,81 г,30,0 ммоль). Раствор перемешивают при температуре окружающей среды в течение 6 часов,после чего добавляют воду. Из раствора выпадает в осадок 4-бензилоксифенилацетонитрил. Суспензию фильтруют, и промывают осадок водой (3 х). Получают 24,8 г вещества (97%) в виде желтых кристаллов. Целевой продукт получают из 4-бензилоксифенилацетонитрила так,как описано в получении 7. Выход 76%. Масс-спектр (полевая десорбция): М = 237,2. Элементный анализ для C16H15NO. Теоретически: С 80,98; Н 6,37; N 5,90. Найдено: С 80,93; Н 6,46; N 6,11. Получение 35. Гидрохлорид 2-(4-бензилоксифенил)пропиламина. Целевое соединение получают из продукта получения 34 так, как описано в получении 2. Элементный анализ для C16H20ClNO. Теоретически: С 59,55; Н 8,00; N 6,94. Найдено: С 59,33; Н 7,89; N 6,71. Получение 36. N-трет-бутоксикарбонил-N(2-(4-гидроксифенил)пропил)-2-пропансульфонамид. Продукт примера 40 (7,6 г, 23,8 ммоль) растворяют в дихлорметане (100 мл), и к этой смеси добавляют ди-трет-бутилдикарбонат (5,71 г, 26,2 ммоль) и 4-диметиламинопиридин (1,45 г, 11,9 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Реакционную смесь промывают насыщенным водным раствором гидросульфата натрия и солевым раствором. Органическую фракцию сушат над сульфатом магния и концентрируют в вакууме. Сульфонамид с защитной группой (9,00 г, 21,0 ммоль) растворяют в смеси этилацетата с H2O (5:1), и к смеси добавляют формиат аммония (2,0 г, 31,5 ммоль). Затем к реакционной смеси добавляют палладийна-угле (10%) (0,9 г), и все перемешивают при температуре окружающей среды в течение 6 часов. Суспензию фильтруют через целит, и полученный раствор концентрируют в вакууме,и получают 5,51 г (78%) целевого продукта. Масс-спектр (полевая десорбция): М = 329,1. Элементный анализ для C15H23NO5S. Теоретически: С 54,69; Н 7,04; N 4,25. 34 Найдено: С 53,70; Н 7,72; N 4,04. Получение 37. 2-(4-Бромфенил)-1-нитро-1 метилэтилен. Раствор 30,0 г (162 ммоль) 4-бромбензальдегида, 116 мл (1,6 моль) нитроэтана и 37,5 г (486 ммоль) ацетата аммония в 200 мл толуола греют с ловушкой Дина-Старка в течение 18 ч. Затем смесь охлаждают до 80 С, добавляют 1 мл концентрированной серной кислоты, и смесь перемешивают при 80 С в течение 2 ч. Затем смесь охлаждают до температуры окружающей среды и промывают 200 мл солевого раствора. Органический слой отделяют, и водный слой три раза экстрагируют 60 мл диэтилового эфира. Объединенные органические экстракты сушат(МgSO4), фильтруют и концентрируют в вакууме. Остаток перекристаллизовывают из метанола, и получают 18,7 г (47%) целевого соединения. Получение 38. 2-(4-Бромфенил)-1-нитро-1 метилэтан. Суспензию 1,3 г (33,9 ммоль) алюмогидрида лития в 55 мл тетрагидрофурана (ТГФ) охлаждают до 0 С. Добавляют по каплям раствор 4,1 г (16,9 ммоль) вещества из получения 37 в 5 мл ТГФ. Добавляют последовательно 1,3 мл воды, 1,3 мл 1 М раствора гидроксида натрия и 4,0 мл воды. Смесь фильтруют через целит, и промывают дихлорметаном. Органические вещества концентрируют в вакууме, и получают 3,0 г целевого соединения (83%). Получение 39. N-2-(4-Бромфенил)пропил 2-пропансульфонамид. Раствор 15,0 г (59,9 ммоль) вещества из получения 31 и 18,4 мл (131,8 ммоль) триэтиламина в 150 мл дихлорметана перемешивают в течение 20 мин при комнатной температуре,затем охлаждают до 0 С и обрабатывают, добавляя по каплям в течение 5 мин, 8,1 мл (71,9 ммоль) 2-пропилсульфонилхлорида в 10 мл дихлорметана. После перемешивания в течение ночи при комнатной температуре реакционную смесь промывают один раз 200 мл 10% водного раствора бисульфата натрия, слои разделяют, и водный слой дважды экстрагируют дихлорметаном, каждый раз по 100 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (500 г силикагеля, 30% этилацетата в гексане) дает 11,0 г (57%) целевого соединения. Получение 40. N-2-(4-Три-н-бутилстаннилфенил)пропил-2-пропансульфонамид. К обезгаженному раствору 4,8 г (15,1 ммоль) вещества из получения 39, 2,1 мл (15,1 ммоль) триэтиламина и 8,0 мл (15,9 ммоль) гексабутилдиолова в 35 мл толуола добавляют 0,9 г(0). Смесь греют при 100 С в течение 16 ч, охлаждают до комнатной температуры и разбавляют 35 мл этилацетата. Смесь промывают 50 мл 10% водного раствора бисульфата натрия, 35 органический слой отделяют, и водный слой экстрагируют два раза этилацетатом, каждый раз по 50 мл. Объединенные органические части сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (350 г силикагеля, 20% этилацетата в гексане) дает 3,5 г(44%) целевого соединения в виде прозрачного бесцветного масла. Элементный анализ дляC24H45NO2SSn. Вычислено, %: С 54,35; Н 8,55; N 2,64. Найдено, %: С 54,41; Н 8,16; N 2,74. Масс-спектр: М = 530. Получение 41. 2-(4-Бромфенил)-N-(третбутоксикарбонил)этиламин. При комнатной температуре к раствору 10,0 г (50,0 ммоль) 4-бромфенетиламина и 11,0 г(50,0 ммоль) ди-трет-бутилдикарбоната в 100 мл хлороформа добавляют 100 мл насыщенного водного раствора бикарбоната натрия. Смесь перемешивают при комнатной температуре в течение 1,5 ч и разбавляют 100 мл воды. Органический слой отделяют, и водный слой экстрагируют хлороформом два раза, каждый раз по 100 мл. Объединенные органические части промывают один раз 100 мл 10% водного раствора бисульфата натрия, сушат (Na2SO4), фильтруют и концентрируют в вакууме, и получают 14,6 г(97%) указанного вещества. Масс-спектр: М+1 = 301. Получение 42. 4-Цианофенилбороновая кислота. Раствор 10,0 г (54,9 ммоль) 4-бромбензонитрила в 100 мл тетрагидрофурана охлаждают до -85 С, после чего добавляют 36,0 мл (57,6 ммоль) 1,6 М раствора н-бутиллития в гексане. Смесь перемешивают в течение пяти минут, и добавляют 19,0 мл (82,4 ммоль) триизопропилбората. Смесь перемешивают при -85 С в течение 30 мин, затем нагревают до температуры окружающей среды в течение одного часа. К смеси добавляют 35 мл 5 N соляной кислоты, и продолжают перемешивание в течение 2,5 ч. Смесь разбавляют 100 мл насыщенного водного раствора хлорида натрия и экстрагируют три раза этиловым эфиром, каждый раз по 100 мл. Объединенные органические части сушат(МgSO4), фильтруют и концентрируют в вакууме. Остаток перекристаллизовывают из воды и фильтруют, и получают 2,0 г (25%) целевого соединения. Получение 43. N-2-(4-Формилфенил) пропил-2-пропансульфонамид. Раствор 4,6 г (14,5 ммоль) вещества из получения 39 в 50 мл тетрагидрофурана охлаждают до -85 С, и добавляют через шприц 19 мл(30,5 ммоль) 1,6 М раствора н-бутиллития. Смесь перемешивают при -85 С в течение 30 мин, затем добавляют через шприц 2,2 мл (29,0 ммоль) N,N-диметилформамида, и перемешивание продолжают в течение 30 мин. Смесь перемешивают при 0 С в течение 30 мин, и затем добавляют 100 мл солевого раствора и 50 мл 36 эфира. Органический слой отделяют, и водный слой экстрагируют три раза эфиром, каждый раз по 20 мл. Объединенные органические экстракты сушат (МgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (200 г силикагеля, 40% этилацетата в гек-сане) дает 2,2 г(56%) целевого соединения. Получение 44. N-2-(4-(4-(1-гидрокси-2-(N(трет-бутоксикарбонил)метилсульфонамидо) этил)фенил)фенил)пропил-2-пропансульфонамид. А. N-(трет-бутоксикарбонил)метансульфонамид. К раствору 15,0 г (157,7 ммоль) метансульфонамида, 17,6 г (173,5 ммоль) триэтиламина и 1,9 г (15,8 ммоль) 4-диметиламинопиридина в 200 мл дихлорметана добавляют в течение десяти минут 37,9 г (173,5 ммоль) дитрет-бутилдикарбоната в 200 мл дихлорметана. Смесь перемешивают при температуре окружающей среды в течение 2,25 ч и концентрируют в вакууме. Остаток растворяют в 250 мл этилацетата и промывают один раз 200 мл 1N соляной кислоты, один раз 100 мл воды и один раз 100 мл насыщенного раствора хлорида натрия. Органический слой сушат (МgSO4),фильтруют и концентрируют в вакууме. Остаток суспендируют в 100 мл гексана, фильтруют и сушат в вакууме, и получают 26,1 г (85%) целевого соединения. Элементный анализ для C7H13NO4S. Вычислено, %: С 36,91; Н 6,71; N 7,17. Найдено,%: С 36,97; Н 6,79; N 7,04. Масс-спектр: М+1 = 196. Б. N-(4-Бромфенил)карбонилметил-N-третбутоксикарбонилметансульфонамид. Раствор 1,0 г (5,1 ммоль) вещества со стадии А, 1,4 г (5,1 ммоль) 2,4'-дибромацетофенона и 0,8 г (5,6 ммоль) карбоната калия в 25 мл ацетонитрила перемешивают при температуре окружающей среды в течение двух часов. Смесь разбавляют 25 мл этилацетата и промывают один раз 15 мл воды. Органический слой отделяют, и водный слой экстрагируют три раза этилацетатом, каждый раз по 10 мл. Объединенные органические фракции сушат (MgSO4),фильтруют и концентрируют в вакууме. Хроматография остатка (50 г силикагеля, 20% этилацетата в гексане) дает 1,5 г (76%) целевого соединения. Элементный анализ для C14H17NBrO5S. Вычислено%,: С 42,87; Н 4,63; N 3,57. Найдено,%: С 43,11; Н 4,66; N 3,37. Масс-спектр: М-1 = 391. В. N-[2-(4-Бромфенил)-2-гидроксиэтил]-N(трет-бутоксикарбонил)метансульфонамид. К раствору 2,6 г (6,7 ммоль) вещества со стадии Б в 25 мл этанола добавляют 0,3 г (6,7 ммоль) борогидрида натрия, и смесь перемешивают в течение 16 ч. Смесь концентрируют в вакууме, и остаток обрабатывают 25 мл этилацетата и 25 мл воды. Органический слой отде 37 ляют, и водный слой экстрагируют три раза этилацетатом, каждый раз по 10 мл. Объединенные органические фракции сушат (MgSO4),фильтруют и концентрируют в вакууме, и получают 2,6 г (98%) целевого соединения. Элементный анализ для C14H19NBrO5S. Вычислено,%: С 42,65; Н 5,11; N 3,55. Найдено,%: С 42,60; Н 5,08; N 3,46. Масс-спектр: М = 394. Г. К обезгаженному раствору 0,6 г (1,5 ммоль) вещества со стадии В и 0,8 г (1,5 ммоль) вещества из получения 40 в 5 мл толуола добавляют 0,08 г (0,07 ммоль) тетракис(трифенилфосфин)палладия(0). Смесь кипятят с обратным холодильником в течение 16 ч, охлаждают до температуры окружающей среды и разбавляют 10 мл этилацетата. Смесь промывают один раз 8 мл насыщенного водного раствора фторида калия, органический слой отделяют, и водный слой экстрагируют четыре раза этилацетатом,каждый раз по 5 мл. Объединенные органические фракции сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (50 г силикагеля, 50% этилацетата в гексане) дает 0,3 г (32%) целевого соединения. Элементный анализ для С 26 Н 38N2O7S20,05 СНСl3 Вычислено,%: С 55,80; %Н 6,84; N 5,00. Найдено, %: С 55,47; Н 6,93; N 4,72. Масс-спектр: М = 554. Получение 45. Дибромформальдоксим. Раствор 150 г (1,6 моль) глиоксиловой кислоты и 142 г (2,0 моль) гидрохлорида гидроксиламина в 1200 мл воды перемешивают в течение 2 суток. К смеси постепенно добавляют 342 г (4,1 моль) бикарбоната натрия и 1000 мл дихлорметана. Смесь охлаждают до 0 С, и добавляют по каплям раствор 147 мл (2,8 моль) брома в 700 мл дихлорметана. Смесь перемешивают при температуре окружающей среды в течение 18 ч. Органический слой отделяют, и водный слой экстрагируют три раза дихлорметаном, каждый раз по 300 мл. Объединенные органические экстракты сушат (МgSO4), фильтруют и концентрируют в вакууме, и получают 93,1 г (28%) целевого соединения. Получение 46. 2-Триметилстаннилтиазол. А. К охлажденному до -78 С раствору 5,0 г(58,7 ммоль) тиазола в 120 мл тетрагидрофурана добавляют 36,7 мл (58,7 ммоль) 1,6 М раствора н-бутиллития в гексане. Смесь перемешивают в течение 20 мин, после чего добавляют по каплям, в течение 15 мин, раствор 11,7 г (58,7 ммоль) хлорид триметилолова в 15 мл тетрагидрофурана. Охлаждающую баню удаляют, и смесь перемешивают в течение двух часов. Смесь разбавляют 100 мл воды и экстрагируют три раза по 100 мл этилового эфира. Объединенные органические фракции сушат (MgSO4),фильтруют и концентрируют в вакууме. Остаток растворяют в 50 мл этилового эфира, фильт 001919 38 руют через силикагель и концентрируют в вакууме, и получают 3,6 г (24%) целевого соединения. Получение 47. N-2-(4-Бромфенил)этил-2 пропансульфонамид. К раствору 10,0 г (50 ммоль) 4 бромфенетиламина и 7,6 мл (55 ммоль) триэтиламина в 150 мл дихлорметана добавляют по каплям раствор 6,2 мл (55 ммоль) изопропилсульфонилхлорида в 40 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 18 ч. Смесь промывают 100 мл 1N соляной кислоты, органический слой отделяют, и водный слой экстрагируют один раз 100 мл дихлорметана. Объединенные органические части сушат (Na2SO4), фильтруют и концентрируют в вакууме, и получают 6,7 г (44%) целевого соединения. Получение 48. N-2-(4-(Три-н-бутилстаннил)фенил)этил-2-пропансульфонамид. К раствору 5,0 г (16,3 ммоль) вещества из получения 47, 9,9 г (17,1 ммоль) бис-три-нбутилстаннана и 2,3 мл (16,3 ммоль) триэтиламина в 55 мл толуола добавляют 0,9 г (0,8 ммоль) тетракис(трифенилфосфин)палладия (0). Смесь греют при 100 С в течение 18 ч. Смесь охлаждают до комнатной температуры, и добавляют 55 мл 10% водного раствора бисульфата натрия. Органический слой отделяют, и водный слой экстрагируют два раза простым эфиром,каждый раз по 20 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (400 г силикагеля, 25% этилацетата в гексане) дает 3,5 г (42%) целевого соединения. Получение 49. 4-(4-Бромфенил)-1,1 диоксотетрагидро-1,2-тиазин. А. Этил-4-бромфенилацетат. Раствор 25,0 г (116,3 ммоль) 4-бромфенилуксусной кислоты, 24,1 г (174,4 ммоль) карбоната калия и 10,2 мл (127,9 ммоль) йодметана в 250 мл ацетонитрила греют при 70 С в течение 16 ч. Смесь охлаждают до температуры окружающей среды, разбавляют 200 мл этилацетата и промывают один раз 200 мл насыщенного водного раствора бикарбоната натрия. Органический слой отделяют, и водный слой экстрагируют три раза этилацетатом, каждый раз по 75 мл. Объединенные органические части сушат(MgSO4), фильтруют и концентрируют в вакууме, и получают 16,2 г (57%) целевого соединения. Б. Фенил-3-карбэтокси-3-(4-бромфенил) пропилсульфонат. Раствор 16,2 г (66,6 ммоль) вещества со стадии А, 4,6 г (33,3 ммоль) карбоната калия и 4,4 г (16,7 ммоль) 18-краун-6 в 130 мл толуола нагревают до 90 С, и добавляют по каплям в течение одного часа 6,1 г (33,3 ммоль) фенилвинилсульфоната в 35 мл толуола. Смесь греют в течение 16 ч, охлаждают до температуры окружающей среды и разбавляют 100 мл этилацета 39 та. Смесь промывают один раз 100 мл полунасыщенного солевого раствора. Органический слой отделяют, и водный слой экстрагируют один раз 50 мл этилацетата. Объединенные органические части сушат (МgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (Waters 2000, 15% этилацетата в гексане) дает 4,8 г (17%) целевого соединения. Элементный анализ для C18H19O5SBr. Вычислено,%:С 50,59; Н 4,48. Найдено, %: С 50,61; %Н 4,47. Масс-спектр: М+1 = 428. В. Фенил-3-карбокси-3-(4-бромфенил) пропилсульфонат. К раствору 4,8 г (11,3 ммоль) вещества со стадии Б в 40 мл метанола добавляют 6,8 мл 2N водного раствора гидроксида натрия. Смесь перемешивают при температуре окружающей среды в течение 5 ч и концентрируют в вакууме. Остаток растворяют в 50 мл воды и экстрагируют три раза этиловым эфиром, каждый раз по 20 мл. Водный слой подкисляют до рН 2 10% водным раствором бисульфата натрия и экстрагируют четыре раза этилацетатом, каждый раз по 20 мл. Объединенные этилацетатные слои сушат(MgSO4), фильтруют и концентрируют в вакууме, и получают 4,1 г (91%) целевого соединения. Элементный анализ для C16H15O5SBr. Вычислено,%: С 48,13; Н 3,79. Найдено,%:С 48,17; Н 3,53. Масс-спектр: М = 399. Г. Фенил-3-карбоксамидо-3-(4-бромфенил) пропилсульфонат. К охлажденному до 0 С раствору 4,1 г(10,2 ммоль) вещества со стадии В и 2,0 мл (14,3 ммоль) триэтиламина в 23 мл тетрагидрофурана добавляют 1,9 мл (14,3 ммоль) изобутилхлорформиата. Смесь перемешивают при 0 С в течение 25 мин, после чего добавляют 11,2 мл(22,4 ммоль) 2N раствора аммиака в метаноле. Охлаждающую баню убирают, и смесь перемешивают в течение 16 ч. Смесь разбавляют 50 мл этилацетата и промывают один раз 50 мл воды. Органический слой отделяют, и водный слой экстрагируют три раза этилацетатом, каждый раз по 25 мл. Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (250 г силикагеля, 35% ацетона в гексане) дает 1,7 г (44%) целевого соединения. Масс-спектр: М = 398. Д. 4-(4-Бромфенил)-1,1,3-триоксотетрагидро-1,2-тиазин. К охлажденному до 0 С раствору 9,0 мл(9,0 ммоль) 1,0 М раствора в тетрагидрофуране трет-бутоксида калия в 15 мл тетрагидрофурана добавляют по каплям в течение 30 мин раствор 1,7 г (4,5 ммоль) вещества со стадии Г в 14 мл тетрагидрофурана. После перемешивания при 0 С в течение двух часов охлаждающую баню убирают, и продолжают перемешивание в тече 001919 40 ние 30 мин. Смесь разбавляют 25 мл воды и экстрагируют два раза этиловым эфиром, каждый раз по 10 мл. Водную часть подкисляют до рН 2 10% водным раствором бисульфата натрия и экстрагируют четыре раза этилацетатом, каждый раз по 20 мл. Объединенные этилацетатные слои сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (75 г силикагеля, 0,25% уксусной кислоты и 40% ацетона в гексане) дает 0,2 г (17%) целевого соединения. Элементный анализ для С 10 Н 10NО 3SВr. Вычислено, %: С 39,49; Н 3,31; N 4,61. Найдено, %: С 39,74; Н 3,23; N 4,42. Масс-спектр: М = 304. Е. К суспензии 0,13 г (0,4 ммоль) вещества со стадии Д и 0,2 г (4,9 ммоль) борогидрида натрия в 3 мл диоксана постепенно, через шприц,добавляют 0,4 мл (4,9 ммоль) трифторуксусной кислоты. После перемешивания при температуре окружающей среды в течение 30 мин смесь кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают до температуры окружающей среды, разбавляют 3 мл метанола и перемешивают в течение 16 ч. Смесь снимают с нагревательного устройства, и продолжают перемешивание в течение 30 мин. Смесь концентрируют в вакууме, растворяют в 10 мл этилацетата и промывают два раза 1N соляной кислотой,каждый раз по 5 мл, и один раз 5 мл солевого раствора с 20% насыщенного водного раствора бикарбоната натрия. Органические слои сушат(МgSO4), фильтруют и концентрируют в вакууме, и получают 0,1 г (89%) целевого соединения. Элементный анализ для С 10 Н 12NO3SBr. Вычислено, %: С 41,39; Н 4,17; N 4,83. Найдено, %:С 41,10; Н 4,34; N 4,76. Масс-спектр: М-1 = 289. Получение 50. Гидрохлорид метилового эфира D,L-пеницилламина. Через суспензию 10,0 г (67,0 ммоль) D,Lпеницилламина в 200 мл метанола в течение 5 мин барботируют хлористый водород. Смесь кипятят с обратным холодильником в течение 16 ч, охлаждают до температуры окружающей среды и концентрируют в вакууме. Остаток суспендируют в этиловом эфире, отфильтровывают и сушат, и получают 12,6 г (94%) целевого соединения. Масс-спектр: М = 163. Получение 51. N-(Трет-бутоксикарбонил)4-трибутилстанниланилин. А. N-(Трет-бутоксикарбонил)-4-броманилин. К раствору 6,0 г (39,4 ммоль) 4 броманилина в 30 мл тетрагидрофурана добавляют 69,8 мл (69,8 ммоль) 1,0 М раствора бис(триметилсилил)амида натрия в тетрагидрофуране. К смеси добавляют 7,6 г (34,9 ммоль) ди-трет-бутилдикарбоната в 10 мл тетрагидрофурана. Смесь перемешивают при температуре 41 окружающей среды в течение одного часа и концентрируют в вакууме. Остаток растворяют в 50 мл этилацетата и промывают один раз 50 мл 10% водного раствора бисульфата натрия. Органический слой отделяют, и водный слой экстрагируют два раза этилацетатом, каждый раз по 25 мл. Объединенные органические слои сушат (МgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (250 г силикагеля, 10% этилацетата в гексане) дает 5,0 г(53%) целевого соединения. Элементный анализ для C11H14NO2Br. Вычислено, %: С 48,55; Н 5,19; N 5,15. Найдено, %: С 48,81; Н 5,29; N 4,95. Масс-спектр: М-1 = 271. Б. Обезгаженный раствор 4,9 г (18,0 ммоль) вещества со стадии А, 2,6 мл (18,9 ммоль) триэтиламина, 9,6 мл (18,9 ммоль) бис(трибутилолова) и 1,0 г (0,9 ммоль) тетракис(трифенилфосфин)палладия(0) в 45 мл толуола греют при 100 С в течение 5 ч. Смесь охлаждают до температуры окружающей среды и разбавляют 40 мл этилацетата. Смесь промывают один раз 50 мл 10% водного раствора бисульфата натрия, органические вещества отделяют, и водный слой экстрагируют три раза этилацетатом, каждый раз по 20 мл. Объединенные органические слои сушат (MgSO4),фильтруют и концентрируют в вакууме. Хроматография остатка (400 г силикагеля, 5% этилацетата в гексане) дает 1,4 г (16%) целевого соединения. Масс-спектр: М+1 = 483. Получение 52. N-2-(4-три-н-бутилстаннилфенил)пропилметансульфонамид. Целевое соединение (3,6 г) получают способом получения 40, исходя из продукта примера 1. Получение 53. N-2-(4-(3-тиенил)фенил) пропиламин. А. 2-(3-тиенил)фенил)-N-(трет-бутоксикарбонил)пропиламин. К раствору 0,7 г (2,2 ммоль) вещества из получения 4, 0,3 г (2,4 ммоль) тиофен-3 бороновой кислоты и 0,46 г (3,3 ммоль) карбоната калия в 5 мл диоксана и 1 мл воды добавляют 0,025 г (0,11 ммоль) ацетата палладия(II) и 0,058 г (0,22 ммоль) трифенилфосфина. Смесь греют при 100 С в течение 18 час. Смесь охлаждают до комнатной температуры, и добавляют 5 мл солевого раствора. Органический слой отделяют и сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (25 г силикагеля, 25% этилацетата в гексане) дает 0,44 г (60%) целевого соединения. Б. Раствор 0,4 г (1,3 ммоль) вещества из получения 53 А в 4 мл дихлорметана и 1 мл трифторуксусной кислоты перемешивают при температуре окружающей среды в течение 3 ч. Смесь концентрируют в вакууме, и остаток растворяют в 5 мл этилацетата и 5 мл насыщенного раствора бикарбоната натрия. Органический 42 слой отделяют, и водный слой три раза экстрагируют по 5 мл этилацетата. Объединенные органические слои сушат (МgSO4), фильтруют и концентрируют в вакууме, и получают 0,21 г(74%) целевого соединения. Получение 54 А. 4-(N,N-Дибензиламино) фенилацетонитрил. Раствор 4-аминофенилацетонитрила (20 г,151,3 ммоль) в сухом ДМФА (150 мл) обрабатывают карбонатом калия (50,1 г, 363,1 ммоль),бензилбромидом (54,4 г, 318 ммоль) и йодидом калия (5 г, 30,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. К смеси добавляют воду (100 мл), и экстрагируют простым эфиром органические вещества (3 х 200 мл). Объединенную органическую фракцию промывают солевым раствором(200 мл), сушат над сульфатом натрия и концентрируют. Затем сырой продукт очищают флэшхроматографией (SiO2, 20% EtOAc в гексане), и получают 36,2 г (76%) чистого продукта. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 312. Получение 54 Б. 1-Хлорпроп-2-илсульфонилхлорид. К охлажденному до 0 С насыщенному раствору хлора в 100 мл воды добавляют по каплям 15,7 мл (200 ммоль) пропиленсульфида при барботировании через смесь хлора. Смесь после добавления перемешивают при 0 С в течение одного часа. Полученное масло отделяют, а водную часть экстрагируют два раза дихлорметаном, каждый раз по 20 мл. Объединенные органические слои сушат (CaCl2), фильтруют и концентрируют в вакууме. Вакуумная перегонка дает 10,8 г (30%) целевого соединения. Масс-спектр (полевая десорбция): М-1 = 176. Получение 55 2-(4-(N,N-Дибензиламино) фенил)пропионитрил. Охлажденный до -78 С раствор вещества из получения 54 А (22,8 г, 73 ммоль) в сухом ТГФ (70 мл) обрабатывают бис(триметилсилил) амидом лития (1 М раствор в ТГФ, 76,6 мл, 76,6 ммоль). Полученную смесь перемешивают при-78 С в течение 1 ч. К смеси добавляют метилйодид (4,8 мл, 76,6 ммоль). Реакционную смесь перемешивают при -78 С в течение 1 ч, и постепенно, в течение 12 ч, нагревают до комнатной температуры. К смеси добавляют соляную кислоту (0,2 М, 100 мл), и органические вещества экстрагируют простым эфиром (3 х 200 мл). Объединенную органическую фракцию промывают водой (3 х 200 мл), солевым раствором (200 мл), сушат над сульфатом натрия и концентрируют. Затем сырой продукт очищают флэш-хроматографией (SiO2, 20% EtOAc в гексане), и получают 22,6 г (95%) чистого продукта. ЯМР соответствует целевому соединению. Масс-спектр (полевая десорбция): М+ = 326. 43 Получение 56. Гидрохлорид 2-(4-(N, Nдибензиламино)фенил)пропиламина. Охлажденный до 0 С раствор вещества из получения 55 (23,6 г, 72,3 ммоль) в сухом ТГФ(10 М раствор в ТГФ, 8 мл, 80 ммоль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 3 ч. Раствор охлаждают до комнатной температуры и обрабатывают насыщенным раствором хлористого водорода в метаноле до тех пор, пока не образуется осадок. Растворитель удаляют в вакууме, и полученное белое твердое вещество растирают в порошок с простым эфиром (4 х 100 мл). Нужный гидрохлорид сушат в вакууме, и получают 28,2 г (97%) чистого продукта, который используют на последующей стадии без дополнительной очистки. ЯМР соответствует строению целевого соединения. Получение 57. N-2-(4-(N',N'-дибензиламино)фенил)пропил-2-пропансульфонамид. Охлажденную до 0 С суспензию вещества из получения 56 (15,2 г, 37,7 ммоль) в дихлорметане (125 мл) обрабатывают три-этиламином(11,4 г, 113 ммоль), а затем 2-пропилсульфонилхлоридом (9,2 г, 56,5 ммоль). Реакционную смесь перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 6 ч. Реакцию останавливают посредством добавления воды (100 мл). Органические вещества экстрагируют дихлорметаном (3 х 200 мл). Объединенную органическую фракцию промывают соляной кислотой (0,2 М, 100 мл), водой (3 х 200 мл), солевым раствором (100 мл), сушат над сульфатом натрия и концентрируют в вакууме,и получают сырое вещество, которое затем очищают флэш-хроматографией (SiO2, 30%EtOAc в гексане), и получают 10,32 г (63%) целевого соединения. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 436. Получение 58. N-2-(4-Аминофенил)пропил-2-пропансульфонамид. Раствор продукта получения 57 (2,5 г, 5,72 ммоль) в EtOH (30 мл) обрабатывают формиатом аммония (0,4 г, 6,3 ммоль) и палладием-наугле (0,25 г, 10 мол. %). Реакционную смесь перемешивают при комнатной температуре в течение 6 ч. Смесь фильтруют через слой целита, и фильтрат концентрируют в вакууме, и получают 1,36 г (93%) чистого продукта. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 257. Получение 59. N-трет-бутилоксикарбонилN-2-(4-(N',N'-дибензиламино)фенил)пропил-2 пропансульфонамид. Раствор вещества из получения 57 (2,5 г,5,72 ммоль) в сухом дихлорметане (25 мл) обрабатывают ди-трет-бутилдикарбонатом (1,47 г,6,3 ммоль) и 4-диметиламинопиридином (0,37 г, 001919 44 2,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Реакцию останавливают посредством добавления воды (20 мл). Органические вещества экстрагируют простым эфиром (3 х 30 мл). Объединенную органическую фракцию промывают 20% раствором гидросульфата натрия (2 х 30 мл),водой (3 х 100 мл), солевым раствором (30 мл),сушат над сульфатом натрия и концентрируют в вакууме, и получают сырое вещество, которое затем очищают флэш-хроматографией (SiO2,30% EtOAc в гексане), и получают 3,07 г (100%) целевого соединения. ЯМР соответствует целевому соединению. Масс-спектр (полевая десорбция): М+ =XXX. Получение 60. N-Трет-бутилоксикарбонилN-2-(4-аминофенил)пропил-2-пропансульфонамид. Раствор продукта получения 59 (3,07 г,5,72 ммоль) в EtOH (30 мл) обрабатывают формиатом аммония (0,54 г, 8,6 ммоль) и палладием-на-угле (0,3 г, 10 мол.%). Реакционную смесь перемешивают при комнатной температуре в течение 6 час. Смесь фильтруют через слой целита, и фильтрат концентрируют в вакууме, и получают 1,9 г (93%) целевого соединения. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 257. Получение 61. 2-(4-Нитрофенил)пропионитрил. Охлажденный до -15 С раствор 4 нитроацетофенона (16,5 г, 100 ммоль) и тозилметилизоцианида (29,3 г, 150 ммоль) в метоксиэтиловом эфире (400 мл) постепенно обрабатывают раствором трет-бутоксида калия (28 г, 250 ммоль) в трет-бутаноле (200 мл) комнатной температуры. Реакционную смесь перемешивают при -15 С в течение 1 ч, и затем в течение ночи нагревают до комнатной температуры. К смеси добавляют воду (100 мл), и органические вещества экстрагируют простым эфиром (3 х 200 мл). Объединенную органическую фракцию промывают водой (3 х 200 мл), солевым раствором (100 мл), сушат над сульфатом натрия и концентрируют в вакууме, и получают сырое вещество, которое затем очищают флэшхроматографией (SiO2, 30% EtOAc в гексане), и получают 13,6 г целевого соединения. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 225. Получение 62. 2-(4-Нитрофенил)пропиламин. Охлажденный до 0 С раствор вещества из получения 61 (11,8 г, 67 ммоль) в сухом ТГФ(200 мл) обрабатывают борантетрагидрофураном (1 М раствор в ТГФ, 72 мл, 72 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. К реак 45 ционной смеси постепенно добавляют раствор смеси ТГФ с МеОН (1:1, 10 мл) и 5 н. раствора гидроксида натрия (40 мл), и смесь кипятят с обратным холодильником в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры. Органические вещества экстрагируют дихлорметаном (3 х 100 мл). Объединенную органическую фракцию промывают водой (3 х 200 мл), солевым раствором (100 мл), сушат над карбонатом калия и концентрируют в вакууме, и получают сырое вещество, которое затем очищают флэш-хроматографией (SiO2, 5% МеОН вCH2Cl2), и получают 8,5 г (71%) чистого продукта. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 181. Получение 63. N-2-(4-Нитрофенил)пропил 2-пропансульфонамид. Охлажденную до 0 С суспензию вещества из получения 62 (8,2 г, 45,3 ммоль) в дихлорметане (200 мл) обрабатывают 1,8-диазабицикло[5.4.0]ундеценом (7,6 г, 49,8 ммоль), а затем 2 пропилсульфонилхлоридом (12 г, 49,8 ммоль). Реакционную смесь перемешивают при 0 С в течение 1 ч и еще при комнатной температуре в течение 12 ч. Реакцию останавливают посредством добавления воды (100 мл). Органические вещества экстрагируют дихлорметаном (3 х 200 мл). Объединенную органическую фракцию промывают водой (3 х 200 мл), солевым раствором (100 мл), сушат над карбонатом калия и концентрируют в вакууме, и получают сырое вещество, которое затем очищают флэшхроматографией (SiO2, 30% EtOAc в гексане), и получают 8,9 г (68%) чистого продукта. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 287. Получение 64. N-2-(4-Аминофенил)пропил-2-пропансульфонамид. Обезгаженный раствор вещества из получения 63 (8,75 г, 31 ммоль) в этилацетате (200 мл) обрабатывают палладием-на-угле (4 г, 50 мол.%). Смесь встряхивают при давлении водорода 413,7 кПа (60 ф/д 2) в течение 2 ч. Реакционную смесь фильтруют через слой целита, и фильтрат концентрируют в вакууме, получают 7,44 г (94%) чистого продукта. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): M+ = 257. Получение 65. N-2-(4-Бензиламино)фенил) пропил-2-пропансульфонамид. В трубе высокого давления обезгаженный раствор бромида из получения 39 (3 г, 9,7 ммоль) в безводном толуоле (40 мл) обрабатывают бензиламином (1,27 мл, 11,6 ммоль), трис(дибензил-иденацетон)дипалладием(0) (170 мг,0,19 ммоль), S(-)-BINAP (360 мг, 0,58 ммоль) и трет-бутоксидом натрия (1,95 мг, 20,3 ммоль). Реакционную смесь перемешивают при 80 С в течение 16 ч. Смесь охлаждают до комнатной 46 температуры. К смеси добавляют воду (5 мл), и органические вещества экстрагируют эфиром(3 х 5 мл). Объединенную органическую фракцию промывают водой (2 х 5 мл), солевым раствором (5 мл), сушат над сульфатом натрия и концентрируют в вакууме, и получают сырой продукт, который затем очищают флэшхроматографией (SiO2, 20% EtOAc в гексане), и получают 1,9 г (58%) целевого соединения в виде желтого масла. ЯМР соответствует строению целевого соединения. Получение 66. 2-(4-Аминофенил)пропил-2 пропансульфонамид. Раствор продукта получения 65 (1,5 г, 4,33 ммоль) в EtOAc (30 мл) обрабатывают формиатом аммония (0,41 г, 6,5 ммоль) и палладием-наугле (0,15 г, 10 мол.%). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Смесь фильтруют через слой целита,и фильтрат концентрируют в вакууме, получают 1,1 г (98%) целевого соединения. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 257. Получение 67. N-2-(4-Карбокси)фенил) пропил-2-пропансульфонамид. Охлажденный до -85 С раствор продукта получения 39 (220 мг, 0,65 ммоль) в сухом ТГФ(0,87 мл, 1,37 ммоль, 1,6 М раствор). Реакционную смесь перемешивают в течение 10 мин при-85 С, и затем через смесь в течение 1 мин барботируют газообразный диоксид углерода. Реакционную смесь нагревают до комнатной температуры. К смеси добавляют воду (5 мл) и концентрированную соляную кислоту (3 мл), и органические вещества экстрагируют простым эфиром (3 х 10 мл). Объединенные органические фракции промывают водой (2 х 10 мл), солевым раствором (5 мл), сушат над сульфатом натрия и концентрируют в вакууме, получают 210 мг (98%) чистого продукта, который используют на последующей стадии без дополнительной очистки. Получение 68. N-Трет-бутилоксикарбонил 4-пиперазиноацетофенон. Раствор 4-пиперазиноацетофенона (10 г, 49 ммоль) в смеси тетрагидрофурана с водой (200 мл, 1:1) обрабатывают карбонатом калия (8,43 г,58 ммоль) и ди-трет-бутилдикарбонатом (13,1 г,53,9 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. К смеси добавляют воду (300 мл), и органические вещества экстрагируют этилацетатом (3 х 100 мл). Объединенную органическую фракцию промывают водой (2 х 200 мл), солевым раствором (100 мл), сушат над сульфатом натрия и концентрируют в вакууме до 17,41 г желтоватого твердого вещества. Затем сырой продукт очищают препаративной ЖХ 2000 с элюированием 30% EtOAc в гексане, и получают 10,9 г(73%) целевого соединения в виде белого твердого вещества. Масс-спектр (полевая десорбция): М+ = 305. Получение 69. 2-(N-Трет-бутилоксикарбонил-4-пиперазинофенил)пропионитрил. Целевое соединение (1,8 г, 16%) получают в виде твердого вещества по способу получения 61, исходя из продукта получения 68 и используя тозилметилизоцианид. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 316. Получение 70. 2-(N-Трет-бутилоксикарбонил-4-пиперазинофенил)пропиламин. Целевое соединение (1,78 г, 100%) получают в виде твердого вещества по способу получения 62, исходя из продукта получения 69 и используя боранметилсульфид. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция) : М+ = 319. Получение 71. N-2-(N-Трет-бутилоксикарбонил-4-пиперазинофенил)пропил-2-пропансульфонамид. Целевое соединение (676 мг, 61%) получают в виде твердого вещества по способу получения 63, исходя из продукта получения 70 и используя боранметилсульфид. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 319. Получение 72. N-2-(4-пиперазинофенил) пропил-2-пропансульфонамид. Раствор вещества из получения 71 (800 мг,1,88 ммоль) в дихлорметане (10 мл) обрабатывают трифторуксусной кислотой (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. К смеси добавляют 1 н. раствор гидроксида натрия (10 мл), и органические вещества экстрагируют дихлорметаном (3 х 20 мл). Объединенную органическую фракцию промывают водой (2 х 20 мл), солевым раствором (20 мл), сушат над карбонатом калия и концентрируют в вакууме, и получают 560 мг(91%) чистого продукта. ЯМР соответствует целевому соединению. Масс-спектр (полевая десорбция) : М+ = 319. Получение 73. N-2-(N-бензоил-4-пиперазинофенил)пропил-2-пропансульфонамид. Охлажденный до 0 С раствор вещества из получения 72 (80 мг, 0,25 ммоль) в дихлорметане (10 мл) обрабатывают триэтиламином (28 мг,0,27 ммоль) и ангидридом бензойной кислоты(61 мг, 0,27 ммоль). Реакционную смесь перемешивают при 0 С в течение 30 мин. К смеси добавляют воду (5 мл), и органические вещества экстрагируют дихлорметаном (3 х 5 мл). Объединенную органическую фракцию промывают водой (2 х 5 мл), солевым раствором (5 мл), сушат над карбонатом калия и концентрируют в 48 вакууме, и получают 94 мг (87%) целевого соединения. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 430,2. Получение 74. 3-Трибутилолово-2-циклопентен-1-он. Охлажденный до -20 С раствор гексабутилдиолова (4,6 г, 7,9 ммоль) в сухом ТГФ (15 мл) обрабатывают н-BuLi (4,9 г, 7,9 ммоль, 1,6 М раствор в гексане). Реакционную смесь перемешивают при -20 С в течение 30 мин, и затем охлаждают до -78 С. Реакционную смесь обрабатывают 3-этокси-2-циклопентен-1-оном (1,0 г,7,9 ммоль), и затем перемешивают при -78 С в течение 30 мин. Добавляют насыщенный водный раствор хлорида аммония (2 мл), а затем воду (30 мл), и органические вещества экстрагируют гексаном (2 х 30 мл). Объединенные органические слои промывают солевым раствором (20 мл), сушат над сульфатом магния и концентрируют в вакууме. При этом получают 2,7 г (93%) неочищенного продукта, который используют без дополнительной очистки. ЯМР соответствует строению целевого соединения. Получение 75. N-2-(4-(1-(3-Оксо)циклопентенил)фенил)пропил-2-пропансульфонамид. Раствор продукта получения 39 (1,0 г, 3,22 ммоль) в сухом обезгаженном ТГФ (15 мл) обрабатывают продуктом получения 74 (1,8 г, 4,83 ммоль) и дихлорбис(трифенилфосфин)палладием(II) (45 мг, 0,06 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 48 ч. Смесь охлаждают и обрабатывают ацетонитрилом и гексаном. Ацетонитрильный слой промывают гексаном (3 х 20 мл), и затем концентрируют в вакууме. Затем сырой продукт очищают флэш-хроматографией (SiO2, 70%EtOAc в гексане), и получают 0,71 г (68%) целевого соединения как чистый продукт. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 321,1. Получение 76. 1-(4-Бромфенил)-2,5-диметилпиррол. Помещают в толуол (500 мл) 4 броманилин (56,0 г, 0,33 моль), 2,5-гександион(37,6 г, 0,33 моль) и уксусную кислоту (5 мл), и кипятят с обратным холодильником в течение 8 ч с использованием ловушки Дина-Старка для удаления воды из реакционной смеси. Реакционную смесь охлаждают до комнатной температуры и концентрируют при низком вакууме. Полученное масло растворяют в этилацетате,промывают по одному разу 2 н. соляной кислотой, 2N раствором NaOH и H2O, сушат надNa2SO4 и концентрируют при низком вакууме,получают коричневое твердое вещество. Вещество очищают посредством флэш-хроматографии на силикагеле с элюированием гексаном. Концентрирование соответствующих 49 фракций дает 55,0 г (68%) светло-желтого твердого вещества. ЯМР соответствует целевому соединению. Масс-спектр (полевая десорбция): М+ 249,т.пл. 71-73 С. Получение 77. 1-(4-Ацетилфенил)-2,5 диметилпиррол. Охлажденный до -30 С раствор вещества из получения 76 (25,0 г, 0,1 моль) в сухом простом эфире (500 мл) обрабатывают нбутиллитием (70 мл 1,6 М раствора, 0,12 моль), и перемешивают в течение одного часа при -30 С. Добавляют N,N-диметилацетамид (9,7 г, 0,12 моль), и реакцию продолжают при той же температуре в течение 4 ч. Затем реакционную смесь нагревают до комнатной температуры и перемешивают при этой температуре в течение ночи. Утром смесь разбавляют этилацетатом, и объединенные органические слои промывают по одному разу 2,0 н. соляной кислотой и Н 2 О,сушат над Na2SO4 и концентрируют при низком вакууме, получают белое твердое вещество. Это вещество растирают в порошок в гексане и фильтруют, и получают 12,8 г (60%) белого твердого вещества, т.пл. 106-108 С. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ = 214. Получение 78. 1-(4-(1-Циано)этилфенил)2,5-диметилпиррол. Исходный кетон из получения 77 (44,3 г,0,21 моль), тозилметилизоцианид (40,6 г, 0,21 моль), трет-бутоксид калия (39,2 г, 0,35 моль) и трет-бутиловый спирт (250 мл) подвергают взаимодействию в диметиловом эфире этиленгликоля (500 мл) так, как описано в получении 61, и получают желтое твердое вещество. Это вещество очищают флэш-хроматографией на силикагеле с элюированием гексаном с этилацетатом, 4:1, и получают 32,3 г (68%) желтых кристаллов, т.пл. 79-80 С. Масс-спектр (полевая десорбция): М+ 225. Получение 79. 1-(4-(2-(2-циано)пропил) фенил)-2,5-диметилпиррол. Охлажденный до -78 С раствор вещества из получения 78 (7,0 г, 32 ммоль) в сухом тетрагидрофуране (100 мл) обрабатывают (бис)триметилсилиламидом лития (40 мл 1,0 М раствора,1,3 экв). После перемешивания при этой температуре в течение 30 мин добавляют по каплям метилйодид (2,6 мл, 1,3 экв), и реакционную смесь нагревают до комнатной температуры. Смесь разбавляют простым эфиром, и объединенные органические слои промывают один раз Н 2 О, сушат над К 2 СО 3 и концентрируют при низком вакууме, получают 7,61 г желтого твердого вещества. Вещество очищают хроматографией на силикагеле с элюированием смесью гексана с этилацетатом, 9:1, и получают 6,30 г 50 Масс-спектр (полевая десорбция): М 1 239. Получение 80. 1-(4-(2-(3-Амино-2 метил)пропил)фенил)-2,5-диметилпиррол. Нитрил из получения 79 (6,23 г, 26,2 ммоль) в тетрагидрофуране (250 мл) обрабатывают комплексом боран-ТГФ (17,1 мл, 1,0 М раствор), как описано в получении 62, и получают 6,37 г пенистого вещества. Это вещество очищают хроматографией на силикагеле с элюированием растворителем с градиентом от дихлорметана до смеси дихлорметана с метанолом, 9:1, и получают 4,08 г (65%) белого твердого вещества, т.пл. 95-97 С. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ 243. Получение 81. N-2-(4-(2,5-Диметилпиррол) фенил)-2-метилпропил-2-пропансульфонамид. Амин из получения 80 (4,0 г, 16,6 ммоль) обрабатывают 1,8-диазабицикло[5.4.0]ундеценом (3,28 г, 1,3 экв) и 2-пропилсульфонилхлоридом (3,2 мл, 1,3 экв) в дихлорметане (80 мл),как описано в получении 63, получают 6,1 г желтого масла. Это вещество очищают хроматографией на силикагеле с элюированием изократным растворителем из гексана и этилацетата, 4:1, и получают 4,3 г (62%) белого твердого вещества, т.пл. 110-112 С. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ 349. Получение 82. N-2-(4-Аминофенил)-2-метилпиррол-2-пропансульфонамид. Сульфонамид из получения 81 (2,17 г, 6,3 ммоль) обрабатывают гидрохлоридом гидроксиламина (2,0 г, 13,8 ммоль) и гидроксидом калия (0,96 г, 20,0 ммоль) в абсолютном этаноле(16 мл) и воде (6 мл). Эту смесь кипятят с обратным холодильником в течение 24 ч. Раствор охлаждают до комнатной температуры и выливают в H2O, и нужный продукт экстрагируют простым эфиром. Органический слой промывают один раз Н 2 О обратной струй, сушат над К 2 СО 3 и концентрируют при пониженном давлении, и получают 1,57 г вещества в виде масла. Это вещество очищают хроматографией на силикагеле с элюированием изократным растворителем из гексана и этилацетата, 1:1, и получают 1,41 г (84%) белого твердого вещества, т.пл. 8788 С. ЯМР соответствует строению целевого соединения. Масс-спектр (полевая десорбция): М+ 271. Получение 83. N-2-(4-Нитрофенил)пропилN,N-диметилсульфамид. Нитроамин из получения 62 (1,8 г, 0,01 моль) обрабатывают 1,8-диазабицикло[5.4.0] ундеценом (1,70 г, 1,1 экв) и N,N-диметилсульфамоилхлоридом (2,1 мл, 1,1 экв) в дихлорметане (40 мл) так, как указано в получении 63, и получают 3,60 г вещества в виде темного масла. Это вещество очищают хроматографией на силикагеле с элюированием растворителем с 51 градиентом от гексана с этилацетатом 9:1 до гексана с этилацетатом 7:3, и получают 1,0 г(50%) белого твердого вещества, т.пл. 79-81 С. Масс-спектр (полевая десорбция): М+ 288. Получение 84. N-2-(4-Аминофенил)пропил-N,N-диметилсульфамид. Нитросульфамид из получения 83 (1,0 г,3,5 ммоль) обрабатывают 5% Pd/C (2,0 г, избыток) и водородом в этилацетате (100 мл) так, как описано в получении 64, и получают 820 мг(91%) белого твердого вещества, т.пл. 101,5103 С. Масс-спектр (полевая десорбция): М+ 258. Получение 85. 4-Бромфенилацетилхлорид. Раствор 50,0 г (232 ммоль) 4-бромфенилуксусной кислоты в 150 мл тионилхлорида перемешивают при комнатной температуре в течение 18 ч. Смесь концентрируют в вакууме, и получают 54 г (100%) целевого соединения. Получение 86.(R)-(-)-4-Бензил-3-(4 бромфенилацетил)-2-оксазолидинон. Раствор 20,0 г (117 ммоль) (R)-(+)-4 бензил-2-оксазолидинона в 300 мл тетрагидрофурана охлаждают до -78 С, и добавляют по каплям 73,0 мл (117 ммоль) 1,6 М раствора нбутиллития. Смесь перемешивают в течение 30 мин, а затем постепенно, при -78 С, к раствору добавляют через канюлю 25 г (107 ммоль) вещества из получения 85 в 150 мл тетрагидрофурана. Смесь перемешивают в течение 1 часа, и затем добавляют 300 мл 10% водного раствора бисульфата натрия. Органический слой отделяют, и водный слой экстрагируют три раза простым эфиром, каждый раз по 100 мл. Объединенные органические экстракты сушат (МgSO4),фильтруют и концентрируют в вакууме. Хроматография остатка (750 г силикагеля, 25% этилацетата в гексане) дает 27,4 г (68 %) целевого соединения. Элементный анализ для C18H16BrNO3. Вычислено, %: С 57,77; Н 4,31; N 3,74. Найдено, %:С 57,62; Н 4,21; N 3,74. Масс-спектр (полевая десорбция): М = 374.[а]D20 = -59,83 (с = 1,04, СНСl3). Получение 87. (-)-4R-Бензил-3-(2R-(4 бромфенил)пропионитрил)-2-оксазолидинон. Раствор 48 г (128 ммоль) вещества из получения 86 в 200 мл тетрагидрофурана охлаждают до -78 С, и добавляют по каплям 141 мл(141 ммоль) 1 М раствора бис(триметилсилил) амида натрия. Смесь перемешивают в течение 60 мин, а затем постепенно добавляют раствор 20 г (141 ммоль) йодметана в 20 мл тетрагидрофурана. Смесь перемешивают в течение 60 мин при -78 С, и затем нагревают до комнатной температуры в течение 60 мин. К реакционной смеси добавляют 10% водный раствор бисульфата натрия, органический слой отделяют, водный слой экстрагируют три раза простым эфиром, каждый раз по 100 мл. Объединенные органические экстракты сушат (MgSO4), фильт 001919 52 руют и концентрируют в вакууме. Хроматография остатка (500 г силикагеля, 25% этилацетата в гексане) дает 28,7 г (58%) целевого соединения. Элементный анализ для C19H18BrNO3. Вычислено, %: С 58,78; Н 4,67; N 3,61. Найдено, %: С 58,81; Н 4,63; N 3,54. Масс-спектр (полевая десорбция): М = 388.[a]D20 = -110,4 (с = 0,96, СНСl3). Получение 88. (R)-(+)-2-(4-Бромфенил) пропанол. Раствор 28,7 г (74 ммоль) вещества из получения 87 в 250 мл простого эфира охлаждают до 0 С, и добавляют по каплям 74 мл (148 ммоль) 2 М раствора литийборогидрида в тетрагидрофуране. Смесь перемешивают в течение 2 ч, затем добавляют 1 н. раствор гидроксида натрия, и смесь перемешивают до тех пор, пока оба слоя - органический и водный - не станут прозрачными. Органический слой отделяют, и водный слой экстрагируют три раза этилацетатом, каждый раз по 10 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (800 г силикагеля, 25% этилацетата в гексане) дает 12,3 г (79%) целевого соединения. Элементный анализ для С 9H11 ВrО. Вычислено, %: С 50,26; Н 5,15. Найдено, %: С 48,96; Н 4,91. Масс-спектр (полевая десорбция): М+1 = 216. [а]D20 = +13,79 (с = 1,06, СНСl3). Получение 89. (R)-2-(4-Бромфенил)пропилметансульфонат. Раствор 12,2 г (56,7 ммоль) вещества из получения 88 и 8,7 мл (62,4 ммоль) триэтиламина в 180 мл дихлорметана охлаждают до 0 С. Добавляют по каплям раствор 4,8 мл (62,4 ммоль) метансульфонилхлорида в 10 мл дихлорметана. Ледяную баню удаляют, и смесь перемешивают при комнатной температуре в течение 2 ч. Затем смесь промывают 200 мл 10% водного раствора бисульфата натрия, органический слой отделяют, и водный слой экстрагируют три раза простым эфиром, каждый раз по 60 мл. Объединенные органические растворы сушат (МgSО 4), фильтруют и концентрируют в вакууме, и получают 15,9 г (96%) целевого соединения. Получение 90. (R)-2-(4-бромфенил)пропилазид. Раствор 15,8 г (54 ммоль) вещества из получения 89 в 180 мл N,N-диметилформамида и 7,0 г (108 ммоль) азида натрия греют при 80 С в течение 15 ч. Смесь охлаждают и концентрируют в вакууме. Остаток обрабатывают 100 мл воды и 100 мл простого эфира. Органический слой отделяют, и водный слой промывают три раза простым эфиром, каждый раз по 30 мл. Объединенные органические экстракты сушат(МgSО 4), фильтруют и концентрируют в вакуу 53 ме, получают 12,13 г (94%) целевого соединения. Получение 91. Гидрохлорид (R)-(+)-2-(4 бромфенил)пропиламина. Раствор 12,2 г (50,4 ммоль) вещества из получения 90 в 168 мл тетрагидрофурана и 3,6 мл воды перемешивают при комнатной температуре в течение 18 ч. Смесь разбавляют 100 мл простого эфира и 50 мл солевого раствора. Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток растворяют в 100 мл простого эфира, и добавляют к этому раствору 200 мл простого эфира, насыщенного хлористым водородом. Отфильтровывание полученного твердого вещества дает 11,9 г (94%) целевого соединения. Элементный анализ для С 9 Н 13BrСlN. Вычислено, %: С 43,14; Н 5,23; N 5,59. Найдено, %: С 43,44; Н 5,22; N 5,56. Масс-спектр: [М-НСl] = 214.[а]D20 = +24,06 (с = 1,00, Н 2 О). Получение 92. (R)-2-(4-Бромфенил)-N(трет-бутоксикарбонил)пропиламин. К раствору 5,0 г (20,0 ммоль) вещества из получения 91 в 30 мл хлороформа и 30 мл насыщенного раствора бикарбоната натрия добавляют 4,3 г (20,0 ммоль) ди-трет-бутилдикарбоната. Раствор перемешивают при комнатной температуре в течение 18 ч. Органический слой отделяют, и водный слой экстрагируют три раза хлороформом, каждый раз по 10 мл. Объединенные органические экстракты сушат (MgSO4),фильтруют и концентрируют в вакууме, получают 6,2 г (100%) целевого соединения. Получение 93. (S)-(+)-4-Бензил-3-(4-бромфенилацетил)-2-оксазолидинон. Следуя процедуре получения 86 и используя (S)-(-)-4-бензил-2-оксазолидинон вместо(R)-(+)-4-бензил-2-оксазолидинона,получают 25,3 г (63%) целевого соединения. Элементный анализ для C18H16BrNO3. Вычислено, %: С 57,77; Н 4,31; N 3,74. Найдено, %: С 57,69; Н 4,18; N 3,82. Масс-спектр (полевая десорбция): М = 374.[а]D20 = +59,35 (с = 1,04, СНСl3). Получение 94. (+)-4S-Бензил-3-(2S-(4 бромфенил)пропионил)-2-оксазолидинон. Следуя процедуре получения 87 и используя вещество из получения 93 вместо вещества из получения 86, получают 28,9 г (51%) целевого соединения. Элементный анализ для C19H18BrNO3 Вычислено, %: С 58,78; Н 4,67; N 3,61. Найдено, %: С 59,40; Н 4,61; N 3,64. Масс-спектр (полевая десорбция): М = 388.[а]D20 = +114,8 (с = 1,01, СНСl3). Получение 95. (S)-(-)-(2-(4-Бромфенил) пропанол. Следуя процедуре получения 88 и используя вещество из получения 94 вместо вещества 54 из получения 87, получают 12,3 г (79%) целевого соединения. Элементный анализ для С 9 Н 11 ВrО. Вычислено, %: С 50,26; Н 5,15. Найдено, %: С 50,38; Н 5,08. Масс-спектр (полевая десорбция): М+1 = 216.[а]D20 = -13,25 (с = 1,06, СНСl3). Получение 96. (S)-2-(4-Бромфенил)пропилметансульфонат. Следуя процедуре получения 89 и используя вещество из получения 95 вместо вещества из получения 88, получают 16,9 г (100%) целевого соединения. Получение 97. (S)-2-(4-Бромфенил)пропилазид. Следуя процедуре получения 90 и используя вещество из получения 96 вместо вещества из получения 89, получают 13,0 г (94%) целевого соединения. Получение 98. Гидрохлорид (S)-(-)-2-(4 бромфенил)пропиламина. Следуя процедуре получения 91 и используя вещество получения 97 вместо вещества из получения 90, получают 11,6 г (86%) целевого соединения. Элементный анализ для С 9 Н 13 ВrСlN. Вычислено, %: С 43,14; Н 5,23; N 5,59. Найдено, %: С 43,36; Н 5,39; N 5,64. Масс-спектр: [М-НСl] = 214. [a]D20 = -25,3(с = 1,02, Н 2O). Получение 99. (S)-2-(4-Бромфенил)-N(трет-бутоксикарбонил)пропиламин. Следуя процедуре получения 92 и используя вещество из получения 98 вместо вещества из получения 91, получают 5,9 г (94%) целевого соединения. Получение 100. (R)-2-(4-(3-Тиенил)фенил)N-(трет-бутоксикарбонил)пропиламин. К раствору 2,0 г (6,4 ммоль) вещества из получения 92, 0,9 г (7,0 ммоль) тиофен-3 бороновой кислоты и 1,3 г (9,6 ммоль) карбоната калия в 20 мл диоксана и 5 мл воды добавляют 0,4 г (0,32 ммоль) тетракис(трифенилфосфин)палладия(0). Смесь греют при 100 С в течение 18 ч. Смесь охлаждают до комнатной температуры, и добавляют 20 мл воды и 20 мл простого эфира. Органический слой отделяют, и водный слой экстрагируют три раза простым эфиром, каждый раз по 10 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (150 г силикагеля, 15% этилацетата в гексане) дает 1,4 г (70%) целевого соединения. Получение 101. (S)-2-(4-(3-Тиенил)фенил)N-(трет-бутоксикарбонил)пропиламин. Следуя процедуре получения 100 и используя вещество из получения 99 вместо вещества из получения 92, получают 5,9 г (94%) целевого соединения. 55 Получение 102. 2R-(4-(3-Тиенил)фенил) пропиламин. Раствор 1,4 г вещества из получения 100 в 15 мл 25% трифторуксусной кислоты в дихлорметане перемешивают при комнатной температуре в течение 3 ч. Смесь концентрируют в вакууме, и остаток растворяют в 20 мл 1 н. раствора гидроксида натрия и 20 мл этилацетата. Органический слой отделяют, и водный слой экстрагируют четыре раза этилацетатом, каждый раз по 10 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме, и получают 0,85 г (89%) целевого соединения. Получение 103. 2S-(4-(3-Тиенил)фенил) пропиламин. Следуя процедуре получения 102 и используя вещество из получения 101 вместо вещества из получения 100, получают 0,9 г (94 %) целевого соединения. Пример 1. N-2-(4-Бромфенил)пропилметансульфонамид. При температуре окружающей среды к раствору 2,8 г (11,3 ммоль) вещества получения 2 в 30 мл дихлорметана и 30 мл 10% водного раствора гидроксида натрия добавляют 1,1 мл(13,6 ммоль) метансульфонилхлорида. Через 1 ч добавляют еще 1,1 мл (13,6 ммоль) метансульфонилхлорида, и продолжают перемешивание в течение 1,5 ч. Органическую часть отделяют, и водную часть дважды экстрагируют дихлорметаном, каждый раз по 25 мл. Объединенные органические части промывают один раз 25 мл 10% водного раствора бисульфата натрия, сушат (Nа 2SO4), фильтруют и концентрируют в вакууме, получают 2,7 г (81%) целевого соединения. Элементный анализ для C10H14NBrO2S. Вычислено, %: С 41,11; Н 4,83; N 4,79. Найдено, %: С 40,92; Н 4,78; N 4,85. Масс-спектр (полевая десорбция): М-1 = 291. Пример 2. N-2-(4-(3-Фторфенил)фенил) пропилметансульфонамид. К обезгаженному раствору 1,5 г (5,1 ммоль) вещества из примера 1, 1,1 г (7,7 ммоль) 3-фторбензолбороновой кислоты и 1,1 г (7,7 ммоль) карбоната калия в 30 мл толуола добавляют 0,2 г (0,3 ммоль) дихлорида бис(трифенилфосфин)палладия(II). Смесь греют при 100 С в течение 16 ч, охлаждают до температуры окружающей среды и разбавляют 20 мл этилацетата. Смесь промывают один раз 25 мл воды, и органическую часть отделяют. Водную часть три раза экстрагируют этилацетатом, и объединенные органические части сушат(MgSO4), фильтруют и концентрируют в вакууме. Хроматография на 75 г силикагеля (20% этилацетата в толуоле) с последующей перекристаллизацией из этилового эфира, фильтрацией 56 и сушкой в вакууме при 60 С дают 0,15 г (9%) целевого соединения. Элементный анализ для C16H18NFO2S 0,25H2O. Вычислено, %: С 61,62; Н 5,98; N 4,49. Найдено, %: С 61,67; Н 5,83; N 4,64. Масс-спектр (полевая десорбция): М = 307. Пример 3. N-2-(4-(3-Формилфенил)фенил) пропилметансульфонамид. К обезгаженному раствору 1,5 г (5,1 ммоль) вещества из примера 1, 1,2 г (8,1 ммоль) 3-формилбензолбороновой кислоты и 1,1 г (8,1 ммоль) карбоната калия в 30 мл толуола добавляют 0,3 г (0,3 ммоль) тетракис(трифенилфосфин)палладия(0). Смесь греют при 100 С в течение 16 ч, после чего добавляют 5 мл воды, и продолжают нагревание в течение 1 ч. Затем смесь охлаждают до температуры окружающей среды, и добавляют 10 мл воды. Органическую часть отделяют, и водную часть дважды экстрагируют этилацетатом. Объединенные органические части сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография на 50 г силикагеля (40% этилацетата в гексане) дает 0,7 г (41%) целевого соединения. Элементный анализ для С 17 Н 19NО 3S. Вычислено, %: С 64,33; Н 6,03; N 4,41. Найдено, %: С 64,33; Н 6,06; N 4,01. Масс-спектр (полевая десорбция): М = 317. Пример 4. N-2-(4-(4-Формилфенил)фенил) пропилметансульфонамид. К обезгаженному раствору 1,5 г (5,1 ммоль) вещества из примера 1, 1,2 г (8,1 ммоль) 4-формилбензолбороновой кислоты и 1,1 г (8,1 ммоль) карбоната калия в 30 мл толуола добавляют 0,3 г (0,3 ммоль) тетракис(трифенилфосфин)палладия(0). Смесь греют при 100 С в течение 4 часов, после чего добавляют 0,3 г (2,0 ммоль) 4-формилбензолбороновой кислоты и 0,1 г (0,09 ммоль) тетракис(трифенилфосфин) палладия(0), и продолжают нагревание в течение 16 ч. К этому раствору добавляют 5 мл воды, и продолжают нагревание в течение 1 ч. Затем смесь охлаждают до температуры окружающей среды, и добавляют 10 мл воды. Органическую часть отделяют, и водную часть дважды экстрагируют этилацетатом. Объединенные органические части сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография на 50 г силикагеля (50% этилацетата в гексане) дает твердое вещество, которое перекристаллизовывают из бромбутана и этилацетата,фильтруют и сушат в вакууме при 60 С, получают 0,5 г (32%) целевого соединения. Элементный анализ для C17H19NO3S. Вычислено, %: С 64,33; Н 6,03; N 4,41. Найдено, %: С 64,62; Н 5,97; N 4,36. Масс-спектр (полевая десорбция): М = 317. Пример 5. N-2-(4-(3-Тиенил)фенил)пропилметансульфонамид. 57 К обезгаженному раствору 1,5 г (5,1 ммоль) вещества из примера 1, 1,0 г (7,7 ммоль) тиофен-3-бороновой кислоты и 1,1 г (7,7 ммоль) карбоната калия в 30 мл толуола добавляют 0,3 г (0,3 ммоль) тетракис(трифенилфосфин)палладия (0). Смесь греют при 100 С в течение 4 ч,охлаждают до температуры окружающей среды,и разбавляют 20 мл этилацетата. Затем смесь промывают один раз водой, и органическую часть отделяют. Водную часть дважды экстрагируют этилацетатом, и объединенные органические части сушат (МgSO4), фильтруют и концентрируют в вакууме. Хроматография на 50 г силикагеля (35% этилацетата в гексане) дает твердое вещество, которое перекристаллизовывают из бромбутана, фильтруют и сушат в вакууме при 60 С, и получают 0,4 г (27%) целевого соединения. Элементный анализ для C14H17NO2S2. Вычислено, %:С 56,92; Н 5,80; N 4,74. Найдено, %: С 57,00; Н 5,92; N 4,78. Масс-спектр (полевая десорбция): М = 295. Пример 6. N-2-(4-(2-Метоксифенил)фенил) пропилметансульфонамид. К обезгаженному раствору 1,0 г (3,4 ммоль) вещества из примера 1, 0,8 г (5,1 ммоль) 2-метоксибензолбороновой кислоты и 0,7 г (5,1 ммоль) карбоната калия в 15 мл диоксана и 5 мл воды добавляют 0,2 г (0,2 ммоль) тетракис(трифенилфосфин)палладия(0). Смесь греют при 100 С в течение 16 ч. Реакционную смесь охлаждают до температуры окружающей среды,разбавляют 10 мл воды, и три раза экстрагируют этилацетатом. Объединенные органические части сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография на 50 г силикагеля(35% этилацетата в гексане) дает 1,0 г (90%) целевого соединения в виде вязкого масла. Элементный анализ для C17H21NO3S. Вычислено, %: С 63,92; Н 6,62; N 4,39. Найдено, %: С 63,68; Н 6,78; N 4,23. Масс-спектр (полевая десорбция): М = 319. Пример 7. N-2-(4-(2-фторфенил)фенил) этил)-2-пропансульфонамид. А. (2-(4-бромфенил)-N-(трет-бутоксикарбонил)этиламин. К раствору 10,0 г (50,0 ммоль) 4 бромфенетиламина в 100 мл хлороформа и 100 мл насыщенного раствора бикарбоната натрия добавляют 11,0 г (50,0 ммоль) ди-третбутилдикарбоната. Раствор перемешивают при температуре окружающей среды в течение 1 ч. Органический слой отделяют, и водный слой экстрагируют три раза хлороформом, каждый раз по 30 мл. Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют в вакууме, и получают 15 г (100%) целевого соединения. Б. 58 К обезгаженному раствору 7,9 г (26,2 ммоль) вещества со стадии А, 5,5 г (39,3 ммоль) вещества из получения 3 и 5,4 г (39,3 ммоль) карбоната калия в 90 мл толуола добавляют 1,5 г (1,3 ммоль) тетракис(трифенилфосфин)палладия (0). Смесь греют при 90 С в течение 3 ч. Смесь охлаждают до температуры окружающей среды и добавляют 90 мл воды. Органический слой отделяют, и водный слой три раза экстрагируют этилацетатом, каждый раз по 30 мл. Объединенные органические экстракты сушат(MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (400 г силикагеля,15% этилацетата в гексане) дает 7,1 г вещества,которое растирают в порошок в гексане, и получают 3,5 г (42%) целевого соединения. В. 2-(4'-(2-фторбифенил)этиламин. Раствор 3,5 г вещества со стадии Б в 40 мл 20% трифторуксусной кислоты в дихлорметане перемешивают при температуре окружающей среды в течение 1 ч. Смесь концентрируют в вакууме, и получают 3,9 г (100%) целевого соединения. Г. Раствор 1,0 г (3,0 ммоль) вещества со стадии В и 1 мл (7,6 ммоль) триэтиламина в 10 мл дихлорметана охлаждают до 0 С. Добавляют по каплям раствор 0,33 мл (3,0 ммоль) изопропилсульфонилхлорида в 5 мл дихлорметана. Ледяную баню убирают, и смесь перемешивают при температуре окружающей среды в течение 1 ч. Смесь разбавляют 10 мл простого эфира и промывают 20 мл 10% водного раствора бисульфата натрия, органический слой отделяют,и водный слой экстрагируют три раза простым эфиром, каждый раз по 10 мл. Объединенные органические части сушат (MgSO4) г фильтруют и концентрируют в вакууме, и получают 0,5 г(52%) целевого соединения. Элементный анализ для C17H20FNO2S 0,25 Н 2O. Вычислено, %: С 62,65; Н 6,34; N 4,30. Найдено, %, С 62,62; Н 6,15; N 4,49. Масс-спектр (полевая десорбция): М = 321. Пример 8. N-2-(4-(2-Фторфенил)фенил) пропилэтенсульфонамид. Раствор 1,0 г (4,4 ммоль) вещества из получения 6 и 0,67 мл (4,8 ммоль) триэтиламина в 15 мл дихлорметана охлаждают до 0 С. Добавляют по каплям раствор 0,46 мл (4,4 ммоль) 2 хлор-1-этансульфонилхлорида в 2 мл дихлорметана. Ледяную баню убирают, и смесь перемешивают при температуре окружающей среды в течение 1 ч. Смесь разбавляют 15 мл простого эфира и промывают 15 мл 10% водного раствора бисульфата натрия, органический слой отделяют, и водный слой экстрагируют три раза простым эфиром, каждый раз по 5 мл. Объединенные органические части сушат (МgSO4),фильтруют и концентрируют в вакууме. Хроматография остатка (25 г силикагеля, 30% этил 59 ацетата в гексане) дает 0,6 г (43%) целевого соединения. Элементный анализ для C17H18FNO2S. Вычислено, %: С 63,93; Н 5,68; N 4,39. Найдено, %: С 63,98; Н 5,58; N 4,42. Масс-спектр (полевая десорбция): М = 319. Пример 9. N-2-(4-(2-Фторфенил)фенил) пропилэтансульфонамид. Раствор 0,2 г (0,80 ммоль) вещества из получения 6 и 0,13 мл (0,95 ммоль) триэтиламина в 5 мл дихлорметана охлаждают до 0 С. Добавляют по каплям раствор 0,076 мл (0,80 ммоль) этансульфонилхлорида в 1 мл дихлорметана. Ледяную баню убирают, и смесь перемешивают при температуре окружающей среды в течение 16 ч. Смесь промывают 5 мл 10% водного раствора бисульфата натрия, органический слой отделяют, и водный слой экстрагируют один раз 5 мл дихлорметана. Объединенные органические части сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка(25 г силикагеля, 35% этилацетата в гексане) дает 0,20 г (78%) целевого соединения. Элементный анализ для C17H20FNO2S. Вычислено, %: С 63,53; Н 6,27; N 4,36. Найдено, %: С 63,24; Н 6,27; N 4,39. Масс-спектр (полевая десорбция): М = 321. Пример 10. N-2-(4-(2-Фторфенил)фенил) пропил-2-пропансульфонамид. Раствор 0,2 г (0,80 ммоль) вещества из получения 6 и 0,13 мл (0,95 ммоль) триэтиламина в 5 мл дихлорметана охлаждают до 0 С. Добавляют по каплям раствор 0,090 мл (0,80 ммоль) изо-пропилсульфонилхлорида в 1 мл дихлорметана. Ледяную баню убирают, и смесь перемешивают при температуре окружающей среды в течение 16 ч. Смесь промывают 5 мл 10% водного раствора бисульфата натрия, органический слой отделяют, и водный слой экстрагируют один раз 5 мл дихлорметана. Объединенные органические части сушат (MgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (25 г силикагеля, 35% этилацетата в гексане) дает 0,040 г (15%) целевого соединения. Элементный анализ для C18H22FNO2S. Вычислено, %: С 64,45; Н 6,61; N 4,81. Найдено, %: С 64,2; Н 6,51; N 4,02. Масс-спектр (полевая десорбция): М = 335. Пример 11. N-2-(4-(2-Фторфенил)фенил) пропил-N',N'-диметилсульфамид. Раствор 0,2 г (0,80 ммоль) вещества из получения 6 и 0,13 мл (0,95 ммоль) триэтиламина в 5 мл дихлорметана охлаждают до 0 С. Добавляют по каплям раствор 0,086 мл (0,80 ммоль) диметилсульфамоилхлорида в 1 мл дихлорметана. Ледяную баню убирают, и смесь перемешивают при температуре окружающей среды в течение 16 ч. Смесь промывают 5 мл 10% водного раствора бисульфата натрия, органический слой отделяют, и водный слой экстрагируют один раз 5 мл дихлорметана. Объединенные 60 органические части сушат (МgSO4), фильтруют и концентрируют в вакууме. Хроматография остатка (25 г силикагеля, 35% этилацетата в гексане) дает 0,20 г (74%) целевого соединения. Элементный анализ для C17H21FN2O2S. Вычислено, %: С 60,69; Н 6,29; N 8,33. Найдено, %: С 60,42; Н 6,23; N 8,06. Масс-спектр (полевая десорбция): М = 336. Пример 12. N-2-(4-(Изопропил)фенил)пропилтрифторметансульфонамид. Суспензию продукта получения 8 0,30 г(1,40 ммоль) в дихлорметане (20 мл) охлаждают до 0 С. К суспензии добавляют три-этиламин 0,59 мл (4,21 ммоль), а затем трифторметансульфонилхлорид 0,16 мл (1,54 ммоль). Раствор перемешивают при 0 С в течение тридцати минут, затем нагревают до температуры окружающей среды. Развитие реакции контролируют с помощью тонкослойной хроматографии. После израсходования исходного вещества реакционную смесь обрабатывают водой и дихлорметаном. Органическую фракцию промывают 0,2 М соляной кислотой, солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Хроматография (SiO2, 30% этилацетата в гексане) дает 0,35 г (81%) целевого соединения. Масс-спектр (полевая десорбция): М = 309. Элементный анализ для C13H18F3NO3S. Теоретически: С 50,48; Н 5,86; N 4,53. Найдено: С 50,40; Н 5,78; N 4,74. Пример 13. N-2-(4-Изопропилфенил)пропил-2-пропансульфонамид. Суспензию продукта получения 8 0,30 г(1,40 ммоль) в дихлорметане (20 мл) охлаждают до 0 С. К суспензии добавляют три-этиламин 0,59 мл (4,21 ммоль), а затем изопропилсульфонилхлорид 0,16 мл (1,54 ммоль). Раствор перемешивают при 0 С в течение тридцати минут,затем нагревают до температуры окружающей среды. Развитие реакции контролируют с помощью тонкослойной хроматографии. После израсходования исходного вещества реакционную смесь обрабатывают водой и дихлорметаном. Органическую фракцию промывают 0,2 М соляной кислотой, солевым раствором, сушат(полевая десорбция): М = 283. Элементный анализ для С 13 Н 18F3NО 3S. Теоретически: С 63,57; Н 8,89; N 4,94. Найдено: С 63,63; Н 8,90; N 5,18. Пример 14. N-2-(4-Метоксифенил)пропилтрифторметансульфонамид. Суспензию продукта получения 10 1,00 г(4,96 ммоль) в дихлорметане (50 мл) охлаждают до 0 С. К суспензии добавляют триэтиламин 2,09 мл (14,9 ммоль), а затем трифторметансульфонилхлорид 0,58 мл (5,45 ммоль). Раствор
МПК / Метки
МПК: A61K 31/18
Метки: производные, сульфонамидные
Код ссылки
<a href="https://eas.patents.su/30-1919-sulfonamidnye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонамидные производные</a>
Предыдущий патент: Таблетка для глотания, включающая в себя парацетамол
Следующий патент: Синтез 1,3-оксаселеноланнуклеозидов, их активность против вируса иммунодефицита человека и против вируса гепатита-b
Случайный патент: Безалкогольный напиток "эликса" с широким спектром биологического действия и способ его получения












