Способ получения циталопрама
Номер патента: 2770
Опубликовано: 29.08.2002
Авторы: Брайнедаль Петер, Петерсен Ханс, Бегесе Клаус Петер
Формула / Реферат
1. Способ получения циталопрама, включающий стадии
а) реакции соединения формулы IV
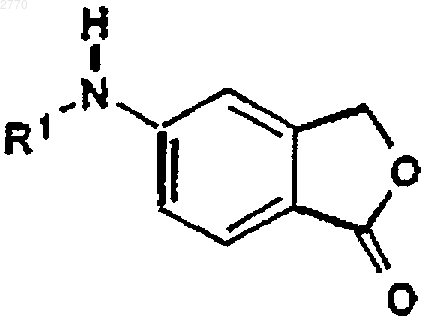
где R1 представляет Н или C1-6-алкилкарбонил, с реактивом Гриньяра, представляющим собой 4-фторфенилмагнийгалогенид;
b) реакции полученного соединения формулы V
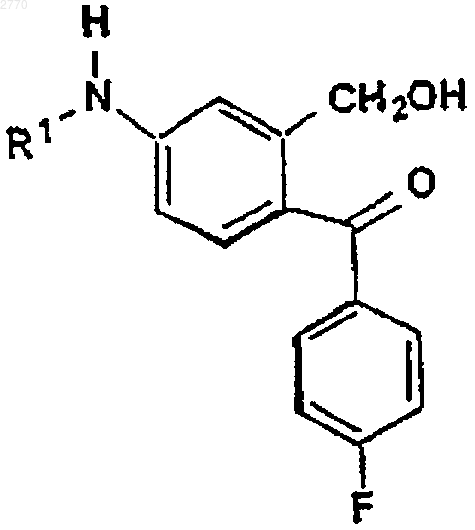
где R1 имеет указанные выше значения, с реактивом Гриньяра, представляющим собой 3-диметиламинопропилмагнийгалогенид;
с) циклизации полученного соединения формулы VI
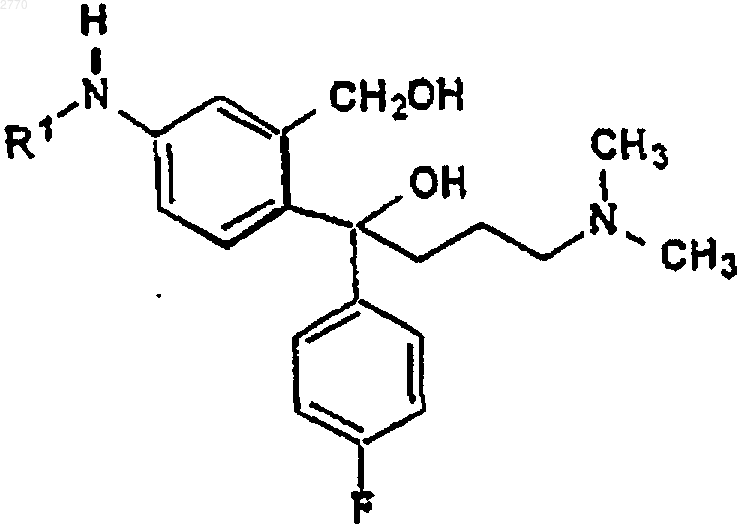
где R1 имеет указанные выше значения, и
d) превращения полученного соединения формулы VII
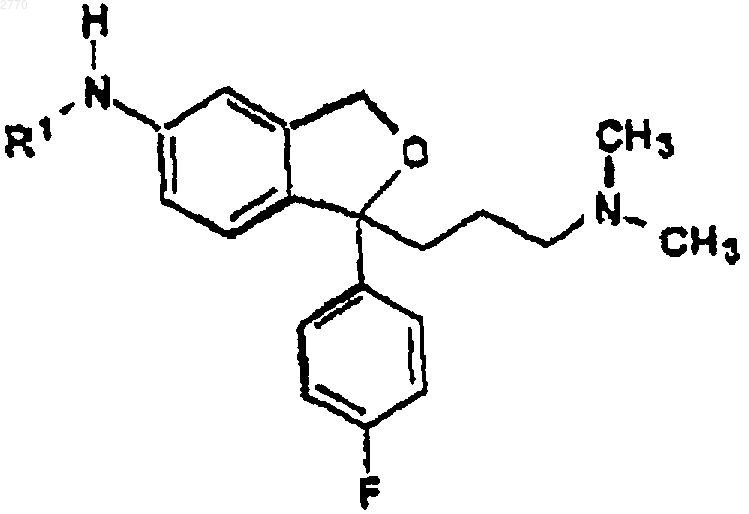
где R1 имеет указанные выше значения, в соответствующее 5-цианопроизводное, т.е. циталопрам, который выделяют в виде основания или его фармацевтически приемлемой соли.
2. Способ по п.1, в котором R1 представляет Н.
3. Способ по п.1, в котором R1 представляет C1-6-алкилкарбонил.
4. Способ по п.3, в котором C1-6-алкил представляет метил, этил, пропил или бутил.
5. Способ по пп.1-4, в котором используемый реактив Гриньяра представляет галогенид магния, предпочтительно хлорид, бромид или иодид.
6. Способ по п.5, в котором реактив Гриньяра, используемый в стадии а), представляет бромид магния.
7. Способ по п.5, в котором реактив Гриньяра, используемый в стадии b), представляет хлорид магния.
8. Способ по любому из пп.1-7, в котором циклизацию соединения формулы VI выполняют кислотным замыканием кольца, осуществляемым неорганической кислотой, такой как серная или фосфорная кислота, или органической кислотой, такой как метансульфоновая, п-толуолсульфоновая или трифторуксусная кислота.
9. Способ по п.3, в котором циклизацию соединения формулы VI выполняют основным замыканием кольца посредством лабильного эфира, предпочтительно с одновременными этерификацией и добавлением основания.
10. Способ по п.9, в котором указанный лабильный эфир представляет метансульфоновый эфир, п-толуолсульфоновый эфир, 10-камфорсульфоновый эфир, трифторацетильный или трифторметансульфоновый эфир, а основание представляет собой триэтиламин, диметиланилин или пиридин.
11. Способ по п.2, в котором превращение группы R1-NH- в циано проводят диазотированием с последующей реакцией с CN- .
12. Способ по п.3, в котором превращение группы R1-NH- в циано проводят гидролизом C1-6-алкилкарбониламиногруппы, R1-NH- в соответствующую аминогруппу, где R1 представляет Н, с последующим диазотированием и реакцией с CN-.
13. Способ по любому из пп.1-12, отличающийся тем, что перед его использованием в реакции замыкания кольца в стадии с) соединение формулы VI разделяют на оптически активные энантиомеры, получая (S)-энантиомер.
14. Соединение формулы V

где R1 представляет Н или C1-6-алкилкарбонил.
15. Соединение формулы VI
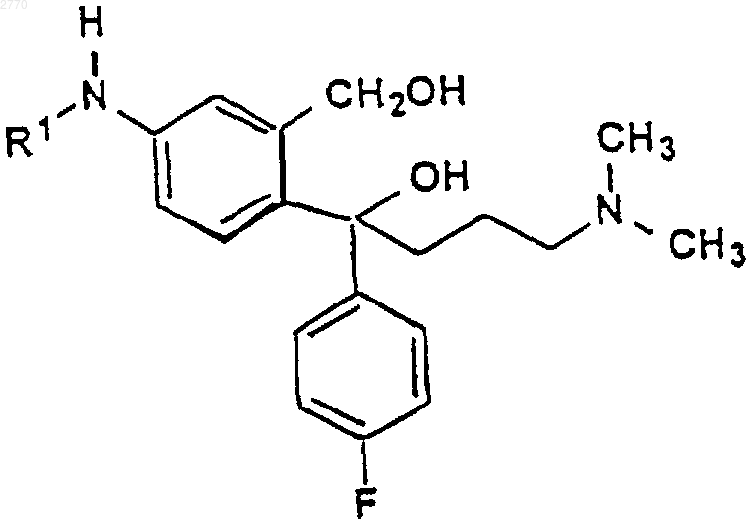
где R1 представляет собой Н или C1-6-алкилкарбонил.
16. Соединение формулы VII

где R1 представляет собой Н или C1-6-алкилкарбонил.
Текст
1 Данное изобретение относится к способу получения хорошо известного антидепрессивного лекарственного средства (антидепрессанта) циталопрама и промежуточных продуктов, используемых в этом способе. Предпосылки изобретения Циталопрам является хорошо известным антидепрессивным лекарственным средством,которое находиться на рынке в течение нескольких лет, и имеет следующую структуру: Формула I Он является селективным, активным в центральной нервной системе ингибитором повторного поглощения серотонина (5-гидрокситриптамина; 5-НТ), обладающим вследствие этого антидепрессивной активностью. Антидепрессивная активность этого соединения сообщалась в нескольких публикациях, например, J.Psychiatr. Scand., 1987, 75, 478-486. Это соединение было дополнительно описано с целью демонстрации эффектов в лечении деменции и цереброваскулярных нарушений, ЕР-А 474580. Циталопрам был впервые описан в DE 2 657 271, соответствующем патенту США US 4 136 193. Эта патентная публикация описывает получение циталопрама одним способом и описывает в общих чертах дополнительный способ,который может быть использован для получения циталопрама. Согласно описанному способу, соответствующий 1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрил взаимодействует с 3-(N,Nдиметиламино)пропилхлоридом в присутствии метилсульфинилметида в качестве конденсирующего агента. Исходный материал получали из соответствующего 5-бромпроизводного реакцией с цианидом меди (I). В соответствии с этим способом, который описан лишь в общих чертах, циталопрам может быть получен замыканием цикла этого соединения: Формула II в присутствии дегидратирующего агента и последующим обменом группы 5-бром с цианидом меди (I). Исходный материал формулы II получают из 5-бромфталида посредством двух последовательных реакций Гриньяра, т.е. с 4 фторфенилмагнийхлоридом и N,N-диметиламинопропилмагнийхлоридом, соответственно. 2 Новый и неожиданный способ и промежуточный продукт для получения циталопрама были описаны в патенте США 4 650 884, согласно которому промежуточный продукт формулы Формула III подвергают реакции замыкания цикла путем дегидратации концентрированной серной кислотой для получения циталопрама. Промежуточный продукт формулы III получали из 5 цианофталида посредством двух последовательных реакций Гриньяра, т.е. с 4 фторфенилмагнийгалогенидом иN,Nдиметиламинопропилмагнийгалогенидом, соответственно. Наконец, способы получения индивидуальных энантиомеров циталопрама описаны в патенте США 4 943 590, из которого также очевидно, что замыкание цикла промежуточного продукта формулы III можно проводить через лабильный сложный эфир при помощи основания. Теперь, неожиданно, было обнаружено,что циталопрам может быть получен при помощи новой предпочтительной и безопасной процедуры с использованием удобных исходных материалов. Существо изобретения Таким образом, данное изобретение относится к новому способу получения циталопрама,предусматривающему стадии: а) реакции соединения формулы IVb) реакции полученного соединения формулы V Формула V где R1 имеет указанные выше значения, с реактивом Гриньяра 3-галоген-N,N-диметилпропиламина; с) выполнения замыкания цикла полученного соединения формулы VI Формула VI где R1 имеет указанные выше значения, иd) превращения полученного соединения формулы VII Формула VII где R1 имеет указанные выше значения, в соответствующее 5-цианопроизводное, т.е. циталопрам, который выделяют в виде основания или его фармацевтически приемлемой соли. В другом аспекте данное изобретение обеспечивает новые промежуточные продукты формулы V. В дополнительном аспекте данное изобретение обеспечивает новые промежуточные продукты формулы VI. В дополнительном аспекте данное изобретение обеспечивает новые промежуточные продукты формулы VII. Еще в одном аспекте данное изобретение относится к антидепрессивной фармацевтической композиции, содержащей циталопрам, изготовленный по способу данного изобретения. Во всем описании и в формуле изобретения C1-6-алкилом является разветвленная или неразветвленная алкильная группа, имеющая от одного до шести атомов углерода, такая как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил,2-метил-2-пропил, 2,2-диметил-1-этил и 2 метил-1-пропил. Реактивы Гриньяра 4-галогенфторфенила,которые могут быть использованы в стадии а),представляют собой галогениды магния, такие как хлорид, бромид или иодид. Предпочтительно используют бромид магния. Реактивы Гриньяра 3-галоген-N,N-диметилпропиламина, которые могут быть использованы, представляют собой галогениды магния, такие как хлорид,бромид или иодид, предпочтительно бромид магния. Предпочтительно, эти две реакции проводят последовательно без выделения промежуточного продукта. Замыкание цикла соединения формулы VI может быть выполнено кислотой или, когда R1 представляет собой C1-6-алкилкарбонил, оно может альтернативно проводиться через лабильный сложный эфир основанием. Кислотное замыкание цикла выполняют неорганической кислотой, такой как серная или фосфорная кислота, или органической кислотой, такой как метилсульфоновая, п-толуолсульфоновая или трифторуксусная кислота. Замыкание основного 4 кольца выполняют посредством лабильного сложного эфира, такого как метансульфонатный, п-толуолсульфонатный, 10-камфорсульфонатный, трифторацетатный или трифторметансульфонатный эфир с добавлением основания,такого как триэтиламин, диметиланилин или пиридин. Основную реакцию проводят в инертном растворителе, предпочтительно с охлаждением, в частности, при приблизительно 0 С, и ее предпочтительно проводят процедурой в одном сосуде, т.е. с этерификацией и одновременным добавлением основания. Когда R1 представляет Н, превращение R1NH- в циано предпочтительно проводят диазотированием и последующей реакцией с CN-. Наиболее предпочтительно используют NaNO2 и CuCN и/или NaCN. Когда R1 представляет собой C1-6-алкилкарбонил, его сначала подвергают гидролизу с получением в результате соответствующего соединения, где R1 представляет собой Н, которое превращают, как описано выше. Гидролиз может проводиться либо в кислой,либо в щелочной среде. Способ данного изобретения может проводиться с выделением или без выделения промежуточных продуктов. Способ данного изобретения может также проводиться для получения активного (S)энантиомера циталопрама. В этом случае соединение формулы VI разделяют на оптически активные энантиомеры при помощи процедуры,аналогичной процедуре, описанной в патенте США 4 943 590, с получением в результате(S)-энантиомера соединения формулы VI, который используют в реакции замыкания цикла в стадии с). Таким образом, индивидуальные энантиомеры промежуточных продуктов формул VI и VII, соответственно, включены в данную формулу изобретения. Другие условия реакций, растворители и т.д. являются общепринятыми условиями для таких реакций и могут быть легко определены специалистом в данной области. Исходный материал формулы IV, где R1 представляет собой Н, является коммерчески доступным и может быть получен известными процедурами (Tirouflet, J.; Bull. Soc. Sci. Bretagne 26, 1959, 35), и соединения, в которых R1 является ацилом, могут быть получены из аминосоединения (R1 обозначает Н) общепринятым ацилированием. В одном варианте данного изобретения R1 представляет собой C1-6-алкилкарбонил, в частности, метил-, этил-, пропил-, или бутилкарбонил. В другом варианте данного изобретения R1 представляет собой Н. Соединение общей формулы I может быть использовано в виде свободного основания или в виде его фармакологически приемлемой кислотно-аддитивной соли. В качестве кислотноаддитивных солей могут быть использованы 5 такие соли, образованные органическими или неорганическими кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бис-метиленсалициловой,метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой,гликолевой, п-аминобензойной, глутаминовой,бензолсульфоновой и теофиллинуксусной кислотами, а также 8-галогентеофиллинами, например, 8-бромтеофиллином. Примерами таких неорганических солей являются соли с хлористо-водородной, бромисто-водородной, серной,сульфамовой, фосфорной и азотной кислотами. Кислотно-аддитивные соли этих соединений могут быть получены способами, известными в данной области. Основание взаимодействует либо с рассчитанным количеством кислоты в смешивающемся с водой растворителе,таком как ацетон или этанол, с последующим выделением этой соли концентрированием и охлаждением, или с избытком этой кислоты в не смешивающемся с водой растворителе, таком как этиловый эфир, этилацетат или дихлорметан, с самопроизвольно отделяющейся солью. Фармацевтические композиции в соответствии с данным изобретением могут быть введены любым подходящим путем в любой пригодной форме, например, перорально в форме таблеток, капсул, порошков или сиропов, или парентерально в форме обычных стерильных растворов для инъекции. Фармацевтические композиции данного изобретения могут быть получены общепринятыми в данной области способами. Например,таблетки могут быть приготовлены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и затем прессованием этой смеси в обычной таблетировочной машине. Примеры адъювантов или разбавителей включают в себя: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Любой другой адъювант или вспомогательные красители, ароматизаторы, консерванты и т.д. могут быть использованы, при условии, что они являются совместимыми с активными ингредиентами. Растворы для инъекций могут быть приготовлены растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно стерильной воды, с доведением раствора до желаемого объема, стерилизацией раствора и заполнением в подходящие ампулы или флаконы. Может быть добавлена любая подходящая добавка, обычно применяемая в данной области, такая как агенты тоничности, консерванты, антиоксиданты и т.д. 6 Примеры Способ данного изобретения иллюстрируется далее следующими примерами. Пример 1. 4-Диметиламино-1-(4-амино-2 гидроксиметилфенил)-1-(4-фторфенил)бутан-1 ол. Раствор 4-фторфенилмагнийбромида, полученный из 4-фторбромбензола (116 г, 0,66 моль) и магниевых стружек (20 г, 0,8 моль) в сухом ТГФ (500 мл), добавляют по каплям к суспензии 5-аминофталида (30 г, 0,2 моль) в сухом ТГФ (500 мл). Температуру поддерживают ниже 5 С. После завершения добавления реакционную смесь перемешивают в течение 0,5 ч при комнатной температуре. Второй раствор Гриньяра, полученный из 3-диметиламинопропилхлорида (25 г, 0,2 моль) и стружек магния (6 г, 0,25 моль) в сухом ТГФ(150 мл), добавляют к реакционной смеси. Температуру поддерживают ниже 5 С во время добавления. Перемешивание продолжают в течение 0,5 ч, затем прекращают и оставляют на ночь при температуре окружающей среды. Реакционную смесь обрабатывают ледяной водой (1000 мл) и уксусной кислотой (60 г). ТГФ выпаривают в вакууме. Водную фазу промывают этилацетатом (2 х 200 мл). К водной фазе добавляют NH4OH с получением конечного рН 9. Водный слой экстрагируют этилацетатом(2 х 200 мл) и органическую фазу фильтруют и промывают водой (100 мл). Выпаривание растворителей в вакууме оставляет указанное в заголовке соединение (38,8 г, 58%) в виде масла. 1(1H, д, J=8 Гц), 6,62 (1H, с), 6,95 (2 Н, т, J=8,5 Гц), 7,25 (1H, д, J=8 Гц), 7,45 (2 Н, дт, J=1,2 Гц,J=8,5 Гц). 5-амино-1-(3-диметиламинопропил)-1-(4 фторфенил)-1,3-дигидроизобензофуран. Неочищенный 4-диметиламино-1-(4-амино-2-гидроксиметилфенил)-1-(4-фторфенил)бутан-1-ол растворяют в Н 3 РO4 (60%, 140 г) и нагревают до 80 С в течение 2 ч. Реакционную смесь выливают на смесь воды со льдом (1000 мл). Добавляют NH4OH с получением конечного рН 9. Водный слой экстрагируют этилацетатом (2 х 200 мл). Объединенную органическую фазу фильтруют, промывают водой (100 мл) и сушат (MgSO4, 10 г). Растворитель выпаривают в вакууме. Указанное в заголовке соединение получают в виде масла. 1(8 мл). NaNO2 (4,1 г, 0,06 моль) растворяют в воде (20 мл) и добавляют по каплям при температуре ниже 5 С. Диазотированный раствор перемешивают в течение 0,5 ч при 0-5 С. рН доводят до 6,5 добавлением насыщенного раствора Nа 2 СО 3. Этот раствор добавляют к смеси воды (100 мл) и толуола (120 мл), содержащегоCuCN (6 г, 0,067 моль) и NaCN (10 г, 0,2 моль) при 50-60 С. Перемешивание продолжают в течение 0,5 ч. Фазы разделяют и водную фазу дополнительно экстрагируют толуолом (100 мл). Объединенную органическую фазу промывают NaCN (10% вод., 2 х 50 мл). Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле (этилацетат : н-гептан : триэтиламин; 85:10:5) с получением указанного в заголовке соединения (6 г, 32%) в виде масла. 1(2 Н, т, J=8,5 Гц), 7,4 (2 Н, т, J=8,5 Гц), 7,45 (1 Н,д, J=7,5 Гц), 7,5 (1 Н, с), 7,58 (1 Н, д, J=7,5 Гц). Пример 2. 4-Диметиламино-1-(4-ацетиламино-2-гидроксиметилфенил)-1-(4-фторфенил) бутан-1-ол. Раствор 4-фторфенилмагнийбромида, полученный из 4-фторбромбензола (11,6 г, 0,067 моль) и магниевых стружек (2 г, 0,08 моль) в сухом ТГФ (50 мл), добавляют по каплям к суспензии 5-ацетиламинофталида (5 г, 0,03 моль) в сухом ТГФ (50 мл). Температуру поддерживают ниже 5 С. После завершения добавления реакционную смесь перемешивают в течение 0,5 ч при комнатной температуре. Второй раствор Гриньяра, полученный из 3-диметиламинопропилхлорида (3,7 г, 0,03 моль) и стружек магния (0,87 г, 0,036 моль) в сухом ТГФ (15 мл), добавляют к реакционной смеси. Температуру поддерживают ниже 5 С во время добавления. Перемешивание продолжают в течение 0,5 ч, затем прекращают и оставляют на ночь при температуре окружающей среды. Реакционную смесь обрабатывают ледяной водой (100 мл) и уксусной кислотой (6 г). ТГФ выпаривают в вакууме. Водную фазу промывают этилацетатом (2 х 50 мл). К водной фазе добавляют NH4OH с получением конечного рН 9. Водный слой экстрагируют этилацетатом (2 х 50 мл) и органическую фазу фильтруют и промывают водой (50 мл). Выпаривание растворителей в вакууме оставляет указанное в заголовке соединение (6,6 г, 63%) в виде масла. 1 8 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения циталопрама, включающий стадии а) реакции соединения формулы IVb) реакции полученного соединения формулы V где R1 имеет указанные выше значения, с реактивом Гриньяра, представляющим собой 3 диметиламинопропилмагнийгалогенид; с) циклизации полученного соединения формулы VI где R1 имеет указанные выше значения, иd) превращения полученного соединения формулы VII где R1 имеет указанные выше значения, в соответствующее 5-цианопроизводное, т.е. циталопрам, который выделяют в виде основания или его фармацевтически приемлемой соли. 2. Способ по п.1, в котором R1 представляет Н. 3. Способ по п.1, в котором R1 представляет C1-6-алкилкарбонил. 4. Способ по п.3, в котором C1-6-алкил представляет метил, этил, пропил или бутил. 5. Способ по пп.1-4, в котором используемый реактив Гриньяра представляет галогенид магния, предпочтительно хлорид, бромид или иодид. 6. Способ по п.5, в котором реактив Гриньяра, используемый в стадии а), представляет бромид магния. 7. Способ по п.5, в котором реактив Гриньяра, используемый в стадии b), представляет хлорид магния. 8. Способ по любому из пп.1-7, в котором циклизацию соединения формулы VI выполняют кислотным замыканием кольца, осуществляемым неорганической кислотой, такой как серная или фосфорная кислота, или органической кислотой, такой как метансульфоновая, птолуолсульфоновая или трифторуксусная кислота. 9. Способ по п.3, в котором циклизацию соединения формулы VI выполняют основным замыканием кольца посредством лабильного эфира, предпочтительно с одновременными этерификацией и добавлением основания. 10. Способ по п.9, в котором указанный лабильный эфир представляет метансульфоновый эфир, п-толуолсульфоновый эфир, 10 камфорсульфоновый эфир, трифторацетильный или трифторметансульфоновый эфир, а основание представляет собой триэтиламин, диметиланилин или пиридин. 11. Способ по п.2, в котором превращение группы R1-NH- в циано проводят диазотированием с последующей реакцией с CN. 12. Способ по п.3, в котором превращение группы R1-NH- в циано проводят гидролизомC1-6-алкилкарбониламиногруппы, R1-NH- в соответствующую аминогруппу, где R1 представляет Н, с последующим диазотированием и реакцией с CN-. 13. Способ по любому из пп.1-12, отличающийся тем, что перед его использованием в 10 реакции замыкания кольца в стадии с) соединение формулы VI разделяют на оптически активные энантиомеры, получая (S)-энантиомер. 14. Соединение формулы V
МПК / Метки
МПК: A61K 31/343, C07D 307/87
Метки: циталопрама, получения, способ
Код ссылки
<a href="https://eas.patents.su/6-2770-sposob-polucheniya-citaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения циталопрама</a>
Предыдущий патент: Замещенные 6,5-гетеробициклические производные
Случайный патент: Вакцина










