Система экспрессии
Номер патента: 17803
Опубликовано: 29.03.2013
Авторы: Маттанович Дитхард, Гассер Бригитте, Штадльмайр Герхард, Зауэр Михель
Формула / Реферат
1. Промоторная последовательность дрожжей, выделенная из Pichia pastoris и идентичная фрагменту в 1000 п.о. из 5'-некодирующего района гена THI3 (SEQ ID NO: 135) или соответствующая указанному фрагменту в 1000 п.о. из 5'-некодирующего района гена THI3 (SEQ ID NO: 135) и имеющая его функциональные характеристики.
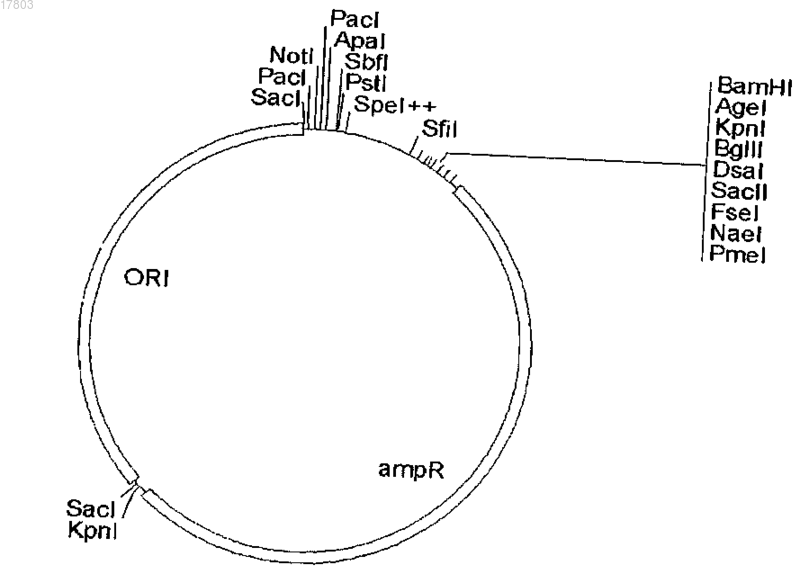
2. Эукариотический экспрессирующий вектор на основе молекулярного скелета pPuzzle, дополнительно содержащий следующие компоненты, функционально связанные друг с другом:
рекомбинантную нуклеотидную последовательность, кодирующую POI, необязательно связанную с лидерной последовательностью, эффективной для вызывания секреции POI из клетки-хозяина;
промотор, эффективный для контроля экспрессии белка в клетке-хозяине;
терминатор транскрипции;
маркер селекции;
последовательности гомологичной интеграции, либо последовательности автономной репликации,
где промотор представляет собой промоторную последовательность дрожжей, выделенную из Pichia pastoris, где указанная последовательность идентична фрагменту в 1000 п.о. из 5'-некодирующего района гена THI3 (SEQ ID NO: 135) или соответствует указанному фрагменту в 1000 п.о. из 5'-некодирующего района гена THI3 (SEQ ID NO: 135) и имеет его функциональные характеристики и где клеткой-хозяином является клетка дрожжей, предпочтительно клетка штамма рода Komagataella, в частности клетка штамма Komagataella pastoris, Komagataella pseudopastoris или Komagataella phaffii.
3. Применение экспрессирующего вектора по п.2 для рекомбинантной экспрессии POI в клетке-хозяине.
4. Применение промоторной последовательности дрожжей, выделенной из Pichia pastoris и идентичной SEQ ID NO: 135 или соответствующей SEQ ID NO: 135 и имеющей ее функциональные характеристики, для модуляции экспрессии гомологичного POI в клетке-хозяине.
5. Применение по п.4, в котором эта промоторная последовательность дрожжей имеет увеличенную промоторную активность относительно промоторной активности природной промоторной последовательности POI.
6. Применение по п.4, в котором эта промоторная последовательность дрожжей имеет уменьшенную промоторную активность относительно промоторной активности природной промоторной последовательности POI.
Текст
ПОЛИМУН САЙНТИФИК ИММУНБИОЛОГИШЕ ФОРШУНГ ГМБХ (AT) Изобретение относится к способам увеличения секреции представляющего интерес белка (POI) из эукариотической клетки, предусматривающим коэкспрессию POI и по меньшей мере одного белка, который усиливает секрецию белка, причем указанный усиливающий (энхансерный) белок выбран из группы,состоящей из BMH2, BFR2, COG6, COY1, CUP5, IMH1, KIN2, SEC31, SSA4, SSE1, а также дополнительно к промоторной последовательности дрожжей, в частности промоторной последовательности гена PET9P.pastoris, имеющей при сравнимых условиях увеличенную промоторную активность относительно промоторной последовательности белка GAP. Кроме того, изобретение относится к экспрессирующему вектору, содержащему такую промоторную последовательность, и к применению такого экспрессирующего вектора для экспрессии POI в клетке-хозяине, а также к новым промоторным последовательностям генов изP.pastoris, которые применимы для экспрессии POI в дрожжах. Область техники, к которой относится изобретение Данное изобретение относится к области биотехнологии, в частности в области экспрессии генов, и относится к способу увеличения секреции представляющего интерес белка (POI) из эукариотической клетки, предусматривающему коэкспрессию рекомбинантной нуклеотидной последовательности, кодирующей представляющий интерес белок, и по меньшей мере одной рекомбинантной нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка. Это изобретение дополнительно относится к промоторной последовательности дрожжей, в частности промоторной последовательности гена PET9 Pichia pastoris (P.pastoris), которая применима, в частности, для экспрессии представляющего интерес белка в дрожжах, предпочтительно в штамме рода Komagataella (Komagataellapastoris, Komagataella pseudopastoris или Komagataella phaffii), и которая имеет увеличенную активность относительно активности промоторной последовательности гена глицеральдегидфосфатдегидрогеназы(GAP) Pichia pastoris при сравнимых условиях. Это изобретение относится дополнительно к экспрессирующему вектору на основе молекулярного скелета pPuzzle, содержащего последовательность промотора PET9 из P.pastoris, а также к применению такого экспрессирующего вектора для экспрессии представляющего интерес белка в клетке-хозяине, в частности в штамме рода Komagataella (K.pastoris,K.pseudopastoris или K.phaffii). Это изобретение относится также к новым промоторным последовательностям дрожжей генов изP.pastoris, которые применимы для экспрессии представляющего интерес белка в дрожжах, предпочтительно в штамме рода Komagataella (K.pastoris, K.pseudopastoris или K.phaffii). Уровень техники Как прокариотическими, так и эукариотическими хозяевами осуществлялась успешная секреция белков. Наиболее известными примерами являются бактерии, такие как Escherichia coli, дрожжи, такие как Saccharomyces cerevisiae, Pichia pastoris или Hansenula polymorpha, мицелиальные грибы, такие какCHO. Хотя секреция некоторых белков легко достигается при высоких скоростях, многие другие белки секретируются только при сравнительно низких уровнях (Punt et al., 2002; Macauley-Patrick et al., 2005;Porro et al., 2005). Гетерологичная экспрессия гена в организме-хозяине требует вектора, позволяющего стабильную трансформацию организма-хозяина. Этот вектор должен обеспечивать ген с функциональным промотором, примыкающим к 5'-концу кодирующей последовательности. Посредством этого транскрипция регулируется и инициируется этой промоторной последовательностью. Большинство промоторов, используемых в настоящее время, были произведены из генов, которые кодируют метаболические ферменты,которые обычно присутствуют в клетке при высоких концентрациях.EP 0103409 описывает применение промоторов дрожжей, ассоциированных с экспрессией конкретных ферментов в гликолитическом пути, т.е. промоторов, участвующих в экспрессии пируваткиназы,триозофосфатизомеразы, фосфоглюкозоизомеразы, фосфоглицератмутазы, гексокиназ 1 и 2, глюкокиназы, фосфофруктозокиназы, альдолазы и гена гликолитической регуляции.WO 97/44470 описывает промоторы дрожжей из Yarrowia lipolytica для белка фактора 1 элонгации трансляции (TEF1) и для рибосомного белка S7, которые пригодны для гетерологичной экспрессии белков в дрожжах.WO 2005/003310 обеспечивает способы экспрессии представляющей интерес кодирующей последовательности в дрожжах с использованием промотора глицеральдегид-3-фосфатдегидрогеназы или фосфоглицератмутазы из масляных дрожжей Yarrowia lipolytica. Один подход к улучшению секреции рекомбинантного белка осуществляли случайным мутагенезом(Archer et al., 1994; Lang and Looman, 1995). Основным недостатком этого способа является то, что положительные результаты обычно не могут переноситься на другие штаммы. Секреторный путь - фолдинг и процессинг белков эукариотических организмов, например дрожжей, является очень сложным, включающим в себя многие взаимодействующие члены (участники). Некоторые из этих белков имеют каталитическую активность в отношении белков, такие как протеиндисульфидизомераза (PDI), другие действуют посредством связывания с этими белками и предотвращения их агрегации (шапероны, например, BiP) или посредством стимуляции высвобождения этого белка во внеклеточное пространство в более поздней стадии в этом секреторном пути (белки SSO). Вследствие этой взаимозависимости увеличение скорости одной стадии реакции в этом секреторном пути не может автоматически увеличивать секрецию представляющего интерес белка, но вместо этого может вызывать ограничение скорости по меньшей мере в одной или нескольких из последующих стадий реакции и, следовательно, может не удалять, а только смещать узкое место (узкие места) этой системы экспрессии. Секреторный путь обычно начинается транслокацией трансмембранных полипептидов и полипептидов, предназначенных для секреции, в просвет эндоплазматического ретикулума (ЭР) (эндоплазматической сети, ЭПС). Для этой цели эти белки имеют аминоконцевую сигнальную последовательность. Эта сигнальная последовательность, также называемая лидерной последовательностью, обычно состоит из 13-36 довольно гидрофобных аминокислот; специальная консенсусная последовательность пока еще не была идентифицирована. На стороне просвета ЭР эта сигнальная последовательность удаляется сигналь-1 017803 ной пептидазой, тогда как возникающий полипептид связывается с шаперонами для предотвращения неправильного свертывания, пока не завершилась трансляция. Находящиеся в ЭР белки ответственны за механизмы правильного фолдинга. Они включают в себя, например, калнексин, калретикулин, Erp72,GRP94 и PDI, которая впоследствии катализирует образование дисульфидных связей, и пролилизомеразу. Кроме того, некоторые из посттрансляционных модификаций, такие как N-гликозилирование, инициируются в просвете ЭР. Белки экспортируются в аппарат Гольджи везикулярным транспортом (в виде пузырьков) только после того, как правильная конформация этих белков обеспечена контрольным механизмом качества ЭР. Если нет другого сигнала, белки, предназначенные для секреции, направляются из аппарата Гольджи к наружной стороне плазматической мембраны специфическими транспортными пузырьками (везикулами) (Stryer and Lubert, 1995; Gething and Sambrook, 1992). Было обнаружено, что в большинстве случаев ограничивающей скорость стадией в эукариотическом пути секреции является перемещение белков из ЭР в аппарат Гольджи (Shuster, 1991). Механизм,названный ЭР-ассоциированной деградацией белков (ERAD), является ответственным за удерживание ошибочно уложенных или немодифицированных функциональных белков в ЭР и их последующее удаление. В некоторых случаях было показано, что процесс секреции гетерологичных белков может ускоряться ко-сверхэкспрессией определенных белков, которые участвуют в этом секреторном пути и которые поддерживают фолдинг и/или процессинг других белков (Mattanovich et al., 2004). Коэкспрессия гена, кодирующего PDI, и гена, кодирующего гетерологичный дисульфид-связанный белок, была впервые предложена в WO 93/25676 в качестве средства увеличения получения этого гетерологичного белка. WO 93/25676 сообщает, что рекомбинантная экспрессия антистазина и антикоагулянтного белка клеща могла быть увеличена коэкспрессией с PDI.WO 94/08012 обеспечивает способы увеличения секреции белка дрожжами посредством увеличения экспрессии белка-шаперона Hsp70, т.е. KAR2 и BiP, или белка-шаперона PDI. Гомологи синтаксина дрожжей SSO1 и SSO2 являются необходимыми для слияния секреторных пузырьков с мембраной плазмы, действующими в качестве t-SNARE.WO 94/08024 описывает процесс продуцирования увеличенных количеств секретируемых чужеродных или эндогенных белков коэкспрессией генов SSO1 и SSO2.WO 03/057897 обеспечивает способы рекомбинантной экспрессии представляющего интерес белка коэкспрессией по меньшей мере двух генов, кодирующих белки, выбранные из группы, состоящей из белков-шаперонов GroEL, GRoES, Dnak, DnaJ, GRpe, ClpB и их гомологов.WO 2005/0617818 и WO 2006/067511 обеспечивают способы получения желаемого гетерологичного белка в дрожжах с использованием экспрессионной плазмиды на основе 2 мкм. Было показано, что продуцирование гетерологичного белка существенно увеличивается, когда гены одного или нескольких белков-шаперонов и гетерологичного белка, коэкспрессируются на одной и той же плазмиде. Другим подходом к стимуляции секреторного пути является сверхэкспрессия фактора транскрипции HAC1, активирующего реакцию неуложенного белка (UPR). Транскрипционные анализы показали,что до 330 генов регулируются HAC1, большинство из которых принадлежит к функциональным группам секреции или биогенезу секреторных органелл (например, находящимся в ЭР шаперонам, фолдазам,компонентам транслокона (комплекса белков, ассоциированных с транслокацией возникающих полипептидов в просвет ЭР).WO 01/72783 описывает способы увеличения количества гетерологичного белка, секретируемого из эукариотической клетки, индукцией увеличенной реакции неуложенного белка (UPR), где эта UPR модулируется коэкспрессией белка, выбранного из группы, состоящей из HAC1, PTC2 и IRE1. Флавофермент ERO1 необходим для окисления дитиолов белка в ЭР. Он окисляется молекулярным кислородом и действует в качестве специфического оксиданта PDI. Дисульфиды, генерируемые de novo в ERO1, переносятся к PDI и затем к субстратным белкам реакциями обмена дитиол-дисульфид.WO 99/07727 описывает применение ЕРО 1 для увеличения образования дисульфидных связей и тем самым для увеличения выхода правильно уложенных рекомбинантных белков. Хотя эти подходы, после их установления, могут быть перенесены на другие штаммы и использованы также для других белков, они имеют недостаток, заключающийся в том, что отсутствует подлинное понимание функции таких белков, поддерживающих секрецию других белков. Можно думать, что успешная секреция высокого уровня рекомбинантного белка может ограничиваться в ряде различных стадий, таких как фолдинг, образование дисульфидных мостиков, гликозилирование, транспорт внутри клетки или высвобождение из клетки. Поскольку многие из этих процессов все еще не выяснены полностью, можно также думать, что в них участвуют гораздо больше белков, которые поддерживают секрецию белка, чем это известно в настоящее время. Однако такие вспомогательные(хелперные) функции не могут быть предсказаны при существующем знании состояния в данной области, даже в случае доступности последовательности ДНК всего генома организма-хозяина. Белки, о которых известно, что они участвуют в секреторном пути дрожжей, часто влияют на процесс фолдинга и последующую секрецию белков в различных стадиях процесса секреции. Таким образом, желательным является обеспечение новых способов увеличения получения секретируемых белков в прокариотических клетках, которые являются простыми и эффективными. Желательным является также обеспечение новых генов для применения в способах увеличенного получения секретируемых белков. Желательным является также обеспечение новых промоторов дрожжей, в частности,для применения в экспрессии гетерологичных или гомологичных генов в дрожжах, в частности в дрожжах рода Komagataella, а также для экспрессии желаемого гена в любой другой эукариотической системе экспрессии. Сущность изобретения Целью данного изобретения является обеспечение способа увеличения секреции представляющего интерес белка (PQI) из эукариотической клетки, предусматривающего коэкспрессию рекомбинантной нуклеотидной последовательности, кодирующей POI, и по меньшей мере одной рекомбинантной нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка из клеткихозяина. Увеличение секреции POI определяют на основе сравнения выхода секреции этого белка в присутствии или в отсутствие коэкспрессии указанного белка, который увеличивает секрецию белка. В одном аспекте это изобретение относится к такому способу, включающему в себя коэкспрессию рекомбинантной нуклеотидной последовательности, кодирующей POI, и по меньшей мере одной другой рекомбинантной нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка, где указанный белок, который увеличивает секрецию белка, выбран из группы, состоящей изBMH2, BFR2, COG6, COY1, CUP5, IMH1, KIN2, SEC31, SSA4, SSE1 и биологически активного фрагмента любого из перечисленных белков. В другом аспекте это изобретение относится к такому способу, в котором по меньшей мере одна другая рекомбинантная нуклеотидная последовательность получена из дрожжей, предпочтительно изSaccharomyces cerevisiae или из Pichia pastoris. В другом аспекте это изобретение относится к такому способу, в котором по меньшей мере одна рекомбинантная нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, получена из Saccharomyces cerevisiae и является идентичной или соответствует или имеет функциональные характеристики последовательности, выбранной из группы, состоящей из SEQ ID NO: 32,SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38,SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41. В другом аспекте это изобретение относится к такому способу, в котором по меньшей мере одна рекомбинантная нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, получена из Pichia pastoris и является идентичной или соответствует или имеет функциональные характеристики последовательности, выбранной из группы, состоящей из SEQ ID NO: 42,SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48,SEQ ID NO: 49, SEQ ID NO: 50 и SEQ ID NO: 51. Еще в одном аспекте это изобретение относится к применению такой нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка, в качестве энхансера секреции белка, в частности в качестве энхансера секреции POI из эукариотической клетки. Другой целью этого изобретения является обеспечение нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка из клетки-хозяина, где эта нуклеотидная последовательность выделена из Pichia pastoris и является идентичной или соответствует или имеет функциональные характеристики последовательности, выбранной из группы, состоящей из нуклеотидной последовательности, кодирующей белок BMH2 (SEQ ID NO: 42), нуклеотидной последовательности, кодирующей белок BFR2 (SEQ ID NO: 43), нуклеотидной последовательности, кодирующей белок COG6KIN2 (SEQ ID NO: 48), нуклеотидной последовательности, кодирующей белок SEC31 (SEQ ID NO: 49),нуклеотидной последовательности, кодирующей белок SSA4 (SEQ ID NO: 50), и нуклеотидной последовательности, кодирующей белок SSE1 (SEQ ID NO: 51). Другой целью этого изобретения является обеспечение последовательности промотора гена PET9 дрожжей из Pichia pastoris, который применим для экспрессии POI в дрожжах, предпочтительно в штамме рода Komagataella, в частности в штамме K.pastoris, K.pseudopastoris или K.phaffii, и который имеет при сравнимых условиях увеличенную промоторную активность относительно промоторной активности промоторной последовательности белка GAP Pichia pastoris. Другой целью этого изобретения является обеспечение такой промоторной последовательности дрожжей, в частности промоторной последовательности дрожжей, идентичной или соответствующей и имеющей функциональные характеристики SEQ ID NO: 125, или ее функционально эквивалентного варианта. В другом аспекте это изобретение относится к экспрессирующему вектору на основе молекулярного скелета pPuzzle, дополнительно содержащему промоторную последовательность дрожжей гена PET9 из Pichia pastoris, которая является идентичной или соответствует и имеет функциональные характери-3 017803 стики SEQ ID NO: 125, или ее функционально эквивалентный вариант. Еще в одном аспекте это изобретение относится к применению такой плазмиды для экспрессии POI в клетке-хозяине, причем эта клетка-хозяин предпочтительно является клеткой штамма родаKomagataella, в частности клеткой штамма K.pastoris, K.pseudopastoris или K.phaffii. Другой целью этого изобретения является обеспечение промоторной последовательности дрожжей из Pichia pastoris, которая применима для экспрессии POI в дрожжах, предпочтительно в штамме родаKomagataella, где эта промоторная последовательность дрожжей является идентичной или соответствует и имеет функциональные характеристики последовательности, выбранной из группы, состоящей из фрагмента 1000 п.о. из 5'-некодирующего района гена GND1 (SEQ ID NO: 126), фрагмента 1000 п.о. из 5'-некодирующего района гена GPM1 (SEQ ID NO: 127), фрагмента 1000 п.о. из 5'-некодирующего района гена HSP90 (SEQ ID NO: 128), фрагмента 1000 п.о. из 5'-некодирующего района гена KAR2(SEQ ID NO: 144), фрагмента 1000 п.о. из 5'-некодирующего района гена NMT1 (SEQ ID NO: 145), фрагмента 1000 п.о. из 5'-некодирующего района гена РНО 8 (SEQ ID NO: 146) и фрагмента 1000 п.о. из 5'-некодирующего района гена предшественника FET3 (FET3pre) (SEQ ID NO: 147) или функционально эквивалентного варианта любой из перечисленных последовательностей. В другом аспекте это изобретение относится к экспрессирующему вектору на основе молекулярного скелета pPuzzle, дополнительно содержащему такую промоторную последовательность дрожжей,идентичную или соответствующую и имеющую функциональные характеристики последовательности,выбранной из группы, состоящей из SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129,SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135,SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141,SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147,или функционально эквивалентный вариант любой из перечисленных последовательностей. В другом аспекте это изобретение относится к применению такого экспрессирующего вектора для экспрессии POI в клетке-хозяине, причем эта клетка-хозяин предпочтительно является клеткой штамма рода Komagataella, в частности клеткой штамма K.pastoris, K.pseudopastoris или K.phaffii. Принцип этого изобретения дополнительно описан в независимых пунктах формулы изобретения,тогда как различные варианты этого изобретения являются предметом зависимых пунктов формулы изобретения. Краткое описание чертежей Фиг. 1 показывает структуру и релевантные сайты расщепления рестрикционных ферментов (рестриктаз) молекулярного скелета вектора pPuzzle, содержащего маркер селекции AmpR для E.coli, амплифицированный из клонирующего вектора pBR322, и сайт инициации репликации (ORI), амплифицированный из клонирующего вектора pUC19. Подробное описание процедуры клонирования молекулярного скелета вектора pPuzzle можно найти в примере 3. Фиг. 2 показывает структуру и релевантные сайты расщепления рестрикционных ферментов (рестриктаз) молекулярного скелета вектора pPuzzlezeoRPPET9eGFPAOXTT, где репортерный ген GFP(зеленого флуоресцентного белка) находится под контролем фрагмента 1000 п.о. из 5'-некодирующего района гена PET9 P.pastoris. Этот вектор дополнительно содержит ORI E.coli, амплифицированный изpUC19, терминатор транскрипции гена цитохрома с из S.cerevisiae (cyc1TT), маркер селекции зеоцина и промоторную последовательность гена АОХ 1 P.pastoris (AOXTTpart 1 и 2). Подробное описание изобретения Для лучшего понимания регуляции генов организма-хозяина во время продуцирования белка, проводили эксперименты по гибридизации микроматрицы ДНК с клонами P.pastoris, экспрессирующими рекомбинантный трипсиноген человека (rh-трипсиноген), в сравнении с непродуцирующим штаммом (в соответствии с Sauer et al., 2004). Подробное описание экспериментальной процедуры можно найти в примере 1. Эти эксперименты позволяют определять уровни транскрипции приблизительно 1/3 всех генов в P.pastoris, но они не обеспечивают прямой информации о потенциале любого до сих пор не идентифицированного белка в отношении усиления секреции. Дополнительный анализ данных, полученных из гибридизации микроматриц ДНК, позволял идентифицировать потенциальные способствующие секреции белки или их гены соответственно. Для достижения этого относительные уровни экспрессии всех измеряемых генов штамма P.pastoris, трансформированного плазмидой, несущей ген rh-трипсиногена, сравнивали со штаммом дикого типа, культивируемого при тех же самых условиях. Затем эти гены располагали по относительному различию их уровней экспрессии и некоторые из 524 генов с наивысшим различием подвергали дополнительному анализу. Поскольку используемые для этих экспериментов микроматрицы ДНК были получены из последовательностей Saccharomyces cerevisiae, только предположительные функции генов для P.pastoris могут быть отнесены в соответствии с гомологией к S.cerevisiae. После ранжирования 524 дифференциально регулируемых генов на основе их предположительной внутриклеточной локализации и функции и сосредоточения на генах, участвующих в секреции и/или общей реакции на стресс, из количества 64 потенциально представляющих интерес генов были отобраны 15 генов для дополнительного анализа. Эти гены клонировали из S.cerevisiae при помощи ПЦР и субклонировали в экспрессирующий вектор P.pastoris и затем трансформировали в штамм P.pastoris, экспрессирующий Fab-фрагмент моноклонального антитела (2F5mAB) против ВИЧ 1. Посредством культивирования этих клонов, продуцирующих как Fab-фрагмент, так и различные предположительные хелперные белки секреции, в сравнении с клонами, продуцирующими только Fab-фрагмент, удалось идентифицировать благоприятное действие сверхэкспрессии следующих генов, кодирующих предположительные хелперные белки, на секрецию Fab-фрагмента: PDI1, CUP5, SSA4,BMH2, KIN2, KAR2, HAC1, ERO1, SSE1, BFR2, COG6, SSO2, COY1, IMH1 и SEC31. Белки PDI1, KAR2, HAC1, ERO1 и SSO2 уже известны в данной области как являющиеся успешно применимыми хелперными факторами фолдинга/секреции при коэкспрессии во время рекомбинантной экспрессии гетерологичных белков. Другие белки, идентифицированные в анализе с микроматрицами ДНК, т.е. CUP5, SSA4, BMH2, KIN2, SSE1, BFR2, COG6, COY1, IMH1 и SEC31, еще не были описаны как имеющие благоприятное действие на секрецию рекомбинантно продуцируемого POI. Таким образом, данное изобретение в его первом аспекте относится к способу увеличения секрецииPOI из эукариотической клетки, предусматривающему: обеспечение клетки-хозяина, содержащей рекомбинантную нуклеотидную последовательность, кодирующую POI, и по меньшей мере одну рекомбинантную нуклеотидную последовательность, кодирующую белок, который увеличивает секрецию белка; и экспрессию в этой клетке-хозяине рекомбинантной нуклеотидной последовательности, кодирующей POI, и по меньшей мере одной рекомбинантной нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка, где указанный белок, который увеличивает секрецию белка, выбран из группы, состоящей из BMH2, BFR2, COG6, COY1, CUP5, IMH1, KIN2, SEC31, SSA4, SSE1 и биологически активного фрагмента любого из перечисленных белков. Термин "представляющий интерес белок (POI)" относится в данном контексте к белку, который получают посредством рекомбинантной технологии в клетке-хозяине. Более конкретно, этот белок может быть либо полипептидом, не встречающимся природно в клетке-хозяине, т.е. гетерологичным белком,либо может быть природным в отношении этой клетки-хозяина, т.е. гомологичным белком в отношении этой клетки-хозяина, но полученным, например, трансформацией вектором саморепликации, содержащим последовательность нуклеиновой кислоты, кодирующую POI, или после интеграции рекомбинантными способами одной или более копий последовательности нуклеиновой кислоты, кодирующей POI, в геном клетки-хозяина или рекомбинантной модификации одной или более регуляторных последовательностей, контролирующих экспрессию гена, кодирующего POI, например промоторной последовательности. Этот POI может быть любым эукариотическим или прокариотическим белком. Этот белок может быть природно секретируемым белком или внутриклеточным белком, т.е. белком, который не секретируется природно. Данное изобретение включает в себя также биологически активные фрагменты природно секретируемых или природно не секретируемых белков. Описанный здесь секретируемый POI может быть, но не ограничивается им, белком, подходящим в качестве биофармацевтического вещества, такого как антитело или фрагмент антитела, фактор роста,гормон, фермент, вакцина или белок, который может быть использован для промышленного применения,такой как, например, фермент. Внутриклеточный POI, описанный здесь, может быть, но не ограничивается ими, хелперным фактором для секреции белка или ферментом, используемым для целей метаболического конструирования. В другом варианте осуществления POI является эукариотическим белком или его биологически активным фрагментом, предпочтительно иммуноглобулином или фрагментом иммуноглобулина, таким какFc-фрагмент или Fab-фрагмент. Наиболее предпочтительно POI является Fab-фрагментом моноклонального анти-ВИЧ 1-антитела 2F5. Обычно представляющие интерес белки, описанные здесь, могут быть получены способами рекомбинантной экспрессии, хорошо известными квалифицированному в данной области специалисту. Понятно, что описанные здесь способы могут дополнительно включать в себя культивирование указанных рекомбинантных клеток-хозяев при условиях, позволяющих экспрессию POI. Затем секрети-5 017803 рованный, рекомбинантно полученный POI может быть выделен из среды культуры клеток и дополнительно очищен способами, хорошо известными квалифицированному в данной области специалисту. В данном контексте "биологически активный фрагмент" белка будет обозначать фрагмент белка,который проявляет биологическое действие, сходное или сравнимое с действием полноразмерного белка. Такие фрагменты могут быть получены, например, амино- или карбоксиконцевыми делециями, а также внутренними делециями. Обычно клеткой-хозяином, из которой секретируются эти белки, может быть любая эукариотическая клетка, подходящая для рекомбинантной экспрессии POI. В предпочтительном варианте осуществления это изобретение относится к такому способу, в котором этой клеткой-хозяином является клетка грибов, например клетка дрожжей, или высшая эукариотическая клетка, например клетка млекопитающего или клетка растения. Примеры клеток дрожжей включают в себя, но не ограничиваются ими, род Saccharomyces (например, Saccharomyces cerevisiae), род Komagataella (Komagataella pastoris, Komagataella pseudopastoris илиKomagataella phaffii), Pichia methanolica, Hansenula polymorpha или Kluyveromyces lactis. В предпочтительном варианте осуществления это изобретение относится к способу, в котором клеткой дрожжей является клетка рода Komagataella, в частности клетка штамма Komagataella pastoris,Komagataella pseudopastoris или Komagataella phaffii. Прежний вид Pichia pastoris был подразделен и переименован в Komagataella pastoris и Komagataellaphaffii (Kurtzman, 2005). Таким образом, Pichia pastoris является синонимом как для Komagataella pastoris,так и для Komagataella phaffii. Нуклеотидные последовательности, кодирующие белки, которые увеличивают секрецию белка, могут быть получены из различных источников. Указанные белки могут участвовать в секреторном пути эукариотических белков. В одном аспекте это изобретение относится к такому способу, в котором по меньшей мере одна рекомбинантная нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, является нуклеотидной последовательностью дрожжей, предпочтительно, но без ограничения,нуклеотидной последовательностью вида дрожжей Saccharomyces cerevisiae или Pichia pastoris. Могут быть использованы также гомологичные нуклеотидные последовательности из других подходящих дрожжей, или других грибов, или из других организмов, таких как позвоночные. Термин "гомологичные нуклеотидные последовательности" относится в этом контексте к нуклеотидным последовательностям, которые являются родственными, но не идентичными в их нуклеотидной последовательности с рассматриваемой нуклеотидной последовательностью, и выполняют, по существу,ту же самую функцию. В следующем аспекте это изобретение относится к такому способу, в котором по меньшей мере одна рекомбинантная нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, получена из Saccharomyces cerevisiae и является идентичной или соответствует и имеет функциональные характеристики последовательности, выбранной из группы, состоящей изSEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37,SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41. В этом контексте термин "нуклеотидная последовательность, которая соответствует и имеет функциональные характеристики", включает в себя вариации в ее нуклеотидном составе, в том числе вариации вследствие вырожденности генетического кода, посредством чего эта нуклеотидная последовательность выполняет, по существу, ту же самую функцию. Скринингом базы данных генома P.pastoris (ERGO, IG-66, Integrated Genomics) с использованием нуклеотидных последовательностей хелперных факторов секреции, выделенных из Saccharomycescerevisiae, были идентифицированы гомологичные нуклеотидные последовательности в Pichia pastoris. Предварительные экспериментальные результаты указывают на то, что эти гомологичные нуклеотидные последовательности, выделенные из Pichia pastoris, обнаруживают сходные действия на секрецию белка из клетки-хозяина в сравнении с соответствующими нуклеотидными последовательностями, выделенными из Saccharomyces cerevisiae. В следующем аспекте это изобретение относится к такому способу, в котором по меньшей мере одна рекомбинантная нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, получена из Pichia pastoris и является идентичной или соответствует и имеет функциональные характеристики последовательности, выбранной из группы, состоящей из SEQ ID NO: 42,SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48,SEQ ID NO: 49, SEQ ID NO: 50 и SEQ ID NO: 51. В дополнительном аспекте это изобретение относится к такому способу, в котором рекомбинантная нуклеотидная последовательность, кодирующая POI, обеспечена на плазмиде, подходящей для интеграции в геном клетки-хозяина, в единственной копии или во множественных копиях на клетку. Рекомбинантная нуклеотидная последовательность, кодирующая POI, может быть также обеспечена на плазмиде автономной репликации в единственной копии или во множественных копиях на клетку. Альтернативно, рекомбинантная нуклеотидная последовательность, кодирующая POI, и рекомбинантная нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка,присутствуют на одной и той же плазмиде в единственной копии или множественных копиях на клетку. Термины "плазмида" и "вектор" в данном контексте включают в себя нуклеотидные последовательности автономной репликации, а также интегрирующиеся в геном нуклеотидные последовательности. В следующем аспекте это изобретение относится к такому способу, в котором эта плазмида является эукариотическим экспрессирующим вектором, предпочтительно экспрессирующим вектором дрожжей."Экспрессирующие векторы" определяются здесь как ДНК-последовательности, которые необходимы для транскрипции клонированных рекомбинантных последовательностей, т.е. рекомбинантных генов, и трансляции их мРНК в подходящем организме-хозяине. Такие экспрессирующие векторы обычно содержат сайт (ориджин) начала репликации в клетках-хозяевах, маркеры селекции (например, ген синтеза аминокислоты или ген, придающий устойчивость к антибиотикам, таким как зеоцин, канамицин,G418 или гигромицин), ряд сайтов расщепления рестрикционных ферментов, подходящую последовательность промотора и терминатор транскрипции, причем эти компоненты функционально связаны вместе. Термин "функционально связанные" относится в этом контексте к ассоциации нуклеотидных последовательностей на единственной молекуле нуклеиновой кислоты, например векторе, таким образом,что на функцию одной или более нуклеотидных последовательностей влияет по меньшей мере одна другая нуклеотидная последовательность, присутствующая на указанной молекуле нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью рекомбинантного гена,когда он способен влиять на экспрессию этой кодирующей последовательности. Экспрессирующие векторы могут включать в себя, но не ограничиваются ими, клонирующие векторы, модифицированные клонирующие векторы и специфически сконструированные плазмиды. Экспрессирующим вектором этого изобретения может быть любой экспрессирующий вектор, подходящий для экспрессии рекомбинантного гена в клетке-хозяине, и его выбирают в зависимости от организмахозяина. В другом аспекте это изобретение относится к такому способу, в котором экспрессирующий вектор содержит лидерную последовательность секреции, эффективную для вызывания секреции POI из клеткихозяина. Присутствие такой лидерной последовательности секреции в экспрессирующем векторе необходимо, когда POI, предназначенный для рекомбинантной экспрессии и секреции, является белком, который в природе не секретируется и, следовательно, лишен природной лидерной последовательности секреции,или его нуклеотидная последовательность была клонирована без его природной лидерной последовательности секреции. Обычно любая лидерная последовательность секреции, эффективная для вызывания секреции POI из клетки-хозяина, может быть использована в данном изобретении. Эта лидерная последовательность секреции может происходить из дрожжевого источника, например из -фактора дрожжей,такого как MFa Saccharomyces cerevisiae, или дрожжевой фосфатазы, из источника млекопитающего или растения или других источников. Выбор подходящей лидерной последовательности секреции является очевидным для квалифицированного лица. Альтернативно, лидерная последовательность секреции может быть слита с нуклеотидной последовательностью, кодирующей POI, который предназначен для рекомбинантной экспрессии, общепринятыми способами клонирования, известными квалифицированному специалисту, перед клонированием этой нуклеотидной последовательности в экспрессирующем векторе, или нуклеотидную последовательность,кодирующую POI, содержащую природную лидерную последовательность секреции, клонируют в этом экспрессирующем векторе. В этих случаях не требуется присутствие лидерной последовательности секреции в этом экспрессирующем векторе. Для возможности экспрессии рекомбинантной нуклеотидной последовательности в клетке-хозяине должна быть обеспечена рекомбинантная нуклеотидная последовательность с функциональным промотором, примыкающим к 5'-концу этой кодирующей последовательности. Посредством этого транскрипция регулируется и инициируется этой промоторной последовательностью. В следующем аспекте это изобретение относится к такому способу, в котором экспрессирующий вектор содержит промоторную последовательность, эффективную для регуляции экспрессии POI в клетке-хозяине."Промоторной последовательностью" в этом контексте называют ДНК-последовательность, способную регулировать экспрессию кодирующей последовательности или функциональной РНК. Подходящие промоторные последовательности для применения с клетками-хозяевами дрожжей могут включать в себя, но не ограничиваются ими, промоторы, полученные из генов, которые кодируют метаболические ферменты, о которых известно, что они присутствуют при высоких концентрациях в клетке, например гликолитические ферменты, такие как триозофосфатизомераза (TPI), фосфоглицераткиназа (PGK), глицеральдегид-3-фосфатдегидрогеназа (GAPDH), алкогольоксидаза (АОХ), лактаза Подходящие промоторные последовательности для применения с клетками-хозяевами млекопитающих могут включать в себя, но не ограничиваются ими, промоторы, полученные из геномов вирусов,гетерологичные промоторы млекопитающих, например промотор актина или промотор иммуноглобулина и промоторы белка теплового шока. Для идентификации новых промоторных последовательностей для применения в клетках-хозяевах дрожжей, предпочтительно для применения в штамме рода Komagataella, в частности для применения в штамме K.pastoris, K.pseudopastoris или K.phaffii, для рекомбинантной экспрессии POI, данные, полученные из гибридизации ДНК-микроматриц, описанные в примере 1, оценивали специфическим образом. Промоторные последовательности 23 представляющих наибольший интерес генов, идентифицированных этим анализом (до 1000 р.н. 5'-района соответствующих генов), амплифицировали из P.pastoris при помощи ПЦР и клонировали в экспрессирующий вектор P.pastoris, который дополнительно несет усиленный зеленый флуоресцентный белок (eGFP) в качестве репортерного гена. Для испытания свойств этих различных промоторов, т.е. промоторной активности, 25 векторов (в том числе два контрольных вектора) последовательно трансформировали в штамм P.pastoris. Эти клоны культивировали при разных условиях культивирования и количество рекомбинантного eGFP определяли количественно с использованием проточного цитометрического анализа. Сравнительный анализ хорошо установленного дрожжевого промотора GAP и этих 23 промоторных последовательностей приведен в примере 5. Термин "промоторная активность" относится здесь к оценке транскрипционной эффективности промотора. Она может быть определена непосредственно измерением количества транскрипции мРНК от этого промотора, например, Нозерн-блоттингом или опосредованно измерением количества генного продукта, экспрессируемого от этого промотора. Неожиданно было обнаружено, что фрагмент 1000 п.о. из 5'-некодирующего района гена PET9P.pastoris приводит к совершенно неожиданным высоким уровням экспрессии рекомбинантого eGFP, в диапазоне от приблизительно 700 до приблизительно 1600% промоторной активности промотора GAP, в зависимости от источника углерода во время культивирования, при экспериментальных условиях, описанных в примере 5.PET9 известен из S.cerevisiae в качестве главного носителя АДФ/АТФ митохондриальной внутренней мембраны, который заменяет цитозольным АДФ синтезированный митохондриями АТФ. В другом аспекте это изобретение относится к способу увеличения секреции POI из эукариотической клетки, в котором нуклеотидная последовательность, кодирующая POI, контролируется промоторной последовательностью, которая является фрагментом 1000 п.о. из 5'-некодирующего района генаPET9 Pichia pastoris, соответствующим SEQ ID NO: 125, или его функционально эквивалентным вариантом, а клетка-хозяин является клеткой рода Komagataella, в частности клеткой штамма K.pastoris,K.pseudopastoris или K.phaffii. В другом аспекте это изобретение относится к применению нуклеотидной последовательности, выделенной из Saccharomyces cerevisiae и кодирующей белок, который увеличивает секрецию белка и выбран из группы, состоящей из BMH2, BFR2, COG6, COY1, CUP5, IMH1, KIN2, SEC31, SSA4, SSE1, и биологически активного фрагмента любого из перечисленных белков, в качестве усилителя (энхансера) секреции POI из эукариотической клетки, предпочтительно в клетке дрожжей и наиболее предпочтительно в клетке штамма K.pastoris, K.pseudopastoris или K.phaffii. В следующем аспекте это изобретение относится к такому применению, в котором нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, является идентичной или соответствует и имеет функциональные характеристики последовательности, выбранной из группы, состоящей из SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36,SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41. В другом аспекте это изобретение относится к применению нуклеотидной последовательности, выделенной из Pichia pastoris и кодирующей белок, который увеличивает секрецию белка и выбран из группы, состоящей из BMH2, BFR2, COG6, COY1, CUP5, IMH1, KIN2, SEC31, SSA4, SSE1 и биологически активного фрагмента любого из перечисленных белков, в качестве энхансера, в частности в качестве энхансера секреции из эукариотической клетки, предпочтительно в клетке дрожжей и наиболее предпочтительно в клетке штамма K.pastoris, K.pseudopastoris или K.phaffii. В следующем аспекте это изобретение относится к такому применению, в котором нуклеотидная последовательность, кодирующая белок, который увеличивает секрецию белка, является идентичной или соответствует и имеет функциональные характеристики последовательности, выбранной из группы, состоящей из SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46,SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50 и SEQ ID NO: 51.SRP-зависимом нацеливании белка на мембрану ЭР перед котрансляционной транслокацией этого белка в ЭР-просвет и индуцируется после реакции стресса. Шаперонины подкласса SSE/HSP110 HSP70-семейства, которые кодируются SSE1 и SSE2, способствуют фолдингу связыванием с возникающими пептидами и удерживанием их в фолдинг-компетентном состоянии, однако они не могут активно стимулировать реакции фолдинга. На основе их удерживающей("холдазной") активности взаимодействия с шаперонами, такими как Ssa1p и Ssb1p HSP70-семейства, так же как и с комплексом HSP90, кажутся вероятными.Sec31p является незаменимым фосфопротеиновым компонентом комплекса белка оболочки II(COPII) пузырьков секреторного пути, в комплексе с Sec13p. Дефекты роста вследствие мутаций либо в Sec13, либо в Sec23 (а также в Sec16 и Ypt1) могут быть преодолены сверхэкспрессией незаменимого гена BFR2 S.cerevisiae. Он был выделен в виде многокопийного супрессора лекарственного средства Брефелдина А, грибного метаболита, который препятствует притоку этого белка в аппарат Гольджи и разрушает структуру самого аппарата Гольджи. Было обнаружено, что белки 14-3-3, кодируемые BMH1 и BMH2, участвуют во множественных стадиях в направленной миграции пузырьков, особенно в выходе белка из ЭР, прямой направленной миграции мультимерных белков мембраны клеточной поверхности, а также в ретроградной транспортировке в аппарате Гольджи.COG6 принадлежит к 1-8 генам, кодирующим консервативный олигомерный комплекс аппарата Гольджи (COG), имеющий восемь субъединиц периферический белок Гольджи, который участвует в направленной мембранной миграции и синтезе гликоконъюгатов. Кроме того, комплекс COG не только является необходимым для поддержания нормальной структуры и функции Гольджи, но также и непосредственно участвует в ретроградном транспорте пузырьков внутри аппарата Гольджи. Молекулярная функция Coy1, белка, идентифицированного по сходству с CASP млекопитающих,еще не выяснена, но предполагается, что он играет роль в транспорте пузырьков Гольджи через взаимодействие с Gos1. Gos1 является SNARE (растворимым чувствительным к N-этилмалеимиду белком фактора присоединения), обычно используемым в качестве маркера более поздних компартментов Гольджи в S.cerevisiae. Продукт гена IMH1/SYS3 является членом периферической мембраны Гольджи, участвующим в транспорте пузырьков между поздним компартментом Гольджи и предвакуолярным подобным эндосоме компартментом. IMH1 рекрутируется аппаратом Гольджи посредством двух ARF-подобных (ARL)Kin2 и близкородственная Kin1 являются двумя серин/треонин-протеинкиназами, локализованными на цитоплазматической стороне плазматической мембраны. Каталитическая активность Kin2 является существенной для ее функции в регуляции экзоцитоза фосфорилированием t-SNARE Sec9 плазматической мембраны, белка, действующего в конечной фазе экзоцитоза. Генетический анализ указывает на то,что киназы KIN действуют ниже в этом процессе, чем экзоцист, фактор привязывания пузырьков в участке экзоцитоза, и его регулятор Sec4 (GTP-связывающий белок семейства Ras).CUP5 кодирует с-субъединицу дрожжевого вакуолярного V0-домена (H)-АТФазы (V-АТФазы),принадлежащей к семейству АТФ-зависимых протоновых насосов, которые подкисляют центральную вакуоль дрожжей. Этот V0-домен является интегральной мембранной структурой из пяти субъединиц,ответственных за транспорт протонов через мембрану. Сборка V0-домена невозможна в отсутствиеCUP5. V-АТФазная функция является важной для многих процессов, включающих в себя эндоцитоз,деградацию белка и сопряженный транспорт через мембрану. Дополнительно, сообщалась рольV-АТФазы в детоксификации меди, метаболизме железа и митохондриальной функции. В другом аспекте это изобретение относится к нуклеотидной последовательности, кодирующей белок, который увеличивает секрецию белка из клетки-хозяина, где эта нуклеотидная последовательность выделена из Pichia pastoris и является идентичной или соответствует или имеет функциональные характеристики последовательности, выбранной из группы, состоящей из нуклеотидной последовательности,кодирующей белок BMH2 (SEQ ID NO: 42), нуклеотидной последовательности, кодирующей белок BFR2(SEQ ID NO: 48), нуклеотидной последовательности, кодирующей белок SEC31 (SEQ ID NO: 49), нуклеотидной последовательности, кодирующей белок SSA4 (SEQ ID NO: 50), и нуклеотидной последовательности, кодирующей белок SSE1 (SEQ ID NO: 51). В следующем аспекте это изобретение относится к промоторной последовательности дрожжей, являющейся фрагментом 1000 п.о. из 5'-некодирующего района гена PET9, соответствующимSEQ ID NO: 125, или его функционально эквивалентным вариантом, и выделенной из Pichia pastoris. Должно быть понятно, что промоторные последовательности различной уменьшающейся длины могут иметь идентичную промоторную активность и, следовдтельно, должны быть также включены в данное изобретение, так как точные границы регуляторной последовательности этого 5'-некодирующего района гена PET9 не были определены. Таким образом, термин "функционально эквивалентный вариант" промоторной последовательности обозначает в данном контексте нуклеотидную последовательность, полученную из модификации этой нуклеотидной последовательности инсерцией, делецией или заменой одного или более нуклеотидов внутри этой последовательности или на любом дистальном конце или на обоих дистальных концах этой последовательности, причем модификация не должна влиять (в частности, не должна нарушать) на промоторную активность этой нуклеотидной последовательности. В следующем аспекте это изобретение относится к такой промоторной последовательности дрожжей, которая имеет при сравнимых условиях улучшенные свойства в отношении экспрессии POI в дрожжах, предпочтительно в штамме рода Komagataella, в частности в штамме Komagataella pastoris,Komagataella pseudopastoris или Komagataella phaffii, относительно промотора дрожжей, известного в данной области, в частности родственного GAP-промотору, выделенному из Pichia pastoris. В следующем аспекте это изобретение относится к такой промоторной последовательности дрожжей, имеющей при сравнимых условиях, по меньшей мере, ту же самую или по меньшей мере приблизительно 1,5-кратную, или по меньшей мере приблизительно 2-кратную, или по меньшей мере приблизительно 4-кратную, 7-кратную, 10-кратную, или по меньшей мере приблизительно 15-кратную промоторную активность относительно промоторной активности промотора GAP, выделенного из Pichia pastoris. Желательно иметь систему экспрессии для рекомбинантной экспрессии нуклеотидной последовательности в организме-хозяине, в частности в хозяине-дрожжах, более конкретно, в штамме рода Komagataella, которая предоставляет возможность легкого изменения различных частей вектора, таких как маркер селекции, например зеоцин, канамицин/генетицин, гигромицин и др., промотор или терминатор транскрипции. Было бы также выгодно, если бы этот вектор мог быть либо интегрирован в геном хозяина (с использованием последовательностей гомологичной интеграции), либо локализован эписомально заменой части этого вектора, которая не является важной для экспрессии гетерологичного гена. Для конструирования новой векторной системы pPuzzle, которая обеспечивает вышеупомянутые преимущества, в первой стадии был генерирован скелет вектора pPuzzle, несущий сайт инициации репликации и маркер селекции для Escherichia coli (E.coli), который позволяет амплификацию этого скелета вектора в E.coli. Кроме того, этот скелет вектора pPuzzle содержит сайт множественного клонирования(см. фиг. 1 и пример 3). Во второй стадии конструировали экспрессирующий вектор pPuzzle, несущий эукариотический маркер селекции, промотор для рекомбинантной экспрессии гетерологичной или гомологичной нуклеотидной последовательности, терминатор транскрипции и, необязательно, последовательности для гомологичной интеграции этого вектора в геном хозяина (см. пример 4). Выбор промоторной последовательности и маркера селекции зависит от организма-хозяина, который используют для рекомбинантной экспрессии нуклеотидной последовательности. Терминатором транскрипции может быть, в принципе, каждый функциональный терминатор транскрипции и, в частности, им является терминатор транскрипции гена цитохрома с из S.cerevisiae. Далее, присутствие последовательностей гомологичной интеграции зависит от того, предназначена или не предназначена эта нуклеотидная последовательность для интеграции в геном хозяина. Поскольку маркер селекции, промоторная последовательность и последовательности гомологичной интеграции фланкированы уникальными сайтами расщепления рестрикционных ферментов, они могут быть легко заменены, т.е. вырезаны и замещены, посредством чего этот вектор может легким и эффективным путем изменяться или адаптироваться для выбранного организма-хозяина. Конкретно, маркер селекции клонируют в уникальном сайте рестрикции KpnI, последовательности гомологичной рекомбинации клонируют в уникальном сайте рестрикции NotI, промотор клонируют с использованием сайта рестрикции ApaI и SbfI/AarI и нуклеотидную последовательность, кодирующуюPOI, клонируют в MCS (сайте множественного клонирования) с использованием сайтов рестрикции SbfI и SfiI. В дополнительном аспекте это изобретение относится к эукариотическому экспрессирующему вектору на основе молекулярного скелета pPuzzle, дополнительно содержащему следующие компоненты,функционально связанные друг с другом: рекомбинантную нуклеотидную последовательность, кодирующую POI, необязательно связанную с лидерной последовательностью, эффективной для вызывания секреции POI из клетки-хозяина; промотор, эффективный для контроля экспрессии белка в клетке-хозяине; терминатор транскрипции; маркер селекции; последовательности гомологичной интеграции либо последовательности автономной репликации,где этим промотором является промотор 1000 п.о. из 5'-некодирующего района гена PET9 Pichia pastoris(SEQ ID NO: 125) или его функционально эквивалентный вариант, терминатором транскрипции является терминатор транскрипции гена цитохрома с из S.cerevisiae, маркером селекции является ген устойчивости к зеоцину, и клеткой-хозяином является клетка дрожжей, предпочтительно клетка штамма родаKomagataella, в частности клетка штамма Komagataella pastoris, Komagataella pseudopastoris илиKomagataella phaffii. Подробное описание процедуры для конструирования такого вектора, который дополнительно содержит усиленный зеленый флуоресцентный белок eGFP в качестве репортерного гена Понятно, что любая гетерологичная или гомологичная нуклеотидная последовательность, предназначенная для рекомбинантной экспрессии в клетке-хозяине, может быть использована в положенииeGFP. В другом аспекте это изобретение относится к применению такого эукариотического экспрессирующего вектора для рекомбинантной экспрессии POI в клетке-хозяине. В зависимости от подлежащей решению проблемы может быть желательным либо получение сильной экспрессии представляющего интерес белка в клетке-хозяине (например, рекомбинантного продуцирования POI в клетке-хозяине), либо получение слабой или уменьшенной экспрессии представляющего интерес белка в клетке-хозяине (например, при анализе молекулярной функции POI в клетке-хозяине). Конкретно, в случае анализа молекулярной функции клеточного POI или в случае POI, предназначенного для применений метаболического конструирования, когда белок не должен секретироваться и развивает его активность внутри желаемого компартмента клетки, было бы заманчивым иметь возможность регулировать уровень экспрессии этого представляющего интерес белка посредством промоторной активности. Может быть желательным либо получение сильной экспрессии POI (сравнимой с экспрессией от промотора GAP или более сильной, чем от промотора GAP). Таким образом, полезно иметь выбор из различных последовательностей промоторов, подходящих для рекомбинантной экспрессии гетерологичной или гомологичной нуклеотидной последовательности в организме-хозяине, в частности в хозяине-дрожжах, более конкретно, в штамме рода Komagataella, в частности в клетке штамма Komagataellapastoris, Komagataella pseudopastoris или Komagataella phaffii, имеющих разные промоторные активности при сравнимых условиях культивирования клеток, варьирующие от сильной промоторной активности до слабой или уменьшенной промоторной активности, в сравнении с промотором GAP. Это позволяет регулировать уровень экспрессии представляющего интерес белка выбором подходящей промоторной последовательности в соответствии с экспериментальной ситуацией. Из сравнительного анализа промоторных последовательностей, описанного в примере 5, т.е. из анализа промоторной активности, были обнаружены несколько промоторных последовательностей с различными промоторными активностями, находящимися в диапазоне от 0 до приблизительно 135% промоторной активности промотора GAP, выделенного из Pichia pastoris, при экспериментальных условиях,описанных в примере 5. Суммирование промоторных активностей промоторных последовательностей дрожжей, испытанных в примере 5 (определяемых измерением относительного уровня экспрессии в % продукта репортерного гена eGFP и стандартизацией относительно экспрессии eGFP под контролем промотора GAP), может быть найдено в табл. 8. Более подробно, фрагмент 1000 п.о. из 5'-некодирующего района гена GND1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 67% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена GPM1 имел,при экспериментальных условиях примера 5, промоторную активность в диапазоне от 19 до приблизительно 41% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена HSP90 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 6 до приблизительно 81% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена KAR2 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 11 до приблизительно 135% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена MCM1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 6% промоторной активности промотораGAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена RAD2 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 5% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена RPS2 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 12% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена RSP31 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 8% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена SSA1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 30% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена THI3 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 42% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена TPI1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 92% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена UBI4 имел, при экспериментальных условиях примера 5,промоторную активность в диапазоне от 0 до приблизительно 4% промоторной активности промотораGAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена ENO1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 17 до приблизительно 47% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена RPS7A имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 1 до приблизительно 18% промо- 11017803 торной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена RPL1 имел,при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 11 промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена TKL1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 9% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена PIS1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 7% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена FET3 имел, при экспериментальных условиях примера 5,промоторную активность в диапазоне от 0 до приблизительно 7% промоторной активности промотораGAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена FTR1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 6% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена NMT1 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 5 до приблизительно 30% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена РНО 8 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 6% промоторной активности промотора GAP. Фрагмент 1000 п.о. из 5'-некодирующего района гена FET3 имел, при экспериментальных условиях примера 5, промоторную активность в диапазоне от 0 до приблизительно 7% промоторной активности промотора GAP. В другом аспекте это изобретение относится к промоторной последовательности дрожжей, выделенной из Pichia pastoris и являющейся идентичной или соответствующей и имеющей функциональные характеристики последовательности, выбранной из группы, состоящей из фрагмента 1000 п.о. из 5'-некодирующего района гена GND1 (SEQ ID NO: 126), фрагмента 1000 п.о. из 5'-некодирующего района гена GPM1 (SEQ ID NO: 127), фрагмента 1000 п.о. из 5'-некодирующего района гена HSP90SEQ ID NO: 143), фрагмента 1000 п.о. из 5'-некодирующего района гена FTR1 (SEQ ID NO: 144), фрагмента 1000 п.о. из 5'-некодирующего района гена NMT1 (SEQ ID NO: 145), фрагмента 1000 п.о. из 5'-некодирующего района гена РНО 8 (SEQ ID NO: 146) и фрагмента 1000 п.о. из 5'-некодирующего района гена предшественника FET3 (FET3pre) (SEQ ID NO: 147), или функционально эквивалентного варианта любой из перечисленных последовательностей. Энолаза 1 (ENO1) является фосфопируватгидратазой, которая катализирует превращение 2-фосфоглицерата в фосфоенолпируват во время гликолиза и обратную реакцию во время глюконеогенеза. Триозофосфатизомераза (TPI1) является имеющимся в изобилии гликолитическим ферментом. Она катализирует взаимное превращение глицеральдегид-3-фосфата и дигидроксиацетонфосфата во время гликолиза.THI3 является возможной декарбоксилазой, требуемой для экспрессии ферментов, участвующих в биосинтезе тиамина, и может играть роль в катаболизме аминокислот до длинноцепочечных и комплексных спиртов.SSA1 является АТФазой, участвующей в фолдинге белка и ядерном транспорте, направляемом сигналом ядерной локализации (NLS). SSA1 является членом семейства белка 70 теплового шока (HSP70).RPS7A является белковым компонентом малой субъединицы (40S) рибосомы. 6-Фосфоглюконатдегидрогеназа (GND1) катализирует реакцию регенерации NADPH в пентозофосфатном пути и необходима для роста на D-глюконо-дельта-лактоне и адаптации к окислительному стрессу.GPM1 кодирует фосфоглицератмутазу, которая является тетрамерным ферментом, ответственным за превращение 3-фосфоглицерата в 2-фосфоглицерат во время гликолиза и обращенную реакцию во время глюконеогенеза. Транскетолаза (TKL1) катализирует превращение ксилулозо-5-фосфата и рибозо-5-фосфата в седогептулозо-7-фосфат и глицеральдегид-3-фосфат в пентозофосфатном пути и необходима для синтеза ароматических аминокислот. Белок 90 теплового шока (HSP90) является цитоплазматическим шапероном (Hsp90-семейства).RPS2 является белковым компонентом малой субъединицы (40S) рибосом.RPS31 является слитым белком, который расщепляется с образованием рибосомного белка малой субъединицы (40S) рибосом и убиквитина.RPL1A является белковым компонентом большой субъединицы (60S) рибосом. Фосфатидилинозитолсинтаза PIS1 необходима для биосинтеза фосфатидилинозита, который является предшественником полифосфоинозитидов, сфинголипидов и гликолипидных "якорей" для некоторых из белков плазматической мембраны. Ферро-O2-оксидоредуктаза (FET3) принадлежит к классу интегральных мембранных мульти-Cuоксидаз и необходима для высокоаффинного поглощения железа и участвует в опосредовании устойчивости к токсичности ионов меди, FET3pre является ее предшественником. Высокоаффинная Fe-пермеаза (FTR1) участвует в транспорте железа через плазматическую мембрану и образует комплекс с Fet3p.PHO8 является репрессируемой щелочной фосфатазой.N-Миристоилтрансфераза NMT1 катализирует котрансляционное, ковалентное присоединение миристиновой кислоты к N-концевому остатку глицина нескольких белков, участвующих в клеточном росте и трансдукции сигнала. Фактор транскрипции MCM1 участвует в специфической в отношении клеточного типа транскрипции и феромоновой реакции. Убиквитин (UBI4) становится конъюгированным с белками, маркируя их для селективной деградации через комплекс убиквитин-протеасома 26S.RAD2, эндонуклеаза одноцепочечной ДНК, расщепляет одноцепочечную ДНК во время репарации с вырезанием нуклеотидов для вырезания поврежденной ДНК. В следующем аспекте это изобретение относится к эукариотическому вектору экспрессии на основе молекулярного скелета pPuzzle, дополнительно содержащему следующие компоненты, функционально связанные друг с другом: рекомбинантную нуклеотидную последовательность, кодирующую POI, функционально связанную с лидерной последовательностью, эффективной для вызывания секреции этого POI из клетки-хозяина; промотор, эффективный для контроля (регуляции) экспрессии белка в клетке-хозяине; терминатор транскрипции; маркер селекции; последовательности гомологичной интеграции либо последовательности автономной репликации,где этот промотор является последовательностью промотора дрожжей, выделенной из Pichia pastoris, и является идентичным или соответствует и имеет функциональные характеристики последовательности,выбранной из группы, состоящей из SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127,SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133,SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139,SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145,SEQ ID NO: 146 и SEQ ID NO: 147, или функционально эквивалентного варианта любой из перечисленных последовательностей, и эта клетка-хозяин является клеткой дрожжей, предпочтительно клеткой штамма рода Komagataella, в частности клеткой штамма Komagataella pastoris, Komagataellapseudopastoris или Komagataella phaffii. В другом аспекте это изобретение относится к применению такого эукариотического экспрессирующего вектора для рекомбинантной экспрессии POI в клетке-хозяине. В случае, когда POI является клеточным белком, предназначенным для применений метаболического конструирования, т.е. для экспрессии и развития его активности в желаемом компартменте клеткихозяина, этот POI может быть экспрессирован из эукариотического экспрессирующего вектора на основе молекулярного скелета pPuzzle без лидерной последовательности, эффективной для вызывания секреции этого POI из этой клетки-хозяина. Если этот клеточный POI является гомологичным белком для клетки-хозяина, т.е. белком, который природно встречается в этой клетке-хозяине, экспрессия этого POI в клетке-хозяине может быть модулирована заменой его природной промоторной последовательности промоторной последовательностью дрожжей, выделенной из Pichia pastoris и являющейся идентичной или соответствующей и имеющей функциональные характеристики последовательности, выбранной из группы, состоящей изSEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130,SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136,SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142,SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147 или функционально эквивалентного варианта любой из перечисленных последовательностей. Эта цель может быть достигнута, например, трансформацией клетки-хозяина рекомбинантной молекулой ДНК, содержащей гомологичные последовательности гена-мишени для возможности специфической рекомбинации, желаемые промоторные последовательности дрожжей и маркер селекции, подходящий для этой клетки-хозяина. Сайт-специфическая рекомбинация будет иметь место для функционального связывания промоторной последовательности дрожжей с нуклеотидной последовательностью,- 13017803 кодирующей POI. Это приводит к экспрессии POI от промоторной последовательности дрожжей вместо экспрессии от природной промоторной последовательности. В зависимости от подлежащей решению проблемы, выбранный промотор дрожжей может иметь либо увеличенную промоторную активность относительно промоторной активности природной промоторной последовательности, приводящую к увеличенной экспрессии POI в клетке-хозяине, либо может иметь уменьшенную промоторную активность относительно промоторной активности природной промоторной последовательности, приводящую к уменьшенной экспрессии POI в клетке-хозяине. В другом аспекте это изобретение относится к применению промоторной последовательности дрожжей, выделенной из Pichia pastoris и являющейся идентичной или соответствующей и имеющей функциональные характеристики последовательности, выбранной из группы, состоящей изSEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130,SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136,SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142,SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147 или функционально эквивалентного варианта любой из перечисленных последовательностей. В другом аспекте это изобретение относится к такому применению, в котором эта промоторная последовательность дрожжей имеет увеличенную промоторную активность относительно промоторной активности природной промоторной последовательности этого POI. В другом аспекте это изобретение относится к такому применению, в котором эта промоторная последовательность дрожжей имеет уменьшенную промоторную активность относительно промоторной активности природной промоторной последовательности этого POI. Для лучшего понимания описанного здесь изобретения приведены следующие примеры. Эти примеры приведены только для иллюстративных целей и не должны пониматься как ограничивающие это изобретение в каком-либо отношении. Кроме того, понятно, что данное изобретение будет также включать в себя вариации специально описанных вариантов осуществления до такой степени, которая могла бы предполагаться специалистом с обычной квалификацией в данной области. Примеры Примеры 1 и 2 ниже иллюстрируют материалы и способы, используемые для исследования действия коэкспрессии различных белков, участвующих в эукариотическом пути секреции (секреции хелперных факторов) на выход представляющего интерес секретируемого гетерологичного белка, т.е. на секрецию Fab-фрагмента моноклонального анти-ВИЧ 1-антитела 2F5 в P.pastoris. Пример 1. Идентификация и клонирование нескольких хелперных факторов секреции изSaccharomyces cerevisiae. Для идентификации генов и их соответствующих белков, которые играют потенциальную роль во время продуцирования белков, например в секреторном пути белков P.pastoris, картину (паттерн) экспрессии генов штамма P.pastoris, содержащего ген трипсиногена 1 человека, сравнивали до и после индукции продуцирования гетерологичного белка (индукцию выполняли переключением с глицерина на метанол в качестве единственного источника углерода), т.е. продуцирования трипсиногена, посредством анализа с использованием микроматриц. Поскольку последовательность генома P.pastoris не была опубликована и немногие гены были охарактеризованы для P.pastoris, для гетерологичной гибридизации с кДНК P.pastoris использовали микроматрицы ДНК S.cerevisiae. Экспериментальную процедуру гибридизации микроматриц и оценивание полученных данных проводили, как описано в Sauer et al. (2004). Дополнительные подробности приведены ниже.a) Штамм. Экспрессирующим штаммом был штамм P.pastoris X33 (Invitrogen), штамм дикого типа, который может расти на минимальной среде без добавок. Механизмы отбора основывались на устойчивости к зеоцину (Zeocin) трансформирующего вектора. Трансформацию этого штамма проводили с использованием плазмиды, произведенной из pPICZB (Invitrogen), содержащей ген трипсиногена 1 человека(Hohenblum et al., 2003). pPICZB использует промотор AOX1 P.pastoris, который репрессируется многими источниками углерода, такими как глюкоза, глицерин или этанол, но индуцируется таким источником углерода, как метанол, и лидерную последовательность -фактора S.cerevisiae для секреции продукта. Выбранный штамм имел фенотип, положительный в отношении утилизации метанола (mut+), что означает, что он полностью способен метаболизировать метанол в качестве единственного источника углерода.b) Культура клеток. Ферментация P.pastoris. Ферментации культур с подпиткой выполняли с использованием мини-биореактора MBR с конечным рабочим объемом 2 л, в основном, как описано Hohenblum et al., 2003). Среды были следующими. Исходный раствор солей микроэлементов PTM1 содержал на 1 л: 6,0 г CuSO45H2O, 0,08 г NaI, 3,0 г MnSO4H2O, 0,2 г Na2MoO42H2O, 0,02 г H3BO3, 0,5 г CoCl2, 20,0 гZnCl2, 65,0 г FeSO47H2O, 0,2 г биотина и 5,0 мл H2SO4 (95-98%). Все химикалии для исходного раствора солей микроэлементов были из Riedel-de Haen, за исключением биотина (Sigma) и H2SO4 (Merck Eurolab). Среда для периодической культуры содержала на 1 л: 23,7 мл H3PO4 (85%), 0,6 г CaSO42H2O, 9,5 г K2SO4, 7,8 г MgSO47H2O, 2,6 г KOH, 40 г глицерина,4,4 мл исходного раствора солей микроэлементов PTM1. Глицериновый раствор для среды с подпиткой содержал на 1 л: 632 г глицерина (100%) и 12 мл исходного раствора солей микроэлементов PTM1. Раствор метанола для среды с подпиткой содержал на 1 л: 988 мл метанола (100%) и 12 мл исходного раствора солей микроэлементов PTM1. Растворенный кислород контролировали при DO=30% со скоростью мешалки (600-1200 об/мин). Скорость аэрации была 100 л/ч, и кислород добавляли (до 25%) после начала периодического процесса с подпиткой. Температура была равна 25C и pH регулировали с использованием NH3 (25%). Перед началом ферментации pH 1,2 л среды для периодического процесса устанавливали на 5,0 при помощи NH3 (25%). После периодической фазы в течение приблизительно 32 ч следовал 4-часовой период с подачей глицериновой среды (скорость подачи 15,6 мл/ч), что приводило к концентрации сухой массы приблизительно 40 г/л. Затем начинали подпитку метанольной средой со скоростью подачи 6,4 мл/ч. Метанол индуцирует продуцирование гетерологичного белка трипсиногена и служит одновременно в качестве источника углерода. Ферментацию заканчивали спустя 14 ч после начала подачи метанола. pH был равен 5,0 во время периодического процесса и поддерживался при 5,0 на протяжении всей ферментации. Пробы брали в конце фазы подпитки глицерином (не экспрессирующие трипсиногена клетки) и в конце фазы подпитки метанолом (экспрессирующие трипсиноген клетки) соответственно. Клетки центрифугировали для отделения супернатанта культуры клеток, затем осадки клеток ресуспендировали в 10-кратном объеме реагента TRI (Sigma) и замораживали.c) Выделение РНК. Пробы оттаивали на льду и после добавления промытых кислотой стеклянных гранул клетки гомогенизировали в приборе Ribolyser (Hybaid Ltd.) в течение 220 с при охлаждении в промежутке на льду. После добавления хлороформа эти пробы центрифугировали и тотальную РНК преципитировали (осаждали) из водной фазы добавлением изопропанола. Осадок промывали 2 раза 70% этанолом, сушили и ресуспендировали в не содержащей РНКаз воде. мРНК выделяли с использованием набора для очистки мРНК MicroPoly(A) Purist mRNA (Ambion) в соответствии с протоколом изготовителя.d) Синтез и мечение кДНК. 5 мкг мРНК и 0,5 мкг олиго-dT-праймера смешивали в 7 мкл воды, инкубировали в течение 5 мин при 70C и затем при 42C в течение приблизительно 3 мин. К 5 мкл указанной реакционной смеси добавляли следующие компоненты: 4 мкл реакционного буфера (5) для обратной транскриптазыCy5-dUTP (1 мМ, Amersham Biosciences) соответственно и 1 мкл обратной транскриптазы Superscript IIreverse transcriptase (200 Е, Invitrogen) с получением в целом 19,5 мкл. Эту смесь инкубировали в течение 1 ч при 42C. После добавления дополнительно 200 Е обратной транскриптазы Superscript II эту смесь инкубировали в течение еще 1 ч при 42C. Добавляли 7 мкл 0,5 М NaOH/50 мМ ЭДТА и эту смесь инкубировали при 70C в течение 15 мин. Эту реакционную смесь нейтрализовали добавлением 10 мклTris-HCl pH 7,5 (1 М). Меченую ДНК очищали с использованием колонок для очистки Qiaquick (Qiagen) в соответствии с протоколом изготовителя.e) Чип-гибридизация и создание микроматриц. Микроматрицами кДНК S.cerevisiae, используемыми для этого исследования, были микропроцессоры (чипы) Hyper Gene Yeast Chips из Hitachi Software Engineering Europe AG. В соответствии с протоколом изготовителя приблизительно 0,1-0,3 нг ПЦР-амплифицированной кДНК (приблизительно 2008000 п.о.) наносили в виде пятен на покрытое поли-L-лизином предметное стекло и фиксировали отжиганием, блокированием янтарным ангидридом и денатурацией нагреванием. Меченую кДНК ресуспендировали в приблизительно 70 мкл 5SSC/0,05% ДСН, денатурировали нагреванием при 95C в течение 3 мин и охлаждали на льду. Появляющиеся кристаллы ДСН растворяли кратковременным и слабым нагреванием и эту смесь осторожно наносили на дрожжевой чип. Зону с пятнами покрывали покровным стеклом и чипы помещали в воздухонепроницаемый контейнер с увлажненной атмосферой при 60C на 16 ч. Покровные стекла удаляли в 2SSC/0,1% ДСН и эти чипы промывали последовательно в течение 5-10 мин в каждом случае в 2SSC/0,1% ДСН, 0,5SSC/0,1% ДСР и 0,2SSC/0,1% ДСН при комнатной температуре (RT). Эти чипы центрифугировали при 600 об/мин в течение 3 мин для высушивания. Усло- 15017803 вия сушки выбирали в соответствии с инструкциями изготовителя. Каждую пробу (меченую кДНК из не экспрессирующих трипсиноген клеток и из экспрессирующих трипсиноген клеток) использовали для гибридизации двух параллельных микроматриц кДНК для испытания воспроизводимости этих сигналов.f) Получение данных и статистическое оценивание данных микроматриц. Изображения сканировали при разрешении 50 мкм с использованием сканера микроматрицG2565AA (Agilent) и импортировали в программу анализа микроматриц GenePix Pro 4.1 (AxonInstruments). GenePix Pro 4.1 использовали для количественного определения интенсивности пятен. Каждое появляющееся пятно гена усредняли. Затем этот набор данных импортировали в GeneSpring 6.1(Silicon Genetics) для дальнейшей нормализации и анализа данных. Все из величин каждого канала на каждом чипе делили на их соответствующую медиану для нормализации. Затем медианную интенсивность всех ТЕ-пятен (пятен с буфером, без ДНК) выводили из каждой величины и все величины пятен, меньшие стандартного отклонения указанных пороговых величин, считали не значимыми и относили к величине стандартного отклонения. Для определения индукции или репрессии активности гена эти нормализованные сигналы на каждом пятне сравнивали и все гены,обнаруживающие различие сигнала, превышающее порог 1,5-кратные) на обеих параллельных независимых микроматрицах, оценивали как значимо регулируемые. После определения этих относительных уровней экспрессии всех измеряемых генов эти гены выстраивали (ранжировали) по относительному различию их уровней экспрессии и 524 гена с наивысшим различием выбирали для дальнейшего анализа. При использовании для этих экспериментов ДНКмикроматриц, полученных из последовательностей генов Saccharomyces cerevisiae, только предположительные функции генов для P.pastoris могут быть отнесены в соответствии с гомологией к S.cerevisiae. После ранжирования этих 524 дифференциально регулируемых генов на основе их предположительной внутриклеточной локализации и функции и фокусирования внимания на генах, участвующих в секреции и/или общей стрессовой реакции, из 64 потенциально представляющих интерес генов были выбраны 15 генов для дальнейшего анализа: PDH, CUP5, SSA4, BMH2, KIN2, KAR2, HAC1, ERO1, SSE1, BFR2,COG6, SSO2, COY1, IMH1 и SEC31.g) Конструирование экспрессирующего вектора для клонирования идентифицированных хелперных факторов секреции. Для генерирования вектора, содержащего промотор GAP и ген his4 в качестве маркера селекции,промотор АОХ 1 вектора pPIC9 (Invitrogen) заменяли на промотор GAP pGAPZ B (Invitrogen) рестрикционным расщеплением обоих векторов с использованием NotI и Mph11031 и последующим лигированием в соответствии со стандартным протоколом. Этот заново сконструированный вектор был назван pGAPHis.h) Выделение генов хелперных факторов из Saccharomyces cerevisiae и клонирование в pGAPHis. Все эти гены, кроме HAC1, амплифицировали непосредственно из геномной ДНК Saccharomycescerevisiae при помощи ПЦР со специфическими олигонуклеотидными праймерами, изображенными в табл. 1. Последовательность Козака P.pastoris (ACG) инсертировали непосредственно перед стартовым кодоном ATG. Не кодируемые матрицей сайты рестрикции SacII (XhoI для гена PDI1) и либо PmlI, либоSfiI (EcoRI для гена PDI1) добавляли с использованием прямого и обратного праймера (см. табл. 1). После рестрикционного расщепления ПЦР-фрагментов правильной длины (проверяемой разделением на агарозном геле) SacII (XhoI для гена PDI1) и либо PmlI, либо SfiI (EcoRI для гена PDI1), как показано в табл. 1, эти фрагменты клонировали в вектор pGAPHis (также расщепленный соответствующими рестрикционными ферментами и обработанный щелочной фосфатазой). Для конструирования индуцированного варианта гена HAC1 S.cerevisiae ДНК-фрагмент, кодирующий первые 220 аминокислот, объединяли с фрагментом, кодирующим состоящий из 18 аминокислот экзон индуцированного Hac1p (Mori et al.,2000) в двухступенчатой ПЦР-реакции, и полученный фрагмент лигировали в pGAPHis. Все лигированные плазмиды трансформировали в E.coli Top 10F' (Invitrogen) и высевали на содержащий ампициллин LB-агар. Анализ с использованием рестрикционных ферментов выполняли для подтверждения точной идентичности соответствующих плазмид. Таблица 1 ПЦР-праймеры для амплификации хелперных факторов секреции из Пример 2. Исследование действия хелперных факторов секреции на продуцирование гетерологичного белка рекомбинантного Fab 2F5 в P.pastoris. Плазмидную ДНК из E.coli из примера 1 использовали для трансформации штамма P.pastorisSMD1168, уже содержащего экспрессионные кассеты для Fab 2F5 под контролем промотора GAP, причем этот штамм был предварительно отобран на высокий уровень секреции Fab. Этот штамм SMD1168 является his4-дефектным штаммом P.pastoris (рер 4-мутантом). Отбор выполняли на основе устойчивости к зеоцину для генов антител и гистидиновой ауксотрофии для других генов.a) Конструирование штамма P.pastoris SMD1168, секретирующего Fab-фрагмент моноклонального анти-ВИЧ 1-антитела 2F5. Последовательности фрагмента антитела 2F5 для легкой и тяжелой цепей Fab амплифицировали при помощи ПЦР из pRC/RSV, содержащей гуманизированное IgG1-mAb, как описано в Gasser et al.,2006. Для клонирования использовали сайты рестрикции EcoRI и SacII. Более подробно, для генерирования Fab полные гены легкой цепи (vL и cL) и район vH и cH1 генов тяжелой цепи амплифицировали при помощи ПЦР. Фрагмент легкой цепи лигировали в модифицированную версию pGAPZA, где сайт рестрикции AvrII изменяли на сайт NdeI сайт-направленным мутагенезом для создания возможности последующей линеаризации плазмид, содержащих две кассеты. Фрагмент тяжелой цепи инсертировали в первоначальную версию pGAPZA, которая содержит конститутивный промотор глицеральдегидфосфатдегидрогеназы (GAP) с последующей лидерной последовательностью MF S.cerevisiae (Invitrogen, Carlsbad, CA, USA). Плазмиды, соединяющие экспрессионные кассеты для обеих цепей Fab на одном векторе, получали двойным расщеплением вектора легкой цепи с использованием BglII и BamHI и последующим инсерти- 18017803 рованием в уникальный сайт BamHI вектора pGAPZA, уже содержащего единственную копию экспрессионной кассеты фрагмента тяжелой цепи. Затем плазмиды линеаризовали с использованием AvrII перед электротрансформацией в P.pastoris. Все сконструированные экспрессионные кассеты проверяли секвенированием ДНК с прямымb) Конструирование штаммов P.pastoris, коэкспрессирующих Fab 2F5 и хелперный фактор секреции. Трансформацию штаммов P.pastoris, полученных в стадии а), проводили с плазмидами примера 1,которые были линеаризованы в локусе His4. Эти плазмиды вводили в клетки электротрансформацией. Трансформированные клетки культивировали на RDB-агаре (не содержащем гистидина) для отбора Hisпрототрофных клонов, которые содержат экспрессионные кассеты для хелперных факторов секреции.c) Культивирование трансформированных штаммов P.pastoris в культурах во встряхиваемых колбах. 5 мл YP-среды (10 г/л дрожжевой экстракт, 20 г/л пептон), содержащей 20 г/л глицерина, инокулировали единственной колонией P.pastoris, отобранной на RDB-чашках, и выращивали в течение ночи при 28C. Аликвоты этих культур, соответствующие конечной OD600 0,1, переносили в 10 мл основной культуральной среды (на 1 л: 10 г дрожжевого экстракта, 10 г пептона, 100 мМ калий-фосфатный буфер рН 6,0, 13,4 г азотистого основания дрожжей с сульфатом аммония, 0,4 мг биотина) и инкубировали в течение 48 ч при 28C при сильном встряхивании в колбах Эрленмейера на 100 мл. Для индукции экспрессии рекомбинантного белка культуры с промотором GAP дополняли 10 г/л глюкозы. То же самое количество субстрата добавляли повторяемым образом 4 раза каждые 12 ч перед сбором клеток центрифугированием при 2500g в течение 5 мин при комнатной температуре и готовили для анализа (определения биомассы измерением оптической плотности при 600 нм, ELISA для количественного определения Fab в культуральном супернатанте).d) Оценивание действия ко-сверхэкспрессии отдельных хелперных факторов секреции по количественному определению Fab 2F5. Для определения количества секретированного рекомбинантно экспрессируемого Fab 2F5,96-луночные микротитрационные планшеты (MaxiSorb, Nunc, Denmark) покрывали анти-hIgG-антителом(Fab-специфическим) в течение ночи при комнатной температуре (Sigma I-5260; 1:1000 в ЗФР, рН 7,4),перед нанесением серийно разведенных супернатантов культур P.pastoris, секретирующих Fab 2F5, из стадии с) (начиная с разведения 1:200 в ЗФР/Твин 20 (0,1%) + 1% БСА), и инкубированием в течение 2 ч при комнатной температуре. В качестве стандартного белка использовали Fab нормального IgG человека(Rockland) при начальной концентрации 200 нг/мл. После каждой стадии инкубации эти планшеты промывали четыре раза ЗФР, содержащим 0,1% Твин 20, доведенным до рН 7,4. 100 мкл конъюгата антилегкая цепь каппа - АР в качестве вторичного антитела (1:1000 в ЗФР/Твин + 1% БСА) добавляли в каждую лунку и инкубировали в течение 1 ч при комнатной температуре. После промывания планшеты окрашивали pNPP (1 мг/мл п-нитрофенилфосфат в буфере для покрытия, 0,1 н. Na2CO3/NaHCO3; pH 9,6) и считывали при 405 нм (ссылочная длина волны 620 нм). Из каждой из 15 различных конструкций хелперных факторов секреции 16 индивидуальных клонов культивировали в культурах встряхиваемых колб, как описано в стадии с), и сравнивали с 16 индивидуальными клонами контрольного штамма, который был трансформирован вектором pGAPHis, лишенным гена. Продуктивность Fab 2F5 (мкг Fab/биомасса) определяли для всех анализируемых культур (первый раунд скрининга). 6 наилучших клонов каждой из этих конструкций повторно анализировали с использованием той же самой системы во втором раунде скрининга (в отношении результатов см. табл. 2). Табл. 2 показывает среднюю относительную продуктивность 6 наилучших клонов каждой тестированной конструкции хелперного фактора, в том числе контрольной конструкции (пустой векторpGAPHis). Эта таблица показывает средний улучшающий фактор секреции Fab 2F5 двух раундов скрининга, полученный ко-сверхэкспрессией хелперных факторов секреции, относительно контрольных культур. Хелперные факторы секреции, которые, как известно в данной области, улучшают секрецию гетерологичных белков при их ко-сверхэкспрессии (PDM, KAR2, HAC1, ERO1 и SSO2), включены в табл. 2 для сравнения. Таблица 2 Средняя относительная продуктивность тестированных хелперных факторов Как видно из табл. 2, секреция гетерологичного белка, т.е. секреция Fab 2F5 увеличивалась для большинства анализированных хелперных факторов секреции в 1,2-1,7 раз. Кроме хелперных факторов секреции, уже известных в данной области, имеющих положительное действие на секрецию гетерологичного белка, ко-сверхэкспрессия хелперных факторов секреции CUP5, SSA4, BMH2, KIN2, SSE1 иBFR2 показала высокозначимое увеличение количества секретируемого гетерологичного белка, а косверхэкспрессия COG6, COY1 и IMH1 показала значимое увеличение количества секретируемого гетерологичного белка. Информация последовательности для хелперных факторов PDI1, KAR2, HAC1, ERO1 и SSO2 описана в известном уровне техники. Нуклеотидные последовательности хелперных факторов секреции, которые еще не известны в данной области, улучшающих секрецию гетерологичных белков при ко-сверхэкспрессии, показаны в табл. 3. Таблица 3 Нуклеотидные последовательности выделенных хелперных факторов секреции (SEQ ID NO: 32-SEQ ID NO: 41)
МПК / Метки
МПК: C12P 21/02, C12N 15/81, C07K 14/39
Метки: система, экспрессии
Код ссылки
<a href="https://eas.patents.su/30-17803-sistema-ekspressii.html" rel="bookmark" title="База патентов Евразийского Союза">Система экспрессии</a>
Предыдущий патент: Азабициклоалкановые производные, их получение и их применение в терапии
Следующий патент: Противомалярийная фармацевтическая композиция
Случайный патент: Способ уведомления при невозможности установить вызов и система для его осуществления в сетях сотовой связи












