Новые соединения аминопирролина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4042
Опубликовано: 25.12.2003
Авторы: Ренар Пьер, Эрард Жан-Даниель, Брюбан Вероник, Скальбер Элизабет, Буске Паскаль, Пфейффер Брюно, Фельдман Жозьян, Шанн Стефан
Формула / Реферат
1. Соединения формулы (I)
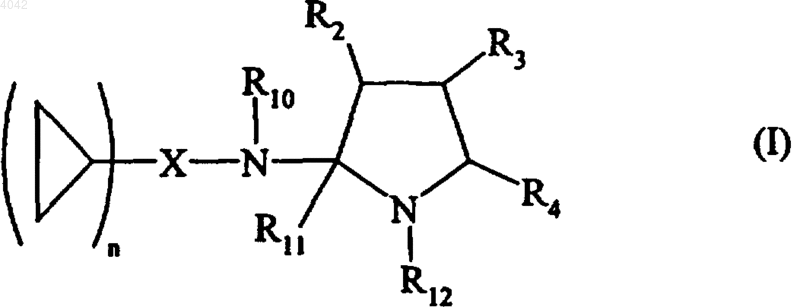
в которой n представляет 1 или 2,
X представляет алкиленовую, алкениленовую или алкиниленовую группу, или необязательно замещенную ариленовую группу, или необязательно замещенную гетероариленовую группу,
R10 представляет атом водорода или неразветвленную или разветвленную (C1-C6)алкильную группу и R11 и R12 вместе образуют связь, или, альтернативно, R12 представляет атом водорода или неразветвленную или разветвленную (C1-C16)алкильную группу, a R10 и R11 вместе образуют связь,
R2, R3 и R4, каждый независимо от других, представляет атом водорода, неразветвленную или разветвленную (C1-C6)алкильную группу, неразветвленную или разветвленную (C1-C6)гидроксиалкильную группу, неразветвленную или разветвленную (C1-C6)алкоксигруппу, неразветвленную или разветвленную (C1-C6)алкоксикарбонильную группу, необязательно замещенную арильную группу, необязательно замещенную арилалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, или необязательно замещенную арилоксиалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, или, альтернативно, два из R2, R3 и R4 вместе с несущими их атомами углерода образуют (C5-C7)циклоалкильную группу,
причем
термин "алкилен" означает неразветвленную или разветвленную двухвалентную группу, содержащую от 1 до 6 углеродных атомов,
термин "алкенилен" означает неразветвленную или разветвленную двухвалентную группу, содержащую от 2 до 6 углеродных атомов и от 1 до 3 двойных связей,
термин "алкинилен" означает неразветвленную или разветвленную двухвалентную группу, содержащую от 2 до 6 углеродных атомов и от 1 до 3 тройных связей,
термин "арил" представляет фенильную или нафтильную группу, а термин "арилен" представляет двухвалентную группу того же самого типа,
термин "гетероарил" означает моно- или бициклическую ненасыщенную или частично ненасыщенную группу, имеющую от 4 до 11 кольцевых членов и от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, а термин "гетероарилен" представляет двухвалентную группу того же самого типа,
термин "замещенный" в сочетании с выражениями "арил", "арилен", "арилалкил", "арилоксиалкил", "гетероарил" и "гетероарилен" означает, что группы, о которых идет речь, замещены в ароматическом фрагменте одной или несколькими группами, выбранными из атомов галогена или неразветвленных или разветвленных (C1-C6)алкильных групп, неразветвленных или разветвленных (C1-C6)алкоксигрупп, гидроксигрупп, цианогрупп, нитрогрупп или аминогрупп (необязательно замещенных одной или двумя неразветвленными или разветвленными (C1-C6)алкильньми группами),
их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
2. Соединения формулы (I) по п.1, в которых X представляет необязательно замещенную ариленовую группу или необязательно замещенную гетероариленовую группу, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
3. Соединения формулы (I) по п.1, в которых X представляет алкиленовую, алкениленовую или алкиниленовую группу, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
4. Соединения формулы (I) по п.1, в которых R11 и R12 вместе образуют связь, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
5. Соединения формулы (I) по п.1, в которых каждый из R2, R3 и R4 представляет атом водорода, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
6. Соединения формулы (I) по п.1, в которых X представляет алкиленовую группу или необязательно замещенную ариленовую группу, R10 представляет атом водорода или неразветвленную или разветвленную (C1-C6)алкильную группу, R11 и R12 вместе образуют связь и R2, R3 и R4, каждый независимо от других, представляет атом водорода, неразветвленную или разветвленную (C1-C6)алкильную группу, неразветвленную или разветвленную (C1-C6)гидроксиалкильную группу, неразветвленную или разветвленную (C1-C6)алкоксикарбонильную группу, неразветвленную или разветвленную (C1-C6)алкоксигруппу, необязательно замещенную арильную группу или необязательно замещенную арилоксиалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, их энантиомеры и диастереоизомры и их аддитивные соли с фармацевтически приемлемой (ым) кислотой или основанием.
7. Соединение формулы (I) по п.1, которое представляет собой N-(2-циклопропилфенил)-3,4-дигидро-2H-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой.
8. Соединение формулы (I) по п.1, которое представляет собой N-(2-дициклопропилметил)-3,4-дигидро-2H-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой.
9. Соединение формулы (I) по п.1, которое представляет собой N-(2-циклопропилфенил)-2-метил-3,4-дигидро-2H-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой.
10. Способ получения соединений формулы (I) по п.1, отличающийся тем, что исходное соединение формулы (II)
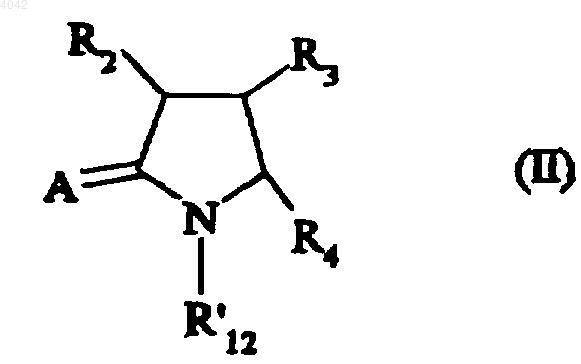
в которой R2, R3 и R4 имеют значения, определенные для формулы (I), R12' представляет атом водорода или неразветвленную или разветвленную (C1-C6)алкильную группу и A представляет атом кислорода или атом серы, после проведения метилирования подвергают взаимодействию с амином формулы (III)
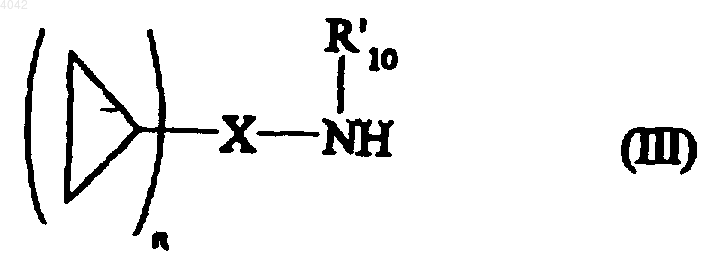
в которой n и X имеют значения, определенные для формулы (I), и R'10 представляет собой атом водорода или неразветвленную или разветвленную (C1-C6)алкильную группу, с получением в среде основания соединения формулы (I), которое
при необходимости очищают в соответствии с традиционными методами очистки,
при необходимости разделяют на его стереоизомеры традиционными методами разделения,
при необходимости превращают в его аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
11. Фармацевтическая композиция, включающая в качестве активного компонента по крайней мере одно соединение по любому из пп.1-9, одно или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми наполнителями или носителями.
12. Применение фармацевтической композиции по п.11 в производстве лекарственных средств для лечения сердечно-сосудистых заболеваний.
13. Применение по п.12 в производстве лекарственных средств для лечения артериальной гипертензии.
14. Применение по п.12 для применения в производстве лекарственных средств для лечения аритмии.
Текст
1 Настоящее изобретение относится к новым соединениям аминопирролина, к способу их получения и к содержащим их фармацевтическим композициям. Соединения, имеющие 2-аминопирролиновую структуру, уже были описаны в отношении их антидиарейных (ЕР 0155653) или антипаразитарных (DE 2029297) свойств. Соединения настоящего изобретения имеют новую структуру, характерную наличием циклопропильной группы, связанной с аминопирролиновым кольцом. Данная структура придает им ценные фармакологические свойства. В частности, испытания показали, что они способны снижать артериальное давление, частоту сердечного пульса, а также уменьшать нарушения сердечного ритма. Соответственно, соединения настоящего изобретению используются для лечения сердечно-сосудистых заболеваний,в частности гипертензии, аритмии и связанных с ними расстройств. Настоящее изобретение относится к соединениям формулы (I)n представляет 1 или 2,X представляет алкиленовую, алкениленовую или алкиниленовую группу, или необязательно замещенную ариленовую группу или необязательно замещенную гетероариленовую группу,R10 представляет атом водорода или неразветвленную или разветвленную (C1-C6) алкильную группу, и R11 и R12 вместе образуют связь,или, альтернативно, R12 представляет атом водорода или неразветвленную или разветвленную (C1-C16) алкильную группу и R10 и R11 вместе образуют связь,R2, R3 и R4, каждый независимо от других представляет атом водорода, неразветвленную или разветвленную (С 1-С 6)алкильную группу, неразветвленную или разветвленную (С 1-С 6)гидроксиалкильную группу, неразветвленную или разветвленную (С 1-С 6)алкоксигруппу, неразветвленную или разветвленную (С 1-С 6)алкоксикарбонильную группу, необязательно замещенную арильную группу, необязательно замещенную арилалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, или необязательно замещенную арилоксиалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, или, альтернативно, два из R2, R3 и R4 вместе с несущими их атомами углерода образуют (С 5-С 7)циклоалкильную группу, 004042 2 причем: термин алкилен означает неразветвленную или разветвленную двухвалентную группу,содержащую от 1 до 6 углеродных атомов,термин алкенилен означает неразветвленную или разветвленную двухвалентную группу, содержащую от 2 до 6 углеродных атомов и от 1 до 3 двойных связей,термин алкинилен означает неразветвленную или разветвленную двухвалентную группу, содержащую от 2 до 6 углеродных атомов и от 1 до 3 тройных связей,термин арил представляет фенильную или нафтильную группу, а термин арилен представляет двухвалентную группу того же самого типа,термин гетероарил означает моно- или бициклическую ненасыщенную или частично ненасыщенную группу, имеющую от 4 до 11 кольцевых членов и от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, а термин гетероарилен представляет двухвалентную группу того же самого типа,термин замещенный, связанный с выражениями арил, арилен, арилалкил, арилоксиалкил, гетероарил и гетероарилен означает, что группы, о которых идет речь, замещены в ароматической части одной или несколькими группами, выбранными из атомов галогена или неразветвленных или разветвленных (С 1-С 6)алкильных групп, неразветвленных или разветвленных (С 1-С 6)алкоксигрупп, гидроксигрупп, цианогрупп, нитрогрупп или аминогрупп (необязательно замещенных одной или двумя неразветвленными или разветвленными(С 1-С 6)алкильными группами),их энантиомерам и диастереоизомерам и их аддитивным солям с фармацевтически приемлемой кислотой или основанием. Преимущественный аспект настоящего изобретения относится к соединениям, в которых X представляет необязательно замещенную ариленовую группу или необязательно замещенную гетероариленовую группу. Из этих соединений особенно предпочтительными являются те, в которых X представляет необязательно замещенную ариленовую группу, например фениленовую группу. Еще один предпочтительный аспект настоящего изобретения относится к соединениям,в которых X представляет алкиленовую, алкениленовую или алкиниленовую группу, особенно алкиленовую группу. Предпочтительными соединениями настоящего изобретения являются те, в которыхR11 и R12 вместе образуют связь, причем R10 предпочтительно представляет атом водорода. Другими предпочтительными соединениями настоящего изобретения являются соединения, в которых R2, R3 и R4 представляют атом водорода. 3 Особенно предпочтительный аспект настоящего изобретения относится к соединениям формулы (I), в которых X представляет алкиленовую группу или необязательно замещенную ариленовую группу, R10 представляет атом водорода или неразветвленную или разветвленную (С 1-С 6)алкильную группу, R11 и R12 вместе образуют связь и R2, R3 и R4, каждый независимо от других, представляет атом водорода, неразветвленную или разветвленную(С 1 С 6)алкильную группу, неразветвленную или разветвленную (С 1-С 6)гидроксиалкильную группу, неразветвленную или разветвленную (С 1-С 6)алкоксикарбонильную группу, неразветвленную или разветвленную (C1-С 6)алкоксигруппу, необязательно замещенную арильную группу или необязательно замещенную арилоксиалкильную группу, в которой алкильная часть является неразветвленной или разветвленной и имеет от 1 до 6 углеродных атомов. Предпочтительной ариленовой группой согласно настоящему изобретению является фениленовая группа. Из предпочтительных соединений согласно настоящему изобретению особенно следует упомянуть следующие:N-(2-циклопропилфенил)-3,4-дигидро-2 Нпиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой,N-(2-дициклопропилметил)-3,4-дигидро 2 Н-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой,N-(2-циклопропилфенил)-2-метил-3,4 дигидро-2 Н-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой. Изобретение относится также к способу получения соединений формулы (I), отличающемуся тем, что в качестве исходного материала используют соединение формулы (II) в которой R2, R3 и R4 имеют значения, определенные в формуле (I), R'12 представляет атом водорода или неразветвленную или разветвленную (С 1-С 6)алкильную группу, и А представляет атом кислорода или атом серы,которое подвергают взаимодействию или с ароматическим амином формулы в которой n имеет значения, определенные в формуле (I), Ха представляет ариленовую или гетероариленовую группу, и R10 представляет атом водорода или неразветвленную или разветвленную (С 1-С 6)алкильную группу, с получением соединения формулы (I/a) частного случая соединений формулы (I), в которой R2, R3, R4 и n имеют значения, определенные выше, Ха представляет ариленовую или гетероариленовую группу, и R10, R11 и R12 имеют значения, определенные в формуле (I),или с метилирующим агентом, таким как,например, диметилсульфат или метилйодид, с получением после обработки в основной среде промежуточного соединения, которое обрабатывают непосредственно в спиртовой среде гидрохлоридом амина (IV) где R1 и n имеют значения, определенные в формуле (I), Хb представляет алкиленовую, алкениленовую или алкиниленовую группу, a R10 представляет атом водорода или неразветвленную или разветвленную (С 1-С 6)алкильную группу,с получением соединения формулы (I/b) частного случая соединений формулы (I), в которой R1, R2, R3, R4 и n имеют значения, определенные выше, и Хb представляет алкиленовую,алкениленовую или алкиниленовую группу,соединения (I/a) и (I/b) образуют совокупность соединений формулы (I) и при желании могут очищаться в соответствии с традиционными методами очистки,при желании разделяются на их стереоизомеры традиционными методами разделения,при желании превращаются в их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. Настоящее изобретение относится также к фармацевтическим композициям, содержащим в качестве активного компонента, по крайней мере одно соединение формулы (I), одно или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми наполнителями (эксципиентами) или носителями. Из фармацевтических композиций согласно изобретению следует упомянуть те, которые подходят для перорального, парентерального и назального введения: таблетки, драже, подъязычные таблетки, желатиновые капсулы, пастилки, суппозитории, кремы, мази, дермальные гели и т.д. Применяемые дозы варьируются в соответствии с возрастом и весом пациента, характера и тяжести расстройства и способа введения, который может быть пероральным, назальным, ректальным или парентеральным. Обычно 5 единичная доза находится в диапазоне 0,1-500 мг для лечения при 1-3 дозах в сутки (24 ч). Следующие далее примеры иллюстрируют настоящее изобретение и ни в коей мере не ограничивают его. Используемые исходные материалы являются продуктами, которые известны или получены известными методами. Получение А. 2-Циклопропиланилин Раствор 5 г (42 ммоль) циклопропилбензола в 20 мл уксусного ангидрида охлаждают до 15 С. Поддерживая температуру ниже 20 С,медленно добавляют 3,7 мл 68%-ной азотной кислоты. Реакционную смесь перемешивают один час при указанной температуре, гидролизуют, подщелачивают 2 н. раствором гидроксида натрия и экстрагируют два раза 100 мл эфира. Затем органическую фазу сушат и концентрируют с получением смеси 2-нитроциклопропилбензола и 4-нитроциклопропилбензола. Смесь растворяют в 15 мл этанола и гидрируют при нормальных температуре и давлении в присутствии 50 мг PtO2. Остаток, полученный после отфильтровывания катализатора и выпаривания растворителя, очищают с помощью хроматографии на силикагеле с получением указанного в заголовке продукта. Получение В. 4-Циклопропиланилин Целевой продукт получают в ходе синтеза соединения, описанного в получении А. Получение С. 2-Хлор-4-циклопропиланилин Раствор 7,9 ммоль (1,05 г) 4-циклопропиланилина (получение В) в 15 мл уксусного ангидрида перемешивают 3 ч при температуре окружающей среды. Реакционную смесь концентрируют. Остаток берут в воду, нейтрализуют и экстрагируют два раза дихлорметаном. Органическую фазу сушат и концентрируют. 4-Циклопропилацетанилид растворяют в уксусной кислоте и обрабатывают 10 ммоль хлора. Через 30 мин растворитель выпаривают и полученный остаток берут в 100 мл этанола и затем гидролизуют гидроксидом калия при нагревании с обратным холодильником. Затем выпаривают этанол и остаток берут в воду и дважды экстрагируют дихлорметаном. Органическую фазу сушат и концентрируют, и полученный остаток очищают с помощью хроматографии на силикагеле с получением указанного в заголовке продукта. Получение D. 4-Хлор-2-циклопропиланилин Целевой продукт получают в соответствии с процессом, описанным в получении С, используя в качестве исходного материала соединение, описанное в получении А. Получение Е. 2,4-Дициклопропиланилин Целевой продукт получают в соответствии с процессом, описанным в получении А, из мдициклопропилбензола, получение которого описано в Сhem. Веr., 1973, 106, 511-524. 6 Получение F. 2,5-Дициклопропиланилин Целевой продукт получают в соответствии с процессом, описанным в получении А, из пдициклопропилбензола, получение которого описано в Chem. Ber., 1973, 106, 511-524. Получение G. 3,4-Дициклопропиланилин Целевой продукт получают в соответствии с процессом, описанным в получении А, из одициклопропилбензола, получение которого описано в Chem. Ber., 1973, 106, 511-524. Пример 1. Гидрохлорид N-(2-циклопропилфенил)-3,4-дигидро-2 Н-пиррол-5-амина. К раствору 5 ммоль (666 мг) 2 циклопропиланилина в 30 мл 1,2-дихлорэтана добавляют 5 ммоль (425 мг) 2-пирролидинона и 5 ммоль (766 мг) оксихлорида фосфора. Все нагревают при 60 С в течение 3,5 ч. После выпаривания растворителя остаток берут в воду,подщелачивают карбонатом натрия и дважды экстрагируют 100 мл эфира. Органическую фазу затем сушат, концентрируют и очищают хроматографией на силикагеле с получением целевого продукта. Соответствующий гидрохлорид получают действием титрованного раствора хлороводородной кислоты в этаноле. Температура плавления: 182-184 С Пример 2. Гидрохлорид N-(4-хлор-2 циклопропилфенил)-3,4-дигидро-2 Н-пиррол-5 амина. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении D. Температура плавления: 198-199 С Пример 3. Гидрохлорид N-(4-циклопропилфенил)-3,4-дигидро-2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении В. Пример 4. Гидрохлорид N-(2-хлор-4-циклопропилфенил)-3,4-дигидро-2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении С. Температура плавления 149-151 С Пример 5. Гидрохлорид N-(дициклопропилметил)-3,4-дигидро-2 Н-пиррол-5-амина. Смесь 0,2 моль (25,2 г) диметилсульфата и 0,2 моль (17 г) 2-пирролидинона нагревают при 60 С в течение ночи. Реакционную смесь выливают в охлажденный льдом насыщенный раствор К 2 СO3. Водную фазу экстрагируют два раза эфиром и объединенные органические фазы сушат и концентрируют. Затем остаток перегоняют при пониженном давлении. Полученный продукт (2 ммоль) растворяют в 20 мл метанола и добавляют 2 ммоль (295 мг) гидрохлорида дициклопропилметиламина. Реакционную смесь перемешивают при 50 С в течение 2 ч. После 7 выпаривания метанола остаток берут в воду,подщелачивают и дважды экстрагируют эфиром. Органическую фазу сушат, концентрируют и очищают с получением целевого продукта. Соответствующий гидрохлорид получают действием титрованного раствора хлороводородной кислоты в этаноле. Температура плавления 223-225 С Пример 6. Гидрохлорид N-(дициклопропилметил)-3-метил-3,4-дидидро-2 Н-пиррол-5 амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 4-метил-2-пирролидиноном. Температура плавления 198-199 С Пример 7. Гидрохлорид N-(дициклопропилметил)-2-метил-3,4-дигидро-2 Н-пиррол-5 амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 5-метил-2-пирролидиноном. Температура плавления 144-146 С Пример 8. Гидрохлорид N-(дициклопропилметил)-4-метил-3,4-дигидро-2 Н-пиррол-5 амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 3-метил-2-пирролидиноном. Температура плавления 201-203 С Пример 9. Гидрохлорид N-(дициклопропилметил)-2,3-диметил-3,4-дигидро-2 Н-пиррол 5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 4,5-диметил-2-пирролидиноном. Температура плавления 143-145 С Пример 10. Гидрохлорид (цис)-N-(дициклопропилметил)-2,3-диметил-3,4-дигидро-2 Нпиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон (цис)-4,5-диметил-2-пирролидиноном. Температура плавления 163-165 С Пример 11. Гидрохлорид (транс)-N-(дициклопропилметил)-2,3-диметил-3,4-дигидро-2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон (транс)-4,5-диметил-2-пирролидиноном. Температура плавления 138-140 С Пример 12. Гидрохлорид N-(дициклопропилметил)-2-этил-3,4-дигидро-2 Н-пиррол-5 амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 5-этил-2-пирролидиноном. Температура плавления 108-110 С Пример 13. Гидрохлорид 3-(4-хлорфенил)N-(дициклопропилметил)-3,4-дигидро-2 Н-пиррол-5-амина. 8 Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 4-(4-хлорфенил)-2-пирролидиноном. Температура плавления 220-223 С Пример 14. Гидрохлорид N-(дициклопропилметил)-3-[(2-метилфенокси)метил]-3,4 дигидро-2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон 4-[(2-метилфенокси)-метил]-2 пирролидиноном. Температура плавления 193-194 С Пример 15. Гидрохлорид(цис)-N(дициклопропилметил)-3 а,4,5,6,7,7 а-гексагидро-3 Н-индол-2-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 5, заменяя 2 пирролидинон (цис)-октагидро-2 Н-индол-8-оном. Температура плавления 204-206 С Пример 16. Гидрохлорид N-(дициклопропилметил)-3-гидроксиметил-3,4-дигидро 2 Н-пиррол-5-амина. К раствору 10 ммоль 4-гидроксиметилпирролидинтиона (получение которого описано в Tet. Lett., 1982, 23, 2547-2950) в изопропаноле добавляют 70 ммоль метилйодида. После перемешивания при температуре окружающей среды выпаривают растворитель и затем добавляют этанол и дициклопропилметиламин(15 ммоль). После нагревания с обратным холодильником в течение 24 ч выпаривают растворитель и затем остаток берут в воду, подщелачивают и экстрагируют дихлорметаном. После промывки, сушки и выпаривания органической фазы получают целевой продукт в виде белого твердого вещества. Соответствующий гидрохлорид получают действием титрованного раствора хлороводородной кислоты в этаноле. Температура плавления 199-200 С Пример 17. Гидрохлорид N-(дициклопропилметил)-3-метоксикарбонил-3,4-дигидро 2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 16, из 4 метоксикарбонилпирролидинтиона (получение которого описано в Tet. Lett., 1982, 23, 29472950). Температура плавления 123-125 С Пример 18. Гидрохлорид N-(2,4-дициклопропилфенил)-3,4-дигидро-2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 1, из соединения, описанного в получении Е. Температура плавления 163-165 С Пример 19. Фумарат N-(2,5-дициклопропилфенил)-3,4-дигидро-2 Н-пиррол-5-амина. 9 Целевой продукт получают в соответствии с процессом, описанным в примере 1, из соединения, описанного в получении F. Фумарат получают действием титрованного раствора фумаровой кислоты в этаноле. Температура плавления 174-176 С Пример 20. Фумарат N-(3,4-дициклопропилфенил)-3,4-дигидро-2 Н-пиррол-5-амина. Целевой продукт получают в соответствии с процессом, описанным в примере 19, из соединения, описанного в получении G. Температура плавления 202-204 С Пример 21. Гидрохлорид N-(2-циклопропилфенил)-2-метил-3,4-дигидро-2 Н-пиррол-5 амина. Целевой продукт получают в соответствии с процессом, описанным в примере 1, из 5 метил-2-пирролидинона. Температура плавления 138-139 С Фармакологическое исследование Пример А. Демонстрация антигипертензивной активности на анестезированных кроликах с нормальным артериальным давлением. Эксперименты проводят на кроликахсамцах с нормальным артериальным давлением. Животных анестезируют пентобарбиталом натрия (40 мг/кг) через краевую вену уха. Кролику делают трахеотомию и сразу же производят вентиляцию легких окружающим воздухом с помощью респиратора. Затем вводят ему кураре и катетеризируют правую бедренную вену и артерию. Перед каждым экспериментом вводят равный объем носителя и в течение 15-20 мин дают измеряемым параметрам возможность стабилизироваться. Испытуемые соединения или носитель вводят интрацистернально (и.ц.) или внутривенно (в.в.). Непрерывно регистрируют артериальное давление (АД, АР) с помощью катетера,помещенного в брюшную аорту через правую бедренную артерию и соединенного с датчиком давления. Результаты выражают в мм ртутного столба. Измерение частоты сердечных сокращений (ЧСС, CF), выраженной в сокращениях в минуту (с/мин, bpm), производят с помощью быстрого проведения регистрации АД и подсчета на протяжении шести секунд регистрации. Видно, что соединения изобретения вызывают длительное падение артериального давления и длительную брадикардию. В качестве примера, результаты, полученные с использованием соединения примера 1,приведены в следующей таблице: Соединение АД перед АД после ЧСС перед ЧСС после примера 1 инъекцией инъекции инъекцией инъекции Доза мг/кг) (мм рт.ст.) (мм рт.ст.) (с/мин) Пример В. Демонстрация антигипертензивной активности на 8HR. 10 Эксперименты проводили на крысах с самопроизвольно повышенным артериальным давлением (SHR). Животных анестезируют пентобарбиталом, вводя его внутрибрюшинно (45 мг/кг). Бедренные вены и артерии катетеризируют для введения испытуемых соединений. Вводят им кураре и вентилируют легкие окружающим воздухом с помощью респиратора. Перед каждым экспериментом вводят равный объем носителя, и в течение 15-20 мин дают измеряемым параметрам возможность стабилизироваться. Испытуемые соединения или носитель вводят интрацистернально (и.ц.) или внутривенно (в.в.). Непрерывно регистрируют артериальное давление (АД, АР) с помощью катетера,введенного в брюшную аорту через правую бедренную артерию и соединенного с датчиком давления. Результаты выражают в мм ртутного столба. Измерение частоты сердечных сокращений (ЧСС, CF), выраженной в сокращениях в минуту (с/мин, bpm), производят с помощью быстрого проведения регистрации АД и подсчета на протяжении шестисекундной регистрации. Видно, что соединения изобретения вызывают гипотензию и длительную брадикардию. В качестве примера результаты, полученные с использованием соединений примера 1 и примера 21, приведены в следующей таблице: Пример 1 21 21 Доза АД перед АД после ЧСС перед ЧСС после(мг/кг) инъекцией инъекции инъекцией инъекции Кроме того, соединение примера 21 не обладает сосудосужающим действием при любой дозе. Пример С. Демонстрация антиаритмической активности у анестезированных кроликов с нормальным артериальным давлением. Эксперименты проводят на кроликахсамцах с нормальным артериальным давлением. Животных анестезируют пентобарбиталом натрия (40 мг/кг) через краевую вену уха. Кролику делают трахеотомию и сразу же производят вентиляцию легких окружающим воздухом с помощью респиратора. Затем вводят ему кураре и катетеризируют правую бедренную вену и артерию. С помощью чрескожных электродов записывают электрокардиограмму. Интрацистернально (и.ц.) вводят испытуемые соединения или носитель и затем бикукуллин (10 мкг/кг). Затем в течение 30 мин непрерывно записывают электрокардиограмму, чтобы подсчитать нарушения ритма. Результаты выражают в виде числа желудочковых экстрасистол (ЖЭ, VES). Явствует, что соединения изобретения вызывают снижение числа ЖЭ. В качестве примера, результаты, полученные с использованием соединения примера 9,приведены в следующей таблице: Количество Среднее Количество % защиты животных в число защищен- от нарушегруппе ЖЭ ных кроли- ний ритма ков Контроль бикукулин Соединение примера 9 0,3 мг/кг и.ц. введение Пример D. Фармацевтическая композиция Состав для 1000 таблеток, содержащих каждая 10 мг: Соединение примера 1 10 г Гидроксипропилцеллюлоза 2 г Кукурузный крахмал 10 г Лактоза 100 г Стерата магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой n представляет 1 или 2,X представляет алкиленовую, алкениленовую или алкиниленовую группу, или необязательно замещенную ариленовую группу или необязательно замещенную гетероариленовую группу,R10 представляет атом водорода или неразветвленную или разветвленную (С 1-С 6)алкильную группу и R11 и R12 вместе образуют связь,или, альтернативно, R12 представляет атом водорода или неразветвленную или разветвленную (С 1-С 16)алкильную группу, a R10 и R11 вместе образуют связь,R2, R3 и R4, каждый независимо от других,представляет атом водорода, неразветвленную или разветвленную (С 1-С 6)алкильную группу,неразветвленную или разветвленную (С 1-С 6)гидроксиалкильную группу, неразветвленную или разветвленную (С 1-С 6)алкоксигруппу, неразветвленную или разветвленную (С 1-С 6)алкоксикарбонильную группу, необязательно замещенную арильную группу, необязательно замещенную арилалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, или необязательно замещенную арилоксиалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных 12 атомов, или, альтернативно, два из R2, R3 и R4 вместе с несущими их атомами углерода образуют (С 5-С 7)циклоалкильную группу,причем термин "алкилен" означает неразветвленную или разветвленную двухвалентную группу,содержащую от 1 до 6 углеродных атомов,термин "алкенилен" означает неразветвленную или разветвленную двухвалентную группу, содержащую от 2 до 6 углеродных атомов и от 1 до 3 двойных связей,термин "алкинилен" означает неразветвленную или разветвленную двухвалентную группу, содержащую от 2 до 6 углеродных атомов и от 1 до 3 тройных связей,термин "арил" представляет фенильную или нафтильную группу, а термин "арилен" представляет двухвалентную группу того же самого типа,термин "гетероарил" означает моно- или бициклическую ненасыщенную или частично ненасыщенную группу, имеющую от 4 до 11 кольцевых членов и от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, а термин"гетероарилен" представляет двухвалентную группу того же самого типа,термин "замещенный" в сочетании с выражениями "арил", "арилен", "арилалкил", "арилоксиалкил", "гетероарил" и "гетероарилен" означает, что группы, о которых идет речь, замещены в ароматическом фрагменте одной или несколькими группами, выбранными из атомов галогена или неразветвленных или разветвленных (С 1-С 6)алкильных групп, неразветвленных или разветвленных (С 1-С 6)алкоксигрупп, гидроксигрупп, цианогрупп, нитрогрупп или аминогрупп (необязательно замещенных одной или двумя неразветвленными или разветвленными(С 1-С 6)алкильньпли группами),их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 2. Соединения формулы (I) по п.1, в которых X представляет необязательно замещенную ариленовую группу или необязательно замещенную гетероариленовую группу, их энантиомеры и диастереоизомеры, и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 3. Соединения формулы (I) по п.1, в которых X представляет алкиленовую, алкениленовую или алкиниленовую группу, их энантиомеры и диастереоизомеры, и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 4. Соединения формулы (I) по п.1, в которых R11 и R12 вместе образуют связь, их энантиомеры и диастереоизомеры, и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 5. Соединения формулы (I) по п.1, в которых каждый из R2, R3 и R4 представляет атом водорода, их энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 6. Соединения формулы (I) по п.1, в которых X представляет алкиленовую группу или необязательно замещенную ариленовую группу,R10 представляет атом водорода или неразветвленную или разветвленную (С 1-С 6)алкильную группу, R11 и R12 вместе образуют связь, и R2, R3 и R4 каждый независимо от других представляет атом водорода, неразветвленную или разветвленную (C1-С 6)алкильную группу, неразветвленную или разветвленную (С 1-С 6)гидроксиалкильную группу, неразветвленную или разветвленную (С 1-С 6)алкоксикарбонильную группу,неразветвленную или разветвленную (С 1-С 6)алкоксигруппу,необязательно замещенную арильную группу или необязательно замещенную арилоксиалкильную группу, в которой алкильный фрагмент является неразветвленным или разветвленным и имеет от 1 до 6 углеродных атомов, их энантиомеры и диастереоизомры и их аддитивные соли с фармацевтически приемлемой (ым) кислотой или основанием. 7. Соединение формулы (I) по п.1, которое представляет собой N-(2-циклопропилфенил)3,4-дигидро-2 Н-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой. 8. Соединение формулы (I) по п.1, которое представляет собой N-(2-дициклопропилметил)3,4-дигидро-2 Н-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой. 9. Соединение формулы (I) по п.1, которое представляет собой N-(2-циклопропилфенил)-2 метил-3,4-дигидро-2 Н-пиррол-5-амин и его аддитивные соли с фармацевтически приемлемой кислотой. 10. Способ получения соединений формулы (I) по п.1, отличающийся тем, что исходное соединение формулы (II) в которой R2, R3 и R4 имеют значения, определенные для формулы (I), R12 представляет атом водорода или неразветвленную или разветвленную (C1-С 6)алкильную группу, и А представляет атом кислорода или атом серы, после проведения метилирования подвергают взаимодействию с амином формулы (III) в которой n и X имеют значения, определенные для формулы (I), и R'10 представляет собой атом водорода или неразветвленную или разветвленную (C1-С 6)алкильную группу, с получением в среде основания соединения формулы (I), которое при необходимости очищают в соответствии с традиционными методами очистки,при необходимости разделяют на его стереоизомеры традиционными методами разделения,при необходимости превращают в его аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 11. Фармацевтическая композиция, включающая в качестве активного компонента по крайней мере одно соединение по любому из пп.1-9, одно или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми наполнителями или носителями. 12. Применение фармацевтической композиции по п.11 в производстве лекарственных средств для лечения сердечно-сосудистых заболеваний. 13. Применение по п.12 в производстве лекарственных средств для лечения артериальной гипертензии. 14. Применение по п.12 для применения в производстве лекарственных средств для лечения аритмии.
МПК / Метки
МПК: A61K 31/40, C07D 207/22, A61P 9/00
Метки: новые, композиции, содержащие, способ, фармацевтические, аминопирролина, соединения, получения
Код ссылки
<a href="https://eas.patents.su/8-4042-novye-soedineniya-aminopirrolina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения аминопирролина, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Эмульгирующиеся концентраты гербицидов
Следующий патент: 4-оксо-1,4-дигидро-3-хинолинкарбоксамиды как антивирусные агенты












