Замещенный натрий -1н-пиразол-5-олат
Формула / Реферат
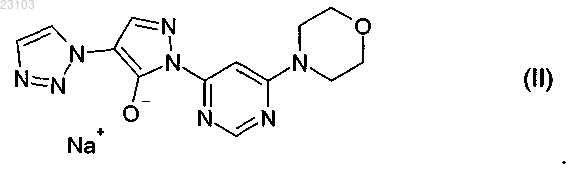
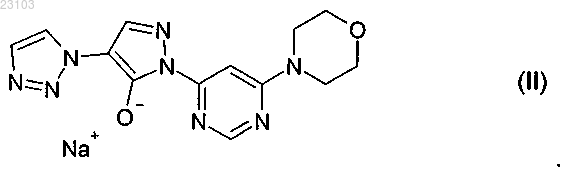
1. Натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1Н-1,2,3-триазол-1-ил)-1Н-пиразол-5-олат, соответствующий соединению формулы (II)
2. Соединение формулы (II) по п.1, отличающееся тем, что соединение формулы (II) представлено в кристаллической форме.
3. Способ получения соединения формулы (II) по п.1, отличающийся тем, что соединение формулы (I)
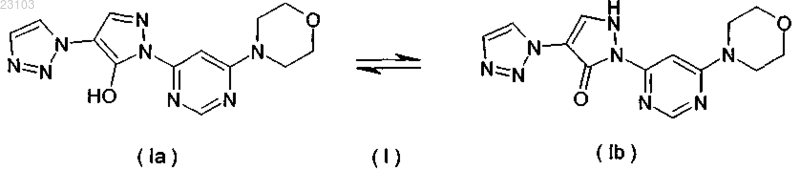
подвергают взаимодействию в растворителе с гидроксидом натрия или водным натронным щелоком.
4. Способ получения соединения формулы (II) по п.3, отличающийся тем, что взаимодействие осуществляют в присутствии дополнительного основания.
5. Способ получения соединения формулы (II) по п.3, отличающийся тем, что соединение формулы (I) подвергают взаимодействию в растворителе с водным натронным щелоком при необходимости с добавлением основания.
6. Способ получения соединения формулы (II) по п.3, отличающийся тем, что соединение формулы (I) подвергают взаимодействию в растворителе с водным натронным щелоком с добавлением триэтиламина.
7. Ингибитор HIF-пролил-4-гидроксилаз, представляющий собой соединение формулы (II)
8. Ингибитор по п.7, причем соединение формулы (II) представлено в кристаллической форме.
9. Применение соединения по п.1 или 2 для получения лекарства для лечения и/или профилактики сердечно-сосудистых заболеваний, сердечной недостаточности, анемии, хронических почечных заболеваний и почечной недостаточности.
10. Лекарство, содержащее соединение по п.1 или 2 в комбинации с инертным, нетоксичным, фармацевтически пригодным вспомогательным веществом.
11. Лекарство по п.10 для лечения и/или профилактики сердечно-сосудистых заболеваний, сердечной недостаточности, анемии, хронических почечных заболеваний и почечной недостаточности.
Текст
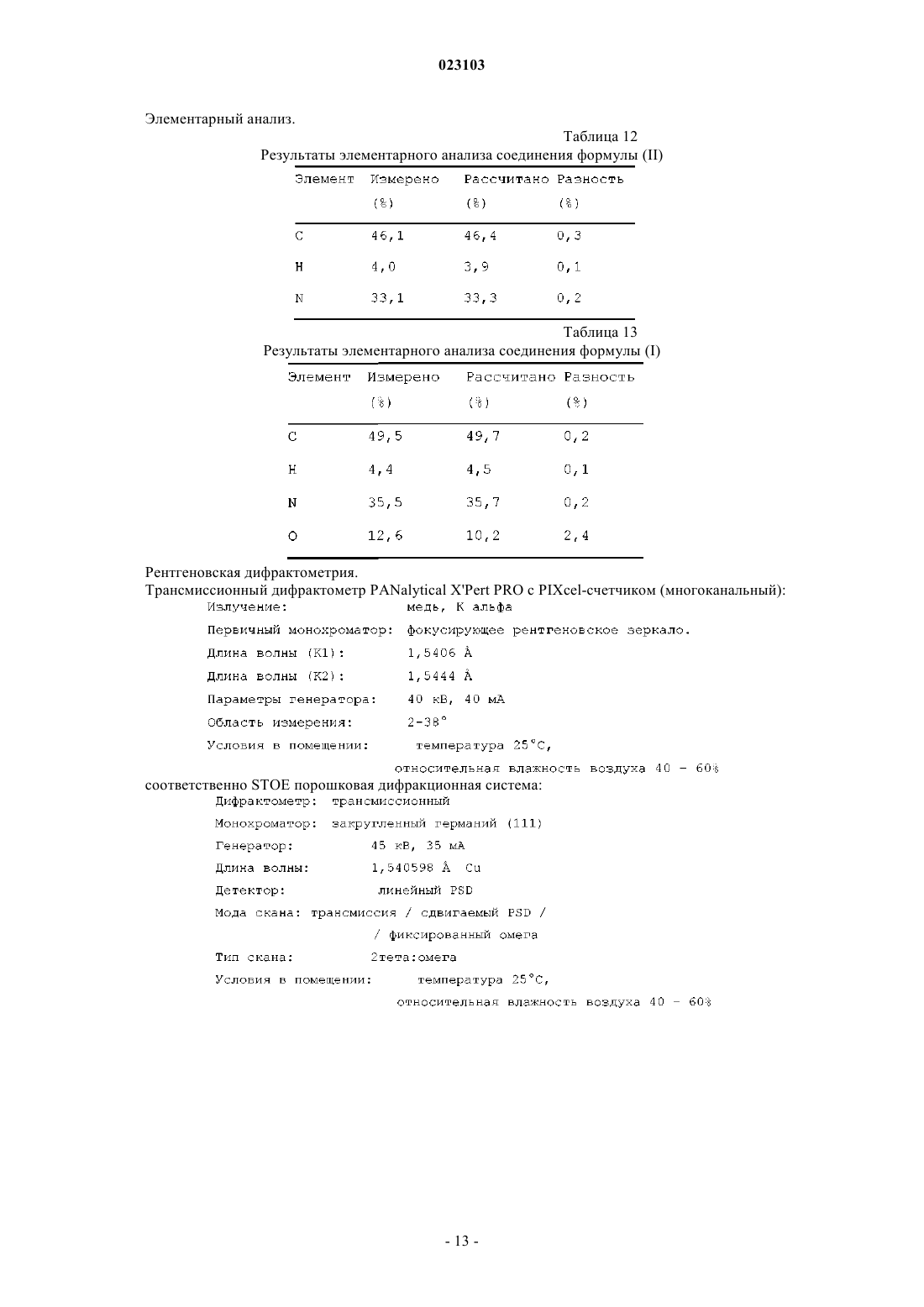
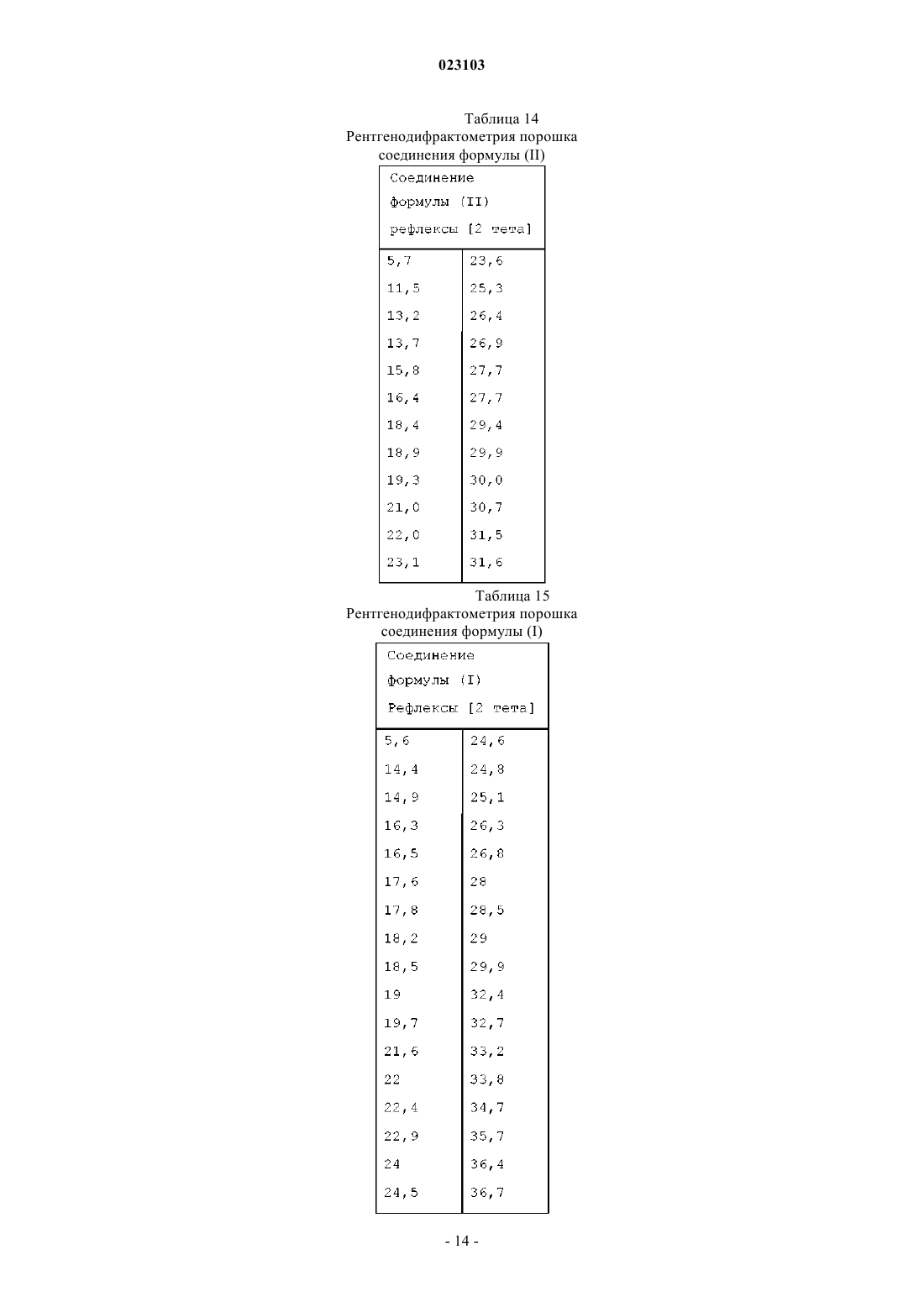
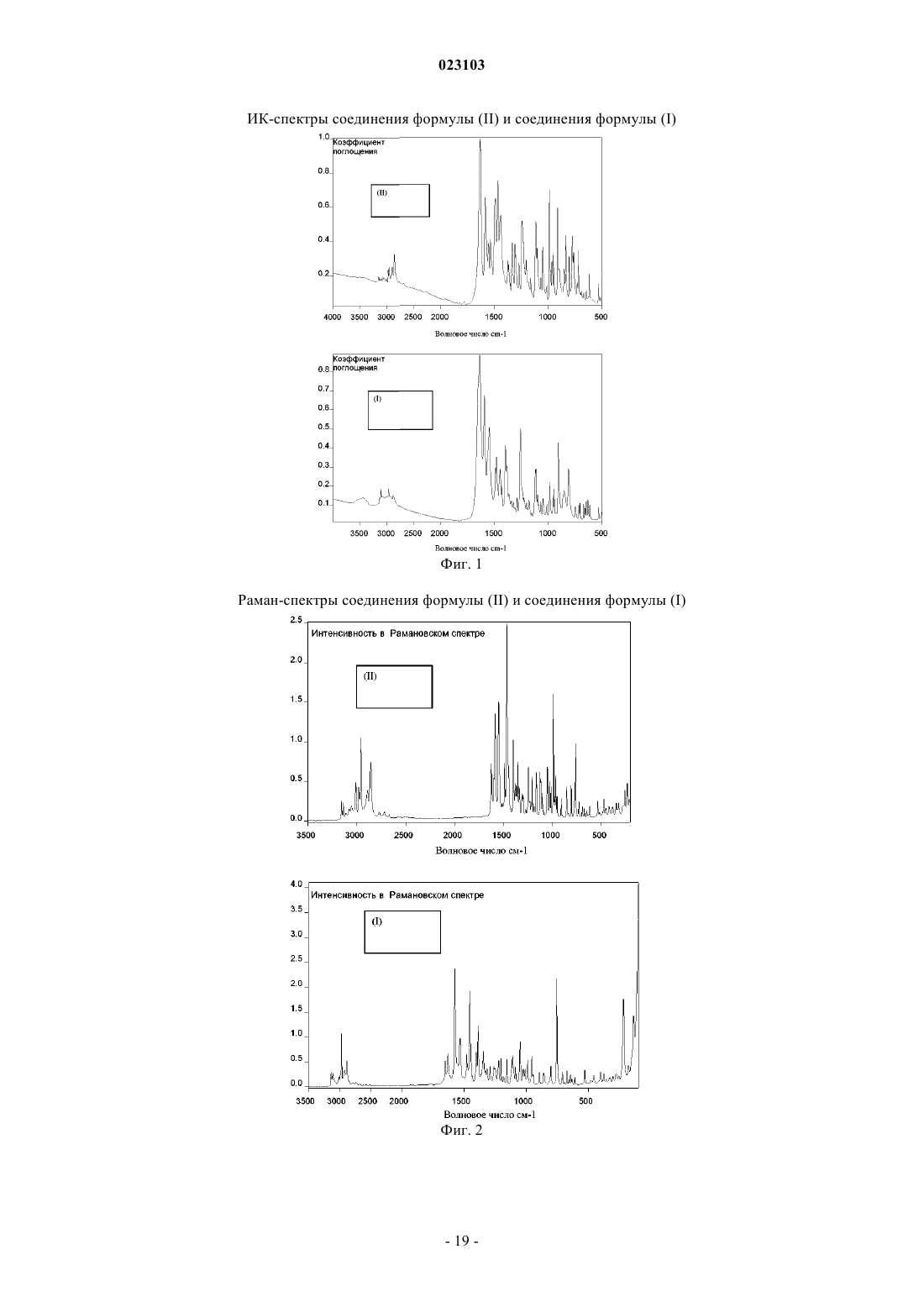
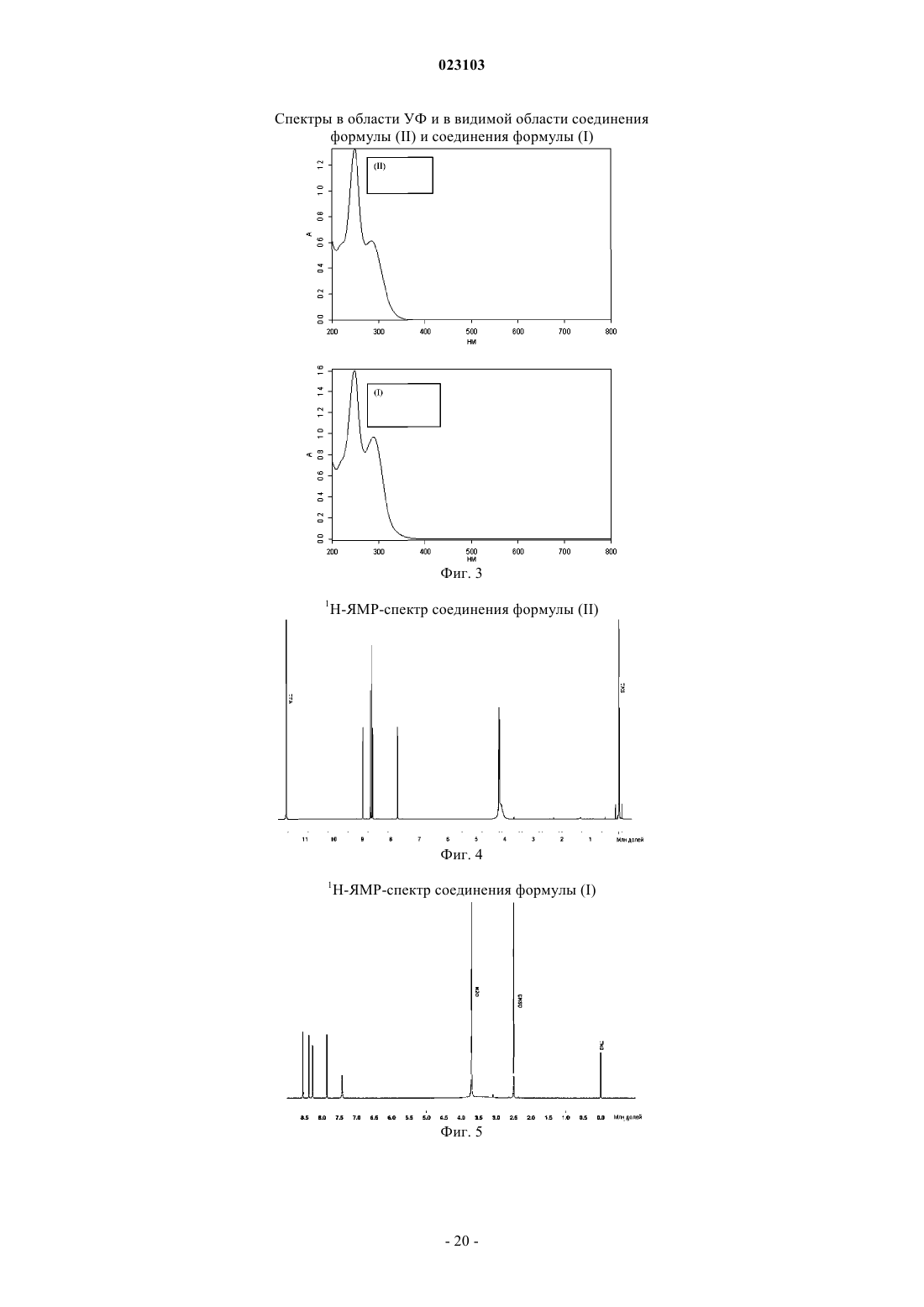
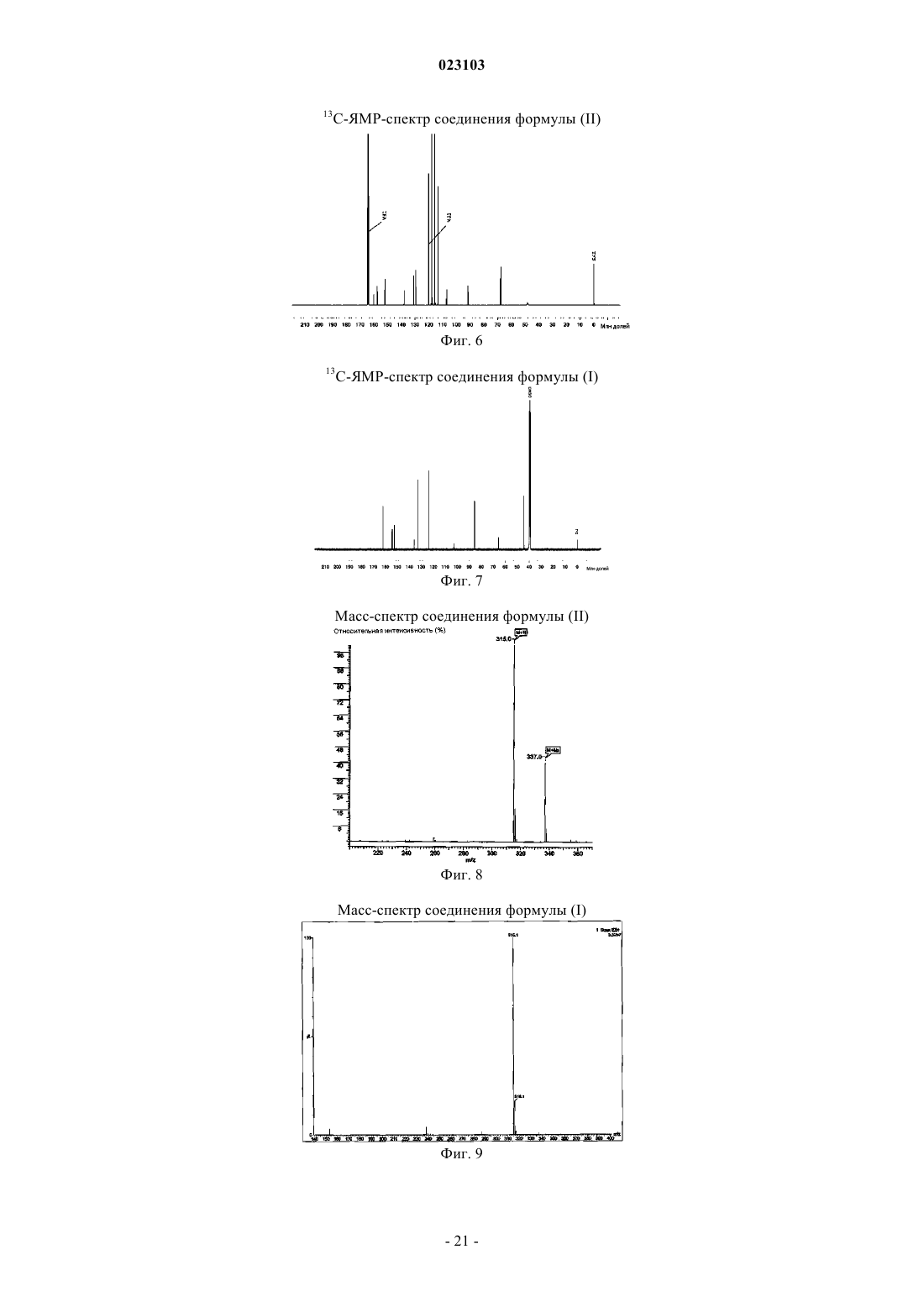
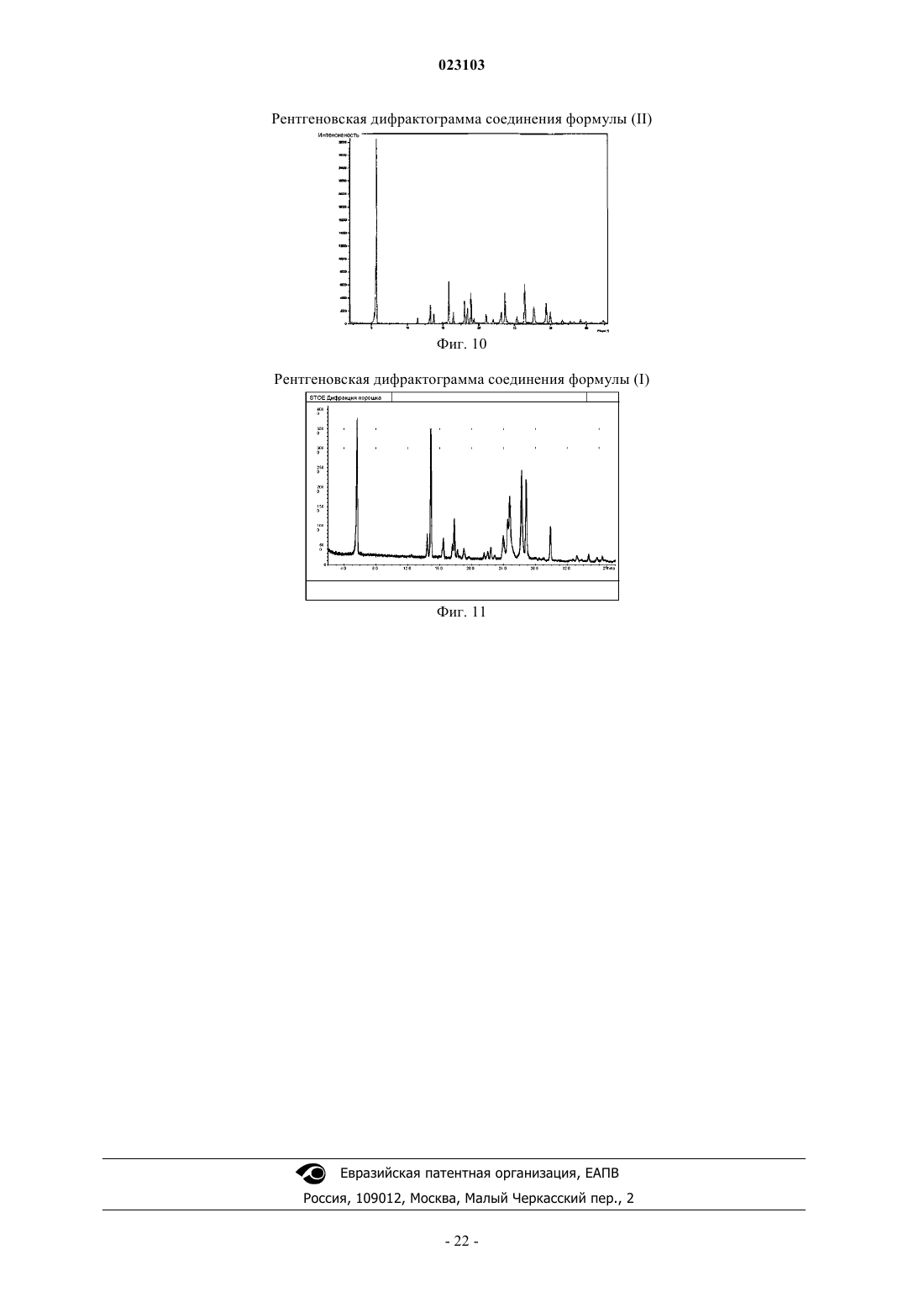
Изобретение относится к натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1 ил)-1H-пиразол-5-олату, способу его получения, к его применению для лечения и/или профилактики заболеваний, а также к его применению для изготовления лекарств для лечения и/или профилактики заболеваний, в частности сердечно-сосудистых и гематологических заболеваний,заболеваний почек, а также для способствования заживлению ран.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТУЭЛЬ ПРОПЕРТИ ГМБХ (DE) Данное изобретение относится к натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3 триазол-1-ил)-1H-пиразол-5-олату, способу его получения, его применению для лечения и/или профилактики заболеваний, в частности сердечно-сосудистых и гематологических заболеваний, заболеваний почек, а также для способствования заживлению ран. Соединение формулы (I) 1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1Hпиразол-5-ол (энольная форма, формула (Ia, соответственно 2-[6-(морфолин-4-ил)пиримидин-4-ил]-4(1 Н-1,2,3-триазол-1-ил)-1,2-дигидро-3H-пиразол-3-он (кето-форма, формула (Ib, известно из WO 2008/067871. Соединение формулы (I) действует в качестве ингибитора HIF-пролил-4-гидроксилаз и приводит,опираясь на этот специфический механизм действия, in vivo после парентерального или орального приема к индуцированию HIF-целевых генов, таких как, например, эритропоэтин, и обусловленных этим биологических процессов, таких как, например, эритропоэз. Соединение формулы (I) является гигроскопическим и поглощает при обычных окружающих условиях (20-35C, нормальное давление) уже при относительной влажности воздуха более 20% вплоть до 6 вес.% воды. Поглощение 6 вес.% воды при относительной влажности воздуха 30% почти достигается. Содержащее воду соединение формулы (I) при убывании влажности воздуха вниз от 30% опять высвобождает часть воды. Это поглощение воды, соответственно выделение воды, затрудняет обращение с соединением формулы (I), например, процессы взвешивания и получение соединения формулы (I) в остающейся постоянной, стабильной и определенной форме для применения в лекарствах, соответственно для получения лекарств, содержащих соединение формулы (I). В результате этого особенно повышаются технические расходы при получении готовых для применения форм, содержащих соединение формулы(I), таких как таблетки, грануляты и растворы для питья, так как для сохранения концентрации соединения формулы (I) необходимо применять меры по контролю и регулированию влажности воздуха. Неожиданно было открыто, что из соединения формулы (I) может быть получена натриевая соль,которая обнаруживает решающие преимущества по сравнению с соединением формулы (I). Предметом данного изобретения является соединение натрий-1-[6-(морфолин-4-ил)пиримидин-4 ил]-4-(1 Н-1,2,3-триазол-1-ил)-1H-пиразол-5-олат, соответствующий соединению формулы (II) Предпочтительно в рамках данного изобретения натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4(1 Н-1,2,3-триазол-1-ил)-1H-пиразол-5-олат (соединение формулы (II представлен в кристаллическом виде. В результате применения согласно данному изобретению соединения формулы (II) гарантируется,что по сравнению с известным соединением формулы (I) достигается значительно более высокая стабильность по отношению к поглощению воды, соответственно высвобождению воды при колеблющейся влажности воздуха. Натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1Hпиразол-5-олат (соединение формулы (II содержит менее 0,5 вес.% воды, не является гигроскопичным и изменяет при обычных окружающих условиях (20-35C, нормальное давление) и при повышенной относительной влажности воздуха вплоть до 90% содержание воды только минимально, то есть менее чем на 0,5 вес.%. С соединением формулы (II) технически отчетливо лучше обращаться, например, при процессах взвешивания, и, в частности, когда имеется в виду гарантирование сохранения постоянной концентрации соединения формулы (II) в готовой для применения форме, такой как, например, гранулят,раствор для питья или таблетка. Кроме того, соединение формулы (II) проявляет по сравнению с соединением формулы (I) более повышенную растворимость в воде. Другим предметом данного изобретения является способ получения соединения формулы (II) согласно данному изобретению, отличающийся тем, что соединение формулы (I) подвергают превращению в растворителе в присутствии гидроксида натрия или водного натронного щелока, или натриевой соли, при необходимости с добавлением основания. Более предпочтителен способ получения соединения формулы (II) согласно данному изобретению,отличающийся тем, что соединение формулы (I) подвергают превращению в растворителе, содержащем водный натронный щелок, при необходимости с добавлением основания. Еще более предпочтителен способ получения соединения формулы (II) согласно данному изобретению, отличающийся тем, что соединение формулы (I) подвергают превращению в растворителе, содержащем водный натронный щелок, с добавлением триэтиламина. Взаимодействие с гидроксидом натрия, или водным натронным щелоком, или натриевой солью происходит, как правило, в растворителе предпочтительно в температурном интервале от 20 до 120C,более предпочтительно в температурном интервале от 40 до 70C, при нормальном давлении. Соединение формулы (II) выделяют из полученной суспензии при температуре от -20 до 80C, предпочтительно при температуре от 0 до 20C, при нормальном давлении путем фильтрования и затем подвергают сушке. В том случае, когда превращение происходит при добавлении основания, соединение формулы (I),как правило, вначале разбавляют при добавлении органического основания в растворителе при температуре от 20 до 120C, более предпочтительно при температуре от 40 до 70C, при нормальном давлении, и затем осаждают соединение формулы (II) путем добавления гидроксида натрия, или водного натронного щелока, или натриевой соли при температуре от 20 до 120C, более предпочтительно при температуре от 40 до 70C, при нормальном давлении. Соединение формулы (II) выделяют из полученной суспензии при температуре от -20 до 80C, предпочтительно при температуре от 0 до 20C, при нормальном давлении путем фильтрования и затем подвергают сушке. Гидроксид натрия, или водный натронный щелок, или натриевую соль добавляют в молярном отношении от 0,8 до 2 мол.экв. по отношению к соединению формулы (I). Предпочтительно гидроксид натрия, или водный натронный щелок, или натриевую соль добавляют в молярном отношении от 1,0 до 1,4 мол.экв. по отношению к соединению формулы (I). В качестве натриевой соли подходят, например, соли органических кислот, такие как карбоксилат натрия, например ацетат натрия или цитрат натрия, или соли неорганических кислот, такие как, например, карбонат натрия, гидрокарбонат натрия, фосфат натрия, гидрофосфат натрия или хлористый натрий. В качестве растворителей подходят низкие спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол, изобутанол, 1-пентанол, или тетрагидрофуран, или ацетонитрил, или толуол, или 1,4-диоксан или смеси указанных растворителей, или смеси указанных растворителей с водой. Предпочтительны метанол, этанол, 2-пропанол, тетрагидрофуран или смеси указанных растворителей с водой. Более предпочтительны смеси метанола с водой или смеси этанола с водой в соотношении от 1:1 до 50:1 (об./об.), еще более предпочтительны смеси метанола с водой в соотношении от 7:3 до 30:1(об./об.). В качестве органических оснований подходят третичные амины, такие как триэтиламин или диизопропилэтиламин. Более предпочтителен триэтиламин. Органическое основание применяют в соотношении от 0 до 4 мол.экв. по отношению к соединению формулы (I). Предпочтительно органическое основание применяют в соотношении от 0,7 до 1,5 мол.экв. по отношению к соединению формулы (I). Получение соединения формулы (II) согласно данному изобретению можно наглядно представить в виде следующей схемы реакции: Пояснения к приведенным спектрам. На фиг. 1 приведены ИК-спектры соединения формулы (II) и соединения формулы (I). На фиг. 2 приведены Рамановские спектры соединения формулы (II) и соединения формулы (I). На фиг. 3 приведены спектры в области УФ и в видимой области спектра соединения формулы (II) и соединения формулы (I). На фиг. 4 приведен 1 Н-ЯМР спектр соединения формулы (II). На фиг. 5 приведен 1 Н-ЯМР спектр соединения формулы (I). На фиг. 6 приведен 13 С-ЯМР спектр соединения формулы (II). На фиг. 7 приведен 13 С-ЯМР спектр соединения формулы (I). На фиг. 8 приведен масс-спектр соединения формулы (II). На фиг. 9 приведен масс-спектр соединения формулы (I). На фиг. 10 приведена рентгеновская дифрактограмма соединения формулы (II). На фиг. 11 приведена рентгеновская дифрактограмма соединения формулы (I). Соединение формулы (II) согласно данному изобретению обнаруживает непредвидимый, ценный фармакологический спектр действия. В связи с этим оно подходит для применения в качестве лекарства для лечения и профилактики заболеваний у людей и животных. Соединение формулы (II) согласно данному изобретению проявляет себя в качестве специфического ингибитора HIF-пролил-4-гидроксилаз. Соединение формулы (II) согласно данному изобретению можно, опираясь на его фармакологические свойства, применять для лечения и/или профилактики сердечно-сосудистых заболеваний, в частности сердечной недостаточности, коронарных сердечных заболеваний, стенокардии, инфаркта миокарда,апоплексического удара, артериосклероза, эссенциальной, легочной и пагубной гипертонии, а также закупорки периферийных артерий. Соединение формулы (II) согласно данному изобретению пригодно далее для лечения и/или профилактики нарушений кровеобразования, таких как, например, идиопатические анемии и анемии, сопровождаемые опухолевым заболеванием (в частности, индуцированные химиотерапией анемии), инфекцией(в частности, HIV-инфекцией) или другим воспалительным заболеванием, таким как, например, ревматический артрит. Соединение формулы (II) согласно данному изобретению, кроме того, подходит для поддерживающего лечения анемий вследствие потери крови, связанной с недостатком железа анемии,связанной с недостатком витаминов анемии (например, вследствие недостатка витамина В 12 или вследствие недостатка фолиевой кислоты), гипопластической и апластической анемии, гемолитической анемии или для поддерживающего лечения анемий, вызванных нарушением использования железа (сидероахристическая анемия), или анемий, вызванных другими эндокринными нарушениями (например, гипотиреоз). Соединение формулы (II) согласно данному изобретению далее подходит для повышения гематокрита с целью получения собственной донорской крови перед операцией. Соединение формулы (II) согласно данному изобретению можно также применять для лечения и/или профилактики обусловленных операциями ишемических состояний и их последствий после хирургических вмешательств на сердце с применением аппарата искусственное сердце-легкое (например, байпассных операций, имплантаций сердечных клапанов), операций на шейной артерии, операций на аорте и операций с инструментальным открыванием или проникновением через черепную коробку. Соединение формулы (II) согласно данному изобретению далее пригодно для общего лечения и/или профилактики хирургических вмешательств с целью ускорения заживления ран и сокращения времени выздоровления. Соединение формулы (II) согласно данному изобретению, кроме того, пригодно для лечения и/или профилактики последствий острых и затяжных ишемических состояний мозга (например, апоплексического удара, удушья при родах). Соединение формулы (II) согласно данному изобретению может далее применяться для лечения и/или профилактики рака, а также для лечения и/или профилактики вреда здоровью, нанесенного в ходе лечения рака, в частности после лечения цитостатическими (противораковыми) средствами, антибиотиками и путем облучения. Соединение формулы (II) согласно данному изобретению далее пригодно для лечения и/или профилактики заболеваний из круга ревматических заболеваний и других форм заболеваний, относящихся к аутоиммунным заболеваниям и, в частности, для лечения и/или профилактики вреда здоровью, нанесенного в ходе медикаментозного лечения такого рода заболеваний. Далее соединение формулы (II) согласно данному изобретению можно применять для лечения и/или профилактики заболеваний глаза (например, глаукома), мозга (например, болезнь Паркинсона, болезнь Альцгеймера, слабоумие, хроническое болевое ощущение), хронических заболеваний почек, почечной недостаточности и острой почечной недостаточности, а также для стимулирования заживления ран. Кроме того, соединение формулы (II) согласно данному изобретению пригодно для лечения и/или профилактики, в особенности в более пожилом возрасте, часто проявляющейся общей физической слабости, вплоть до кахексии (истощения). Наряду с этим, соединение формулы (II) согласно данному изобретению пригодно для лечения и/или профилактики сексуальных нарушений. Кроме того, соединение формулы (II) согласно данному изобретению пригодно для лечения и/или профилактики сахарного диабета и заболеваний, связанных с его последствиями, таких как, например,диабетическая макро- и микроангиопатия, диабетическая нефропатия и нейропатия. Далее соединение формулы (II) согласно данному изобретению пригодно для лечения и/или профилактики фиброзных заболеваний, например, сердца, легких и печени. В особенности соединение формулы (II) согласно данному изобретению также пригодно для лечения и/или профилактики ретинопатии у недоношенных детей (Retinopathia praematurorum). Другим предметом данного изобретения является применение соединения формулы (II) согласно данному изобретению для лечения и/или предупреждения заболеваний, в частности перечисленных выше заболеваний. Другим предметом данного изобретения является применение соединения формулы (II) согласно данному изобретению для получения лекарства для лечения и/или предупреждения заболеваний, в частности перечисленных выше заболеваний. Другим предметом данного изобретения является способ лечения и/или предупреждения заболеваний, в частности перечисленных выше заболеваний, путем применения эффективного количества соединения формулы (II) согласно данному изобретению. Соединение формулы (II) согласно данному изобретению можно применять отдельно или при необходимости в комбинации с другими активными веществами. Другим предметом данного изобретения являются лекарства, содержащие соединение формулы (II) согласно данному изобретению и одно или несколько дополнительных активных веществ, в частности, для лечения и/или предупреждения перечисленных выше заболеваний. В качестве подходящих комбинационных активных веществ могут быть названы, например и предпочтительно: АСЕ-ингибиторы, антагонисты ангиотензин II-рецептора, блокаторы бета-рецептора, антагонисты калия, PDE-ингибиторы, антагонисты минералокортикоидного рецептора, диуретики, аспирин, добавки железа, добавки витамина В 12 и фолиевой кислоты, статин, производные дигиталиса (дигоксина), опухолевые химиотерапевтические средства, а также антибиотики. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с АСЕ-ингибитором, таким как, например и предпочтительно, эналаприл, каптоприл, лисиноприл, рамиприл, делаприл, фосиноприл, квиноприл, периндоприл или трандоприл. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с антагонистами ангиотензина AII, такими как, например и предпочтительно, лосартан, кандесартан, валсартан, телмисартан или эмбусартан. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с блокаторами бета-рецепторов, такими как, например и предпочтительно, пропанолол, атенолол, тимолол, пиндолол, алпренолол, окспренолол, пенбутолол,бупранолол, метипранолол, надолол, мепиндолол, каразалол, соталол, метопролол, бетаксолол, целипролол, бисопролол, картеолол, эсмолол, лабеталол, карведилол, адапролол, ландиолол, небиволол, эпанолол или буциндолол. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с антагонистами кальция, такими как, например и предпочтительно, нифедипин, амлодипин, верапамил или дилтиазем. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с ингибиторами фосфодиэстеразы (PDE), такими как, например и предпочтительно, милтринон, амринон, пимобендан, цилостазол, силденафил, варденафил или тадалафил. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с антагонистами минералокортикоидного рецептора, такими как, например и предпочтительно, спиронолактон, эплеренон, канренон или калий-канреноат. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с диуретиками, такими как, например и предпочтительно,фуросемид, буметанид, торсемид, бендрофлуметиазид, хлортиазид, гидрохлортиазид, гидрофлуметиазид,метиклотиазид, политиазид, трихлорметиазид, хлорталидон, индапамид, метолазон, квинэтазон, ацетазоламид, дихлорфенамид, метазоламид, глицерин, изосорбид, маннитол, амилорид или триамтерен. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с ингибитором HMG-CoA-редуктазы из класса статинов, таким как, например и предпочтительно, ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, росувастатин, церивастатин или питавастатин. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с опухолевыми химиотерапевтическими средствами, такими как, например и предпочтительно, из группы комплексов платины, таких как, например, цисплатина и карбоплатина, алкилирующих агентов, таких как, например, циклофосфамид и хлорамбуцил, антиметаболитов, таких как, например, 5-фторурацил и метотрексат, ингибиторов топоизомеразы, таких как, например, этопосид и камптотецин, антибиотиков, таких как, например, доксорубицин и даунорубицин,или ингибиторов киназы, таких как, например, сорафениб и сунитиниб. В предпочтительном варианте изобретения соединение формулы (II) согласно данному изобретению применяют для лечения в комбинации с антибиотиком, например и предпочтительно, из группы пенициллина, цефалоспорина или хинолона, таких как, например, ципрофлоксацин и моксифлоксацин. Далее предметом данного изобретения являются лекарства, которые содержат соединение формулы(II) согласно данному изобретению, обычно вместе с одним или несколькими инертными не токсичными,фармацевтически приемлемыми вспомогательными веществами, а также их применение для указанных выше целей. Соединение формулы (II) согласно данному изобретению может действовать систематически и ло-4 023103 кально. Для этой цели его можно применять подходящим образом, например орально, парентерально,пульмонально, назально, сублингвально, лингвально, буккально, ректально, дермально, трансдермально,конъюктивально, в уши или в качестве имплантата, соответственно стента. При этих путях применения соединение формулы (II) согласно данному изобретению может приниматься в подходящих для применения формах. Для орального применения подходят функционирующие согласно уровню техники применяемые формы, которые быстро и/или модифицированно высвобождают соединение формулы (II) согласно данному изобретению, такие как, например, таблетки (таблетки без покрытия и с покрытием, например, с устойчивыми к желудочному соку или замедленно растворяющимися, или нерастворимыми покрытиями,которые контролируют высвобождение соединения данного изобретения), быстро распадающиеся в полости рта таблетки или пленки/облатки, пленки/лиофилизаты, капсулы (например, твердые или мягкие желатиновые капсулы), драже, грануляты, гранулы, порошки, эмульсии, суспензии, аэрозоли или растворы. Парентеральное применение может происходить в обход ресорбционной стадии (например, внутривенно, внутриартериально, интракардиально, интраспинально или интралумбально) или путем включения ресорбции (например, внутримышечно, субкутанно, интракутанно, перкутанно или интраперитонеально). Для парентерального применения подходят в качестве применяемых форм среди других инъекционные и инфузионные препараты в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков. Для других путей применения подходят, например, ингаляционные формы лекарств (например, порошковые ингаляторы, распылители), капли в нос, растворы или спреи в нос, таблетки, принимаемые лингвально, сублингвально или буккально, пленки/облатки или капсулы, суппозитории, препараты для ушей или глаз, вагинальные капсулы, водные суспензии (лосьоны, получаемые при встряхивании микстуры), липофильные суспензии, мази, кремы, трансдермальные терапевтические системы (например,пластыри), молочко, пасты, пены, пудры для рассыпания, имплантаты или стенты. Предпочтительны оральное или парентеральное применения, более предпочтительны оральное и внутривенное применения. Соединение формулы (II) согласно данному изобретению может быть переведено в приведенные формы применения. Это можно осуществлять известным образом путем смешивания с инертными, не токсичными, фармацевтически пригодными вспомогательными веществами. К этим вспомогательным веществам относятся среди других носители (например, микрокристаллическая целлюлоза, лактоза, маннитол), растворители (например, жидкие полиэтиленгликоли), эмульгаторы и диспергирующие или смачивающие средства (например, додецилсульфат натрия, олеат полиоксисорбитана), связующие средства(например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как, например, аскорбиновая кислота), красители (например,неорганические пигменты, такие как, например, оксиды железа) и вещества, исправляющие вкус и/или запах. Как правило, оказалось предпочтительным при парентеральном применении прием количеств от около 0,001 до 1 мг/кг, более предпочтительно от около 0,01 до 0,5 мг/кг на 1 кг веса тела для достижения эффективных результатов. При оральном приеме дозировка составляет от около 0,01 до 100 мг/кг,предпочтительно от около 0,01 до 20 мг/кг и более предпочтительно от 0,1 до 10 мг/кг веса тела. Однако может оказаться необходимым отклонение от указанных количеств и в, частности, в том что касается зависимости от веса тела, пути применения, индивидуального поведения по отношению к биологически активному веществу, виду препарата и времени, соответственно интервалу времени, через который происходит прием. Так в некоторых случаях может оказаться достаточным прием меньше указанного минимального количества, в то время как в других случаях приходится превысить указанный верхний предел. В случае приема больших количеств можно рекомендовать это количество разделить на несколько меньших отдельных доз для нескольких приемов в день. Приведенные ниже примеры получения поясняют изобретение. Изобретение не ограничивается этими примерами. Значения, приведенные в процентах в последующих тестах и примерах, если особо не оговорено,означают весовые проценты; части приведены в весовых частях. Соотношения растворителей, соотношения разбавления и задание концентраций жидкий/жидкий растворов относятся в каждом случае к объемам. А. Примеры. Сокращения:S - синглет (в ЯМР спектрах),с - секунды,Т - триплет (в ЯМР спектрах),об./об - объем/объем, - деформационные колебания, - продольные колебания. Исходные соединения Пример 1 А. Метиловый эфир 2-(1 Н-1,2,3-триазол-1-ил)уксусной кислоты. 450 г этилового эфира 2-(1H-1,2,3-триазол-1-ил)уксусной кислоты растворяют в 3,5 л метанола, добавляют 30 г триэтиламина и перемешивают 16 ч при температуре 22C. Затем отгоняют растворители в вакууме. Получают 410 г титульного соединения в виде масла. Пример 2 А. Метиловый эфир 3-(диметиламино)-2-(1 Н-1,2,3-триазол-1-ил)акриловой кислоты. К 400 г метилового эфира 2-(1 Н-1,2,3-триазол-1-ил)уксусной кислоты добавляют 522 г диметилформамид-диметилацеталя и нагревают до кипения. Образующиеся легкокипящие соединения отгоняют. Через 4 ч охлаждают до температуры 55C и дополнительно дозируют 1050 мл метил-трет-бутилового эфира/2-пропанола (3:1 об./об.). Полученную суспензию охлаждают до 22C и фильтруют. Фильтровальный остаток многократно промывают метил-трет-бутиловым эфиром и сушат в вакууме при температуре 40C. Получают 493 г титульного соединения в виде твердого вещества. Пример 3 А. 1-[6-(Морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1H-пиразол-5-ол(энольная форма; формула (Ia, соответственно 2-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3 триазол-1-ил)-1,2-дигидро-3H-пиразол-3-он (кето-форма; формула (Ib. К 20 г 4-(6-гидразинопиримидин-4-ил)морфолина и 24,6 г метилового эфира (2E/Z)-3(диметиламино)-2-(1 Н-1,2,3-триазол-1-ил)акриловой кислоты в 210 мл этилацетата добавляют 5,84 г трифторуксусной кислоты и нагревают в течение 24 ч в условиях рефлюкса. Полученную суспензию охлаждают до температуры 0C и фильтруют. Фильтровальный остаток промывают этилацетатом, резко отсасывают и затем суспендируют в 160 мл воды. К суспензии добавляют 4,5 мл уксусной кислоты, устанавливая значение pH 5, перемешивают еще 15 мин и фильтруют. Фильтровальный остаток промывают два раза 50 мл воды и затем сушат в вакууме при температуре 40C. Выход: 26,0 г (79,4% от теор.) титульного соединения. Получение соединений 4-(6-гидразинопиримидин-4-ил)морфолина (пример 16 А), этилового эфира 2-(1H-1,2,3-триазол-1-ил)уксусной кислоты (пример 39 А) и этилового эфира 3-(диметиламино)2-(1H-1,2,3-триазол-1-ил)акриловой кислоты (пример 3 А) описано в WO 2008/067871. Получение соединения 2-(6-морфолин-4-илпиримидин-4-ил)-4-(1H-1,2,3-триазол-1-ил)-1,2-дигидро 3H-пиразол-3-она из 4-(6-гидразинопиримидин-4-ил)морфолина и этилового эфира 3-(диметиламино)-2(1H-1,2,3-триазол-1-ил)акриловой кислоты также описано в WO 2008/067871 (пример 71). Примеры осуществления Пример 1. Натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1H-пиразол-5 олат (соединение формулы (II. Пример 1.1. 10 г соединения из примера 3 А суспендируют в 50 мл метанола/воды (9:1 об./об.). К суспензии добавляют при перемешивании 3,4 г 45-процентного натронного щелока и дополнительно 50 мл метанола/воды (9:1 об./об.). Суспензию нагревают до температуры 50C и перемешивают в течение 2 ч при температуре 50C. Затем охлаждают до температуры 0C, перемешивают в течение 1 ч при температуре 0C и фильтруют. Полученный фильтровальный остаток промывают метанолом/водой (9:1 об./об.) и сушат. Выход: 10,1 г соединения формулы (II); 6,8 вес.% Na. Пример 1.2. 5 г соединения из примера 3 А суспендируют в 60 мл этанола/воды (1:1 об./об.) и при температуре 22C добавляют 1,41 г 45-процентного натронного щелока. Суспензию перемешивают в течение 3 дней при температуре 50C и в течение 2 ч при температуре 20C. Отфильтровывают твердое вещество, промывают 10 мл воды и сушат. Выход: 4 г соединения формулы (II). Пример 1.3. 30,25 г соединения из примера 3 А суспендируют в 150 мл метанола/воды (9:1 об./об.) при температуре 22C. Добавляют 13,3 мл триэтиламина и смесь нагревают до температуры 60C. Через 15 мин фильтруют полученный почти прозрачный раствор, фильтр промывают 10 мл метанола/воды (9:1 об./об.) и к собранному фильтрату при температуре 60C медленно добавляют 10,3 г 45-процентного натронного щелока. К полученной суспензии добавляют небольшое количество кристаллов соединения формулы(II), перемешивают в течение 1 ч при температуре 60C, затем медленно охлаждают до температуры 0C и фильтруют. Фильтровальный остаток промывают 15 мл метанола/воды (9:1 об./об.) и сушат в вакууме при температуре 40C. Выход: 25,1 г соединения формулы (II). Пример 1.4. 25 г соединения из примера 3 А суспендируют в 150 мл метанола/воды (1:1 об./об.) и добавляют 11 мл триэтиламина. Полученный раствор нагревают до температуры 60C и добавляют 8,5 г 45 процентного натронного щелока. Полученную суспензию медленно охлаждают до температуры 22C,перемешивают в течение 2 ч при температуре 22C и затем в течение 1 ч при температуре 0-5C. После фильтрования фильтровальный остаток промывают 15 мл метанола/воды (1:1 об./об.) и сушат в вакууме при температуре 40C. Выход: 26 г соединения формулы (II). Динамическая дифференциальная сканирующая калориметрия (ДСК). Термограммы получены с применением дифференциального сканирующего калориметра DSC 7,соответственно Pyris-1 и термогравиметрического анализатора TGA 7 фирмы Perkin-Elmer. Дифференциальный сканирующий калориметр DSC 7, соответственно Pyris-1; изготовитель: фирмаPerkin-Elmer; скорость нагревания: 2 и 20 K/мин: промывающий газ: азот; тигель: не герметичный для газа алюминиевый тигель; пробоподготовка: не было. Термогравиметрический анализатор TGA 7; изготовитель: фирма Perkin-Elmer; скорость нагревания: 10 К/мин: промывающий газ: азот, 20-30 мл/мин; тигель: открытый платиновый тигель; пробоподготовка: не было. Натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1H-пиразол-5-олат(соединение формулы (II разлагается при температуре выше 300C без плавления. Адсорбция и десорбция водяного пара. Изотерма сорбции влажности была записана с помощью динамического анализатора сорбции параIGA Sorp фирмы Hiden Analytical. Измерение проводили при температуре 25C. Обработка пробы не проводилась. Таблица 1 Адсорбция водяного пара натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1Hпиразол-5-олатом (соединение формулы (II Данные по растворимости. Способ: насыщенные растворы испытываемого вещества получают при 16-часовом перемешивании суспензии в воде при температуре 25C. Полученные суспензии после этого фильтруют и содержание в фильтрате определяют с помощью ЖХВР-измерений (ЖХВР = жидкостная хроматография высокого разрешения). Таблица 2 Растворимость в воде ИК-спектроскопия и Раман-спектроскопия (спектроскопия комбинационного рассеяния). Для измерения ИК-спектра и Раман-спектра соединения формулы (II) используют спектрометры фирмы Bruker FT/IR-Spektrometer IFS 66v и FT/Raman-Spektrometer MultiRAM со следующими параметрами: Таблица 3 Отнесение характеристических полос колебательного спектра в ИК-спектре,соответственно Раман-спектре соединения формулы (II) Таблица 4 Отнесение характеристических полос колебательного спектра в ИК-спектре,соответственно Раман-спектре соединения формулы (I) УФ/видимая - спектроскопия. Спектры в ультрафиолетовой и видимой областях спектра были сняты на спектрометре фирмы Perkin Elmer Spektrometer (Lambda 40P) при следующих условиях, соответственно параметрах. Кювета: толщина слоя поглощения 1 см; кварцевое стекло. Область длин волн: 200-800 нм. Отверстие щели: 1 нм. Подготовка пробы: около 1 мг/100 мл ацетонитрил/вода 1:1. Полосы: 285; 249 нм соединения формулы (II) и 289,3; 248,2 нм соединения формулы (I). Таблица 5 Расчет удельного поглощения и молярного коэффициента поглощения ЯМР-спектрометрия. ЯМР-спектры записывали на спектрометре Bruker NMR-Spektrometer (Advance) со следующими условиями, соответственно параметрами: Структурные формулы соединения формулы (II) и соединения формулы (I) с отнесением соответствующих ЯМР-сигналов Таблица 6 Н-ЯМР-спектр соединения формулы (II)-химические сдвиги, мультиплетность сигналов,относительное число протонов (нумерация Н-атомов опирается на структурную формулу для отнесения каждого из ЯМР-сигналов) Таблица 7 Н-ЯМР-спектр соединения формулы (I) - химические сдвиги, мультиплетность сигналов,относительное число протонов (нумерация Н-атомов опирается на структурную формулу для отнесения каждого из ЯМР-сигналов) Таблица 8 С-ЯМР-спектр соединения формулы (II) - химические сдвиги, мультиплетность сигнала,относительное число С-ядер в соединении формулы (II) (нумерация С-атомов опирается на структурную формулу для отнесения каждого из ЯМР-сигналов) 13 Таблица 9 С-ЯМР-спектр соединения формулы (I) - химические сдвиги, мультиплетность сигнала,относительное число С-ядер в соединении формулы (I) (нумерация С-атомов опирается на структурную формулу для отнесения каждого из ЯМР-сигналов) 13 Масс-спектрометрия. Масс-спектр записывали на масс-спектрометре Waters Massenspektrometer (ZQ) при приведенных далее условиях, соответственно параметрах. Элементарный анализ. Таблица 12 Результаты элементарного анализа соединения формулы (II) Таблица 13 Результаты элементарного анализа соединения формулы (I) Таблица 14 Рентгенодифрактометрия порошка соединения формулы (II) Таблица 15 Рентгенодифрактометрия порошка соединения формулы (I) В. Определение фармакологической эффективности. Фармакологические свойства соединений данного изобретения можно продемонстрировать с помощью следующих опытов. Сокращения.DMEM - Модифицированная Дулбекко среда Еагла,FCS - фетальная телячья сыворотка,ТМВ - 3,3',5,5'-тетраметилбензидин,Tris - трис-(гидроксиметил)аминометан. 1. In vitro-тесты для определения активности и селективности ингибиторов HIF-пролил-4 гидроксилазы. 1.а) Ингибирование активности HIF-пролилгидроксилазы. Гидроксилированный HIF связывается специфически с Гиппел-Линдау белок-элонгин В-элонгин Скомплексом (VBC-комплекс). Это взаимодействие происходит только тогда, когда HIF гидроксилирован на консервированном пролильном радикале. Оно является основой для биохимического определения активности HIF-пролилгидроксилазы. Тест проводится так, как описано в работе [Oehme F., Jonghaus W.,Narouz-Ott L., Huetter J., Flamme I., Anal. Biochem. 330 (1), 74-80 (2004)]. Прозрачную, покрытую слоем NeutrAvidin HBC микротитровальную пластинку с 96-углублениями(фирма Pierce) инкубируют в течение 30 мин с блокер-казеином. Затем пластинку три раза промывают каждое углубление по 200 мкл моющего буфера (50 мМ Tris, pH 7,5, 100 мМ NaCl, 10% (об./об.) блокерказеина, 0,05% (об./об.) Твеен 20). Пептид биотин-DLDLEMLAPYIPMDDDFQL (фирма Eurogentec, 4102Seraing, Бельгия) добавляют в концентрации 400 нМ в 100 мкл моющего буфера. Этот пептид служит в качестве субстрата для пролилгидроксилирования и связывается с микротитровальной пластинкой. После инкубирования в течение 60 мин пластинку промывают три раза моющим буфером, инкубируют в течение 30 мин с 1 мМ биотина в блокер-казеине и затем опять промывают три раза моющим буфером. Для того чтобы провести реакцию пролилгидроксилазы, связанный с пластинкой субстрат пептида инкубируют в течение от 1 до 60 мин с лизатом клетки, содержащим пролилгидроксилазу. Реакция происходит в 100 мкл реакционного буфера (20 мМ Tris, pH 7,5, 5 мМ KCl, 1,5 мМ MgCl2, 1 мкМ-1 мМ 2 оксоглутарата, 10 мкМ FeSO4, 2 мМ аскорбата) при комнатной температуре. Реакционная смесь содержит, наряду с этим, подлежащий тестированию ингибитор пролилгидроксилазы в различных концентрациях. Тестируемое вещество предпочтительно, но не исключительно применяют с концентрацией от 1 нМ до 100 мкМ. Трехкратным промыванием пластинки моющим буфером реакцию останавливают. Для количественного определения пролилгидроксилирования добавляют слившийся белок, который содержит как тиоредоксин из Е. coli, так и VBC-комплекс, в 80 мкл связывающего буфера (50 мМTris, pH 7,5, 120 мМ NaCl). Через 15 мин добавляют 10 мкл раствора поликлонального анти-тиоредоксинантитела из кролика в связывающем буфере. Через следующие 30 мин добавляют 10 мкл раствора в связывающем буфере пероксидазы хрена, связанного с антииммуноглобулином кролика. После 30 мин инкубирования при комнатной температуре три раза промывают моющим буфером, для того чтобы удалить не связанный VBC-комплекс и антитела. Для того чтобы определить количество связанного VBCкомплекса, проводят инкубирование в течение 15 мин с ТМВ. Реакцию окрашивания завершают добавлением 100 мкл 1 М серной кислоты. Измерением оптической плотности при длине волны 450 нм определяют количество связанного VBC-комплекса. Оно пропорционально количеству гидроксилированного пролина в субстрате пептида. Для детектирования пролилгидроксилирования можно, альтернативно, применять связанный с европием (фирма Perkin Elmer) VBC-комплекс. В этом случае количество связанного VBC-комплекса определяют с помощью разрешенной по времени флуоресценции. Кроме того, возможно применение VBCкомплекса, меченного [35S]-метионином. Для этого можно получить радиоактивно меченный VBCкомплекс путем in vitro-транскрипции-трансляции в лизате ретикулоцитов. Соединение формулы (II) согласно данному изобретению ингибирует активность HIFпролилгидроксилазы в этом тесте с IC50-значением 0,47 мкМ (среднее значение для EGLN2 C.elegans)EGL9 homolog 2)/PHD1 (Prolyl hydroxylase domain-containing protein 1, соответственно 0,14 мкМ (среднее значение для EGLN1 С.elegans) EGL9 homolog 1)/PHD2 (Prolyl hydroxylase domain-containing protein 1. (IC50 = концентрация, при которой ингибирование составляет 50%). 1.b) Клеточный, функциональный in vitro-тест. Количественную оценку эффективности соединений данного изобретения проводят с помощью рекомбинантной клеточной линии. Клетка происходит изначально от клеточной линии карциномы легких человека (А 549, АТСС: американский тип коллекций культуры, Manassas, VA 20108, США). Тестируемая клеточная линия стабильно трансфицируется вектором, который содержит репортерный ген Photinuspyralis-люциферазы (в дальнейшем называемый люциферазой) под контролем искусственного минимального промотора. Минимальный промотор состоит из двух ответственных за гипоксию элементов,направленных противопотоком ТАТА-боксу [Oehme F., Ellinghaus P., Kolkhof P., Smith T.J., RamakrishnanS., Hutter J., Schramm M., Flamme I., Biochem. Biophys. Res. Commun. 296 (2), 343-9 (2002)]. Под воздействием гипоксии (например, культивирование в присутствии 1% кислорода в течение 24 ч) или под воз- 15023103 действием не селективных диоксигеназы-ингибиторов (например, десферроксамин с концентрацией 100 мкМ, хлорида кобальта с концентрацией 100 мкМ или диэтиловый эфир N-оксалилглицина с концентрацией 1 мМ) продуцируют тестируемую клеточную линию люциферазы, которую можно детектировать и количественно оценить с помощью подходящих биолюминесцентных реагентов (например,Steady-Glo люциферазы опытной системы, фирмы Promega Corporation, Madison, WI 53711, США) и подходящего люминометра. Ход тестирования. Клетки за день до тестирования в точно измеренном количестве культурной среды (DMEM, 10%FCS, 2 мМ глутамина) помещают в микротитровальные пластинки с 384- или 1536-углублениями и выдерживают в инкубаторе для клеток (относительная влажность воздуха 96%, 5% об./об. CO2, температура 37C). В день проведения тестирования к культурной среде добавляют тестируемые соединения с определенными ступенями концентраций. В порции-углубления, которые служат для отрицательного контроля, к клеткам не добавляют тестируемые соединения. В качестве положительного контроля для определения чувствительности клетки к ингибиторам добавляют, например, десферроксамин с конечной концентрацией 100 мкМ. Через от 6 до 24 ч после внесения тестируемых веществ в углубления микротитровальных пластинок измеряют результирующий световой сигнал на люминометре. Исходя из измеренных величин определяют зависимость между дозой и эффективностью, которая служит основой для определения полумаксимальной эффективной концентрации (обозначенной как EC50-значение). Соединение формулы (II) данному изобретению показывает в описанном здесь тесте EC50-значение при 7 мкМ. 1.с) Клеточный, функциональный in vitro-тест для изменения экспрессии гена. Для того чтобы исследовать изменения экспрессии специфических мРНК в клеточных линиях человека после обработки тестируемыми соединениями, культивируют следующие клеточные линии на пластинках с 6- или 24-углублениями: клетки гепатомы человека (HUH, JCRB банк клеток, Япония), эмбриональные фибробласты почки человека (HEK/293, АТСС, Manassas, VA 20108, США), клетки карциномы шеи (Cervixcarcinom) человека (HeLa, АТСС, Manassas, VA 20108, США), клетки эндотелия вен пуповины человека (HUVEC, Cambrex, East Rutherford, New Jersey 07073, США). Через 24 ч после добавления тестируемых веществ клетки промывают солевым раствором с фосфатным буфером и извлекают из них суммарное РНК при использовании подходящих способов (например, тризол-реагент, фирмыInvitrogen GmbH, 76131 Karlsruhe, Германия). Для типичного аналитического эксперимента переваривают (усвояют) 1 мкг полученного таким путем суммарного РНК с помощью DNase I и с применением подходящей реакции с реверсной транскриптазой (ImProm-II реверсная транскрипционная система, фирмы Promega Corporation, Madison, WI 53711,США) переводят в комплементарную ДНК (цДНК). 2,5% полученного таким образом цДНК-продукта применяют в каждом случае для полимеразной цепной реакции. Уровень экспрессии мРНК подлежащих исследованию генов определяют с помощью количественной полимеразной цепной реакции в реальном времени [TaqMan-PCR; Heid С.A., Stevens J., Livak K.J., Williams P.M., Genome Res. 6 (10), 986-94 (1996)] с применением детектирующего последовательности прибора ABI Prism 7700 SequenzDetektionsinstruments (фирмы Applied Biosystems, Inc.). Использованные при этом комбинации праймерзондов генерируются программным обеспечением Primer Express 1.5 Software (фирмы AppliedBiosystems, Inc.). По отдельности исследуются мРНК эритропоэтина, карбоангидразы IX, лактатдегидрогеназы А и фактора роста клеток эндотелия сосудов. 2. In vivo-тесты для обнаружения действия в сердечно-сосудистой системе. 2.a) In vivo-тест для изменения экспрессии гена. Мышам или крысам вводят растворенные в подходящих растворителях испытываемые соединения орально с помощью желудочного зонда, внутрибрюшинно или внутривенно. Типичные дозировки составляют 0,1, 0,5, 1, 5, 10, 20, 50, 100 и 300 мг вещества на 1 кг веса тела и за один прием. Контрольные животные получают только растворитель. Через 4,8 или 24 ч после приема испытываемого вещества животным дают избыточную дозу изофлурана, умерщвляют путем перелома шейного позвонка и извлекают из них подлежащие исследованию органы. Части органов быстро замораживают в жидком азоте. Из частей органов выделяют суммарное РНК, как описано в B.1.a) и превращают его в цДНК. Уровень экспрессии мРНК подлежащих исследованию генов определяют с помощью количественной полимеразной цепной реакции в реальном времени [TaqMan-PCR; Heid С.A., Stevens J., Livak K.J., Williams P.M., GenomeRes. 6 (10), 986-94 (1996)] с применением детектирующего последовательности прибора ABI Prism 7700Sequenz-Detektionsinstruments (фирмы Applied Biosystems, Inc.). Соединение согласно данному изобретению приводит по сравнению с плацебо контролем после орального или внутрибрюшинного приема к значительному, зависящему от дозы возрастанию мРНК эритропоэтина в почке. 2.b) Определение уровня эритропоэтина в сыворотке. Мышам или крысам вводят испытываемое вещество в подходящем растворителе внутрибрюшинно или орально один или два раза в день. Типичные дозировки составляют 0,1, 0,5, 1, 5, 10, 20, 50, 100 и 300 мг вещества на 1 кг веса тела и за один прием. Контрольные животные получают только растворитель. Перед введением и через 4 ч после последнего введения вещества у животных после наркоза короткого действия делают забор крови из ретроорбитального венного сплетения или из хвостовой вены. К крови добавляют литий-гепарин для несворачиваемости. Центрифугированием выделяют плазму крови. В плазме крови с помощью эритропоэтин-ELISA (Quantikine mouse Epo Immunoassay, фирмы RD Systems, Inc., Minneapolis, США) в соответствии с инструкцией изготовителя определяют содержание эритропоэтина. Измеренные величины пересчитывают, опираясь на повышенное сравнительное измерение,в пг/мл. Соединение согласно данному изобретению приводит после орального и внутрибрюшинного введения к значительному, зависящему от дозы возрастанию эритропоэтина в плазме по сравнению с исходным значением и плацебо-контролем. 2.с) Определение клеточного состава периферийной крови. Мышам или крысам вводят испытываемое вещество в подходящем растворителе внутрибрюшинно или орально один или два раза в день в течение нескольких дней. Типичные дозировки составляют, например, 0,1, 0,5, 1, 5, 10, 20, 50, 100 и 300 мг вещества на 1 кг веса тела и за один прием. Контрольные животные получают только растворитель. В конце опыта у животных при краткосрочном наркозе делают забор крови из сплетения вен в уголке глаза или из вены хвоста и делают кровь несворачиваемой добавлением цитрата натрия. На подходящем электронном измерительном устройстве определяют в пробах крови концентрацию эритроцитов, лейкоцитов и тромбоцитов. Концентрацию ретикулоцитов определяют с помощью мазков крови, которые для этого окрашивают с помощью подходящего раствора краски(фирмы KABE Labortechnik, Numbrecht), определяют путем тщательного микроскопического просмотра каждых 1000 эритроцитов. Для определения гематокрита делают забор крови из ретроорбитального сплетения вен с помощью гематокриткапилляра и вручную определяют (считывают) величину гематокрита после центрифугирования капилляра в подходящей для этого центрифуге. Соединение согласно данному изобретению после орального и внутрибрюшинного введения приводит к значительному, зависимому от дозы возрастанию гематокрита, числа эритроцитов и ретикулоцитов по отношению к исходному значению и плацебо-контролю. С. Примеры приготовления фармацевтических препаратов. Соединения согласно данному изобретению можно следующим образом перевести в фармацевтические препараты. Таблетки. Состав. 100 мг соединения согласно данному изобретению, 50 мг лактозы (моногидрат), 50 мг кукурузного крахмала (нативно), 10 мг поливинилпирролидона (PVP 25) (фирмы BASF, Ludwigshafen, Германия) и 2 мг стеарата магния. Вес таблетки 212 мг. Диаметр 8 мм, радиус закругления 12 мм. Получение. Смесь соединения согласно данному изобретению, лактозы и крахмала гранулируют с 5% раствором (м/м) поливинилпирролидона в воде. Гранулят после высушивания перемешивают в течение 5 мин со стеаратом магния. Эту смесь прессуют на обычном прессе для прессования таблеток (формат таблетки смотри выше). В качестве контрольной величины для прессования применяют силу прессования 15 кН. Суспензия для орального применения. Состав. 1000 мг соединения согласно данному изобретению, 1000 мг этанола (96%), 400 мг родигеля(ксантановая смола фирмы FMC, Pennsylvania, США) и 99 г воды. Единичная доза в 100 мг соединения согласно данному изобретению соответствует 10 мл суспензии для орального приема. Получение. Родигель суспендируют в этаноле, соединение согласно данному изобретению добавляют к суспензии. При перемешивании добавляют воду. Перемешивают до завершения набухания родигеля примерно в течение 6 ч. Раствор для орального применения. Состав. 500 мг соединения согласно данному изобретению, 2,5 г полисорбата и 97 г полиэтиленгликоля 400. Единичная доза в 100 мг соединения согласно данному изобретению соответствует 20 г раствора для орального применения. Получение. Соединение согласно данному изобретению суспендируют при перемешивании в смеси, состоящей из полиэтиленгликоля и полисорбата. Процесс перемешивания продолжают до полного растворения соединения согласно данному изобретению. Внутривенный раствор. Соединение согласно данному изобретению растворяют с концентрацией ниже, чем у насыщенного раствора в физиологически переносимом растворителе (например, изотонический раствор поваренной соли, 5% раствор глюкозы и/или 30% раствор полиэтиленгликоля PEG 400). Раствор стерильно фильтруют и помещают в стерильные и свободные от пирогенов инъекционные емкости. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Натрий-1-[6-(морфолин-4-ил)пиримидин-4-ил]-4-(1 Н-1,2,3-триазол-1-ил)-1 Н-пиразол-5-олат, соответствующий соединению формулы (II) 2. Соединение формулы (II) по п.1, отличающееся тем, что соединение формулы (II) представлено в кристаллической форме. 3. Способ получения соединения формулы (II) по п.1, отличающийся тем, что соединение формулы подвергают взаимодействию в растворителе с гидроксидом натрия или водным натронным щелоком. 4. Способ получения соединения формулы (II) по п.3, отличающийся тем, что взаимодействие осуществляют в присутствии дополнительного основания. 5. Способ получения соединения формулы (II) по п.3, отличающийся тем, что соединение формулы(I) подвергают взаимодействию в растворителе с водным натронным щелоком при необходимости с добавлением основания. 6. Способ получения соединения формулы (II) по п.3, отличающийся тем, что соединение формулы(I) подвергают взаимодействию в растворителе с водным натронным щелоком с добавлением триэтиламина. 7. Ингибитор HIF-пролил-4-гидроксилаз, представляющий собой соединение формулы (II) 8. Ингибитор по п.7, причем соединение формулы (II) представлено в кристаллической форме. 9. Применение соединения по п.1 или 2 для получения лекарства для лечения и/или профилактики сердечно-сосудистых заболеваний, сердечной недостаточности, анемии, хронических почечных заболеваний и почечной недостаточности. 10. Лекарство, содержащее соединение по п.1 или 2 в комбинации с инертным, нетоксичным, фармацевтически пригодным вспомогательным веществом. 11. Лекарство по п.10 для лечения и/или профилактики сердечно-сосудистых заболеваний, сердечной недостаточности, анемии, хронических почечных заболеваний и почечной недостаточности. Спектры в области УФ и в видимой области соединения формулы (II) и соединения формулы (I) Рентгеновская дифрактограмма соединения формулы (II) Фиг. 10 Рентгеновская дифрактограмма соединения формулы (I)
МПК / Метки
МПК: A61K 31/506, C07D 403/14, A61P 9/00
Метки: замещенный, 1н-пиразол-5-олат, натрий
Код ссылки
<a href="https://eas.patents.su/23-23103-zameshhennyjj-natrijj-1n-pirazol-5-olat.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенный натрий -1н-пиразол-5-олат</a>