Аналоги эпоксиэйкозатриеновой кислоты и способы их получения и использования
Номер патента: 23104
Опубликовано: 29.04.2016
Авторы: Кэмпбелл Уилльям Б., Имиг Джон Дэвид, Фок Джон Рассел
Формула / Реферат
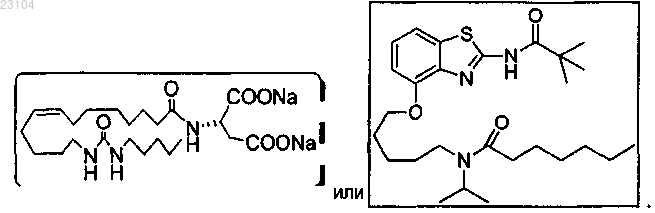
1. Соединение, выбранное из группы, состоящей из

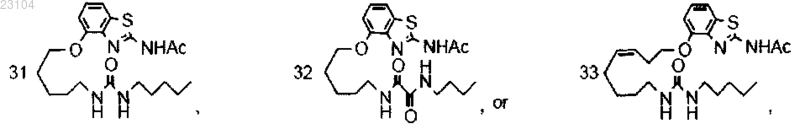
2. Соединение по п.1, где соединение представляет собой
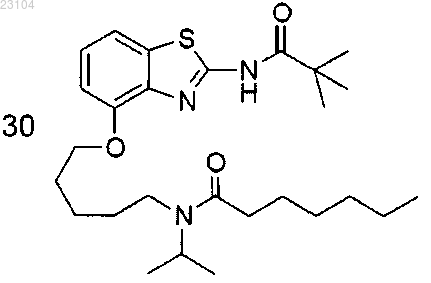
3. Соединение по п.1, где соединение представляет собой
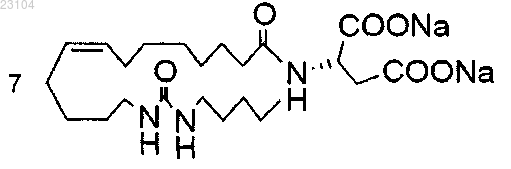
4. Соединение, выбранное из группы, состоящей из
5. Композиция для лечения гипертензии и цисплатин-индуцированной нефротоксичности, включающая соединение по п.1 или 4 и фармацевтически приемлемый носитель.
6. Способ снижения гипертензии у субъекта, включающий введение субъекту терапевтически эффективного количества соединения по п.1 или 4, где гипертензия у указанного субъекта снижается.
7. Применение соединения по п.1 или 4 для получения лекарственного средства для лечения гипертензии у субъекта.
8. Применение соединения по п.1 или 4 при лечении гипертензии у субъекта.
9. Способ снижения нефротоксичности у субъекта, включающий введение субъекту терапевтически эффективного количества соединения по п.1 или 4, где нефротоксичность у указанного субъекта снижается.
10. Способ по п.9, где нефротоксичность является лекарственно-индуцированной.
11. Способ по п.9, где нефротоксичность является цисплатин-индуцированной.
12. Применение соединения по п.1 или 4 для получения лекарственного средства для лечения лекарственно-индуцированной нефротоксичности у субъекта.
13. Применение соединения по п.1 или 4 при лечении лекарственно-индуцированной нефротоксичности у субъекта.
14. Способ снижения цисплатин-индуцированной нефротоксичности у субъекта, включающий введение субъекту терапевтически эффективного количества соединения по п.1 или 4, где цисплатин-индуцированная нефротоксичность у указанного субъекта снижается.
15. Применение соединения по п.1 или 4 для получения лекарственного препарата для лечения цисплатин-индуцированной нефротоксичности у субъекта.
16. Применение соединения по п.1 или 4 при лечении цисплатин-индуцированной нефротоксичности у субъекта.
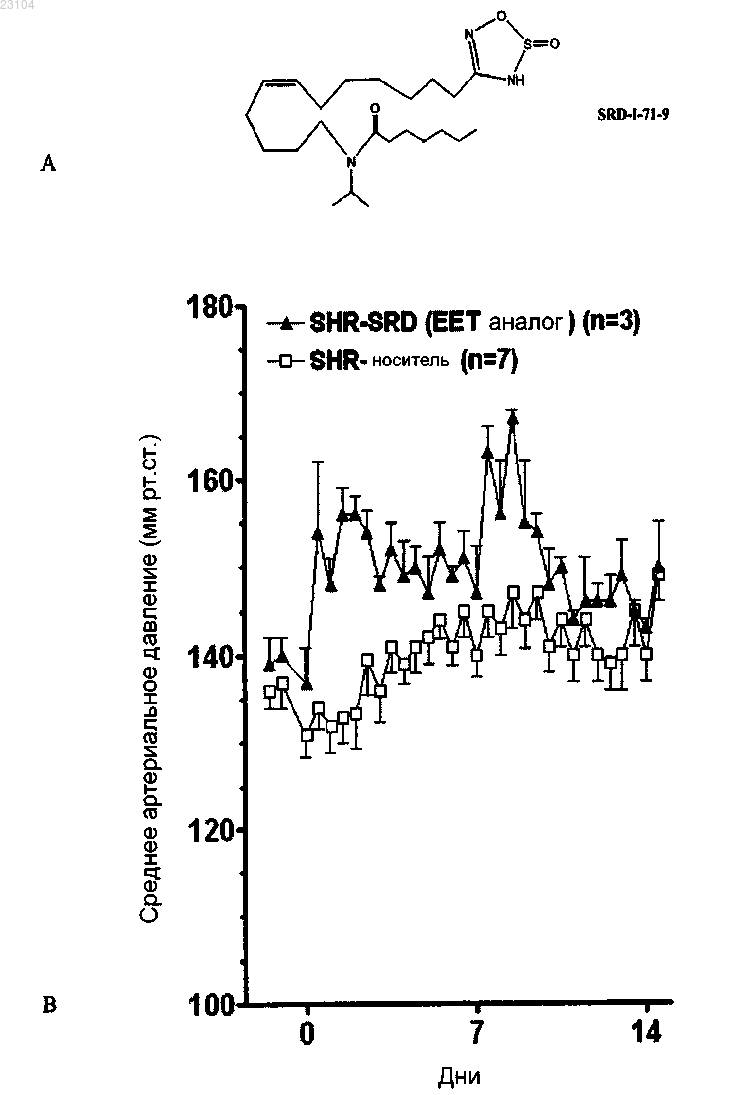
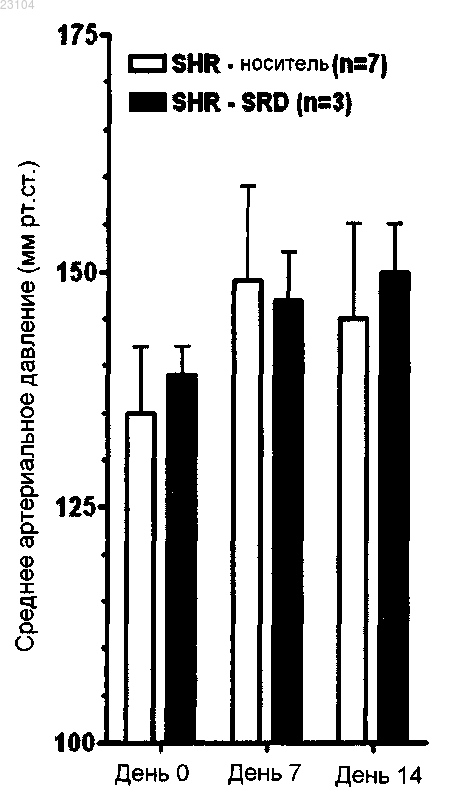
Текст
АНАЛОГИ ЭПОКСИЭЙКОЗАТРИЕНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ Соединения и композиции, включающие аналоги эпоксиэйкозатриеновой кислоты (ЕЕТ),которые действуют как агонисты ЕЕТ и являются полезными в качестве лекарственных средств для лечения лекарственно-индуцированной нефротоксичности, гипертензии и других связанных с этим состояний. Способы получения и использования соединений и композиций описаны в настоящей заявке.(71)(73) Заявитель и патентовладелец: ДЗЕ МЕДИКАЛ КОЛЛЕДЖ ОФ ВИСКОНСИН; ДЗЕ БОРД ОФ РИДЖЕНТС ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ТЕХАС СИСТЕМ (US) Перекрестная ссылка на родственные заявки Настоящая заявка заявляет приоритет к предварительной патентной заявке США 61/472410, поданной 6 апреля 2011 года, и предварительной патентной заявке США 61/608361, поданной 8 марта 2012 года, которые обе включены в настоящее описание посредством ссылки для всех целей. Заявление о федеральном финансировании научных исследований Настоящее изобретение было создано при поддержке правительства на основании DK38226,HL59699, GM31278 и HL51055, присужденными Национальными институтами здравоохранения. Правительство имеет определенные права на данное изобретение. Область техники, к которой относится изобретение Настоящее изобретение относится, главным образом, к аналогам эпоксиэйкозатриеновой кислоты(ЕЕТ). Более конкретно, настоящее изобретение направлено на аналоги ЕЕТ, которые действуют в качестве агонистов ЕЕТ и полезны в качестве лекарственных средств при лечении лекарственноиндуцированной нефротоксичности, гипертензии и других связанных с этим состояний. Предпосылки создания изобретения Эпоксиэйкозатриеновые кислоты (ЕЕТ) представляют собой сигнальные молекулы, которые действуют в качестве гормонов с малым диапазоном действия (то есть они являются аутокринными и паракринными медиаторами) сердечно-сосудистой системы и почек. Они вызывают вазорелаксацию, а также противовоспалительные и профибринолитические эффекты. Гипертензия и связанные с этим состояния. Сердечно-сосудистое заболевание поражает 81 миллионов из 300 миллионов человек в Соединенных Штатах, и у 75 миллионов из этих людей есть гипертония. Метаболиты CYP эпоксигеназы обладают биологическими действиями, которые вовлекают их в качестве важных участников в контроль сердечно-сосудистой системы и кровяного давления. Одной из первых биологических активностей, описанных для эпоксиэйкозатриеновых кислот(ЕЕТ), было ингибирование реабсорбции натрия в почечных канальцах. Позднее было определено, что ЕЕТ расширяют кровеносные сосуды, и их идентифицировали как эндотелиальные факторы гиперполяризации (EDHF). Эти биологические действия согласуются с идеей, что ЕЕТ могут представлять собой эйкозаноиды, которые способствуют снижению кровяного давления и предотвращению солечувствительной гипертензии. Измененные уровни ЕЕТ могут способствовать гипертензии у человека. Единичный нуклеотидный полиморфизм в гене CYP эпоксигеназы связан с гипертензией. Экспериментальные исследования на грызунах показали также гипертензию в условиях, когда уровни в почках фермента CYP эпоксигеназы и/или ЕЕТ были понижены. Увеличение уровней ЕЕТ с использованием 11,12-EET-SI, аналога 11,12 ЕЕТ, улучшало почечную афферентную артериолярную функцию in vitro. На данный момент, ингибиторы растворимой эпоксидгидролазы (sEHI) используют in vivo для повышения уровней ЕЕТ, и это приводит к генерализованному увеличению уровней 11,12-ЕЕТ и 14,15-ЕЕТ и в меньшей степени 8,9-ЕЕТ. Недавние исследования in vivo продемонстрировали, что аналоги ЕЕТ снижают кровяное давление у гипертензивных крыс, а также улучшают фенотип метаболического синдрома у гемоксигеназа 2-дефицитных мышей и предотвращают поражения сосудов и почек, связанное с ожирением. Действительно складывается впечатление, что некоторые из агонистов ЕЕТ, такие как NUDSA, могут также ингибировать sEH и увеличивать экспрессию CYP2C эпоксигеназы. Такой тип комбинационной активности, описанный для NUDSA, мог бы обеспечить дополнительные благоприятные эффекты. В целом, эти открытия вызвали интерес, заключающийся в направленном действии на путь CYP эпоксигеназы и ЕЕТ для лечения гипертензии. Даже если ЕЕТ обладают воздействиями на почечный канальциевый транспорт и васкулярную функцию, которые необходимы для регуляции кровяного давления, стало очевидным, что дополнительные биологические действия, приписываемые ЕЕТ, делают их отличной терапевтической мишенью для лечения других сердечно-сосудистых заболеваний. Эти дополнительные активности, продемонстрированные для ЕЕТ, включают ингибирование агрегации тромбоцитов и антивоспалительную активность. Также было обнаружено, что ЕЕТ влияют на сосудистую миграцию и пролиферацию, включая стимуляцию ангиогенеза. Таким образом, ЕЕТ стали терапевтической мишенью при конечном поражении органов, связанном с сердечно-сосудистыми заболеваниями, ишемическом поражении сердца, атеросклерозе и инсульте. Возможно, что терапевтический потенциал для ЕЕТ агонистов и sEHI не ограничивается гипертензией и сердечно-сосудистыми заболеваниями. Защиту нервных клеток от ишемического поражения относят за счет действия sEHI на кровеносные сосуды и нейроны. Существует все больше доказательств того, что sEHI обеспечивают защиту от ишемического поражения в головном мозге и сердце через эффекты на апоптозные сигнальные каскады. Также было продемонстрировано, что агонисты ЕЕТ и sEHI модулируют боль в различных экспериментальных животных моделях. Другие возможные терапевтические применения для агонистов ЕЕТ, несомненно, будут обнаружены, когда эти средства будут испытаны в других моделях заболеваний. Следовательно, в данной области существует потребность в новых агонистах ЕЕТ, которые активны в качестве терапевтических средств против гипертензии и связанных с этим сердечно-сосудистых и неврологических заболеваний. Лекарственно-индуцированная нефротоксичность. Распространенным побочным эффектом многих лекарственных средств, используемых при лечении различных состояний, является нефротоксичность. Например, цисплатин, неорганическое соединение на основе платины, является одним из наиболее эффективных и широко используемых химиотерапевтических средств, доступных для лечения различных злокачественных опухолей, включая раковые заболевания яичников, легких, темтикулярный рак и рак мочевого пузыря. Хотя цисплатин используют в качестве важного химиотерапевтического лекарственного средства в клинических условиях, он имеет потенциально летальные побочные эффекты. Наиболее распространенным из этих побочных эффектов является нефротоксичность (у 25-40% пациентов, принимающих цисплатин, развивается острая почечная недостаточность), которая ограничивает безопасное и эффективное применение этого широко используемого химиотерапевтического средства. Патофизиология цисплатин-индуцированной нефротоксичности включает повышенный окислительный стресс, воспаление, повышенный эндоплазматически-ретикулярный стресс (ER) и почечно-клеточный апоптоз. ЕЕТ является важным липидным медиатором, который проявляет ряд биологических действий,включая противовоспалительную, противоокислительную и антиапоптическую активности. Ряд исследований показали, что обладая противовоспалительной, противоокислительной и антиапоптической активностями, ЕЕТ обладает сильным потенциалом защиты органов. Например, повышенная биодоступность ЕЕТ, являющаяся результатом пониженной конверсии ЕЕТ в ее менее активную форму под действием ингибитора растворимой эпоксидгидролазы (sEH), обеспечивает защиту почек в ряде предклинических моделей заболеваний человека. Эти исследования показали, что защитное действие ЕЕТ для почки связано с противовоспалительными и противоокислительными действиями ЕЕТ. Действительно, есть убедительные доказательства, что ЕЕТ обладает противовоспалительными действиями против острых и хронических воспалений. Помимо воспаления ЕЕТ также защищает клетки от апоптоза. Таким образом,существуют убедительные доказательства способности ЕЕТ защищать орган посредством механизмов,включающих их противовоспалительные, антиапоптические и противоокислительные активности. Однако известно, что эндогенно продуцируемые ЕЕТ являются химически и метаболически лабильными. Также, быстрый метаболизм, низкая растворимость и проблемы хранения ограничивают терапевтические перспективы ЕЕТ. Таким образом, появился значительный интерес к разработке стратегий для повышения биодоступности ЕЕТ. Для этого были предприняты попытки разработать аналоги ЕЕТ,которые обладают активностью ЕЕТ-миметиков, наряду с несколькими ключевыми особенностями, важными для стабильности и биодоступности. Некоторые из таких аналогов ЕЕТ продемонстрировали ряд биологических активностей, включая защиту органов. В настоящей работе авторы исследовали защитное действие на почки двух недавно разработанных перорально активных ЕЕТ аналогов в цисплатин-индуцированной нефротоксичности. Было продемонстрировано, что ЕЕТ аналоги оказывают заметное рено-защитное действие во время введения цисплатина,и этот эффект связан с их противоокислительными, противовоспалительными, анти-ЭР стрессовыми и антиапоптическими активностями. Кроме того, было продемонстрировано, что защищая почки от вредных нефротоксичных эффектов цисплатина, эти ЕЕТ аналоги не оказывают негативное влияние на химиотерапевтический эффект цисплатина. Следовательно, в данной области существует необходимость в новых аналогах ЕЕТ, которые активны в качестве терапевтических средств против вредных нефротоксических эффектов цисплатина. Краткое изложение изобретения В данной заявке авторы настоящего изобретения демонстрируют новые композиции аналогов эпоксиэйкозатриеновых кислот (ЕЕТ) и способы их применения для лечения сердечно-сосудистых заболеваний, в частности применение таких композиций в качестве антигипертензивных средств. Следовательно, изобретение охватывает в первом аспекте определенные соединения, которые являются аналогами 14,15-ЕЕТ. В некоторых вариантах воплощения соединение имеет структуру любого из следующих соединений: В одном варианте воплощения изобретение включает соединения 7 и 30. В другом аспекте изобретение обеспечивает способ получения любого из соединений 1-33, описанных и заявленных в настоящей заявке. Соединения в соответствии с настоящим изобретением в некоторых вариантах воплощения представлены в форме композиции, включающей соединение, описанное и заявленное в настоящей заявке, в комбинации с фармацевтически приемлемым носителем. Настоящее изобретение дополнительно включает способы обеспечения лечения гипертензии у субъекта, приводящие к снижению кровяного давления у субъекта. Такие способы включают стадии введения субъекту терапевтически эффективного количества любого из соединений 1-33, отдельно или в комбинации, как описано и заявлено в настоящей заявке, посредством чего кровяное давление у субъекта снижается. В одном варианте воплощения способ включает введение соединения 7. В альтернативном варианте воплощения способ включает введение соединения 30. В другом варианте воплощения настоящее изобретение обеспечивает аналоги ЕЕТ, имеющие структуры, выбранные из группы, включающей В еще одном варианте воплощения изобретение охватывает использование любого из описанных выше аналогов 14,15-ЕЕТ для получения лекарственного препарата для лечения гипертензии у субъекта. Кроме того, настоящее изобретение дополнительно предусматривает соединения в соответствии с изобретением для использования в лечении гипертензии у субъекта. Настоящее изобретение, кроме того, включает способы лечения лекарственно-индуцированной нефротоксичности у субъекта. В одном варианте воплощения изобретение включает обеспечение лечения вредных нефротоксических эффектов цисплатина у субъекта. Такие способы включают стадии введения субъекту терапевтически эффективного количества соединения, описанного и заявленного в настоящей заявке, посредством чего снижаются вредные нефротоксические эффекты лекарственного средства у субъекта. Другие цели, признаки и преимущества настоящего изобретения станут очевидными после обзора описания, формулы изобретения и рисунков. Краткое описание рисунков Фиг. 1 А представляет химическую структуру SRD-I-71-9, которая соответствует ЕЕТ аналогу,представляющему собой соединение 26 из табл. 1. Фиг. 1 В демонстрирует среднее измеренное кровяное давление в зависимости от дней обработки у спонтанно гипертензивных крыс, которым вводили компо-3 023104 зицию, содержащую носитель или соединение 26. Фиг. 1 С демонстрирует среднее измеренное кровяное давление на день 0, день 7 и день 14 у спонтанно гипертензивных крыс, которым вводили композицию,содержащую носитель или соединение 26. Фиг. 2 А представляет химическую структуру LGK-I-119-15, которая соответствует ЕЕТ аналогу,представляющему собой соединение 20 из табл. 1. Фиг. 2 В демонстрирует среднее измеренное кровяное давление в зависимости от дней обработки у спонтанно гипертензивных крыс, которым вводили композицию, содержащую носитель или соединение 20. Фиг. 2 С демонстрирует среднее измеренное кровяное давление на день 0, день 7 и день 14 у спонтанно гипертензивных крыс, которым вводили композицию,содержащую носитель или соединение 20. Фиг. 3 А представляет химическую структуру JLJ-I-94-6, которая соответствует ЕЕТ аналогу, представляющему собой соединение 7 из табл. 1. Фиг. 3 В демонстрирует среднее измеренное кровяное давление в зависимости от дней обработки у спонтанно гипертензивных крыс, которым вводили композицию, содержащую носитель или соединение 7. Данные представлены графически в виде 12-часовых средних значений. Соединения вводили интраперитонеально в течение 14 дней. Фиг. 3 С демонстрирует среднее измеренное кровяное давление на день 0, день 7 и день 14 относительно начала лечения у спонтанно гипертензивных крыс, которым вводили композицию, содержащую носитель или соединение 7. Фиг. 4 А представляет химическую структуру MV-IV-110-20, которая соответствует ЕЕТ аналогу,представляющему собой соединение 30 из табл. 1. Фиг. 4 В демонстрирует среднее измеренное кровяное давление в зависимости от дней обработки у спонтанно гипертензивных крыс, которым вводили композицию, содержащую носитель или соединение 30. Данные представлены графически в виде 12-часовых средних значений. Фиг. 3 С демонстрирует среднее измеренное кровяное давление на день 0, день 7 и день 14 у спонтанно гипертензивных крыс, которым вводили композицию, содержащую носитель или соединение 30. Фиг. 5 А демонстрирует среднее измеренное кровяное давление в зависимости от дней обработки у крыс с индуцированной ангиотензином II спонтанной гипертензией, которым вводили композицию, содержащую носитель или соединение 7. Данные представлены графически в виде 12-часовых средних значений. Фиг. 5 В демонстрирует среднее измеренное кровяное давление на день 0, день 7 и день 14 у крыс с индуцированной ангиотензином II спонтанной гипертензией, которым вводили композицию, содержащую носитель или соединение 7. Фиг. 6 А демонстрирует среднее измеренное кровяное давление в зависимости от дней обработки у крыс с индуцированной ангиотензином II спонтанной гипертензией, которым вводили композицию, содержащую носитель или соединение 30. Данные представлены графически в виде 12-часовых средних значений. Фиг. 6 В демонстрирует среднее измеренное кровяное давление на день 0, день 7 и день 14 у крыс с индуцированной ангиотензином II спонтанной гипертензией, которым вводили композицию, содержащую носитель или соединение 30. Фиг. 7: (а) концентрация креатинина в плазме крови, (b) азот мочевины в крови (BUN), (с) молекула-1 почечного поражения и (d) содержание в моче NA G у крыс, которым вводили цисплатин, предварительно обработанных либо ЕЕТ аналогами ЕЕТ-А и ЕЕТ-В, либо носителем. р 0,05 против нормальных крыс Wistar Kyoto; р 0,05 против крыс, обработанных носителем, которым вводили цисплатин. Данные выражены как среднее значение SEM, n=5-7. Фиг. 8 А: репрезентативные микрофотоснимки, полученные методом окрашивания (200) реактивом Шиффа (PAS), показывающие образование мочевых цилиндров вместе с рассчитанной долей площади образования мочевых цилиндров (%) в почечных кортикальных срезах разных экспериментальных групп. р 0,05 против нормальных крыс Wistar Kyoto; p0,05 против крыс, обработанных носителем. Данные выражены как среднее значение SEM, n=5-7. Фиг. 8 В: Репрезентативные микрофотоснимки, полученные методом окрашивания (200) реактивом Шиффа (PAS), показывающие образование мочевых цилиндров вместе с рассчитанной долей площади образования мочевых цилиндров (%) в почечных медуллярных срезах разных экспериментальных групп. р 0,05 против нормальных крыс Wistar Kyoto; p0,05 против крыс, обработанных носителем. Данные выражены как среднее значение SEM, n=5-7. Фиг. 9: RT-PCR анализ РНК экспрессии (а) NOX1, (b) gp91Phox, (d) SOD1, (е) SOD2, (f) SOD3 и (с) измерения реактивных соединений тиобарбитуровой кислоты в почках (TBARS) у крыс, которым вводили цисплатин и обрабатывали либо ЕЕТ аналогами А, В, либо носителем. р 0,05 против нормальных крыс Wistar Kyoto; p0,05 против предварительно обработанных носителем крыс, которым вводили цисплатин. Данные выражены как среднее значение SEM, n=5-7. Фиг. 10: экспрессия в почках воспалительных маркерных генов TNF- (a), IL-6 (b) и IL-1 (с) у крыс, которым вводили цисплатин, предварительно обработанных либо ЕЕТ аналогами ЕЕТ-А и ЕЕТ-В,либо носителем. р 0,05 против нормальных крыс Wistar Kyoto; p0,05 против крыс, которым вводили цисплатин, предварительно обработанных носителем. Данные выражены как среднее значение SEM,n=5-7. Фиг. 11: экспрессия в почках маркерных генов эндоплазматического ретикулярного стрессаGRP78/BiP (a) и caspase 12 (b) у крыс, которым вводили цисплатин, обработанных либо ЕЕТ аналогами ЕЕТ-А и ЕЕТ-В, либо носителем. р 0,05 против нормальных крыс WistarKyot; p0,05 против крыс,обработанных носителем. Данные выражены как среднее значение SEM, n=5-7. Фиг. 12: активность каспазы 3 в почечной кортикальной области: (а) экспрессия антиапоптического гена Bcl2 в надпочечниках (b) в разных экспериментальных группах. Соотношения между экспрессией антиапоптическим геном Bcl2 и апоптическими генами Bak (с) и Bax (d) в разных экспериментальных группах. р 0,05 против нормальных крыс Wistar Kyoto; p0,05 против крыс, обработанных носителем,которым вводили цисплатин. Данные выражены как среднее значение SEM, n=5-7. Фиг. 13 А: цитотоксический эффект цисплатина в нормальных почечных клетках (HEK293) и раковых клетках (Hela, U87, NCCIT). Фиг. 13 В: эффект ЕЕТ аналога ЕЕТ-А на клеточный рост HEK293, Hela, U87, NCCIT. ЕЕТ-А не влияет на химиотерапевтический эффект цисплатина в NCCIT раковых клетках. Данные выражены как среднее значение SEM, n=5-7. Фиг. 14: структура ЕЕТ аналогов ЕЕТ-А и ЕЕТ-В. Фиг. 15: синтез ЕЕТ-В. Фиг. 16 А: синтез ЕЕТ-А. Фиг. 16 В: альтернативный синтез ЕЕТ-А. Подробное описание изобретенияI. Общее Перед описанием веществ и способов по настоящему изобретению следует пояснить, что данное изобретение не ограничено конкретной методологией, протоколами, материалами и описанными реагентами, поскольку они могут изменяться. Также следует понимать, что терминология, используемая в настоящей заявке, представлена исключительно для целей описания конкретных вариантов воплощения и не предназначена для ограничения объема настоящего изобретения, которое будет ограничено только любыми поданными позже невременными заявками. Следует отметить, что при использовании в настоящей заявке и в прилагаемой формуле изобретения формы единственного числа "a", "an" и "the" включают множественное число, если контекст четко не диктует иное. Кроме того, термины "а" (или "an"), "один или несколько" и "по меньшей мере один" можно использовать в настоящей заявке взаимозаменяемо. Также следует отметить, что термины "включающий", "включая" и "содержащий" можно использовать взаимозаменяемо. Если не указано иного, все технические и научные термины, используемые в настоящей заявке,имеют те же значения, которые общеизвестны обычным специалистам в области техники, к которой относится настоящее изобретение. Хотя любые способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке, можно использовать на практике или для испытания настоящего изобретения, предпочтительный способы и материалы будут описаны ниже. Все публикации и патенты, конкретно указанные в настоящей заявке, включены посредством ссылки для всех целей, включая описание и раскрытие химикатов, инструментов, статистического анализа и методологий, которые приведены в публикациях, которые могут быть использованы в связи с настоящим изобретением. Все ссылки, приведенные в данном описании, должны рассматриваться как указывающие на существующий уровень техники. Ничто в настоящей заявке не должно быть истолковано как допущение, что настоящее изобретение не вправе датировать более ранним числом такое раскрытие в силу предшествующего изобретения.II. Изобретение Авторы изобретения в настоящей заявке раскрывают новые аналоги ЕЕТ, агонисты ЕЕТ и другие родственные липидные соединения и композиции, содержащие такие соединения, а также способы синтеза таких соединений и использование таких композиций в лечении гипертензии и связанных с этим состояний, для лечения побочных эффектов цисплатиновой нефротоксичности и связанных с этим состояний. Авторы изобретения показали, что некоторые из соединений проявляют антигипертензивные эффекты и являются хорошо переносимыми в соответствующих крысиных моделях. Возможны различные варианты доставки соединений, включая интраперитонеальные инъекции, инъекции в кровоток или пероральную доставку. Липосомы, мицеллы и эмульгаторы можно использовать для лучшей растворимости этих препаратов. Как используется в настоящей заявке, "субъект" означает млекопитающих и немлекопитающих."Млекопитающие" означает любого члена класса млекопитающих, включая, но не ограничиваясь этим,людей, приматов, отличных от человека, таких как шимпанзе и другие виды приматов и обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки; и тому подобное. Примеры немлекопитающих включают, но не ограничиваются этим, птиц и т.п. Термин "субъект" не указывает на конкретный возраст или пол. Как используется в настоящей заявке, "вводить" или "введение" включает любые средства введения соединения по настоящему изобретению в организм, предпочтительно в системный кровоток. Примеры включают, но не ограничиваются этим, пероральные, буккальные, сублингвальные, пульмонарные, тран-5 023104"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения заболевания или состояния, является достаточным для эффективного лечения такого заболевания. "Терапевтически эффективное количество" будет варьироваться в зависимости от соединения, болезненного состояния, подлежащего лечению, тяжести заболевания, подлежащего лечению,возраста и относительного состояния здоровья субъекта, способа и формы введения, заключения лечащего врача или ветеринара и других факторов. Для целей настоящего изобретения "лечащий" или "лечение" описывает лечение и уход за пациентом с целью борьбы с заболеванием, состоянием или расстройством. Термины охватывают как превентивное, то есть профилактические, так и паллиативные методы лечения. Лечение включает введение соединения по настоящему изобретению для предотвращения появления симптомов или осложнений, облегчения симптомов или осложнений или устранения заболевания, состояния или расстройства. Соединение вводят пациенту в терапевтически эффективном количестве. Соединение можно вводить отдельно или как часть фармацевтически приемлемой композиции. Кроме того, соединение или композицию можно вводить одноразово, как, например, путем болюсной инъекции, несколько раз, например, с использованием нескольких таблеток или доставлять, по существу, равномерно в течение определенного периода времени, как, например, при использовании трансдермальной доставки. Кроме того, доза соединения может изменяться с течением времени. Соединение можно вводить с использованием композиции немедленного высвобождения, композиции с контролируемым высвобождением или их комбинации. Термин "контролируемое высвобождение" включает длительное высвобождение, отсроченное высвобождение и их сочетания. Фармацевтическая композиция по настоящему изобретению может быть получена, упакована или продаваться без упаковки в виде единичной стандартной дозы или в виде множества единичных стандартных доз. В настоящей заявке "стандартная доза" представляет собой дискретное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозе активного ингредиента, которую можно вводить пациенту,или удобной части такой дозы, такой как, например, половина или треть такой дозировки. Относительные количества активного ингредиента, фармацевтически приемлемый носитель и любые дополнительные ингредиенты в фармацевтической композиции по настоящему изобретению будут изменяться в зависимости от идентичности, размера и состояния пациента, а также зависят от пути, которым будут вводить композицию. В качестве примера, композиция может содержать от 0,1 и 100%(мас./мас.) активного ингредиента. Разовая доза фармацевтической композиции по настоящему изобретению обычно содержит от около 100 миллиграмм до около 2 грамм активного ингредиента и предпочтительно содержит от около 200 миллиграмм до около 1,0 грамма активного ингредиента. Предпочтительная доза для человека находится в низком мг/кг диапазоне, и ее вводят перорально один раз в день. Также может быть приемлемо введение два раза в день. Для улучшения растворимости в воде предпочтительные соединения можно формулировать с циклодекстринами или продуктами, являющимися производными циклодекстрина, дериватизированными заместителями, такими как полиэтиленгликоли или другие полярные функциональные группы, или включенными в липосомы. Для пероральной доставки соединения можно модифицировать с использованием липофильных функциональных групп или конъюгировать с активно абсорбируемыми молекулами(другие подходы описаны в публикации "Strategies to improve oral drug bioavailability", Isabel GomezOrellana, Expert Opinion on Drug Delivery, May 2005, vol. 2, No. 3: pages 419-433, которая включена в качестве ссылки в настоящую заявку). Другой аспект настоящего изобретения относится к набору, включающему фармацевтическую композицию по настоящему изобретению и инструктивные материалы. Инструктивные материалы включают публикации, записи, схему или любой другую среду выражения, которые используют для сообщения индивидууму сведений о полезности фармацевтической композиции по настоящему изобретению для одной из целей, указанных в настоящей заявке. Инструктивные материалы также могут, например, описывать подходящую дозу фармацевтической композиции по настоящему изобретению. Инструктивные материалы, включенные в набор по настоящему изобретению, могут, например, быть прикреплены к контейнеру, который содержит фармацевтическую композицию по настоящему изобретению, или их отправляют вместе с контейнером, который содержит фармацевтическую композицию. Альтернативно,инструктивные материалы можно поставлять отдельно от контейнера, предполагая, что инструктивные материалы и фармацевтическая композиция должны использоваться реципиентом вместе. Изобретение также включает набор, содержащий фармацевтическую композицию по настоящему изобретению и устройство доставки лекарственного средства для доставки композиции человеку. В качестве примера, устройство для доставки лекарственного средства может представлять собой работающий под нажатием аэрозольный баллончик, аэрозольный баллончик с дозатором, аэрозольный пульверизатор, аэрозольный ингалятор, устройство для доставки сухого порошка, дозатор с растворителем/порошком, шприц, иглу, тампон или контейнер с отмеренными дозами. Набор может дополнительно содержать инструктивные материалы, описанные в настоящей заявке. Набор также включает контейнер для отдельных композиций, такой как разделенный флакон или разделенный пакет из фольги. Дополнительные примеры контейнеров включают шприцы, коробки, пакеты и т.п. Как правило, комплект содержит указания для введения отдельных компонентов. Форма набора особенно выгодна, когда отдельные компоненты предпочтительно вводят в различных лекарственных формах (например, пероральной и парентеральной), вводят с разными интервалами между введением доз, или когда желательно титрование отдельных компонентов комбинации, как предписано лечащим врачом. Желательно обеспечить набор памяткой, например, в виде чисел рядом с таблетками или капсулами, где номера соответствуют дням приема, когда таблетки или капсулы, отмеченные таким образом,следует принимать внутрь. Другим примером такой памятки является календарь, напечатанный на карте,например, как указано далее "Первая неделя, понедельник, вторник,и т.д.Вторая неделя, понедельник, вторник" и т.д. Другие варианты для памяток будут очевидны. "Суточная доза" может представлять собой одну таблетку или капсулу или несколько таблеток или капсул, которые необходимо принять в данный день. В другом варианте воплощения настоящего изобретения обеспечивается дозатор, разработанный для распределения суточных доз по одной в порядке их предполагаемого использования. Предпочтительно дозатор оснащен памяткой таким образом, чтобы дополнительно облегчить соблюдение режима дозирования. Пример такой памятки представляет собой механический счетчик, который указывает количество суточных доз, которые были выданы. Другой пример такой памятки представляет собой микрочип с питанием от аккумуляторной батарейки в сочетании с жидкокристаллическим индикатором или звуковым сигналом напоминания, который, например, считывает дату, когда была принята последняя суточная доза, и/или напоминает о дате, когда должна быть принята следующая доза. Соединения по настоящему изобретению, необязательно включающие другие фармацевтически активные соединения, можно вводить пациенту перорально, ректально, парентерально, (например, внутривенно, внутримышечно или подкожно) интрацистернально, интравагинально, интраперитонеально, интравезикально, местно (например, порошки, мази или капли) или в виде буккального или назального спрея. Другие рассматриваемые композиции включают наночастицы, липосомные препараты, повторно герметизированные эритроциты, содержащие активный ингредиент, и композиции на иммунологической основе. Парентеральное введение фармацевтической композиции включает любой способ введения, характеризующийся физическим разрывом ткани человека и введением фармацевтической композиции через разрыв в ткани. Парентеральное введение, таким образом, включает введения фармацевтической композиции путем инъекции композиции, посредством нанесения композиции через хирургический разрез,посредством нанесения композиции путем проникновения через безоперационную рану в ткани и т.п. В частности, парентеральное введение включает подкожные, интраперитонеальные, внутривенные, внутриартериальные, внутримышечные или интрастернальные инъекции и внутривенный, внутриартериальный способ или метод диализа почек. Например, композиции по настоящему изобретению можно вводить субъекту путем инъекций в головной мозг (через vPAG), интратекальных инъекций, интраперитонеальных инъекций или инъекций в кровоток. Композиции, подходящие для парентеральных инъекций, включают активный ингредиент в сочетании с фармацевтически приемлемым носителем, таким как физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, или могут включать стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, изотонический солевой раствор, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и подобные),их подходящие смеси, триглицериды, включая растительные масла, такие как оливковое масло, или органические сложные эфиры для инъекций, такие как этилолеат. Подходящую текучесть можно поддерживать, например, при использовании покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и/или при использовании поверхностно-активных веществ. Такие композиции могут быть получены, упакованы или продаваться в форме, подходящей для болюсного введения или для непрерывного введения. Композиции могут быть получены, упакованы или продаваться в стандартной лекарственной форме, такой как ампулы, в многодозовых контейнерах, содержащих консервант, или в одноразовых устройствах для самостоятельного введения путем инъекции или для введения инъекции медицинским работником. Композиции для парентерального введения включают суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые композиции замедленного высвобождения или биоразлагаемые композиции. Такие композиции могут также включать один или несколько дополнительных ингредиентов, включая суспендирующие, стабилизирующие или диспергирующие вещества. В одном варианте воплощения композиции для парентерального введения активный ингредиент представлен в сухой форме (то есть порошок или гранулы) для восстановления подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением восстановленной композиции. Фармацевтические композиции могут быть получены, упакованы или продаваться в форме сте-7 023104 рильной водной или масляной суспензии или раствора для инъекций. Такую суспензию или раствор можно сформулировать в соответствии с известным уровнем техники, и они могут включать, помимо активного ингредиента, дополнительные ингредиенты, такие как диспергирующие вещества, увлажнители или суспендирующие вещества, описанные в настоящей заявке. Такие стерильные композиции для инъекций можно получить с использованием нетоксичного парентерально приемлемого разбавителя или растворителя, такого как вода или 1,3-бутандиол, например. Другие приемлемые разбавители и растворители включают раствор Рингера, изотонический раствор хлорида натрия и жирные масла, такие как синтетические моно- или диглицериды. Другие парентерально вводимые композиции, которые являются полезными, включают композиции, которые включают активный ингредиент в микрокристаллической форме, в липосомном препарате или в качестве компонента биоразлагаемых полимерных систем. Композиции для замедленного высвобождения или имплантации могут включать фармацевтически приемлемые полимерные или гидрофобные вещества, такие как эмульсия, ионообменная смола, умеренно растворимый полимер или умеренно растворимая соль. Соединения в соответствии с настоящим изобретением также могут содержать адъюванты, такие как консерванты, увлажнители, эмульгаторы и/или диспергирующие вещества, включая, например, парабены, хлорбутанол, фенол, сорбиновую кислоту и подобные. Также желательно включить изотонические вещества, например, сахара, хлорид натрия и тому подобное. Пролонгированная абсорбция фармацевтических композиций для инъекций может быть достигнута за счет использования средств, способных задерживать абсорбцию, например моностеарата алюминия и/или желатина. В частности, липосомы, мисомы и эмульгаторы можно использовать, чтобы сделать соединения по настоящему изобретению более растворимыми для доставки. Лекарственные формы могут включать твердые или инъецируемые имплантаты или депо. В предпочтительных вариантах воплощения имплантат содержит эффективное количество активного вещества и биоразлагаемого полимера. В предпочтительных вариантах воплощения подходящий биоразлагаемый полимер может быть выбран из группы, включающей полиаспартат, полиглютамат, поли(L-лактид), поли(D,L-лактид), поли(лактид-со-гликолид), поли(-капролактон), полиангидрид, поли(бета-гидроксибутират), поли(орто-эфир) и полифосфазен. В других вариантах воплощения имплантат содержит эффективное количество активного вещества и силиконовый полимер. Имплантат обеспечивает высвобождение эффективного количества активного вещества в течение длительного периода от около одной недели до нескольких лет. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, порошки и гранулы. В такой твердой лекарственной форме активное соединение смешивают по меньшей мере с одним обычным инертным эксципиентом (или носителем), таким как цитрат натрия или дикальцийфосфат, или (а) наполнителями или веществами, создающими объем, например, такими как крахмалы, лактоза, сахароза, маннит или кремниевая кислота; (b) связующими веществами, например, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза или камедь; (с) смачивающими средствами, например, такими как глицерин; (d) разрыхлителями, например, такими как агар-агар,карбонат кальция, картофельный крахмал или тапиоковый крахмал, альгиновая кислота, некоторые сложные силикаты или карбонат натрия; (е) замедлителями растворения, например, такими как парафин;(f) ускорителями абсорбции, например, такими как соединения четвертичного аммония; (g) увлажняющими веществами, например, такими как цетиловый спирт или глицеринмоностеарат; (h) адсорбентами,например, такими как каолин или бентонит; и/или (i) смазывающими веществами, например, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, или их смесями. В случае капсул и таблеток лекарственные формы также включают буферные вещества. Таблетку, включающую активный ингредиент, можно, например, получить путем прессования или формования активного ингредиента, необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки можно получить путем прессования в подходящем устройстве активного ингредиента в свободно-текучей форме, такой как порошок или гранулированный препарат, необязательно смешанный с одним или несколькими связующими веществами, агентами скольжения, эксципиентами, поверхностно-активными веществами и диспергирующими веществами. Формованные таблетки можно получить путем формования в подходящем устройстве смеси активного ингредиента, фармацевтически приемлемого носителя и, по меньшей мере, достаточного количества жидкости для увлажнения смеси. Фармацевтически приемлемые эксципиенты, используемые для получения таблеток, включают инертные разбавители, гранулирующие вещества и разрыхлители, связующие и смазывающие вещества. Известные диспергирующие вещества включают картофельный крахмал и натрий крахмалгликолат. Известные поверхностно-активные вещества включают лаурилсульфат натрия. Известные разбавители включают карбонат кальция, карбонат натрия, лактозу, микрокристаллическую целлюлозу, фосфат кальция, гидрофосфат кальция и фосфат натрия. Известные гранулирующие вещества и разрыхлители включают кукурузный крахмал и альгиновую кислоту. Известные связывающие вещества включают желатин,камедь, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон и гидроксипропилметилцеллюлозу. Известные смазочные вещества включают стеарат магния, стеариновую кисло-8 023104 ту, диоксид кремния и тальк. Таблетки могут быть без покрытия или они могут быть покрыты с использованием известных способов для достижения замедленного разложения в желудочно-кишечном тракте человека, тем самым обеспечивая пролонгированное высвобождение и абсорбцию активного ингредиента. В качестве примера, вещество, такое как глицерилмоностеарат или глицерилдистеарат, можно использовать для покрытия таблеток. Дополнительно в качестве примера, таблетки можно покрыть с использованием способов, описанных в патентах США 4256108; 4160452 и 4265874, с получением таблеток с осмотически контролируемым высвобождением. Таблетки могут дополнительно включать подсластитель, ароматизатор, краситель, консервант или некоторую комбинацию этих веществ в целях обеспечения фармацевтически элегантного и приятного на вкус препарата. Твердые лекарственные формы, такие как таблетки, драже, капсулы и гранулы, можно получить с покрытиями или оболочками, такими как энтеросолюбильные покрытия и другие, хорошо известные в данной области техники. Они могут также содержать опалесцирующие компоненты и также могут представлять такую композицию, которая высвобождает активное соединение или соединения замедленным образом. Примерами инкапсулирующих композиций, которые можно использовать, являются полимерные вещества и воски. Активные соединения также могут быть в форме микрокапсул, в случае необходимости, с одним или несколькими из вышеуказанных эксципиентов. Твердые композиции аналогичного типа также можно использовать в качестве наполнителей в мягких или твердых желатиновых капсулах с использованием эксципиентов, таких как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и подобные. Твердые капсулы,включающие активный ингредиент, можно получить с использованием физиологически разлагаемой композиции, такой как желатин. Такие твердые капсулы включают активный ингредиент и могут дополнительно включать дополнительные ингредиенты, включая, например, инертный твердый разбавитель,такой как карбонат кальция, фосфат кальция или каолин. Мягкие желатиновые капсулы, включающие активный ингредиент, можно получить с использованием физиологически разлагаемой композиции, такой как желатин. Такие мягкие капсулы включают активный ингредиент, который можно смешать с водной или масляной средой, такой как арахисовое масло, жидкий парафин или оливковое масло. Композиции для перорального применения можно получить с использованием известной технологии, таким образом, чтобы они специфически высвобождали перорально вводимые средства в тонком или толстом кишечнике пациента-человека. Например, композиции для доставки в желудочно-кишечный тракт, включая толстую кишку, включают системы с энтеросолюбильным покрытием, основанным, например, на метакрилатных сополимерах, таких как поли(метакриловая кислота, метилметакрилат), которые являются растворимыми только при рН 6 и выше, таким образом, что полимер только начинает растворяться при попадании в тонкий кишечник. Место, где такие полимерные композиции распадаются,зависит от скорости прохождения через кишечник и количества присутствующего полимера. Например,относительно толстое полимерное покрытие используют для доставки в проксимальный отдел толстой кишки (Hardy et al., Aliment. Pharmacol. Therap. (1987) 1:273-280). Также можно использовать полимеры,способные к обеспечению сайт-специфической доставки в ободочную кишку, где полимер зависит от бактериальной флоры толстой кишки для обеспечения ферментативного разложения полимерной оболочки и, следовательно, высвобождения лекарственного средства. Например, в таких композициях можно использовать азополимеры (патент США 4663308), гликозиды (Friend et al., J. Med. Chem. (1984) 27:261-268) и различные природные и модифицированные полисахариды (см. РСТ заявкуPCT/GB89/00581). Также можно использовать технологию прерывистого высвобождения, такую как описана в патенте США 4777049 для введения активного вещества в определенном месте в желудочно-кишечном тракте. Такие системы обеспечивают возможность доставки лекарственного средства в заранее определенное время, и их можно использовать для доставки активного вещества, необязательно совместно с другими добавками, которые могут изменить локальное микроокружение для промотирования стабильности и поглощения средства непосредственно в толстой кишке, не полагаясь на внешние условия, кроме присутствия воды для обеспечения высвобождения in vivo. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкая лекарственная форма может содержать инертные разбавители, обычно используемые в данной области,такие как вода или другие растворители, изотонический солевой раствор, солюбилизирующие вещества и эмульгаторы, вещества, например, такие как этиловый спирт, изопропиловый спирт, этилкарбонат,этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид,масла, в частности миндальное масло, арахисовое масло, кокосовое масло, хлопковое масло, арахисовое масло, кукурузное масло, оливковое масло, касторовое масло, кунжутное масло, MIGLYOL, глицерин,фракционированные растительные масла, минеральные масла, такие как жидкие парафин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, сложные эфиры жирной кислоты сорбитана или смеси этих веществ и т.п. Помимо таких инертных разбавителей соединения по настоящему изобретению также могут вклю-9 023104 чать адъюванты, такие как увлажняющие средства, эмульгирующие и суспендирующие вещества, мягчительные вещества, консерванты, буферы, соли, подсластители, ароматизаторы, красители и отдушки. Суспензии в дополнение к активному соединению могут содержать суспендирующие вещества, например, такие как этоксилированные изостеариловые спирты, полиоксиэтиленсорбит или сложные эфиры сорбитана, микрокристаллическую целлюлозу, гидрогенизированные пищевые жиры, альгинат натрия,поливинилпирролидон, трагакантовую камедь, аравийскую камедь, агар-агар и производные целлюлозы,такие как натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, метагидроксид алюминия, бентонит или смеси этих веществ и т.п. Жидкие препараты фармацевтической композиции по настоящему изобретению, которые подходят для перорального введения, могут быть получены,упакованы или продаваться или в жидкой форме или в форме сухого продукта, предназначенного для разведения водой или другим подходящим носителем перед использованием. Известные диспергирующие или увлажняющие вещества включают природные фосфатиды, такие как лецитин, продукты конденсации алкиленоксида с жирной кислотой, с алифатическим спиртом с длинной цепью, с неполным эфиром жирной кислоты и гексита или с неполным эфиром жирной кислоты и гекситангидрида (например, полиоксиэтиленстеарат, гептадекаэтиленоксицетанол, полиоксиэтиленмоноолеат и полиоксиэтиленсорбитанмоноолеат соответственно). Известные эмульгирующие вещества включают лецитин и камедь. Известные консерванты включают метил, этил или н-пропилпарагидроксибензоаты, аскорбиновую кислоту и сорбиновую кислоту. Известные подсластители включают, например, глицерин, пропиленгликоль, сорбит, сахарозу и сахарин. Известные загустители для масляных суспензий включают, например, пчелиный воск, парафин и твердый цетиловый спирт. Жидкие растворы активного ингредиента в водных или масляных растворителях можно получить,по существу, таким же образом, как и жидкие суспензии, с главным отличием, что активный ингредиент растворяют, а не суспендируют в растворителе. Жидкие растворы фармацевтической композиции по настоящему изобретению могут включать каждый из компонентов, описанных для жидких суспензий, но при этом должно быть понятно, что суспендирующие вещества необязательно помогают растворению активного ингредиента в растворителе. Водные растворители включают, например, воду и изотонический солевой раствор. Масляные растворители включают, например, миндальное масло, масляные сложные эфиры, этиловый спирт, растительное масло, такое как арахисовое, оливковое, кунжутное или кокосовое масло, фракционированные растительные масла и минеральные масла, такие как жидкий парафин. Композиции для ректального или вагинального введения можно получить путем смешивания соединения по настоящему изобретению и любых дополнительных соединений с подходящими не раздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычной комнатной температуре и жидкими при температуре тела и, следовательно, плавятся в прямой кишке или вагинальной полости и высвобождают активный ингредиент. Такая композиция может быть в форме, например, суппозитория, удерживающей клизьмы и раствора для ректального или кишечного промывания. Композиции суппозиториев могут дополнительно включать различные дополнительные ингредиенты, включая антиоксиданты и консерванты. Препараты в виде удерживающей клизьмы или растворов для ректального или кишечного промывания можно получить путем объединения активного ингредиента с фармацевтически приемлемым жидким носителем. Как известно из уровня техники, препараты в виде клизьм можно вводить с использованием устройства, и они могут быть упакованы в устройстве, для доставки лекарственного средства, адаптированном к ректальной анатомии человека. Препараты в виде клизьм могут дополнительно включать различные дополнительные ингредиенты, включая антиоксиданты и консерванты. Фармацевтическая композиция по настоящему изобретению может быть получена, упакована или продаваться в виде препарата, подходящего для вагинального введения. Такие композиции могут быть в форме, например, суппозиториев, пропитанного или покрытого вагинально вставляемого материала, такого как тампон, препарат для орошения или раствор для вагинального промывания. Лекарственные формы для местного применения соединений в соответствии с настоящим изобретением включают мази, порошки, спреи и ингаляторы. Соединения смешивают в стерильных условиях с физиологически приемлемым носителем и любыми консервантами, буферами и/или пропеллентами, которые могут потребоваться. Композиции, подходящие для местного применения, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, эмульсии масло-в-воде или вода-в-масле, такие как кремы, мази или пасты, и растворы или суспензии. Вводимые местным путем композиции могут,например, включать от около 0,1 до около 10% (мас./мас.) активного ингредиента, хотя концентрация активного ингредиента может быть выше, чем предел растворимости активного ингредиента в растворителе. Композиции для местного применения могут дополнительно включать один или несколько дополнительных ингредиентов, описанных в настоящей заявке. Офтальмологические композиции, глазные мази, порошки и растворы также рассматривают как входящие в объем настоящего изобретения. Такие композиции могут, например, быть в форме глазных капель, включая, например, 0,1-1,0% (мас./мас.) раствор или суспензию активного ингредиента в водных или масляных жидких носителях. Такие капли могут дополнительно включать буферные вещества, соли или один или несколько других дополнительных ингредиентов, описанные в настоящей заявке. В других вариантах воплощения офтальмологически вводимые композиции включают активный ингредиент в микрокристаллической форме или в липосомном препарате. Фармацевтические композиции по настоящему изобретению, формулированные для пульмонарной доставки, могут обеспечить активный ингредиент в форме капель раствора или суспензии. Такие композиции могут быть получены, упакованы или продаваться в виде водных или разбавленных спиртовых растворов или суспензий, необязательно стерильных, включающих активный ингредиент, и их удобно вводить с использованием любого устройства для распыления или пульверизации. Такие композиции могут дополнительно включать один или несколько дополнительных ингредиентов, включая ароматизатор, такой как натрий сахарин, эфирное масло, буферное вещество, поверхностно-активное вещество или консервант, такой как метилгидроксибензоат. Капли, обеспечиваемые для такого пути введения, предпочтительно имеют средний диаметр в диапазоне от около 0,1 до около 200 нанометров. Фармацевтическая композиция по настоящему изобретению может быть получена, упакована или продаваться в виде препарата, подходящего для буккального введения. Такие композиции могут, например, быть в форме таблеток или пастилок, полученных с использованием обычных способов, и могут,например, включать 0,1-20% (мас./мас.) активного ингредиента, где остальное количество составляет перорально растворимую или разлагаемую композицию, и, необязательно, один или несколько дополнительных ингредиентов, описанных в настоящей заявке. Альтернативно, композиции, подходящие для буккального введения, могут включать порошок или аэрозольный или распыляемый раствор или суспензию, содержащие активный ингредиент. Такие порошкообразные, аэрозольные или распыляемые композиции при распылении предпочтительно имеют средний размер частицы или капли в диапазоне от около 0,1 до около 200 нанометров и могут дополнительно включать один или несколько дополнительных ингредиентов, описанных в настоящей заявке. Для парентерального введения животному, не относящемуся к человеку, соединения настоящего изобретения можно получить в форме пасты или гранул и вводить в виде имплантата, как правило, под кожу головы или уха животного. Композиции в виде паст можно получить путем дисперсии соединения или соединений в фармацевтически приемлемом масле, таком как арахисовое масло, кунжутное масло,кукурузное масло или подобные. Пеллеты, содержащие терапевтически эффективное количество соединения или соединений, можно получить путем смешивания соединения с разбавителем, таким как карбовакс, карнаубский воск и подобные, и для улучшения процесса гранулирования можно добавить смазывающее вещество, такое как стеарат магния или кальция. Конечно, признано, что животным для достижения желаемого уровня дозы можно вводить более одной пеллеты. Кроме того, было обнаружено, что такие имплантаты можно также вводить периодически в течение периода лечения животного для поддержания надлежащего уровня активного средства в теле животного. Соединения по настоящему изобретению и их фармацевтически приемлемые соли можно вводить пациенту при уровнях доз в диапазоне от около 0,01 до около 1,000 мг в сутки. Для нормального взрослого человека, имеющего массу тела около 70 кг, доза в диапазоне от около 0,01 до около 300 мг, как правило, является достаточной, при этом предпочтительными являются дозы 1-10 мг/кг. Тем не менее,могут потребоваться некоторые изменения общего диапазона доз в зависимости от возраста и массы тела субъекта, подлежащего лечению, от предполагаемого пути введения, конкретного вводимого соединения и тому подобного. Определение диапазона доз и оптимальных дозировок для конкретного пациента вполне сможет определить обычный специалист в данной области, когда он ознакомится с настоящим раскрытием. Также следует отметить, что соединения по настоящему изобретению можно использовать в композициях замедленного высвобождения, контролируемого высвобождения и отсроченного высвобождения, формы которых также хорошо известны обычному специалисту в данной области. Не является критическим, будут ли соединения настоящего изобретения вводить непосредственно в клетку, в ткань, включающую клетку, в жидкость тела, которая контактирует с клеткой, или в то место в организме, из которого соединение может диффундировать или быть доставлено в клетку. Достаточно,чтобы соединение вводили пациенту в количестве и путем, посредством которого количество соединения, достаточное для мобилизации липидов в клетке, достигают непосредственно или косвенно на клетке. Минимальное количество варьируется в зависимости от конкретных соединений. Конкретные дозы и диапазон доз, который можно использовать, зависят от ряда факторов, включая потребности пациента, тяжесть состояния, подлежащего лечению, и фармакологическую активность вводимого соединения. Определение диапазона доз и оптимальных доз для конкретного пациента хорошо известно обычному специалисту в данной области с учетом данного описания. Понятно, что обычный специалист, врач или ветеринар, легко определит и пропишет эффективное количество соединения для мобилизации липидного обмена, индукции потери веса или ингибирования аппетита у пациента. Таким образом, врач или ветеринар сможет, например, назначить относительно низкую дозу на начальном этапе, последовательно увеличивая дозу до тех пор, пока соответствующий ответ не будет получен. Кроме того, понятно, однако, что конкретный уровень доз для любого конкретного человека будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраст, массу тела,общее состояние здоровья, пол и режим питания человека, время введения, способ введения, скорость выведения, любую комбинацию лекарственного средства и тяжесть любого расстройства, подлежащего лечению. Различные иллюстративные варианты воплощения композиций и способов в соответствии с настоящим изобретением теперь будут описаны в следующих примерах. В этих вариантах воплощения конкретные продукты, идентифицированные при помощи арабских цифр (например, 1, 2, 3 и т.д.), относятся к конкретным структурам, определенным таким образом в следующем описании, в частности в табл. 1 ниже и прилагаемой формуле изобретения.III. Примеры Следующие примеры предложены исключительно для иллюстративных целей и не предназначены каким-либо образом для ограничения объема настоящего изобретения. Действительно, различные модификации настоящего изобретения в дополнение к тем, что показаны и описаны в настоящей заявке, станут очевидными специалистам в данной области из приведенного выше описания и следующих примеров и попадают в объем прилагаемой формулы изобретения. Пример 1. Синтез 33 ЕЕТ аналогов В этом примере изобретатели описывают синтез библиотеки аналогов ЕЕТ. Химические структуры этих соединений, обозначенных как соединения 1-33, приведены в табл. 1 ниже. Общие процедуры. Если не указано иное, выходы относятся к очищенным продуктам и не оптимизированы. Конечные соединения оценивали как имеющие чистоту 95% согласно данным ВЭЖХ, с использованием колонки Zorbax Eclipse C18 (2504,6 мм; Agilent), соединенной с Agilent 1200 API/LC-MS, и с использованием комбинаций ацетонитрил/вода в качестве растворителя. Все чувствительные к кислороду и/или влаге реакции осуществляли в атмосфере аргона с использованием высушенной в печи посуды и безводных растворителей. Безводные растворители были свежеперегнаны из натрийбензофенонкетила, за исключением CH2Cl2,который перегоняли из СаН 2. Экстракты сушили над безводным Na2SO4 и фильтровали для удаления всех летучих веществ при пониженном давлении. Если не указано иное, коммерчески доступные вещества использовали без очистки. Флэш-хроматографию (FC) осуществляли с использованием Е Merck силикагеля 60 (240400 меш). Тонкослойную хроматографию (ТСХ) осуществляли с использованием предварительно покрытых пластин, приобретенных у Е. Merck (силикагель 60 PF254, 0,25 мм). Спектры ядерного магнитного резонанса(ЯМР) регистрировали на спектрометрах Varian 300, 400 или 500 при рабочих частотах 300/400/500 МГц (1 Н) или 75/100/125 МГц (13 С) в CDCl3, если не указано иное. Картины расщепления ядерного магнитного резонанса (ЯМР) описаны как синглет (с), дублет (д), триплет (т), квартет (кв.) и широкий (шир.); значения химических сдвиговприведены в миллионных долях (м.д.) по отношению к остаточному растворителю (хлороформ =7,27 для 1 Н NMR или =77,23 для 13 С NMR с несвязанными протонами), и константы связывания(J) указаны в Герцах (Гц). Температуры плавления определяли с использованием OptiMelt (Stanford ResearchSystems) и не корректировали. Масс-спектральные анализы с высоким разрешением были любезно предоставлены лабораторией масс-спектроскопии Университета Нотр-Дам или профессором Касем Нитипатиком(медицинский колледж Висконсина). Таблица 1. 33 EET аналога и измеренная сосудистая релаксация и активность ингибирования sEHN-Бутиллитий (12,0 мл 2,5 М раствор в гексане, 30,0 ммоль) добавляли по каплям при перемешивании к охлажденному до -78 С раствору 2-(гекс-5-инилокси)тетрагидро-2H-пирана (5,0 г, 27,43 ммоль, G.F. Smith Chem. Co.) в смеси THF/HMPA (4:1, 150 мл) в атмосфере аргона. Через 30 мин реакционную смесь нагревали до 0 С и поддерживали при этой температуре в течение 2 ч. После повторного охлаждения до -78 С добавляли раствор 1-трет-бутилдифенилсилилокси-6-бромгексана 1 (11,50 г, 27,43 ммоль) вTHF (55 мл) и температуру повышали в течение 3 ч до 23 С. Еще через 12 ч реакционную смесь гасили насыщенным водным раствором NH4Cl (25 мл). Смесь экстрагировали при помощи EtOAc (2100 мл) и объединенные экстракты промывали водой (2150 мл), насыщенным солевым раствором (50 мл), сушили и концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением указанного в заголовке соединения (11,14 г, 78%), которое получали в виде бесцветного масла, спектральные данные которого соответствовали литературным данным. ТСХ: 15%EtOAc/гексан, Rf0,60; 1 Н ЯМР (400 МГц)7,64-7,68 (м, 4H), 7,34-7,42 (м, 6 Н), 4,57 (т, J=4,3 Гц, 1H),3,78-3,86 (м, 2 Н), 3,65 (т, J=6,3 Гц, 2 Н), 3,32-3,54 (м, 2 Н), 2,10-2,22 (м, 4H), 1,24-1,84 (м, 18H), 1,04 (с,9 Н); 13 С ЯМР (100 МГц)130,61, 129,17, 124,54, 122,62, 93,82, 75,48, 74,89, 72,41, 72,10, 71,78, 62,11,58,93, 57,32, 27,51, 25,79, 24,18, 23,99, 23,68, 21,96, 21,87, 21,0, 20,55, 20,40, 14,26, 13,77, 13,67. 12-(трет-Бутилдифенилсилилокси)додец-5-ин-1-ол Смесь трет-бутилдифенил-[12-(тетрагидро-2H-пиран-2-илокси)додец-7-инилокси)]силана (11,0 г,21,14 ммоль) и паратолуолсульфоновой кислоты (165 мг) в МеОН (110 мл) перемешивали при комнатной температуре в течение 10 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (10 мл). Метанол выпаривали, затем добавляли дополнительное количество воды (50 мл) и смесь экстрагировали при помощи EtOAc (375 мл). Объединенные органические экстракты промывали водой (250 мл), насыщенным солевым раствором (40 мл), сушили и концентрировали при пониженном давлении. Остаток очищали при помощи хроматографии на SiO2 с получением указанного в заголовке соединения (7,93 г,86%), которое получали в виде бесцветного масла, спектральные данные которого соответствовали литературным данным 1, ТСХ: EtOAc/гексан (3:7), Rf0,44; 1 Н ЯМР (300 МГц)7,64-7,68 (м, 4 Н), 7,34-7,42 (м,6 Н), 3,62 (т, J=6,3 Гц, 4 Н), 2,06-2,22 (м, 4 Н), 1,50-1,64 (м, 12 Н), 1,04 (с, 9 Н); 13 С ЯМР (100 МГц)135,81,134,36, 129,74, 127,82, 80,89, 80,01, 64,14, 62,71, 32,71, 32,10, 29,34, 28,86, 27,11, 25,59, 25,57, 19,46, 18,93,18,77.NaBH4 (82 мг, 2,28 ммоль) добавляли порциями при интенсивном перемешивании при комнатной температуре к раствору Ni(OAc)24 Н 2 О (567 мг, 2,28 ммоль) в абсолютном этаноле (20 мл) в атмосфере водорода (1 атм). Через 15 мин к черной суспензии добавляли свежеперегнанный этилендиамин (0,30 мл,4,56 ммоль) с последующим добавлением через 15 мин раствора 12-(трет-бутилдифенилсилилокси)додец-5-ин-1-ола (4,0 г, 9,16 ммоль) в абсолютном EtOH (10 мл). Через 1 ч реакционную смесь гасили при помощи Et2O (20 мл) и пропускали через небольшой слой силикагеля. Слой промывали еще одной порцией Et2O (5 мл). Объединенные эфирные фильтраты концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,85 г, 96%) в виде бесцветного масла, достаточно чистого для использования непосредственно на следующей стадии. ТСХ: EtOAc/гексан (3:7), Rf0,46. 1H ЯМР 1-трет-Бутилдифенилсилилокси-12-азидододец-7(Z)-ен Диизопропилазодикарбоксилат (DIAD; 1,46 мл, 7,35 ммоль) добавляли по каплям к охлажденному до -20 С раствору PPh3 (2,10 г, 8,0 ммоль) в безводном THF (45 мл) в атмосфере аргона. Через 10 мин добавляли по каплям раствор 12-(трет-бутилдифенилсилилокси)додец-5(Z)-ен-1-ола (3,20 г, 7,35 ммоль) с предыдущей стадии в безводном THF (10 мл). Через 30 мин смесь нагревали до 0 С и добавляли по каплям дифенилфосфорилазид (1,58 мл, 7,35 ммоль). После перемешивания в течение 4 ч при комнатной температуре реакционную смесь гасили водой (150 мл) и экстрагировали при помощи EtOAc (2100 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (100 мл), сушили(Na2SO4) и концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на SiO2, элюируя смесью 4% EtOAc/гексан, с получением указанного в заголовке соединения 1-трет-Бутилдифенилсилилокси-12-аминододец-7(Z)-ен Трифенилфосфин (1,18 г, 4,50 ммоль) добавляли к перемешиваемому раствору азид 1-третбутилдифенилсилилокси-12-азидододец-7(2)-ена (1,90 г, 4,10 ммоль) в THF (12 мл), содержащему 4 капли деионизированной воды. Через 12 ч реакционную смесь разбавляли при помощи CH2Cl2 (10 мл), сушили и концентрировали в вакууме с получением указанного в заголовке соединения (1,36 г, 76%) в виде густого бесцветного масла, которое использовали непосредственно в следующей реакции без дополнительной очистки. ТСХ: MeOH/CH2Cl2 (1:4), Rf0,25; 1H ЯМР (400 МГц)7,62-7,68 (м, 4 Н), 7,32-7,40 (м,6 Н), 5,30-5,40 (м, 2 Н), 3,63 (т, J=5,2 Гц, 2 Н), 2,62 (т, J=4,8 Гц, 2 Н), 1,92-2,06 (м, 4 Н), 1,40-1,58 (м, 4 Н),1,20-1,40 (м, 8 Н), 1,03 (с, 9 Н); 13 С ЯМР (100 МГц)135,79, 134,37, 130,42, 129,70, 127,78, 64,19, 42,28,33,44, 32,77, 29,93, 29,28, 27,40, 27,21, 27,10, 25,92, 19,44. HRMS вычислено для C28H44NOSi [M+1]+ 438,3192, обнаружено 438,3186. 1-(12-(трет-Бутилдифенилсилилокси)додец-5(Z)-енил)-3-н-пентилмочевина Раствор 1-трет-бутилдифенилсилилокси-12-аминододец-7(Z)-ена (1,32 г, 3,0 ммоль) в THF (5 мл) добавляли по каплям к перемешиваемому раствору н-пентилизоцианата (0,386 мл, 3,0 ммоль) в THF (10 мл). После 3 ч перемешивания при комнатной температуре все летучие вещества удаляли при пониженном давлении и остаток очищали при помощи колоночной хроматографии на SiO2, элюируя смесью 20% 1-(12-Гидроксидодец-5(Z)-енил)-3-н-пентилмочевина Смесь 1-(12-(трет-бутилдифенилсилилокси)додец-5(Z)-енил)-3-н-пентилмочевины (1,12 г, 2,0 ммоль) и тетра-н-бутиламмонийфторида (2,20 мл, 1 М раствор в THF, 2,2 ммоль) в безводном THF (10 мл) перемешивали при комнатной температуре в атмосфере аргона в течение 12 ч и затем упаривали досуха в вакууме. Остаток растворяли в EtOAc (50 мл) и промывали водой (30 мл), насыщенным солевым раствором (30 мл), сушили и упаривали в вакууме. Очистка остатка при помощи колоночной хроматографии на SiO2 давала указанное в заголовке соединение (0,56 г, 89%) в виде бесцветного твердого вещества, т.пл. 63,7-63,8 С. ТСХ: EtOAc/гексан (7:3), Rf0,30; 1H ЯМР (300 МГц)5,25-5,42 (м, 2 Н), 4,40-4,56CBr4 (0,55 г, 1,66 ммоль) и PPh3 (0,43 г, 1,66 ммоль) добавляли к охлажденному до 0 С раствору 1(12-гидроксидодец-5(Z)-енил)-3-н-пентилмочевины (0,43 г, 1,38 ммоль) в CH2Cl2 (20 мл). Через 2 ч при комнатной температуре реакционную смесь концентрировали в вакууме и остаток очищали при помощи колоночной хроматографии на SiO2 с получением 1-(12-бромдодец-5(Z)-енил)-3-н-пентилмочевины (0,43 г, 83%) в виде вязкого масла, т.пл. 46,7-46,8 С. ТСХ: EtOAc/гексан (2:3), Rf0,60; 1H ЯМР (300 МГц) 1-(12-Цианододец-5(Z)-енил)-3-н-пентилмочевина Смесь цианида калия (0,23 г, 3,54 ммоль) и 1-(12-бромдодец-5(Z)-енил)-3-н-пентилмочевины (0,90 г, 2,40 ммоль) перемешивали в DMSO (5 мл) при комнатной температуре. Через 12 ч реакционную смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (250 мл). Объединенные органические экстракты промывали водой (225 мл), насыщенным солевым раствором (25 мл), сушили (Na2SO4) и пропускали через колонку с силикагелем с получением указанного в заголовке соединения (0,62 г, 81%) в виде бесцветного твердого вещества, т.пл. 56-57 С. ТСХ: EtOAc/гексан (2:3), Rf0,45. 1 Н ЯМР (300 МГц)5,29-5,40 (м, 2 Н), 4,27 (шир. с, -NH, 2H), 3,10-3,20 (м, 4 Н), 2,34 (т, J=7,0 Гц, 2 Н), 1,98-2,08 (м, 4 Н) 1,241,70 (м, 18 Н), 0,89 (т, J=7,0 Гц, 3 Н); 13 С ЯМР (125 МГц)159,41, 129,94, 129,86, 120,14, 40,45, 40,35,30,30, 29,50, 29,33, 28,70, 28,51, 27,26, 27,16, 25,47, 22,66, 17,28, 14,24. IR (беспримесный) 2930, 2281,2184, 2042, 1936, 1613, 1197, 1042 см-1. HRMS вычислено для C19H36N3O [M+1]+ 322,2858, обнаружено 322,2867.N'-Гидрокси-13-(3-н-пентилуреидо)тридец-8(Z)-енимидамид К суспензии 1-(12-цианододец-5(Z)-енил)-3-н-пентилмочевины (350 мг, 1,09 ммоль) в смеси МеОН/Н 2 О (4:1; 12 мл) добавляли H2NOHHCl (228 мг, 3,28 ммоль) и Na2CO3 (344 мг, 3,25 ммоль). Реакционную смесь нагревали при 60 С в течение 18 ч, затем охлаждали до комнатной температуры и все летучие вещества удаляли в вакууме. Остаток разбавляли водой (30 мл) и экстрагировали в этилацетат (225 мл). Объединенные органические экстракты промывали водой (210 мл), насыщенным солевым раствором (10 мл), сушили и очищали при помощи колоночной флэш-хроматографии на силикагеле с использованием 5% MeOH/CH2Cl2 с получением указанного в заголовке соединения (239 мг, 62%) в виде бесцветного твердого вещества, т.пл. 94,6-94,7 С. ТСХ: MeOH/CH2Cl2 (1:4), Rf0,20; 1H ЯМР (CD3OD, 300 МГц)5,34-5,42 (м, 2 Н), 3,33 (с, 2 Н), 3,08-3,16 (м, 3 Н), 2,02-2,10 (м, 6 Н), 1,52-1,60 (м, 2 Н), 1,44-1,52 (м,5 Н), 1,30-1,44 (м, 10 Н), 0,92 (т, J=7,2 Гц, 3 Н); 13 С ЯМР (CD3OD, 125 МГц)160,14, 155,23, 129,95, 129,42,39,86, 39,76, 30,70, 29,95, 29,89, 29,59, 29,06, 28,91, 27,18, 26,97, 26,95, 26,78, 22,39, 13,34. HRMS вычислено для C19H39N4O2 [M+1]+ 355,3073, обнаружено 355,3078. Аналог 25 К охлажденному льдом раствору N'-гидрокси-13-(3-н-пентилуреидо)тридец-8(Z)-енимидамида (100 мг, 0,28 ммоль) и пиридина (45 мкл, 0,56 ммоль) в THF (100 мл) добавляли по каплям раствор тионилхлорида (20 мкл, 0,28 ммоль) в CH2Cl2 (2 мл). Через 1 ч реакционную смесь концентрировали в вакууме,разбавляли водой (25 мл) и экстрагировали при помощи CH2Cl2 (210 мл). Объединенные органические экстракты промывали водой и сушили. Растворитель выпаривали в вакууме и остаток очищали при помощи колоночной хроматографии на SiO2 с использованием 10% MeOH/CH2Cl2 с получением соединения 25 (80 мг, 72%) в виде липкого твердого вещества. ТСХ: MeOH/CH2Cl2 (1:9), Rf0,60; 1H ЯМР(1:3,8 мл) при интенсивном перемешивании в закрытой пробирке. Через 18 ч смесь охлаждали до комнатной температуры и рН доводили до 1 с использованием водного раствора HCl (3 н, 4 мл). Добавляли этилацетат (10 мл) и перемешивание продолжали до тех пор, пока твердое вещество не растворилось. Органический слой отделяли и водный слой экстрагировали при помощи EtOAc (225 мл). Объединенные органические фракции промывали водой (325 мл), сушили и концентрировали в вакууме. Остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с получением аналога 20 (431 мг,76%) в виде бесцветного твердого вещества, т.пл. 205,6-205,8 С. ТСХ: 10% MeOH/CH2Cl2, Rf0,30; 1H ЯМР (CD3OD, 300 МГц)5,40-5,30 (м, 2 Н), 3,06-3,11 (м, 4 Н), 2,93 (т, J=8,0 Гц, 2 Н), 1,98-2,10 (м, 4 Н),1,70-1,82 (м, 2 Н), 1,24-1,50 (м, 16 Н), 0,90 (т, J=7,6 Гц, 3 Н); 13 С ЯМР (CD3OD, 75 МГц)160,16, 156,81,129,77, 129,47, 39,81, 39,68, 29,88, 29,80, 29,35, 28,99, 28,69, 28,55, 27,48, 26,85, 26,81, 26,68, 22,96, 22,31,13,22. HRMS вычислено для C19H37N6O [M+1]+ 365,3029, обнаружено 365,3030. Синтез аналога 29 Аналог 29 Смесь N'-гидрокси-13-(3-н-пентилуреидо)тридец-8(Z)-енимидамида (150 мг, 0,42 ммоль) и 1,1'тиокарбонилдиимидазола (90%; 91 мг, 0,51 ммоль) в THF (5 мл) перемешивали при комнатной температуре. Через 45 мин смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (35 мл). Объединенные экстракты промывали водой, сушили и концентрировали в вакууме. Остаток растворяли в безводномTHF (5 мл) и добавляли диэтилэфират трифторида бора (103 мкл, 0,84 ммоль). Еще через 1 ч реакционную смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (210 мл). Объединенные экстракты промывали водой, сушили (Na2SO4) и растворитель выпаривали в вакууме. Остаток очищали при помощи колоночной хроматографии с получением аналога 29 (104 мг, 63%) в виде бесцветного твердого вещества, т.пл. 124,2-125, 1 С. ТСХ: MeOH/CH2Cl2 (1:9), Rf0,60; 1H ЯМР (CD3OD, 300 МГц)5,30-5,40 Аналог 28 Смесь N'-гидрокси-13-(3-н-пентилуреидо)тридец-8(Z)-енимидамида (150 мг, 0,42 ммоль) и 1,1'тиокарбонилдиимидазола (90%; 91 мг, 0,51 ммоль) в THF (5 мл) перемешивали при комнатной температуре в течение 45 мин. Смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (310 мл). Объединенные органические экстракты промывали водой, сушили и растворитель выпаривали в вакууме. Остаток растворяли в ацетонитриле (5 мл), затем добавляли DBU (147 мг, 0,96 ммоль). После перемешивания при комнатной температуре в течение 1 ч смесь разбавляли водой 10 мл, доводили до рН 4 при помощи 1 н раствора HCl и экстрагировали этилацетатом (310 мл). Объединенные экстракты промывали водой, сушили над Na2SO4 и растворитель выпаривали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле с получением аналога 28 (101 мг, 61%) в виде бесцветного сиропа. ТСХ: MeOH/CH2Cl2 (1:9), Rf0,55; 1H ЯМР (CD3OD, 300 МГц)5,30-5,40 (м, 2H), 3,04-3,14 (м, 4H), 2,62(352 мг, 2,8 ммоль) и циклогексена (649 мг, 7,9 ммоль) в этаноле (5 мл) кипятили с обратным холодильником в течение ночи. Летучие вещества удаляли при пониженном давлении и остаток растворяли в деионизированной воде. Добавляли биогранулы BioRad SM-2 (5 г; предварительно промытые при помощи 0,1 н раствором NH4OH и H2O), осторожно перемешивали в течение 30 мин и затем собирали на воронке из спеченного стекла. Гранулы промывали деионизированной водой (210 мл) и затем EtOH (310 мл). Концентрирование этанольных промывок давало аналог 11 (235 мг, 75%) в виде бесцветного твердого вещества, т.пл. 133,6-133,8 С. 1H ЯМР (CD3OD, 300 МГц)5,30-5,40 (м, 2 Н), 3,02-3,14 (м, 4 Н), 2,78 (т,J=8,0 Гц, 2 Н), 1,98-2,12 (м, 4 Н), 1,72-1,84 (м, 2 Н), 1,22-1,50 (м, 16H), 0,91 (т, J=7,0 Гц, 3 Н); 13 С ЯМР(10 мл) в THF (10 мл) нагревали при кипячении с обратным холодильником. Затем в течение 48 ч все летучие вещества удаляли в вакууме и остаток очищали при помощи колоночной хроматографии на силикагеле с использованием 60% EtOAc/CH2Cl2 с получением диметил (12-(3-н-пентилуреидо)додец-7(Z)ен-1-ил)фосфоната (160 мг, 59%) в виде вязкого масла. ТСХ: EtOAc, Rf0,55; 1 Н ЯМР (400 МГц)5,305,40 (м, 2 Н), 5,10 (шир. с, -NH, 1H), 5,02 (шир. с, -NH, 1 Н), 3,70 (с, 3 Н), 3,68 (с, 3 Н), 3,06-3,14 (м, 4 Н),1,97-2,20 (м, 4 Н), 1,63-1,78 (м, 2 Н), 1,20-1,60 (м, 18 Н), 0,88 (т, J=7,2 Гц, 3 Н); 13 С ЯМР (100 МГц)159,11,130,17, 129,93, 52,59, 52,56, 40,49, 30,49, 30,32, 30,28, 29,34, 29,33, 28,58, 27,21, 27,15, 27,11, 25,32, 23,93,22,66, 22,35, 22,30, 14,24. HRMS вычислено для C20H42N2O4P [М+1]+ 405,2882, обнаружено 405,2883. Аналог 10 Триметилсилилбромид (37 мкл) добавляли к раствору описанного указанного выше фосфонатного диэфира (100 мг, 0,25 ммоль) в безводном CHCl3 (4 мл). После выдерживания в течение 2 ч при комнатной температуре раствор концентрировали и остаток суспендировали в этилацетате (5 мл). Полученный осадок собирали и растворяли в деионизированной воде. Добавляли биогранулы BioRad SM-2 (5 г; предварительно промытые при помощи 0,1 н NH4OH и H2O), осторожно перемешивали в течение 1 ч и затем собирали на воронке из спеченного стекла. Гранулы промывали деионизированной водой (210 мл) и затем EtOH (310 мл). Концентрирование этанольных промывок давало динатрийфосфонат 10 (68 мг,65%). 1H ЯМР (CD3OD, 300 МГц)5,30-5,42 (м, 2H), 3,18-3,24 (м, 4H), 1,97-2,20 (м, 4H), 1,50-1,78 (м,8 Н), 1,20-1,60 (м, 12H), 0,92 (т, J=7,2 Гц, 3 Н); 13 С ЯМР (CD3OD, 75 МГц)159,48, 130,10, 129,25, 40,85,40,76, 30,48, 30,25, 29,38, 29,13, 29,06, 28,81, 28,67, 27,62, 26,92, 26,70, 26,64, 25,80, 22,65, 22,58, 22,25,13,02. HRMS вычислено для C18H35N2Na2O4P [M]+ 420,2130, обнаружено 420,2122. Синтез аналога 16(101 мг, 0,99 ммоль) в безводном DMF (5 мл). После перемешивания в течение 10 мин добавляли 1-(12 бромдодец-5(Z)-енил)-3-н-пентилмочевину (250 мг, 0,66 ммоль). После перемешивания в течение ночи реакционную смесь выливали в ледяную воду (100 мл) и полученный осадок собирали при помощи фильтрации и сушили в вакууме. Неочищенное твердое вещество суспендировали в дихлорметане (100 мл), перемешивали в течение 1 ч и фильтровали с получением аналога 16 (222 мг, 85%) в виде бесцветного твердого вещества, т.пл. 76,1-76,2 С. ТСХ: EtOAc, Rf0,30; 1 Н ЯМР (CD3OD, 300 МГц)8,26 (шир. с, 1H), 5,29-5,40 (м, 2H), 3,04-3,14 (м, 6H), 1,98-2,10 (м, 4H), 1,62-1,72 (м, 2H), 1,22-1,50 (м, 16H), 0,90 (т,J=7,2 Гц, 3 Н); 13 С ЯМР (CD3OD, 75 МГц)160,15, 157,16, 146,90, 129,86, 129,44, 39,84, 39,73, 32,10,29,91, 29,84, 29,65, 29,49, 29,02, 28,60, 28,30, 26,88, 26,73, 22,34, 13,28. HRMS вычислено для C20H38N5OS Аналог 17 Молибдат аммония (160 мг, 0,13 ммоль) и пероксид водорода (0,6 мл, 30% водный раствор) объединяли при 0 С и перемешивали в течение 15 мин. Аликвоту полученного ярко-желтого раствора (0,15 мл) добавляли по каплям к перемешиваемому при 0 С раствору сульфида 16 (77 мг, 0,2 ммоль) в этаноле(1,0 мл) с получением светло-желтого осадка. В течение следующих 15 мин аликвоты (0,15 мл) окисляющего раствора добавляли каждые 5 мин. Еще через 10 мин реакционную смесь распределяли между Н 2 О и дихлорметаном (10 мл). Водную фазу экстрагировали дихлорметаном (10 мл) и объединенные органические экстракты промывали насыщенным солевым раствором и сушили (Na2SO4). Остаток очищали при помощи SiO2 флэш-хроматографии (70% EtOAc/гексан) с получением сульфоксида 17 (43 мг, 52%) в виде бесцветного твердого вещества, т.пл. 88,2-88,4 С. ТСХ: MeOH/EtOAc (1:9), Rf0,30; 1H ЯМР Аналог 18 Молибдат аммония (960 мг, 0,77 ммоль) и пероксид водорода (3,6 мл, 30% водный раствор) объединяли при 0 С и перемешивали в течение 15 мин. Аликвоту полученного ярко-желтого раствора (0,45 мл) добавляли по каплям к перемешиваемому при 0 С раствору сульфида 16 (154 мг, 0,39 ммоль) в этаноле (3,6 мл) с получением светло-желтого осадка. В течение следующих 90 мин аликвоты (0,5 мл) окисляющего раствора добавляли каждые 15 мин. Еще через 15 мин реакционную смесь распределяли между Н 2 О и дихлорметаном (10 мл). Водную фазу экстрагировали дихлорметаном (10 мл) и объединенные органические экстракты промывали насыщенным солевым раствором и сушили (Na2SO4). Остаток очищали при помощи SiO2 флэш-хроматографии (70% EtOAc/гексан) с получением сульфона 18 (129 мг, 78%) в виде белого твердого вещества, т.пл. 90,6-90,8 С. ТСХ: MeOH/EtOAc (1:9), Rf0,50; 1H ЯМР (CD3OD, 300 МГц)8,44 (шир. с, 1 Н), 5,25-5,30 (м, 2 Н), 5,02 (шир. с, 1 Н), 4,90 (шир. с, 1 Н), 3,35 (т, J=7,9 Гц, 2 Н), 3,223,10 (м, 4 Н), 1,90-2,60 (м, 4 Н), 1,66-1,80 (м, 2 Н), 1,20-1,54 (м, 16 Н), 0,87 (т, J=7,3 Гц, 3 Н); 13 С ЯМР Аналог 23 К раствору N'-гидрокси-13-(3-н-пентилуреидо)тридец-8(Z)-енимидамида (50 мг, 0,14 ммоль) в безводном диоксане (3 мл) добавляли 1,1-карбонилдиимидазол (CDI; 27 мг, 0,16 ммоль) с последующим добавлением 1,8-диазабициклоундец-7-ена (DBU; 23 мг, 0,15 ммоль). После перемешивания в течение 15 мин реакционную смесь нагревали до 110 С в течение 15 мин, затем охлаждали до комнатной температуры. Реакционную смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (35 мл). Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением аналога 23 (36 мг, 67%) в виде липкого твердого вещества. ТСХ: EtOAc/гексан (4:1), Rf0,40; 1 Н ЯМР (CD3OD, 300 МГц)5,30-5,40 (м, 2 Н), 3,02-3,14 (м, 4 Н), 2,52 (т, J=7,7 Гц, 2 Н), 2,00-2,10 (м, 4 Н),1,60-1,70 (м, 2 Н), 1,24-1,50 (м, 16 Н), 0,90 (т, J=6,7 Гц, 3 Н); 13 С ЯМР (CD3OD, 75 МГц)158,30, 157,33,126,98, 126,68, 37,02, 36,90, 26,97, 26,53, 26,19, 25,76, 25,72, 24,02, 23,89, 22,68, 21,84, 19,52, 10,43; IR 0,44 г, 3,30 ммоль) и [1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид] (0,63 г, 3,30 ммоль) в безводном DMF (5 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили водой (30 мл) и экстрагировали в этилацетат (320 мл). Объединенные органические экстракты промывали водой (210 мл), насыщенным солевым раствором (10 мл), сушили и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением N1-н-бутил-N2(12-(трет-бутилдифенилсилилокси) додец-5(Z)-енил)оксаламида (1,10 г, 73%). ТСХ: EtOAc/гексан (2:3),Rf0,55; 1H ЯМР (400 МГц)8,05 (шир. с, -NH, 2H), 7,66-7,74 (м, 4 Н), 7,32-7,42 (м, 6 Н), 5,30-5,42 (м, 2 Н),3,67 (т, J=3,9 Гц, 2 Н), 3,31 (кв., J=5,2 Гц, 4 Н), 1,96-2,10 (м, 4 Н), 1,50-1,64 (м, 6 Н), 1,22-1,44 (м, 10 Н), 1,06N1-н-Бутил-N2-(12-(трет-бутилдифенилсилилокси)додец-5(Z)-енил)оксаламид (1,20 г, 2,12 ммоль) десилилировали, как описано выше, с получением N1-н-бутил-N2-(12-гидроксидодец-5(Z)-енил)оксаламида (0,568 г, 82%) в виде бесцветного твердого вещества, т.пл. 102,8-102,9 С. ТСХ: EtOAc/гексанN1-н-Бутил-N2-(12-гидроксидодец-5(Z)-енил)оксаламид (330 мг, 1,0 ммоль) бромировали, как описано выше, с получением N1-(12-бромдодец-5(Z)-енил)-N2-н-бутилоксаламида (330 мг, 84%) в виде белого твердого вещества, т.пл. 46,0-46,3 С. ТСХ: EtOAc/гексан (3:2), Rf0,55; 1H ЯМР (400 МГц)7,79N1-(12-бромдодец-5(Z)-енил)-N2-н-бутилоксаламид (250 мг, 0,642 ммоль) обрабатывали, как описано выше, цианидом калия с получением N1-н-бутил-N2-(12-цианододец-5(Z-енил)оксаламида (168 мг,78%) в виде бесцветного твердого вещества, т.пл. 83,0-83,3 С. ТСХ: EtOAc/гексан (3:2), Rf0,35; 1H ЯМРN1-(13-Амино-13-(гидроксиимино)тридец-5(Z)-енил)-N2-н-бутилоксаламид Следуя описанной выше процедуре, смесь N1-н-бутил-N2-(12-цианододец-5(Z)-енил)оксаламида,H2NOHHCl и Na2CO3 преобразовывали в N1-(13-амино-13-(гидроксиимино)тридец-5(Z)-енил)-N2-нбутилоксаламид (102 мг, 62%) в виде бесцветного твердого вещества, 116,3-116,4 С. ТСХ: MeOH/CH2Cl2 Аналог 27 Обработка N1-(13-амино-13-(гидроксиимино)тридец-5(Z)-енил)-N2-н-бутилоксаламида (100 мг, 0,27 ммоль) 1,1'-тиокарбонилдиимидазолом давала аналог 27 (71 мг, 63%) в виде белого твердого вещества,т.пл. 110,6-110,8 С. ТСХ: MeOH/CH2Cl2 (1:9), Rf0,55; 1H ЯМР (400 МГц)8,90 (шир. с, NH, 1H), 7,52 Аналог 21 Следуя процедуре, используемой для получения аналога 22, смесь N1-н-бутил-N2-(12-цианододец 5(Z)-енил)оксаламида (30 мг, 0,10 ммоль), азида натрия (11 мг, 0,20 ммоль) и бромида цинка (40 мг, 0,20 ммоль) нагревали в смеси изопропанол/метанол/H2O (1:1:3, 4 мл) с получением тетразола 21 (25 мг, 74%) в виде бесцветного твердого вещества, т.пл. 113-114 С. ТСХ: 10% MeOH/CH2Cl2, Rf0,26; 1H ЯМР 1-(трет-Бутилдифенилсилилокси-12-йодододец-7(Z)-ен Трифенилфосфин (504 мг, 1,14 ммоль) и имидазол (156 мг, 2,30 ммоль) добавляли к охлажденному до 0 С раствору указанного выше 12-(трет-бутилдифенилсилилокси)додец-5(Z)-ен-11-ола (500 мг, 1,14 ммоль) в безводном THF (25 мл) в атмосфере аргона. Через 10 мин добавляли порциями твердый йод(252 мг, 1,2 эквивалента). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь гасили насыщенным водным раствором бисульфита натрия (10 мл). Еще через 1 ч раствор промывали водой (230 мл) и концентрировали при пониженном давлении. Остаток очищали при помощи колоночной флэш-хроматографии на SiO2 с использованием в качестве элюента 10% EtOAc/гексан с получением указанного в заголовке соединения (474 мг, 76%) в виде бесцветного масла. ТСХ: 20% 1-(трет-Бутилдифенилсилилокси-12-N-изопропиламино-додец-7(Z)-ен Изопропиламин (464 мкл, 5,45 ммоль) и K2CO3 (373 мг, 2,73 ммоль) добавляли последовательно к охлажденному до комнатной температуры раствору 1-(трет-бутилдифенилсилилокси-12-йоддодец-7(Z)ена (500 мг, 0,91 ммоль) в безводном тетрагидрофуране (8 мл). Смесь нагревали в герметично закрытой пробирке при 90 С в течение 12 ч, затем охлаждали до комнатной температуры, разбавляли водой (5 мл),фильтровали и фильтрат экстрагировали этилацетатом (310 мл). Объединенные органические экстракты сушили, концентрировали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на SiO2 с использованием градиента от 2 до 5% MeOH/CH2Cl2 в качестве элюента, с получением указанного в заголовке амина (335 мг, 77%) в виде бесцветного масла. ТСХ: 5% MeOH/CH2Cl2,Rf0,3; 1H ЯМР (300 МГц)7,62-7,70 (м, 4 Н), 7,34-7,44 (м, 6 Н), 5,30-5,40 (м, 2 Н), 3,64 (т, J=6,4 Гц, 2 Н),2,72-2,84 (м, 1 Н), 2,58 (т, J=7,0 Гц, 2 Н), 1,94-2,08 (м, 4 Н), 1,20-1,60 (м, 12 Н), 1,05 (д, J=7,2 Гц, 6 Н), 1,04 (с,9 Н); 13 С ЯМР (75 МГц)135,81, 134,40, 132,0, 129,72, 127,81, 64,21, 48,96, 47,75, 32,80, 30,33, 29,97,- 20023104 29,31, 27,85, 27,44, 27,33, 27,11, 25,95, 23,27, 19,46. HRMS вычислено для C31H50NOSi [M+1]+ 480,3662,обнаружено 480,3666.N-(12-(трет-Бутилдифенилсилилокси)додец-5(Z)-енил)-N-изопропил н-гептанамид Твердый [1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид] (EDCI; 131 мг, 0,69 ммоль) добавляли порциями к охлажденному до комнатной температуры раствору 1-(трет-бутилдифенилсилилокси-12-N-изопропиламино-додец-7(Z)-ена (300 мг, 0,63 ммоль), DMAP (84 мг, 0,69 ммоль), Nгидроксибензотриазола (HOBt; 93 мг, 0,69 ммоль) и н-гептановой кислоты (90 мг, 0,68 ммоль) в безводном DMF (5 мл). Через 12 ч реакционную смесь разбавляли водой (10 мл) и экстрагировали эфиром (35 мл). Объединенные эфирные экстракты промывали насыщенным солевым раствором, сушили и выпаривали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением указанного в заголовке соединения (281 мг, 76%) в виде бесцветного масла. ТСХ: EtOAc/гексан (1:4), Rf0,65; 1N-(12-Гидроксидодец-5(Z)-енил)-N-изопропил н-гептанамид Следуя описанной выше процедуре десилилирования, N-(12-(трет-бутилдифенилсилилокси)додец 5(Z)-енил)-N-изопропил н-гептанамид (275 мг, 0,464 ммоль) преобразовывали в указанный в заголовке спирт (155 мг, 94%) в виде сиропа. ТСХ: 40% EtOAc/гексан, Rf0,45; 1H ЯМР (300 МГц, 45/55 смесь ротамеров)5,30-5,46 (м, 2 Н), 4,62-4,72 и 4,00-4,08 (м, 1 Н для двух ротамеров), 3,63 (т, J=5,4 Гц, 2 Н), 3,063,14 (м, 2 Н), 2,22-2,36 (м, 2 Н), 1,98-2,10 (м, 4 Н), 1,24-1,70 (м, 20 Н), 1,17 и 1,10 (д, J=6,8 Гц, 6 Н для двух ротамеров), 0,88 (т, J=7,2 Гц, 3H); 13 С ЯМР (75 МГц)173,23, 172,67, 130,83, 130,12, 129,71, 128,96,62,69, 62,64, 48,34, 45,56, 43,52, 41,07, 34,0, 33,91, 32,91, 32,88, 31,84, 31,81, 31,18, 29,82, 29,74, 29,46,29,33, 29,11, 27,78, 27,37, 27,35, 27,16, 27,13, 26,84, 25,89, 25,81, 25,66, 22,69, 21,51, 20,65, 14,21. HRMS вычислено для C22H44NO2 [М+1]+ 354,3372, обнаружено 354,3380.N-(12-Бромдодец-5(Z)-енил)-N-изопропил-н-гексанамид Следуя описанной выше процедуре, N-(12-гидроксидодец-5(Z)-енил)-N-изопропил н-гептанамидN-(12-Цианододец-5(Z)-енил)-N-изопропил-н-гексанамид Следуя описанной выше процедуре замещения цианида, N-(12-бромдодец-5(Z)-енил)-N-изопропилн-гексанамид (500 мг, 1,20 ммоль) давал указанный в заголовке нитрил (339 мг, 78%) в виде сиропа. ТСХ: EtOAc/гексан (3:7), Rf0,40; 1H ЯМР (500 МГц, 45/55 отношение ротамеров)5,20-5,34 (м, 2 Н),4,52-4,62 и 3,90-4,02 (м, 1 Н для двух ротамеров), 3,00-3,10 (м, 2 Н), 2,16-2,30 (м, 4 Н), 1,90-2,05 (м, 4 Н),1,60-1,70 (м, 8 Н), 1,22-1,50 (м, 12 Н), 1,18 и 1,11, (д, J=6,8 Гц, 6 Н для двух ротамеров), 0,88 (т, J=7,2 Гц,- 21023104 3 Н); 13 С ЯМР (75 МГц)173,22, 172,66, 130,42, 130,04, 129,78, 129,35, 120,04, 119,99, 48,34, 45,58, 43,54,41,07, 34,02, 33,95, 31,89, 31,86, 31,22, 29,53, 29,49, 29,37, 28,73, 28,70, 28,57, 28,53, 27,78, 27,39, 27,26,27,18, 27,17, 26,91, 25,85, 25,70, 25,52, 25,49, 22,73, 21,56, 20,70, 17,26, 14,27. HRMS вычислено дляN-(13-Амино-13-(гидроксиимино)тридец-5(Z)-енил)-N-изопропил-н-гептанамид Следуя описанной выше процедуре, смесь N-(12-цианододец-5(Z)-енил)-N-изопропил-нгексанамида, H2NOHHCl и Na2CO3 преобразовывали в указанное в заголовке соединение (64%). ТСХ:N-(13-Амино-13-(гидроксиимино)тридец-5(Z)-енил)-N-изопропил-н-гептанамид (150 мг, 0,38 ммоль) обрабатывали тионилхлоридом при 0 С, как описано выше, с получением аналога 26 (133 мг,68%) в виде сиропа. ТСХ: EtOAc/гексан (1:1), Rf0,30; 1H ЯМР (400 МГц, 35/65 отношение ротамеров)5,22-5,40 (м, 2 Н), 4,48-4,70 и 4,00-4,12 (м, 1 Н для двух ротамеров), 3,04-3,20 (м, 2 Н), 2,50 и 2,64 (т, J=6,9 Гц, 2 Н для двух ротамеров), 2,22,2,38 (т, J=8,0 Гц, 2 Н для двух ротамеров), 1,90-2,10 (м, 4 Н), 1,50-1,78 (м,8 Н), 1,20-1,40 (м, 12 Н), 1,22 и 1,12 (д, J=6,7 Гц, 6 Н для двух ротамеров), 0,88 (т, J=7,2 Гц, 3 Н); 13 С ЯМРN-(12-Цианододец-5(Z)-енил)-N-изопропил-н-гексанамид (350 мг, 0,97 ммоль) обрабатывали азидом натрия, как описано выше, с получением тетразола 19 (250 мг, 64%) в виде липкого твердого вещества. ТСХ: EtOAc, Rf0,40; 1H ЯМР (300 МГц, 35/65 отношение ротамеров)5,22-5,40 (м, 2 Н), 4,58-4,68 и 4,02-4,18 (м, 1 Н для двух ротамеров), 3,10-3,24 (м, 2 Н), 2,98 (т, J=7,6 Гц, 2 Н), 2,44 и 2,30 (т, J=7,3 Гц,2 Н для двух ротамеров), 1,94-2,10 (м, 4 Н), 1,72-1,84 (м, 2 Н), 1,50-1,70 (м, 4 Н), 1,18-1,40 (м, 14 Н), 1,21 и 1,10 (д, J=7,2 Гц, 6 Н для двух ротамеров), 0,82-0,87 (м, 3 Н); 13 С ЯМР (75 МГц)174,06, 173,80, 130,85,130,04, 129,79, 129,08, 48,94, 46,32, 43,97, 41,55, 34,11, 34,05, 31,79, 31,72, 31,12, 29,61, 29,61, 29,51, 29,25,29,05, 28,85, 28,22, 27,98, 27,89, 27,32, 27,19, 26,92, 25,97, 23,70, 22,67, 21,51, 20,67, 14,02. HRMS вычислено для C23H44N5O [М+1]+ 406,3546, обнаружено 406,3547. Синтез аналога 22(5,0 г, 27,40 ммоль) подвергали сочетанию с 1-трет-бутилдифенилсилилокси-7-бромгептаном (11,90 г,27,40 ммоль) с получением 1-трет-бутилдифенилсилилокси-13-(тетрагидро-2H-пиран-2-илокси)тридец-8 ина 3 (10,50 г, 72%) в виде бесцветного сиропа, спектральные данные которого соответствовали литературным данным 3. ТСХ: EtOAc/гексан (1:4), Rf0,60; 1H ЯМР (400 МГц)7,64-7,68 (м, 4 Н), 7,34-7,42 (м,6 Н), 4,57 (т, J=4,3 Гц, 1 Н), 3,78-3,86 (м, 2 Н), 3,65 (т, J=6,3 Гц, 2 Н), 3,32-3,54 (м, 2 Н), 2,10-2,22 (м, 4 Н),1,24-1,84 (м, 20 Н), 1,04 (с, 9 Н); 13 С ЯМР (100 МГц)135,80, 134,38, 129,72, 127,81, 99,0, 80,72, 80,10,- 22023104 13-(трет-Бутилдифенилсилилокси)тридец-5-ин-1-ол Следуя процедуре, используемой в синтезе аналога 25, 1-трет-бутилдифенилсилилокси-13-(тетрагидро-2H-пиран-2-илокси)тридец-8-ин (10,0 г, 18,70 ммоль) подвергали реакции удаления защиты с использованием PPTS, с получением 13-(трет-бутилдифенилсилилокси)тридец-5-ин-1-ола (7,70 г, 91%) в виде бесцветного сиропа. ТСХ: EtOAc/гексан (3:7), Rf0,43; 1H ЯМР (300 МГц)7,64-7,68 (м, 4 Н), 7,347,42 (м, 6 Н), 3,62 (т, J=5,6 Гц, 4H), 2,06-2,22 (м, 4 Н), 1,50-1,64 (м, 14 Н), 1,04 (с, 9 Н); 13 С ЯМР (100 МГц)135,82, 134,37, 129,76, 127,85, 80,93, 80,04, 64,21, 62,63, 32,77, 32,09, 29,33, 29,13, 29,10, 27,14, 25,92,25,63, 19,47, 19,0, 18,81. HRMS вычислено для C29H43O2Si [М+1]+ 451,3032, обнаружено 451,3032.(Z)-13-(трет-Бутилдифенилсилилокси)тридец-5-ен-1-ол Следуя процедуре, используемой в синтезе аналога 25, 13-(трет-бутилдифенилсилилокси)тридец-5 ин-1-ол (7,50 г, 16,60 ммоль) подвергали реакции полугидрирования с получением 13-(трет-бутилдифенилсилилокси)тридец-5(Z)-ен-1-ола (6,90 г, 92%) в виде сиропа, спектральные данные которого соответствуют данным, известным из литературы 2, ТСХ: EtOAc/гексан (3:7), Rf0,45; 1 Н ЯМР (400 МГц)7,647,68 (м, 4 Н), 7,42-7,34 (м, 6 Н), 5,28-5,42 (м, 2 Н), 3,68-3,67 (т, J=6,4 Гц, 4 Н), 1,98-2,12 (м, 4 Н), 1,50-1,60 (м,4 Н), 1,40-1,24 (м, 10 Н), 1,04 (с, 9 Н); 13 С ЯМР (100 МГц)135,83, 134,40, 130,61, 129,74, 129,60, 127,83,64,21, 63,08, 32,83, 32,60, 29,94, 29,54, 27,50, 27,18, 27,14, 26,12, 26,01, 19,48. 1-трет-Бутилдифенилсилилокси-13-аминотридец-8(Z)-ен Следуя процедуре, используемой в синтезе аналога 25, 1-трет-бутилдифенилсилилокси-13 азидотридец-8(Z)-ен (3,50 г, 7,32 ммоль) восстанавливали при помощи трифенилфосфина с получением 1-трет-бутилдифенилсилилокси-13-аминотридец-8(Z)-ена (2,44 г, 74%) в виде бесцветного масла. ТСХ: 1-(13-Гидрокситридец-5(Z)-енил)-3-н-пентилмочевина Следуя процедуре, используемой в синтезе аналога 25, 1-(13-(трет-бутилдифенилсилилокси)тридец 5(Z)-енил)-3-н-пентилмочевину (2,30 г, 4,07 ммоль) десилилировали с использованием TBAF с получением 1-(13-гидрокситридец-5(Z)-енил)-3-н-пентилмочевины (1,22 г, 92%) в виде белого твердого вещества, т.пл. 63,1-63,3 С. ТСХ: EtOAc/гексан (7:3), Rf0,55; 1H ЯМР (400 МГц)5,24-5,38 (м, 2 Н), 4,74 (шир. с, -NH, 2H), 3,62 (т, J=5,6 Гц, 2 Н), 3,06-3,18 (м, 4 Н), 1,98-2,06 (м, 4 Н), 1,20-1,60 (м, 20 Н), 0,86 (т, J=7,3 Гц,3 Н); 13 С ЯМР (100 МГц)159,31, 130,38, 129,63, 62,90, 40,51, 40,46, 32,93, 30,30, 30,29, 29,79, 29,41,29,34, 29,23, 27,30, 27,24, 27,15, 25,98, 22,67, 14,25. HRMS вычислено для C19H39N2O2 [М+1]+ 327,3012,обнаружено 327,3011. 1-(13-Бромтридец-5(Z)-енил)-3-н-пентилмочевина Следуя процедуре, используемой в синтезе аналога 25, 1-(13-гидрокситридец-5(Z)-енил)-3-нпентилмочевину (1,20 г, 3,68 ммоль) преобразовывали в 1-(13-бромтридец-5(Z)-енил)-3-н-пентилмочевину (1,17 г, 82%), полученную в виде липкого твердого вещества. ТСХ: EtOAc/гексан (2:3), Rf0,60; 1 1-(13-Цианотридец-5(Z)-енил)-3-н-пентилмочевина 1-(13-Бромтридец-5(Z)-енил)-3-н-пентилмочевину (1,10 г, 2,82 ммоль) подвергали взаимодействию с цианидом калия, как описано выше в синтезе аналога 25, с получением 1-(13-цианотридец-5(Z)-енил)3-н-пентилмочевины (0,69 г, 73%) в виде бесцветного твердого вещества, т.пл. 44,3-44,4 С. ТСХ: 1-(13-(1H-Тетразол-5-ил)тридец-5(Z)-енил)-3-н-пентилмочевина (22) Следуя описанной выше в синтезе аналога 20 процедуре, смесь 1-(13-цианотридец-5(Z)-енил)-3-нпентилмочевины, азида натрия и бромида цинка нагревали при 110 С с получением аналога 22 (66%) в виде бесцветного твердого вещества, т.пл. 86,0-86,2 С. ТСХ: MeOH/CH2Cl2 (1:9), Rf0,30; 1H ЯМР 1-(трет-Бутилдифенилсилилокси)-11-(тетрагидро-2H-пиран-2-илокси)ундец-6-ин Следуя процедуре, используемой в синтезе аналога 25, 2-(гекс-5-инилокси)тетрагидро-2H-пиран 1 обрабатывали при помощи н-BuLi и 1-(трет-бутилдифенилсилилокси-5-бромпентана 4 с получением указанного в заголовке соединения (73%) в виде бесцветной жидкости. ТСХ: EtOAc/гексан (1:4), Rf0,60; 1H ЯМР (400 МГц)7,64-7,68 (м, 4 Н), 7,34-7,42 (м, 6 Н), 4,57 (т, J=4,3 Гц, 1 Н), 3,78-3,86 (м, 2 Н), 3,65 (т,J=6,3 Гц, 2 Н), 3,32-3,54 (м, 2 Н), 2,10-2,22 (м, 4 Н), 1,24-1,84 (м, 16 Н), 1,04 (с, 9 Н); 13 С ЯМР (125 МГц)135,80, 134,32, 129,74, 127,84, 99,01, 80,54, 80,16, 67,30, 64,02, 62,50, 32,34, 30,98, 29,18, 29,12, 27,32,27,10, 26,17, 25,73, 25,32, 19,87, 18,99, 18,86. HRMS вычислено для C31H45O3Si [М+1]+ 493,3138, обнаружено 493,3144. 11-(трет-Бутилдифенилсилилокси)ундец-5-ин-1-ол Следуя процедуре, описанной для получения аналога 25, 1-(трет-бутилдифенилсилилокси)-11(тетрагидро-2H-пиран-2-илокси)ундец-6-ин расщепляли с использованием каталитического количества 1-(трет-Бутилдифенилсилилокси-11-азидоундец-6(Z)-ен Следуя описанному выше протоколу, 11-(трет-бутилдифенилсилилокси)ундец-5(Z)-ен-1-ол (6,0 г,14,24 ммоль) преобразовывали в указанный в заголовке азид (4,60 г, 72%) в виде бесцветной жидкости. ТСХ: EtOAc/гексан (1:9), Rf0,55; 1H ЯМР (300 МГц)7,64-7,68 (м, 4 Н), 7,34-7,42 (м, 6 Н), 5,28-5,42 (м,2 Н), 3,65 (т, J=6,4 Гц, 2 Н), 3,25 (т, J=7,1 Гц, 2 Н), 1,96-2,10 (м, 4 Н), 1,24-1,64 (м, 10 Н), 1,04 (с, 9 Н); 13 С ЯМР (100 МГц)136,63, 135,85, 134,41, 130,83, 129,79, 129,22, 127,88, 64,20, 51,62, 32,77, 29,73, 28,70,27,53, 27,18, 27,05, 26,94, 25,77, 19,52; IR (беспримесный) 2931, 2857, 2094, 1589, 1110 см-1. HRMS вычислено для C27H40N3OSi [M+1]+ 450,2940, обнаружено 450,2941. 1-Амино-11-(трет-бутилдифенилсилилокси)ундец-5(Z)-ен 1-(трет-Бутилдифенилсилилокси-11-азидоундец-6(Z)-ен (4,30 г, 9,57 ммоль) восстанавливали при помощи трифенилфосфина, как описано выше, с получением указанного в заголовке амина (2,96 г, 74%) в виде бесцветного масла. ТСХ: MeOH/CH2Cl2 (1:4), Rf0,25; 1H ЯМР (300 МГц)7,64-7,68 (м, 4 Н), 7,347,42 (м, 6 Н), 5,28-5,42 (м, 2 Н), 3,64 (т, J=6,4 Гц, 2 Н), 2,82 (т, J=4,8 Гц, 2 Н), 1,96-2,10 (м, 4 Н), 1,52-1,64 (м,4 Н), 1,30-1,42 (м, 6 Н), 1,04 (с, 9 Н); 13 С ЯМР (100 МГц)135,82, 134,37, 132,37, 132,27, 130,70, 129,78,129,21, 128,93, 128,81, 127,86, 64,19, 40,88, 32,77, 29,89, 29,73, 27,52, 27,37, 27,17, 27,12, 27,03, 25,76,19,47. HRMS вычислено для C27H42NOSi [M+1]+ 420,3046, обнаружено 420,3050. 1-(11-(2-Гидроксифенилтио)ундец-5(Z)-енил)-3-н-пентилмочевина (13) К раствору 2-меркаптофенола (100 мг, 0,79 ммоль) в DMF (3 мл) добавляли K2CO3 (161 мг, 1,18 ммоль) и 1-(11-бромундец-5(2)-енил)-3-н-пентилмочевину (0,29 г, 0,79 ммоль). После выдерживания в течение 12 ч при комнатной температуре раствор разбавляли водой (10 мл) и экстрагировали этилацетатом (35 мл). Объединенные органические экстракты промывали водой, насыщенным солевым раствором и сушили (Na2SO4). Остаток очищали при помощи колоночной хроматографии на SiO2 с получением аналога 13 (230 мг, 69%) в виде липкого твердого вещества. ТСХ: EtOAc/гексан (1:1), Rf0,32; 1H ЯМР 1-(11-(2-Гидроксифенилсульфонил)ундец-5(Z)-енил)-3-н-пентилмочевина (14) Следуя процедуре, описанной для получения аналога 18, аналог 13 окисляли с получением аналога 14 (60 мг, 75%) в виде бесцветной жидкости. ТСХ: EtOAc/гексан (2:3), Rf0,32; 1H ЯМР (300 МГц)9,08(154 мг, 1,58 ммоль) в безводном DMSO (4 мл) перемешивали при комнатной температуре. Через 24 ч реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (35 мл). Объединенные органические экстракты промывали водой, насыщенным солевым раствором и сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением указанной в заголовке мочевины (116 мг, 65%) в виде бесцветного сиропа. ТСХ: EtOAc/гексан (2:3),Rf0,32; 1H ЯМР (300 МГц)5,28-5,42 (м, 2 Н), 4,42 (шир. с, 2 Н), 3,10-3,20 (м, 4 Н), 2,94 (т, J=7,0 Гц, 2 Н),2,00-2,10 (м, 4 Н), 1,70-1,80 (м, 2 Н), 1,20-1,56 (м, 14 Н), 0,88 (т, J=7,2 Гц, 3 Н); 13 С ЯМР (75 МГц)158,92,130,20, 129,68, 112,84, 40,67, 40,54, 34,23, 30,22, 30,03, 29,31, 29,08, 27,66, 27,19, 27,15, 27,04, 22,66, 14,27. 1-(11-(1H-Тетразол-5-илтио)ундец-5(Z)-енил)-3-пентилмочевина (15) Следуя процедуре, описанной для получения аналога 19, 1-н-пентил-3-(11-тиоцианатоундец-5(Z)енил)мочевину (150 мг, 0,44 ммоль) обрабатывали азидом натрия с получением аналога 15 (104 мг, 62%) в виде липкого твердого вещества. ТСХ: 5% MeOH/CH2Cl2, Rf0,40; 1H ЯМР (300 МГц)5,28-5,42 (м,2 Н), 4,63 (шир. с, 2 Н), 3,30 (т, J=6,7 Гц, 2 Н), 3,17-3,23 (м, 4 Н), 1,95-2,04 (м, 4 Н), 1,44-1,80 (м, 6 Н), 1,24- 26023104 1,42 (м, 10 Н), 0,89 (т, J=7,2 Гц, 3 Н); 13 С ЯМР (CD3OD, 75 МГц)160,17, 155,38, 129,65, 129,58, 39,81,39,69, 32,38, 29,87, 29,79, 29,36, 28,99, 28,96, 27,84, 26,84, 26,72, 26,69, 22,31, 13,21. HRMS (ESI-neg) вычислено для C18H33N6OS [M-1]- 381,2442, обнаружено 381,2348. Синтез аналога 12N-(11-(3-н-Пентилуреидо)ундец-6(Z)-енил)бензолсульфонамид (12) К раствору бензолсульфонамида (50 мг, 0,31 ммоль) в смеси THF/HMPA (4:1; 5 мл) добавляли нбутиллитий (2,5 М раствор в гексане, 125 мкл, 0,31 ммоль) при -78 С в атмосфере аргона. Добавляли по каплям раствор 1-(11-бромундец-5(Z)-енил)-3-н-пентилмочевины (115 мг, 0,32 ммоль) в THF (2 мл). Через 2 ч при той же температуре реакционную смесь гасили насыщенным водным раствором NH4Cl (5 мл). Смесь экстрагировали при помощи EtOAc (35 мл) и объединенные экстракты промывали водой, насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением аналога 12 (44 мг, 32%) в виде бесцветного твердого вещества, т.пл. 73,5-73,6 С. ТСХ: 5% MeOH/CH2Cl2, Rf0,40; 1H ЯМР (300 МГц)7,84-7,90 1-(11-(2,4-Диоксотиазолидин-5-ил)ундец-5(Z)-енил)-3-н-пентилмочевина (24) н-Бутиллитий (1,10 мл, 2,76 ммоль, 2,5 М раствор в гексане) добавляли по каплям к охлажденному до -78 С раствору тиазолидин-2,4-диона (0,16 г, 1,38 ммоль) в смеси безводный THF/HMPA (50 мл, 4:1) в атмосфере аргона. Через 30 мин реакционную смесь нагревали до 0 С в течение 1 ч, поддерживали при этой температуре в течение 2 ч и затем повторно охлаждали до -78 С. После добавления раствора 1-(11 бромундец-5(Z)-енил)-3-н-пентилмочевины (0,50 г, 1,38 ммоль) в THF (15 мл) температуру реакционной смеси медленно повышали до комнатной температуры в течение 3 ч и перемешивали еще в течение 12 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (5 мл), рН доводили до 4 с использованием 1 М раствора щавелевой кислоты и реакционную смесь экстрагировали при помощи EtOAc(3125 мл). Объединенные экстракты промывали водой (2100 мл), насыщенным солевым раствором(100 мл), сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с использованием 5% MeOH/CH2Cl2 с получением аналога 24 (169 мг, 31%) в виде бесцветного твердого вещества, т.пл. 92,8-93 С. ТСХ: 10% MeOH/CH2Cl2, Rf0,20; 1H ЯМР (CD3OD,300 МГц)5,30-5,40 (м, 2 Н), 4,42 (дд, J=3,4, 4,2 Гц, 1 Н), 3,04-3,13 (м, 4 Н), 2,00-2,16 (м, 4 Н), 1,80-1,96 (м,2 Н), 1,24-1,58 (м, 16 Н), 0,91 (т, J=6,7 Гц, 3 Н); 13 С ЯМР (75 МГц)177,09, 172,56, 160,15, 129,68, 129,60,51,89, 39,69, 32,57, 29,90, 29,83, 29,23, 29,02, 28,43, 26,88, 26,73, 26,47, 22,35, 13,27. HRMS вычислено для(S)-Диметил 2-(13-(3-н-пентилуреидо)тридец-8(Z)-енамидо)сукцинат Диметиловый эфир L-аспарагиновой кислоты, гидрохлорид (38 мг, 0,19 ммоль) и HATU (67 мг, 0,18 ммоль) добавляли к перемешиваемому раствору 13-(3-н-пентилуреидо)тридец-8(Z)-еноевой кислоты 2 (50 мг, 0,15 ммоль) в безводном DMF (20 мл) в атмосфере аргона. Через 5 мин добавляли 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (EDCI; 33 мг, 0,17 ммоль) с последующим добавлением диизопропилэтиламина (33 мкл, 0,19 ммоль). Через 12 ч реакционную смесь разбавляли при помощи EtOAc(30 мл), промывали водой (30 мл) и насыщенным солевым раствором (20 мл). Объединенные водные слои повторно экстрагировали при помощи EtOAc (330 мл). Объединенные органические экстракты сушили над Na2SO4, концентрировали при пониженном давлении и остаток очищали при помощи SiO2 колоночной хроматографии с использованием 50% EtOAc/гексан в качестве элюента с получением указанного в заголовке диэфира (60 мг, 84%) в виде вязкого масла. ТСХ: EtOAc/гексан (3:2), Rf0,30; 1HLiOH (2 мл, 2 М водный раствор) добавляли к охлажденному до 0 С раствору указанного выше (S)диметил 2-(13-(3-н-пентилуреидо)тридец-8(Z)-енамидо)сукцината (60 мг, 0,12 ммоль) в THF (25 мл) и деионизированной H2O (4 мл). После перемешивания при комнатной температуре в течение ночи реакционную смесь охлаждали до 0 С, рН доводили до 4 при помощи 1 М водного раствора щавелевой кислоты и смесь экстрагировали при помощи EtOAc (315 мл). Объединенные экстракты промывали водой(30 мл), насыщенным солевым раствором (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с использованием 25% 2-(2-(2-Гидроксиэтокси)этокси)этил 13-(2-(н-бутиламино)-2-оксоацетамидо)тридец-8(Z)-еноат (3) Триэтиленгликоль (0,12 г, 0,8 ммоль; высушенный на молекулярных ситах) добавляли к раствору 13-(2-(н-бутиламино)-2-оксоацетамидо)тридец-8(Z)-еноевой кислоты 2 (30 мг, 0,08 ммоль) и N,Nдиметиламинопиридина (DMAP, 11 мг, 0,09 ммоль) в безводном дихлорметане (10 мл) в атмосфере аргона при комнатной температуре. Через 3 мин добавляли твердый EDCI (18 мг, 0,09 ммоль). Через 12 ч реакционную смесь разбавляли при помощи EtOAc (10 мл), промывали водой (5 мл) и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с использованием EtOAc с получением аналога 3 (33 мг, 82%) в виде бесцветного твердого вещества, т.пл. 71,7-71,9 С. ТСХ: 2-(2-(2-Гидроксиэтокси)этокси)этил-13-(3-н-пентилуреидо)тридец-8(Z)-еноат (2) 13-(3-н-Пентилуреидо)тридец-8(Z)-еноевую кислоту 2 (80 мг, 0,20 ммоль) конденсировали с триэтиленгликолем, как описано выше, с получением аналога 2 (86 мг, 78%) в виде бесцветного твердого вещества, т.пл. 42,4-42,6 С. ТСХ: EtOAc, Rf0,20; 1H ЯМР (300 МГц)5,24-5,40 (м, 2 Н), 4,28 (шир. с, 2 Н),4,23 (дд, J=4,9, 1,0 Гц, 2 Н), 3,58-3,68 (м, 10 Н), 3,10-3,20 (м, 4 Н), 2,52 (шир. с, -ОН, 1 Н), 2,33 (т, J=7,6 Гц,2 Н), 1,90-2,10 (м, 4 Н), 1,44-1,64 (м, 4 Н), 1,22-1,40 (м, 14), 0,88 (т, J=7,3 Гц, 3 Н); 13 С ЯМР (75 МГц)174,22, 158,50, 130,41, 129,62, 72,76, 70,75, 70,51, 69,38, 63,47, 61,94, 40,78, 40,71, 34,33, 30,13, 30,08,29,57, 29,25, 29,09, 28,94, 27,23, 27,15, 27,06, 25,03, 22,61, 14,24. HRMS вычислено для C25H49N2O6 [М+1]+ 473,3591, обнаружено 473,3588. Синтез аналога 1N-Гидроксисукцинимидил 13-(3-н-пентилуреидо)тридец-8(Z)-еноат Смесь 13-(3-н-пентилуреидо)тридец-8(Z)-еноевой кислоты 2 (100 мг, 0,29 ммоль) и N-гидроксисукцинимида (37 мг, 0,31 ммоль) подвергали азеотропной сушке с использованием безводного бензола(25 мл), затем растворяли в безводном CH2Cl2 (5 мл). К этой смеси добавляли EDCI (67 мг, 0,35 ммоль) и DMAP (38 мг, 0,31 ммоль) в атмосфере аргона. После выдерживания в течение 12 ч при комнатной температуре реакционную смесь разбавляли при помощи дополнительного количества CH2Cl2 (20 мл),промывали водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на SiO2 с получением указанного в заголовкеNHS эфира (110 мг, 86%) в виде липкого твердого вещества, которое использовали сразу же без дополнительной очистки. ТСХ: EtOAc/гексан (7:3), Rf0,40; 1H ЯМР (400 МГц)5,27-5,36 (м, 2H), 4,48 (шир. с, 2H), 3,09-3,15 (м, 4 Н), 2,81 (шир. с, 4H), 2,58 (т, J=7,8 Гц, 2 Н), 1,94-2,06 (м, 4 Н), 1,68-1,74 (м, 2H), 1,201,50 (м, 16 Н), 0,86 (т, J=7,2 Гц, 3 Н); 13 С ЯМР (100 МГц)169,40, 168,96, 158,62, 130,29, 129,71, 40,75,40,68, 31,12, 30,18, 30,14, 29,51, 29,28, 28,80, 27,21, 27,19, 27,10, 25,81, 24,72, 22,62, 14,24. 13-(3-н-Пентилуреидо)-N-(фенилсульфонил)тридец-8(Z)-енамид (8) Смесь N-гидроксисукцинимидил 13-(3-н-пентилуреидо)тридец-8(Z)-еноата (150 мг, 0,34 ммоль) с предыдущей стадии, бензолсульфонамида (78 мг, 0,49 ммоль) и 4-диметиламинопиридина (DMAP; 50 мг,0,40 ммоль) нагревали в безводном гексаметилфосфорамиде (НМРА; 3 мл) при 80 С в течение 24 ч. После охлаждения до комнатной температуры реакционную смесь разбавляли водой и экстрагировали вEtOAc (310 мл). Объединенные экстракты промывали водой, насыщенным солевым раствором, сушили(Na2SO4) и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии наSiO2 с получением аналога 8 (105 мг, 65%) в виде бесцветного твердого вещества, т.пл. 91,4-91,6 С. ТСХ:N-Гидроксисукцинимидил 13-(3-н-пентилуреидо)тридец-8(Z)-еноат с предыдущей стадии (150 мг,0,34 ммоль) подвергали взаимодействию с метансульфонамидом (48 мг, 0,50 ммоль), как описано выше,с получением аналога 8 (102 мг, 72%) в виде бесцветного твердого вещества, т.пл. 113,5-113,6 С. ТСХ:
МПК / Метки
МПК: A61P 9/12, A61K 31/17, A61K 31/16, C07C 275/20, C07C 233/46, C07C 233/56
Метки: аналоги, кислоты, эпоксиэйкозатриеновой, получения, способы, использования
Код ссылки
<a href="https://eas.patents.su/30-23104-analogi-epoksiejjkozatrienovojj-kisloty-i-sposoby-ih-polucheniya-i-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги эпоксиэйкозатриеновой кислоты и способы их получения и использования</a>
Предыдущий патент: Замещенный натрий -1н-пиразол-5-олат
Следующий патент: Способ оценки кинетики образования наноразмерных пленок и их оптических характеристик
Случайный патент: Фумарат 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрила












