Производные 4-аминопиримидина как антагонисты аденозинового рецептора а2a
Номер патента: 21565
Опубликовано: 30.07.2015
Авторы: Камачо Гомез Джуан Альберто, Кастро-Паломино Лариа Джулио Кесар
Формула / Реферат
1. Соединение формулы (I)
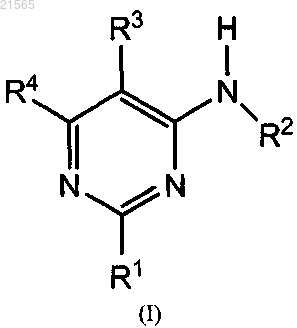
где R1 представляет пятичленное гетероарильное кольцо, выбранное из пиразолового, тиазольного или триазольного колец, необязательно замещенное одним или двумя атомами галогена или одним или двумя алкилом (1-8 атомов углерода), алкокси (1-8 атомов углерода) или циано;
R2 представляет атом водорода;
R3 представляет независимо:
a) атом галогена,
b) цианогруппу;
R4 представляет независимо:
a) пятичленную гетероарильную группу, содержащую по крайней мере один гетероатом, выбранный из О, S и N, необязательно замещенный одним или более атомами галогена или одной или более группами алкильной (1-8 атомов углерода), алкокси (1-8 атомов углерода), алкилтио (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),
b) группу -N(R5)(R6), в которой R5 и R6 представляют независимо
атом водорода,
алкильную или циклоалкильную группу из 3-6 атомов углерода, прямую или разветвленную, необязательно замещенную одним или более атомами галогена или одной или более группами гидрокси, алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),
или R5 и R6 образуют вместе с атомом азота, к которому они присоединены, насыщенную гетероциклическую группу из 4-6 членов, в которой дополнительный гетероатом, выбранный из N и О, может быть вставлен, который необязательно замещен одним или более атомами галогена или одной или более алкильными группами (1-8 атомов углерода), гидрокси, алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода), или
c) группу -OR7 или -SR7, где R7 представляет независимо
алкильную группу (1-8 атомов углерода), прямую или разветвленную, необязательно замещенную одним или более атомами галогена или одной или более группами алкильной (1-8 атомов углерода), алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),
фенильное кольцо, необязательно замещенное одним или более атомом галогена или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R3 представляет атом брома, атом хлора или цианогруппу.
3. Соединение по п.1, где R3 представляет атом брома или атом хлора.
4. Соединение по п.2, где R4 представляет группу -N(R5)(R6), как определено в п.1.
5. Соединение по п.2, где R4 представляет пиразоловое кольцо, присоединенное к пиримидиновому кольцу через атомы азота пиразолового кольца, при этом указанное пиразоловое кольцо необязательно замещено одним или двумя атомами галогена или одной или двумя метильными группами.
6. Соединение по п.2, где R4 представляет 2-тиазольное кольцо, при этом указанное тиазольное кольцо необязательно замещено одним или двумя атомами галогена или одной или двумя метильными группами.
7. Соединение по п.4, где R5 представляет атом водорода и R6 представляет алкильную группу (1-8 атомов углерода), группу, необязательно замещенную атомами галогена, амино, алкиламино (1-8 атомов углерода).
8. Соединение по п.3, где R1 и R4 представляет независимо пиразоловое или тиазольное кольцо, оба необязательно замещенные одним или двумя атомами галогена или одной или двумя метильными группами.
9. Соединение по п.3, где R1 и R4 представляют пиразоловое кольцо, необязательно замещенное одним или двумя атомами галогена или метильными группами.
10. Соединение по п.3, где R1 представляет пиразоловое или тиазольное кольцо, необязательно замещенное одним или двумя атомами галогена или метильными группами, и R4 представляет группу -N(R5)(R6).
11. Соединение по п.3, где R1 представляет пиразоловое или тиазольное кольцо, необязательно замещенное одним или двумя атомами галогена или метильными группами, и R4 представляет группу SR7 или OR7, где R7 представляет прямую или разветвленную алкильную группу (1-8 атомов углерода), необязательно замещенную атомами фтора.
12. Соединение по п.1, которое является одним из


13. Применение соединения по любому из пп.1-12 для лечения патологических состояний или заболеваний, улучшаемых или облегчаемых с помощью антагонистического воздействия на аденозиновый рецептор A2a.
14. Применение соединения по любому из пп.1-12 для лечения патологического состояния или болезни, где патологическим состоянием или болезнью является ишемия, суправентрикулярная аритмия, мерцательная аритмия, острая почечная недостаточность, реперфузионное повреждение миокарда, болезни, вызванные задержкой жидкости, аллергические реакции, склеродермия, артрит, воспалительное заболевание пищеварительного тракта/кишечника, сахарный диабет, ожирение, болезнь Паркинсона, болезнь Хантингтона, дистонии, дискенезии, застойная сердечная недостаточность, гипертензия, интрадиализная гипотония, деменция, тревожный невроз и глаукома.
15. Применение соединения по пп.1-12 для лечения болезни Альцгеймера.
16. Применение по п.14, где аллергическими реакциями являются реакции, выбранные из группы, состоящей из ринита и крапивницы, дистонией является синдром беспокойных ног и дискенезией является состояние, выбранное из группы, состоящей из дискенезии, вызванной продолжительным употреблением дофамина, или нейролептических препаратов, или нарушением сна.
17. Фармацевтическая композиция для лечения патологических состояний или заболеваний, улучшаемых или облегчаемых с помощью антагонистического воздействия на аденозиновый рецептор A2a, включающая в себя эффективное количество соединения, как определено в любом из пп.1-12, смешанное с фармацевтически приемлемым разбавителем или носителем.
Текст
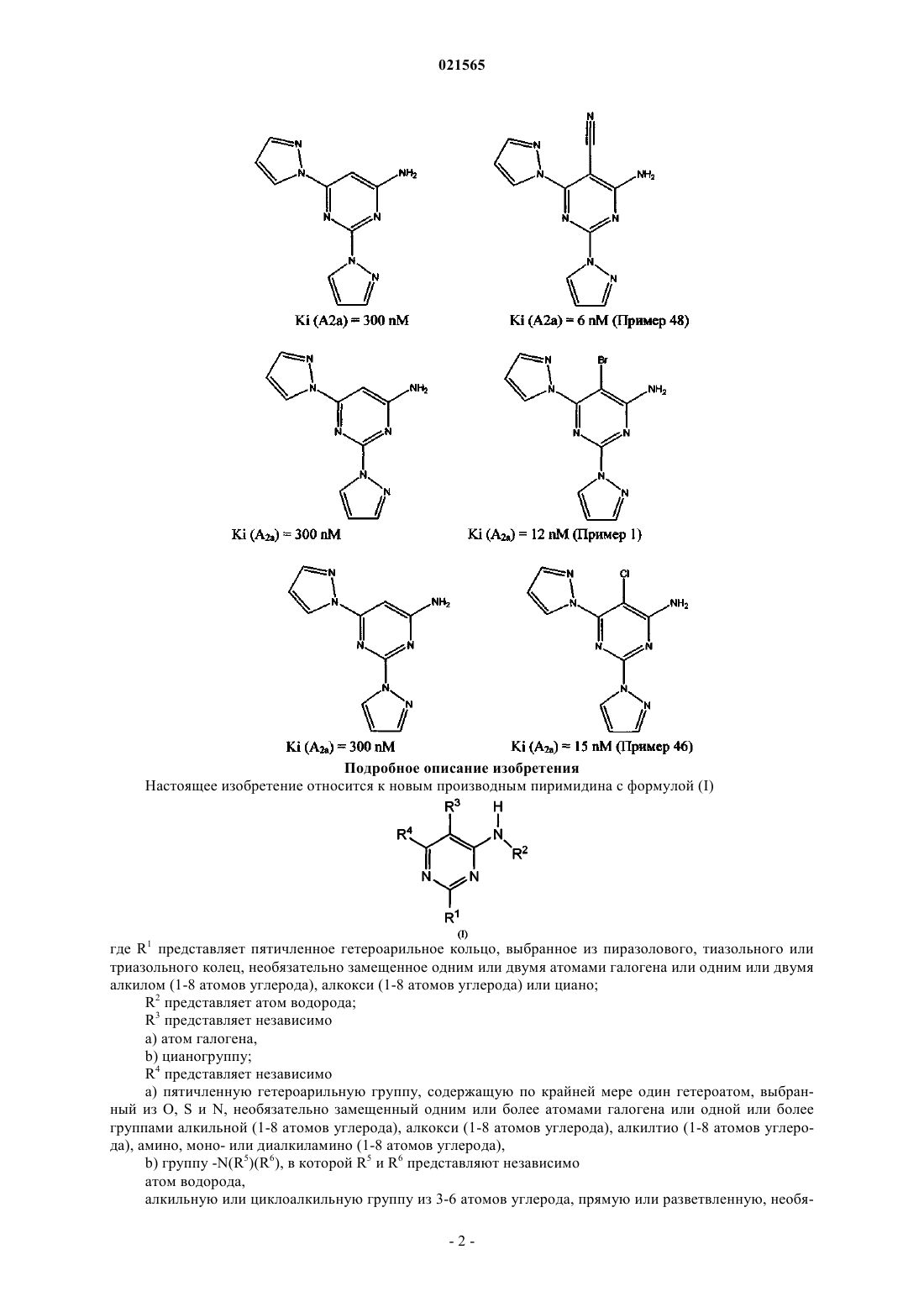
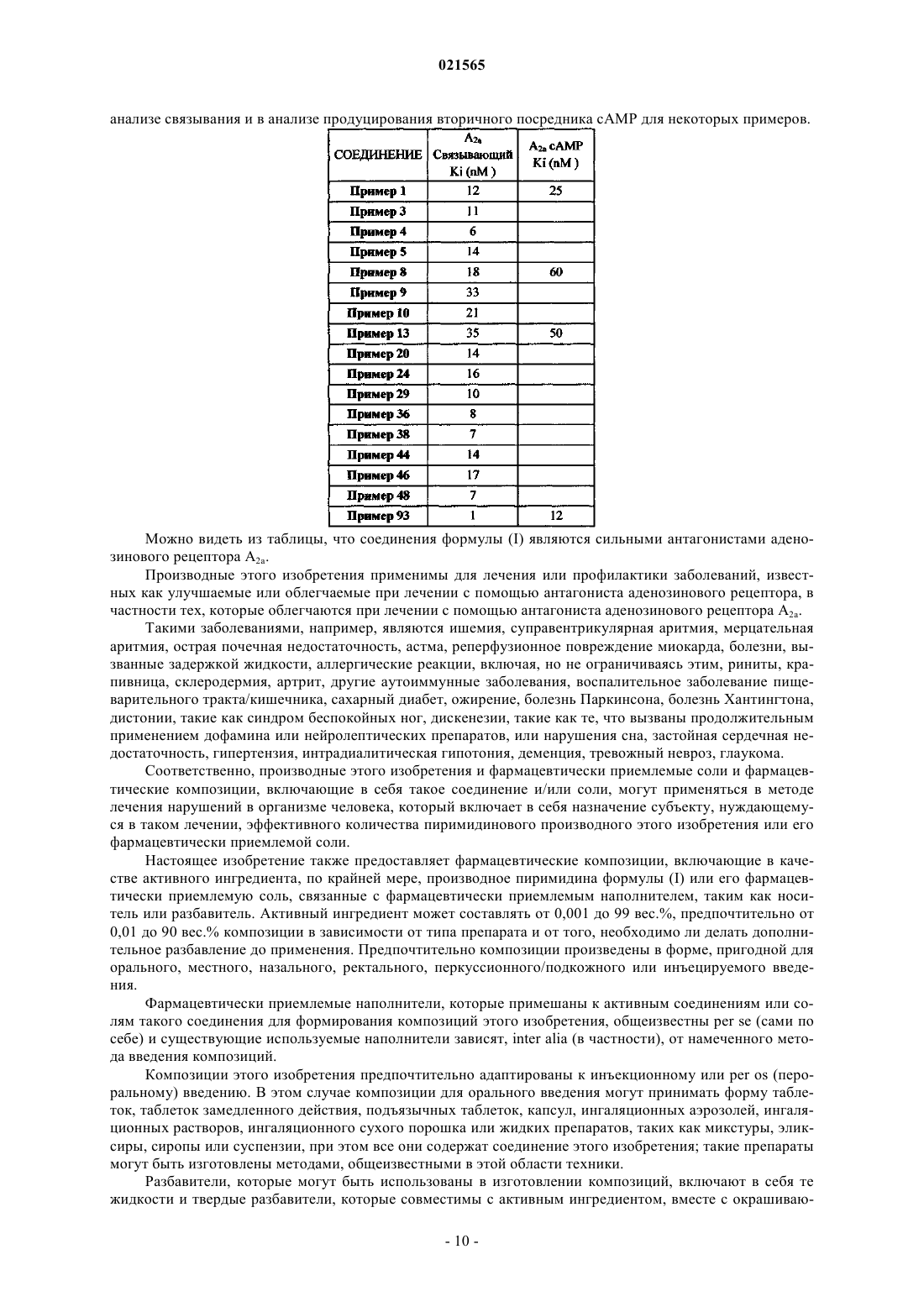
ПРОИЗВОДНЫЕ 4-АМИНОПИРИМИДИНА КАК АНТАГОНИСТЫ АДЕНОЗИНОВОГО РЕЦЕПТОРА А 2a Камачо Гомез Джуан Альберто,Кастро-Паломино Лариа Джулио Кесар (ES) Изобретение предоставляет также фармацевтические композиции, которые включают эффективное количество этих соединений, и применение таких соединений для лечения патологических состояний или заболеваний, улучшаемых или облегчаемых с помощью антагонистического воздействия на аденозиновый рецептор A2a. Область изобретения Настоящее изобретение относится к новым производным пиримидина, легко замещаемым в качестве антагонистов аденозинового рецептора A2a. Другими целями настоящего изобретения является предоставление способа изготовления таких соединений, фармацевтических композиций, содержащих эффективное количество этих соединений, использование соединений при изготовлении медикамента для лечения патологических поражений или болезней, которые могут быть облегчены при помощи антагонизма аденозинового рецептора A2a. Предшествующий уровень техники Результаты воздействия аденозина опосредованы по крайней мере через четыре специфических рецептора клеточной мембраны, которые до настоящего момента идентифицировались и классифицировались как рецепторы А 1, A2A, A2B и A3, принадлежащие семье рецептора, сопряженного с G-белком. Рецепторы A1 и A3 подавляют клеточные уровни сАМР (сАМР) через их сцепление с Gi-белками, которые ингибируют аденилатциклазу. Напротив, рецепторы A2A и A2B сцепляются с Gs-белками, которые активируют аденилатциклазу и увеличивают внутриклеточные уровни сАМР. Через эти рецепторы аденозин регулирует широкий диапазон физиологических функций. Некоторые доклинические исследования демонстрируют полезность антагонистов аденозинового рецептора A2A в лечении нейродегенеративных заболеваний, в основном болезней Паркинсона, Хантингтона или Альцгеймера (Trends in Neurosci. 2006, 29(11), 647-654; Expert Opinion Ther. Patents, 2007, 17,979-991; Exp. Neurol. 2003, 184(1), 285-284; Prog. Brain Res, 2010, 183, 183-208; J. Alzheimer Dus. 2010,Suppl. 1, 117-126; J. Neurosci. 2009, 29(47), 14741-14751; Neuroscience, 2010, 166(2), 590-603; J. Pharmacol.Exp. Ther. 2009, 330(1), 294-303; Frontiers Biosci. 2008, 13, 2614-2632). Кроме благоприятного применения антагонистов рецептора A2A в лечении нейро-дегенеративных заболеваний эти соединения рассматривались для дополнительных симптоматических показаний. Они основаны на доказательствах, подтверждающих, что активация рецептора A2A может внести свой вклад в патофизиологию ряда нервно-психических нарушений и дисфункций, таких как депрессия,чрезмерная сонливость в дневное время, синдром беспокойных ног, нарушение, связанное с дефицитом внимания при гиперфункции, и когнитивная усталость (Neurology, 2003, 61 (11 Suppl 6), S82-S87; Behav.Pharmacol. 2009, 20(2), 134-145; CNS Drug Duscov. 2007, 2(1), 1-21). Некоторые авторы предлагают использовать антагонисты A2 для лечения диабетов (WO 1999035147; WO 2001002400). Другие исследования предлагают привлечь аденозиновые рецепторы A2a для исцеления ран или фибрилляции предсердий (мерцательной аритмии) (Am. J. Path., 2007, 6, 1774-1778; ArthritisRheumatism, 2006, 54(8), 2632-2642). По этой причине наблюдается повышенный интерес в открытии новых сильнодействующих и избирательных антагонистов аденозина A2a. Некоторые из сильнодействующих антагонистов аденозина A2a,открытых в прошлом фармацевтическими компаниями, успешно внедрены в клинические испытания,показывающие положительные результаты и демонстрирующие потенциал соединения этого класса для лечения нейро-дегенеративных нарушений, таких как болезни Паркинсона, Хантингтона или Альцгеймера, а также других болезней, относящихся к CNS (ЦНС), таких как депрессия, синдром беспокойных ног, нарушения сна и страхи (Clin. Neuropharmacol. 2010, 33, 55-60; J. Neurosci. 2010, 30(48), 1628416292; Parkinsonisn Relat. Dusord. 2010, 16(6), 423-426; 1 Expert Opinion Ther. Patents, 2010, 20(8), 9871005; Current Opinion in Drug DiscoveryDevelopment, 2010, 13(4), 466-480 и ссылки в этом; Mov. Disorders, 2010, 25(2), S305). Настоящее изобретение относится к новым производным 4-аминопиримидина в качестве сильнодействующих антагонистов аденозинового рецептора A2a. В литературе имеются доклады, показывающие, что 4-аминопиримидины с формулой где R1 и R3 могут быть гетероарильными группами и R2 может быть атомом водорода или замещенной алкильной цепью, являются сильнодействующими антагонистами аденозинового рецептора A2a (например, WO 2005058883 A1; WO 2008116185). Однако к нашему удивлению мы обнаружили, что путем введения электроноакцепторного заместителя в позиции 5 пиримидинового кольца активность соединений в качестве антагонистов аденозина A2a может быть существенно повышена по сравнению с исходными незамещенными производными, как это проиллюстрировано следующими примерами: Подробное описание изобретения Настоящее изобретение относится к новым производным пиримидина с формулой (I) где R1 представляет пятичленное гетероарильное кольцо, выбранное из пиразолового, тиазольного или триазольного колец, необязательно замещенное одним или двумя атомами галогена или одним или двумя алкилом (1-8 атомов углерода), алкокси (1-8 атомов углерода) или циано;R4 представляет независимо а) пятичленную гетероарильную группу, содержащую по крайней мере один гетероатом, выбранный из О, S и N, необязательно замещенный одним или более атомами галогена или одной или более группами алкильной (1-8 атомов углерода), алкокси (1-8 атомов углерода), алкилтио (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),b) группу -N(R5)(R6), в которой R5 и R6 представляют независимо атом водорода,алкильную или циклоалкильную группу из 3-6 атомов углерода, прямую или разветвленную, необя-2 021565 зательно замещенную одним или более атомами галогена или одной или более группами гидрокси, алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),или R5 и R6 образуют вместе с атомом азота, к которому они присоединены, насыщенную гетероциклическую группу из 4-6 членов, в которой дополнительный гетероатом, выбранный из N и О, может быть вставлен, который необязательно замещен одним или более атомами галогена или одной или более алкильными группами (1-8 атомов углерода), гидрокси, алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода), илиc) группу -OR7 или -SR7, где R7 представляет независимо алкильную группу (1-8 атомов углерода), прямую или разветвленную, необязательно замещенную одним или более атомами галогена или одной или более группами алкильной (1-8 атомов углерода), алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),фенильное кольцо, необязательно замещенное одним или более атомом галогена, или его фармацевтически приемлемую соль. Другими особенностями настоящего изобретения являются: а) применение указанных соединений для лечения патологических состояний или заболеваний, улучшаемых или облегчаемых с помощью антагонистического воздействия на аденозиновый рецептор A2a, b) фармацевтические композиции, включающие в себя эффективное количество указанных соединений. Термин "низший алкил" в значении, используемом здесь, охватывает необязательно замещенные,прямые или разветвленные радикалы, имеющие от 1 до 8, предпочтительнее от 1 до 6 или более предпочтительно от 1 до 4 атомов углерода. Примеры включают метил, этил, n-пропил, i-пропил, n-бутил, втор-бутил и трет-бутил, n-пентил, 1 метилбутил, 2-метилбутил, изопентил, 1-этилпропил, 1,1-диметилпропил, 1,2-диметилпропил, n-гексил,1-этилбутил, 2-этилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил,2,3-диметилбутил, 2-метилпентил, 3-метилпентил и изогексил-радикалы. Термин "низший алкокси" в значении, используемом здесь, охватывает необязательно замещенные,прямые или разветвленные радикалы, каждый имеющий от 1 до 8, предпочтительно от 1 до 6 или еще более предпочтительно от 1 до 4 атомов углерода. Предпочтительные алкокси-радикалы включают метокси, этокси, n-пропокси, i-пропокси, nбутокси, втор-бутокси, t-бутокси, трифторметокси, дифторметокси, гидроксиметокси, 2-гидроксиэтокси или 2-гидроксипропокси. Термин "низший алкилтио" в значении, используемом здесь, охватывает необязательно замещенные, прямые или разветвленные тиосодержащие радикалы, каждый имеющий алкильные части, состоящие из 1-8, предпочтительно 1-6 или еще более предпочтительно 1-4 атомов углерода. Предпочтительные алкилтио-радикалы включают метилтио, этилтио, n-пропилтио, i-пропилтио, nбутилтио, втор-бутилтио, t-бутилтио, трифторметилтио, дифторметилтио, гидроксиметилтио, 2 гидроксиэтилтио или 2-гидроксипропилтио. Термин "циклическая группа" в значении, используемом здесь, охватывает, если не указано иное,карбоциклические и гетероциклические радикалы. Циклические радикалы могут содержать одно или более колец. Карбоциклические радикалы могут быть ароматическими или алициклическими, например циклоалкил-радикалы. Гетероциклические радикалы также включают в себя гетероарильные радикалы. Термин "ароматическая группа" в значении, используемом здесь, включает типично систему ароматического кольца из 5-14 членов, такую как кольцо из 5-6 членов, которые могут содержать один или более гетероатомов, выбранных из О, S и N. Когда не присутствует ни одного гетероатома, радикал называется арильным радикалом, когда присутствует как минимум один гетероатом, он называется гетероарильным радикалом. Ароматический радикал может быть моноциклическим и полициклическим, как фенил или нафтил. Когда ароматический радикал или доля несет 2 или более заместителей, заместители могут быть теми же или другими. Термин "пятичленное гетероарильное кольцо" в значении, используемом здесь, охватывает типично 5-членную кольцевую систему, включающую в себя как минимум одно гетероароматическое кольцо и содержащее как минимум один гетероатом, выбранный из О, S и N. Примеры включают фурил, оксадиазолил, оксазолил, имидазолил, тиазолил, тиадиазолил, тиенил,пирролил, триазолил, имидазолидинил и пиразолил-радикалы. Предпочтительными радикалами являются пиразолил, триазолил, тиазолил и фурил, необязательно замещенный. Когда радикал гетероарила несет 2 и больше заместителей, заместители могут быть теми же или другими. То, как это используется здесь, некоторые из атомов, радикалов, долей, цепей или циклов, присутствующих в общих структурах данного изобретения, являются "необязательно замещенными". Это означает, что эти атомы, радикалы, доли, цепи или циклы могут быть либо незамещенными, либо замещенными в любой позиции одним или более, например 1, 2, 3 или 4, заместителями, в силу чего атомы водорода, связанные с незамещенными атомами, радикалами, долями, цепями или циклами, замещаются химически приемлемыми атомами, радикалами, долями, цепями или циклами. Когда присутствуют два или более заместителей, каждый заместитель может быть тем же или другим. В значении, используемом здесь, термин "атом галогена" охватывает атомы хлора, фтора, брома или йода, типично атом фтора, хлора или брома, наиболее предпочтительно хлора и фтора. Термин "гало" в случае использования его в качестве приставки имеет такое же значение. В значении, используемом здесь, термин "фармацевтически приемлемая соль" охватывает соли с фармацевтически приемлемой кислотой или основой. Фармацевтически приемлемые кислоты включают в себя как неорганические кислоты, например хлористо-водородную, серную, фосфорную, дифосфорную, бромисто-водородную, йодисто-водородную и азотную кислоту, так и органические кислоты, например лимонную, фумаровую, малеиновую, яблочную, миндальную, аскорбиновую, щавелевую, янтарную, виннокаменную, бензойную, уксусную, метансульфоновую, этансульфоновую, бензолсульфоновую или p-толуолсульфоновую кислоту. Фармацевтически приемлемые основы включают в себя щелочной металл (например, натрий или калий) и щлочно-земельный металл (например, кальций или магний),гидроксиды и органические основы, например алкиламины, арилалкиламины и гетероциклические амины. Другими предпочтительными солями в соответствии с данным изобретением являются четвертичные соединения аммония, где эквивалент аниона (X-) связан с положительным зарядом N атома. X- может быть анионом различных минеральных кислот, таких как, например, хлорид, бромид, йодид, сульфат, нитрат, фосфат, или анионом органической кислоты, такой, например, как ацетат, малеат, фумарат,цитрат, оксалат, сукцинат, тартрат, манат, миндальный, трифторацетат, метансульфонат и pтолуенсульфонат. X- предпочтительно является анионом, выбранным из хлорида, бромида, йодида,сульфата, нитрата, ацетата, малеата, оксалата, сукцината или трифторацетата. Наиболее предпочтительным X- является хлорид, бромид, трифторацетат или метансульфонат. В соответствии с одним воплощением настоящего изобретения в соединениях формулы (I) R1 независимо представляет необязательно замещенные пиразоловое, тиазольное или триазольное кольца. В соответствии с предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 независимо представляет необязательно замещенные пиразол, тиазол или триазол и R2 представляет атом водорода. В соответствии с наиболее предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 независимо представляет необязательно замещенные пиразоловое, тиазольное или триазольное колца, R2 представляет атом водорода и R3 представляет атом брома или цианогруппу. В соответствии с наиболее предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 и R4 независимо представляют необязательно замещенные пиразоловое, тиазольное или триазольное кольца, R2 представляет атом водорода и R3 представляет атом брома или цианогруппу. В соответствии с еще более предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 и R4 представляют пиразоловое кольцо, необязательно замещенное одним или более заместителями, группа R2 представляет атом водорода, и группа R3 представляет атом брома или цианогруппу. В соответствии с еще одним предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 представляет необязательно замещенные пиразоловое, тиазольное или триазольное кольца, R2 представляет атом водорода, R3 представляет атом брома, R4 независимо представляет группу-N(R5)(R6), в которой R5 представляет атом водорода, R6 представляет алкильную группу, необязательно замещенную атомами фтора, амино, диалкиламино и алкокси. В соответствии с еще одним предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 представляет необязательно замещенное пиразоловое кольцо, R2 представляет атом водорода, R3 представляет атом брома и R4 независимо представляет изопропиловое, циклопропиловое и циклобутиловое кольца, необязательно замещенные атомами фтора. В соответствии с еще одним предпочтительным воплощением настоящего изобретения в соединениях формулы (I) R1 представляет необязательно замещенное пиразоловое кольцо, R2 представляет атом водорода, R3 представляет атом брома и R4 независимо представляет атомы кислорода или серы, необязательно замещенные. Конкретные индивидуальные соединения изобретения включают Соединения настоящего изобретения могут быть приготовлены при помощи одного из процессов,описанных ниже. Пути синтезирования описаны с использованием специфических примеров, которые не ограничивают никоим образом объем настоящего изобретения. Производные, где заместитель R3 является атомом брома или хлора, могут быть приготовлены при помощи последовательности реакций, представленных в схеме 1. Метилтиогруппа серийно выпускаемого производного (Aldrich) формулы (II) была оксидизирована с использованием 1,2 экв. метахлорпербензойной кислоты при комнатной температуре в дихлорметане(DCM) в качестве растворителя, дающего сульфоксид формулы (III), который выпадает в осадок непосредственно в результате реакции. Позиция 5 пиримидинового производного формулы (III) была бромирована с использованием Nбромсукцинимида в диметилформамиде (DMF) при комнатной температуре, что дает производное формулы (IV). Аналогичная реакция с использованием N-хлорсукцинимида ведет к хлорированным производным в позиции 5 пиримидинового кольца, что также является предметом изобретения. Схема 1(1,2 экв.), DMF, RT; (с) пиразол (1,3 экв.), карбонат цезия, DMF, RT; (d) 3-метилпиразол (3 экв.), карбонат цезия, DMF, 85C; (е) пирролидин (3 экв.), THF, 60C; (f) метилат натрия, метанол, RT. Галогенированные сульфоксиды формулы (IV) реагируют с различными серийно выпускаемыми пятичленными гетероциклическими (например, пиразолы или триазолы) производными при комнатной температуре с использованием диметилформамида (DMF) в качестве растворителя в присутствии основы, такой как карбонат цезия. Например, если соединение формулы (IV) реагирует с пиразолом при этих условиях, получается производное формулы (V). Атом хлора в позиции 6 производного пиримидина формулы (V) может также быть замещен пятичленными гетероциклическими производными (например, пиразолы или триазолы) с использованиемDMF в качестве растворителя и в присутствии основы, такой как карбонат цезия при 85 С. Например,реакция производного (V) с пиразолом при этих условиях дает соединение формулы (VI), которое является примером того типа соединений, которые заявлены настоящим изобретением. Более того, пиримидиновые производные формулы (V) могут также реагировать с первичными или вторичными серийно выпускаемыми аминами, спиртами, и тиолами при комнатной температуре, чтобы получить на выходе соединение формулы (I), заявленной настоящим изобретением. Например, реакция производного (V) с пирролидином или метоксидом натрия при этих условиях ведет к формированию соединения формулы (VII) или (VIII), которые являются особыми примерами соединений формулы (I),заявленной настоящим изобретением. Для синтезирования производных пиримидина, в которых заместитель R3 пятой позиции пиримидина, описанный выше, соответствует цианогруппе или гетероарильным группам, могут быть использованы процедуры, описанные в схеме 2. Схема 2 Реагенты и условия: (g) медь(I) цианид (1,1 экв.), пиридин, микроволна (MB), 20 мин при 250C; (h) тиазолил-2-трибутилстаннан, карбонат цезия, палладиевый катализатор, диоксин, вода, MW, 20 мин при 150C. Введение цианогруппы выполняется с использованием метода, описанного А.Р. Ijzerman и др. в BiorganicMedical Chemistry 2008. Например, реакция бромпроизводных формулы (VII) с цианидом меди(I) при условиях микроволны 20 мин при 250C дает на выходе соединение формулы (IX), содержащее цианогруппу в позиции 5 пиримидинового кольца. С другой стороны, бромпроизводное формулы (VI) реагирует с серийно выпускаемым гетероарилбороновыми кислотами в обычно применимой реакции связывания Suzuki или с серийно выпускаемым гетероарил-трибутилстаннан производными в стандартной реакции Stille, чтобы дать производные, где позиция 5 пиримидинового кольца замещена гетероциклическим кольцом. Например, реакция соединения формулы (VII) с 2-трибутилстаннилтиазолом, опосредованная палладиевым катализом дает на выходе соединение формулы (X), которое является специфическим примером соединений, заявленных в настоящем изобретении. Соединения, в которых аминогруппа в позиции 4 пиримидинового кольца замещена алкильной группой R2, как это указано выше, может быть получена с использованием пути синтезирования, описанного в схеме 3. Схема 3 Производное формулы (VI) вступает в реакцию с нитритом натрия в уксусной кислоте при комнатной температуре с образованием соответствующего пиримидинона формулы (XI). Реакция этого производного с тионилхлоридом в растворе DMF/DCM (1/2: v/v) при 40C ведет к образованию 4-хлорпиримидин производного формулы (XII). Соединение (XII) затем вступает в реакцию с серийно выпускаемыми аминами с очень хорошими выходами (результатами), дающими требуемые N-пиримидин-4 амины формулы (XIII), которые являются предметом настоящего изобретения. Если остатки R1 и R4, указанные в общей формуле (I), являются одинаковыми, производные могут тоже быть синтезированы, следуя процедуре, описанной в схеме 4. Схема 4 Реагенты и условия: (L) N-бромсукцинимид (1,2 экв.), DMF, RT; (m) 4-метилпиразол (4 экв.), карбонат цезия, DMF, 85C. Бромирование серийно выпускаемого соединения формулы (XIV) выполняется с Nбромсукцинимидом в DMF, что дает соединение формулы (XV). Реакция соединения (XIV) с различными серийно выпускаемыми пиразолами в присутствии карбоната цезия в DMF при 85C ведет к образованию производных пиримидина, замещенных идентичными производными пиразола в позиции 2 и 6,таких как соединение формулы (XVI), которое является специфическим примером соединений формулы(I), заявленной настоящим изобретением. Аналогичным образом, если остаток R4, как указано в общей формуле (I), является алкильной или циклоалкильной группой, производные могут тоже быть синтезированы, следуя процедуре, описанной в схеме 5. Схема 5 Реагенты и условия: (L) N-бромсукцинимид (1,2 экв.), DMF, RT; (m) пиразол (4 экв.), карбонат цезия, DMF, 85C. Бромирование серийно выпускаемого соединения формулы (XVII) выполняется с Nбромсукцинимидом в DMF, что дает соединение формулы (XVIII). Реакция соединения (XVIII) с различными серийно выпускаемыми пиразолами в присутствии карбоната цезия в DMF при 85C ведет к образованию производных, таких как соединение формулы (XIX), которое является специфическим примером соединений формулы (I), заявленной настоящим изобретением. Когда заместители в позиции 2 и 6 пиримидинового кольца являются гетероциклическими кольцами, которые не могут быть введены при помощи нуклеофильного замещения, соответствующие производные могут быть синтезированы, как описано в схеме 6. Серийно выпускаемое производное (XVI) вступает в реакцию с серийно выпускаемыми пинакол эфирами гетероарильных-бороновых кислот в стандартной реакции связывания Suzuki, или с серийно выпускаемыми гетероарильными-трибутилстаннановыми производными в типовой реакции Stille, чтобы дать смесь всех возможных заместителей, которые могут быть выделены при помощи колоночной хроматографии. Например, реакция соединения формулы (XVI) с 2-трибутилстаннилтиазолом, опосредованная палладиевым катализом, дает на выходе соединения формулы (XX), (XXI) и (XXII). Эти промежуточные продукты (интермедиаты) могут быть бромированы и замещены несколькими пиразольными производными, что дает соединения формулы (XXIII), (XIV) и (XV), которые представляют специфические примеры соединений формулы (I), заявленной настоящим изобретением. Реагенты и условия: (h) тиазолил-2-трибутилстаннан, фторид цезия, палладиевый катализатор, диоксан, 24 ч при 80C; (L) N-бромсукцинимид (1,2 экв.), DMF, RT; (m) пиразол (4 экв.), карбонат цезия,DMF, 85C. Фармакологическая активность Сравнительный анализ радиолигандного связывания подтипа аденозинового рецептора A2a. Мембраны человека из рекомбинированных аденозиновых рецепторов были приобретены в корпорации Receptor Biology, Inc., USA (США). Сравнительные анализы были проведены путем инкубирования мембран из рецепторов hA1, трансфектированных в СНО клетки, [3H]-DPCPX в качестве радиолиганда, буфер (HEPES 20 mM (pH 7.4), 10mM MgCl2, 100 mM NaCl, 2 ед/мл аденозин деаминазы), и немеченый лиганд, в общем объеме, равном 0,2 мл на 60 мин при 25C. R-PIA использовался для обозначения неспецифической связи. Фильтрование проводилось через фильтры SchleicherSchuell GF/52 (предварительно пропитанные 0,5% полиэтилэнимином) в харвестере клеток Brandel. Несвязанный (свободный) радиолиганд устранялся при помощи(3250 l) HEPES 20 mM (pH 7.4), 100 mM NaCl и 10 mM MgCl2. Сравнительные анализы были проведены путем инкубирования мембран из рецепторов hA2a,трансфектированных в клетки HeLa, [3H]ZM241385 в качестве радиолиганда, буфер (50 mM Tris-HCl (pH 7.4), 10 mM MgCl2, 1 mM EDTA, 2 ед/мл аденозин деаминазы) и непомеченный лиганд, в общем объеме,равном 0,2 мл на 30 мин при 25C. NECA использовался для определения неспецифической связи. Фильтрование проводилось через фильтры SchleicherSchuell GF/52 (предварительно пропитанные 0,5% полиэтилэнимином) в харвестере клеток Brandel. Несвязанный радиолиганд устранялся при помощи 3250l ледяного (холодного как лед) 50 mM Tris-HCl (pH 7.4), 10 mM MgCl и 1 mM EDTA. Сравнительные кривые связывания концентрация-ответ были выполнены путем проведения анализа 6 различных концентраций (диапазон между 10-100 М). Ингибиторная константа (Ki) каждого соединения была рассчитана при помощи уравнения Cheng-PrusoffKi = IC50/(1 + [L]/KD),где IC50 - это концентрация соединения, которое вытесняет связывание радиолиганд 50%, (L) - это свободная от радиолиганда концентрация и KD - это константа диссоциации каждого радиолиганда. Величины IC50 были получены путем подбора данных с нелинейной регрессией при помощи компьютерной программы Prism 2.1 (GraphPad, San Diego, CA). Измерение продуцирования циклического аденозинмонофосфата. Эти анализы были проведены на аденозиновых рецепторах, трансфектированных с использованием сАМР набора реактивов (Amersham Biosciences) энзим иммунологического анализа сАМР. Клетки СНОA2A были высеяны (10000 клеток/лунка) в культуральные планшеты на 96 лунок каждый и инкубированы при 37C в атмосфере с 5% CO2 в смеси модифицированной Дульбекко среды Игла (Dulbecco's ModifiedEagle's Medium) F-12 (DMEM F-12) от Eagle, содержащей 10% фетальной/эмбриональной телячьей сыворотки (FCS/ФТС) и 1% L-глутамина. Клетки были промыты 3 с 200 l среды для количественного определения (DMEM F-12 и 25 mM HEPES pH 7.4) и предварительно инкубированы при помощи среды для количественного определения, содержащей 30 М ролипрама и тестовые составы при 37C в течение 15 мин. 1 М NECA инкубировали в течение 15 мин при 37C (полное инкубационное время 30 мин). Реакция была остановлена буфером для лизиса, имеющейся в наборе реактивов, и энзим-иммунологический анализ был выполнен для определения внутриклеточного сАМР при 450 nm в ультра-эволюционном детекторе (Tecan). Данные были приведены в соответствие при помощи нелинейной регрессии с использованием GraphPad Prism v2.01 (компьютерная программа GraphPad). Таблица показывает ингибиторные константы против аденозинового рецептора A2a, полученные в анализе связывания и в анализе продуцирования вторичного посредника сАМР для некоторых примеров. Можно видеть из таблицы, что соединения формулы (I) являются сильными антагонистами аденозинового рецептора A2a. Производные этого изобретения применимы для лечения или профилактики заболеваний, известных как улучшаемые или облегчаемые при лечении с помощью антагониста аденозинового рецептора, в частности тех, которые облегчаются при лечении с помощью антагониста аденозинового рецептора А 2 а. Такими заболеваниями, например, являются ишемия, суправентрикулярная аритмия, мерцательная аритмия, острая почечная недостаточность, астма, реперфузионное повреждение миокарда, болезни, вызванные задержкой жидкости, аллергические реакции, включая, но не ограничиваясь этим, риниты, крапивница, склеродермия, артрит, другие аутоиммунные заболевания, воспалительное заболевание пищеварительного тракта/кишечника, сахарный диабет, ожирение, болезнь Паркинсона, болезнь Хантингтона,дистонии, такие как синдром беспокойных ног, дискенезии, такие как те, что вызваны продолжительным применением дофамина или нейролептических препаратов, или нарушения сна, застойная сердечная недостаточность, гипертензия, интрадиалитическая гипотония, деменция, тревожный невроз, глаукома. Соответственно, производные этого изобретения и фармацевтически приемлемые соли и фармацевтические композиции, включающие в себя такое соединение и/или соли, могут применяться в методе лечения нарушений в организме человека, который включает в себя назначение субъекту, нуждающемуся в таком лечении, эффективного количества пиримидинового производного этого изобретения или его фармацевтически приемлемой соли. Настоящее изобретение также предоставляет фармацевтические композиции, включающие в качестве активного ингредиента, по крайней мере, производное пиримидина формулы (I) или его фармацевтически приемлемую соль, связанные с фармацевтически приемлемым наполнителем, таким как носитель или разбавитель. Активный ингредиент может составлять от 0,001 до 99 вес.%, предпочтительно от 0,01 до 90 вес.% композиции в зависимости от типа препарата и от того, необходимо ли делать дополнительное разбавление до применения. Предпочтительно композиции произведены в форме, пригодной для орального, местного, назального, ректального, перкуссионного/подкожного или инъецируемого введения. Фармацевтически приемлемые наполнители, которые примешаны к активным соединениям или солям такого соединения для формирования композиций этого изобретения, общеизвестны per se (сами по себе) и существующие используемые наполнители зависят, inter alia (в частности), от намеченного метода введения композиций. Композиции этого изобретения предпочтительно адаптированы к инъекционному или per os (пероральному) введению. В этом случае композиции для орального введения могут принимать форму таблеток, таблеток замедленного действия, подъязычных таблеток, капсул, ингаляционных аэрозолей, ингаляционных растворов, ингаляционного сухого порошка или жидких препаратов, таких как микстуры, эликсиры, сиропы или суспензии, при этом все они содержат соединение этого изобретения; такие препараты могут быть изготовлены методами, общеизвестными в этой области техники. Разбавители, которые могут быть использованы в изготовлении композиций, включают в себя те жидкости и твердые разбавители, которые совместимы с активным ингредиентом, вместе с окрашиваю- 10021565 щими или ароматизирующими агентами, если это желательно. Таблетки или капсулы могут удобно содержать от 2 до 500 мг активного ингредиента или эквивалентное количество его солей. Жидкая композиция, адаптированная для орального применения, может быть в форме растворов или суспензий. Растворы могут быть водными растворами, или растворимой солью, или другим производным активного соединения в объединении, например, с сахарозой для формирования сиропа. Суспензии могут включать в себя нерастворимое активное соединение этого изобретения или фармакологически приемлемую его соль в объединении с водой вместе с взвешивающим/суспендирующим агентом или ароматизатором. Композиции для парентеральных инъекций могут быть приготовлены из растворимых солей, которые могут быть или не быть лиофилизированными и которые могут быть растворенными в свободной от пирогенов водной среде или в другой жидкости, пригодной для парентеральных инъекций. Эффективные дозы обычно находятся в диапазоне 2-2000 мг активного ингредиента в день. Дневная доза может назначаться в количестве одного или более приемов, предпочтительно от 1 до 4 приемов в день. Синтез соединений этого изобретения иллюстрируется примерами (от 1 до 69), которые следуют ниже, включая приготовление промежуточных продуктов и которые никоим образом не ограничивают объем данного изобретения. Общая информация. Реагенты, исходные материалы и растворители были приобретены у коммерческих поставщиков и использованы в полученном виде. Концентрация относится к испарению в условиях вакуума с использованием вращающегося выпаривателя Bchi. Продукты реакции при необходимости очищались при помощи кратковременной хроматографии на силикагеле (40-63 m) с индикацией системы растворителя. Спектроскопические данные регистрировались на спектрометре Varian Gemini 200, спектрометре Varian Gemini 300, спектрометре Varian Inova 400 и спектрометре Brucker DPX-250. Точки плавления регистрировались на аппарате Bchi 535. HPLC-MS выполнялась на приборе Gilson, оборудованном поршневым насосом Gilson 321, вакуумным дегазаторомGilson 864, жидкостным манипулятором Gilson 215, впрыскивающим модулем Gilson 189, 7000, 1/1000 расщепителем Gilson Valvemate, подпиточным насосом Gilson 307, диодным матричным детектором Gilson 170 и детектором Thermoquest Finnigan aQa. Полуподготовительная очистка выполнялась с использованием Symmetry C18 колонки с обращенной фазой (100, 5 m, 19100 мм, куплено у фирмы WATERS) и водного/аммониевого формиата (0,1%, pH 3) и ацетонитрил/аммониевого формиата (0,1%, pH 3) в качестве подвижной фазы. Промежуточный продукт 1: 6-хлор-2-(метилсульфинил)пиримидин-4-амин. К взболтанному раствору 10,0 г (57,2 ммоль) 6-хлор-2-(метилтио)пиримидин-4-амина в 300 мл дихлорметана добавлялся в течение 30 мин раствор 15,3 г (68,6 ммоль) m-хлорпербензойной кислоты (77%)(Aldrich), растворенной в 200 мл DCM. Реакционная смесь взбалтывалась при комнатной температуре в течение 4 ч. Образовавшийся белый осадок был отфильтрован, промыт несколько раз с DCM и затем после просушки дал 10,4 г (94,9%) промежуточного продукта. 1H-ЯМР (300 МГц, DMSO-d6):3.28 (s, 3H), 6.64 (s, 1H), 8.11 (s, 2H). Промежуточный продукт 2: 5-бром-6-хлор-2-(метилсульфинил)пиримидин-4-амин. 11,2 г (62,6 ммоль) N-бромсукцинимида медленно добавляли к охлажденной суспензии 10 г (52,2 ммоль) 6-хлор-2-(метилсульфинил)пиримидин-4-амина в 130 мл DMF. После 50 мин взбалтывания при комнатной температуре осадок был отфильтрован, промыт с охлажденным DMF, несколько раз холодной водой и высушен в вакууме. Было получено 11,4 г (81%) белого твердого вещества. 1H-ЯМР (300 МГц, DMSO-d6):2.78 (s, 3H), 8.17 (d, 2 Н). Промежуточный продукт 3: 5-бром-2,6-дихлорпиримидин-4-амин. 2 г (12,2 ммоль) 4-амино-2,6-дихлорпиримидина было растворено в 10 мл DMF. К этому раствору было добавлено 2,6 г (14,6 ммоль) N-бромсукцинимида. Реакционная смесь взбалтывалась при комнатной температуре в течение ночи. Раствор был вылит на 200 мл охлажденной воды. Образовавшийся осадок был отфильтрован и промыт водой. Было получено продукта 2,7 г (91,9%) в виде белого порошка. 1H-ЯМР (300 МГц, DMSO-d6):8.16 (d, 2H). Промежуточный продукт 4: 2,5,6-трихлорпиримидин-4-амин. 1 г (6,1 ммоль) 4-амино-2,6-дихлорпиримидина было растворено в 5 мл DMF. К этому раствору было добавлено 0,98 г (7,32 ммоль) N-хлорсукцинимида. Раствор был вылит на 100 мл охлажденной воды. Образовавшийся осадок был отфильтрован, промыт водой и высушен, что дало на выходе 1,4 г (80%) белого твердого вещества. 1H-ЯМР (300 МГц, DMSO-d6):8.24 (d, 2H). Промежуточный продукт 5: 5-бром-6-хлор-2-(1 Н-пиразол-1-ил)пирнмидин-4-амин. 1 г (3,7 ммоль) 5-бром-6-хлор-2-(метилсульфинил)пиримидин-4-амина (промежуточный продукт 2) был взвешен в 10 мл DMF. К этой взвеси было добавлено 0,33 г (4,8 ммоль) депиразола и 0,8 г карбоната цезия. Реакционная смесь мгновенно приобрела светло-желтый цвет и была предоставлена для взбалты- 11021565 вания при комнатной температуре на протяжении от 1 до 2 ч. После почти полной конверсии в соответствующее монозамещенное производное, о чем свидетельствовала TLC, раствор был вылит на 100 мл охлажденной воды. Образовавшийся осадок был отфильтрован, промыт водой и высушен, чтобы дать на выходе 0,66 г (65%) требуемого продукта. 1H-ЯМР (300 МГц, DMSO-d6):6.56 (dd, 1H), 7.81 (d, 1H), 8.44 (d, 1H), 8.15 (d, 2H). Следующие промежуточные продукты были синтезированы с использованием процедуры, описанной для промежуточного продукта 5, начиная с соответствующих производных пиразола. Промежуточный продукт 6: 5-бром-6-хлор-2-(4-метил-1H-пиразол-1-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):7.94 (s, 1H), 8.57 (s, 1H), 8.13 (d, 2H). Промежуточный продукт 8: 5-бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4(3H)-один. 1,84 г (6 ммоль) 5-бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин (пример 1) был растворен в 20 мл уксусной кислоты. К этому раствору добавлялся раствор 4,16 г (18,4 ммоль) NaNO2 в 8 мл воды четырьмя дозами в течение 5 ч. Смесь взбалтывалась при комнатной температуре в течение 30 ч. Растворитель был удален в вакууме и неочищенный осадок промыт водой, чтобы дать на выходе 1,22 г (65,8%) чистого промежуточного продукта 8. 1H-ЯМР (300 МГц, DMSO-d6):6.50 (m, 2 Н), 7.73 (d, 1H), 7.75 (d, 1H), 8.30 (d, 1H), 8.53 (d, 1H). Промежуточный продукт 9: 5-бром-4-хлор-2,6-ди-(1H-пиразол-1-ил)пиримидин. К раствору из 1 г (3,26 ммоль) 5-бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4(3H)-один (промежуточный продукт 8) в 10 мл DMF и 40 мл DCM добавлялся по капле раствор 0,71 мл (9.8 ммоль) тионил хлорида в 10 мл DCM. Реакционная смесь орошалась в течение 2 ч, за это время никакого исходного материала не наблюдалось при помощи TLC. Раствор экстрагировался два раза при помощи 10 мл насыщенного раствораNaHCO3 и соляного раствора Brine. Органический слой был отделен, высушен при помощи MgSO4 и концентрирован, чтобы дать 0,65 г (61,5%) 4-хлорпиримидин производного. 1H-ЯМР (300 МГц, DMSO-d6):6.68 (dd, 1H), 6.73 (dd, 1H), 7.95 (d, 1H), 8.02 (d, 1H), 8.76 (d, 1H),8.80 (d, 1H). Промежуточный продукт 10: 2,6-дихлор-5-йодпиримидин-4-амин. 1 г (6,1 ммоль) 4-амино-2,6-дихлорпиримидина был растворен в 5 мл DMF. К этому раствору было добавлено 0,76 г (7,32 ммоль) N-иодсукцинимида. Раствор взбалтывался 18 ч при комнатной температуре и затем был вылит на 100 мл охлажденной воды. Образовавшийся осадок был отфильтрован, промыт водой и высушен, чтобы дать на выходе 1,2 г (76%) бледно-желтого твердого вещества. 1H-ЯМР (300 МГц, DMSO-d6):7.81 (d, 1H), 8.44 (d, 1H), 8.15 (d, 2H). Примеры Производные промежуточного продукта 5 (R1 = пиразол). Пример 1: 5-бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин. К раствору 0,15 г (0,55 ммоль) 5-бром-6-хлор-2-(1H-пиразол-1-ил)пиримидин-4-амин (промежуточный продукт 5) в 3 мл DMF было добавлено 0,11 г (1,64 ммоль) 1H-пиразола и 0,18 г (0,55 ммоль) карбоната цезия. Смесь взбалтывалась при 85C в течение 24 ч. Раствор DMF был концентрирован под пониженным давлением. Неочищенный осадок был промыт водой и высушен, что дало 0,13 г (77%) примера 1. 1H-ЯМР (300 МГц, DMSO-d6):6.57 (dd, 1H), 6.60 (dd, 1H), 7.52 (s, 1H), 7.81 (d, 1H), 7.87 (d, 1H),8.41 (s, 1H), 8.51 (d, 1H), 8.60 (d, 1H). Соединение, указанное в заглавии, может быть также синтезировано из промежуточного продукта 3 с использованием процедуры, описанной для примера 47, и пиразола вместо 4-метилпиразола. Примеры 2-33 были синтезированы с использованием процедуры, описанной для примера 1, начиная с промежуточного продукта 5 и соответствующих аминов или пиразол производных. Пример 2: 5-бром-6-(4-метил-1H-пиразол-1-ил)-2-(1H-пиразол-1-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):0.87 (t, 3H), 1.18 (d, 3H), 1.53 (m, 1H), 1.60 (m, 1H), 4.18 (m, 1H),6.14 (d, 1H), 6.48 (dd, 1H), 6.74 (s, 2H), 7.71 (d, 1H), 8.45 (d, 1H). Производные промежуточного продукта 1 (R1 = пиразол, R4 = -S-R7). Пример 33: 5-бром-6-(фенилтио)-2-(1H-пиразол-1-ил)пиримидин-4-амин. К раствору в 0,1 г (0,36 ммоль) 5-бром-6-хлор-2-(1H-пиразол-1-ил)пиримидин-4-амина (промежуточный продукт 5) в 4 мл THF было добавлено 74 l (0,73 ммоль) тиофенола и 0,178 г (0,55 ммоль)Cs2CO3. Микстура помещалась для вступления в реакцию в условия микроволны на 15 мин при 100C. Затем реакционная смесь выливалась на 10 мл охлажденной воды. Образовавшийся белый осадок фильтровался, промывался несколько раз холодной водой и высушивался. 1H-ЯМР (300 МГц, DMSO-d6):6.40 (dd, 1H), 7.39 (t, 1H), 7.54 (m, 4H), 7.62 (m, 2H), 7.68 (m, 2H). Пример 34: 5-бром-6-(метилтио)-2-(1H-пиразол-1-ил)пиримидин-4-амин. 0,05 г (0,73 ммоль) метанэтиолата натрия было добавлено к раствору 0,1 г (0,36 ммоль) 5-бром-6 хлор-2-(1H-пиразол-1-ил)пиримидин-4-амина (промежуточный продукт 5) в 4 мл THF. Смесь взбалтывалась в течение 1 ч при комнатной температуре. Затем она выливалась на 10 мл охлажденной воды. Образовавшийся осадок фильтровался, промывался несколько раз холодной водой и высушивался. 1H-ЯМР (300 МГц, DMSO-d6):2.56 (s, 3H), 6.54 (dd, 1H), 7.47 (s, 2H), 7.78 (d, 1H), 8.57 (d, 1H). Примеры от 35 до 37 синтезировались с использованием процедуры, описанной для примера 34 из промежуточного продукта 5 с использованием солей натрия соответствующих тиолатов. Пример 35: 5-бром-6-(этилтио)-2-(1H-пиразол-1-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):1.40 (d, 6H), 4.04 (m, 1H), 6.55 (dd, 1H), 7.46 (s, 2H), 7.79 (d, 1H),8.51 (d, 1H). Производные промежуточного продукта 1 (R1 = пиразол, R4 = -O-R7). Пример 38: 5-бром-6-фенокси-2-(1H-пиразол-1-ил)пиримидин-4-амин. К раствору 0,1 г (0,36 ммоль) 5-бром-6-хлор-2-(1H-пиразол-1-ил)пиримидин-4-амина (промежуточный продукт 5) в 4 мл THF было добавлено 0,07 г (0,73 ммоль) фенола и 0,1 г (0,73 ммоль) K2CO3. Микстура помещалась для вступления в реакцию в условия микроволны на 30 мин при 100C. Затем реакционная смесь выливалась на 10 мл охлажденной воды. Образовавшийся белый осадок фильтровался, промывался несколько раз холодной водой и высушивался. 1 Примеры от 39 до 41 синтезировались с использованием процедуры, описанной для примера 38 из промежуточного продукта 5 с использованием соответствующих арил- или гетероарилфенолов. Пример 39 (сравн.): 5-бром-2-(1H-пиразол-1-ил)-6-(пиридин-2-илокси)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):6.48 (dd, 1H), 6.37 (s, 2H), 7.73 (s, 1H), 8.11 (m, 2H), 8.58 (m, 2H). Пример 42: 5-бром-6-метокси-2-(1H-пиразол-1-ил)пиримидин-4-амин. 3 мл (1,5 ммоль) раствора (0,5 M) метанолат натрия в метаноле было добавлено к раствору 0,1 гTHF. Смесь взбалтывалась в течение 1 ч при комнатной температуре. Затем растворитель удалялся под пониженным давлением, осадок промывался несколько раз холодной водой, фильтровался и высушивался. 1H-ЯМР (300 МГц, DMSO-d6):3.99 (s, 3H), 6.54 (dd, 1H), 7.31 (s, 2H), 7.77 (d, 1H), 8.53 (d, 1H). Следующий пример был синтезирован с использованием процедуры, описанной для примера 42 из промежуточного продукта 5 с использованием раствора натрия 2,2,2-трифторэтанолат натрия в 2,2,2 трифторэтаноле. Пример 43: 6-(2,2,2-трифторэтокси)-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):5.17 (m, 2H), 6.56 (dd, 1H), 7.33 (s, 2H), 7.79 (d, 1H), 8.64 (d, 1H). Пример 44: 5-бром-2-(1H-пиразол-1-ил)пиримидине-4,6-диамин. Раствор 0,10 г (0,37 ммоль) 5-бром-6-хлор-2-(1H-пиразол-1-ил)пиримидин-4-амин (промежуточный продукт 5) и 0,05 г (0,77 ммоль) азида натрия в диоксане (10 мл) взбалтывался при 80C в течение 6 ч. Раствор был затем выпарен и осадок растворен в метаноле, добавлен Pd на древесном угле (10 мг) и гидрогенизирован на протяжении 30 мин. Раствор снова был выпарен и осадок кристаллизовался из этанола. 1H-ЯМР (300 МГц, DMSO-d6):6.46 (d, 1H), 6.70 (s, 2H), 6.74 (s, 2H), 7.69 (d, 1H), 8.48 (d, 1H). Пример 45: 5-хлор-2,6-ди-(1H-пиразол-1-ил)пиримидине-4-амин. 1 г (5,04 ммоль) 2,5,6-трихлорпиримидин-4-амина (промежуточный продукт 4) допускался для реагирования с 2,1 г (30,2 ммоль) 1H-пиразола и 2 г (6,05 ммоль) Cs2CO3 в 5 мл DMF при 85C в течение 24 ч. DMF удалялся в вакууме. Неочищенный осадок промывался несколько раз водой и затем высушивался. 1H-ЯМР (300 МГц, DMSO-d6):6.57 (dd, 1H), 6.62 (dd, 1H), 7.70 (s, 1H), 7.81 (d, 1H), 7.90 (d, 1H),8.36 (s, 1H), 8.59 (d, 1H), 8.63 (d, 1H). Пример 46: 5-йод-2,6-ди-(1H-пиразол-1-ил)пиримидине-4-амин. Соединение было синтезировано с привлечением процедуры, описанной для примера 31 с использованием промежуточного продукта 10 в качестве исходного материала. 1H-ЯМР (300 МГц, DMSO-d6):6.56 (dd, 1H), 6.60 (dd, 1H), 7.55 (s, 2H), 7.79 (d, 1H), 7.87 (d, 1H),8.74 (d, 1H), 8.75 (d, 1H). Пример 47: 4-амино-2,6-ди-(1H-пиразол-1-ил)пиримидине-5-карбонитрил. Смесь 0,2 г (0,65 ммоль) 5-бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин и 0,06 г (0,72 ммоль) цианида меди в 3 мл пиридина облучалась микроволнами при 250C в течение 20 мин. После почти полной конверсии в соответствующий карбонитрил, о чем свидетельствовала TLC, был добавлен этилацетат и профильтрован через целит. Раствор был экстрагирован два раза при помощи 10 мл насыщенного раствора NaHCO3 и соляного раствора (Brine). Органический слой отделен, высушен при помощи MgSO4 и концентрирован, чтобы дать 0,065 г (39,6%) требуемого продукта. 1H-ЯМР (300 МГц, DMSO-d6):6.58 (dd, 1H), 6.63 (dd, 1H), 7.72 (s, 1H), 7.81 (d, 1H), 7.89 (d, 1H),8.39 (s, 1H), 8.55 (d, 1H), 8.61 (d, 1H). Пример 48: 4-амино-6-N-циклопентиламино-2-(1H-пиразол-1-ил)пиримидин-5-карбонитрил. Соединение было синтезировано с использованием процедуры, описанной для примера 33 и 5 бром-N4-циклопентил-2-(1H-пиразол-1-ил)пиримидин-4,6-диамин (пример 4) в качестве исходного продукта. 1H-ЯМР (300 МГц, DMSO-d6):1.55 (m, 4 Н), 1.70 (m, 2 Н), 1.96 (m, 2 Н), 4.41 (m, 1H), 6.25 (d, 1H),6.48 (dd, 1H), 6.74 (s, 2H), 7.73 (d, 1H), 8.48 (d, 1H). Пример 49 (сравн.): 5-бром-N-метил-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин. К раствору 0,1 г (0,31 ммоль) 5-бром-4-хлор-2,6-ди-(1H-пиразол-1-ил)пиримидина (промежуточный продукт 9) в 3 мл THF было добавлено 0,124 г (1,84 ммоль) метиламин гидрохлорида и 0,45 г (1,38 ммоль) Ce2CO3. Реакционная смесь взбалтывалась при комнатной температуре в реакционной трубе в течение 48 ч. THF был удален в вакууме, и неочищенный продукт промыт водой и высушен. 1 7.95 (m, 1H), 8.46 (d, 1H), 8.65 (d, 1H). Примеры от 50 до 56 были синтезированы с использованием процедуры, описанной для примера 49,из соответствующего амина и 5-бром-4-хлор-2,6-ди-(1H-пиразол-1-ил)пиримидина (промежуточный продукт 9) в качестве исходного продукта. Пример 50 (сравн.): 5-бром-N-этил-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин. 1(d, 1H). Производные промежуточного продукта 6 (R1 = 4-метилпиразол). Примеры от 58 до 64 были синтезированы с использованием процедуры, описанной для примера 1,начиная от промежуточного продукта 6 и соответствующих аминов или пиразол производных. Пример 58: 5-бром-2-(4-метил-1H-пиразол-1-ил)-6-(1H-пиразол-1-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):1.21 (d, 3H), 1.57 (m, 1H), 1.77 (m, 1H), 1.93 (m, 1H), 2.08 (m, 1H),2.12 (s, 3H), 3.63 (m, 1H), 3.93 (m, 1H), 4.52 (m, 1H), 6.80 (s, 2H), 7.52 (s, 1H), 8.20 (s, 1H). Производные промежуточного продукта 7 (R1 = 4-хлор-1H-пиразол). Примеры 65 и 66 были синтезированы с использованием процедуры, описанной для примера 1, начиная с промежуточного продукта 7 и соответствующих аминов или пиразол производных. Пример 65: 5-бром-N-циклопропил-2-(4-хлор-1H-пиразол-1-ил)пиримидин-4,6-диамин. 1H-ЯМР (300 МГц, DMSO-d6):2.12 (q, 2H), 4.28 (t, 4H), 6.77 (s, 2H), 7.72 (s, 1H), 8.35 (s, 1H). Производные, содержащие одинаковый заместитель в позиции 2 и 6 пиримидинового кольца. Пример 67: 5-бром-2,6-ди-(4-метил-1H-пиразол-1-ил)пиримидин-4-амин. 0,2 мл (2,47 ммоль) 4-метил-1H-пиразола и 0,4 г (1,24 ммоль) карбоната цезия были добавлены к раствору 0,15 г (0,62 ммоль) 5-бром-2,6-дихлорпиримидин-4-амина (промежуточный продукт 3) в 3 млDMF. Смесь подогревалась при 85C в течение 24 ч. DMF был концентрирован в вакууме. Осадок был промыт водой и высушен, чтобы дать 0,16 г (78,7%) белого твердого вещества. 1(s, 1H), 8.16 (d, 2H). Следующие производные были синтезированы с применением метода, использованного для примера 67, с использованием производного соответствующего пиразола. Пример 68: 5-бром-2,6-ди-(4-хлор-1H-пиразол-1-ил)пиримидин-4-амин. 1(d, 1H), 7.38 (d, 2H). Следующий пример был синтезирован с использованием процедуры, описанной для примера 1 из промежуточного продукта 5, с использованием соответствующих аминов или пиразол производных. Пример 72: 5-бром-6-(3,5-диметил-1H-пиразол-1-ил)-2-(1H-пиразол-1-ил)пиримидин-4-амин. 1(s, 2H). Следующее производное было синтезировано при помощи метода, использованного для примера(s, 1H). Производные, содержащие гетероциклическое кольцо в позиции 5 (R3) пиримидинового кольца. Пример 85 (сравн.): 5-(1-метил-1H-пиразол-4-ил)-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин. Смесь 0,1 г (0,33 ммоль) 5-бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амина (пример 1), 0,10 г(0,49 ммоль) 1-метилпиразол-4-пинаколовый эфир бороновой кислоты, 0,23 г (0,72 ммоль) карбоната цезия и 5 мг (6,5 ммоль) [1,1'-бис(дифенилфосфино)ферроцин]дихлорпаладиум(II) дихлорметан комплекса в 3 мл диоксана и 0,5 мл воды облучалась микроволнами при 140C в течение 30 мин. После охлаждения до комнатной температуры был добавлен этилацетат и произведена фильтрация при помощи целлита. Раствор был экстрагирован два раза при помощи 10 мл насыщенного раствора NaHCO3 и соляного раствора (Brine). Органический слой отделен, высушен при помощи MgSO4 и концентрирован. Твердое вещество было очищено при помощи колоночной хроматографии с силикагелем и метиленхлоридом и метанолом в качестве элюента, чтобы дать 45,5 мг (45,3%) требуемого продукта. 1H-ЯМР (300 МГц, DMSO-d6):4.05 (s, 3H), 6.56 (dd, 1H), 6.59 (dd, 1H), 7.25 (s, 1H), 7.45 (s, 1H),7.52 (s, 1H), 7.80 (d, 1H), 7.86 (d, 1H), 8.40 (s, 1H), 8.51 (d, 1H), 8.59 (d, 1H). Следующее производное было синтезировано при помощи метода, использованного для примера 85 с использованием пинаколового эфира бороновой кислоты. Пример 86 (сравн.): 2,6-ди-(1H-пиразол-1-ил)-5-(1H-пиразол-4-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):0,41 (m, 2H), 0,65 (m, 2H), 1,61 (m, 1H), 6.57 (dd, 1H), 6.61 (dd, 1H),7.54 (s, 1H), 7.81 (d, 1H), 7.88 (d, 1H), 8.42 (s, 1H), 8.51 (d, 1H), 8.60 (d, 1H). Пример 89 (сравн.): 2,6-ди-(1H-пиразол-1-ил)-5-(тиазол-2-ил)пиримидин-4-амин. Реакция была выполнена в соответствии с методом, описанным Морганом в Chem. Eur. J. 2010, 16,4279-4283. Смесь 8,9 мг (13,1 ммоль) Pd-PEPPSI-IPr-катализатора, 0,1 г (0,33 ммоль) 5-бром-2,6-ди-(1Hпиразол-1-ил)пиримидин-4-амина (пример 1), 0,1 г (0,65 ммоль) фторида цезия и активированных, дробленых 4 молекулярных сит (33 мг) в стеклянной пробирке была очищена при помощи аргона и был добавлен 1 мл диоксина. Затем было добавлено 0,15 мг (0,39 ммоль) 2-трибутилстаннилтиазола и реакция (проба) взбалтывалась при 80C в течение 24 ч. Смесь была профильтрована через целит/CsF. Разбавитель удален в вакууме. Твердое вещество было очищено при помощи колоночной хроматографии с силикагелем и метиленхлоридом и метанолом в качестве элюента, чтобы дать 47,9 мг (47,2%) требуемого продукта. 1H-ЯМР (300 МГц, DMSO-d6):6.57 (dd, 1H), 6.58 (dd, 1H), 7.34 (d, 1H), 7.52 (s, 1H), 7.81 (d, 1H),7.86 (d, 1H), 7.92 (d, 1H), 8.41 (s, 1H), 8.51 (d, 1H), 8.60 (d, 1H). Следующее производное было синтезировано при помощи метода, использованного для примера 89, с использованием 2-трибутилстаннилоксазола. Пример 90 (сравн.): 5-(оксазол-2-ил)-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин. 1H-ЯМР (300 МГц, DMSO-d6):6.57 (dd, 1H), 6.56 (dd, 1H), 7.28 (d, 1H), 7.51 (s, 1H), 7.81 (d, 1H),7.85 (d, 1H), 7.90 (d, 1H), 8.40 (s, 1H), 8.50 (d, 1H), 8.58 (d, 1H). Пример 91 (сравн.): 5-(трифторметил)-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амин. Реакция была выполнена в соответствии с методом, описанным Бухвальдом в Science 2010, 328,1679-1681. Раствор 11,3 мг (20 ммоль) Pd(dba)2 и 15,8 мг (29,4 ммоль) 2-(дициклогексилфосфино)-3,6 диметокси-2',4',6'-триизопропил-1,1'-бифенил в 3 мл диоксина был добавлен к смеси 0,1 г (0,33 ммоль) 5 бром-2,6-ди-(1H-пиразол-1-ил)пиримидин-4-амина (пример 1), 0,04 г (0,65 ммоль) фторида калия. Затем было добавлено 0,093 г (0,65 ммоль) триметил(трифторметил)силана, и реакция (проба) взбалтывалась при 140C в течение 20 ч. Смесь была отфильтрована при помощи целлита и концентрирована в вакууме. Твердое вещество было очищено при помощи колоночной хроматографии с силикагелем и метиленхлоридом и метанолом в качестве элюента, чтобы дать 41,6 мг (43,1%) требуемого продукта. 1 Производные, содержащие гетероциклическое кольцо, прикрепленное углерод-углерод связью к позициям 2 или 6 пиримидинового кольца. Промежуточные продукты от 14 до 16 были синтезированы с использованием процедуры, описанной для примера 89, начиная с 2,6-дихлорпиримидин-4-амина и 2-(трибутилстаннил)тиазола в стандартной реакции Штилля (Stille). Три образованных промежуточных продукта были отделены при помощи колоночной хроматографии с силикагелем и циклогексагеном и этилацетатом в качестве элюента. Промежуточный продукт 14: 2-хлор-6-(тиазол-2-ил)пиримидин-4-амин. 1(d, 1H). Следующие промежуточные продукты были синтезированы с использованием процедуры, описанной для промежуточного продукта 3 из соответствующих производных тиазолилпиримидин-4-амина иH-ЯМР (300 МГц, DMSO-d6):7.35 (d, 1H), 7.96 (d, 1H), 8.17 (s, 2H). Пример 92: 5-бром-2,6-ди-(тиазол-2-ил)пиримидин-4-амин. Соединение было синтезировано, следуя процедуре, описанной для синтеза промежуточного продукта 3, с использованием промежуточного продукта 16 в качестве исходного продукта. 1H-ЯМР (300 МГц, DMSO-d6):7.35 (d, 1H), 7.41 (d, 1H), 7.96 (d, 1H), 8.01 (d, 1H), 8.18 (s, 2H). Примеры от 93 до 94 были синтезированы с использованием процедуры, описанной для примера 1,начиная с соответствующего промежуточного продукта 17 и 18 и пиразола. Пример 93: 5-бром-2-(1H-пиразол-1-ил)-6-(тиазол-2-ил)пиримидин-4-амин. 1 где R1 представляет пятичленное гетероарильное кольцо, выбранное из пиразолового, тиазольного или триазольного колец, необязательно замещенное одним или двумя атомами галогена или одним или двумя алкилом (1-8 атомов углерода), алкокси (1-8 атомов углерода) или циано;a) пятичленную гетероарильную группу, содержащую по крайней мере один гетероатом, выбранный из О, S и N, необязательно замещенный одним или более атомами галогена или одной или более группами алкильной (1-8 атомов углерода), алкокси (1-8 атомов углерода), алкилтио (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),b) группу -N(R5)(R6), в которой R5 и R6 представляют независимо атом водорода,алкильную или циклоалкильную группу из 3-6 атомов углерода, прямую или разветвленную, необязательно замещенную одним или более атомами галогена или одной или более группами гидрокси, алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),или R5 и R6 образуют вместе с атомом азота, к которому они присоединены, насыщенную гетероциклическую группу из 4-6 членов, в которой дополнительный гетероатом, выбранный из N и О, может быть вставлен, который необязательно замещен одним или более атомами галогена или одной или более алкильными группами (1-8 атомов углерода), гидрокси, алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода), илиc) группу -OR7 или -SR7, где R7 представляет независимо алкильную группу (1-8 атомов углерода), прямую или разветвленную, необязательно замещенную одним или более атомами галогена или одной или более группами алкильной (1-8 атомов углерода), алкокси (1-8 атомов углерода), амино, моно- или диалкиламино (1-8 атомов углерода),фенильное кольцо, необязательно замещенное одним или более атомом галогена или его фармацевтически приемлемая соль. 2. Соединение по п.1, где R3 представляет атом брома, атом хлора или цианогруппу. 3. Соединение по п.1, где R3 представляет атом брома или атом хлора. 4. Соединение по п.2, где R4 представляет группу -N(R5)(R6), как определено в п.1. 5. Соединение по п.2, где R4 представляет пиразоловое кольцо, присоединенное к пиримидиновому кольцу через атомы азота пиразолового кольца, при этом указанное пиразоловое кольцо необязательно замещено одним или двумя атомами галогена или одной или двумя метильными группами. 6. Соединение по п.2, где R4 представляет 2-тиазольное кольцо, при этом указанное тиазольное кольцо необязательно замещено одним или двумя атомами галогена или одной или двумя метильными группами. 7. Соединение по п.4, где R5 представляет атом водорода и R6 представляет алкильную группу (1-8 атомов углерода), группу, необязательно замещенную атомами галогена, амино, алкиламино (1-8 атомов углерода). 8. Соединение по п.3, где R1 и R4 представляет независимо пиразоловое или тиазольное кольцо, оба необязательно замещенные одним или двумя атомами галогена или одной или двумя метильными группами. 9. Соединение по п.3, где R1 и R4 представляют пиразоловое кольцо, необязательно замещенное одним или двумя атомами галогена или метильными группами. 10. Соединение по п.3, где R1 представляет пиразоловое или тиазольное кольцо, необязательно замещенное одним или двумя атомами галогена или метильными группами, и R4 представляет группу N(R5)(R6). 11. Соединение по п.3, где R1 представляет пиразоловое или тиазольное кольцо, необязательно замещенное одним или двумя атомами галогена или метильными группами, и R4 представляет группу SR7 или OR7, где R7 представляет прямую или разветвленную алкильную группу (1-8 атомов углерода), необязательно замещенную атомами фтора. 12. Соединение по п.1, которое является одним из 13. Применение соединения по любому из пп.1-12 для лечения патологических состояний или заболеваний, улучшаемых или облегчаемых с помощью антагонистического воздействия на аденозиновый рецептор A2a. 14. Применение соединения по любому из пп.1-12 для лечения патологического состояния или болезни, где патологическим состоянием или болезнью является ишемия, суправентрикулярная аритмия,мерцательная аритмия, острая почечная недостаточность, реперфузионное повреждение миокарда, болезни, вызванные задержкой жидкости, аллергические реакции, склеродермия, артрит, воспалительное заболевание пищеварительного тракта/кишечника, сахарный диабет, ожирение, болезнь Паркинсона,болезнь Хантингтона, дистонии, дискенезии, застойная сердечная недостаточность, гипертензия, интрадиализная гипотония, деменция, тревожный невроз и глаукома. 15. Применение соединения по пп.1-12 для лечения болезни Альцгеймера. 16. Применение по п.14, где аллергическими реакциями являются реакции, выбранные из группы,состоящей из ринита и крапивницы, дистонией является синдром беспокойных ног и дискенезией является состояние, выбранное из группы, состоящей из дискенезии, вызванной продолжительным употреблением дофамина, или нейролептических препаратов, или нарушением сна. 17. Фармацевтическая композиция для лечения патологических состояний или заболеваний, улучшаемых или облегчаемых с помощью антагонистического воздействия на аденозиновый рецептор A2a,включающая в себя эффективное количество соединения, как определено в любом из пп.1-12, смешанное с фармацевтически приемлемым разбавителем или носителем.
МПК / Метки
МПК: C07D 409/14, C07D 403/14, C07D 403/04, C07D 417/04, A61P 3/10, A61K 31/506, C07D 413/14, A61P 25/00, C07D 417/14
Метки: антагонисты, аденозинового, рецептора, 4-аминопиримидина, производные
Код ссылки
<a href="https://eas.patents.su/23-21565-proizvodnye-4-aminopirimidina-kak-antagonisty-adenozinovogo-receptora-a2a.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-аминопиримидина как антагонисты аденозинового рецептора а2a</a>
Предыдущий патент: Способ изготовления мембран sapo-34 для использования в разделении газов
Следующий патент: Стабилизированные пищевые продукты с покрытием, приготавливаемые с помощью микроволнового излучения
Случайный патент: Система радиочастотных ofdm-mimo передач