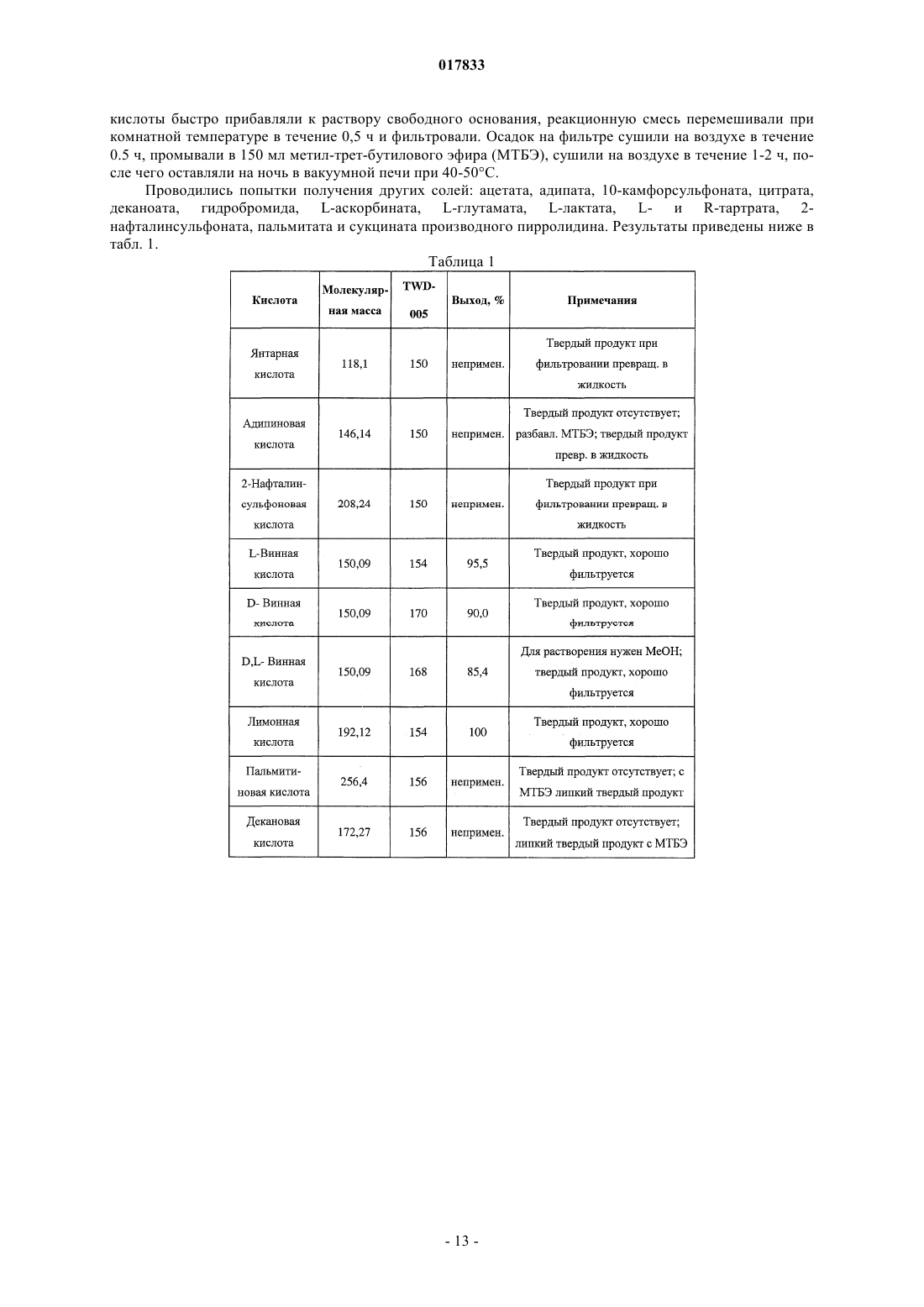
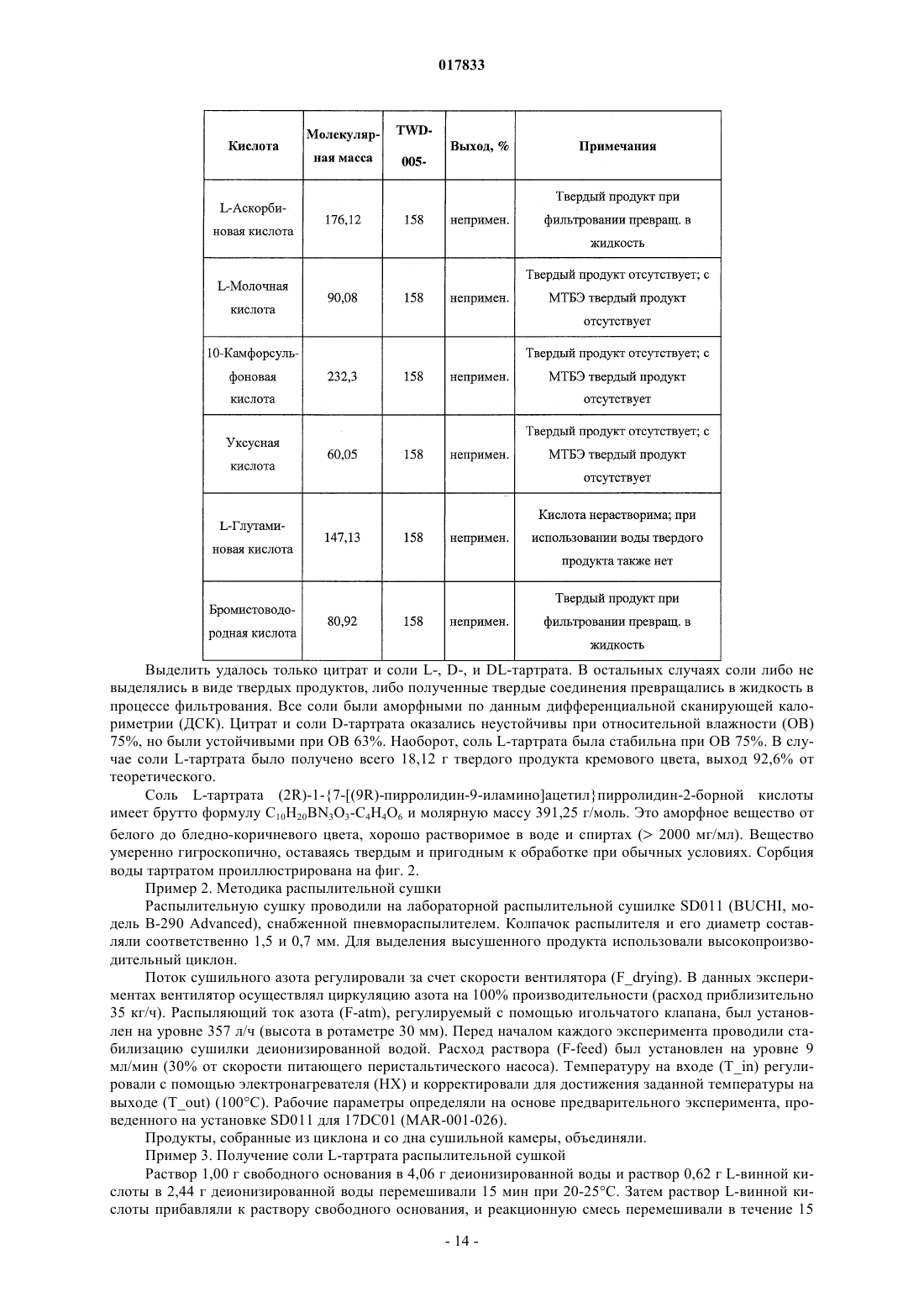
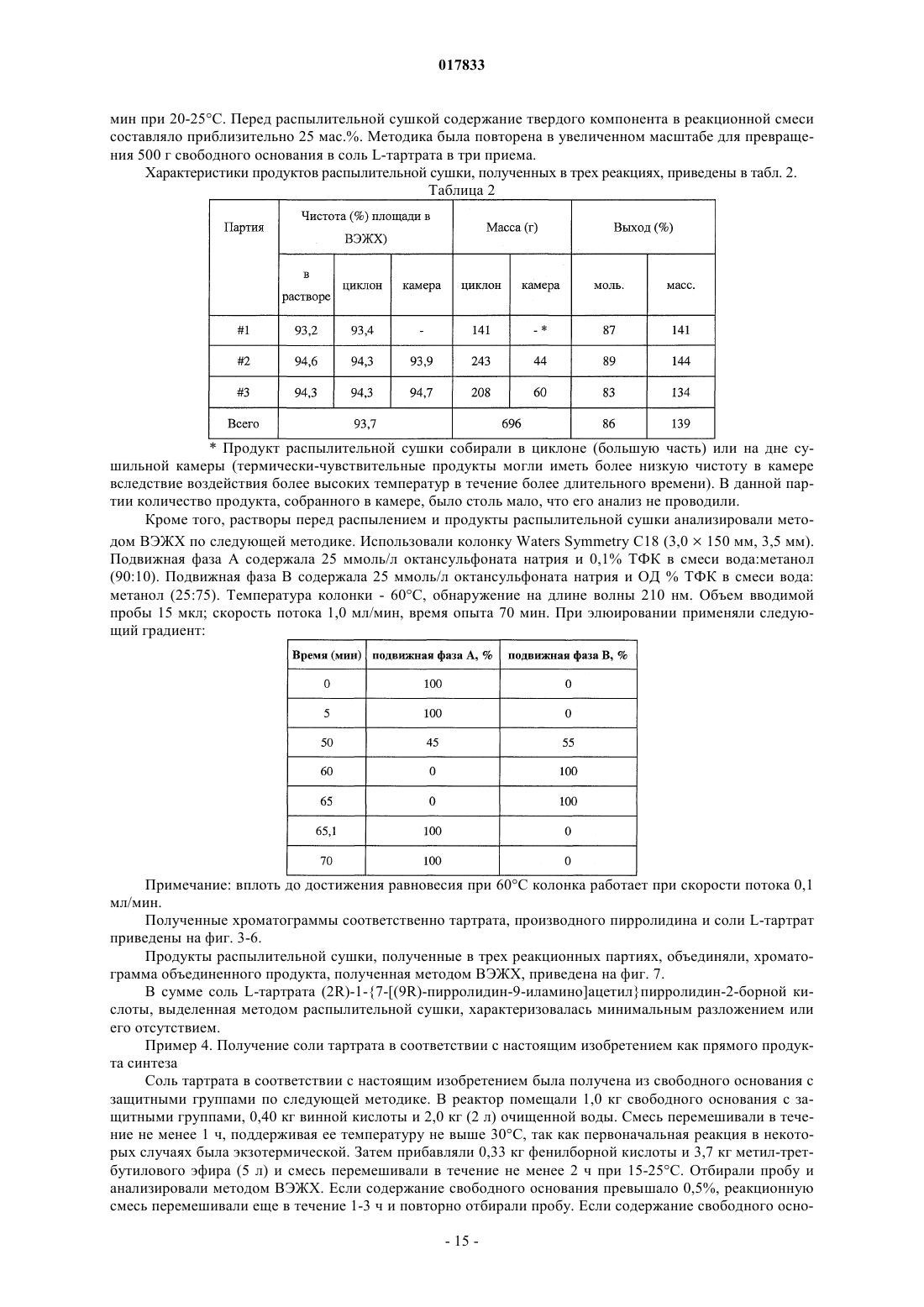
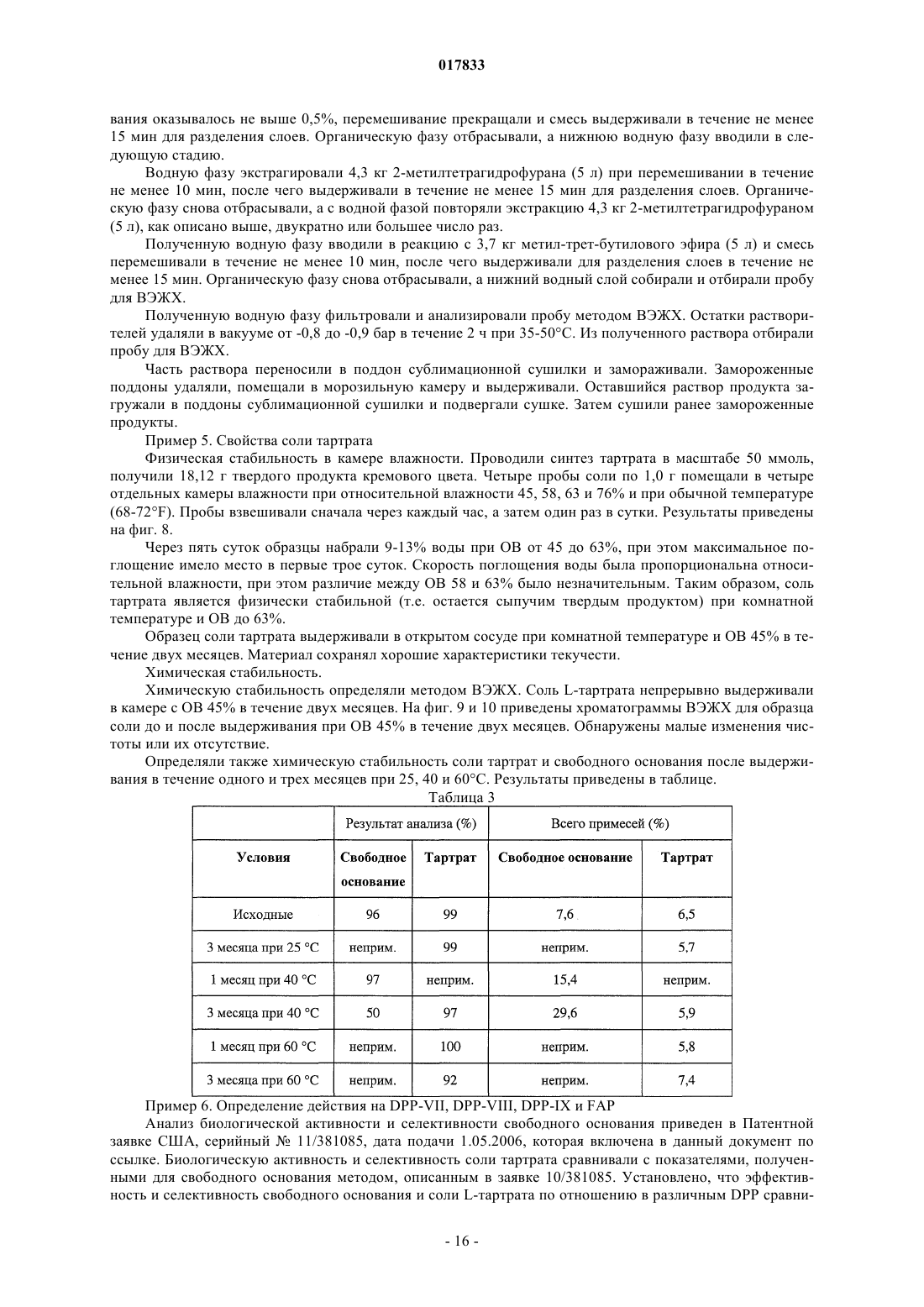
Твердые лимоннокислые и виннокислые соли ингибиторов dpp-iv
Номер патента: 17833
Опубликовано: 29.03.2013
Авторы: Кэмпбелл Дэвид Алан, Ву Чжэнь-Пин, Черрингтон Джули М.
Формула / Реферат
1. Фармацевтическая композиция, содержащая твердую форму гидрата соли цитрата или гидрата соли L-тартрата (2R)-1-{7-[(9R)-пирролидин-9-иламино]ацетил}пирролидин-2-бороновой кислоты формулы
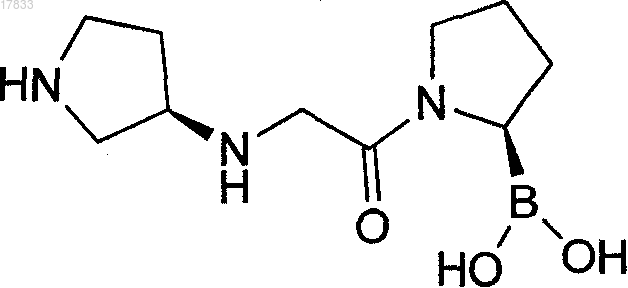
или его циклического изомера, или любой смеси этого пирролидинового соединения и его циклического изомера и фармацевтически приемлемый носитель.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что циклический изомер пирролидина является соединением формулы
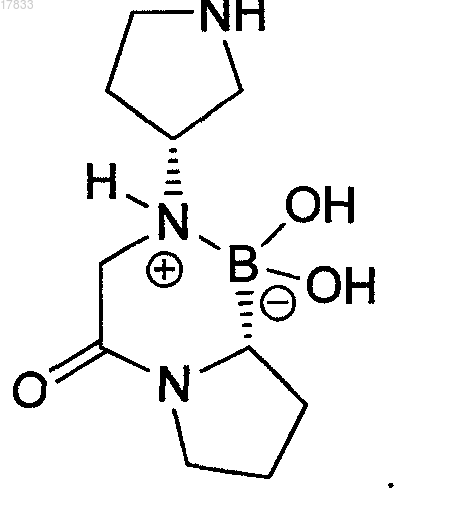
3. Фармацевтическая комбинация, содержащая композицию по любому из пп.1, 2 и дополнительно известное второе лекарственное средство, повышающее секрецию инсулина, повышающее чувствительность к инсулину, снижающее усвоение сахара из ЖКТ, усиливающее действие эндогенных пептидов или белков, влияющих на гликемический контроль, способное заменить эндогенные пептиды или белки, влияющие на гликемический контроль, или любые их комбинации; или где второе лекарственное средство является антидиабетическим агентом.
4. Лекарственная форма, содержащая композицию по любому из пп.1 или 2, в которой лекарственная форма содержит, по меньшей мере, единичную эффективную для человека дозу однородного образца соли цитрата или гидрата соли L-тартрата и фармацевтически приемлемый носитель.
5. Фармацевтическая композиция по любому из пп.1 или 2 для лечения диабета или расстройств у пациента, при которых медицински показано ингибирование DPP-IV.
Текст
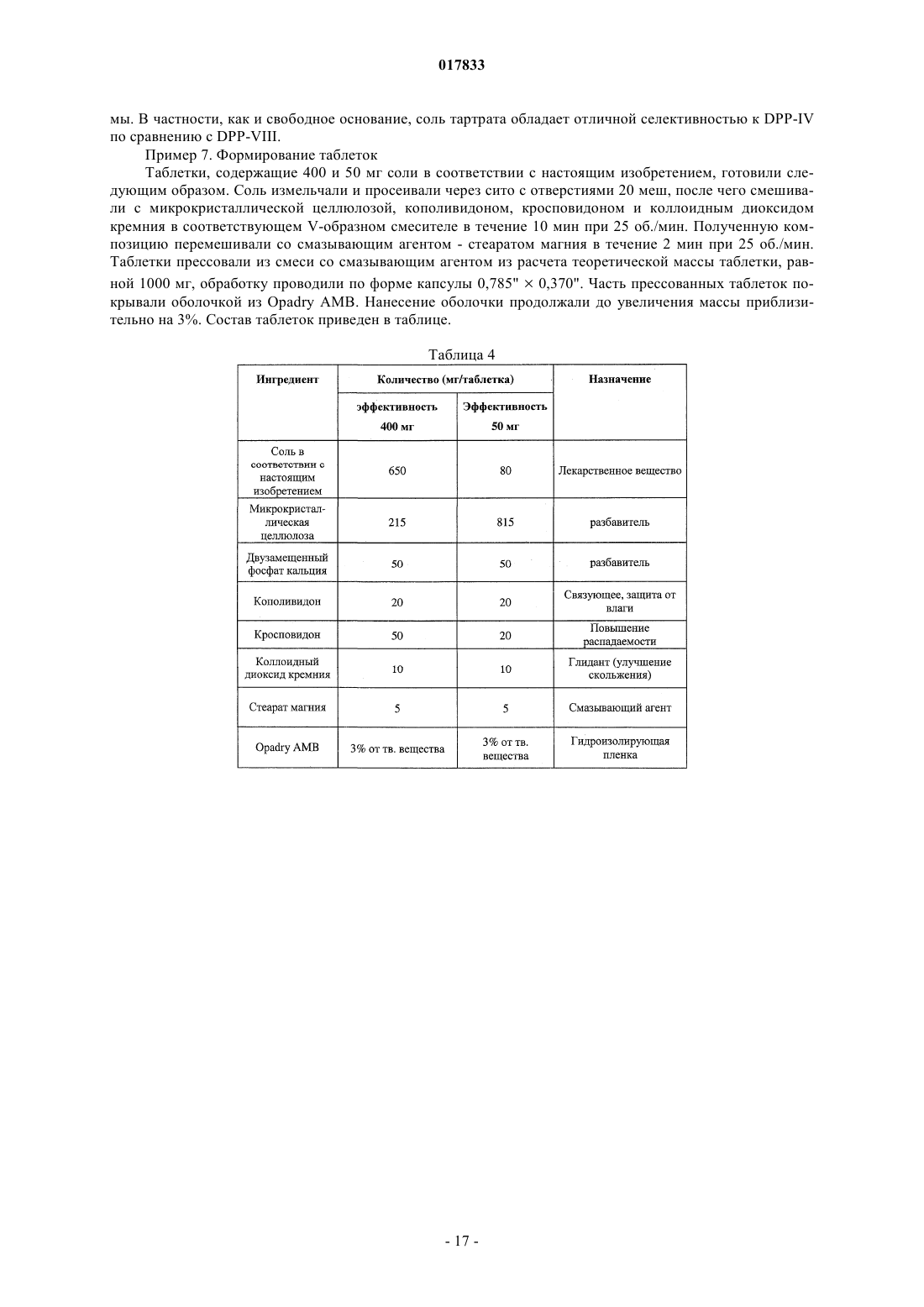
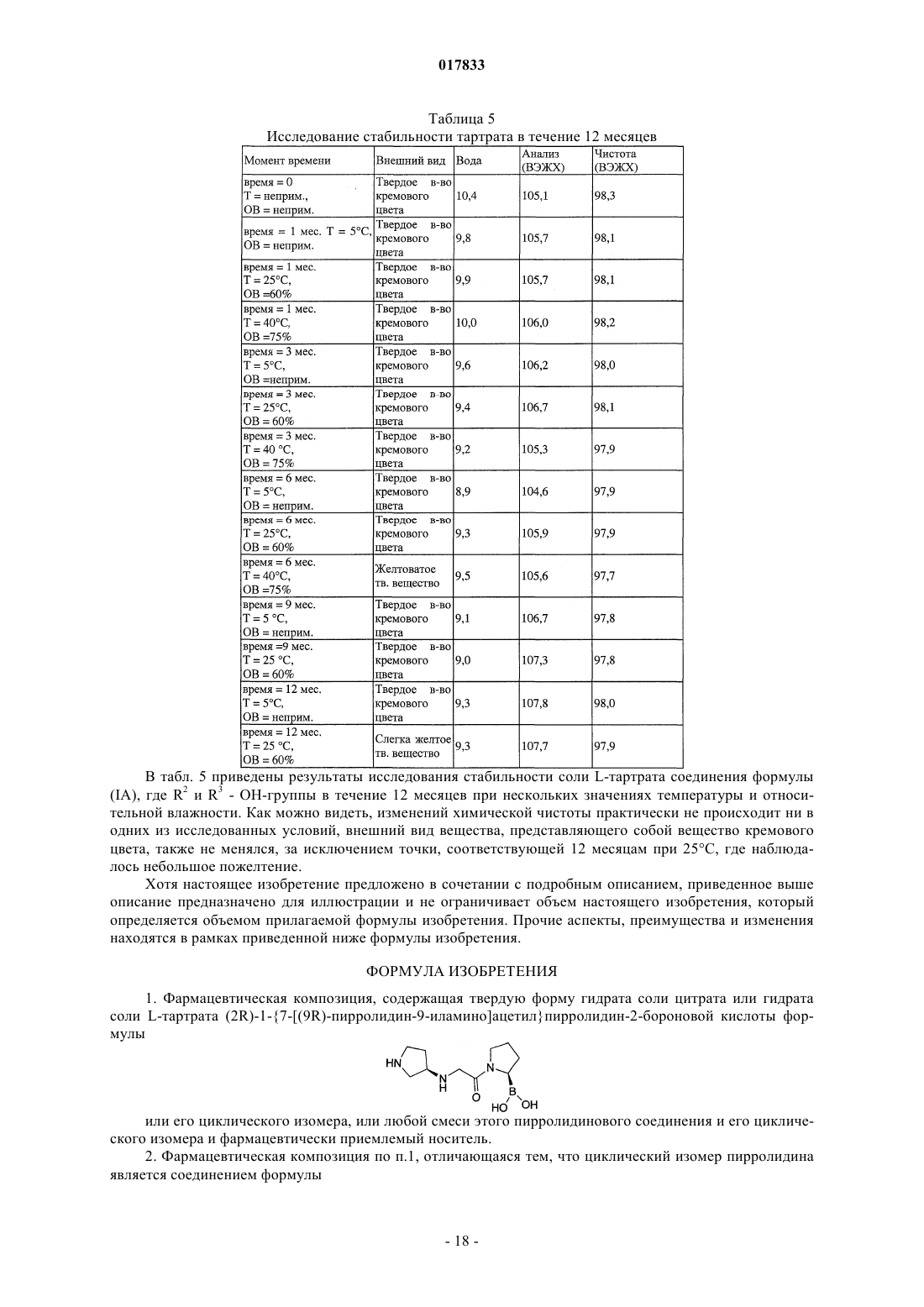
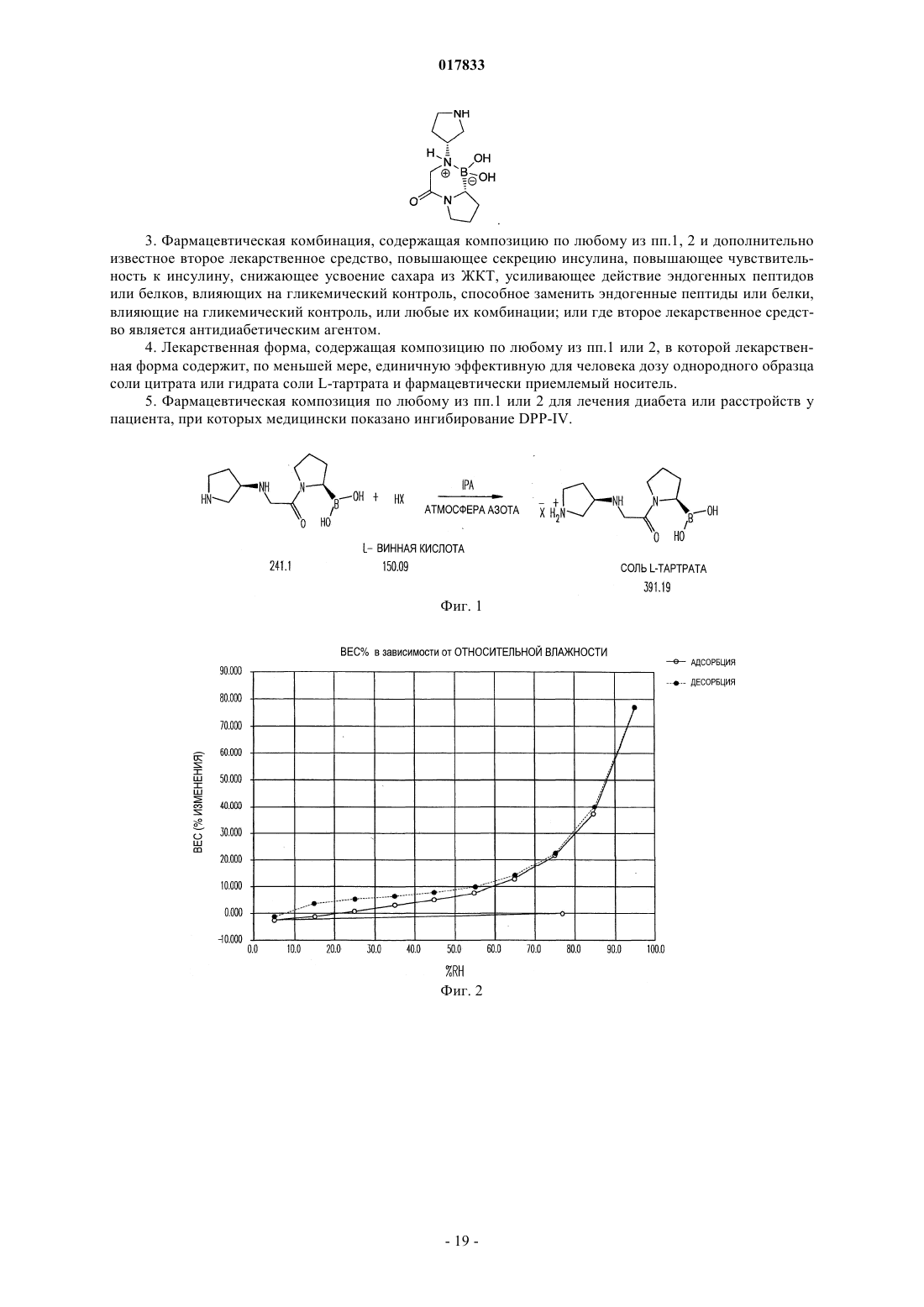
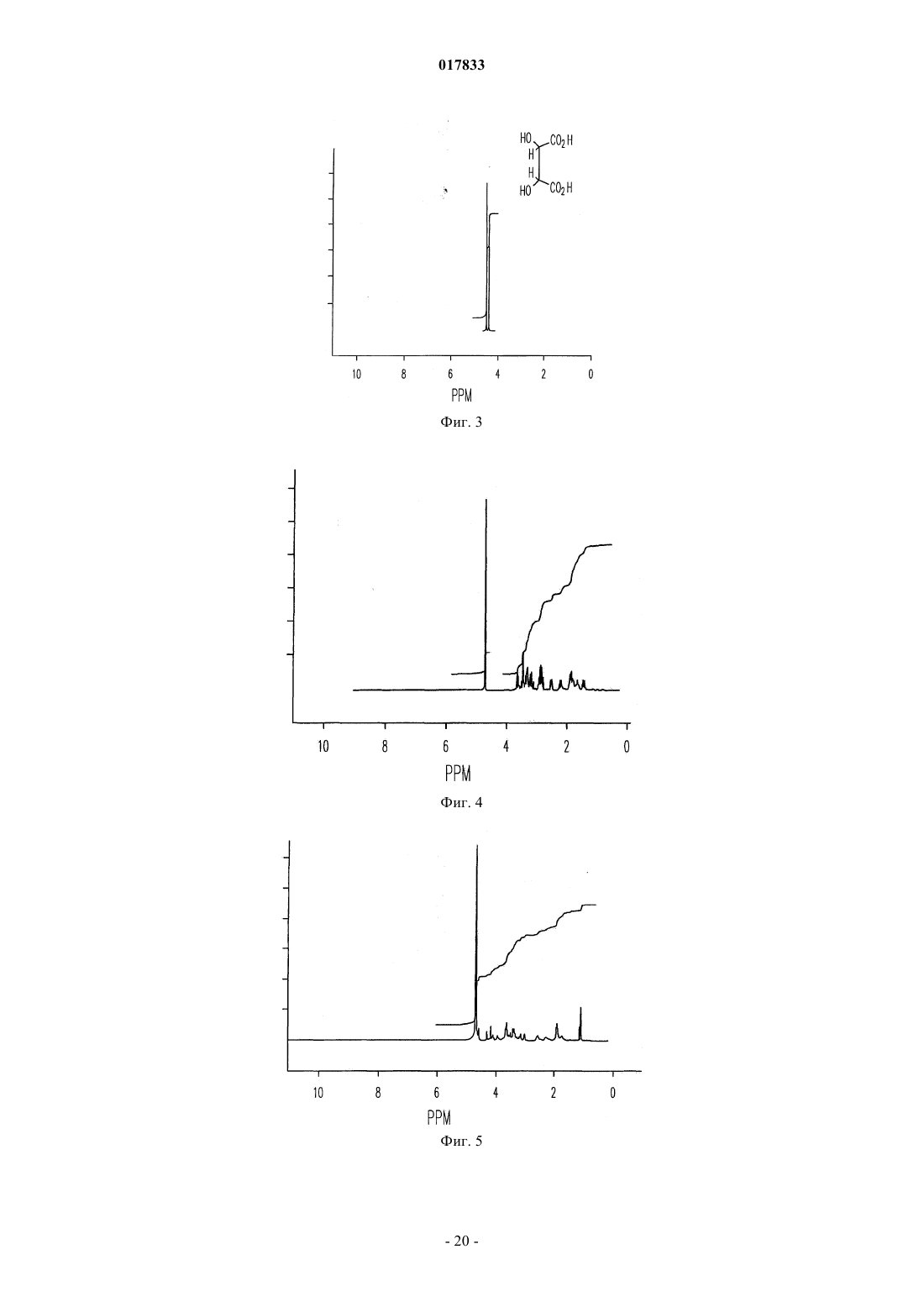
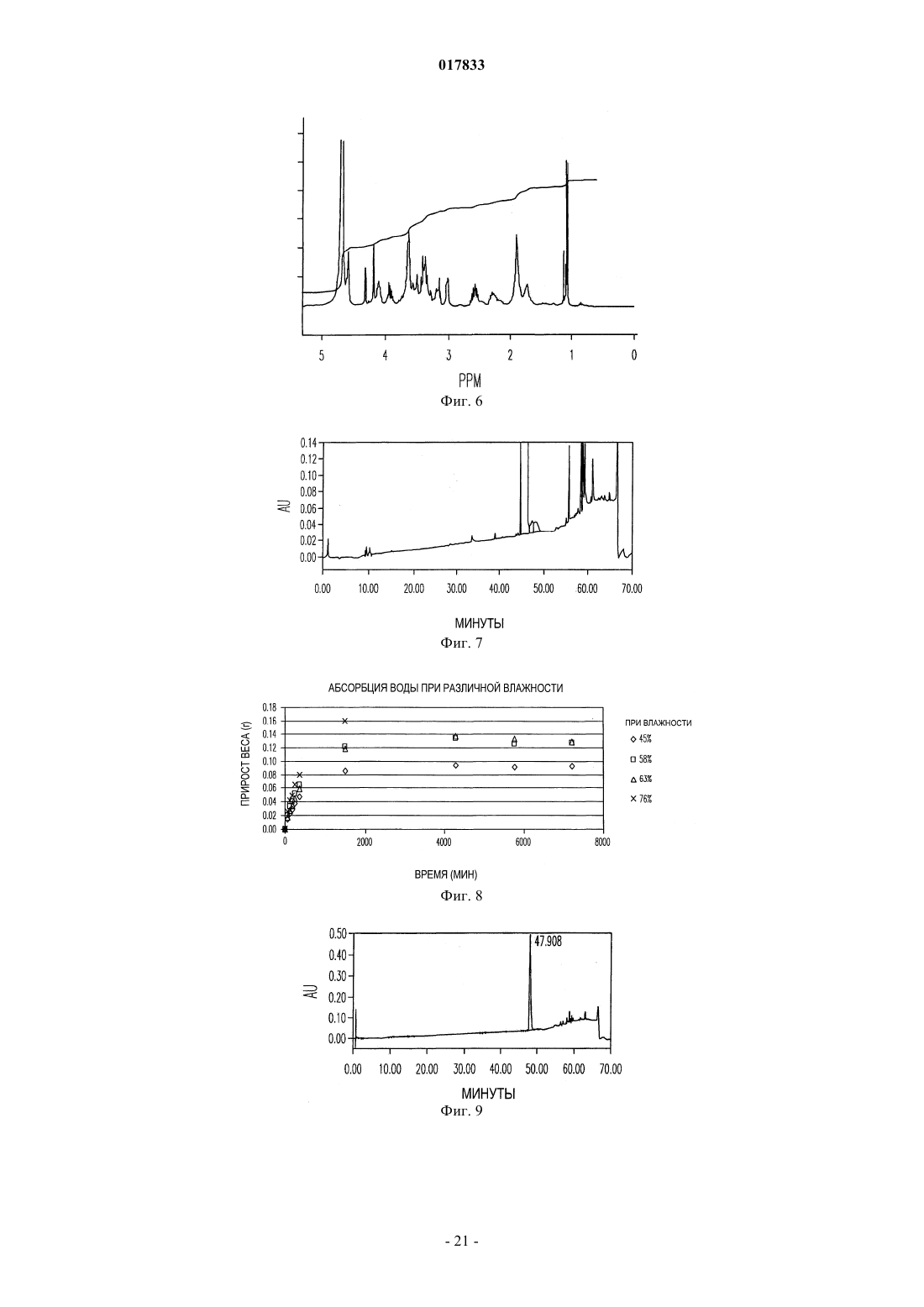
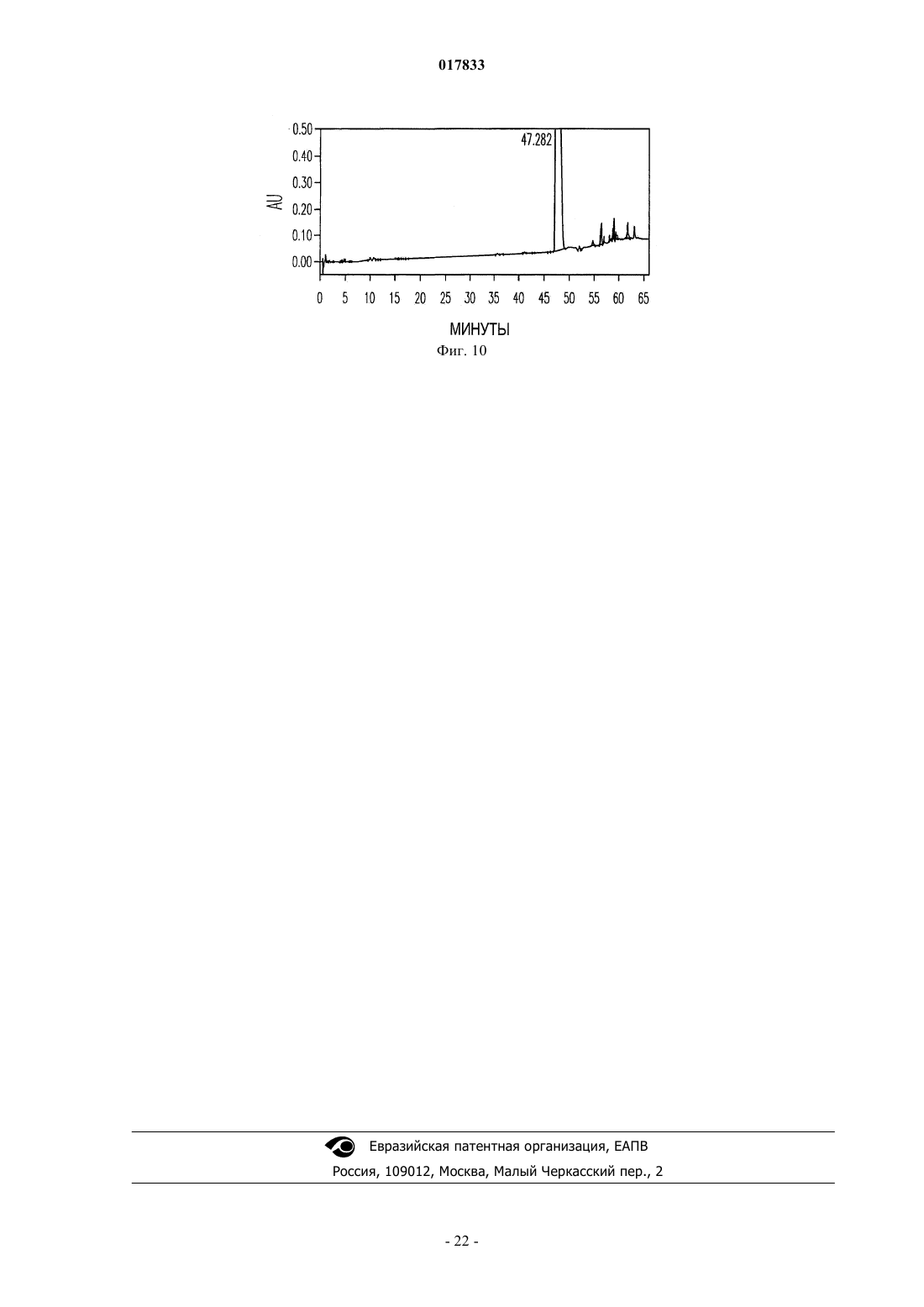
ТВЕРДЫЕ ЛИМОННОКИСЛЫЕ И ВИННОКИСЛЫЕ СОЛИ ИНГИБИТОРОВ DPP-IV Изобретение относится к солям тартрату и цитрату производных пирролидиниламиноацетилпирролидинборной кислоты, ингибиторов DPP-IV, которые являются химически и физически стабильными и представляют собой в основном нерасплывающиеся твердые вещества при обычных условиях. Область техники Областью изобретения являются новые формы твердых солей определенных селективных ингибиторов дипептидилпептидазы IV. Изобретение относится к солям тартрату и цитрату производных пирролидиниламиноацетилпирролидинборной кислоты, сильных и селективных ингибиторов DPP-IV. Указанные новые соли химически и физически стабильны в течение не менее 12 месяцев, представляют собой в основном нерасплывающиеся твердые вещества и пригодны для изготовления лекарственных средств. Предпосылки создания изобретения Дипептидилпептидаза-IV (DPP-IV) - серин-протеаза, принадлежащая к группе аминодипептидаз,включающей DPP-VII, DPP-VIII, DPP-IX, а также белок, активирующий фибробласты (FAP). Считается,что DPP-IV, катализирующая отщепление дипептида от N-конца белков, участвует в регулировании метаболизма глюкозы. Введение в организм синтетических ингибиторов DPP-ГУ препятствует Nконцевому распаду инсулинотропного гормона глюкагоноподобного пептида 1 (GLP-1) и желудочного ингибиторного пептида (GIP), что приводит в повышению секреции инсулина и улучшению толерантности к глюкозе. Замещенные аминоацетилпирролидинборные кислоты были разработаны как ингибиторы для лечения больных с нарушением гликемического контроля, например, сахарным диабетом и сходными состояниями. В связи с этим желательно создавать из таких ингибиторов удобные в употреблении твердые фармацевтические продукты. Типичными фармацевтическими продуктами являются многие фармацевтические вещества в виде свободных оснований или солей. Однако некоторые аминоацетилпирролидинборные кислоты в форме свободных оснований - это неустойчивые твердые вещества, легко поглощающие влагу из атмосферы. Кроме того, некоторые соли указанных свободных оснований также неустойчивы. В заявке США, серийный 10/514575, дата подачи 15.11.2004, под названием "Гетероциклические производные борных кислот", опубликованной 15.03.2007, как US 2007/0060547, раскрывается большой класс производных пирролидинборной кислоты, обладающих ингибирующим действием по отношению к дипептидилпептидазе-IV. Помимо этого, в предварительной заявке США, серийный 11/381085, дата подачи 1.05.2006, под названием "Производные пирролидина и методы селективного ингибирования дипептидилпептидазы-IV", опубликованной 23.11.2006 как US 2006/0264400, раскрывается более узкий класс производных пирролидиниламиноацетилпирролидинборной кислоты, обладающих селективным ингибирующим действием по отношению к DPP-IV. Одно из осуществлений упомянутого изобретения является особенно перспективным в качестве лекарственного средства. Однако биологическая эффективность наблюдалась для свободного основания, но свободное основание в виде твердого соединения физически или химически малоустойчиво при хранении. Таким образом, необходимо создание химически устойчивой формы соли данного соединения для применения в составе фармацевтической композиции для лечения расстройств, при которых медицинским назначением является селективное ингибирование DPP-IV. Сущность изобретения Данное изобретение относится к физически и химически стабильным органическим солевым композициям, ингибирующим DPP-IV, содержащим твердую форму гидрата соли цитрата или гидрата соли Твердая форма гидрата соли цитрата или гидрата соли L-тартрата (2R)-1-7-[(9R)-пирролидин-9 иламино]ацетилпирролидин-2-бороновой кислоты указанной формулы представляет собой нерасплывающиеся твердые вещества, сохраняющиеся при обычных условиях в течение не менее 12 месяцев без разложения. Композиции по изобретению могут также содержать циклический изомер или смесь пирролидинового соединения указанной формулы и его циклического изомера. Циклический изомер вышеуказанного производного пирролидина представляет собой соединение формулы Изобретение также включает лекарственную форму, содержащую композицию, в которой лекарственная форма содержит по меньшей мере единичную эффективную для человека дозу однородного об-1 017833 разца соли цитрата или гидрата соли L-тартрата и фармацевтически приемлемый носитель. Фармацевтическая композиция может быть приготовлена в виде лекарственного препарата для любого способа приема, включая в частности парентеральные инъекции, а также пероральное, трансбуккальное, перректальное введение и др. Фармацевтическая композиция может быть использована для лечения расстройств, поддающихся регулированию или нормализации за счет ингибирования DPP-IV. Способ включает введение эффективного количества соли цитрата или тартрата в соответствии с настоящим изобретением в организм млекопитающих, например человека, для воздействия на расстройства, поддающиеся регулированию или нормализации за счет ингибирования DPP-IV. Настоящее изобретение включает в себя и комбинированный фармацевтический препарат, состоящий из соли цитрата или тартрата в соответствии с настоящим изобретением и одного или более лекарственного средства, увеличивающего секрецию инсулина, повышающего чувствительность к инсулину,снижающего усвоение сахара из ЖКТ, усиливающего действие эндогенных пептидов или белков,влияющих на гликемический контроль, способного заменить эндогенные пептиды или белки, влияющие на гликемический контроль, либо их сочетания. Комбинированный фармацевтический препарат может быть приготовлен в соответствии с настоящим изобретением в форме фармацевтической композиции. Далее приведены способы получения солей цитрата или тартрата, способы приготовления фармацевтической композиции для лечения расстройств, поддающихся регулированию или нормализации за счет ингибирования DPP-IV. Описание чертежей Фиг. 1 схема образования соли(2R)-1-7-[(9R)-пирролидин-9 иламино]ацетилпирролидин-2-борной кислоты. Фиг. 2 - график зависимости влагопоглощения соли L-тартрата (2R)-1-7-[(9R)-пирролидин-9 иламино]ацетилпирролидин-2-борной кислоты от относительной влажности. Фиг. 3 - хроматограмма L-тартрата, полученная методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Фиг. 4 - хроматограмма производного пирролидина, полученная методом ВЭЖХ. Фиг. 5 - хроматограмма соли L-тартрата производного пирролидина, полученная методом ВЭЖХ. Фиг. 6 - пики, соответствующие соли L-тартрата производного пирролидина, в увеличенном масштабе. Фиг. 7 - хроматограмма продукта после распылительной сушки, полученная методом ВЭЖХ, на которой видно, что соль L-тартрата в соответствии с настоящим изобретением была выделена методом распылительной сушки без разложения. Фиг. 8 - график, показывающий типовое влагопоглощение соли тартрата в соответствии с настоящим изобретением в течение пяти суток при относительной влажности, равной 45, 58, 63 и 76%. Фиг. 9 - хроматограмма соли L-тартрата в соответствии с настоящим изобретением перед выдерживанием в камере с относительной влажностью 45% в течение 2 месяцев, полученная методом ВЭЖХ. Фиг. 10 - хроматограмма соли L-тартрата в соответствии с настоящим изобретением после выдерживания в камере с относительной влажностью 45% в течение 2 месяцев, полученная методом ВЭЖХ. Подробное описание изобретения Определения Если не указано иное, все технические и научные термины, встречающиеся в данном документе,имеют то же значение, которое обычно подразумевается при наличии соответствующей квалификации в области, к которой относится изобретение. Хотя для практической реализации изобретения можно применять методы и материалы, аналогичные или эквивалентные описанным здесь, ниже описаны пригодные методы и материалы. Все публикации, патентные заявки, патенты и прочие упомянутые здесь источники полностью включены в настоящий документ по ссылке. В настоящем описании приводятся основные определения некоторых терминов, и указанные определения являются более предпочтительными, чем другие в случае расхождений. Кроме того, материалы, методы и примеры приводятся для иллюстрации и не являются ограничительными. Другие признаки и преимущества настоящего изобретения станут очевидны из приведенного ниже подробного описания и формулы изобретения. Понятие "абсолютная конфигурация" в отношении асимметрического атома углерода определяется при рассмотрении тетраэдрического расположения связей при асимметрическом атоме углерода и присвоения старшинства от 1 до 4 каждой группе, связанной с асимметрическим атомом углерода, причем группа с максимальным атомным номером является самой старшей. Если на тетраэдр смотреть со стороны, удаленной от группы 4, то абсолютная R-конфигурация присваивается в случае, если группы 1-3 расположены по часовой стрелке, а абсолютная S-конфигурация - если группы 1-3 расположены против часовой стрелки. Термин "и/или" здесь относится к одному члену упомянутой группы или любому их сочетанию. Термин "или" является включительным, если не указано иное. Термин "обычные условия" включает температуры в интервале от приблизительно 15 до прибл.-2 017833 45 С, например 20, 25, 30, 35 С, и относительную влажность в интервале от приблизительно 20 до приблизительно 65%, например 25, 30, 35, 40, 45, 50, 55 и 60%. Термин "асимметрический атом углерода" относится к атому углерода, связанному ковалентными связями с четырьмя разными группами. Термин "деструкция бета-клеток" относится к нарушению функций бета-клеток, дисфункции бетаклеток, а также гибели бета-клеток, таких как некроз или апоптоз бета-клеток. Термин "Сахарный диабет и сходные состояния" относится к диабету 1 типа, диабету 2 типа, гестационному диабету, юношескому диабету MODY, нарушению толерантности к глюкозе, нарушению гликемии натощак, гипергликемии, нарушению метаболизма глюкозы, резистентности к инсулину, ожирению, осложнениям диабета и т.п. Термин "осложнения диабета" относится к состояниям, заболеваниям и расстройствам, связанным с диабетом, в том числе ретинопатии, невропатии, нефропатии, кардиомиопатии, дермопатии, артросклерозу, коронарно-артериальному заболеванию и другим известным осложнениям диабета. Термин "диастереомер" означает одно вещество из пары или более стереоизомеров, имеющих не менее двух асимметрических атомов углерода, т.е. эти стереоизомеры не являются зеркальными отражениями друг друга. Термины DPP-VII, DPP-VIII, DPP-IX и FAP означают соответственно аминодипептидилпептидазуVII, VIII, IX и белок, активирующий фибробласты. Ферменты DPP расщепляют N-концевые дипептидные фрагменты субстратовбелков или олигопептидов. В частности, термин "DPP-IV" обозначает дипептидилпептидазу IV (ЕС 3.4.14.5; DPP-IV), известную также как "CD-26". DPP-IV преимущественно расщепляет дипептид с N-конца полипептидной цепи, содержащей остаток пролина или аланина в предконцевом положении. Термин "энантиомер" означает одно соединение из пары стереоизомеров, имеющих одинаковое молекулярное строение и хотя бы один асимметрический атом углерода, так что стереоизомеры данной пары являются зеркальными отражениями друг друга. Если энантиомер содержит два или более асимметрических атома углерода, энантиомеры будут иметь разные конфигурации для каждого асимметрического атома углерода. Термин "свободное основание" относится к производному пирролидиниламиноацетилпирролидинборной кислоты формулы I или V, в котором аминогруппы не протонированы. Термин "группа, способная гидролизоваться с образованием гидроксильной группы" здесь означает сложноэфирную группу, образованную сочетанием алифатического или ароматического спирта либо диола и борной кислоты. Термин "ингибитор" (а также соответствующий глагол и причастие) означает соединение, в том числе и его соль, способное обратимо, необратимо или временно взаимодействовать с ферментом, восстанавливая или модифицируя его, и замедляя или блокируя его ферментативную активность по отношению к нормальному субстрату. Взаимодействие может происходить внутри или у активного центра фермента либо у аллостерического центра, связанного с ферментом. Используемый в данной публикации термин "N-защитная группа" или "N-защищенный" относится к группам, предназначенным для защиты N-конца аминокислоты или пептида или для защиты аминогруппы от нежелательных реакций в процессе синтеза. Наиболее распространенные N-защитные группы раскрыты в книге T.W. Greene, P. G. Wuts, "Protective Groups in Organic Synthesis, 3rd Ed" (Защитные группы в органическом синтезе, 3-е издание) (John WileySons, Нью-Йорк (1999, которая таким образом включена в данный документ по ссылке. К N-защитным группам относятся ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил, 4 бромбензоил, 4-нитробензоил, и аналогичные; сульфогруппы такие как бензолсульфонил, птолуолсульфонил и аналогичные; карбаминат-образующие группы такие как бензилоксикарбонил, пхлорбензилоксикарбонил,п-метоксибензилоксикарбонил,п-нитробензилоксикарбонил,2 нитробензилоксикарбонил,п-бромбензилоксикарбонил,3,4-диметоксибензилоксикарбонил,3,5 диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2 нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1 метилэтоксикарбонил, ,-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, третбутилоксикарбонил-диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил,аллилоксикарбонил,2,2,2,-трихлороэтоксикарбонил,феноксикарбонил,4 нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и аналогичные; алкильные группы такие как бензил, трифенилметил, бензилоксиметил и аналогичные; и силильные группы такие как триметилсилил и аналогичные. Предпочтительно N-защитные группы представляют собой формил, ацетил, бензоил, пивалоил, т-бутилацетил, фенилсульфонил, бензил, 9-флуоренилметилоксикарбонил (Fmoc), тбутилоксикарбонил (Воc) и бензилоксикарбонил (Cbz). Термин "оптически активный" относится к органическому соединению, содержащему хотя бы один-3 017833 асимметрический атом углерода, причем раствор такого органического соединения вращает плоскость поляризации плоскополяризованного света. Термин "оптически активная смесь" относится к смеси оптически активных соединений в растворе,способной вращать плоскость поляризации плоскополяризованного света. Оптически активная смесь может быть смесью диастереомеров либо смесью неравных количеств энантиомеров. Термин "пролекарство" означает фармацевтически приемлемое соединение, способное превращаться в активный ингредиент либо его активный метаболит после введения пролекарства в организм, предпочтительно млекопитающего, более предпочтительно человека. Указанное превращение представляет собой ферментативную реакцию, химический гидролиз, окисление, восстановление либо другой физиологический процесс in vivo, сопровождающийся химической или биохимической реакцией. Термин "рацемическая смесь" относится к смеси пары энантиомеров, присутствующих в равных количествах, так что вращение плоскости плоскополяризованного света взаимно компенсируется. Словосочетание "соль в соответствии с настоящим изобретением" относится к солям цитрата и тартрата производного пирролидиниламиноацетилпирролидинборной кислоты формулы I или V. В данном документе при употреблении единственного числа подразумевается и множественное и аналогично термин во множественном числе включает и единственное. Таким образом, "соль в соответствии с настоящим изобретением" относится к индивидуальному стереоизомеру, различным стереоизомерам и их смесям. Примерами солей в соответствии с настоящим изобретением, помимо прочего, являются (а) соли L-,D-, или мезо-тартрат (2R)-1-7-[(9R)-пирролидин-9-5-иламино]ацетилпирролидин-2-борной кислоты и их смеси, (b) L-, D-, или мезо-тартрат (2R)-1-7-[(9S)-пирролидин-9-иламино]ацетилпирролидин-2 борной кислоты и их смеси. Соль в соответствии с настоящим изобретением может также представлять собой соль цитрата (а) (2R)-1-7-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-борной кислоты; (b)(2R)-1-7-[(9S)-пирролидин-9-иламино]ацетил-10 пирролидин-2-борной кислоты; (с) их любую комбинацию. Термин "гигроскопичный" употребляется здесь для обозначения свойства твердого вещества самопроизвольно поглощать пары воды из влажного воздуха или газа, контактирующего с веществом. Твердое вещество "расплывается" ("разжижается"), если оно гигроскопично, и после поглощения достаточного количества водяных паров, растворяется в поглощенной воде. Термин "стереоизомер" относится к одной из абсолютных конфигураций индивидуальной органической молекулы, имеющей хотя бы один асимметрический атом углерода. Понятие стереоизомера включает энантиомеры и диастереомеры. Один стереоизомер характеризуется одной абсолютной конфигурацией по каждому из асимметрических атомов углерода органической молекулы. Органическая молекула с одним асимметрическим атомом углерода может существовать в виде двух стереоизомеров. Органическая молекула с двумя асимметрическими атомами углерода может существовать в виде четырех стереоизомеров. Органическая молекула с тремя асимметрическими атомами углерода имеет восемь стереоизомеров. При пропускании плоскополяризованного света через раствор, содержащий один стереоизомер, плоскость поляризованного света будет вращаться. Термин "стереомерная смесь" относится к смеси двух или более стереоизомеров и включает энантиомеры, диастереомеры и их сочетания. Стереомерная смесь может быть или не быть оптически активной. Термин "стереоизомерная чистота" с конкретной величиной в % означает, что определенный стереоизомер преобладает в смеси стереоизомеров на указанную величину. Если специально не указано иное, приведенные здесь определения для терминов химические группы, функциональные группы, фрагменты и химические реакции соответствуют определениям, данным в таких учебниках и монографиях по органической химии как Roberts и Caserio "Basic Principles of OrganicDictionary, 11 изд., ред.: Sax и Lewis, Van Nostrand, Reinhold, Нью-Йорк, 1987. Далее определения стереохимических терминов основаны на "Stereochemistry of Carbon Compounds" (Стереохимия соединений углерода), Ernest Eliel, McGraw-Hill, Нью-Йорк, 1962. Данные, раскрытые в указанных книгах, включены в данный документ по ссылке. Подробное описание Соли цитратов или тартратов соединения формулы (I), включая циклические изомеры, гидраты и сольваты, называемые здесь "солями в соответствии с настоящим изобретением", проявляют благоприятные свойства, благодаря которым являются полезными, помимо прочего, при изготовлении фармацевтических составов для лечения диабета. К указанным свойствам относится, например, биологическая активность в отношении ингибирования in vivo DPP-IV, хороший выход при синтезе, хорошая растворимость и скорость растворения в воде или жидкостях организма, а также физическая и химическая стабильность в обычных условиях в течение длительного времени, что удобно для обработки солей в соответствии с настоящим изобретением, приготовления составов, хранения и применения.-4 017833 Данное изобретение включает неожиданное открытие того факта, что соли цитрата или тартрата производного пирролидиниламиноацетилпирролидинборной кислоты, например соли цитрата или тартрат 1-7-пирролидин-9-иламино]ацетилпирролидин-2-борной кислоты, соединение формулы (I), являющееся селективным ингибитором дипептидилпептидазы IV, обладает хорошей физической стабильностью в твердом виде, благоприятно для обработки, приготовления составов, хранения и приема. Было показано, что свободные основания соединений формулы (I), такие как соединения формул (IA) и (IB), и ряд других солевых форм имеют низкую физическую стабильность при обычных условиях. Свободное основание и соли свободного основания с рядом органических кислот существуют либо в виде масел,либо расплывающихся твердых веществ. Из приведенной ниже табл. 1 видно, что свободные основания и ряд других солей соединения формулы (I), где R2 и R3 - одновременно гидроксильные группы, не образуют твердых веществ либо, если твердые вещества и образуются, то они расплываются при обычных условиях, и таким образом не могут быть использованы для создания твердых лекарственных форм. Соли цитратов и тартратов в соответствии с настоящим изобретением легко образуют твердые вещества. Более того, указанные вещества не расплываются на воздухе и остаются пригодными для обработки в обычных условиях. При комнатной температуре и влажности менее 70%, например при относительной влажности 63%, хотя соль в соответствии с настоящим изобретением и может сначала поглотить немного воды, но водопоглощение выходит на плато и в состоянии равновесия соль остается сухим порошком, что позволяет создавать твердые лекарственные формы. Таким образом, цитрат и тартрат в соответствии с настоящим изобретением обладают хорошей физической стабильностью, так как, хотя они и поглощают некоторое количество атмосферной влаги, но остаются физически и химически стабильными твердыми веществами. Поэтому они особенно хорошо приспособлены для приготовления таблеток и капсул, а также других твердых фармацевтических составов. Эти соли в соответствии с настоящим изобретением характеризуются также хорошей технологичностью, так как не являются клейкими, вследствие чего возможно измерение и дозировка точных и воспроизводимых количеств солей. Таким образом, свойства солей в соответствии с настоящим изобретением благоприятны для приготовления различных фармацевтических составов. Как показано в табл. 5 и обсуждается ниже, соли в соответствии с настоящим изобретением можно в течение длительного времени, не менее 12 месяцев, хранить при обычных условиях в присутствии атмосферной влаги без существенного разложения. Осуществление настоящего изобретения представляет собой соль цитрата или тартрата производного пирролидиниламиноацетилпирролидинборной кислоты формулы (I) - соль в соответствии с настоящим изобретением. Солью в соответствии с настоящим изобретением может быть любая комбинация стереоизомеров кислоты и свободного основания. Термин "кислота" здесь относится к цитрату или тартрату, а термин "свободное основание" или "производное пирролидина" относится к пирролидиниламиноацетилпирролидинборной кислоте. Цитрат не является хиральным соединением, в отличие от тартрата, а тартрат может существовать в виде L-тартрата, D-тартрата, мезо-тартрата, а также стереомерной смеси, например, рацемической смеси, диастереомерной смеси, смеси пары энантиомеров и диастереомера или оптически активной смеси хотя бы двух стереоизомеров. Производное пирролидина может иметь линейное или циклическое строение в соответствии с формулой (I) или (V). Предпочтительное производное пирролидина (2R)-1-7-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-борная кислота или (2R)-1-7-[(9S)-пирролидин-9-иламино]-ацетилпирролидин-2-борная кислота. Таким образом,предпочтительной солью в соответствии с настоящим изобретением является цитрат или тартрат (2R)-17-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-борной кислоты или (2R)-1-7-[(9S)-пирролидин 9-иламино]ацетилпирролидин-2-борной кислоты. Точнее, предпочтительной солью в соответствии с настоящим изобретением является соль где R2 и R3 - гидроксильные группы. Соль в соответствии с настоящим изобретением имеет улучшенные физические свойства, позволяющие легко выделять твердые продукты и готовить твердые лекарственные формы. Напротив, соответствующие свободные основания расплываются на воздухе при обычных условиях. Было обнаружено также, что многие изученные соли (см. табл. 1) не образуют твердыхвеществ либо, если твердые вещества и образуются, то они расплываются на воздухе при обычных условиях или превращаются в клейкие трудноперерабатываемые материалы. Неожиданно две соли органических кислот - соли тартрата и цитрата - свободного основания не-5 017833 проявляют физической и химической нестабильности, наблюдаемой для других солей. Соли в соответствии с настоящим изобретением, например предпочтительная соль моно (2R,3R)-винной кислоты (Lвинной кислоты) и 1-7-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-борной кислоты, легко образуют твердые продукты и не расплываются при обычных условиях. Соли в соответствии с настоящим изобретением проявляют улучшенную физическую стабильность, в частности стабильны в условиях высокой температуры и влажности. Ниже приведена табл. 5, из которой видно, что образцы L-тартрата (2R)-1-7-[(9R)-пирролидин-9 иламино]ацетилпирролидин-2-борной кислоты хранили в течение длительного времени при сравнительно высокой относительной влажности (ОВ); например, хранение в течение 6 месяцев при ОВ 75% и в течение 12 месяцев при ОВ 60% (в обоих случаях при 25 С) не привело к обнаруживаемому разложению в пределах статистической ошибки. Гидратированная форма соли тартрата или цитрата пригодна для приготовления лекарственных форм. С этой целью соли по данному изобретению оставляют при обычных условиях до получения равновесного гидрата. Массу поглощенной воды в гидрате можно определить и учесть в последующих операциях, что позволяет точно рассчитывать необходимую дозировку соли. Атмосферные условия, в которых осуществляется приготовление фармацевтических препаратов, должным образом контролируются для обеспечения точного и воспроизводимого количества активного соединения в ходе технологического процесса. После приготовления лекарственной формы воздействие переменной влажности не повлияет на дозирование соли, хотя общая масса индивидуальной твердой лекарственной формы и может меняться в результате дальнейшего поглощения или десорбции воды. Пример 5 и табл. 3, приведенные ниже,иллюстрируют тактику приготовления препарата точного состава в зависимости от поглощения воды. Настоящее изобретение включает соли цитратов и тартратов всех стереоизомеров производного пирролидина формулы (I), в том числе энантиомеров, диастереомеров, а также рацематов и стереоизомерных смесей. Смеси могут быть или не быть оптически активными. В некоторых вариантах осуществления настоящего изобретения соль в соответствии с настоящим изобретением имеет оптическую чистоту хотя бы 55%, предпочтительно 80%, более предпочтительно 90%, наиболее предпочтительно 98%. В других вариантах осуществления настоящего изобретения соль является оптически обогащенным энантиомером тартрата и/или производного пирролидина. В других вариантах осуществления изобретения соль представляет собой смесь стереоизомеров, включая, помимо прочего, смеси неравных количеств энантиомеров и/или смеси диастереомеров тартрата и/или производного пирролидина. Методы лечения Осуществление настоящего изобретения представляет собой способ ингибирования дипептидилпептидазы-IV, заключающийся в контактировании фермента дипептидилпептидазы-IV с солью в соответствии с настоящим изобретением в любой форме, как описано выше. Контакт может осуществлятьсяin vitro, например, в виде диагностического или скрининг теста или in vivo при использовании соответствующего способа введения, которые обсуждаются ниже. Методы in vivo в соответствии с настоящим изобретением включают соль в соответствии с настоящим изобретением в качестве селективного ингибитора DPP-IV. Например, настоящее изобретение предлагает способ лечения млекопитающего (в частности, человека) от расстройств, поддающихся регулированию или нормализации за счет ингибирования DPP-IV. Способ в соответствии с настоящим изобретением осуществляется путем введения в организм млекопитающего (напр., человека) эффективного количества соли в соответствии с настоящим изобретением с целью лечения, уменьшения интенсивности или профилактики расстройства. Воздействие осуществляется путем ингибирования DPP-IV. Введение обычно проводится в результате применения фармацевтической композиции, содержащей соль в соответствии с настоящим изобретением. Для применения in vivo в качестве DPP-IV ингибитора соль в соответствии с настоящим изобретением может быть включена в лекарственный препарат, как описано в данном документе. Лечение солями в соответствии с настоящим изобретением предлагается для расстройств, поддающихся регулированию или нормализации за счет ингибирования DPP-IV. Известно, что указанные расстройства являются следствием, по крайней мере частично, снижения количества, отсутствия или изменения активности пептидов, регулируемых ферментом DPP-IV, особенно в отношении его физиологической роли в гликемическом контроле. Таким образом, указанные расстройства включают заболевания,связанные с нарушением гликемического контроля, такие как сахарный диабет и сходные состояния. Например, расстройство представляет собой диабет 1 типа, диабет 2 типа, гестационный диабет, юношеский диабет MODY, нарушение толерантности к глюкозе, нарушению гликемии натощак, гипергликемию, нарушение метаболизма глюкозы, нарушение толерантности к глюкозе (НТГ) и ее прогрессирование в диабет 2 типа, гиперинсулинемию, ожирение, деструкцию бета-клеток (в частности, апоптоз бетаклеток), прогрессирование инсулинонезависимого диабета 2 типа до инсулинозависимого диабета 2 типа; потерю количества и/или размера бета-клеток в организме млекопитающего, а также осложнения диабета, такие как ретинопатия, невропатии, нефропатии, кардиомиопатии, дермопатии, инфекции, вызванные диабетом, артросклероз, коронарно-артериальное заболевание, нарушение мозгового кровообращения и т.п.-6 017833 В другом варианте осуществления способа лечения в соответствии с настоящим изобретением, расстройство, поддающееся регулированию или нормализации за счет ингибирования DPP-IV, подразумевает резистентность к инсулину . Например, расстройством может быть нарушение гликемии натощак, нарушение толерантности к глюкозе, синдром поликистоза яичников и т.п. В еще одном варианте осуществления расстройство, поддающееся регулированию или нормализации за счет ингибирования DPP-IV,включает снижение островкового неогенеза, выживаемости -клеток или биосинтеза инсулина. Соль в соответствии с настоящим изобретением можно вводить в организм млекопитающего, особенно человека, нуждающегося в таком лечении, профилактике, устранении, уменьшении интенсивности или ослаблении упомянутых выше расстройств. К таким млекопитающим относятся, помимо прочего,домашние животные, как комнатные, так и сельскохозяйственные, а также дикие животные. Количество соли для введения пациенту - это любое количество, достаточное для ингибированияDPP-IV, приводящее к лечению состояния и полезному воздействию на пациента. Количество соли для введения может быть эффективной дозой или ее частью. Указанное количество зависит от индивидуальных показателей пациента - возраста, физического состояния, размеров, массы тела, состояния, подлежащего лечению, тяжести состояния и другого лечения, проходящего одновременно. Факторы, определяющие дозировку, хорошо известны специалистам и могут быть установлены обычным опытным путем на основе квалификации и знаний лечащего врача. Например, определение фармакокинетических и фармакодинамических свойств может быть проведено с помощью стандартных химических и биологических методов анализа и методов математического моделирования, известных в области фармакологии. Терапевтическая польза и режим дозирования могут быть определены экстраполированием полученных результатов и с помощью соответствующих фармакокинетических и/или фармакодинамических моделей. Доза для введения производного пирролидина в соответствии с настоящим изобретением подбирается в соответствии с возрастом, массой тела и состоянием пациента, а также в зависимости от способа введения, лекарственной формы и режима и ожидаемого результата. Окончательный выбор дозировки,способа приема и состава фармацевтического препарата может сделать лечащий врач, чье мастерство и знания позволяют руководить процессом. Однако пациент может настаивать на меньшей дозе или лучше переносимой дозе по медицинским, психологическим либо иным причинам. Предпочтительно соль в соответствии с настоящим изобретением вводится в дозировке от 0,1 до 30 мг соли на 1 кг веса млекопитающего, более предпочтительно от 2 до 15 мг/кг массой тела млекопитающего. Дозировка для взрослого человека обычно находится в интервале от приблизительно 0,5 до приблизительно 2400 мг/сут., предпочтительно от приблизительно 10 до 1050 мг/сут., более предпочтительно от приблизительно 50 мг до приблизительно 750 мг/сут. Это количество может быть введено в один прием либо в несколько приемов (до 4 раз в день). Указанные дозы основаны на массе только свободного основания. Для получения реальной массы гидратированной формы соли, предназначенной для введения, вводятся поправки на вклады массы компонентов винной или лимонной кислоты и гидратной воды. В некоторых случаях полезно начать с более высокой дозы, а когда состояние будет находиться под контролем, снижать ее. Например, может быть целесообразно назначить в первый день дозу от приблизительно 70 до приблизительно 2400 мг, а в последующие дни - более низкую дозу, от приблизительно 20 до приблизительно 1200 мг. В других случаях полезно начать терапию с более низкой дозы, а затем при необходимости ее увеличить. Точная дозировка зависит от способа приема, от требуемой терапии, от формы препарата, от пациента и массы тела пациента, а также от предпочтения и опыта ответственного врача или ветеринара. Дозировка определяется в расчете на свободное основание и корректируется на соответствующую соль - цитрат или тартрат. Применение соли в соответствии с настоящим изобретением включает также производство лекарственного средства и способ лечения указанным лекарственным средством в форме комбинированного фармацевтического препарата и/или фармацевтической композиции. Комбинированные фармацевтические препараты и их применение для лечения Соль в соответствии с настоящим изобретением можно комбинировать со вторым лекарственным средством с образованием комбинированного фармацевтического препарата в соответствии с настоящим изобретением. Вторым лекарственным средством является известный препарат для лечения, контроля или профилактики расстройств, поддающихся регулированию или нормализации за счет ингибированияDPP-IV. Такие составы применяются для лечения расстройств, поддающихся регулированию или нормализации за счет ингибирования DPP-IV. Второе лекарственное средство может быть также терапевтически эффективным количеством известного антидиабетического средства, включая, помимо прочего, агент, повышающий секрецию инсулина, агент, повышающий чувствительность инсулина, агент, снижающий усвоение сахара из ЖКТ,агент, усиливающий действие эндогенных пептидов или белков, влияющих на гликемический контроль,либо агент, применяемый в заместительной терапии эндогенных пептидов или белков, играющих известную роль в гликемическом контроле. К числу таких агентов относятся, в частности, глибенкламид (например, Micronase и Diabeta), глипизид (например, глюкотрол), натеглинид (например, старликс), репаглинид (например, прандин), метформин (например, глюкофаг), росиглитазон (например, авандия), акарбоза (например, Precose), миглитол (например, Glyset), эксенатид (например, Byetta) и инсулин (напри-7 017833 мер, хумулин и новолин). К дополнительным агентам в частности относятся, например, бигуаниды,хлорпропамиды, глюкагоноподобный пептид-1 (GLP-1) или их миметики, такие как LY315902 илиLY307161, глимепирид, меглитинид, фенформин, пиоглитазон, сульфонилмочевины, троглитазон, G1262570, изаглитазон, JTT-501, NN-2344, L895645, YM-440, R-119702, AJ9677, KAD1129, APR-H039242,GW-409544, KRP297, АС 2993, эксендин-4 и NN2211. Химическая структура, тривиальные названия и фармакологические исследования указанных выше соединений, обозначенных буквами и цифрами, легко доступны в сети интернет, например, если ввести буквенное/цифровое обозначение в качестве строки поиска в поисковой системе GOOGLE. Соль в соответствии с настоящим изобретением можно применять в сочетании с одним антидиабетическим лекарственным средством (которое используют при лечении диабета и родственных заболеваний) или большим числом таких средств. Второе лекарственное средство можно вводить перорально в одной лекарственной форме с солью в соответствии с настоящим изобретением, или в отдельной лекарственной форме для приема внутрь. Соль в соответствии с настоящим изобретением и второе лекарственное средство можно вводить также, например, в форме инъекции, отдельно, одновременно или в виде смеси. Комбинированный фармацевтический препарат в соответствии с настоящим изобретением может быть включен в фармацевтическую композицию, содержащую фармацевтически приемлемый носитель,соль в соответствии с настоящим изобретением и одно или более второе лекарственное средство. В комбинированном фармацевтическом препарате в соответствии с настоящим изобретением соль в соответствии с настоящим изобретением обычно содержится в массовом отношении ко второму лекарственному средству от приблизительно 0,01 : 1 до приблизительно 200 : 1 в зависимости от конкретного выбора второго лекарственного средства. Применение соли в соответствии с настоящим изобретением в сочетании с одним или более дополнительным антидиабетическим препаратом может привести к более значительному антигипергликемическому эффекту, чем это возможно с каждым из этих препаратов по отдельности. Применение соли в соответствии с настоящим изобретением в сочетании с одним или более дополнительным антидиабетическим препаратом может привести также к синергетическому действию, заключающемуся в том, что антигипергликемическое действие будет сильнее, чем суммарное антигипергликемическое действие обоих антидиабетических препаратов. Эффективное количество второго лекарственного средства - компонента комбинированного фармацевтического препарата в соответствии с настоящим изобретением - выбирается на основе рекомендаций производителя второго лекарственного средства, суждения лечащего врача, а также правил и административных указаний по дозировкам и информации, приведенной в Настольном справочнике врача (PHYSICIAN'S DESK REFERENCE, PDR). Доза соли в соответствии с настоящим изобретением в составе комбинированного фармацевтического препарата тщательно подбирается, в зависимости от возраста, массы тела и состояния пациента, а также способа приема, лекарственной формы, режима и желаемого результата. Окончательный выбор дозировки, способа приема и фармацевтического состава определяется лечащим врачом, чье мастерство и знания позволяют руководить процессом. Описанные выше композиции можно вводить в виде лекарственных форм, как описано выше, единовременно или в несколько приемов, от одного до четырех раз в день. Может оказаться целесообразным начать терапию с более низкой дозы комбинированного фармацевтического препарата и постепенно повышать дозу. Фармацевтические композиции в соответствии с настоящим изобретением Настоящее изобретение включает фармацевтическую композицию, содержащую соль в соответствии с настоящим изобретением, с еще одним лекарственным средством, как описано выше, или без него и фармацевтический носитель. Фармацевтическая композиция может включать один или несколько носителей, таких как обычные твердые или жидкие связующие и разбавители и фармацевтические добавки в зависимости от выбранного способа применения. Соль в соответствии с настоящим изобретением в составе фармацевтической композиции можно вводить млекопитающим, особенно человеку, перорально,трансбуккально, перректально, интрапульмонально и т.п., например, в форме таблеток, капсул, гранул или порошков. Введение осуществляется парентерально или в форме инъекций. Возможно трансдермальное введение либо с помощью пластыря для трансдермальной подачи либо методом электротранспорта с помощью соответствующего подающего устройства. Фармацевтическую композицию, содержащую соль в соответствии с настоящим изобретением, готовят обычными методами, например, как описано в книге "Remington: The Science и Practice of Pharmacy", изд. 19, 1995. Композиция может выпускаться в стандартной форме: например, капсулы, таблетки, аэрозоль, раствор, суспензия или в форме, пригодной для местного применения. Типовая фармацевтическая композиция содержит соль в соответствии с настоящим изобретением в смеси с фармацевтически приемлемым носителем, представляющим собой инертный наполнитель или разбавитель, а также может быть инкапсулирована внутри носителя, представляющего собой жидкость,капсулу, саше, таблетку, бумажный или другой контейнер. При изготовлении композиции используют-8 017833 обычные методы изготовления фармацевтических композиций. Например, соль в соответствии с настоящим изобретением может быть смешана с носителем, разбавлена носителем, либо инкапсулирована внутри носителя, который может представлять собой ампулу,капсулу, саше, таблетку, бумажный или другой контейнер. Если носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом, играющим роль связующего, наполнителя или среды для активного соединения. Соль может быть адсорбирована на твердом гранулированном контейнере, например саше. Некоторые, без ограничения перечисленные, примеры твердых носителей - это вода, солевые растворы, спирты, полиэтиленгликоли, полигидроксиэтоксилированное касторовое масло,арахисовое масло, оливковое масло, желатин, лактоза, сульфат кальция, сахароза, декстрин, карбонат магния, сахар, циклодекстрин, амилоза, стеарат магния, тальк, агар, пектин, камедь, стеариновая кислота или низшие алкиловые эфиры целлюлозы, кремневая кислота, жирные кислоты, амины жирных кислот,моно- и диглицериды жирных кислот, эфиры пентаэритрита и жирных кислот, полиоксиэтилен, гидроксиметилцеллюлоза и поливинилпирролидон. Аналогично, к числу носителей или разбавителей может относиться любой материал замедленного высвобождения, известный в данной области, такой как глицерилмоностеарат или глицерилдистеарат, в индивидуальном виде или в смеси с парафином. Состав может быть смешан с дополнительными агентами, которые не вступают в нежелательное взаимодействие с производным пирролидина. Такие добавки являются, помимо прочего, смачивающими агентами, эмульгирующими и суспендирующими агентами, солями, влияющими на осмотическое давление, буферными и/или окрашивающими веществами, консервирующими средствами, подслащивающими веществами или ароматизаторами. Фармацевтическая композиция может при необходимости быть стерилизована. Способ введения лекарственного средства может быть любым, обеспечивающим эффективный транспорт соли в соответствии с настоящим изобретением к соответствующему или желаемому месту воздействия, например пероральный, интраназальный, интрапульмональный, трансбуккальный, перректальный, субдермальный, интрадермальный, трансдермальный или пролонгированная инъекция, подкожный, внутривенный, внутриартериальный, внутримышечный, интраназальный, офтальмический раствор или мазь, причем предпочтительным является пероральный способ введения. Если для перорального приема применяется твердый носитель, препарат может выпускаться в виде таблеток, в виде порошка или гранул в твердой желатиновой капсуле, или в виде пастилок или ромбовидных таблеток. В случае жидкого носителя препарат может быть в виде сиропа, эмульсии, мягкой желатиновой капсулы или в виде стерильной жидкости для инъекций, такой как водная или неводная суспензия или раствор. К лекарственным формам для инъекций обычно относятся водные суспензии или масляные суспензии, для которых применяют соответствующий дисперсант или смачивающее средство и суспендирующее средство. Формы для инъекций могут представлять собой раствор или суспензию, которые готовят с помощью растворителя или разбавителя. К приемлемым растворителям или связующим относятся стерилизованная вода, раствор Рингера или водный изотонический раствор. Помимо этого в качестве растворителя или суспендирующего агента можно применять стерильное масло. Предпочтительно масло или жирная кислота являются нелетучими, могут представлять собой натуральное или синтетическое масло, жирную кислоту, моно-, ди- или триглицерид. Фармацевтическая композиция для инъекций может представлять собой порошок, пригодный для восстановления соответствующим раствором, как описано выше. Примерами, помимо прочего, являются порошки сублимационной, распылительной и барабанной сушки, аморфные порошки, гранулы, осадки или дисперсные частицы. Для инъекции фармацевтическая композиция может содержать, но не обязательно содержит стабилизаторы, модификаторы рН, поверхностно-активные вещества, модификаторы биодоступности и их сочетания. Соль в соответствии с настоящим изобретением может входить в состав препарата для парентерального введения путем инъекции, такой как болюсное вливание или непрерывная инфузия. Лекарственная форма для инъекций может быть упакована в ампулы (для единичной инъекции, либо в сосуды (для многократных инъекций). Фармацевтическая композиция в соответствии с настоящим изобретением может быть предназначена для обеспечения быстрого, замедленного или задержанного высвобождения активного ингредиента после введения пациенту, что достигается известными в данной области методами. Так фармацевтическая композиция может быть составлена для управляемого или медленного высвобождения. Фармацевтическая композиция в соответствии с настоящим изобретением может включать, например, мицеллы или липосомы, или другую инкапсулированную форму или может быть изготовлена в форме для замедленного высвобождения или с кишечно-растворимым покрытием для обеспечения длительного действия и/или доставки. В связи с этим фармацевтическая композиция может быть спрессована в форме гранул или цилиндров и имплантирована внутримышечно или подкожно в виде инъекции замедленного действия или в виде имплантата, такого как стент. В таких имплантатах возможно применение известных инертных материалов, таких как силиконы и биоразлагаемые полимеры, например, полилактид-полигликолида. Другие примеры биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды).-9 017833 Соль в соответствии с настоящим изобретением может быть сформирована в виде имплантата с замедленным высвобождением или имплантируемого материала, пригодного для непрерывного введения в течение значительного периода времени. Типичные имплантаты с замедленным высвобождением формируют из фармацевтически приемлемых биоразлагаемых полимеров, таких как полимеры и сополимеры молочной кислоты, лактида, гликолевой кислоты, гликолида, капроновой кислоты и капролактона. Дозировка и количество соли в соответствии с настоящим изобретением в имплантате определяется из расчета установления необходимого уровня соли в крови. Для интраназального введения фармацевтическая композиция может содержать соль в соответствии с настоящим изобретением в виде раствора или суспензии в жидком носителе, в частности, в водном носителе, для аэрозольного введения. Носитель может содержать добавки, такие как солюбилизирующие агенты, например пропиленгликоль, поверхностно-активные вещества, усилители всасывания, такие как лецитин (фосфатидилхолин) или циклодекстрин, или стабилизаторы, такие как парабены. Для парентерального применения оптимальными являются растворы или суспензии для инъекций,предпочтительно водные растворы, где соль в соответствии с настоящим изобретением растворена в полигидроксилированном касторовом масле. Таблетки, драже или капсулы с тальком и/или углеводом в качестве носителя, связующего и т.п. оптимальный вариант для перорального применения. Предпочтительными носителями для таблеток,драже или капсул являются лактоза, кукурузный крахмал и/или картофельный крахмал. В случае, если возможно применение подслащенного связующего, можно применять также сироп или эликсир. Типовую таблетку можно приготовить по обычной технологии следующим образом. Типовая таблетка эффективности 400 мг в расчете на свободное основание готовится на основе 650 мг соли L-тартрата, 215 мг микрокристаллической целлюлозы, 50 мг двузамещенного фосфата кальция,20 мг кополивидона, 50 мг кросповидона, 10 мг коллоидного диоксида кремния, 5 мг стеарата магния и 3% твердого Opadry AMB. Другой типовой состав таблетки эффективности 50 мг в расчете на свободное основание включает 80 мг соли L-тартрата, 815 мг микрокристаллической целлюлозы, 50 мг двузамещенного фосфата кальция, 20 мг кополивидона, 20 мг кросповидона, 10 мг коллоидного диоксида кремния, 5 мг стеарата магния и 3% твердого Opadry AMB. Соль измельчают и просеивают через сито 20 меш. После измельчения и просеивания соль смешивают с микрокристаллической целлюлозой, кополивидоном, кросповидоном и коллоидным диоксидом кремния в соответствующем V-образном смесителе при определенной скорости вращения и в течение определенного времени. Полученный состав смешивают со смазывающим агентом - стеаратом магния. Прессование таблеток осуществляют из полученной смеси при теоретической массе таблетки 1000 мг. Часть прессованных таблеток покрывают оболочкой с помощью материала Opadry AMB. Нанесение покрытия продолжают до тех пор, пока не достигнуто заданное увеличение массы. Типовая капсула для перорального приема содержит соль в соответствии с настоящим изобретением (200 мг в расчете на свободное основание), лактозу (75 мг) и стеарат магния (15 мг). Смесь пропускают через сито с размером ячеек 60 меш и помещают в желатиновые капсулы 1. Для приготовления типового препарата для инъекций соль в соответствии с настоящим изобретением (200 мг в расчете на свободное основание) помещают в асептических условиях в ампулу, подвергают сублимационной сушке в асептических условиях и запаивают. Для применения содержимое ампулы смешивают с 2 мл физиологического раствора, получая таким образом препарат для инъекций. Для соли в соответствии с настоящим изобретением возможен выпуск в виде единичной лекарственной формы, содержащей от приблизительно 0,5 до приблизительно 2000 мг активного ингредиента и фармацевтически приемлемый носитель на однократную дозу. Обычно лекарственная форма для перорального, интраназального, интрапульмонального или трансдермального применения содержит от приблизительно 0,5 до приблизительно 2000 мг, предпочтительно от приблизительно 10 до приблизительно 1000 мг в 1 сутки, более предпочтительно от приблизительно 50 до приблизительно 750 мг соли (в расчете на свободное основание), смешанной с фармацевтически приемлемым носителем или разбавителем. Исследования высвобождения лекарственного вещества из таблеток, изготовленных в соответствии с настоящим изобретением, показали успешную доставку производного пирролидина. Образцы таблеток испытывали на текучесть, твердость, распадаемость и высвобождение лекарственного вещества. В частности, текучесть оценивали на основании индекса Карра и визуально для смесей, содержащих смазывающий агент. Прессованные таблетки имели удовлетворительную твердость, равную приблизительно 12 кП. Таблетки показали также удовлетворительное время распада - менее 15 мин. По данным без сравнения в контролируемых условиях высвобождение in vitro было удовлетворительным - более 90% за 30 мин. При приготовлении фармацевтического препарата, содержащего соль в соответствии с настоящим изобретением, следует учитывать физические свойства соли. Например, соль L-тартрата оставалась в твердом состоянии, пригодном для обработки, в течение нескольких дней при обычной температуре и относительной влажности 75%. Он также обладал улучшенной химической стойкостью по отношению к свободному основанию при 25 С/ОВ 60%, 40 С/ОВ 75% и 60 С/влажность окружающей среды, и оставался пригодным к обработке при комнатной температуре и относительной влажности 63% в течение- 10017833 двух месяцев. Следовательно, в ходе приготовления фармацевтических препаратов, содержащих соль в соответствии с настоящим изобретением, следует выбирать и контролировать температуру и относительную влажность. Если выбрана температура окружающей среды, например, соль в соответствии с настоящим изобретением может находиться при умеренной влажности, т.е. при относительной влажности ниже 65% или предпочтительно ниже 60 %. Далее, хотя соль в соответствии с настоящим изобретением физически стабильна при обычных условиях, следует учитывать ее гигроскопичность. При приготовлении фармацевтических препаратов, содержащих соль в соответствии с настоящим изобретением, следует использовать гигроскопически стабильные формы соли. Соль в соответствии с настоящим изобретением гигроскопически стабильна, если ее масса остается постоянной при определенной температуре и относительной влажности. Таким образом, перед измерением количества, соль в соответствии с настоящим изобретением должна быть приведена в равновесие при соответствующей температуре и влажности. Далее, при взвешивании или ином измерении количества соли в соответствии с настоящим изобретением в ходе приготовления фармацевтической композиции следует учитывать количество поглощенной воды. Например, для достижения заданной эффективной дозы соль в соответствии с настоящим изобретением приводят в равновесие при выбранной температуре и влажности и определяют массу гидратной воды. Определение количества воды и внесение соответствующей массовой поправки дают реальное количество соли, необходимое для получения выбранной эффективной дозы. Если в составе таблетки или капсулы содержится разрыхлитель, состав должен быть подобран и приготовлен таким образом, чтобы избежать преждевременного разрушения и распада таблетки или капсулы в результате взаимодействия разрыхлителя с водой, поглощенной солью. Комбинированный фармацевтический препарат в соответствии с настоящим изобретением также может быть изготовлен в виде фармацевтической композиции, включающей все осуществления настоящего изобретения, носители, выбор способа приема и т.п., описанные выше для получения фармацевтической композиции на основе только соли. Настоящее изобретение предполагает также пролекарства солей в соответствии с настоящим изобретением, которые при попадании в организм подвергаются химическому превращению в результате процессов метаболизма, и таким образом образуют фармакологически активные вещества. В общем случае, такие пролекарства представляют собой функциональные производные соли в соответствии с настоящим изобретением, которые легко превращаются in vivo в указанную соль. Обычные методики для выбора и получения соответствующих пролекарств описаны, например, в книге "Design of Prodrugs" ред. Н. Bundgaard, Elsevier, 1985. Таким образом, еще одним аспектом изобретения является фармацевтическая композиция соли в соответствии с настоящим изобретением, взятой индивидуально или в комбинации с антидиабетическим агентом другого типа и/или терапевтическим препаратом другого типа. Дополнительные осуществления настоящего изобретения представлены: (1) фармацевтической композицией, содержащей соль в соответствии с настоящим изобретением, как описано выше, и хотя бы один фармацевтически приемлемый носитель или разбавитель; (2) способами приготовления фармацевтической композиции соли в соответствии с настоящим изобретением, в которых фармацевтически приемлемый носитель или разбавитель пригоден для перорального применения; (3) способами приготовления фармацевтической композиции соли в соответствии с настоящим изобретением, пригодными для перорального применения, включающими дополнительно стадию формирования композиции в форме таблетки или капсулы; (4) способами приготовления фармацевтической композиции соли в соответствии с настоящим изобретением, в которых фармацевтически приемлемый носитель или разбавитель пригоден для парентерального применения; (5) способами приготовления фармацевтической композиции соли в соответствии с настоящим изобретением, пригодными для парентерального применения, включающими дополнительно стадию сублимационной сушки композиции с образованием лиофилизированного препарата. Ингибирующую активность соли в соответствии с настоящим изобретением по отношению к DPPIV можно определить с помощью системы испытаний in vitro. Константы ингибирования (Ki или IC50) для ингибиторов DPP-IV в соответствии с настоящим изобретением определяют методом, описанным ниже. Методы получения соли в соответствии с настоящим изобретением Осуществление настоящего изобретения включает также способ получения соли в соответствии с настоящим изобретением. Получение производного пирролидина в виде свободного основания описано в Патентной заявке США, серийный 60/704380, дата подачи 1.08.2005 и в Патентной заявке США, серийный 10/514575, дата подачи 15.11.2004. Общая схема синтеза соли тартрата в соответствии с настоящим изобретением приведена ниже (схема 1) Соль в соответствии с настоящим изобретением можно получить непосредственно как продукт синтеза, как показано выше на схеме (см. стадию 8) и подробно описано ниже в примере 4. Помимо этого,свободное основание можно растворить в подходящем растворителе, после чего выделить соль упариванием растворителя. Рекомендуемым растворителем является, например, гидроксилсодержащий органический растворитель, или полярный апротонный органический растворитель, или вода. Упаривание растворителя можно осуществить различными способами, в том числе, помимо прочего, методом распылительной или сублимационной сушки, также применимы и другие методы, приводящие к отделению соли от растворителя, например, осаждение. Так, пример метода получения соли в соответствии с настоящим изобретением включает, помимо прочего, растворение свободного основания в алканоле с 1-6 атомами углерода, содержащем заданное количество соответствующей кислоты, например стехиометрическое количество лимонной или винной кислоты, а затем соль можно выделить упариванием растворителя. В качестве альтернативы, кислоту можно добавлять к раствору свободного основания, а затем выделять соль удалением растворителя. Кроме того, способы получения фармацевтически приемлемой соли из производного амина, например производного пирролидина в соответствии с настоящим изобретением,хорошо известны в данной области. См., например, "The Practice of Medicinal Chemistry, Second Edition"(Практическая медицинская химия второе издание), авт. Camille G. Wermuth, Academic Press, Нью-Йорк,1996. Далее изобретение раскрывается в приведенных ниже примерах, которые не ограничивают область настоящего изобретения, приведенную в формуле изобретения. Примеры Получение и биологическая активность свободного основания приведены в Патентной заявке США, серийный 11/381085, дата подачи 1.05.2006, которая включена в данный документ по ссылке. Пример 1. Получение соли Для получения или при попытках получения различных солей производного пирролидина формулыI (см. фиг. 1) использовали следующую методику. В колбу емкостью 1 л помещали 50 ммоль свободного основания в атмосфере азота и прибавляли 250 мл изопропилового спирта (ИПС). Реакционную смесь перемешивали в течение 20-30 мин до полного растворения. В другую колбу на 500 мл помещали в атмосфере азота 50 ммоль соответствующей кислоты (винной или лимонной), а затем прибавляли 250 мл ИПС. Смесь осторожно нагревали до 30 С и перемешивали в течение 10-20 мин до растворения. Раствор- 12017833 кислоты быстро прибавляли к раствору свободного основания, реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч и фильтровали. Осадок на фильтре сушили на воздухе в течение 0.5 ч, промывали в 150 мл метил-трет-бутилового эфира (МТБЭ), сушили на воздухе в течение 1-2 ч, после чего оставляли на ночь в вакуумной печи при 40-50 С. Проводились попытки получения других солей: ацетата, адипата, 10-камфорсульфоната, цитрата,деканоата, гидробромида, L-аскорбината, L-глутамата, L-лактата, L- и R-тартрата, 2 нафталинсульфоната, пальмитата и сукцината производного пирролидина. Результаты приведены ниже в табл. 1. Таблица 1 Выделить удалось только цитрат и соли L-, D-, и DL-тартрата. В остальных случаях соли либо не выделялись в виде твердых продуктов, либо полученные твердые соединения превращались в жидкость в процессе фильтрования. Все соли были аморфными по данным дифференциальной сканирующей калориметрии (ДСК). Цитрат и соли D-тартрата оказались неустойчивы при относительной влажности (ОВ) 75%, но были устойчивыми при ОВ 63%. Наоборот, соль L-тартрата была стабильна при ОВ 75%. В случае соли L-тартрата было получено всего 18,12 г твердого продукта кремового цвета, выход 92,6% от теоретического. Соль L-тартрата (2R)-1-7-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-борной кислоты имеет брутто формулу C10H20BN3O3-C4H4O6 и молярную массу 391,25 г/моль. Это аморфное вещество от белого до бледно-коричневого цвета, хорошо растворимое в воде и спиртах ( 2000 мг/мл). Вещество умеренно гигроскопично, оставаясь твердым и пригодным к обработке при обычных условиях. Сорбция воды тартратом проиллюстрирована на фиг. 2. Пример 2. Методика распылительной сушки Распылительную сушку проводили на лабораторной распылительной сушилке SD011 (BUCHI, модель В-290 Advanced), снабженной пневмораспылителем. Колпачок распылителя и его диаметр составляли соответственно 1,5 и 0,7 мм. Для выделения высушенного продукта использовали высокопроизводительный циклон. Поток сушильного азота регулировали за счет скорости вентилятора (Fdrying). В данных экспериментах вентилятор осуществлял циркуляцию азота на 100% производительности (расход приблизительно 35 кг/ч). Распыляющий ток азота (F-atm), регулируемый с помощью игольчатого клапана, был установлен на уровне 357 л/ч (высота в ротаметре 30 мм). Перед началом каждого эксперимента проводили стабилизацию сушилки деионизированной водой. Расход раствора (F-feed) был установлен на уровне 9 мл/мин (30% от скорости питающего перистальтического насоса). Температуру на входе (Tin) регулировали с помощью электронагревателя (НХ) и корректировали для достижения заданной температуры на выходе (Tout) (100C). Рабочие параметры определяли на основе предварительного эксперимента, проведенного на установке SD011 для 17DC01 (MAR-001-026). Продукты, собранные из циклона и со дна сушильной камеры, объединяли. Пример 3. Получение соли L-тартрата распылительной сушкой Раствор 1,00 г свободного основания в 4,06 г деионизированной воды и раствор 0,62 г L-винной кислоты в 2,44 г деионизированной воды перемешивали 15 мин при 20-25 С. Затем раствор L-винной кислоты прибавляли к раствору свободного основания, и реакционную смесь перемешивали в течение 15- 14017833 мин при 20-25 С. Перед распылительной сушкой содержание твердого компонента в реакционной смеси составляло приблизительно 25 мас.%. Методика была повторена в увеличенном масштабе для превращения 500 г свободного основания в соль L-тартрата в три приема. Характеристики продуктов распылительной сушки, полученных в трех реакциях, приведены в табл. 2. Таблица 2 Продукт распылительной сушки собирали в циклоне (большую часть) или на дне сушильной камеры (термически-чувствительные продукты могли иметь более низкую чистоту в камере вследствие воздействия более высоких температур в течение более длительного времени). В данной партии количество продукта, собранного в камере, было столь мало, что его анализ не проводили. Кроме того, растворы перед распылением и продукты распылительной сушки анализировали методом ВЭЖХ по следующей методике. Использовали колонку Waters Symmetry C18 (3,0150 мм, 3,5 мм). Подвижная фаза А содержала 25 ммоль/л октансульфоната натрия и 0,1% ТФК в смеси вода:метанол(90:10). Подвижная фаза В содержала 25 ммоль/л октансульфоната натрия и ОД % ТФК в смеси вода: метанол (25:75). Температура колонки - 60 С, обнаружение на длине волны 210 нм. Объем вводимой пробы 15 мкл; скорость потока 1,0 мл/мин, время опыта 70 мин. При элюировании применяли следующий градиент: Примечание: вплоть до достижения равновесия при 60 С колонка работает при скорости потока 0,1 мл/мин. Полученные хроматограммы соответственно тартрата, производного пирролидина и соли L-тартрат приведены на фиг. 3-6. Продукты распылительной сушки, полученные в трех реакционных партиях, объединяли, хроматограмма объединенного продукта, полученная методом ВЭЖХ, приведена на фиг. 7. В сумме соль L-тартрата (2R)-1-7-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-борной кислоты, выделенная методом распылительной сушки, характеризовалась минимальным разложением или его отсутствием. Пример 4. Получение соли тартрата в соответствии с настоящим изобретением как прямого продукта синтеза Соль тартрата в соответствии с настоящим изобретением была получена из свободного основания с защитными группами по следующей методике. В реактор помещали 1,0 кг свободного основания с защитными группами, 0,40 кг винной кислоты и 2,0 кг (2 л) очищенной воды. Смесь перемешивали в течение не менее 1 ч, поддерживая ее температуру не выше 30 С, так как первоначальная реакция в некоторых случаях была экзотермической. Затем прибавляли 0,33 кг фенилборной кислоты и 3,7 кг метил-третбутилового эфира (5 л) и смесь перемешивали в течение не менее 2 ч при 15-25 С. Отбирали пробу и анализировали методом ВЭЖХ. Если содержание свободного основания превышало 0,5%, реакционную смесь перемешивали еще в течение 1-3 ч и повторно отбирали пробу. Если содержание свободного осно- 15017833 вания оказывалось не выше 0,5%, перемешивание прекращали и смесь выдерживали в течение не менее 15 мин для разделения слоев. Органическую фазу отбрасывали, а нижнюю водную фазу вводили в следующую стадию. Водную фазу экстрагировали 4,3 кг 2-метилтетрагидрофурана (5 л) при перемешивании в течение не менее 10 мин, после чего выдерживали в течение не менее 15 мин для разделения слоев. Органическую фазу снова отбрасывали, а с водной фазой повторяли экстракцию 4,3 кг 2-метилтетрагидрофураном(5 л), как описано выше, двукратно или большее число раз. Полученную водную фазу вводили в реакцию с 3,7 кг метил-трет-бутилового эфира (5 л) и смесь перемешивали в течение не менее 10 мин, после чего выдерживали для разделения слоев в течение не менее 15 мин. Органическую фазу снова отбрасывали, а нижний водный слой собирали и отбирали пробу для ВЭЖХ. Полученную водную фазу фильтровали и анализировали пробу методом ВЭЖХ. Остатки растворителей удаляли в вакууме от -0,8 до -0,9 бар в течение 2 ч при 35-50 С. Из полученного раствора отбирали пробу для ВЭЖХ. Часть раствора переносили в поддон сублимационной сушилки и замораживали. Замороженные поддоны удаляли, помещали в морозильную камеру и выдерживали. Оставшийся раствор продукта загружали в поддоны сублимационной сушилки и подвергали сушке. Затем сушили ранее замороженные продукты. Пример 5. Свойства соли тартрата Физическая стабильность в камере влажности. Проводили синтез тартрата в масштабе 50 ммоль,получили 18,12 г твердого продукта кремового цвета. Четыре пробы соли по 1,0 г помещали в четыре отдельных камеры влажности при относительной влажности 45, 58, 63 и 76% и при обычной температуре(68-72F). Пробы взвешивали сначала через каждый час, а затем один раз в сутки. Результаты приведены на фиг. 8. Через пять суток образцы набрали 9-13% воды при ОВ от 45 до 63%, при этом максимальное поглощение имело место в первые трое суток. Скорость поглощения воды была пропорциональна относительной влажности, при этом различие между ОВ 58 и 63% было незначительным. Таким образом, соль тартрата является физически стабильной (т.е. остается сыпучим твердым продуктом) при комнатной температуре и ОВ до 63%. Образец соли тартрата выдерживали в открытом сосуде при комнатной температуре и ОВ 45% в течение двух месяцев. Материал сохранял хорошие характеристики текучести. Химическая стабильность. Химическую стабильность определяли методом ВЭЖХ. Соль L-тартрата непрерывно выдерживали в камере с ОВ 45% в течение двух месяцев. На фиг. 9 и 10 приведены хроматограммы ВЭЖХ для образца соли до и после выдерживания при ОВ 45% в течение двух месяцев. Обнаружены малые изменения чистоты или их отсутствие. Определяли также химическую стабильность соли тартрат и свободного основания после выдерживания в течение одного и трех месяцев при 25, 40 и 60 С. Результаты приведены в таблице. Таблица 3 Пример 6. Определение действия на DPP-VII, DPP-VIII, DPP-IX и FAP Анализ биологической активности и селективности свободного основания приведен в Патентной заявке США, серийный 11/381085, дата подачи 1.05.2006, которая включена в данный документ по ссылке. Биологическую активность и селективность соли тартрата сравнивали с показателями, полученными для свободного основания методом, описанным в заявке 10/381085. Установлено, что эффективность и селективность свободного основания и соли L-тартрата по отношению в различным DPP сравни- 16017833 мы. В частности, как и свободное основание, соль тартрата обладает отличной селективностью к DPP-IV по сравнению с DPP-VIII. Пример 7. Формирование таблеток Таблетки, содержащие 400 и 50 мг соли в соответствии с настоящим изобретением, готовили следующим образом. Соль измельчали и просеивали через сито с отверстиями 20 меш, после чего смешивали с микрокристаллической целлюлозой, кополивидоном, кросповидоном и коллоидным диоксидом кремния в соответствующем V-образном смесителе в течение 10 мин при 25 об./мин. Полученную композицию перемешивали со смазывающим агентом - стеаратом магния в течение 2 мин при 25 об./мин. Таблетки прессовали из смеси со смазывающим агентом из расчета теоретической массы таблетки, равной 1000 мг, обработку проводили по форме капсулы 0,785"0,370". Часть прессованных таблеток покрывали оболочкой из Opadry AMB. Нанесение оболочки продолжали до увеличения массы приблизительно на 3%. Состав таблеток приведен в таблице. Таблица 4- 17017833 Таблица 5 Исследование стабильности тартрата в течение 12 месяцев В табл. 5 приведены результаты исследования стабильности соли L-тартрата соединения формулы(IA), где R2 и R3 - ОН-группы в течение 12 месяцев при нескольких значениях температуры и относительной влажности. Как можно видеть, изменений химической чистоты практически не происходит ни в одних из исследованных условий, внешний вид вещества, представляющего собой вещество кремового цвета, также не менялся, за исключением точки, соответствующей 12 месяцам при 25 С, где наблюдалось небольшое пожелтение. Хотя настоящее изобретение предложено в сочетании с подробным описанием, приведенное выше описание предназначено для иллюстрации и не ограничивает объем настоящего изобретения, который определяется объемом прилагаемой формулы изобретения. Прочие аспекты, преимущества и изменения находятся в рамках приведенной ниже формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая твердую форму гидрата соли цитрата или гидрата соли L-тартрата (2R)-1-7-[(9R)-пирролидин-9-иламино]ацетилпирролидин-2-бороновой кислоты формулы или его циклического изомера, или любой смеси этого пирролидинового соединения и его циклического изомера и фармацевтически приемлемый носитель. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что циклический изомер пирролидина является соединением формулы 3. Фармацевтическая комбинация, содержащая композицию по любому из пп.1, 2 и дополнительно известное второе лекарственное средство, повышающее секрецию инсулина, повышающее чувствительность к инсулину, снижающее усвоение сахара из ЖКТ, усиливающее действие эндогенных пептидов или белков, влияющих на гликемический контроль, способное заменить эндогенные пептиды или белки,влияющие на гликемический контроль, или любые их комбинации; или где второе лекарственное средство является антидиабетическим агентом. 4. Лекарственная форма, содержащая композицию по любому из пп.1 или 2, в которой лекарственная форма содержит, по меньшей мере, единичную эффективную для человека дозу однородного образца соли цитрата или гидрата соли L-тартрата и фармацевтически приемлемый носитель. 5. Фармацевтическая композиция по любому из пп.1 или 2 для лечения диабета или расстройств у пациента, при которых медицински показано ингибирование DPP-IV.
МПК / Метки
МПК: C07D 207/00, A61K 31/44, A61K 31/505, A61K 31/69
Метки: ингибиторов, твердые, dpp-iv, лимоннокислые, виннокислые, соли
Код ссылки
<a href="https://eas.patents.su/23-17833-tverdye-limonnokislye-i-vinnokislye-soli-ingibitorov-dpp-iv.html" rel="bookmark" title="База патентов Евразийского Союза">Твердые лимоннокислые и виннокислые соли ингибиторов dpp-iv</a>
Предыдущий патент: Гранулы и орально дезинтегрируемые таблетки, содержащие оксикодон
Следующий патент: Соединения оксазолидиния, способ их получения и их применение в качестве ингибиторов образования гидратов углеводородов
Случайный патент: Пассажирские транспортые средства, оборудованные громкоговорителями, содержащими панельные акустические излучающие элементы