Пиперидинильное производное как модулятор активности хемокинового рецептора
Формула / Реферат
1. Соединение формулы (I)
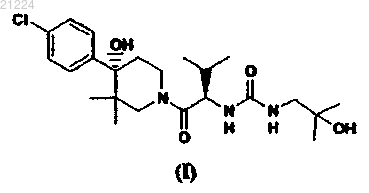
или его стереоизомер или фармацевтически приемлемая соль.
2. Фармацевтическая композиция для лечения и предупреждения воспалительных заболеваний, аллергических и аутоиммунных заболеваний, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
3. Способ модуляции активности хемокина или хемокинового рецептора, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1.
4. Способ по п.3, отличающийся тем, что активность хемокина и активность хемокинового рецептора представляют собой активность хемокина СС-1 и активность хемокинового рецептора CCR-1.
5. Способ лечения расстройства, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1, причем указанное расстройство выбирают из фиброзных заболеваний, интерстициальных легочных болезней, почечного фиброза, кистозного фиброза, идиопатического легочного фиброза и ревматоидного артрита.
6. Способ лечения воспалительных заболеваний, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1.
7. Способ лечения воспалительных заболеваний, которые, по меньшей мере частично, опосредуются CCR-1, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1.
8. Способ лечения воспалительных заболеваний, аллергических и аутоиммунных заболеваний у пациента, нуждающегося в терапии, заключающийся во введении указанному нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1.
9. Способ модуляции активности хемокина или хемокинового рецептора, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2.
10. Способ модуляции активности CCR-1, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2.
11. Способ лечения расстройства, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2, отличающийся тем, что указанное расстройство выбирают из фиброзных заболеваний, интерстициальных легочных болезней, почечного фиброза, кистозного фиброза, идиопатического легочного фиброза и ревматоидного артрита.
12. Способ лечения воспалительных заболеваний, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2.
13. Способ приготовления лекарственного препарата для лечения фиброзных заболеваний, интерстициальных легочных болезней, почечного фиброза, кистозного фиброза, идиопатического легочного фиброза и ревматоидного артрита, заключающийся в приготовлении композиции по п.2 в применимой фармацевтической лекарственной форме.
Текст
ПИПЕРИДИНИЛЬНОЕ ПРОИЗВОДНОЕ КАК МОДУЛЯТОР АКТИВНОСТИ ХЕМОКИНОВОГО РЕЦЕПТОРА В изобретении описывается соединение формулы (I) или его стереоизомеры или фармацевтически приемлемые соли. Помимо этого раскрываются способы лечения или предупреждения воспалительных заболеваний, таких как астма, и аллергических заболеваний, а также аутоиммунных патологий, таких как ревматоидный артрит и атеросклероз, с применением соединения по изобретению. Область, к которой относится изобретение Изобретение в целом относится к пиперидинильному модулятору активности хемокинового рецептора, содержащим его фармацевтическим композициям и способам его применения в качестве агента для лечения и предупреждения воспалительных заболеваний, аллергических и аутоиммунных заболеваний и,в частности, ревматоидного артрита и отторжения трансплантата. Предпосылки создания изобретения Хемокины представляют собой хемотаксические цитокины с молекулярной массой 6-15 кДа, которые высвобождаются весьма различными клетками для привлечения и активации, среди прочих типов клеток, моноцитов, макрофагов, Т и В лимфоцитов, эозинофилов, базофилов и нейтрофилов. Хемокины делят на два основных класса, СХС и СС, в зависимости от того, разделены ли два первых цистеиновых остатка единичной аминокислотой (СХС) или прилегают друг к другу (СС). СХС хемокины, такие как интерлейкин-8 (IL-8), нейтрофил-активирующий белок-2 (NAP-2) и фактор роста меланомы (белок, стимулирующий рост меланомы) (MGSA) являются хемотаксическими агентами главным образом для нейтрофилов и Т лимфоцитов, тогда как СС хемокины, такие как RANTES, MIP-1, MIP-1, моноцитарные хемотаксические белки (МСР-1, МСР-2, МСР-3, МСР-4 и МСР-5) и эотаксины (-1 и -2) являются хемотаксическими для многих других типов клеток, среди которых макрофаги, Т лимфоциты, эозинофилы,дендритные клетки и базофилы. Хемокины связываются со специфическими рецепторами клеточной поверхности, относящимися к семейству белков, состоящих из семи трансмембранных доменов и сопряжнных с G-белками, которые называются "хемокиновыми рецепторами." При связывании "своих" лигандов (когнатное взаимодействие) хемокиновые рецепторы передают внутриклеточный сигнал через ассоциированные тримерные G белки, что в результате вызывает, среди прочих реакций, быстрое повышение внутриклеточной концентрации кальция, изменение формы клеток, повышенную экспрессию молекул клеточной адгезии, дегрануляцию клеток и стимуляцию клеточной миграции. Имеется по меньшей мере десять хемокиновых рецепторов человека, которые связывают или отвечают на СС хемокины со следующими характеристическими паттернами: CCR-1 (или "CKR-1" или "СС-CKR-1") [MIP-1, МСР-3, МСР-4, RANTES]; CCR-2 А и CCR-2 В (или "CKR-2A"/"CKR-2 В" или "СС-CKR- 2A"/"CC-CKR- 2B") [МСР-1, МСР-2, МСР-3, МСР-4,МСР-5]; CCR-3 (или "CKR-3" или "СС-CKR-3") [эотаксин-1, эотаксин-2, RANTES, МСР-3, МСР-4];[МСР-1, МСР-3]; и CCR-11 [МСР-1, МСР-2 и МСР-4]. Показано, что помимо хемокиновых рецепторов млекопитающих, цитомегаловирусы, герпесвирусы и поксвирусы экспрессируют в инфицированных клетках белки со связывающими свойствами хемокиновых рецепторов. СС хемокины человека, такие как RANTES и МСР-3, могут вызывать быструю мобилизацию кальция при посредстве этих кодируемых вирусами рецепторов. Экспрессия рецепторов может являться разрешительной (пермиссивной) для инфекции, допуская нарушение ("поломку") нормальной системы иммунного надзора и ответа на инфекцию. Помимо этого, хемокиновые рецепторы человека,такие как CXCR4, CCR2, CCR3, CCR5 и CCR8, могут действовать в качестве корецепторов для инфицирования клеток млекопитающих микробами, как в случае вирусов иммунодефицита человека (ВИЧ). Хемокины и их "когнатные" рецепторы являются важными медиаторами воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания, а также аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз (см. обзоры:Carter, P.H., Current Opinion in Chemical Biology 2002, 6, 510; Trivedi et al., Ann. Reports Med Chem. 2000,35, 191; Saunders et al., Drug Disc. Today 1999, 4, 80; Premack et al., Nature Medicine 1996, 2, 1174). Например, хемокин - макрофагальный воспалительный белок-1 (MIP-1) и его рецептор, СС хемокиновый рецептор 1 (CCR-1), играют главную роль в притягивании (привлечении) лейкоцитов к местам воспаления и последующей активации этих клеток. Когда хемокин MIP-1 связывается с CCR-1, он вызывает быстрое повышение внутриклеточной концентрации кальция, повышенную экспрессию молекул клеточной адгезии, дегрануляцию клеток и стимуляцию миграции лейкоцитов. Помимо этого, хемотаксические свойства MIP-1 экспериментально продемонстрированы на людях. После интрадермальной инъекции MIP-1 у пациентов наблюдался быстрый и заметный приток лимфоцитов к участку инъекции (Brummet, M.E., J. Immun. 2000, 164, 3392-3401). Важность взаимодействия MIP-1/CCR-1 была показана в экспериментах на генетически модифицированных мышах. У мышей MIP-1 -/- имелось нормальное число лейкоцитов, но они не были способны рекрутировать моноциты в области вирусного воспаления после иммунизации. Недавно было показано, что мыши MIP-1 -/- устойчивы к артриту, вызываемому антителами к коллагену. Аналогично,мыши CCR-1 -/- были неспособны рекрутировать нейтрофилы при иммунизации с помощью MIP-1 invivo; более того, нейтрофилы периферической крови у CCR-1 null мышей не мигрируют в ответ на MIP1, тем самым демонстрируя специфичность взаимодействия MIP-1 /CCR-1. Жизнеспособность и общее нормальное здоровье MIP-1 -/- и CCR-1 -/- животных заслуживает внимания, поскольку нарушение взаимодействия MIP-1 /CCR-1 не вызывает физиологического кризиса. В целом эти факты приводят к выводу, что молекулы, которые блокируют действие MIP-1, могут быть полезными при лечении ряда воспалительных и аутоиммунных расстройств. В настоящее время правильность этой гипотезы подтверждена на различных животных моделях заболеваний, представленных ниже. Известно, что уровень MIP-1 повышен в синовиальной жидкости и крови больных ревматоидным артритом. Кроме того, в некоторых исследованиях продемонстрировано потенциальное терапевтическое значение взаимодействия MIP-1 /CCR-1 при лечении ревматоидного артрита. Следует заметить, что CCR-1 также является рецептором для хемокинов RANTES, МСР-3, НСС-1,Lkn-1/НСС-2, НСС-4 и MPIF-1 (Carter, P.H., Curr. Opin Chem. Bio. 2002, 6, 510-525). Так как предполагалось, что новое соединение формулы (I) по данному описанию противодействует (антагонизм) MIP-1 за счт связывания с CCR-1 рецептором, вполне возможно, что это соединение является также эффективным антагонистом действия вышеуказанного лиганда, которое опосредуется CCR-1. Соответственно,когда в данном описании датся ссылка на "антагонизм MIP-1", следует полагать, что это выражение эквивалентно выражению "антагонизм стимуляции хемокина CCR-1." В последнее время несколько исследовательских групп сообщили о разработке низкомолекулярных антагонистов MIP-1 (см. обзор Carson, K.G. et al., Ann. Reports Med. Chem. 2004, 39, 149-158). Сущность изобретения Таким образом, настоящее изобретение включает антагонист или частичный агонист/антагонистMIP-1 или CCR-1 рецепторной активности или его фармацевтически приемлемые соли. Настоящее изобретение включает фармацевтические композиции, содержащие фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемую соль. Настоящее изобретение включает способ лечения ревматоидного артрита и отторжения трансплантата, заключающийся во введении нуждающемуся в таком лечении хозяину терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение включает способ лечения воспалительных заболеваний, заключающийся во введении нуждающемуся в таком лечении хозяину терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение включает пиперидинильное производное для применения в терапии. Настоящее изобретение включает применение пиперидинильного производного для получения лекарственного препарата для лечения воспалительных заболеваний. Подробное описание изобретения В одном варианте настоящее изобретение включает соединение формулы (I) или его стереоизомеры или фармацевтически приемлемые соли. Настоящее изобретение включает пиперидинильное соединение, профиль которого имеет неожиданные преимущества по сравнению с профилями известных ингибиторов CCR-1 активности, например,пиперидинильных производных, описанных в патентной заявке США US2007/0208056 А 1, опубликованной 6 сентября 2007 года и право на которую передано заявителю. Более предпочтительно, соединение имеет повышенный профиль безопасности с минимальным лекарственным взаимодействием и другие свойства, которые делают его привлекательным кандидатом для клинической разработки. Соответственно, именно эти неожиданные свойства, самостоятельно или в комбинации, делают соединение формулы(I) желательным для применения в качестве фармакологического агента. В другом варианте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы(I). В другом варианте настоящее изобретение относится к способу модуляции активности хемокина или рецептора хемокина, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу модуляции CCR-1 рецепторной активности, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения расстройств, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I), причм указанное расстройство выбирают из остеоартрита, аневризмы, лихорадки, сердечно-сосудистых заболеваний, болезни Крона, застойной сердечной недостаточности, аутоиммунных забо-2 021224 леваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции, псориаза, идиопатического лгочного фиброза, трансплантационного артериосклероза, вызванной физическим или химическим воздействием травмы головы, нейропатической боли, воспалительного заболевания кишечника, альвеолита, язвенного колита,системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы,рассеянного склероза, артросклероза, ревматоидного артрита, рестеноза, трансплантации органа, псориатического артрита, множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, колоректального рака, остеопороза, почечного фиброза и других типов раковых заболеваний, предпочтительно болезни Крона, псориаза, воспалительного заболевания кишечника, системной красной волчанки, рассеянного склероза, ревматоидного артрита, множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, остеопороза и почечного фиброза. В другом варианте настоящее изобретение относится к способу лечения воспалительных заболеваний, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения воспалительного заболевания кишечника, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения болезни Крона, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения псориаза, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения системной красной волчанки, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения рассеянного склероза, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения ревматоидного артрита, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения псориатического артрита,заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения множественной миеломы,заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения аллергии, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения печночно-клеточной карциномы, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения остеопороза, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения почечного фиброза, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу лечения воспалительных заболеваний, например, воспалительных заболеваний, которые по меньшей мере частично опосредуются CCR-1,заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к способу модуляции CCR-1 активности, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I). В другом варианте настоящее изобретение относится к применению соединения формулы (I) для приготовления лекарственного препарата для лечения расстройства, причм указанное расстройство выбирают из остеоартрита, аневризмы, лихорадки, сердечно-сосудистых заболеваний, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧассоциированной деменции, псориаза, идиопатического лгочного фиброза, трансплантационного арте-3 021224 риосклероза, вызванной физическим или химическим воздействием травмы головы, нейропатической боли, воспалительного заболевания кишечника, альвеолита, язвенного колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза,артросклероза, ревматоидного артрита, рестеноза, трансплантации органа, псориатического артрита,множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве,печночно-клеточной карциномы, колоректального рака, остеопороза, почечного фиброза и других типов раковых заболеваний, предпочтительно, болезни Крона, псориаза, воспалительного заболевания кишечника, системной красной волчанки, рассеянного склероза, ревматоидного артрита, множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, остеопороза и почечного фиброза. В другом варианте настоящее изобретение относится к соединению формулы (I) для применения в терапии. В другом варианте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и один или более активных ингредиентов. В другом варианте настоящее изобретение относится к способу модуляции активности хемокинов или хемокиновых рецепторов, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов. В другом варианте настоящее изобретение относится к способу модуляции CCR-1 рецепторной активности, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов. В другом варианте настоящее изобретение относится к способу лечения расстройства, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов, причем указанное расстройство выбирают из остеоартрита, аневризмы, лихорадки, сердечнососудистых заболеваний, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции, псориаза, идиопатического лгочного фиброза,трансплантационного артериосклероза, травмы головы, вызванной физическим или химическим воздействием, нейропатической боли, воспалительного заболевания кишечника, альвеолита, язвенного колита,системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы,рассеянного склероза, артросклероза, ревматоидного артрита, рестеноза, трансплантации органа, псориатического артрита, множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, колоректального рака, остеопороза, почечного фиброза и других типов раковых заболеваний, предпочтительно, болезни Крона, псориаза, воспалительного заболевания кишечника, системной красной волчанки, рассеянного склероза, ревматоидного артрита, множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, остеопороза и почечного фиброза. В другом варианте настоящее изобретение относится к способу лечения воспалительных заболеваний, предпочтительно воспалительных заболеваний, которые по меньшей мере частично опосредуютсяCCR-1, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов. В другом варианте настоящее изобретение относится к способу модуляции CCR-1 активности, заключающемуся во введении нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов. В другом варианте настоящее изобретение относится к применению фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов, для приготовления лекарственного препарата для лечения расстройства, причм указанное расстройство выбирают из остеоартрита, аневризмы, лихорадки, сердечно-сосудистых заболеваний, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции,псориаза, идиопатического лгочного фиброза, трансплантационного артериосклероза, травмы головы,вызванной физическим или химическим воздействием, нейропатической боли, воспалительного заболевания кишечника, альвеолита, язвенного колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, артросклероза, ревматоидного артрита, рестеноза, трансплантации органа, псориатического артрита, множественной миеломы, аллергии,например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, колоректального рака, остеопороза, почечного фиброза и других типов раковых заболеваний, предпочтительно болезни Крона, псориаза, воспалительного заболевания кишечника, системной красной волчанки,рассеянного склероза, ревматоидного артрита, множественной миеломы, аллергии, например, дегрануляции кожных и тучных клеток в конъюнктиве, печночно-клеточной карциномы, остеопороза и почечного фиброза. Ещ в одном варианте настоящее изобретение относится к применению фармацевтической композиции, состоящей из соединения формулы (I) и одного или более активных ингредиентов, в терапии. Изобретение может быть воплощено в других специфических формах, не отступая от его сущности или его существенных признаков. Данное изобретение охватывает также все комбинации альтернативных аспектов изобретения, указанных в данном описании. Следует понимать, что все без исключения варианты настоящего изобретения можно использовать в сочетании с любым другим вариантом изобретения для описания дополнительных вариантов настоящего изобретения. Кроме того, любые элементы изобретения можно объединять с любыми другими элементами из любого варианта изобретения для описания дополнительных вариантов изобретения. Определения Соединения по данному описанию могут иметь асимметрические центры. Соединения по настоящему изобретению, содержащие асимметрически замещнный атом, можно выделять в оптически активной или рацемической форме. В данной области техники (области органического синтеза) хорошо известно, как приготовить оптически активные формы, например, разрешением (разделением) рацемических форм или синтезом из оптически активных исходных материалов. Многие геометрические изомеры олефинов, C=N двойные связи и т.п. также могут присутствовать в соединениях по данному описанию, и все такие устойчивые изомеры рассматриваются в данном изобретении. Описываются цис- и трансгеометрические изомеры соединений по настоящему изобретению, и их можно выделять в виде смеси изомеров или в виде отдельных изомерных форм. Если специально не указывается конкретная стереохимия или изомерная форма, то подразумеваются все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры. Один энантиомер соединения формулы I может проявлять повышенную активность по сравнению с другими. Поэтому все стереоизомеры рассматриваются как часть настоящего изобретения. При необходимости разделение рацемического продукта можно проводить методом ВЭЖХ с применением хиральной колонки или разделением с помощью агента для оптического расщепления, известного в уровне техники. Выражение "фармацевтически приемлемый" применяется в данном описании по отношению к таким соединениям, материалам, композициям и/или лекарственным формам, которые, по мнению компетентного врача, пригодны для применения в контакте с тканями человека и животных, не проявляя токсичности, не вызывая раздражения, аллергической реакции или другой проблемы или осложнения, превышающих допустимое соотношение польза/риск. Выражение "фармацевтически приемлемые соли" относится к производным раскрываемых соединений, исходное соединение для которых модифицируется образованием солей кислоты или основания. Примеры фармацевтически приемлемых солей включают, но без ограничения, соли минеральных или органических кислот с основными остатками, такими как амины; соли щелочных или органических оснований с кислыми остатками, такими как остатки карбоновых кислот; и т.п. Фармацевтически приемлемые соли включают обычные нетоксические соли или четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксических неорганических или органических кислот. Например, такие обычные нетоксические соли включают соли, образованные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, пальмовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтионовая и т.п. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основную или кислую группу, обычными химическими методами. Обычно такие соли можно получать по реакции свободной кислой или основной формы этих соединений со стехиометрическим количеством соответствующего основания или соответствующей кислоты в воде или в органическом растворителе или в их смеси; как правило, предпочтительны неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки соответствующих солей даны в справочнике Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418, его раскрытие вводится в данное описание в качестве ссылки. Указанные ссылочные материалы вводятся в данное описание в качестве ссылки. После получения соединения формулы I предпочтительно выделяют или очищают, получая композицию, содержащую некоторое количество, равное или превышающее 99 вес.%, соединения формулы I("практически чистое" соединение I), которое затем используют или готовят из него препарат по данному описанию. Такие "практически чистые" соединения формулы I также рассматриваются в данном описании как часть настоящего изобретения. Рассматриваются все стереоизомеры соединений по настоящему изобретению, либо в виде смеси,либо в чистом или практически чистом виде. Соединения по настоящему изобретению могут иметь асимметрические центры при любом углеродном атоме, включая любой из заместителей R, и/или прояв-5 021224 лять полиморфизм. Соответственно соединения формулы I могут существовать в виде энантиомеров,диастереомеров или в виде их смеси. Рацематы, энантиомеры или диастереомеры могут использоваться в качестве исходных материалов. После получения энантиомерных продуктов их можно разделять обычными методами, например хроматографией или фракционной кристаллизацией. Предполагается, что термины "устойчивое (стабильное) соединение" или "устойчивая (стабильная) структура" означают соединение, достаточно прочное, чтобы выдержать выделение из реакционной смеси с очисткой до приемлемой степени чистоты и приготовление эффективного терапевтического агента. Предполагается, что настоящее изобретение включает устойчивые соединения. Предполагается, что выражение "теоретически эффективное количество" включает некоторое количество соединения по настоящему изобретению, самостоятельно или в комбинации заявляемых соединений, или некоторое количество соединения по настоящему изобретению в комбинации другими активными ингредиентами, эффективными для ингибирования MIP-1 или для лечения или предупреждения воспалительных расстройств. Термин "лечение" относится к лечению болезненного состояния у млекопитающего, в частности у человека, и включает: (а) предупреждение заболевания у млекопитающего, в частности, когда такое млекопитающее предрасположено к заболеванию, но заболевание у него ещ не диагностировано; (б) ингибирование заболевания, например, прекращение развития заболевания; и/или (в) ослабление заболевания, т.е ремиссию заболевания. Синтез Соединение формулы I получают как описано в нижеприведнном примере, схеме реакции и е описании, а также в релевантных литературных методиках, которые может применять специалист в области органического синтеза. Типичные реагенты и методики этих реакций приводятся ниже. Пример. Стадия 1. трет- Бутил 3,3-диметил-4-оксопиперидин-1-карбоксилат Раствор трет-бутил 4-оксопиперидин-1-карбоксилата (52.47 г, 263 ммоль) в THF (ТГФ) (1000 мл) охлаждают до 0C и прибавляют гидрид натрия (60% суспензия в минеральном масле) (22.12 г, 553 ммоль) четырьмя равными порциями с пятиминутными интервалами. Образовавшуюся суспензию перемешивают при 0C в течение 45 мин ("мин"), а затем по каплям добавляют йодистый метил (41.2 мл, 658 ммоль). Смесь перемешивают 1 ч ("ч" или "час"), а затем оставляют нагреваться до комнатной температуры ("rt"). Через девяносто минут после того, как отставляют баню со льдом, наблюдается быстрый разогрев (20-40C за 3 мин) и энергичное выделение газа. Снова подставляют баню со льдом и смесь оставляют перемешиваться в течение ночи, при этом она медленно нагревается до комнатной температуры. Реакцию прекращают, добавляя насыщенный раствор хлорида аммония (200 мл), затем прибавляют воду в количестве, достаточном для растворения выпавших солей. Фазы разделяют и органический слой упаривают в вакууме. Водный слой экстрагируют этилацетатом и эти вытяжки объединяют с остатком после упаривания органической фазы. К полученному раствору прибавляют 500 мл этилацетата и смесь промывают 2 раза ("х") водой, один раз рассолом, сушат сульфатом натрия, а затем упаривают в вакууме,получают вязкое масло, которое твердеет при стоянии. Затвердевший продукт растворяют в 100 мл смеси гексанов при кипении и полученный раствор оставляют охлаждаться до комнатной температуры в течение ночи. Выпавшие кристаллы отфильтровывают, промывают небольшим количеством смеси гексанов,охлажднной льдом, и сушат, получают титульное соединение в виде порошка (19,5 г, 86 ммоль, выход 32.6%). MS (ES+) = 172, 154. Стадия 2. -трет-Бутил 4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-карбоксилат Раствор 4-бромхлорбензола (136.6 г, 0.71 моль) в сухом ТГФ (1000 мл) охлаждают до -78C, а затем по каплям прибавляют 1.6 М раствор н-бутиллития в смеси гексанов (466 мл, 0.75 моль) с такой скоростью, чтобы температура реакционной смеси была ниже -60C. Полученную смесь перемешивают при-78C в течение 1.5 ч, наблюдают выпадение осадка. К полученной суспензии по каплям прибавляют раствор трет-бутил 3,3-диметил-4-оксопиперидин-1-карбоксилата (73.7 г, 0.32 моль) в сухом (безводном) ТГФ (400 мл) с такой скоростью, чтобы температура реакционной смеси была ниже -60C. Смесь перемешивают при -78C в течение 2 ч, при этом образуется прозрачный раствор. К реакционной смеси прибавляют насыщенный раствор хлористого аммония (300 мл) и оставляют нагреваться до комнатной температуры. Органический слой отделяют, упаривают в вакууме досуха. Водный слой экстрагируют 2 этилацетатом (300 мл). Объединнные органические вытяжки прибавляют к остатку из первоначальной органической фазы и полученную смесь доводят до объма 1200 мл этилацетатом. Полученный раствор промывают водой 2 (300 мл), один раз рассолом, сушат сульфатом натрия и упаривают в вакууме. По-6 021224 лученный остаток растворяют в кипящем гексане (смесь гексанов) (300 мл) и образовавшуюся суспензию охлаждают до комнатной температуры. Белый осадок отфильтровывают, промывают смесью гексанов (2), сушат на воздухе, получают титульное соединение в виде порошка (93.7 г, выход 85%). Стадия 3. -4-(4-Хлорфенил)-3,3-диметилпиперидин-4-ол К раствору -трет-бутил 4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-карбоксилата (93.7 г, 0.276 моль) в диоксане (100 мл) прибавляют 4 М раствор HCl в диоксане (275 мл, 1.1 моль). Полученную смесь перемешивают при комнатной температуре в течение 4 ч. Смесь упаривают в вакууме, а затем трижды (3) концентрируют из хлористого метилена (200 мл) для удаления остатков HCl. Полученный остаток перемешивают в 1 М NaOH (500 мл), образовавшуюся суспензию четырежды (4) экстрагируют 500 мл этилацетата. Объединнные органические вытяжки промывают рассолом, сушат сульфатом натрия и упаривают в вакууме, получают титульное соединение (66.8 г, количественный выход) в виде тврдого вещества. Стадия 4. (S)-4-(4-Хлорфенил)-3,3-диметилпиперидин-4-ол Суспензию -4-(4-хлорфенил)-3,3-диметилпиперидин-4-ола (175 г) и L-винной кислоты (0.9 эквив) в МЕК (3.22 л) нагревают до кипения. Прибавляют воду (100 мл). Образовавшийся раствор кипятят 1 ч, затем оставляют охлаждаться до комнатной температуры и перемешивают при комнатной температуре 48 ч. Полученную суспензию отфильтровывают, объединнные осадки сушат в вакууме, получают 123.4 г соли винной кислоты. Этот продукт объединяют с продуктом из другого опыта, проведнного в том же масштабе, и объединнные осадки ресуспендируют в МЕК (2.55 л) и воде (0.25 л). Полученный раствор нагревают до кипения и прибавляют дополнительное количество воды (0.2 л) для растворения смеси. Раствор кипятят в течение 2 ч, а затем оставляют охлаждаться до комнатной температуры. Перемешивают при комнатной температуре 48 ч (weekend). Полученный осадок отфильтровывают (объединяют осадки) и сушат, получают 219 г соли. Соль делят на две равные порции. Каждую порцию суспендируют в воде (2 л), прибавляют 50% NaOH, выпадает свободное пиперидиновое основание. После фильтрования и сушки выделяют 126.3 г титульного соединения (выход 72%, 99% ее) Стадия 5. трет-Бутил (R)-1-S)-4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-ил)-3-метил 1-оксобутан-2-илкарбамат В трхгорлую круглодонную ("RB") колбу на 3 л помещают (R)-2-(трет-бутоксикарбониламино)-3 метилбутановую кислоту (39.8 г, 183 ммоль), CH2Cl2 (1.6 л), (S)-4-(4-хлорфенил)-3,3-диметилпиперидин 4-ол (40.0 г, 167 ммоль), EDC (70.4 г, 367 ммоль) и HOBt (56.2 г, 416 ммоль). Реакционную смесь перемешивают 30 мин при rt. Прибавляют триэтиламин (ТЭА, TEA, 93 мл, 668 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 20 ч, промывают Na2CO3 (3300 мл, примечание: после первой промывки с помощью Na2CO3 фильтруют в вакууме и полученный фильтрат снова экстрагируют CH2Cl2), 1N HCl (3300 мл), водой (400 мл) и рассолом (300 мл). Полученный раствор сушатNa2SO4 и упаривают, получая полутврдый продукт (106 г, теоретический выход 73.2 г). Полутврдый продукт используют на следующей стадии без дополнительной очистки. Стадия 6. (R)-2-Амино-1-S)-4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-ил)-3-метилбутан-1-онHCl В RB колбу на 1000 мл помещают трет-бутил (R)-1-S)-4-(4-хлорфенил)-4-гидрокси-3,3 диметилпиперидин-1-ил)-3-метил-1-оксобутан-2-илкарбамат (65 г, 148 ммоль) и раствор хлористого водорода (4 М HCl в диоксане, 720 мл, 2880 ммоль). Реакционную смесь перемешивают при rt в течение 2.5 ч, упаривают, получают гель. Гель упаривают совместно с метанолом (8100 мл), а затем с CH2Cl2(7100 мл), получают тврдое вещество (первоначальный вес 57 г, HCl соль). Стадия 7. Фенил (R)-1-S)-4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-ил)-3-метил-1 оксобутан-12-илкарбамат Синтез карбамата проводят в двух отдельных колбах. Приводимые в данном описании количества представляют собой общее количество для проведения экспериментов в двух колбах. (R)-2-амино-1-S)4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-ил)-3-метилбутан-1-онHCl (20 г, 53.3 ммоль) иDEPEA (18.61 мл, 107 ммоль) в CH2Cl2 (15 мл) перемешивают при rt, а затем из капельной воронки по каплям прибавляют фенилхлорформиат (6.71 мл, 53.3 ммоль) в 10 мл хлористого метилена. По окончании прибавления реакционную смесь перемешивают один ч, прибавляют ещ 0.2 эквив. DEPEA, а затем раствор фенилхлорформиата в хлористом метилене. Органический слой отделяют, промывают 1N HCl,насыщенным водным раствором NaHCO3 и рассолом; сушат, а затем отгоняют растворитель и получают масло. К маслу при перемешивании при rt прибавляют 25 мл MeCN, перемешивают 10 мин, выпадает осадок. Прибавляют эфир (50 мл) и образовавшуюся смесь перемешивают 5 мин. Прибавляют ещ 25 мл эфира и продолжают перемешивать ещ в течение 15 мин. Полученный осадок отфильтровывают, промывают эфиром, получают 13 г сырого тврдого продукта, который используют далее без дополнительной очистки. Фильтрат упаривают, остаток очищают хроматографией на силикагеле (элюент: 9:1 до 3:1 до 1:1 смесь гексанов/EtOAc до 100% EtOAc), получая дополнительно 6.72 г продукта (общий массовый выход 19.7 г, выход 81%). Стадия 8. Соединение формулы I(R)-1-S)-4-(4-хлорфенил)-4-гидрокси-3,3-диметилпиперидин-1-ил)-3-метил-1-оксобутан 12-илкарбамат (16.0 г, 34.9 ммоль), 1-амино-2-метилпропан-2-ол (3.42 г, 38.3 ммоль) и DIPEA (6.70 мл,38.3 ммоль) перемешивают в MeCN (30 мл) в атмосфере азота при rt. Образовавшуюся суспензию кипятят при перемешивании, сначала образуется бесцветный раствор, а через 20 мин выпадает осадок. Кипятят при перемешивании 1.5 ч, прибавляют 20 мл ацетонитрила и ещ 0.1 эквив. 1-амино-2-метилпропан 2-ола и DIPEA. Реакционную смесь перемешивают ещ 1.5 ч. Нагреватель отставляют и охлаждают до rt. По охлаждении до rt прибавляют воду (240 мл) для осаждения продукта и полученную текучую суспензию перемешивают в течение ночи. Полученный осадок отфильтровывают, дважды промывают водой, а затем сушат в высоком вакууме в течение 6 ч, получают 15.4 г тврдого продукта. Этот продукт (и плюс 1 г из пилотной партии) при перемешивании при rt суспендируют в 50 мл ацетона, а затем прибавляют трхкратный объм воды (150 мл). Текучую суспензию перемешивают в течение ночи. Полученный тврдый продукт отфильтровывают, дважды промывают водой, сушат в течение 48 ч, получают 15.2 г Соединения формулы I в виде тврдого вещества. 1 Н ЯМР (500 МГц, метанол-d4, ротамерный)м.д. 7.47 (дд, J=15.4, 8.8 Гц, 4 Н), 7.31 (дд, J=8.5, 5.2 Гц, 4 Н), 4.71 (дд, J=12.1, 6.1 Гц, 2 Н), 4.54 (ддд, J=12.9, 2.5, 2.2 Гц, 1 Н), 3.98-4.08 (м, 2 Н), 3.58-3.68 (м, 2 Н),3.48 (дд, J=12.9, 1.4 Гц, 1H), 3.13-3.21 (м, 2 Н), 3.06-3.14 (м, 4 Н), 2.70 (тд, J= 43.6, 4.7 Гц, 1 Н), 2.61 (тд,J=13.5, 5.0 Гц, 1 Н), 2.09 (дкв, J =13.2, 6.6 Гц, 1 Н), 1.95 (дкв, J=13.3, 6.7 Гц, 1 Н), 1.60 (ддд, J=43.9, 2.5, 2.3 Гц, 1 Н), 1.51 (ддд, J=14.2, 2.6, 2.5 Гц, 1 Н), 1.16 (с, 6 Н), 1.14 (d, J= 1.7 Гц, 6 Н), 1.05 (д, J=7.2 Гц, 3H), 0.98(4 С, с), 128.3 (4 С, с), 76.0, 76.0, 71.7, 71.7, 55.9, 55.2, 55.1, 51.8 (2 С, с), 51.1, 43.0, 40.4, 39.9, 39.3, 34.8,33.7, 33.1, 32.4, 27.2 (2 С, с), 27.1 (2 С, с), 23.1, 22.8, 21.4, 21.1, 20.3, 19.8, 17.9, 17.7, m/z: 454.2 [М+]+. Полезность. Было показано, что соединение формулы (I), как правило, является модулятором активности хемокиновых рецепторов. Предполагается, что раз соединение формулы (I) проявляет активность в качестве модулятора активности хемокиновых рецепторов, то оно может применяться при лечении человеческих болезней, ассоциирующихся с хемокинами и их "когнатными" ("своими") рецепторами. Сравнительные фармакологические характеристики. Ниже представлены анализы и результаты сравнения фармакологических характеристик соединения из Примера 1 и соединений из Патентной заявки США US2007/0208056A1 (аналогичной Международной патентной заявке WO 2007/092681). Соединение по настоящему изобретению (соединение 1) сравнивают с другими соединениями, которые, как было обнаружено, представляют собой полезные ингибиторы CCR-1 активности и являются особенно эффективными. Например, поразительное преимущество перед другими соединениями показано ниже, в Таблицах 1 и 2. Анализ связывания CCR1 с ТНР-1 у человека. Для исследования конкурентных реакций с радиолигандами ТНР-1 клетки моноцитарного лейкоза в конечной концентрации 1105 смешивают с LS WGA PS гранулами (100 мкг) (Amersham, Cat.: RPNQ 0260) в 40 мкл аналитического буфера (RPMI 1640 без фенола красного, 50 мМ HEPES, 5 мМ MgCl2, 1 мМ CaCl2, 0.1% BSA). Смесь клетки ТНР-1/гранулы добавляют в каждую лунку 384-луночного аналитического планшета (PerkinElmer, Cat. :6007899), содержащую тестируемое соединение в 3-кратном серийном разведении с конечной концентрацией в интервале от 8 мкМ до 0.14 мкМ. В реакционную смесь добавляют [125I]-MIP-1 (PerkinElmer, CatNEX298) в конечной концентрации 0.1 нМ в 20 мкл аналитического буфера. В некоторые лунки в избытке добавляют немеченый MIP-1 для определения неспецифического связывания. Герметично закрытые планшеты инкубируют при комнатной температуре в течение 12 ч, затем анализируют с помощью программы LEADseeker. Результаты конкурентного анализа определяют как зависимость ингибирования (в процентах от ингибирования радиолиганда, специфически связанного в отсутствие тестируемого соединения (процент от общего сигнала от концентрации тестируемого соединения (в интервале концентраций). После поправки на неспецифическое связывание определяют значения IC50. Величину IC50 определяют как концентрацию тестируемого соединения, требующуюся для уменьшения специфического связывания [125I]-MIP-1 на 50%, и рассчитывают по четырхпараметрическому логистическому уравнению для получения нормализованных данных. Ki, величины определяют, применяя уравнение Ченга-Пруссова к значениям IC50,где Ki = IC50/(1+концентрация лиганда/Kd). Величина Kd для [125I]- MIP-1 в клетках ТНР-1 равна 0.1 нМ. Каждый эксперимент проводят в двойном повторе. Анализ методом локальной фиксации потенциала (электрофизиология, метод patch-clamp (пэтчкламп hERG."Цельноклеточный" patch-clamp используют для непосредственного измерения hERG следового тока в клетках НЕК-293, стабильно экспрессирующих клонированнуюсубъединицу калиевого каналаhERG. Эффекты соединений рассчитывают, количественно определяя ингибирование пикового следового тока. Эксперименты проводят с применением водного буфера с pH 7.4 при комнатной температуре. В аналитическом буфере отсутствует белок. Указанные концентрации тестируемого соединения представляют собой номинальные уровни свободного лекарства. Анализ натриевых и кальциевых каналов L-типа."Цельноклеточный" patch-clamp используют для непосредственного измерения тока ионов натрия внутрь клеток HEK-293, экспрессирующих натриевый канал сердца человека, SCN5A. После достижения эффекта в равновесном состоянии в присутствии лекарства определяют зависимость скорости, стимулируя при частотах 1 Гц и 4 Гц. Эксперименты проводят в водном буфере при pH 7.4 при комнатной температуре. Буфер не содержит белка и указанные концентрации лекарства представляют собой номинальные уровни свободного лекарства. Тестируемое изделие оценивают вплоть до концентрации 10 мкМ(безбелковый буфер). Зависимость скорости ингибирования определяют, стимулируя при частотах 1 Гц и 4 Гц. Помимо потенциала взаимодействия с кальциевым каналом L-типа "цельноклеточный" метод patchclamp (фиксации потенциала) используют для непосредственного измерения тока ионов кальция внутрь клеток HEK-293, стабильно экспрессирующих клонированный кальциевый канал L-типа сердца человека(1C) и егосубъединицы. Эффекты соединений рассчитывают, измеряя ингибирование пикового тока. Эксперименты проводят в водном буфере при pH 7.4 при комнатной температуре. Буфер не содержит белка и указанные концентрации лекарства представляют собой номинальные уровни свободного лекарства. Электрокардиография анестезированных кроликов. Исследование "доза-эффект" тестируемых соединений проводят на анестезированных кроликах для определения электрофизиологических показателей сердца на основе анализов ионных каналов. Эксперименты проводят на закрытом сердце анестезированных (пропофол-фентанил) самцов кроликов. В ходе исследования электрокардиограмму (ЭКГ) (на поверхности тела) и внутрисердечную электрограмму (гисограмму) непрерывно записывают и регистрируют, используя систему PoNeMah и систему электрофизиологического мониторинга Prucka, соответственно. Тестируемое соединение готовят в день исследования в носителе ПЭГ 400:этанол: вода (1:1:1) в концентрации дозирования 30 мг/мл. Тестируемое соединение (n=3) или носитель (n=3) вводят внутривенно через 5 мин с помощью инфузионного насоса в возрастающих дозах 3, 10 и 30 мг/кг. Интервалы между дозами составляют 10 мин и включают 5-минутное вливание тестируемого агента и 5-минутный перерыв. Пробы крови отбирают перед инфузией лекарства (базовая линия) и сразу же по окончании каждой инфузии. В случае дозы 30 мг/кг дополнительные образцы крови отбирают через 10, 10 и 30 мин по окончании инфузии. Интервал PR, длительность QRS и интервал QT являются усредннными от 1 минутного периода регистрации ЭКГ в момент взятия пробы крови. Интервал QT корректируют по частоте сердечных сокращений по формулам Fridericia (QTcf) и Van der Water (QTcv). Интервалы АН и HV, представляющие проводимость в узле А-V и проводимость в системе Гиса-Пуркинье, соответственно, определяют вруч-9 021224 ную по электрограмме пучка Гиса (гисограмме). Результаты выражают как процентное изменение по сравнению с фоном (среднееSEM) для PR, QRS, АН и HV интервалов, а такжеизменение по сравнению с фоном перед вливанием лекарства (среднееSEM) для QTc интервалов. Изменения 10% в PR,QRS и АН интервалах и 20% в HV интервале, а также 10 мсек в QTc интервале считаются значимыми,на основании опыта на модели. Как показано в табл. 1, результаты in vivo демонстрируют повышенный профиль безопасности соединения I. В частности, хотя in vitro Ki соединения I ниже по сравнению с другими соединениями, у соединения I также имеется Уровень Без Наблюдаемых Эффектов (NOEL) у кролика 10 мг/кг. Хотя соединение из примера 491 имеет аналогичный NOEL, у него наблюдается повышенное абсолютное пролонгирование интервала QT, а также пониженная свободная часть циркулирующего лекарства по сравнению с соединением I. Таблица 1. In Vivo и in Vivo сердечно-сосудистый профиль безопасности- Примеры из патентной заявки США, показанные ниже: Анализ трансактивации PXR В качестве среды для клеточных культур используют DMEM. Липофектамин 2000, PBS, термоинактивированная фетальная бычья сыворотка (FBS), трипсин-ЭДТА (EDTK) (0.25%) и пенициллинстрептомицин получают от GIBCO/Invitrogen (Carlsbad, СА). Фетальную бычью сыворотку (FBS), адсорбированную на системе древесный уголь-декстран, получают от Hyclone (Logan, UT). Клетки HepG2 получают из АТСС (Manassas, VA). Человеческую PXR-pcDNA3 (пкДНКЗ) и репортрный ген люциферазы, содержащий промотор CYP3A4, CYP3A-Luc, получают в компании Bristol-Myers Squibb. Белые 384 луночные планшеты для тканевых культур (ТС) получают от Perkin Elmer (Boston, MA). Субстрат для люциферазы (Steady-Glo) получают от Promega (Madison, WI). Контрольные соединения рифампицин,мифепристон и сульфинпиразон Sigma (St. Louis, МО). Культуру клеток HepG2 высевают в колбах Т 175, используя среду DMEM, содержащую 10% FBS. Трансфекционная смесь содержит 1 мкг/мл плазмидной ДНК PXR-pcDNA3, 20 мкг/мл плазмидной ДНК Сур 3 А-Luc, 90 мкл/мл липофектамина 2000 и бессывороточную среду. После инкубации при комнатной температуре в течение 20 мин трансфекционную смесь (1 мл на колбу) добавляют к клеткам в свежей среде (20 мл на колбу) и колбы инкубируют при 37 С (5% CO2) в течение ночи. Клетки в каждой колбе отмывают PBS и добавляют 2 мл трипсин-ЭДТА (0.25%) и инкубируют пять минут при 37C, 5% CO2. Затем по колбам энергично постукивают, чтобы разрушить клеточные агрегаты. Добавляют 8 мл DMEM, содержащей 5% FBS, адсорбированной на системе древесный уголь- 10021224 декстран, всю смесь переносят в конические пробирки. Затем клетки центрифугируют при 1000 rpm(об/мин) в течение 5 мин. Клеточный осадок ресуспендируют до конечного содержания 7106 клеток/мл в среде для замораживания (DMEM, содержащей 20% сыворотки и 10% DMSO). Аликвоты клеточной суспензии (5 мл) помещают в полипропиленовые пробирки на 15 мл. Клетки медленно замораживают,помещая их на ночь в герметизированный пенополистиролом контейнер при -80C. Через 24 ч виалы переносят в низкотемпературную морозильную камеру (-140C) для длительного хранения. Виалы с криоконсервированными клетками быстро размораживают на тплой водяной бане в течение пяти минут. Клетки собирают и разводят до 50 мл в конической виале на 50 мл. Оттаявшие клетки центрифугируют при 1500 об/мин в течение 5 мин, осаждают клетки, а супернатант отбрасывают. Затем клетки ресуспендируют в свежей Среде II (DMEM, содержащей 5% FBS, адсорбированную на системе древесный уголь-декстран, 1% пенициллина/стрептомицина, 100 мкМ заменимых аминокислот, 1 мМ пирувата натрия и 2 мМ L-глутамина), считают с помощью счтчика клеток Guava Cell Counter и разводят до плотности 1.6105 клеток/мл той же самой средой. В лунки 1-23 рядов обработанных клеточными культурами белых 384-луночных планшетов, содержащие 0.25 мкл тестируемого соединения, растворнного в 100% DMSO, добавляют пятьдесят микролитров клеточной смеси. В лунки 24 ряда добавляют пятьдесят микролитров среды II. Планшеты инкубируют при 37 С (5% CO2) в течение 24 ч, затем в каждую лунку добавляют 5 мкл реагента Alamar Blue(Trek Diagnostics, Cat 00- 100). Планшеты инкубируют ещ в течение 2 ч при 37C, 5% CO2, а затем один час при комнатной температуре. Флуоресценцию считывают при длинах волн Ех 525/Еm598. После измерения флуоресценции в каждую лунку добавляют 25 мкл субстрата люциферазы (Steady-Glo, Promega). Планшеты инкубируют в течение пятнадцати минут при комнатной температуре, после чего считывают люминесценцию на планшет-ридере PheraStar (BMG Labtech). Рифампицин (10 мкМ), хорошо известный агонист PXR, вводят в каждый планшет в качестве внутреннего стандарта и позитивного контроля. Затем выражают данные в виде контроля в процентах (%CTRL), где контрольный сигнал представляет собой сигнал от 10 мкМ рифампицина, а сигнал холостого опыта ("холостой" сигнал) представляет собой сигнал носителя (растворителя) DMSO (ДМСО). %CTRL= Сигнал соединения - "Холостой" сигнал)/(Контрольный сигнал -"Холостой" сигнал 100. Соединения тестируют в десяти концентрациях (2.5 нМ - 50 мкМ, серийное разведение 1:3). Результаты анализа регистрируют как EC50, концентрацию соединения, при которой наблюдается 50% максимального отклика, и как Ymax, obs, максимальный отклик (наивысший % CTRL), наблюдаемый для этого соединения. ЕС 50 определяется как концентрация, соответствующая половине максимального отклика, определяется на кривой, построенной по 20 точкам с применением четырхпараметрической логистической регрессионной модели. Помимо этого, соединения могут также характеризоваться с помощью EC20 илиEC50. Результаты анализа на HepG2 цитотоксичность. Соединения тестируют в десяти концентрациях (2.5 нМ - 50 мкМ, серийное разведение 1:3). Результаты анализа регистрируют как IC50, определяемую как концентрация, соответствующая ингибированию 50%, эту величину находят на кривой, построенной по 20 точкам с применением четырхпараметрической логистической регрессионной модели.In Vitro анализы метаболизма. Условия анализа А. Тестируемое соединение получают в виде исходного 3.5 мМ раствора в 100% ДМСО (DMSO). Соединение разводят, получая 50 мкМ раствор в ацетонитриле (ACN), содержащий 1.4% ДМСО, который затем используют в качестве 100 исходного раствора для инкубации с микросомами. Каждое соединение тестируют в двойном повторе отдельно для каждого из трх видов в наборе для анализа Метаболическая Стабильность - человека, крысы и мыши или в качестве индивидуального вида в наборах Метаболическая Стабильность - собака или Метаболическая Стабильность - обезьяна. Растворы соединения,NADPH и микросомы смешивают с целью инкубации в три стадии: 152 мкл суспензии микросом печени, концентрация белка 1.1 мг/мл в 100 мМ NaPi, pH 7.4, 6.6 мМMgCl2 буфера, предварительно нагревают при 37 С. 1) 1.7 мкл раствора соединения с концентрацией 50 мкМ (98.6% ACN, 1.4% DMSO) добавляют в ту же самую пробирку и преинкубируют при 37C в течение 5 мин. 2) Реакцию инициируют, добавляя 17 мкл предварительно нагретого 10 мМ NADPH в 100 мМ NaPi,pH 7.4. 3) Компоненты реакции тщательно перемешивают и 75 мкл сразу же переносят в 150 мкл раствора для тушения/прекращения реакции (временная точка ноль, Т 0). Реакционные смеси инкубируют при 37 С в течение 10 мин, а затем другую аликвоту 75 мкл переносят в 150 мкл раствора для тушения. В качестве раствора для тушения для прекращения метаболических реакций применяют ацетонитрил, содержащий 100 мкМ DMN (UV(УФ)-стандарт для введения количественного контроля). 4) Погашенные смеси центрифугируют при 1500 об/мин (500 X g) в центрифуге Allegra Х-12, ро- 11021224 тор SX4750 rotor (Beckman Coulter Inc., Fullerton,CA), в течение пятнадцати минут для осаждения денатурированных микросом. Затем экстракт супернатанта, содержащий смесь исходного соединения и его метаболитов, в объме 90 мкл переносят в отдельный 96-луночный планшет для UV(УФ)-LC/MS-MS анализа с целью определить процентное содержание исходного соединения, остающегося в смеси. Условия анализа В Тестируемое соединение получают в виде 20 мМ раствора в ДМСО (DMSO). Соединение разводят,получая 300 мкМ раствор в ацетонитриле (ACN), содержащий 1.5% ДМСО, который затем используют в качестве 100 исходного раствора для инкубации с микросомами. Каждое соединение тестируют в двойном повторе отдельно для каждого из трх видов в наборе для анализа Метаболическая Стабильность человека, крысы и мыши или в качестве индивидуального вида в наборах Метаболическая Стабильность- собака или Метаболическая Стабильность - обезьяна. Растворы соединения, NADPH и микросом печени смешивают с целью инкубации в три стадии: 1. 450 мкл суспензии микросом печени, концентрация белка 1.1 мг/мл в 100 мМ NaPi, pH 7.4, 6.6 мМ MgCl2 буфера, предварительно нагревают при 37 С. 2. 5 мкл раствора соединения с концентрацией 300 мкМ (98.5% ACN, 1.5% DMSO) добавляют в ту же самую пробирку. 3. Реакцию инициируют, добавляя 50 мкл предварительно нагретого 5 мМ раствора NADPH в 100 мМ NaPi, pH 7.4. Компоненты реакции тщательно перемешивают и 150 мкл сразу же переносят в 150 мкл раствора для регистрации показания во временной точке ноль. Реакционные смеси инкубируют при 37 С в течение 10 мин, а затем другую аликвоту 150 мкл переносят в 150 мкл и отбирают для инкубации. Взятые аликвоты смешивают с 300 мкл ACN, содержащего 100 мкМ DMN в качестве UV(УФ)-стандарта для детекции. Погашенные смеси центрифугируют при 1500 об/мин (500 X g) в центрифуге Allegra Х-12, роторSX4750 rotor (Beckman Coulter Inc., Fullerton,CA), в течение пятнадцати минут для осаждения денатурированных микросом. Затем экстракт супернатанта, содержащий смесь исходного соединения и его мета- 12021224 болитов, в объме 110 мкл переносят в отдельный 96-луночный планшет для UV(УФ)-LC/MS-MS анализа с целью определить процентное содержание исходного соединения, остающегося в смеси. Как показано ниже, в табл. 2, соединение I можно также позитивно отличать (характеризовать) по двум критическим показателям, PXR трансактивации и стабильности микросом печени человека. Продукт PXR трансактивации позволяет предсказывать возможные лекарственные взаимодействия. Если соединение активирует этот рецептор, другие лекарства могут метаболизироваться быстрее, чем обычно, что приводит к пониженным уровням и пониженной эффективности лекарств. Очевидно, что это нежелательное свойство соединения, предполагаемого для разработки.In vivo скрининг показывает, что соединение I является несущественным активатором этого рецептора по сравнению со всеми, кроме одного, перечисленными соединениями. Наконец, соединения тестируют в анализе стабильности микросом печени человека, который позволяет точно прогнозировать in vivo клиренс соединения. С целью разработки соединения менее чем с 70% выпадают из дальнейшего рассмотрения. Таким образом, что сочетание низкого риска PXR трансактивации со 100% остающегося соединения в анализе метаболизма микросом человеческой печени показывает, что соединение I имеет лучшие фармакологические характеристики по сравнению с другими известными и сходными по структуре CCR1 антагонистами. Таблица 2. Индукция потенциала и метаболическая стабильность PXR/Cyp 3 А 4-In Vitro- Соединения из примеров в патентной заявке США US2007/0208056 Хемокиновые рецепторы млекопитающих предоставляют мишень для вмешательства в функцию или для стимуляции функции иммунных клеток млекопитающего, такого как человек. Соединения, которые ингибируют или стимулируют рецепторную функцию, особенно применимы для модуляции функ- 13021224 ции иммунных клеток для терапевтических целей. В соответствии с этим настоящее изобретение относится к соединению формулы (I), которое, как полагают, применимо для предупреждения и/или лечения большого ряда воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания,инфицирование патогенными микробами (которое, по определению, включает вирусы), а также аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз. Например, соединение по настоящему изобретению, которое ингибирует одну или более функций хемокинового рецептора млекопитающего (например, человеческого хемокинового рецептора), можно вводить для ингибирования (т.е. уменьшения или предупреждения) воспалительного или инфекционного заболевания. В результате ингибируется один или более воспалительных процессов, таких как эмиграция лейкоцитов, адгезия, хемотаксис, экзоцитоз (например, ферментов, гистамина) или высвобождение медиаторов воспаления. Аналогично, соединение по настоящему изобретению, которое ингибирует одну или более функций хемокинового рецептора млекопитающего (например, человеческого хемокина), при введении для стимуляции (индукции или усиления) иммунной или воспалительной реакции, такой как эмиграция лейкоцитов, адгезия, хемотаксис, экзоцитоз (например, ферментов, гистамина) или высвобождение медиаторов воспаления, приводит к благотворной стимуляции воспалительных процессов. Например, эозинофилы могут рекрутироваться для борьбы с паразитарными инфекциями. Помимо этого, лечение вышеуказанных воспалительных, аллергических и аутоиммунных заболеваний с помощью соединения по данному описанию, которое стимулирует одну или более функций хемокинового рецептора млекопитающего,можно также рассматривать, если рассматривают доставку соответствующего соединения для того, чтобы вызвать потерю экспрессии рецептора на клетках за счт индукции интернализации хемокинового рецептора или доставки соединения таким способом, который приводит к неверному направлению миграции клетки. Помимо приматов, таких как человек, различных других млекопитающих можно лечить методом по настоящему изобретению. Например, можно лечить млекопитающих, включая, но без ограничения, коров, овец, лошадей, собак, кошек, морских свинок, крыс или другие виды жвачных, овечьих, лошадиных,псовых, кошачьих, грызунов или мышиных. Однако, метод можно практически применять также и для других видов, таких как птицы. Субъектом, которого лечат вышеуказанными методами, является млекопитающее мужского или женского рода, у которого желательна модуляция активности хемокинового рецептора. Предполагается, что термин "модуляция" по данному описанию охватывает антагонизм, агонизм, частичный антагонизм и/или частичный агонизм. Заболевания или состояния человека или представителя другого вида, которого можно лечить ингибиторами функции хемокинового рецептора, включают, но без ограничения: воспалительные или аллергические заболевания и состояния, включая респираторные аллергические заболевания, такие как астма, аллергический ринит, аллергические заболевания лгких, аллергический пневмонит, эозинофильный целлюлит (например, синдром Уэллса), эозинофильные пневмонии (например, синдром Лффлра,хроническая эозинофильная пневмония), эозинофильный фасциит (например, болезнь Шульмана), аллергическая реакция замедленного типа, интерстициальные лгочные болезни (ILD) (например, идиопатический лгочный фиброз или ILD, ассоциированные с ревматоидным артритом, системной красной волчанкой, анкилозирующим спондилитом, системным склерозом, синдромом Шгрена, полимиозитом или дерматомиозитом); системные анафилактические, или аллергические, реакции, лекарственную аллергию (например, на пенициллин, цефалоспорин), синдром эозинофилии-миалгии, вызванный потреблением содержащего примеси триптофана, аллергии, вызванные укусами насекомых; аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, системная красная волчанка, тяжлая псевдопаралитическая миастения, юношеский диабет; гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета; отторжение трансплантата (например, при трансплантации),включая отторжение аллотрансплантата или болезнь трансплантат-против-хозяина; воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит; спондилоартропатии; склеродермию; псориаз (включая псориаз, опосредуемый Т-клетками) и воспалительные дерматозы, такие как дерматит,экзема, атопический дерматит, аллергический контактный дерматит, крапивница; васкулит (например,некротизирующий, кожный и аллергический васкулит); эозинофильный миозит, эозинофильный фасциит; раковые заболевания с лейкоцитарной инфильтрацией кожи или органов. Можно лечить другие заболевания или состояния, при которых необходимо ингибировать нежелательные воспалительные реакции,включая, но без ограничения, реперфузионное повреждение, атеросклероз, некоторые злокачественные заболевания кроветворной системы, цитокин-индуцированную цитотоксичность (например, септический шок, эндотоксический шок), полимиозит, дерматомиозит. Инфекционные заболевания или состояния человека или других видов животных, которые можно лечить с применением ингибиторов функции хемокиновых рецепторов, включают, но без ограничения, ВИЧ. Заболевания или состояния человека или других видов, которые можно лечить с помощью промоторов функции хемокиновых рецепторов, включают, но без ограничения: иммунодепрессию (подавление иммунитета), такую, которая наблюдается у индивидуумов с синдромами иммунодефицита, например, в случае СПИДа или других вирусных инфекциях, у индивидуумов, проходящих лучевую терапию, химиотерапию, терапию аутоиммунных заболеваний или лекарственную терапию (например, терапию кортикостероидами), которая вызывает иммунодепрессию; иммунодепрессию, вызванную врожднной недостаточностью рецепторной функции или другими причинами; инфекционные заболевания, такие как паразитарные заболевания, включая, но без ограничения, заражение гельминтами, такими как нематоды(круглые черви) (трихуриаз, энтеробиоз, аскаридоз, анкилостомоз, стронгилоидоз, трихиноз, филяриоз); трематодами (сосальщиками) (шихостомоз, клонорхоз), цестодами (ленточными червями) (эхинококкоз,тениаринхоз, цистицеркоз); синдром "блуждающей личинки" (личиночный гельминтоз) (например,Toxocara), эозинофильный гастроэнтерит (например, Anisaki sp. (анизакис), Phocanema sp. (фоканема,кожная мигрирующая личинка (ползучая сыпь) (анкилостома бразильская, анкилостома канинум (собак. В связи с этим соединения по настоящему изобретению применимы для предупреждения и лечения большого ряда воспалительных, инфекционных или иммунорегуляторных расстройств и заболеваний. Помимо этого, лечение вышеуказанных воспалительных, аллергических и аутоиммунных заболеваний также можно рассматривать для промоторов функции хемокиновых рецепторов при рассмотрении доставки соответствующего соединения с целью вызвать потерю экспрессии рецептора на клетках за счт индукции интернализации хемокинового рецептора или доставки соединения таким способом, который приводит к неверному направлению миграции клетки. В другом аспекте настоящее изобретение можно применять для оценки возможных специфических агонистов или антагонистов рецептора, сопряжнного с G-белком. Настоящее изобретение относится к применению соединения формулы (I) для подготовки и проведения скрининга на соединения, которые модулируют активность хемокиновых рецепторов. Помимо этого, соединение по данному изобретению применимо для установления или определения сайта связывания других соединений с хемокиновыми рецепторами, например, с помощью конкурентного ингибирования или в качестве эталона в анализе для сравнения этого соединения с известной активностью с соединением с неизвестной активностью. При разработке новых анализов и протоколов соединение по настоящему изобретению можно было бы использовать для тестирования их эффективности. Конкретно, такое соединение можно было бы включать в продажный набор, например, применения в фармацевтическом исследовании, включающем вышеперечисленные заболевания. Соединение по настоящему изобретению применимо также для оценки возможных специфических модуляторов хемокиновых рецепторов. Помимо этого, соединение по данному изобретению можно применять для изучения специфичности рецепторов, сопряжнных с G-белками, которые, предположительно, не являются хемокиновыми рецепторами, либо в качестве примеров соединений, которые не связываются, либо в качестве структурных вариантов соединений, активных к этим рецепторам, которые могут способствовать определению специфических сайтов взаимодействия. Соединение формулы (I) применяется для лечения или предупреждения расстройств, выбранных из ревматоидного артрита, остеоартрита, септического шока, артросклероза, аневризмы, лихорадки, сердечно-сосудистых эффектов, гемодинамического шока, сепсис-синдрома, реперфузионного постишемического поражения, малярии, болезни Крона, воспалительных заболеваний кишечника, микобактериальных инфекций, менингита, псориаза, застойной сердечной недостаточности, фиброзных заболеваний, кахексии, отторжения трансплантата, аутоиммунных заболеваний, воспалительных заболеваний кожи, рассеянного склероза, радиационного поражения, гипероксидного поражения лгких (альвеолярного эпителия), ВИЧ, ВИЧ деменции, инсулиннезависимого сахарного диабета, астмы, аллергического ринита, атопического дерматита, идиопатического лгочного фиброза, буллзного пемфигоида, гельминтных паразитарных инфекций, аллергического колита, экземы, конъюнктивита, трансплантации, семейной эозинофилии, эозинофильного целлюлита, эозинофильной пневмонии, эозинофильного фасциита, эозинофильного гастроэнтерита, лекарственной эозинофилии, муковисцидоза (кистозного фиброза), синдрома Черга-Страусс, лимфомы, болезни Ходжкина, карциномы толстой кишки, синдрома Фелти, саркоидоза, увеита, болезни Альцгеймера, гломерулонефрита и системной красной волчанки. В другом аспекте соединение формулы (I) применяется для лечения или предупреждения воспалительных расстройств, выбранных из ревматоидного артрита, остеоартрита, артросклероза, аневризмы,лихорадки, сердечно-сосудистых эффектов, болезни Крона, воспалительных заболеваний кишечника,застойной сердечной недостаточности, рассеянного склероза, аутоиммунных заболеваний, воспалительных кожных заболеваний. В другом аспекте изобретения соединение применяют для лечения или предупреждения воспалительных расстройств, выбранных из ревматоидного артрита, остеоартрита, артросклероза, болезни Крона, воспалительных заболеваний кишечника и рассеянного склероза. Комбинированная терапия для предупреждения и лечения воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания, а также аутоиммунные патологии, такие как ревматоидный артрит и артросклероз, и патологии, указанные выше,иллюстрируется комбинацией соединения формулы (I) по данному изобретению и других соединений,заведомо применяемых в таких случаях. Например, для лечения или предупреждения воспаления соединение по данному изобретению можно применять в сочетании с противовоспалительным или обезболи- 15021224 вающим (аналгетик) агентом, таким как агонист опиатов, ингибитор липоксигеназы, ингибитор циклооксигеназы-2, ингибитор интерлейкинов, такой как ингибитор интерлейкина-1, ингибитор фактора некроза опухолей, анагонист NMDA, ингибитор оксида азота или ингибитор синтеза оксида азота, нестероидный противовоспалительный агент, ингибитор фосфодиэстеразы или противовоспалительный агент, подавляющий синтез провоспалительных цитокинов, например, в сочетании с таким соединением, как ацетаминофен, аспирин, кодеин, фентанил, ибупрофен, индометацин, кеторолак, морфин, напроксен, фенацетин, пироксикам, стероидный аналгетик, суфентанил, сунлиндак, интерферон альфа и т.п. Аналогично,соединение по настоящему изобретению можно вводить с агентом, ослабляющим боль; потенцирующим агентом, таким как кофеин, Н 2-антагонист, симетикон, гидроксид алюминия или магния; противозастойным, противоотчным агентом, таким как фенилэфрин, фенилпропаноламин, псевдофедрин, оксиметазолин, эпинефрин, нафазолин, ксилометазолин, пропилгекседрин или леводезоксиэфедрин; противокашлевым агентом, таким как кодеин, гидрокодон, карамифен, карбетапентан или декстрометаморфан; диуретиком; и седативным или неседативным антигистаминным агентом. Также соединение формулы (I) можно использовать в комбинации с другими лекарствами, которые применяются для лечения/предупреждения/подавления или ослабления заболеваний или состояний, для лечения/предупреждения которых применимо соединение по настоящему изобретению. Такие другие лекарства можно вводить таким способом и в таком количестве, которые обычно применяются в этом случае, одновременно или последовательно с соединением по настоящему изобретению. Если соединение формулы (I) применяют одновременно с одним или более других лекарств, помимо соединения формулы (I) может применяться фармацевтическая композиция, содержащая эти другие лекарства. Соответственно, фармацевтические композиции по настоящему изобретению включают такие композиции, которые, помимо соединения формулы(I), содержат также один или более активных ингредиентов. Примеры других активных ингредиентов, которые можно объединять с соединением по настоящему изобретению, либо вводить отдельно, либо в тех же самых фармацевтических композициях, включают, но без ограничения: (а) антагонисты интегрина, такие как антагонисты селектинов, ICAM и VLA-4;(б) стероиды, такие как беклометазон, метилпреднизолон, бетаметазон, преднизон, дексаметазон и гидрокортизон; (в) иммуносупрессоры (иммунодепрессанты), такие как циклоспорин, такролимус, рапамицин и другие иммуносупрессоры типа FK-506; (г) антигистаминные агенты (антагонисты H1- гистамина),такие как бромфенирамин, хлорфенирамин, дексхлорфенирамин, трипролидин, клемастин, дифенгидрамин, дифенилпиралин, трипеленнамин, гидроксизин, метдилазин, прометазин, тримепразин, азатадин,ципрогептадин, антазолин, фенирамин, пириламин, астемизол, терфенадин, лоратадин, цетиризин, фексофенадин, дескарбэтоксилоратадин и т.п.; (д) нестероидные антигистаминные агенты, такие как b2 агонисты (тербуталин, метапротеренол, фенотерол, изоэтарин, альбутерол, битолтерол и пирбутерол),теофиллин, кромолин-натрий, атропин, ипратропия бромид, антагонисты лейкотриена (зафирлукаст,монтелукаст, пранлукаст, иралукаст, побилукаст, SKB-102, 203), ингибиторы биосинтеза лейкотриена(зилеутон, BAY-1005); (е) нестероидные противовоспалительные агенты (НПВП, NSAID), такие как производные пропионовой кислоты (альминопрофен, бенксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флурпрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен,напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен),производные уксусной кислоты (индометацин, ацеметацин, альклофенак, клиданак, диклофенак, фенклофенак, фенклозовая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомерипак), производные фенаминовой кислоты (флуфенаминовая кислота, меклофенаминовая кислота, мефенаминовая кислота, нифлуминовая кислота и толфенаминовая кислота), производные бифенилкарбоновой кислоты (дифлунизал и флуфенизал), оксикамы (изоксикам,пироксикам, судоксикам и теноксикам), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон); (ж) ингибиторы циклооксигеназы-2 (СОХ-2); (з) ингибиторы фосфодиэстеразы типа IV (PDE-IV); (и) другие антагонисты хемокиновых рецепторов; (к) агенты, понижающие содержание холестерина, такие как ингибиторы HMG-СОА редуктазы (ловастатин, симвастатин и правастатин, флувастатин, аторвастатин и другие статины), секвестранты желчных кислот (холестирамин и колестипол), никотиновая кислота, производные фенофиброевой кислоты (гемфиброзил, клофибрат, фенофибрат и бензофибрат) и пробукол; (л) антидиабетические агенты, такие как инсулин, сульфонилмочевины, бигуаниды (метформин), ингибиторы-глюкозидазы (акарбоза) и глитазоны (троглитазон и пиоглитазон); (м) препараты интерферонов (интерферон альфа-2 а, интерферон-2 В, интерферон альфа-N3, интерферон бета-1 а, интерферон бета-2b, интерферон гамма 1b); (н) антивирусные соединения, такие как эфавиренз, невирапин, индинавир, ганцикловир, ламивудин, фамцикловир и зальцитабин; (о) другое соединение, такое как 5-аминосалициловая кислота и ее пролекарства, антиметаболиты, такие как азатиоприн и 6-меркаптопурин, и цитотоксические противораковые химиотерапевтические агенты. Весовое соотношение соединения формулы (I) ко второму активному ингредиенту может варьироваться и зависит от эффективных доз каждого ингредиента. Обычно применяют эффективную дозу каждого ингредиента. Так например, если соединение формулы (I) комбинируют с НПВП (NSAID), весовое отношение соединения по настоящему изобретению к НПВП обычно составляет примерно от 1000:1, примерно до 1:1000 или же примерно от 200:1, примерно до 1:200. Комбинация соединения формулы (I) и других активных ингредиентов обычно находится в вышеуказанном интервале, но в каждом случае берут эффективную дозу каждого активного ингредиента. Соединение вводят млекопитающему в терапевтически эффективном количестве. Под "терапевтически эффективным количеством" понимают количество соединения формулы I, которое при введении его млекопитающему, индивидуально или в комбинации с терапевтически эффективным агентом эффективно предупреждает или уменьшает интенсивность тромбоэмболического болезненного состояния или прогрессирования заболевания. Дозировка и рецептура Соединение по настоящему изобретению можно вводить в виде таких пероральных лекарственных форм, как таблетки, капсулы (каждая из которых включает препараты с пролонгированным высвобождением или с отсроченным высвобождением), пилюли, порошки, гранулы, эликсиры, настойки, суспензии,сиропы и эмульсии. Его также можно применять в виде лекарственных форм для внутривенного (болюс или инфузия), интраперитонеального, подкожного или внутримышечного введения, все эти лекарственные формы хорошо известны рядовому специалисту в области фармации. Его можно вводить самостоятельно, но обычно его вводят с фармацевтическим носителем, выбранным с учтом пути введения и стандартной фармацевтической практики. Лекарственная схема для применения соединения по настоящему изобретению, несомненно, меняется в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного агента и его способ и путь введения; вид, возраст, пол, состояние здоровья, медицинское состояние и масса реципиента; характер и интенсивность симптомов; вид конкурентного (одновременного) лечения; частота лечения; путь введения, почечная и печночная функция пациента и ожидаемый эффект. Врач или ветеринар могут определить и назначить эффективное количество лекарства, необходимое для предупреждения, противодействия или прекращения прогрессирования тромбоэмболического расстройства. В качестве руководства суточная пероральная доза каждого активного ингредиента при применении для идентичных эффектов составляет примерный интервал от 0.001 до 1000 мг/кг массы тела, или,примерно, от 0.01 до 100 мг/кг массы тела в день, или же примерно 1.0-20 мг/кг/день. Интервал доз для внутривенного введения составляет примерно 1-10 мг/кг/минута при инфузии с постоянной скоростью. Соединение по данному изобретению можно вводить в виде однократной суточной дозы или общую суточную дозу можно вводить в виде небольших (дробных) доз два, три или четыре раза ежедневно. Соединение по настоящему изобретению можно вводить в интраназальной форме в подходящих интраназальных растворителях, или трансдермальным методом, используя трансдермальные пэтчи (пластыри). При введении в виде трансдермальной системы доставки введение дозы, естественно, является скорее непрерывным, нежели прерывистым (дробным) в продолжение лекарственной схемы. Соединение обычно вводят в смеси с подходящими фармацевтическими разбавителями, эксципиентами или носителями (все вместе в данном описании они называются фармацевтическими носителями),соответствующим образом выбранными с учтом предполагаемой формы введения, а именно формы пероральных таблеток, капсул, эликсиров, сиропов и т.п., и на основании обычной фармацевтической практики. Например, для перорального применения в виде таблетки или капсулы активный компонент лекарства можно смешивать с пероральным нетоксическим фармацевтически приемлемым инертным носителем, таким как лактоза, крахмал, сахароза, метилцеллюлоза, стеарат магния, дикальцийфосфат, манит,сорбит и т.п.; для перорального введения в жидком виде компоненты перорального лекарства можно смешивать с любым пероральным нетоксическим фармацевтически приемлемым инертным носителем,таким как этанол, глицерин, вода и т.п. Помимо этого, при желании или при необходимости, в смесь можно вводить подходящие связующие, смазки, разрыхлители и красители. Подходящие связующие включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристое вещество из кукурузы, природные и синтетические камеди, такие как аравийская камедь, камедь трагаканта, или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и т.п. Смазки, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия,ацетат натрия, хлорид натрия и т.п. Разрыхлители включают, но без ограничения, крахмал, метилцеллюлозу, агар-агар, бентонит, ксантановую камедь и т.п. Соединение по настоящему изобретению можно также вводить в виде липосомных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин,стеариламин и фосфатидилхолины. Соединение по настоящему изобретению можно также связывать с растворимыми полимерами в качестве носителей нацеленных лекарств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламид-фенол, полигидроксиэтиласпартамидфенол или полиэтиленоксид-полилизин, замещнный пальмитоильными остатками. Помимо этого, соединения по настоящему изобретению могут быть связаны с полимерами класса биоразрушаемых полимеров, применяемыми для достижения контролируемого высвобождения лекарства, например, с полимолочной кис- 17021224 мыми для достижения контролируемого высвобождения лекарства, например, с полимолочной кислотой,полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислот, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами,полицианоацилатами и сшитыми или амфипатическими блок-сополимерами гидрогелей. Лекарственные формы (фармацевтические композиции), пригодные для введения, могут содержать примерно от 1 мг до примерно 100 мг активного ингредиента на единичную (разовую) лекарственную дозу. В этих фармацевтических композициях активный ингредиент обычно присутствует в количестве 0.5-95 вес.% от общего веса композиции. Желатиновые капсулы могут содержать активный ингредиент и порошкообразные носители, такие как лактоза, крахмал, производные целлюлозы, стеарат магния, стеариновая кислота и т.п. Аналогичные разбавители можно применять для приготовления прессованных таблеток. Как таблетки, так и капсулы можно получать в виде продуктов с пролонгированным высвобождением, чтобы обеспечить непрерывное высвобождение лекарственного средства в течение нескольких часов. Прессованные таблетки могут быть покрыты сахаром или плнкой, чтобы замаскировать неприятный вкус и защитить таблетку от окружающей среды, или энтеросолюбильной оболочкой для селективного расщепления в желудочнокишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать краситель и корригент(запаха и вкуса), чтобы быть более привлекательными для пациента. Обычно вода, подходящее масло, солевой (физиологический) раствор, водный раствор декстрозы(глюкозы) и растворы аналогичных сахаров и гликоли, такие как пропиленгликоль или полиэтиленгликоли являются подходящими носителями для парентеральных растворов. Растворы для парентерального введения могут содержать водорастворимую соль активного ингредиента, соответствующие стабилизаторы, и, при необходимости, буферы. Антиоксиданты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота, либо индивидуально, либо в смеси, являются подходящими стабилизаторами. Также применяются лимонная кислота и е соли и натрий ЭДТА. Помимо этого, растворы для парентерального введения могут содержать консерванты, такие как бензалкония хлорид, метил- или пропилпарабен и хлорбутанол. Подходящие фармацевтические носители описаны в Remington's Pharmaceutical Sciences, Mack Publishing Company, стандартном руководстве по фармации. Типичные применяемые фармацевтические лекарственные формы для введения соединений по настоящему изобретению проиллюстрированы ниже. Капсулы. Большое число стандартных капсул (капсул со стандартной дозой) можно приготовить, помещая в каждую стандартную разъмную тврдую желатиновую капсулу 100 мг порошка активного ингредиента,150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы. Можно приготовить смесь активного ингредиента в усвояемом масле, таком как соевое масло,хлопковое масло или оливковое масло, и ввести его с помощью нагнетательного насоса в желатин, получая мягкие желатиновые капсулы, содержащие 100 мг активного ингредиента. Капсулы следует промыть и высушить. Таблетки. Можно приготовить таблетки обычными способами так, чтобы стандартная лекарственная форма составляла 100 мг активного ингредиента, 0.2 мг коллоидного диоксида кремния, 5 мг стеарата магния,275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98.8 мг лактозы. Можно нанести подходящее покрытие, чтобы улучшить вкус или замедлить всасывание. Лекарственный препарат для инъекций. Композицию для парентерального введения, применимую для введения с помощью инъекции,можно приготовить, перемешивая 1.5 вес.% активного ингредиента в 10 об.% растворе полиэтиленгликоля в воде. Раствор следует сделать изотоническим с помощью хлористого натрия и стерилизовать. Суспензия. Водную суспензию для перорального применения можно приготовить таким образом, чтобы каждые 5 мл содержали 100 мг тонкоизмельчнного активного ингредиента, 200 мг натрий карбоксиметилцеллюлозы, 5 мг бензоата натрия, 1.0 г раствора сорбита, U.S.P., и 0.025 мл ванилина. Если соединение по изобретению смешивают с антикоагулянтами, ежедневная (суточная) доза может составлять, например, около 0.1-100 мг соединения формулы I и около 1-7.5 мг второго агента, антикоагулянта, на килограмм веса (массы) тела пациента. В таблетках соединение по данному изобретению обычно может присутствовать в примерном количестве 5-10 мг на стандартную (разовую) лекарственную форму, а второй агент, антикоагулянт, может присутствовать в примерном количестве 1-5 мг на стандартную лекарственную форму. Если с соединением формулы I вводят два или более вышеуказанных вторых терапевтических агентов, как правило, количество каждого компонента в типичной суточной лекарственной форме может быть ниже по сравнению с обычной дозой агента при индивидуальном его введении из-за аддитивного или синергического эффекта терапевтических агентов при введении в комбинации. В частности, при введении в виде единой стандартной лекарственной формы существует возможность химического взаимодействия между активными ингредиентами в смеси. По этой причине, когда соединение формулы I и второй терапевтический агент смешиваются в виде единой стандартной лекарственной формы, их готовят таким образом, чтобы, хотя активные ингредиенты и объединены в виде единой стандартной лекарственной формы, но физический контакт между активными ингредиентами должен сводится к минимальному (т.е. уменьшен). Например, один активный ингредиент может покрываться энтеросолюбильной оболочкой. С помощью энтеросолюбильного покрытия одного из активных ингредиентов можно не только минимизировать контакт между объединнными активными ингредиентами, но возможно также контролировать высвобождение одного из этих компонентов в желудочно- кишечном тракте таким образом, чтобы один из этих компонентов высвобождался скорее не в желудке, а в кишечнике. Один из активных ингредиентов может быть также покрыт материалом, который влияет на пролонгированное высвобождение в желудочно- кишечном тракте, а также служит для снижения физических контактов между смешиваемыми активными ингредиентами до минимума. Более того, соединение с пролонгированным высвобождением может быть покрыто дополнительной энтеросолюбильной оболочкой с тем, чтобы высвобождение этого компонента происходило только в кишечнике. Ещ один метод включает приготовление комбинированного продукта, в котором компонент покрывают полимером для пролонгированного высвобождения и/или высвобождения в кишечнике, а другой компонент также покрывают полимером,таким как гидроксипропилметилцеллюлозой (НРМР) с низкой вязкостью или другими подходящими материалами, известными в уровне техники, чтобы дополнительно разделить активные компоненты. Полимерное покрытие служит для создания дополнительного барьера для взаимодействия с другим компонентом. Эти, а также другие пути минимизации контакта между компонентами комбинированных продуктов по настоящему изобретению, вводимыми либо в виде единой лекарственной формы, либо в отдельных формах одновременно одним и тем же способом. Один из активных ингредиентов может быть также покрыт материалом, который влияет на пролонгированное высвобождение в желудочно-кишечном тракте, а также служит для минимизации физического контакта между смешанными активными ингредиентами. Помимо этого, компонент с пролонгированным высвобождением дополнительно может быть покрыт энтеросолюбильной оболочкой с тем, чтобы высвобождение этого компонента происходило только в кишечнике. Ещ один подход включает приготовление комбинированного продукта, в котором один компонент покрыт полимером для пролонгированного высвобождения и/или высвобождения в кишечнике, а другой компонент также покрыт полимером, таким как гидроксипропилметилцеллюлоза (НРМС) с низкой вязкостью или другими подходящими материалами, известными в фармации, чтобы дополнительно разделить активные компоненты. Полимерное покрытие служит для создания дополнительного барьера между компонентами. Эти, а также другие способы минимизации контакта между компонентами комбинированных продуктов по настоящему изобретению, вводимых либо в виде единой лекарственной формы, либо в виде раздельных форм, но одновременно одним и тем же способом, будут легко понятны специалисту в данной области техники с учтом данного описания. Хотя изобретение описано подробно и со ссылками на его конкретные варианты, специалисту в данной области техники ясно, что в нм можно осуществлять различные изменения и модификации без отступления от его сущности и объма. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его стереоизомер или фармацевтически приемлемая соль. 2. Фармацевтическая композиция для лечения и предупреждения воспалительных заболеваний, аллергических и аутоиммунных заболеваний, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 3. Способ модуляции активности хемокина или хемокинового рецептора, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1. 4. Способ по п.3, отличающийся тем, что активность хемокина и активность хемокинового рецептора представляют собой активность хемокина СС-1 и активность хемокинового рецептора CCR-1. 5. Способ лечения расстройства, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1, причм указанное расстройство выбирают из фиброзных заболеваний, интерстициальных лгочных болезней, почечного фиброза, кистозного фиброза,- 19021224 идиопатического лгочного фиброза и ревматоидного артрита. 6. Способ лечения воспалительных заболеваний, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1. 7. Способ лечения воспалительных заболеваний, которые, по меньшей мере частично, опосредуются CCR-1, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1. 8. Способ лечения воспалительных заболеваний, аллергических и аутоиммунных заболеваний у пациента, нуждающегося в терапии, заключающийся во введении указанному нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1. 9. Способ модуляции активности хемокина или хемокинового рецептора, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2. 10. Способ модуляции активности CCR-1, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2. 11. Способ лечения расстройства, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2, отличающийся тем, что указанное расстройство выбирают из фиброзных заболеваний, интерстициальных лгочных болезней, почечного фиброза,кистозного фиброза, идиопатического лгочного фиброза и ревматоидного артрита. 12. Способ лечения воспалительных заболеваний, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.2. 13. Способ приготовления лекарственного препарата для лечения фиброзных заболеваний, интерстициальных лгочных болезней, почечного фиброза, кистозного фиброза, идиопатического лгочного фиброза и ревматоидного артрита, заключающийся в приготовлении композиции по п.2 в применимой фармацевтической лекарственной форме.
МПК / Метки
МПК: A61P 19/02, A61K 31/451, C07D 211/52
Метки: рецептора, производное, хемокинового, модулятор, активности, пиперидинильное
Код ссылки
<a href="https://eas.patents.su/21-21224-piperidinilnoe-proizvodnoe-kak-modulyator-aktivnosti-hemokinovogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Пиперидинильное производное как модулятор активности хемокинового рецептора</a>












