Новые соединения 2,3-метаноаминокислоты, способ их получения и содержащие их фармацевтические композиции
Номер патента: 2645
Опубликовано: 29.08.2002
Авторы: Де Нантей Гийом, Глоанек Филипп, Верберен Тони, Рюпэн Ален
Формула / Реферат
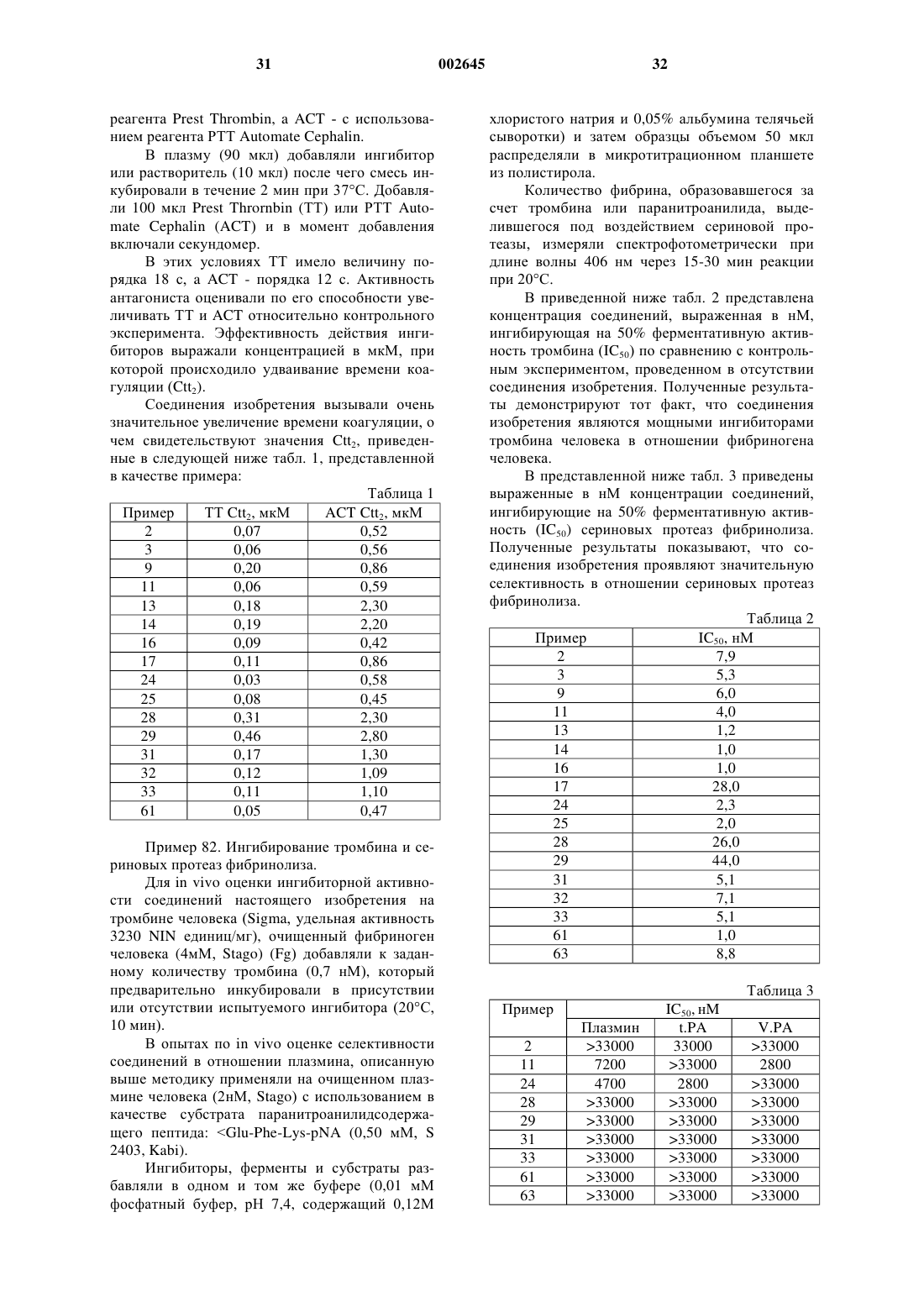
1. Соединение формулы (I)
в которой n равно 2 или 3,
R1 представляет собой (С3-С8)циклоалкильную группу, необязательно замещенную фенильную группу или линейную либо разветвленную (C1-C6)алкильную группу, необязательно замещенную одной или более одинаковыми или различными группами, выбранными из галогена, (С3-C8)циклоалкила и необязательно замещенного фенила,
R2 представляет собой аминогруппу, амидиногруппу, необязательно замещенную одной или более одинаковыми или различными группами, выбранными из линейного или разветвленного (С1-С6)алкила и гидроксигруппы, гуанидиногруппу, необязательно замещенную линейной или разветвленной (C1-С6)алкильной группой, или изотиоуреидогруппу, необязательно замещенную линейной или разветвленной (C1-C6)алкильной группой,
Аr представляет собой арильную группу или моноциклическую азотсодержащую гетероарильную группу,
X1 представляет собой гидроксигруппу, аминогруппу или группу -NHR3,
R3 представляет собой пропаргильную группу, иминометильную группу, линейную или разветвленную (C1-C6)алкилсульфонильную группу, линейную или разветвленную арил(C1-C6)алкилсульфонильную группу, группу -CONR'3R''3 или линейную или разветвленную (C1-С6)алкильную группу, необязательно замещенную группой -СO2R'3, группой -CONR'3R"3, гетероциклической группой, аминосульфонильной группой, арильной группой или гетероарильной группой,
R'3 и R"3, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С1-С6)алкилсульфонильную группу, арильную группу, линейную или разветвленную (C1-C6)алкильную группу (необязательно замещенную карбоксигруппой, линейной или разветвленной (C1-С6)алкоксикарбонильной группой или карбамоильной группой), или совместно с атомом азота, с которым они связаны, образуют гетероциклическую группу,
их изомеры, а также их соли присоединения фармацевтически приемлемой кислоты или основания,
при условии, что термин "необязательно замещенный фенил" обозначает фенил, замещенный одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (С1-С6)алкила, линейной или разветвленной (C1-C6)алкокси, гидрокси, линейного или разветвленного тригалоид(С1-С6)алкила и аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1-C6)алкильными группами),
термин "гетероциклическая группа" относится к насыщенной или ненасыщенной, моно- или бициклической группе, имеющей 5-12 членов кольца, содержащей один, два или три гетероатома, выбранных из кислорода, азота и серы, при условии, что гетероцикл может быть необязательно замещен одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С6)алкила, линейного или разветвленного (C1-С6)алкокси, оксо, гидрокси, линейных или разветвленных тригалоид(С1-С6)алкильных групп и амино (необязательно замещенной одной или более линейными или разветвленными (C1-C6)алкильными группами),
термин "арил" обозначает фенил, бифенилил или нафтил, причем каждая из этих групп может быть необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (C1-C6)алкокси, гидрокси, линейного или разветвленного тригалоид(С1-С6)алкила, аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1-С6)алкильными группами) и карбокси,
а термин "гетероарильная группа" обозначает ароматическую моно- или бициклическую группу, имеющую 5-12 членов кольца, содержащую один, два или три гетероатома, выбранных из кислорода, азота и серы, причем гетероарил может быть необязательно замещен одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С6)алкила, гидрокси, линейного или разветвленного (C1-С6)алкокси, тригалоидметила и аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1-С6)алкильными группами).
2. Соединение формулы (I) по п.1, в котором R1 представляет собой (С3-С8)циклоалкильную группу или необязательно замещенную линейную или разветвленную (C1-C6)алкильную группу.
3. Соединение формулы (I) по п.1, в котором R2 представляет собой амино или амидиногруппу.
4. Соединение формулы (I) по п.1, в котором Аr представляет собой необязательно замещенную фенильную группу или необязательно замещенную пиридильную группу.
5. Соединение формулы (I) по п.1, в котором X1 представляет собой аминогруппу или группу -NHR3, в которой R3 представляет собой линейную или разветвленную арил(С1-С6)алкилсульфонильную группу или необязательно замещенную линейную или разветвленную (C1-C6)алкильную группу.
6. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3,3-дифенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамид, его изомеры, а также соли присоединения фармацевтически приемлемой кислоты.
7. Соединение формулы (I) по п.1, представляющее собой 1-[N-карбоксиметил-(2R)-циклогексилглицил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты.
8. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил]-(2S,3S)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты.
9. Соединение формулы (I) по п.1, представляющее собой 1-[N-метил-(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты.
10. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3,3-дифенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты.
11. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3,3-дициклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты.
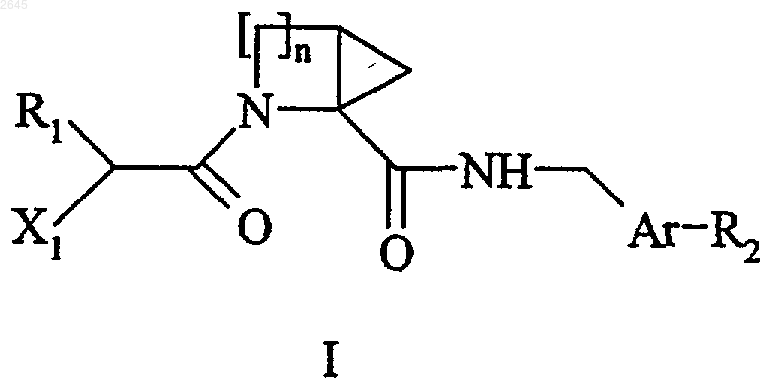
12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II)
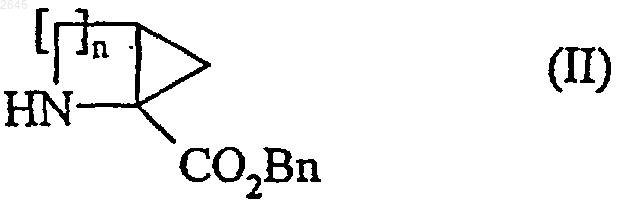
в которой n имеет значения указанные для формулы (I), а Вn представляет собой бензильную группу, подвергают взаимодействию с соединением формулы (III)
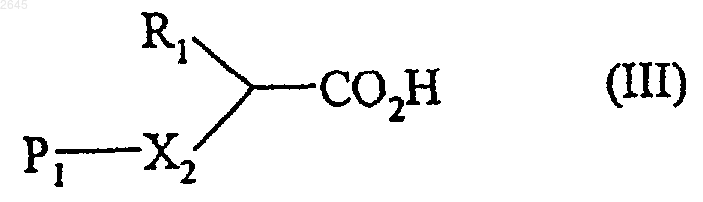
в которой R1 имеет значения указанные для формулы (I), X2 представляет собой атом кислорода или -NH-, a P1 представляет собой защитную группу амино- или гидроксифункции, в присутствии пептидного связующего агента, с образованием соединения формулы (IV)
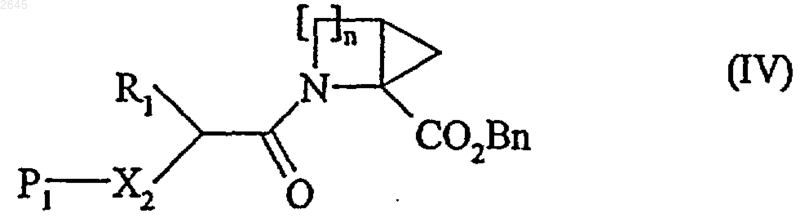
в которой n, R1, Х2, Вn и P1 имеют указанные выше значения, после чего соединение формулы (IV) путем каталитического гидрирования или гидролиза превращают в соединение формулы (V)

в которой n, R1, X2 и P1 имеют указанные выше значения, после чего соединение формулы (V) подвергают взаимодействию с соединением формулы (VI)
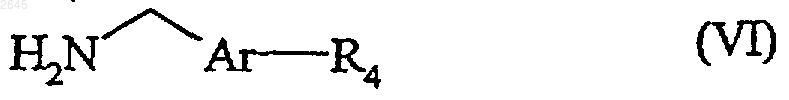
в которой Аr имеет значения указанные для формулы (I), a R4 представляет собой R2 или R2-P2, причем R2 имеет значения указанные для формулы (I), a P2 представляет собой защитную группу аминофункции, в присутствии пептидного связующего агента, с образованием соединения формулы (VII)
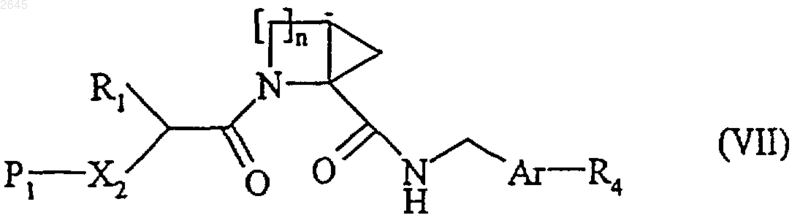
в которой n, R1, R4, Аr, Х2 и P1 имеют указанные выше значения,
после чего соединение формулы (VII) превращают в соединение формулы (I) путем одной или более реакций снятия защитной группы, алкилирования или восстановительного аминирования, после чего соединение формулы (I), если необходимо, подвергают очистке в соответствии с общепринятым методом очистки, если желательно, разделяют на его изомеры в соответствии с общепринятым методом разделения и, если желательно, превращают в соль присоединения фармацевтически приемлемой кислоты или основания.
13. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из п.1-11, совместно с одним или более фармацевтически приемлемыми инертными, нетоксичными носителями.
14. Фармацевтическая композиция по п.13 для применения в качестве ингибитора трипсиноподобной сериновой протеазы.
15. Фармацевтическая композиция по п.14 для применения в качестве ингибитора тромбина.
Текст
1 Настоящее изобретение относится к новым соединениям 2,3-метаноаминокислоты, способу их получения, фармацевтическим композициям,содержащим такие соединения, а также к их применению в качестве ингибиторов трипсиноподобной сериновой протеазы. Одна из таких сериновых протеаз, тромбин, является ключевым ферментом коагуляции и играет центральную роль в патологии венозного и артериального тромбоза, что главным образом связано с выраженной способностью этого фермента вызывать аутоамплификацию системы свертывания крови (F.Toti с сотр., Sang,Thrombose, Vaisseaux 1992, 4, 483-494 и Т.М.Reilly с сотр., Blood coagulation and fibrinolysis 1992, 3, 513-517). Специфическое и непосредственное ингибирование тромбина более эффективно и менее рискованно в отношении возможного кровотечения, чем лечение гепарином. В настоящее время известен ряд тромбиновых ингибиторов прямого действия, однако, недостатком таких пептидных веществ является отсутствие активности при пероральном введении. В литературе описаны пептидомиметические соединения, обладающие пероральной антитромботической активностью. Такие вещества включают, главным образом, соединения бороновой кислоты, описанные в патентах ЕР 293681, ЕР 471651, ЕР 615978 и ЕP 792883, а также соединения, описанные в опубликованных заявках WO 94/29336 и WO 95/23609. В этой связи, особый интерес приобретает синтез новых ингибиторов сериновых протеаз с целью повышения эффективности и увеличении селективности соединений уже описанных в литературе. Кроме того, новые соединения увеличивают время различных коагуляций и они активны при пероральном введении. Настоящее изобретение, более конкретно,относится к соединениям общей формулы (I)n равно 2 или 3,R1 представляет собой (С 3-С 8)циклоалкильную группу, необязательно замещенную фенильную группу или линейную либо разветвленную (C1-С 6)алкильную группу, необязательно замещенную одной или более одинаковыми или различными группами, выбранными из галогена, (С 3-C8)циклоалкила и необязательно замещенного фенила,R2 представляет собой аминогруппу, амидиногруппу, необязательно замещенную одной или более одинаковыми или различными группами, выбранными из линейного или разветвленного (C1-C6)алкила, и гидроксигруппы, гуа 002645 2 нидиногруппу, необязательно замещенную линейной или разветвленной (С 1-С 6)алкильной группой, или изотиоуреидогруппу, необязательно замещенную линейной или разветвленной(C1-C6)алкильной группой,Аr представляет собой арильную группу,или моноциклическую азотсодержащую гетероарильную группу,X1 представляет собой гидроксигруппу,аминогруппу или группу -NHR3,R3 представляет собой пропаргильную группу, иминометильную группу, линейную или разветвленную(C1-C6)алкилсульфонильную группу, линейную или разветвленную арил(С 1 С 6)алкилсульфонильную группу,группу-CONR'3R"3, линейную или разветвленную (C1C6)алкильную группу, необязательно замещенную группой - CO2R'3,группой - CONR'3R"3,гетероциклической группой,аминосульфонильной группой,арильной группой или гетероарильной группой,R'3 и R"3, которые могут быть одинаковыми или различными и каждый представляет собой атом водорода, линейную или разветвленную(C1-C6)алкильную группу (необязательно замещенную карбоксигруппой, линейной или разветвленной (C1-С 6)алкоксикарбонильной группой или карбамоильной группой), или совместно с атомом азота, с которым они связаны, образуют гетероциклическую группу,их изомерам, а также их солям присоединения фармацевтически приемлемых кислот или оснований. Без каких-либо ограничений из фармацевтически приемлемых кислот можно отметить хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту,винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфокислоту, бензолсульфокислоту, камфорную кислоту и т.д. Не ограничиваясь конкретными примерами, из фармацевтически приемлемых оснований можно отметить гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.п. Под необязательно замещенной фенильной группой понимается группа, замещенная одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, гидрокси, линейного или разветвленного тригалоид(С 1 С 6)алкила и аминогруппы (необязательно заме 3 щенной одной или более линейными или разветвленными (С 1-С 6)алкильными группами). Термин гетероциклическая группа относится к насыщенной или ненасыщенной, моноили бициклической группе, имеющей 5-12 членов в цикле, содержащей один, два или три гетероатома, выбранных из кислорода, азота и серы, при этом следует иметь в виду, что гетероцикл может быть необязательно замещен одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, оксо, гидрокси, линейных или разветвленных тригалоид(С 1-С 6)алкильных групп и аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1-С 6)алкильными группами). Предпочтительными гетероциклическими группами являются морфолинил,пиперазинил, пиперидил, дигидротриазолил и имидазолинил. Под арильной группой понимается фенил,бифенилил или нафтил, причем каждая из таких групп может быть необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С 6)алкила, линейного или разветвленного (C1-C6)алкокси, гидрокси,линейного или разветвленного тригалоид(С 1 С 6)алкила, амино группы (необязательно замещенной одной или более линейными или разветвленными (C1-C6)алкильными группами) и карбокси. Под гетероарильной группой понимается ароматическая моно- или бициклическая группа, имеющая 5-12 членов кольца, содержащая один, два или три гетероатома, выбранных из кислорода, азота и серы, причем следует иметь в виду, что гетероарил может быть необязательно замещен одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-C6) алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, тригалоидметила и амино(необязательно замещенной одной или более линейными или разветвленными (C1-C6) алкильными группами). Без каких-либо ограничений, из таких гетероарильных групп можно отметить следующие группы: тиенил, пиридил,фурил, пирролил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиримидинил,пиразинил, пиридазинил, пиразолил и хинолил. К предпочтительным гетероарильным группам относятся необязательно замещенный пиридил и необязательно замещенные хинолильные группы. Предпочтительно относительной конфигурацией 2,3-метаноаминокислотной группы в соединениях формулы (I) является цис 2R,3S) или (2S,3R. Предпочтительная абсолютная конфигурация 2,3-метаноаминокислотной груп 002645 4 пы соединений формулы (I) представляет собой(I) представляют собой циклоалкил и необязательно замещенные алкильные группы. Предпочтительные группы R2 в формуле(I) представляют собой амино и амидиногруппы. Термин арил применительно к группе Аr в формуле (I) предпочтительно относится к необязательно замещенной фенильной группе. Термин моноциклический азотсодержащий гетероарил применительно к группе Аr в формуле (I) предпочтительно относится к необязательно замещенной пиридильной группе. Предпочтительными группами X1 в формуле (I) являются амино и -NHR3, в которых R3 представляет собой линейную или разветвленную арил(C1-C6)алкилсульфонильную группу или необязательно замещенную, линейную или разветвленную (C1-C6)алкильную группу. Настоящее изобретение относится также к способу получения соединений формулы (I),отличающемуся тем, что соединение формулы в которой n имеет значения, указанные для формулы (I), а Вn представляет собой бензильную группу, подвергают взаимодействию с соединением формулы (III) в которой R1 имеет значения, указанные для формулы (I), Х 2 представляет собой атом кислорода или -NH-, a P1 представляет собой защитную группу для аминофункции или гидроксифункции, в присутствии пептидного связующего агента с образованием соединения формулы в которой n, R1, Х 2, Вn и P1 имеют указанные выше значения, после чего соединение формулы(IV) в результате каталитического гидрирования или гидролиза превращают в соединение формулы (V) в которой n, R1, X2 и P1 имеют указанные выше значения, после чего осуществляют взаимодействие соединения формулы (V) с соединением формулы (VI) в которой Аr имеет значения, указанные для формулы (I), а R4 представляет собой R2 или R2 5 Р 2, причем R2 имеет значения, указанные для формулы (I), a P2 представляет собой защитную группу аминофункции в присутствии пептидного связующего агента с получением соединения формулы (VII) в которой n, R1, R4, Аr, Х 2 и P1 имеют указанные выше значения,после чего соединение формулы (VII) превращают в соединение формулы (I), используя для этого одну или более реакций снятия защитной группы, алкилирования или восстановительного аминирования,после чего соединение формулы (I), если это необходимо, подвергают очистке в соответствии с общепринятым методом очистки, если желательно, разделяют на изомеры согласно общепринятому методу разделения и, если желательно, превращают в соль присоединения с помощью фармацевтически приемлемой кислоты или основания. Соединения формулы (II) получают в соответствии со способом, описанным A.Hercouet с сотр. (Tetrahedron: Assymetry 1996, т. 7,5,стр. 1267-1268 и Tet.Lett. 1996, т. 3726, стр. 4529-4532). Помимо того что соединения настоящего изобретения являются новыми, они обладают особенно ценными фармакологическими свойствами. Они являются мощными ингибиторами трипсиноподобной сериновой протеазы, проявляющими значительную селективность в отношении тромбина в сравнении с другими сериновыми протеазами фибринолиза и коагуляции. Такие свойства предопределяют полезное применение рассматриваемых соединений для лечения стабильной или нестабильной стенокардии, различных нарушений тромботического происхождения и/или приводящих к тромботическим осложнениям, лечения или предотвращения инфаркта миокарда, венозного или артериального тромбоза, а также лечения осложнений таких сосудистых и сердечно-сосудистых заболеваний, как атеросклероз, артериит, венозное заболевание, кроме этого они могут применяться для лечения всех нарушений, развитие которых сопровождается образованием и/или активностью тромбина. В равной степени эти соединения могут применяться в терапевтической практике совместно с тромболитическими лекарственными средствами. Настоящее изобретение охватывает также фармацевтические композиции, содержащие в качестве активного ингредиента соединение формулы (I) совместно с одним или более подходящими инертными нетоксичными эксипиен 002645 6 тами. Среди фармацевтических композиций настоящего изобретения можно особо отметить те композиции, которые подходят для перорального, парентерального (внутривенного или подкожного) или назального применений, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, свечи, кремы, мази,дермальные гели, препараты для инъекций,питьевые суспензии и т.п. Выбор подходящей дозировки определяется природой и тяжестью заболевания, путем введения лекарственного средства, а также возрастом и весом пациента. Такие дозировки могут составлять 1-500 мг в день при однократном или многократном введении. Следующие ниже примеры иллюстрируют настоящее изобретение, но не ограничивают его каким-либо образом. В примерах используются следующие сокращения: НОВТ - гидрат 1-гидроксибензотриазола(1S,5R)-2-азабицикло[3.1.0]гексан-1-карбоновую кислоту. (2S,3R)-2,3-метаногомопролин обозначает (1S,6R)-2-азабицикло[4.1.0]гептан-1 карбоновую кислоту. Соединение, имеющее (3) или (3) конфигурацию, представляет собой соединение,выбранное из (3R) и (3S) стереоизомеров, причем следует иметь в виду, что если (3) соединение представляет собой один из (3R) или (3S) стереоизомеров, то (3) соединение является другим стереоизомером из этой пары, а абсолютная конфигурация углеродного атома в положении 3 не указывается. Используемые исходные материалы являются известными веществами или могут быть получены известными методами. Препаративные примеры А-Н демонстрируют синтез промежуточных соединений, предназначенных для получения соединений изобретения. Структуру соединений, описанных в примерах, устанавливали общепринятыми спектрофотометрическими методами (ИК, ЯМР, массспектрометрия). Препаративный пример А. Бензил (2S,3R)2,3-метанопролинат. Целевой продукт получали в соответствии со способом, описанным A.Hercouet с сотр. (Tetrahedron: Asymmetry 1996, т. 75, стр. 12671268). Препаративный пример В. Бензил (2S,3R)2,3-метаногомопролинат. Целевой продукт получали в соответствии со способом, описанным A.Hercouet с сотр. 7 Целевой продукт получали в соответствии со способом, описанным G.De Nanteuil с сотр.(Synth.Comm. 1998, т. 2823, стр. 4419-4429). Препаративный пример D. 6-Амино-3 аминометилпиридин. Литийалюминийгидрид (21 ммоль) небольшими порциями добавляли к 10 ммолям 6 аминоникотинамида в тетрагидрофуране. Полученную смесь нагревали в течение 72 ч при кипении с обратным холодильником, затем охлаждали до температуры окружающей среды и подвергали гидролизу водой и затем 1 Н раствором гидроксида натрия. После перемешивания в течение часа смесь фильтровали через целлит и промывали смесью тетрагидрофуран/метанол в соотношении 85/15. Растворители выпаривали, а полученный остаток очищали хроматографически на силикагеле с получением целевого продукта в виде белого твердого вещества. Препаративный пример Е. 6-Амино-3 аминометил-2-метилпиридин. Стадия А. 6-Амино-3-циано-2-метилпиридин. Цианид меди (I) (12 ммоль) добавляли к 10 ммолям 6-амино-3-бром-2-метилпиридина, растворенного в диметилформамиде. Смесь нагревали в течение 10 ч при кипении с обратным холодильником, затем охлаждали до 80 С и переливали в раствор цианида натрия (40 ммоль) в воде. После перемешивания в течение часа при температуре окружающей среды, полученную смесь экстрагировали этилацетатом. Органическую фазу промывали и затем сушили и выпаривали с получением целевого продукта в виде бледного коричневато-желтого твердого вещества. Стадия В. 6-Амино-3-аминометил-2 метилпиридин. Целевой продукт получали в соответствии со способом, описанным на стадии В примера 1,используя в качестве исходного вещества соединение, описанное на приведенной выше стадии, и никель Ренея в качестве катализатора. Препаративный пример F. 6-Амино-3 аминометил-5-метилпиридин. Целевой продукт получали в соответствии со способом, описанным в препаративном примере Е, используя в качестве исходного вещества 6-амино-3-бром-5-метилпиридин. Препаративный пример G. Бензил [4 аминометиланилино](имино)метилкарбамат. Стадия А. Ди-(трет-бутил) 4-[(амино(имино)метил)амино]бензилимидодикарбонат. 10 ммолей ди-(трет-бутил) 4-аминобензилимидодикарбоната и 100 ммолей цианамида нагревали при кипении с обратным холодильником в течение 2 дней в 80 мл безводного этанола. В результате удаления этанола выпариванием и очистки хроматографией на силикагеле получали целевой продукт. 8 Стадия В. Бензил 4-[ди-(трет-бутоксикарбонил)аминометил]анилино(имино)метилкарбамат. К 10 ммолям соединения, полученного на предыдущей стадии, растворенного в тетрагидрофуране, добавляли 99 ммолей 4 Н раствора гидроксида натрия, после чего при 5 С прикапывали 24 ммоля бензилхлорформиата. После перемешивания в течение ночи при температуре окружающей среды, реакционную смесь декантировали, органическую фазу выпаривали и полученный остаток промывали этилацетатом,фильтровали и сушили с получением целевого продукта. Стадия С. Бензил [4-аминометиланилино](имино)метилкарбамат. Через раствор соединения, описанного на предыдущей стадии (10 ммоль), в этилацетате при 0 и перемешивании в течение 30 мин пропускали поток газообразного HCl. После перемешивания в течение ночи при температуре окружающей среды образовавшийся осадок отфильтровывали, промывали этилацетатом и затем сушили в вакууме с использованием эксикатора. Препаративный пример Н. Бензил [4 аминометиланилино]карботиоилкарбамат. Целевой продукт получали в соответствии со способом, описанным в препаративном примере G, из ди-(трет-бутил) 4-аминобензилимидодикарбоната и тиоциановой кислоты. Пример 1. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метанопролинамида.TBTU (11 ммоль), НОВТ (11 ммоль) и диизопропилэтиламин (22 ммоль) добавляли в раствор соединения, описанного в препаративном примере А (10 ммоль) и N-трет-бутоксикарбонил-(2R)-3-циклогексилаланин (10 ммоль) в диметилформамиде. После перемешивания в течение ночи при температуре окружающей среды растворитель выпаривали. Полученный остаток переносили в этилацетат. Органическую фазу промывали, сушили и выпаривали с получением целевого продукта в виде масла. Стадия В. 1-[N-Трет-бутоксикарбонил(2R)-3-циклогексилаланил]-(2S,3R)-2,3-метанопролин. Раствор соединения, описанного на предыдущей стадии (10 ммоль) в этаноле помещали на ночь в атмосферу водорода в присутствии 10% фильтрацией растворитель выпаривали с образованием белого, стекловидного твердого вещества. Стадия С. 1-[N-Трет-бутоксикарбонил(2R)-3-циклогексилаланил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метанопролинамид.(11 ммоль) добавляли к раствору соединения,описанного на предыдущей стадии (10 ммоль),и соединения, описанного в препаративном примере Е (10 ммоль), в диметилформамиде. После перемешивания в течение ночи при температуре окружающей среды растворитель выпаривали. Полученный остаток переносили в этилацетат. Органическую фазу промывали,сушили и затем выпаривали. Целевой продукт получали хроматографической очисткой остатка на силикагеле с использованием в качестве элюента смеси дихлорметан/этилацетат в соотношении 1/1. Стадия D. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метанопролинамида. При 0 С и перемешивании поток газообразного НСl в течение 30 мин пропускали через этилацетатный раствор соединения, описанного на предыдущей стадии (10 ммоль). После перемешивания в течение ночи при температуре окружающей среды образовавшийся остаток отфильтровывали, промывали этилацетатом и затем сушили в вакууме в эксикаторе. Элементный микроанализ: Пример 2. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-3-циклогексилаланил]-N-[4-(4-бензилоксикарбониламино(имино)метил)бензил]-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве реагентов соединение, описанное в препаративном примере А, N-трет-бутоксикарбонил(2R)-3-циклогексилаланин и соединение,описанное в препаративном примере С. Стадия В. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролидинамида. Целевой продукт получали в соответствии со способом, описанным в стадии В примера 1,используя в качестве исходного вещества соединение, описанное на предыдущей стадии. Пример 3. Гидрохлорид 1-[N-карбоксиметил-(2R)-3-циклогексилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролидинамида. Стадия А. 1-[N-Бензилкарбоксиметил(2R)-3-циклогексилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролидинамид. Карбонат калия (30 ммоль) и затем бензил 2-бромацетат (11 ммоль) добавляли к раствору соединения, описанного в примере 2 (10 ммоль) в ацетонитриле. После перемешивания в течение ночи раствор отфильтровывали и выпаривали, полученный остаток переносили в этилацетат, а органическую фазу промывали и сушили,после чего выпаривали,Стадия В. 1-[N-Карбоксиметил-(2R)-3 циклогексилаланил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролидинамид. Целевой продукт получали в соответствии со способом, описанным на стадии В примера 1,используя в качестве исходного вещества соединение, полученное на предыдущей стадии. Стадия С. Гидрохлорид 1-[N-карбоксиметил-(2R)-3-циклогексилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролидинамида. Целевой продукт получали в соответствии со способом, описанным на стадии D примера 1,используя соединение, полученное на предыдущей стадии в качестве исходного вещества. Элементный микроанализ: Вычислено: Найдено: Пример 4. Дигидрохлорид 1-[N-метил(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3-метанопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-(4-изотиоуреидобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве реагентов соединение, описанное в препаративном примере А, N-трет-бутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере Н. Стадия В. 1-[N-Метил-(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3 метанопролинамид. Целевой продукт получали в соответствии со способом, описанным в J.Org.Chem. 1996, 61,3849-3862, используя в качестве реагентов соединение, полученное на предыдущей стадии и формальдегид, проводя реакцию в присутствии триацетоксиборогидрида натрия. Стадия С. Дигидрохлорид 1-[N-Метил(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3-метанопролинамида. 11 Целевой продукт получали в соответствии со способом, описанным на стадии D примера 1,используя соединение, описанное на предыдущей стадии, в качестве исходного вещества. Пример 5. Дигидрохлорид 1-[N-бензил(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3-метанопролинамида. Стадия А. 1-[N-Бензил-(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)2,3-метанопролинамид. К раствору соединения, полученного на стадии А примера 4 (10 ммоль) в дихлорметане,при 0 С, добавляли диизопропилэтиламин (30 ммоль), после чего прикапывали хлористый бензил (11 ммоль). После перемешивания в течение 4 ч при 0 С раствор подвергали гидролизу и органическую фазу промывали 1 Н раствором хлористо-водородной кислоты, затем водой и после этого выпаривали. Целевой продукт получали хроматографической очисткой остатка на силикагеле, с использованием в качестве элюента смеси дихлорметан/этилацетат. Стадия В. Дигидрохлорид 1-[N-Бензил(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3-метанопролинамид. Целевой продукт получали в соответствии со способом, описанным на стадии D примера 1,используя соединение, описанное на предыдущей стадии в качестве исходного вещества. Пример 6. Дигидрохлорид 1-[N-метил(2R)-3-циклогексилаланил]-N-(4-гуанидинобензил)-(2S,3R)-2,3-метанопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-(4-гуанидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве реагентов соединение, описанное в препаративном примере А, N-трет-бутоксикарбонил (2R)-3-циклогексилаланин и соединение,описанное в препаративном примере G. Стадия В. Дигидрохлорид 1-[N-метил(2R)-3-циклогексилаланил]-N-(4-гуанидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному на стадиях В и С примера 4,используя соединение, полученное на предыдущей стадии, в качестве исходного вещества. Пример 7. Дигидрохлорид 1-[N-бензил(2R)-3-циклогексилаланил]-N-(4-гуанидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному в примере 5, используя соединение, полученное на стадии А примера 6, в качестве исходного вещества. Пример 8. Дигидрохлорид 1-[(2R)-3 фенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3 метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве реагентов соединение, описанное в препаративном примере А, N-трет-бутокси 002645 Пример 9. Гидрохлорид 1-[N-бензилсульфонил-(2R)-3-фенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Стадия А. 1-[N-Бензилсульфонил-(2R)-3 фенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3 метанопролинамида. К раствору соединения, описанного в примере 8 (10 ммоль), в дихлорметане при 0 С добавляли диизопропилэтиламин (30 ммоль), после чего прикапывали фенилметансульфонилхлорид (11 ммоль). После перемешивания в течение 4 ч при 0 С раствор подвергали гидролизу, органическую фазу промывали 1 Н раствором хлористо-водородной кислоты, затем водой и после этого выпаривали. Целевой продукт получали хроматографической очисткой остатка на силикагеле, используя смесь дихлорметан/этилацетат в качестве элюента. Стадия В. Гидрохлорид 1-[N-бензилсульфонил-(2R)-3-фенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным для стадии D примера 1, используя в качестве исходного вещества соединение, описанное на предыдущей стадии. Элементный микроанализ: Вычислено: Найдено: Пример 10. Гидрохлорид 1-[N-карбоксиметил-(2R)-3-фенилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному в примере 3, используя соединение, описанное в примере 8, в качестве исходного вещества. Элементный микроанализ: Вычислено: Найдено: Пример 11. Дигидрохлорид 1-[(2R)-3,3 дифенилаланил]-N-(4-амидинобензил)-(2S,3R)2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному в примере 2, используя в качестве реагентов соединение, описанное в препаративном примере А, N-трет-бутоксикарбонил-(2R)-3,3-дифенилаланин и соединение,описанное в препаративном примере С. Элементный микроанализ: Вычислено: Найдено: Пример 12. Дигидрохлорид 1-[(2R)-3,3 дифенилаланил]-N-[(6-амино-3-пиридил)метил](2S,3R)-2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному в примере 1, используя в качестве реагентов соединение, описанное в препаративном примере А, N-трет-бутоксикарбонил-(2R)-3,3-дифенилаланин и соединение,описанное в препаративном примере D. Элементный микроанализ: Вычислено: Найдено: Пример 13. Дигидрохлорид 1-[(2R)-3,3 дициклогексилаланил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Стадия А. N-трет-бутоксикарбонил-(2R)3,3-дициклогексилаланин. Раствор N-трет-бутоксикарбонил-(2R)-3,3 дифенилаланина (10 ммоль) в этаноле помещали на ночь в атмосферу водорода в присутствииRh/C (0,5 г). После удаления катализатора фильтрацией, растворитель выпаривали с образованием целевого продукта. Стадия В. Дигидрохлорид 1-[(2R)-3,3 дициклогексилаланил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному в примере 2, используя в качестве исходных веществ соединение, описанное в препаративном примере А, соединение,описанное на предыдущей стадии и соединение,описанное в препаративном примере С. Элементный микроанализ: Вычислено: Найдено: Пример 14. Гидрохлорид 1-[N-карбоксиметил-(2R)-3,3-дициклогексилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного вещества соединение,описанное в примере 13. Элементный микроанализ: Вычислено: Найдено: Пример 15. Дигидрохлорид 1-[(2R)циклогексилглицил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере А, N-третбутоксикарбонил-(2R)-циклогексилглицин и соединение, описанное в препаративном примере С. 14 Пример 16. Гидрохлорид 1-[Н-бензилсульфонил-(2R)-циклогексилглицил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходного реагента соединение, описанное в примере 15. Элементный микроанализ: Вычислено: Найдено: Пример 17. Гидрохлорид 1-[N-карбоксиметил-(2R)-циклогексилглицил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного реагента соединение, описанное в примере 15. Элементный микроанализ: Вычислено: Найдено: Пример 18. Дигидрохлорид 1-[N-этоксикарбонилметил-(2R)-циклогексилглицил]-N-(4 амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов этилбромацетат и соединение, описанное в примере 15. Элементный микроанализ: Вычислено: Найдено: Пример 19. Гидрохлорид 1-[N-карбоксиметил-(2R)-лейцил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-лейцил]N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере А, N-третбутоксикарбонил-(2R)-лейцин и соединение,описанное в препаративном примере С. Стадия В. Дигидрохлорид 1-[N-карбоксиметил-(2R)-лейцил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали согласно способу, описанному в примере 3, используя в качестве исходного реагента соединение, описанное на предыдущей стадии. Элементный микроанализ: Вычислено: Найдено: 15 Пример 20. Дигидрохлорид 1-[N-метил(2R)-фенилглицил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-фенилглицил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере А, N-третбутоксикарбонил-(2R)-фенилглицин и соединение, описанное в препаративном примере С. Стадия В. Дигидрохлорид 1-[N-метил(2R)-фенилглицил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным на стадиях В и С примера 4, используя в качестве исходного реагента соединение, описанное на предыдущей стадии. Пример 21. Дигидрохлорид 1-[N-бензил(2R)-фенилглицил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 5, используя в качестве исходного реагента соединение, описанное на стадии А примера 20. Пример 22. Гидрохлорид 1-[(2R)-3-циклогексил-2-гидроксипропионил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Стадия А. (2R)-3-Циклогексил-2-гидроксипропионовая кислота. Целевой продукт получали в соответствии со способом, описанным на стадии А примера 13, используя в качестве исходного реагента(2R)-2-гидрокси-3-фенилпропионовую кислоту. Стадия В. (2R)-2-Ацетокси-3-циклогексилпропионовая кислота. К 10 ммолям соединения, полученного на предыдущей стадии, растворенного в пиридине,добавляли уксусный ангидрид (11 ммоль). После перемешивания в течение часа при температуре окружающей среды, реакционную смесь выливали в воду и добавляли метилтретбутиловый эфир. Органическую фазу промывали, сушили и затем выпаривали с получением целевого продукта. Стадия С. 1-[(2R)-2-Ацетокси-3-циклогексилпропионил]-N-[4-(бензилоксикарбониламино(имино)метил)бензил]-(2S,3R)-2,3-метанопролинамид. Целевой продукт получали в соответствии со способом, описанным на стадиях А-С примера 1, используя в качестве исходных реагентов соединение, описанное в препаративном примере А, соединение, описанное на предыдущей стадии, и соединение, описанное в препаративном примере С. Стадия D. 1-[(2R)-3-Циклогексил-3-гидроксипропионил]-N-[4-(бензилоксикарбонилами 002645 16 но(имино)метил)бензил]-(2S,3R)-2,3-метанопролинамид. К 10 ммолям соединения, описанного на предыдущей стадии, растворенного в тетрагидрофуране, добавляли 1 Н раствор гидроксида натрия. После перемешивания в течение часа при температуре окружающей среды, добавляли этилацетат и органическую фазу промывали,сушили и затем выпаривали с образованием целевого продукта. Стадия Е. Гидрохлорид 1-[(2R)-3 циклогексил-2-гидроксипропионил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Раствор соединения, описанного на предыдущей стадии (10 ммоль), в этанольном растворе 1 Н хлористо-водородной кислоты помещали на ночь в атмосферу водорода в присутствии 10% Pd/C (0,5 г). После удаления катализатора фильтрацией, растворитель выпаривали с получением целевого продукта. Элементный микроанализ: Вычислено: Найдено: Пример 23. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере С. Пример 24. Гидрохлорид 1-[N-карбоксиметил-(2R)-3-циклогексилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного реагента соединение, описанное в примере 23. Элементный микроанализ: Вычислено: Найдено: Пример 25. Дигидрохлорид 1-[N-этоксикарбонилметил-(2R)-3-циклогексилаланил]-N(4-амидинобензил)-(2S,3R)-2,3-метанопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов этилбромацетат и соединение, описанное в примере 23. Элементный микроанализ: Вычислено: Найдено: динобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов 2-бромацетамид и соединение, описанное в примере 23. Пример 27. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-[(6-амино-3-пиридил) метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере D. Элементный микроанализ: Вычислено: Найдено: Пример 28. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-[(4-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере Е. Элементный микроанализ: Вычислено: Найдено: Пример 29. Дигидрохлорид 1-[N-метил(2R)-3-циклогексилаланил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным на стадиях В и С примера 4, используя в качестве исходного реагента соединение, описанное в примере 28. Элементный микроанализ: Вычислено: Найдено: Пример 30. Дигидрохлорид 1-[N-этил(2R)-3-циклогексилаланил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Стадия А. 1-[N-Этил-(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил](2S,3R)-2,3-метаногомопролинамид. Целевой продукт получали в соответствии со способом, описанным в J.Org.Chem., 1996, 61,3849-3862, используя в качестве исходных реагентов соединение, описанное в примере 28, и 18 ацетальдегид в присутствии триацетоксиборогидрида натрия. Стадия В. Дигидрохлорид 1-[N-этил-(2R)3-циклогексилаланил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным на стадии D примера 1,используя в качестве исходного реагента соединение, описанное на предыдущей стадии. Пример 31. Дигидрохлорид 1-[N-бутил(2R)-3-циклогексилаланил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и масляный альдегид. Элементный микроанализ: Вычислено: Найдено: Пример 32. Дигидрохлорид 1-[N-карбоксиметил-(2R)-3-циклогексилаланил]-N-[(6-амино 2-метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного реагента соединение, описанное в примере 28. Элементный микроанализ: Вычислено: Найдено: Пример 33. Дигидрохлорид 1-[N-этоксикарбонилметил-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов этилбромацетат и соединение, описанное в примере 28. Элементный микроанализ: Вычислено: Найдено: Пример 34. Дигидрохлорид 1-[N-этоксикарбонилметоксикарбонилметил-(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил) метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов этилбромацетат и соединение, описанное в примере 32. Элементный микроанализ: Вычислено: Найдено: Пример 35. Дигидрохлорид 1-[N-карбамоилметил)-(2R)-3-циклогексилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали согласно способу, описанному в примере 9, используя в качестве исходных реагентов 2-бромацетамид и соединение, описанное в примере 28. Элементный микроанализ: Вычислено: Найдено: Пример 36. Дигидрохлорид 1-[N-бензил(2R)-3-циклогексилаланил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 5, используя в качестве исходного реагента соединение, описанное в примере 28. Элементный микроанализ: Вычислено: Найдено: Пример 37. Дигидрохлорид 1-[N-(4 гидроксибензил)-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и 4-ацетоксибензальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 38. Дигидрохлорид 1-[N-(4 карбоксибензил)-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и 4-(метоксикарбонил) бензальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 39. Дигидрохлорид 1-[N-(3,4 диметоксибензил)-(2R)-3-циклогексилаланил]N-[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение, 20 описанное в примере 28, и (3,4-диметокси)бензальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 40. Дигидрохлорид 1-[N-[(бифенилил)метил]-(2R)-3-циклогексилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и 4-бифенилкарбальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 41. Дигидрохлорид 1-[N-[(2 нафтил)метил]-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и 2-нафталинкарбальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 42. Дигидрохлорид 1-[N-фенетил(2R)-3-циклогексилаланил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и фенилацетальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 43. Тригидрохлорид 1-[N-[(4 пиридил)метил]-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и изоникотиновый альдегид. Элементный микроанализ: Вычислено: Найдено: Пример 44. Дигидрохлорид 1-[N-[(2 пиридил)метил]-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28,и 2 пиридинкарбальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 45. Дигидрохлорид 1-[N-[(4-хинолил)метил]-(2R)-3-циклогексилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28, и изоникотиновый альдегид. Элементный микроанализ: Вычислено: Найдено: Пример 46. Дигидрохлорид 1-[N-[(2 хинолил)метил]-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 30, используя в качестве исходных реагентов соединение,описанное в примере 28,и 2 хинолинкарбальдегид. Элементный микроанализ: Вычислено: Найдено: Пример 47. Дигидрохлорид 1-[N-[(4,5 дигидро-1 Н-2-имидазолил)метил]-(2R)-3 циклогексилаланил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов соединение,описанное в примере 28, и 2-(хлорметил)-4,5 дигидро-1H-имидазол. Элементный микроанализ: Вычислено: Найдено: 22 Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов пропаргилбромид и соединение, описанное в примере 28. Пример 49. Дигидрохлорид 1-[N-4 морфолинил)этил)-(2R)-3-циклогексилаланил]N-[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов (2-хлорэтил) морфолин и соединение, описанное в примере 28. Пример 50. Дигидрохлорид 1-[N-2 морфолинил)метил)-(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил](2S, 3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов 2-п-толуолсульфонилоксиметилморфолин и соединение,описанное в примере 28. Пример 51. Гидрохлорид 1-[N-4-морфолинил)карбонил)-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов 4 морфолинкарбонилхлорид и соединение, описанное в примере 28. Пример 52. Гидрохлорид 1-[N-метилсульфонил-(2R)-3-циклогексилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов соединение,описанное в примере 28, и метансульфонилхлорид. Пример 53. Гидрохлорид 1-[N-бензилсульфонил-(2R)-3-циклогексилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходного реагента соединение, описанное в примере 28. Пример 54. Дигидрохлорид 1-[N-аминосульфонилметил-(2R)-3-циклогексилаланил]-N[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 9, используя в качестве исходных реагентов соединение,описанное в примере 28, и аминосульфонилметилбромид. Пример 55. Дигидрохлорид 1-[(2R)-3 циклогексилаланил]-N-[(6-амино-5-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере F. Элементный микроанализ: Вычислено: Найдено: Пример 56. Дигидрохлорид 1-[N-метил(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 4, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланаланин и соединение, описанное в препаративном примере Н. Пример 57. Дигидрохлорид 1-[N-бензил(2R)-3-циклогексилаланил]-N-(4-изотиоуреидобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 5, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере Н. Пример 58. Дигидрохлорид 1-[N-метил(2R)-3-циклогексилаланил]-N-(4-гуанидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 4, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере G. Пример 59. Дигидрохлорид 1-[N-бензил(2R)-3-циклогексилаланил]-N-(4-гуанидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 5, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-циклогексилаланин и соединение, описанное в препаративном примере G. Пример 60. Дигидрохлорид 1-[(2R)-3 фенилаланил]-N-[(6-амино-2-метил-3-пиридил) метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3-фенилаланин и соединение, описанное в препаративном примере Е. Пример 61. Дигидрохлорид 1-[(2R)-3,3 дифенилаланил]-N-(4-амидинобензил)-(2S,3R)2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3,3-дифенилаланин и соединение, описанное в препаративном примере G. Элементный микроанализ: Вычислено: Найдено: Пример 62. Дигидрохлорид 1-[(2R)-3,3 дифенилаланил]-N-[(6-амино-3-пиридил)метил](2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3,3-дифенилаланин и соединение, описанное в препаративном примере D. Элементный микроанализ: Вычислено: Найдено: Пример 63. Дигидрохлорид 1-[(2R)-3,3 дициклогексилаланил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3,3-дициклогексилаланин и соединение, описанное в препаративном примере Е. Элементный микроанализ: Вычислено: Найдено: Пример 64. Дигидрохлорид 1-[(2R)-3,3 дициклогексилаланил]-N-[(6-амино-3-пиридил) метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3,3-дициклогексилаланин и соединение, описанное в препаративном примере D. Пример 65. Дигидрохлорид 1-[(2R)циклогексилглицил]-N-(4-амидинобензил)(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-циклогексилглицин и соединение, описанное в препаративном примере С. Пример 66. Гидрохлорид 1-[N-карбоксиметил-(2R)-циклогексилглицил]-N-(4-амидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного реагента соединение, описанное в примере 65. Элементный микроанализ: Вычислено: Найдено: Пример 67. Дигидрохлорид 1-[(2R)циклогексилглицил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-3,3-дициклогексилглицин и соединение, описанное в препаративном примере Е. Элементный микроанализ: Вычислено: Найдено: Пример 68. Дигидрохлорид 1-[(2R)циклогексилглицил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-циклогексилглицин и соединение, описанное в препаративном примере D. Элементный микроанализ: Вычислено: Найдено: Пример 69. Дигидрохлорид 1-[(2R,3)-3 циклогексил-3-трифторметилаланил]-N-(4 26 амидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Стадия А. Бензил 3-циклогексил-4,4,4 трифтор-2-бутеноат. 10 ммолей бензилтриметоксифосфоноацетата при 0 С прикапывали к 10 ммолям гидрида натрия, суспендированного в 10 мл диметоксиэтана. После перемешивания смеси в течение часа при температуре окружающей среды добавляли 10 ммолей циклогексилтрифторметилкетона. Реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды и затем выливали в 20 мл воды. Водную фазу экстрагировали эфиром. Органическую фазу промывали, сушили и затем выпаривали. В результате получали масло, которое перегоняли в вакууме при 100-110 С. Стадия В. -3-Циклогексил-3-трифторметил-1-пропионовая кислота. Целевой продукт получали в соответствии со способом, описанным на стадии В примера 1,используя в качестве исходного реагента соединение, полученное на предыдущей стадии. Стадия С. Хлорангидрид -3-циклогексил-3-трифторметил-1-пропионовой кислоты. К 10 ммолям кислоты, полученной на предыдущей стадии, растворенной в дихлорметане,при 0 С добавляли 10 ммолей тионилхлорида. После нагревания до температуры окружающей среды и перемешивания в течение ночи, полученный раствор выпаривали с получением целевого продукта. Стадия D. (4R)-3-[3-Циклогексил-4,4,4 трифтор-1-оксобутил]-4-бензил-2-оксазолидинон. 2,5 М раствор н-бутиллития в гексане (4,2 мл) добавляли к раствору (4R)-(4-бензил)-2 оксазолидинона (10 ммоль) в тетрагидрофуране. После перемешивания в течение часа при -78 С добавляли раствор соединения, полученного на предыдущей стадии (10 ммоль) в тетрагидрофуране. Реакционную смесь доводили до 0 С и затем переливали в водный раствор хлористого аммония. Водную фазу экстрагировали этилацетатом и затем объединенные органические фазы промывали, сушили и после этого выпаривали с получением целевого продукта в виде смеси двух диастереоизомеров. Стадия Е. (4R)-3-[(3)-Циклогексил-4,4,4 трифтор-1-оксобутил]-4-бензил-2-оксазолидинон. После выделения диастереоизомеров из смеси, полученной на предыдущей стадии, хроматографически на силикагеле с использованием смеси н-гептан/толуол в соотношении 40/60 в качестве элюента целевой продукт получали выпариванием первой из двух элюированных фракций. Стадия F. (4R)-3-[(2R,3)-2-Азидо-4,4,4 трифтор-1-оксобутил]-4-бензил-2-оксазолидинон. 27 К раствору соединения, описанного на предыдущей стадии (10 ммоль) в тетрагидрофуране, при -78 С прикапывали 0,5 М раствор гексаметилдисилазида калия в толуоле (10,5 ммоль) и после перемешивания в течение часа добавляли раствор тритилазида (11 ммоль) в тетрагидрофуране. После перемешивания в течение 5 мин добавляли ледяную уксусную кислоту (3,5 мл) и затем полученную реакционную смесь перемешивали в течение 6 ч при температуре окружающей среды. Добавляли раствор хлорида аммония и после экстракции органическую фазу промывали, сушили и выпаривали с получением целевого продукта. Стадия G. (2R,3)-2-Азидо-3-циклогексил 3-трифторметил-1-пропионовая кислота. Водный раствор гидроксида лития (12 ммоль) и 30% раствор пероксида водорода (5,7 ммоль) при 0 С добавляли к раствору соединения, полученного на предыдущей стадии (10 ммоль) в диоксане. После перемешивания в течение 0,5 ч при 0 С добавляли этилацетат и органическую фазу промывали, сушили и затем выпаривали с получением целевого продукта. Стадия Н.(2R,3)-3-Циклогексил-3 трифторметилаланин. Целевой продукт получали в соответствии со способом, описанным на стадии В примера 1,используя в качестве исходного реагента соединение, полученное на предыдущей стадии. СтадияN-Трет-бутоксикарбонил(2R,3)-3-циклогексил-3-трифторметилаланин. 1N раствор гидроксида натрия (11 ммоль) и ди-трет-бутил дикарбоната (11 ммоль) добавляли к 10 ммолям соединения, описанного на предыдущей стадии, растворенного в третбутаноле. После перемешивания в течение часа растворители выпаривали, остаток переносили в этилацетат, органическую фазу промывали, сушили и выпаривали с образованием целевого продукта. Стадия J. 1-[N-Трет-бутоксикарбонил(2R,3)-3-циклогексил-3-трифторметилаланил](2R,3)-2,3-метаногомопролин. Целевой продукт получали в соответствии со способом, описанным на стадиях А и В примера 1, используя в качестве исходных реагентов соединение, описанное на предыдущей стадии, и соединение, описанное в препаративном примере В. Стадия К. Дигидрохлорид 1-[(2R,3)-3 циклогексил-3-трифторметилаланил]-N-(4 амидинобензил)-(2R,3)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение, полученное на предыдущей стадии, и соединение,описанное в препаративном примере С. Пример 70. Дигидрохлорид 1-[(2R,3)-3 циклогексил-3-трифторметилаланил]-N-(4 002645 28 амидинобензил)-(2R,3R)-2,3-метаногомопролинамида. Стадия А. (4R)-3-[(3)-3-Циклогексил 4,4,4-трифтор-1-оксобутил]-4-бензил-2-оксазолидинон. После выделения диастереоизомеров из смеси, описанной на стадии D примера 69, методом хроматографии на силикагеле с использованием смеси н-гептан/толуол в соотношении 40/60 в качестве элюента, целевой продукт получали выпариванием второй из двух элюированных фракций. Стадия В. 1-[N-Tpeт-бутоксикарбонил(2R,3)-3-циклогексил-3-трифторметилаланил](2S,3R)-2,3-метаногомопролин. Целевой продукт получали в соответствии со способом, описанным на стадиях F-J примера 69, используя в качестве исходного реагента соединение, описанное на предыдущей стадии. Стадия С. Дигидрохлорид 1-[(2R,3)-3 циклогексил-3-трифторметилаланил]-N-(4 амидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение, полученное на предыдущей стадии, и соединение,описанное в препаративном примере С. Пример 71. Гидрохлорид 1-[N-карбоксиметил-(2R,3)-3-циклогексил-3-трифторметилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали согласно способу, описанному в примере 3, используя в качестве исходного вещества соединение, описанное в примере 69. Элементный микроанализ: Вычислено: Найдено: Пример 72. Гидрохлорид 1-[N-карбоксиметил-(2R,3)-3-циклогексил-3-трифторметилаланил]-N-(4-амидинобензил)-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали согласно способу, описанному в примере 3, используя в качестве исходного вещества соединение, описанное в примере 70. Элементный микроанализ: Вычислено: Найдено: Пример 73. Дигидрохлорид 1-[(2R,3)-3 циклогексил-3-трифторметилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение, 29 описанное на стадии J примера 69, и соединение, описанное в препаративном примере Е. Пример 74. Дигидрохлорид 1-[(2R,3)-3 циклогексил-3-трифторметилаланил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное на стадии В примера 70, и соединение, описанное в препаративном примере Е. Пример 75. Дигидрохлорид 1-[N-карбоксиметил-(2R,3)-3-циклогексил-3-трифторметилаланил]-N-[(6-амино-2-метил-3-пиридил)метил](2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного вещества соединение,описанное в примере 73. Пример 76. Дигидрохлорид 1-[N-карбоксиметил-(2R,3)-3-циклогексил-3-трифторметилаланил]-N-[(6-амино-2-метил-3-пиридил)метил](2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали согласно способу, описанному в примере 3, используя в качестве исходного вещества соединение, описанное в примере 74. Пример 77. Гидрохлорид 1-[N-карбоксиметил-(2R)-лейцил]-N-[4-амидинобензил](2S,3R)-2,3-метаногомопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-лейцил]N-[4-амидинобензил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 2, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-третбутоксикарбонил-(2R)-лейцин и соединение,описанное в препаративном примере С. Стадия В. Гидрохлорид 1-[N-карбоксиметил-(2R)-лейцил]-N-[4-амидинобензил](2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 3, используя в качестве исходного реагента соединение, полученное на предыдущей стадии. Элементный микроанализ: Вычислено: Найдено: Пример 78. Дигидрохлорид 1-[N-метил(2R)-фенилглицил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-фенилглицил]-N-[(6-амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное в препаративном примере В, N-трет 30 бутоксикарбонил-(2R)-фенилглицин и соединение, описанное в препаративном примере Е. Стадия В. Дигидрохлорид 1-[N-метил(2R)-фенилглицил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным на стадиях В и С примера 4, используя в качестве исходного реагента соединение, описанное в предыдущей стадии. Пример 79. Дигидрохлорид 1-[N-бензил(2R)-фенилглицил]-N-[(6-амино-2-метил-3 пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 5, используя в качестве исходного вещества соединение,описанное в стадии А примера 78. Пример 80. Гидрохлорид 1-[(2R)-3-циклогексил-2-гидроксипропионил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Стадия А. Дигидрохлорид 1-[(2R)-2 ацетокси-3-циклогексилпропионил]-N-[(6 амино-2-метил-3-пиридил)метил]-(2S,3R)-2,3 метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным в примере 1, используя в качестве исходных реагентов соединение,описанное на стадии В примера 2, соединение,описанное в препаративном примере В, и соединение, описанное в препаративном примере Е. Стадия В. Гидрохлорид 1-[(2R)-3-циклогексил-2-гидроксипропионил]-N-[(6-амино-2 метил-3-пиридил)метил]-(2S,3R)-2,3-метаногомопролинамида. Целевой продукт получали в соответствии со способом, описанным на стадиях D и Е примера 22, используя в качестве исходного вещества соединение, описанное на предыдущей стадии. Элементный микроанализ: Вычислено: Найдено: Фармакологическое исследование соединений изобретения Пример 81. Антикоагуляционная активность, измерение тромбинового времени и активированного кефалинового времени на людях. С целью оценки антикоагуляционной активности соединений изобретения, на образцах плазмы человека проводили измерение тромбинового времени (ТТ) и активированного кефалинового времени (ACT). В исследованиях использовали коагулометр ST4 (Diagnostica Stago,France). Лиофилизованную плазму с дефицитом тромбоцитов (Stago) переносили в дистиллированную воду. ТТ определяли с использованием 31 реагента Prest Thrombin, a ACT - с использованием реагента РТТ Automate Cephalin. В плазму (90 мкл) добавляли ингибитор или растворитель (10 мкл) после чего смесь инкубировали в течение 2 мин при 37 С. Добавляли 100 мкл Prest Thrornbin (ТТ) или РТТ Automate Cephalin (ACT) и в момент добавления включали секундомер. В этих условиях ТТ имело величину порядка 18 с, a ACT - порядка 12 с. Активность антагониста оценивали по его способности увеличивать ТТ и ACT относительно контрольного эксперимента. Эффективность действия ингибиторов выражали концентрацией в мкМ, при которой происходило удваивание времени коагуляции (Ctt2). Соединения изобретения вызывали очень значительное увеличение времени коагуляции, о чем свидетельствуют значения Ctt2, приведенные в следующей ниже табл. 1, представленной в качестве примера: Таблица 1ACT Ctt2, мкМ Пример ТТ Ctt2, мкМ 2 0,07 0,52 3 0,06 0,56 9 0,20 0,86 11 0,06 0,59 13 0,18 2,30 14 0,19 2,20 16 0,09 0,42 17 0,11 0,86 24 0,03 0,58 25 0,08 0,45 28 0,31 2,30 29 0,46 2,80 31 0,17 1,30 32 0,12 1,09 33 0,11 1,10 61 0,05 0,47 Пример 82. Ингибирование тромбина и сериновых протеаз фибринолиза. Для in vivo оценки ингибиторной активности соединений настоящего изобретения на тромбине человека (Sigma, удельная активность 3230 NIN единиц/мг), очищенный фибриноген человека (4 мМ, Stago) (Fg) добавляли к заданному количеству тромбина (0,7 нМ), который предварительно инкубировали в присутствии или отсутствии испытуемого ингибитора (20 С,10 мин). В опытах по in vivo оценке селективности соединений в отношении плазмина, описанную выше методику применяли на очищенном плазмине человека (2 нМ, Stago) с использованием в качестве субстрата паранитроанилидсодержащего пептида: Glu-Phe-Lys-pNA (0,50 мМ, S 2403, Kabi). Ингибиторы, ферменты и субстраты разбавляли в одном и том же буфере (0,01 мМ фосфатный буфер, рН 7,4, содержащий 0,12 М 32 хлористого натрия и 0,05% альбумина телячьей сыворотки) и затем образцы объемом 50 мкл распределяли в микротитрационном планшете из полистирола. Количество фибрина, образовавшегося за счет тромбина или паранитроанилида, выделившегося под воздействием сериновой протеазы, измеряли спектрофотометрически при длине волны 406 нм через 15-30 мин реакции при 20 С. В приведенной ниже табл. 2 представлена концентрация соединений, выраженная в нМ,ингибирующая на 50% ферментативную активность тромбина (IC50) по сравнению с контрольным экспериментом, проведенном в отсутствии соединения изобретения. Полученные результаты демонстрируют тот факт, что соединения изобретения являются мощными ингибиторами тромбина человека в отношении фибриногена человека. В представленной ниже табл. 3 приведены выраженные в нМ концентрации соединений,ингибирующие на 50% ферментативную активность (IC50) сериновых протеаз фибринолиза. Полученные результаты показывают, что соединения изобретения проявляют значительную селективность в отношении сериновых протеаз фибринолиза. Таблица 2 Пример 33 Пример 83. Антикоагулянтная активность после введения per os собакам. Самцам или самкам собак весом 11-28 кг перорально вводили соединения настоящего изобретения (5 или 10 мг/кг). Время коагуляции(ТТ, ACT) определяли на образцах собачьей плазмы крови за 10 мин до и через 30 мин, 1, 2,4 и 6 ч после введения соединений изобретения. Измерение времени коагуляции проводили по методике, описанной в примере 81. В условиях эксперимента ТТ имело значение порядка 19 с, a ACT - порядка 18 с. Соединения настоящего изобретения существенно увеличивают значения ТТ и ACT при испытании на животных. Полученные результаты суммированы в табл. 4. Эти результаты показывают максимальные приросты значений ТТ иACT, которые достигаются после перорального введения собакам. Приведенные значения демонстрируют кратность увеличения значения первоначального времени. Таблица 4 Увеличение значений ТТ и ACT (кратность увеличения значения начального времени) Пример Доза, мг/кг ТТACT 2 5 3,8 1,4 3 5 8,4 2,1 11 5 5,6 2,3 17 5 16,0 3,7 24 5 6,7 1,2 28 10 6,2 1,8 29 10 6,2 1,7 33 5 7,1 1,5 61 5 14,2 2,0 Пример 84. Фармацевтическая композиция. Рецептура приготовления 1000 таблеток,каждая из которых содержит 10 мг активного ингредиента: Соединение примера 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой n равно 2 или 3,R1 представляет собой (С 3-С 8)циклоалкильную группу, необязательно замещенную фенильную группу или линейную либо разветвленную (C1-C6)алкильную группу, необязательно замещенную одной или более одинаковыми 34 или различными группами, выбранными из галогена, (С 3-C8)циклоалкила и необязательно замещенного фенила,R2 представляет собой аминогруппу, амидиногруппу, необязательно замещенную одной или более одинаковыми или различными группами, выбранными из линейного или разветвленного (С 1-С 6)алкила и гидроксигруппы, гуанидиногруппу, необязательно замещенную линейной или разветвленной (C1-С 6)алкильной группой, или изотиоуреидогруппу, необязательно замещенную линейной или разветвленной(C1-C6)алкильной группой,Аr представляет собой арильную группу или моноциклическую азотсодержащую гетероарильную группу,X1 представляет собой гидроксигруппу,аминогруппу или группу -NHR3,R3 представляет собой пропаргильную группу, иминометильную группу, линейную или разветвленную(C1-C6)алкилсульфонильную группу, линейную или разветвленную арил(C1C6)алкилсульфонильную группу,группу-CONR3R3 или линейную или разветвленную(C1-С 6)алкильную группу, необязательно замещенную группой -СO2R3, группой -CONR3R3,гетероциклической группой, аминосульфонильной группой, арильной группой или гетероарильной группой,R3 и R3, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкилсульфонильную группу,арильную группу, линейную или разветвленную(C1-C6)алкильную группу (необязательно замещенную карбоксигруппой, линейной или разветвленной (C1-С 6)алкоксикарбонильной группой или карбамоильной группой), или совместно с атомом азота, с которым они связаны, образуют гетероциклическую группу,их изомеры, а также их соли присоединения фармацевтически приемлемой кислоты или основания,при условии, что термин необязательно замещенный фенил обозначает фенил, замещенный одной или более одинаковыми или различными группами, выбранными из галогена,линейного или разветвленного (С 1-С 6)алкила,линейной или разветвленной (C1-C6)алкокси,гидрокси, линейного или разветвленного тригалоид(С 1-С 6)алкила и аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1-C6)алкильными группами),термин гетероциклическая группа относится к насыщенной или ненасыщенной, моноили бициклической группе, имеющей 5-12 членов кольца, содержащей один, два или три гетероатома, выбранных из кислорода, азота и серы,при условии, что гетероцикл может быть необязательно замещен одной или более одинаковы 35 ми или различными группами, выбранными из галогена, линейного или разветвленного (C1 С 6)алкила, линейного или разветвленного (C1 С 6)алкокси, оксо, гидрокси, линейных или разветвленных тригалоид(С 1-С 6)алкильных групп и амино (необязательно замещенной одной или более линейными или разветвленными (C1C6)алкильными группами),термин арил обозначает фенил, бифенилил или нафтил, причем каждая из этих групп может быть необязательно замещена одной или более одинаковыми или различными группами,выбранными из галогена, линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (C1-C6)алкокси, гидрокси, линейного или разветвленного тригалоид(С 1-С 6)алкила,аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1 С 6)алкильными группами) и карбокси,а термин гетероарильная группа обозначает ароматическую моно- или бициклическую группу, имеющую 5-12 членов кольца, содержащую один, два или три гетероатома, выбранных из кислорода, азота и серы, причем гетероарил может быть необязательно замещен одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С 6)алкила, гидрокси,линейного или разветвленного (C1-С 6)алкокси,тригалоидметила и аминогруппы (необязательно замещенной одной или более линейными или разветвленными (C1-С 6)алкильными группами). 2. Соединение формулы (I) по п.1, в котором R1 представляет собой (С 3-С 8)циклоалкильную группу или необязательно замещенную линейную или разветвленную (C1-C6)алкильную группу. 3. Соединение формулы (I) по п.1, в котором R2 представляет собой амино или амидиногруппу. 4. Соединение формулы (I) по п.1, в котором Аr представляет собой необязательно замещенную фенильную группу или необязательно замещенную пиридильную группу. 5. Соединение формулы (I) по п.1, в котором X1 представляет собой аминогруппу или группу -NHR3, в которой R3 представляет собой линейную или разветвленную арил(С 1-С 6)алкилсульфонильную группу или необязательно замещенную линейную или разветвленную (C1C6)алкильную группу. 6. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3,3-дифенилаланил]N-(4-амидинобензил)-(2S,3R)-2,3-метанопролинамид, его изомеры, а также соли присоединения фармацевтически приемлемой кислоты. 7. Соединение формулы (I) по п.1, представляющее собой 1-[N-карбоксиметил-(2R)циклогексилглицил]-N-(4-амидинобензил)(2S,3R)-2,3-метанопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты. 36 8. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил](2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты. 9. Соединение формулы (I) по п.1, представляющее собой 1-[N-метил-(2R)-3-циклогексилаланил]-N-[(6-амино-2-метил-3-пиридил) метил]-(2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты. 10. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3,3-дифенилаланил]N-(4-амидинобензил)-(2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты. 11. Соединение формулы (I) по п.1, представляющее собой 1-[(2R)-3,3-дициклогексилаланил]-N-[(6-амино-2-метил-3-пиридил)метил](2S,3R)-2,3-метаногомопролинамид, его изомеры, а также его соли присоединения фармацевтически приемлемой кислоты. 12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II) в которой n имеет значения, указанные для формулы (I), а Вn представляет собой бензильную группу, подвергают взаимодействию с соединением формулы (III) в которой R1 имеет значения указанные для формулы (I), X2 представляет собой атом кислорода или -NH-, a P1 представляет собой защитную группу амино- или гидроксифункции, в присутствии пептидного связующего агента, с образованием соединения формулы (IV) в которой n, R1, Х 2, Вn и P1 имеют указанные выше значения, после чего соединение формулы(IV) путем каталитического гидрирования или гидролиза превращают в соединение формулы в которой n, R1, X2 и P1 имеют указанные выше значения, после чего соединение формулы (V) подвергают взаимодействию с соединением формулы (VI) в которой Аr имеет значения, указанные для формулы (I), a R4 представляет собой R2 или R2 37P2, причем R2 имеет значения, указанные для формулы (I), a P2 представляет собой защитную группу аминофункции, в присутствии пептидного связующего агента, с образованием соединения формулы (VII) в которой n, R1, R4, Аr, Х 2 и P1 имеют указанные выше значения,после чего соединение формулы (VII) превращают в соединение формулы (I) путем одной или более реакций снятия защитной группы,алкилирования или восстановительного аминирования, после чего соединение формулы (I),если необходимо, подвергают очистке в соответствии с общепринятым методом очистки, 38 если желательно, разделяют на его изомеры в соответствии с общепринятым методом разделения и, если желательно, превращают в соль присоединения фармацевтически приемлемой кислоты или основания. 13. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-11, совместно с одним или более фармацевтически приемлемыми инертными, нетоксичными носителями. 14. Фармацевтическая композиция по п.13 для применения в качестве ингибитора трипсиноподобной сериновой протеазы. 15. Фармацевтическая композиция по п.14 для применения в качестве ингибитора тромбина.
МПК / Метки
МПК: A61K 38/05, A61P 7/02, C07K 5/06, C07D 209/52
Метки: фармацевтические, 2,3-метаноаминокислоты, соединения, способ, получения, новые, содержащие, композиции
Код ссылки
<a href="https://eas.patents.su/20-2645-novye-soedineniya-23-metanoaminokisloty-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения 2,3-метаноаминокислоты, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Производные 4-циано-4-деформилсордарицина
Следующий патент: Дезинфицирующее средство и способ его получения
Случайный патент: Фунгицидные смеси