Производные 4-циано-4-деформилсордарицина
Формула / Реферат
1. Соединение формулы I
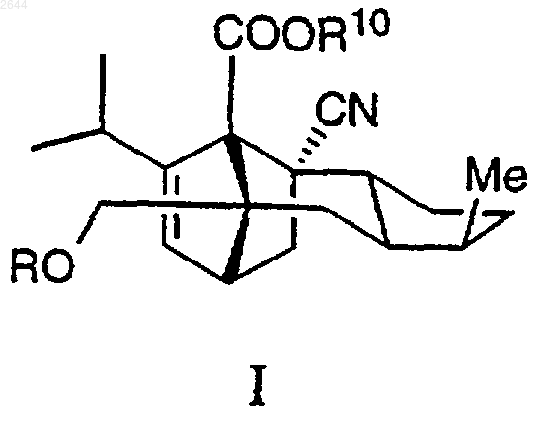
где R представляет собой
(a) C(=O)OR1,
(b) C(=O)NR2R3,
(c) C(=O)R4,
(d) СH(R2)ОR5,
(e) C(R6)(R7)(R8),
(f)
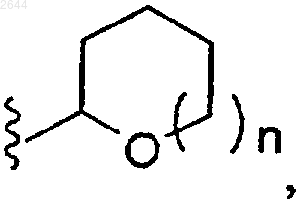
или
(g) H;
R1 представляет собой
(a) C1-C14 алкил,
(b) C2-C14 алкенил,
(c) C2-C14 алкинил,
(d) С3-С20 циклоалкил,
(e) арил или
(f) арил C1-6 алкил;
R2 и R3 независимо представляют собой
(a) Н или
(b) R1;
R4 представляет собой
(а) Н,
(b) R1 или
(c) -(CH2)mNR2R3;
R5 представляет собой
(а) R1 или
(b) -(СH2)xO(СH2)yН;
R6 представляет собой
(а) Н,
(b) C1-C14 алкил,
(c) арил,
(d) арил C1-6 алкил,
(e) -(CH2)yCHR9(CH2)zH,
(f) -(CH2)yCуC(CH2)zH,
(g) -(CH2)yС(R7)=СH(СH2)zН,
(h) -(CH2)yCуC(CH2)mR9,
(i) -(CH2)yC(R7)=CH(CH2)mR9,
R7 и R8 независимо представляют собой
(a) H или
(b) C1-C14 алкил;
R9 представляет собой
(а) ОН или
(b) NR2R3;
R10 представляет собой
(а) H,
(b) -СH2С6Н5,
(c) -СH2СН=СH2,
(d)
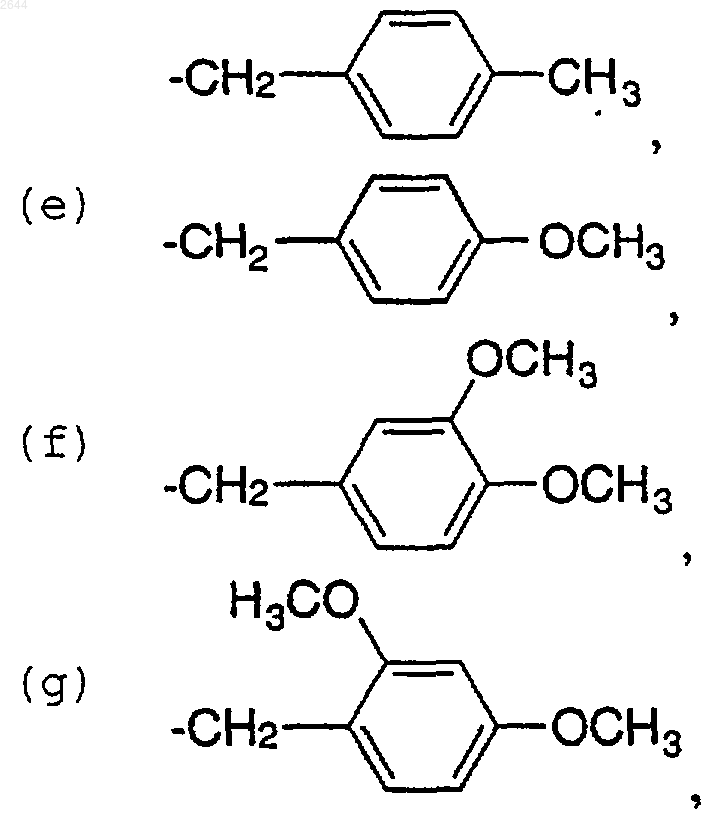
или
n равно 0 или 1;
m равно 1-6;
х равно 2-6;
у равно 0-6;
z равно 0-6;
или его фармацевтически приемлемая или приемлемая в сельском хозяйстве соль.
2. Соединение по п.1 формулы Iа
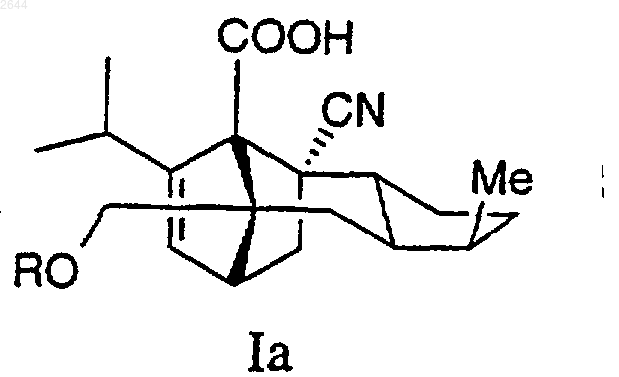
где R представляет собой
(a) C(=O)OR1,
(b) C(=O)NR2R3,
(c) C(=O)R4,
(d) CH2OR5,
(e) C(R6)(R7)(R8) или
(f)
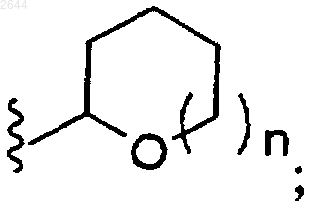
или его фармацевтически приемлемая соль.
3. Соединение по п.2, где R представляет собой C(=O)OR1.
4. Соединение по п.2, где R представляет собой C(=O)NR2R3; или его фармацевтически приемлемая соль.
5. Соединение по п.2, где R представляет собой C(=O)R4; или его фармацевтически приемлемая соль.
6. Соединение по п.2, где R представляет собой CH(R2)OR5; или его фармацевтически приемлемая соль.
7. Соединение по п.2, где R представляет собой С(R6)(R7)(R8); или его фармацевтически приемлемая соль.
8. Соединение по п.2, где R представляет собой

или его фармацевтически приемлемая соль.
9. Соединение по п.2, где R представляет собой CH(R6)(R7),
R6 представляет собой
(а) Н,
(b) C1-C14 алкил,
(c) арил,
(d) арил C1-6 алкил,
(e) -(СH2)yСН(ОН) (CH2)zH,
(f) -(CH2)yC(R7)=CH(CH2)zH,
R7 представляет собой Н или C1-6 алкил,
R9 представляет собой ОН;
или его фармацевтически приемлемая соль.
10. Соединение по п.2, где R представляет собой
(а) -СH3,
(b) -СH2СH3,
(c) -СH2СH2СH3,
(d) -СH2СH2СH2СH3,
(e) -СH2СH2СH2СH2СH3,
(f) -СH2СH2СH2СH2СH2СH3,
(g) -СH2СH2СH2СH2СH2СH2СH3,
(h) -СH2СH2СH2СH2СH2СH2СH2СH3,
(i) -СH2СH2СH2СH2СH2СH2СH2СH2СH3,
(j) -СH2СH2СН(СH3)2,
(k) -СH2С6Н5,
(l) -СН(СH3)2,
(m) -СH2СН(СH3)2,
(n) -СH2СН=СH2,
(о) -СH2СН=СНСH3,
(p) -СH2СН=СНСH2СH3,
(q) -СH2СН=СНСH2СH2СH3;
или его фармацевтически приемлемая соль.
11. Соединение по п.2, где R представляет собой
(а) -СH3,
(b) -СH2СH3,
(c) -СH2СH2СH3,
(d) -СH2СH2СH2СH3,
(e) -СH2СH2СH2СH2СH3,
(f) -СH2СН(СH3)2,
(g) -СH2СH2СН(СH3)2,
(h) -СH2СН=СНСH3,
(i) -СH2СН=СНСH2СH3,
(j) -СH2СН=СНСH2СH2СH3;
или его фармацевтически приемлемая соль.
12. Соединение по п.1, где R представляет собой Н; или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, которая включает соединение по п.1 и фармацевтически приемлемый носитель.
14. Агрохимическая композиция, которая включает соединение по п.1 и приемлемый в сельском хозяйстве носитель.
15. Способ лечения или профилактики грибковой инфекции у животных, который включает введение упомянутому животному антифунгицидно эффективного количества соединения по п.1.
16. Способ подавления фитопатогенных грибков, который включает обработку растения, нуждающегося в таком подавлении, антифунгицидно эффективным количеством соединения по п.1.
Текст
Настоящее изобретение относится к производным 4-циано-4-деформилсордарицина,которые являются мощными антифунгицидными агентами с широким спектром активности, к способу их получения, к фармацевтическим и сельскохозяйственным композициям, содержащим эти соединения, и к способам подавления грибковых инфекций у человека, животных и растений с использованием таких соединений. Предпосылки создания изобретения Сордарин является антифунгицидным антибиотиком, выделенным из плесени SordariaActa, 1971, 51:119-20). В качестве антифунгицидных агентов в литературе также упоминались другие соединения, имеющие сордариновый скелет. В Japanese Kokai J62040292 раскрыто соединение зофимарин, выделенное из Zofiela marina sp. в Japanese Kokai J06157582 раскрыто соединение ВЕ-31405, выделенное изPenicillium sp.; и соединение SCH57404 описано в J. Antibiotics, 1995, 48:1171-1172. Полусинтетические производные сордарина описаны в заявках РСТ WO 96/14326 и WO 96/14327. Сордарицин, агликон, может быть получен из сордарина кислотным гидролизом (Hauserand Sigg, Helvetica Chimica Acta, 1971, 51:11920); подобным образом метиловый эфир сордарицина получают из метилового эфира сордарина. Полный синтез метилового эфира сордарицина описан в Kato et al, J. Chem. Soc., Chem.Commun., 1993, 1002-1004, который также раскрывает метиловый эфир O-метоксиметилсордарицина. Диацетат 4-дезформил-4-гидроксиметилсордарицина раскрыт в Mander andRobinson, J. Org. Chem., 1991, 56(11):3395-3601. Не было продемонстрировано, что сордарицин или его производные, описанные в литературе,обладают биологической активностью. Ранее не были описаны цианопроизводные формильной группы. Подробное описание изобретения Настоящее изобретение предоставляет соединения формулы I 3 или их фармацевтически приемлемые, или приемлемые в сельском хозяйстве соли. В одном из вариантов настоящее изобретение относится к соединениям формулы Iа или их фармацевтически приемлемые соли. В одной подгруппе соединений формулы Предпочтительный вариант настоящего изобретения включает соединения формулы Iа,где R представляет собой CH(R6)(R7),R6 представляет собой(а) Н,(b) C1-C14 алкил,(c) арил,(d) арил C1-6 алкил,(e) -(CH2)yCH(OH) (CH2)zH,(f) -(CH2)yC(R7)=CH(CH2)zH,R7 представляет собой Н или C1-6 алкил. Другой предпочтительный вариант настоящего изобретения относится к соединениям формулы Iа, где(о) -СH2 СН=СНСН 3,(р) -СH2 СН=СНСH2 СН 3,(q) -СH2 СН=СНСH2 СH2 СН 3. В более предпочтительном варианте настоящего изобретения предоставлены соединения формулы Iа, где(а) -СН 3,(b) -СH2 СН 3,(c) -СH2 СH2 СН 3,(d) -СH2 СН 2 СH2 СН 3,(e) -СH2 СH2 СH2 СH2 СН 3,(f) -СH2 СН(СН 3)2,(g) -СH2 СH2 СН(СН 3)2,(h) -СН 2 СН=СНСН 3,(i) -СH2 СН=СНСH2 СН 3,(j ) -СH2 СН=СНСH2 СH2 СН 3. Другим объектом настоящего изобретения является фармацевтическая композиция, которая включает антифунгицидно эффективное количество соединения формулы I и фармацевтически приемлемый носитель. Также предоставлена фармацевтическая композиция, которую получают объединением соединения формулы I и фармацевтически приемлемого носителя. Другим объектом настоящего изобретения является сельскохозяйственная композиция,которая включает антифунгицидно эффективное количество соединения формулы I и приемлемый в сельском хозяйстве носитель. Также предоставляется сельскохозяйственная композиция,которую получают соединением формулы I с приемлемым в сельском хозяйстве носителем. Следующим объектом настоящего изобретения является способ лечения грибковой инфекции у животных (включая человека), который включает введение животному, нуждающемуся в таком лечении, антифунгицидно эффективного количества соединения формулы I. Следующим объектом настоящего изобретения является способ подавления фитопатогенных грибков у растений, который включает обработку упомянутых растений антифунгицидно эффективным количеством соединения формулы I. Используемые в данном описании следующие термины имеют указанные ниже значения, если не определено иначе. Термин "алкил", один или как часть группы (например, аралкила), обозначает алкильный фрагмент с прямой или разветвленной цепью,имеющий определенное число атомов углерода,такой как метил, этил, н-пропил, н-бутил, изопропил, изобутил, изопентил, втор-бутил, тбутил, н-гексил, н-октил, децил, ундецил, циклопропил, циклобутил, циклопентил, циклогексил, циклобутилметил, циклопентилэтил, циклогексилметил и подобные. Термин "циклоалкил" обозначает углеводород, содержащий одно или несколько колец,состоящих из 3-12 атомов углерода, включая 5 углеводород, имеющий вплоть до 20 атомов углерода. Примерами циклоалкильных групп являются циклопропил, циклопропилметил,циклобутил, 2-циклопентилэтил, циклопентил,циклогептил, адамантил, циклододецилметил, 2 этил-1-бицикло[4.4.0]децил и подобные. Термин "арил", один или как часть группы(например, аралкила), обозначает фенил, бифенил, трифенил, нафтил, или гетероарил, каждый необязательно замещен одной-тремя группами,независимо выбранными из галогена, гидроксила, C1-6 алкила, C1-6 алкоксильной группы илиC1-4 алкоксикарбонила. Гетероарильная группа может представлять собой 5- или 6-членный гетероароматический цикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода и серы. Подходящие примеры гетероарильных групп включают пиридил, фурил, тиенил и пирролил. Термин "алкенил" обозначает прямую или разветвленную углеродную цепь, имеющую, по меньшей мере, одну двойную углеродуглеродную связь. Примеры включают винил,аллил, бутенил, изобутенил, бутадиенил и подобные. Термин "алкинил" обозначает прямую или разветвленную углеродную цепь, имеющую, по меньшей мере, одну тройную углеродуглеродную связь. Примеры включают ацетиленил, пропаргил, бутинил, 1,3-пентадиинил и подобные. Термин "подавление", использующийся в связи с фитопатогенным грибком, включает профилактическое применение (т.е. для защиты от инфекции) и лечебное применение (т.е. для уничтожения инфекции). Термин "растения" включает живые растения, листву, цветки, семена, фрукты и другие материалы, полученные из растений. Термин также включает корни растений, на которые воздействуют посредством внесения активного ингредиента в почву. Термин "композиция", в выражениях фармацевтическая или сельскохозяйственная композиция, охватывает продукт, включающий активный ингредиент(ы) и инертный ингредиент(ы), который включает носитель, а также любой продукт, который получается, непосредственно или косвенно, в результате сочетания,комплексации, аггрегации или других взаимодействий любых двух или более ингредиентов,или в результате диссоциации одного или нескольких ингредиентов, или в результате других типов взаимодействий одного или нескольких ингредиентов. Подходящие соли соединения формулы I включают соли неорганических оснований, такие как соли щелочных металлов (например,соли натрия и калия), соли аммония и соли органических оснований. Подходящие соли органических оснований включают соли аминов,такие как соли тетраалкиламмония (например, 002644 6 тетрабутиламмония или триметилцетиламмония), триалкиламина (например, триэтиламина), диалкиламина (например, дициклогексиламина), необязательно замещенного бензиламина (например, фенилбензиламина или пбромбензиламина), этаноламина, диэтаноламина, N-метилглюкозамина, N-метилпиперидина,пиридина и замещенного пиридина (например,коллидина, литидина, 4-диметиламинопиридина), и соли три(гидроксиметил)метиламина, и соли аминокислот (например, соли лизина или аргинина). Соединения формулы I получают из сордарина (II) или его агликона, сордарицина (III). Сордарин представляет собой [1R-(1,3 а,4,4 а,7,7 а,8a)]8 а-[(6-деокси-4-O-метил-D-альтропиранозилокси)метил]-4-формил 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновую кислоту формулы II Сордарин может быть получен путем культивирования Sordaria araneosa NRRL 3196(также депонированной АТСС как АТСС 36386) в соответствии с методикой, описанной в GB 1162027 или в WO 96/14326. Сордарин может быть также выделен при ферментации Roselliniasubiculata (АТСС 74386) или неидентифицированного грибка (АТСС 74387), как описано ниже. Обе культуры депонированы 27 августа 1996 г. в постоянной коллекции Американской Коллекции культур микроорганизмов, 12301Parklawn Drive, Rockville, Maryland 20852, USA,при условии соблюдения Будапештской Конвенции по международному признанию депонирования микроорганизмов для целей процедур патентования. Сордарицин (III) представляет собой [1R(1,3 а,4,4 а,7,7 а,8 а)]8 а]-4-формил-8 а(гидроксиметил)-4,4 а,5,6,7,7 а,8,8 а-октагидро-7 метил-3-(1-метилэтил)-1,4-метано-s-индацен 3a(1 Н)-карбоновую кислоту формулы III Сордарицин может быть получен из сордарина обработкой концентрированной хлористо-водородной кислотой. Как раскрыто в WO 96/14326, сордарицин также получают при ферментации мутанта, полученного из Sordaria araneosa NRRL 3196, и биотрансформацией сордарина, с использованием вида Coryneform. Соединения настоящего изобретения(формула I) могут быть получены по способу, 7 описанному ниже. Условия являются типичными и не рассматриваются как ограничивающие. Схема 1 описывает синтез карбоксизащищенного 4-циано-4-деформилсордарицина (IV) из сордарина. Это производное сордарина может использоваться в качестве исходного материала для синтеза соединений формулы (I). Гидроксильные группы сордарина защищают с помощью подходящей защитной группы, и затем карбоксильные группы защищают с помощью такой же или альтернативной подходящей группы. Формильную группу превращают в альдоксим и альдоксим дегидратируют с образованием нитрила (цианогруппы) с использованием подходящего агента, такого как внутренняя соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (реагент Берджеса). Защитные группы сахара удаляют кислотным гидролизом с получением соединения (IV) Схема 1PG и PG' могут быть идентичными или различными. Сордарицин может быть превращен в соединение (IV) так, как иллюстрируется на схеме 2. Защищают карбоксильные и гидроксильные группы сордарицина и получают альдоксим. Далее дегидратация с помощью подходящего агента, такого как внутренняя соль гидроксида(реагент Берджеса), с последующим удалением гидроксильных защитных групп, дает соединение (IV). Схема 2 8 Карбаматные, сложноэфирные и карбонатные производные 4-циано-4-деформилсордарицина могут быть получены так, как показано на схеме 3. Получение карбаматов может проводиться обработкой соединения (IV) изоцианатом (в примерах, где R3 представляет собой Н),или карбамоилгалогенидом, или другим активированным карбамоилирующим агентом в инертном растворителе. Эфирные производные могут быть получены подобным образом обработкой соединения(IV) активированным карбонильным соединением, таким как хлорангидрид кислоты или смешанный ангидрид, предпочтительно в присутствии катализатора ацилирования, такого как N,Nдиметиламинопиридин, и основания, такого как пиридин. Карбонатные производные могут быть получены обработкой соединения (IV) активированным карбонатом, таким как хлорформиат или пирокарбонат. В реакционной смеси предпочтительно используют катализатор ацилирования, такой как N,N-диметиламинопиридин, и основание, такое как пиридин. Схема 3PG является защитной группой для карбоксильной группы; С(O)Y является активированным карбонилом, таким как галогенангидрид или ангидрид кислоты. Схема 4 демонстрирует синтез простых эфирных производных 4-циано-4-деформилсордарицина. Обработка соединения (IV) галогенпроизводным в основных условиях или виниловым простым эфиром в кислых условиях приводит к образованию замещенных алкоксиэфирных производных. Обработка соединения (IV) первичным или вторичным галогенидом или сульфонатом и подходящим основанием, таким как гидрид натрия, в подходящихSN2 условиях дает соответствующее первичное или вторичное эфирное производное, тогда как обработка соединения (IV) третичным спиртом,третичным галогенидом или третичным сульфонатом и кислотой Льюиса (включая протонные кислоты) в подходящих SN1 условиях дает 9 соответствующее третичное производное простого эфира. Схема 4PG является защитной группой для карбоксильной группы; Х является подходящей уходящей группой, такой как галогенид или сульфонат. Получение циклических ацеталей из соединения (IV) отражено на схеме 5. Обработка соединения (IV) циклическим виниловым эфиром в присутствии кислотного катализатора дает циклическое ацетальное производное соединения (IV). Схема 5PG является защитной группой для карбоксильной группы. Соединения формулы (I) могут быть также получены после того, как первичные гидроксильные группы сордарицина были вначале модифицированы, исключая получение сложноэфирных групп, как показано на схеме 6. Карбаматные, карбонатные, ацетальные, простые эфирные и циклические ацетальные исходные соединения могут быть получены в соответствии с общими методиками, отраженными на схемах 3-5, за исключением того, что защищенный по карбоксильным группам сордарицин используют вместо 4-циано-4-деформилсордарицина. Альдоксим производного сордарицина может быть получен обработкой альдегидного соединения гидрохлоридом гидроксиламина в системе растворителей спирт-пиридин. Альдоксим может быть превращен в цианогруппу взаимодействием альдоксима с подходящим дегидратирующим агентом, таким как внутренняя соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (реагент Берджеса), но для дегидратации может быть использован другой подходящий реагент. Удаление защитной группы дает соединение формулы (I).R'OH является низшим алкильным спиртовым растворителем;PG является защитной группой для карбоксильной группы. Применение. Соединения формулы I являются антифунгицидными агентами, использующимися в качестве лекарственных препаратов для человека и животных, а также в качестве протекторов для культурных растений. Соединения формулы I являются очень активными фунгицидами, полезными для подавления грибковых инфекций у животных, включая человека. Например, они могут использоваться для лечения грибковых инфекций, вызванных такими организмами, как виды Candidaneoformans,Pneumocystis carinii, Aspergillus Sp (например,Aspergillus flavus и Aspergillus fumigatus), Coccidioides (например, Coccidioides immitis), Paracoccidioides (например, Paracoccidioides brasiliensis), Histoplasma (например, Histoplasma capsulatum) или Blastomyces (например, Blastomyces dermatitidis). Они могут использоваться для лечения других грибковых инфекций, вызванных видами Trichophyton, Microsporum или Epidermophyton (например, Trichophyton mentographytes, Trichophyton rubrum, Microsporum canis или Epidermophyton floccosum), или для лечения инфекций слизистой оболочки, вызванных Candida albicans. Соединения формулы I могут также использоваться для лечения других инфекций,вызванных видами волокнистого грибка, такими как Geotrichum (например, Geotrichum clavatum), Trichosporon (например, Trichosporon beigelii), Blastoschizomyces (например, Blastoschizomyces capitatus), Sporothrix (например, Sporothrix schenckii), Scedosporium (например,Scedosporium apiosperum), Cladosporium (например, Cladosporium carrionii) и Pityrosporum оvale. Соединения формулы I могут также использоваться для лечения инфекций, вызванных такими простейшими, как Toxoplasma, Crypto 11Trichomonas. Оценку in vitro антифунгицидной активности соединений данного изобретения проводили в жидкой или твердой среде, используя антифунгицидную с двукратным серийным разведением методику определения минимальной ингибирующей концентрации (МИК) антифунгицидного агента, которая ингибирует развитие роста через 24-48 ч инкубации при 35 С. На практике, ряд микробиологических плашек с агаром или планшетов для микроразведений с бульоном, содержащих двукратные разведения тестируемого антифунгицидного агента, засевали стандартной культурой, относящейся к клиническим патогенам, например, Candida аlbicans. Плашки с агаром или планшеты для микроразведений с бульоном затем исследовали на наличие или отсутствие роста грибка и определяли соответствующие значения МИК. Визуализацию конечных точек проводили с использованием жизнеспособного красителя Almar Blue. Оценка in vivo соединений формулы I может быть проведена для ряда доз путем введения (например, подкожно, перорально, внутрибрюшинно или внутривенно) мышам, зараженным внутривенно штаммом Candida spp. Почки тестируемых животных удаляли и определяли количество живых Candida spp. и снижение инфецирования определяли по сравнению с необработанными контрольными животными. С точки зрения их антифунгицидной активности, соединения формулы I являются полезными для лечения и/или предотвращения ряда грибковых инфекций у человека и животных. Такие инфекции включают поверхностные,кожные, подкожные и системные микотические инфекции, такие как инфекции дыхательного тракта, инфекции желудочно-кишечного тракта,сердечно-сосудистые инфекции, инфекции мочевых путей, инфекции ЦНС, кандидозы и хронические мукокандидозы (например, кандидозный стоматит и вагинальный кандидоз), кожные инфекции, вызванные грибками, кожные и кожно-слизистые кандидозы,дерматофитозы,включающие дерматомикоз и дерматофитию,атлетические ступни, паронихию, отрубевидный лишай, эритразму, опрелости, грибковое пеленочное высыпание, Candida вульвит, Candida баланит и наружный отит. Они также могут использоваться в качестве профилактических агентов для предотвращения системных и местных грибковых инфекций. Применение в качестве профилактических агентов может, например, составлять часть выбранного кишечного деконтаминационного режима при предотвращении инфекции у пациентов с недостаточным иммунитетом(например,пациентов со СПИДом, пациентов, принимающих антираковую терапию или пациентов с трансплантатами). Предотвращение быстрого роста грибков в процессе лечения антибиотиками может быть 12 также желательно при некоторых синдромах заболеваний или ятрогенных состояниях. Соединения формулы I также имеют применение как широкий спектр антифунгицидных агентов для культурных растений и являются эффективными по отношению к широкому спектру фитопатогенных грибков, в частности грибков класса, включающего Deuteromycetesspp.). Вышеприведенный список иллюстрирует фитопатогенные грибки, против которых упомянутые соединения показывают активность, и не является каким-либо образом ограничивающим. Эти соединения обладают преимущественными лечебными и профилактическими свойствами при защите растений и могут использоваться для ингибирования или уничтожения микроорганизмов, встречающихся на растениях или частях растений (фруктах, цветках,листьях, стеблях, клубнях или корнях) различных полезных растений, тогда как в то же время части растений, которые вырастают позже, являются также защищенными от таких микроорганизмов. Они могут также использоваться в качестве удобрения при обработке посевного материала, особенно семян (фруктов, клубней,зерна) и черенковании растений (например, риса), обеспечивая защиту от грибковых инфекций и от фитопатогенных грибков, встречающихся в почве. Соединения формулы I данного изобретения отличаются тем, что они особенно хорошо переносятся растениями и являются безвредными для окружающей среды. Сельскохозяйственная оценка соединений формулы I может быть проведена с использованием следующих тестов. 1. Действие против Erysiphe graminis на пшенице.a). После одной недели культивирования растения пшеницы опрыскивали смесью (200 м.д. активного ингредиента/20% ацетон/0,25%Triton X155). Через 2 ч обработанные растения инфицировали аскоспорами, которые стряхивали с зараженных растений. Развитие фунгицидной инфекции оценивали после инкубации в течение 8 дней при 22 С и 50% относительной влажности для определения защиты, которую обеспечивает соединение.b). После одной недели культивирования растения пшеницы инфицировали аскоспорами,которые стряхивали с зараженных растений. Через 24 ч растения пшеницы опрыскивали смесью (200 м.д. активного ингредиента/20% аце 13 тон/0,25% Triton X155). Развитие фунгицидной инфекции оценивали после инкубации в течение 8 дней при 22 С и 50% относительной влажности для определения степени лечебной активности, которую обеспечивает соединение.c). После одной недели культивирования растения пшеницы инфицировали аскоспорами,которые стряхивали с зараженных растений. Через 24 ч почву, в которой выращивали растения пшеницы, промачивали насквозь смачивающей смесью (200 м.д. активного ингредиента/20% ацетон/0,25% Triton X155). Развитие фунгицидной инфекции оценивали после инкубации в течение 8 дней при 22 С и 50% относительной влажности для определения степени лечебной активности, которую обеспечивает соединение. 2. Действие против Puccinia recondita на пшенице.a). После одной недели культивирования растения пшеницы опрыскивали смесью для опрыскивания (200 м.д. активного ингредиента/20% ацетон/0,25% Triton X155). Через 2 ч обработанные растения инфицировали спорами. Развитие фунгицидной инфекции оценивали после инкубации в течение 1 дня при 95-100% относительной влажности и 20 С и затем в течение 7 дней при 25 С и 50% относительной влажности для определения защиты, которую обеспечивает соединение.b). После одной недели культивирования растения пшеницы инфицировали суспензией спор. Через 24 ч растения пшеницы опрыскивали смесью для опрыскивания (200 м.д. активного ингредиента/20% ацетон/0,25% Triton X155). Развитие фунгицидной инфекции оценивали после инкубации в течение 1 дня при 95-100% относительной влажности и 20 С и затем в течение 7 дней при 25 С и 50% относительной влажности для определения степени лечебной активности, которую обеспечивает соединение. с). После одной недели культивирования растения пшеницы инфицировали суспензией спор. Через 24 ч почву, в которой выращивали растения пшеницы, промачивали насквозь смачивающей смесью (200 м.д. активного ингредиента/20% ацетон/0,25% Triton X155). Развитие фунгицидной инфекции оценивали после инкубации в течение 1 дня при 95-100% относительной влажности и 20 С и затем в течение 7 дней при 25 С и 50% относительной влажности для определения степени лечебной активности, которую обеспечивает соединение. На основании спектра активности соединения настоящего изобретения могут использоваться для защиты или лечения растений от фитопатогенных грибков, поражающих различные полезные культуры. Следующие виды растений подходят для обработки заявляемыми соединениями, описанными в объеме данного изобретения: зерновые (например, пшеница, рожь, овес,ячмень, рис, сорго и родственные культуры);(авокадо, корица и камфора); или такие растения, как маис, табак, орехи, кофе, сахарный тростник, чай, виноградник, хмель, бананы, природные каучуконосные растения, а также декоративные растения (цветы, кустарники, широколиственные деревья и вечнозеленые растения,такие как хвойные). Однако вышеупомянутые виды растений не ограничивают список растений, относящихся к спектру, охватываемому заявляемыми соединениями. Соединения формулы I особенно полезны для подавления следующих заболеваний растений:Fusarium и Verticillium у фруктов и овощей. Соединения формулы I могут также использоваться в качестве защитных материалов (например,для предохранения лесоматериалов от Paecilomyces variotii). Фармацевтические композиции. Хотя возможно, что при использовании в терапии соединения данного изобретения могут быть введены как таковые, предпочтительно присутствие активного ингредиента в виде фармацевтической композиции. Таким образом, данное изобретение далее относится к фармацевтической композиции, включающей соединение формулы (I),или его фармацевтически приемлемую соль,вместе с одним или несколькими фармацевтически приемлемыми носителями, и, необязательно, с другими терапевтическими и/или профилактическими ингредиентами. Носитель(и) должен быть "приемлемым" в том смысле, что он должен быть совместимым с другими ингре 15 диентами композиции и не являться вредным для его реципиента. Композиции данного изобретения включают композиции в форме, специально составленной для перорального, буккального, парентерального, имплантантного, ректального, местного, офтальмологического или мочеполового введения, или в форме, подходящей для введения путем ингаляции или вдувания. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты, например,сироп, гуммиарабик, желатин, сорбит, трагакант, растительный клей из крахмала или поливинилпирролидона; наполнители, например,лактоза, сахар, микрокристаллическая целлюлоза, маис-крахмал, фосфат кальция или сорбит; смазывающие агенты, например, стеарат магния, стеариновая кислота, тальк, полиэтиленгликоль или кремний; разрыхляющие агенты, например, картофельный крахмал или натриевая соль крахмалгликолата или натриевая соль кроскармелозы; или увлажняющие агенты,такие как лаурилсульфат натрия. Таблетки, которые включают жевательные, диспергируемые или шипучие таблетки, могут быть покрыты в соответствии со способами, хорошо известными в данной области. Жидкие препараты для перорального применения могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для объединения с водой, или другим подходящим растворителем перед использованием. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например, сироп сорбитола, метилцеллюлоза, глюкоза/сахарный сироп, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза,гель стеарата алюминия или гидрированные пищевые жиры; эмульгирующие агенты, например, лецитин, моноолеат сорбитана или гуммиарабик; неводные растворители (которые могут включать пищевые масла), например, миндальное масло, фракционированное кокосовое масло, сложные эфиры масел, пропиленгликоль или этиловый спирт; и консервирующие агенты,например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота. Для буккального ведения композиции могут быть в форме таблеток или пастилок, составленных традиционным образом. Композиции в соответствии с данным изобретением могут быть составлены для парентерального введения путем инъекции или длительной инфузии. Составы для инъекций могут быть представлены в виде единичной дозированной формы в ампулах, или в виде контейнеров с множественными дозами с добавлением консервантов. Композиции могут также быть в таких формах как суспензии, растворы или эмульсии в масле или в водных растворителях и 16 могут содержать такие составляющие агенты,как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для соединения перед использованием с подходящим растворителем, например, стерильной,апирогенной водой. Для введения путем ингаляции композиции в соответствии с данным изобретением доставляются в виде аэрозольного спрея из емкостей под давлением с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа, или из распылителя. В случае аэрозоля под давлением дозированная единица может быть обеспечена с помощью клапана для доставки отмеренного количества. Альтернативно, для введения путем ингаляции композиции в соответствии с данным изобретением могут быть в форме сухой порошкообразной композиции, например, порошкообразной смеси соединения и подходящей порошкообразной основы, такой как лактоза или крахмал, или модифицированной физической форме только лекарственного вещества. Порошкообразная композиция может быть представлена в единичной дозированной форме,например, в капсулах или картриджах, например, из желатина, или в блистерных упаковках,из которых порошок может быть введен с помощью ингалятора или инсуффлятора. Композиции могут быть в форме суппозиториев, например, содержащих подходящую основу для суппозиториев, или пессариев, например, содержащих подходящую основу для пессариев. Композиции могут быть также составлены для местного применения в виде мазей, кремов,гелей, лосьонов, шампуней, порошков (включая порошки для спрея), пессариев, тампонов, спреев, растворов, аэрозолей, капель (например,глазных, ушных или носовых капель) или средств для втирания. Мази или кремы могут,например, быть составлены на водной или масляной основе с добавлением подходящих загустителей или гелеобразующих агентов. Мази для введения в глаза могут быть произведены стерильным образом с использованием стерильных компонентов. Средства для втирания могут, например, быть составлены для ветеринарного применения на масляной основе, содержащей органические растворители, необязательно с агентами для составов, например, со стабилизирующими и солюбилизирующими агентами. Пессарии и тампоны для вагинального введения могут быть составлены с помощью обычных методов и где, возможно, могут содержать шипучий носитель. Такие композиции могут также содержать другие активные ингредиенты, такие как кортикостероиды, антибиотики или антипаразитические средства соответственно. 17 Жидкие препараты для внутриназальной доставки могут быть в форме растворов или суспензий и могут содержать традиционные эксципиенты, такие как агенты для доведения,например, хлорид натрия, декстроза или маннит; консерванты, например, хлорид бензалкония, тиомерзал, фенилэтиловый спирт; и другие агенты для композиций, такие как суспендирующие, буфферизующие, стабилизирующие,диспергирующие и/или ароматизирующие агенты. Трансдермальное введение может осуществляться путем создания подходящей системы,которая способствует абсорбции активного соединения через кожу и обычно состоит из основной композиции, включенной в липкий наклеивающийся пластырь, включающий обратимые пленки, мембраны и пропускающие прокладки. Такие системы могут включать усилители абсорбции, такие как спирты, или действовать, способствуя ионотофорезу. Композиции данного изобретения могут быть также составлены в виде препаратов-депо. Такие долгодействующие препараты могут быть введены путем имплантации (например, подкожной или внутримышечной) или путем внутримышечной инфекции. Так, например, соединение данного изобретения может сочетаться с подходящими полимерными или гидрофобными материалами (например, такими как эмульсия в приемлемом масле), или ионнообменными смолами, или может быть в виде умеренно растворимого производного, например, умеренно растворимой соли. Если композиции включают дозированные единицы, то каждая единица предпочтительно содержит от 0,001 до 1000 мг, преимущественно от 0,01 до 400 мг, активного ингредиента, при пероральном введении соединения данного изобретения. Ежедневная доза, применяемая для лечения взрослых людей, предпочтительно составляет от 0,001 до 5000 мг активного ингредиента, наиболее предпочтительно от 0,01 до 2000 мг, эта доза может быть введена в 1-4 приема в день, например, в зависимости от способа введения, от состояния пациента и от заболевания,которое подлежит лечению. Соединение может быть введено путем внутривенного вливания, с использованием,например, до 50 мг/кг/день активного ингредиента. Длительность лечения определяется скоростью ответной реакции в большей степени,чем условным количеством дней. Соединения данного изобретения могут также использоваться в сочетании с другими терапевтическими агентами, и данное изобретение, таким образом, в следующем варианте относится к комбинации, включающей соединение данного изобретения вместе с другим терапевтически активным агентом. Так, например, соединения данного изобретения могут использоваться в сочетании с 18 одним или несколькими другими антифунгицидными агентами, такими как полиеновое производное, например, (амфотерицин В,нистатин, жидкий состав амфотерицина В),азольное производное, например, (флюконазол,интраконазол, кетоконазол, миконазол, клотримазол, ZD-08070, UК-109496, SCH 56592), 5 фторцитозиновое, пневмокандиновое или эхинокандиновое производное, такое как цилофунгин, LY-303366, L-733560, L-743872, или другое, активное по отношению к клеточной стенке соединение, такое как никомицин Z, и/или одним или несколькими иммуномодулирующими агентами, такими как интерферон, например,(IFN-), интерлейкин, например, (IL-1, IL-2, IL-3 и IL-8), факторы, стимулирующие рост колонии,[(G)-CSF, (M)-CSF и (GM)-CSF] и защитные агенты. Особенно преимущественные соединения для применения вместе с соединениями данного изобретения включают интраконазол,флюцитозин, флюконазол или амфотерицин В. Если соединения данного изобретения вводят в сочетании с другим антифунгицидным агентом, то соединения данного изобретения и другой фунгицидный агент могут быть введены в рекомендуемой максимальной клинической дозе или в меньшей дозе. Сочетания, относящиеся к вышеприведенным, могут быть подходящим образом представлены для применения в виде фармацевтической композиции, и, таким образом, фармацевтические композиции, включающие определенное выше сочетание вместе с его фармацевтически приемлемым носителем, составляют следующий объем изобретения. Индивидуальные компоненты таких сочетаний могут быть введены последовательно или одновременно в раздельных или объединенных фармацевтических композициях. Если соединение данного изобретения используют в сочетании со вторым терапевтическим агентом, направленным против того же состояния, то доза каждого соединения может отличаться от дозы, рекомендованной для индивидуального соединения. Соответствующие дозы могут быть легко оценены специалистом в данной области. Агрохимические композиции. Соединения формулы I могут использоваться или в неизмененном виде, или предпочтительно вместе с адъювантами, традиционно использующимися для агрохимических композиций и представляющими собой для этой цели формы, в основном известные как эмульгируемые концентраты,покрываемые пасты, растворы, которые могут непосредственно распыляться или разбавляться,разбавленный раствор, суспензии (включающие высокопроцентные водные, масляные или другие суспензии), дисперсии, масляные дисперсии, распространяющие агенты, смачиваемые порошки, растворимые порошки, дусты, гранулы и капсулированные средства. Композиции 19 получают известным способом, например, путем гомогенного смешивания и/или перемалывания активных ингредиентов с наполнителями,например, растворителями, твердыми носителями, и, при необходимости, с поверхностноактивными веществами (ПАВ). Порошки, дусты и распространяющие агенты могут быть получены путем смешивания или перемалывания активных ингредиентов с твердым носителем. Гранулы, например, покрытые, пропитанные или гомогенные гранулы, могут быть получены путем связывания активных ингредиентов с твердыми носителями. Подходящими растворителями являются ароматические углеводороды, предпочтительно фракции, содержащие от 8 до 12 атомов углерода, такие как ксилоловые смеси или замещенные нафталины, хлорированные ароматические соединения, такие как хлорбензолы, фталаты, такие как дибутиловые или диоктиловые фталаты,алифатические углеводороды, такие как циклогексан или парафины, спирты и гликоли и их сложные и простые эфиры, такие как этанол,этиленгликоль, монометиловый или моноэтиловый эфир этиленгликоля, кетоны, такие как циклогексанон, амины, такие как этаноламин,сильнополярные растворители, такие как Nметил-2-пирролидон, диметилсульфоксид или диметилформамид, и растительные масла или эпоксидированные растительные масла, такие как эпоксидированное кокосовое масло или соевое масло; и вода. Примерами поверхностно-активных веществ являются соли щелочных металлов, щелочно-земельных металлов и аммония и ароматических сульфоновых кислот, например, лигнинсульфоновой кислоты, фенолсульфоновой кислоты, нафталинсульфоновой кислоты и дибутилнафталинсульфоновой кислоты, жирных кислот, алкил- и алкиларилсульфонаты, и сульфаты алкила, лаурилового эфира и жирного спирта и соли сульфатированных гексадеканолов, гептадеканолов и октадеканолов, соли гликолевых эфиров жирных спиртов, продукты конденсации сульфонированного нафталина и нафталиновых производных с формальдегидом,продукты конденсации нафталина или нафталинсульфоновых кислот с фенолом и формальдегидом, полиоксиэтиленоктилфеноловые эфиры, этоксилированный изооктилфенол, этоксилированный октилфенол и этоксилированный нонилфенол, алкилфенолполигликолевые эфиры, трибутилфенилполигликолевые эфиры, алкиларильные полиэфирные спирты, изотридециловый спирт, конденсата жирных спиртов с этиленоксидом, этоксилированное касторовое масло, алкиловые эфиры полиоксиэтилена,этоксилированный полиоксипропилен, ацеталь эфира лаурилового спирта и полигликоля,сложные эфиры сорбита, лигнин-сульфитные стоки метилцеллюлоза. 20 Примерами твердых носителей являются минеральные земли, такие как кремневые кислоты, силикагели, силикаты, тальк, каолин,глина attapulgus, известняк, известь, мел, железистая известковая глина, лесс, глина, доломит,диатомовая земля, сульфат алюминия, кальция,сульфат магния, оксид магния, измельченные пластики, удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония и мочевины, и растительные продукты, такие как мука зерновых, мелкоизмельченная кора, мелкоизмельченная древесина, мелкоизмельченная скорлупа орехов, целлюлозные порошки и т.д. Соединения формулы I могут смешиваться и наноситься вместе с другими активными ингредиентами, например, гербицидами, инсектицидами, бактерицидами, нематоцидами, моллюскицидами, регуляторами роста, микроэлементами и удобрениями. Другими ингредиентами могут также быть один или несколько фунгицидов, принадлежащих к следующим классам фунгицидов, но не ограничиваясь ими, карбоксамиды, бензимидазолы, триазолы, гидроксипиридины, дикарбоксамиды, фениламиды, тиадиазолы, карбаматы, цианооксимы, производные коричной кислоты, морфолины, имидазолы, Вметоксиакрилаты и пиридины/пиримидины. Кроме того, эти дополнительные активные ингредиенты могут использоваться в виде смесей нескольких препаратов, при желании вместе с другими способствующими нанесению адъювантами, обычно применяемыми в области приготовления композиций. Подходящие носители и адъюванты могут быть в твердом или жидком состоянии и принадлежать к веществам, обычно используемым в технологии приготовления композиций (т.е. природные или регенерированные минеральные вещества, растворители,дисперганты и увлажняющие агенты). Следующий список фунгицидов, с которыми соединения формулы I могут быть объединены, предназначен для иллюстрации возможных комбинаций, но не предполагает какихлибо ограничений. Примерами фунгицидов,которые могут быть объединены с соединениями формулы I являются сера, дитиокарбаматы и их производные, такие как диметилдитиокарбамат железа (III), диметилдитиокарбамат цинка,этиленбисдитиокарбамат цинка, этиленбисдитиокарбамат марганца, этилендиаминбисдитиокарбамат марганца, цинка, тетраметилтиурама дисульфиды, комплекс аммиака с N,N'этиленбисдитиокарбаматом цинка, комплекс аммиака с N,N'-пропиленбисдитиокарбаматом цинка, N,N'-пропиленбисдитиокарбамат цинка и(3,5-дихлорфенил)-1-изопропилкарбамилгидантоин, N-(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2-дикарбоксимид, 2-циано-[N-(этиламинокарбонил)-2-метоксимино]ацетамид, 1-[2(2,4-дихлорфенил)пентил]-1H-1,2,4-триазол, 2,4 дифтор-а-(1H-1,2,4-триазол-1-илметил)бензгидриловый спирт,N-(3-хлор-2,6-динитро-4 трифторметилфенил)-5-трифторметил-3-хлор-2 аминопиридин, и 1-бис-(4-фторфенил)метилсилил)метил)-1 Н-1,2,4-триазол. Как и природу композиций, способ нанесения, такой как опрыскивание, распыление,обработка дустом, разбрасывание, нанесение покровного слоя, удобрение и заливка, выбирают в соответствии с поставленными целями нанесения и существующими обстоятельствами. Одним из способов нанесения активного ингредиента или агрохимической композиции, содержащей, по меньшей мере, одно из заявленных соединений, является нанесение на растения (т.е. нанесение на листья). Однако активный ингредиент может также проникать в растение через корни из почвы (т.е. нанесение в почву). Нанесение может осуществляться как нанесение жидкости на почву (промачивание) или нанесение гранул. Активный ингредиент может быть также нанесен на растительный посевной материал,такой как семена (плоды, клубни или зерно) или черенки растений, либо в жидкой форме (нанесение покровного слоя), либо в твердой форме(удобрения). К семенам, например, удобрения можно добавить перед посевом. Соединения данного изобретения могут также наноситься на зерна либо путем пропитки зерен жидкой композицией, либо путем покрытия их твердой композицией. Композиция также может быть внесена в локус выращивания при посадке посевного материала, например, в бороздку для семян во время посева. Преимущественные нормы нанесения обычно составляют от 10 г до 50 кг активного ингредиента (а.и.) на гектар, предпочтительно от 100 г до 2 кг а.и./га, наиболее предпочтительно от 100 до 600 г а.и./га. Активные ингредиенты заявленных соединений обычно используют в виде композиций, и могут быть нанесены на растения, или на части растений, одновременно или последовательно с дополнительными активными ингредиентами. Этими дополнительными активными ингредиентами могут быть удобрения, добавочные микроэлементы, или другие соединения, воздействующие на рост растений. Они могут, однако, также являться селективными гербицидами, инсектицидами,бактерицидами, нематоцидами, инсектицидами,и моллюскицидами, а также другими фунгицидами. 23 Получение исходного вещества Ферментационное получение сордарина Следующие среды используют для ферментации Rosellinia subiculata (ATCC 74386) и АТСС 74387 при получении сордарина. Питательная среда 1. Компонент г/л Дрожжевой экстракт 4,0 Солодовый экстракт 8,0 Глюкоза 4,0 Джунлон 1,5 Среду готовят на дистиллированной воде,рН доводят до 7,0 перед стерилизацией и распределяют в объеме 50 мл в 250 мл колбе Эрленмейера без перегородки. Используют ватные затычки. Стерилизацию проводят при 121 С в течение 20 мин. Питательная среда 2. Компонент г/л Экстракт кукурузной жидкости (высушенный) 2,5 Томатная паста 40,0 Овсяная мука 10,0 Глюкоза 10,0 Раствор следовых элементов 10,0 мл/л Раствор следовых элементов Компонент г/л 1,0ZnSO47 Н 2 О Следовые элементы готовят в 0,6N HCl Среду готовят на дистиллированной воде,рН доводят до 6,8 перед стерилизацией и распределяют в объеме 50 мл в 250 мл колбе Эрленмейера без перегородки. Используют ватные затычки. Стерилизацию проводят при 121 С в течение 20 мин. Твердая среда для получения 1. 1. Твердая часть. Добавляют 675 см 2 вермикулита в 2 литровую бутыль круглого сечения. Закрывают латексной затычкой; автоклавируют в течение 60 мин, плюс 30 мин сушат. 2. Жидкая часть. В колбу объемом 500 мл добавляют 220 мл следующего состава: Компонент г/л Глюкоза 150,0 Глицерин 20,0 Дрожжевой экстракт 4,0 Среду готовят на дистиллированной воде,рН доводят до 7,0 перед стерилизацией. Глюкозу автоклавируют отдельно. Ее распределяют в 500 мл бутыли и автоклавируют при 121 С в течение 15 мин. Жидкая среда для получения 1. Компонент г/л Глюкоза 75,0 Глицерин 75,0 Томатная паста 5,0ZnSO47H2O 10,0 СаСО 3 Среду готовят на дистиллированной воде,рН доводят до 7,0 перед стерилизацией. Среду распределяют в объеме 50 мл в 250 мл колбе Эрленмейера без перегородки. Колбы закрывают ватой и автоклавируют при 121 С в течение 20 мин. Твердая среда для получения 1. 1. Твердая часть. Добавляют 675 см 2 вермикулита в 2 литровую бутыль круглого сечения. Закрывают латексной затычкой; автоклавируют в течение 60 мин плюс 30 мин сушат. Компонент г/л Сахароза 60,0 Глюкоза 80,0 Глицерин 60,0 Лимонная кислота 15,0HCl (концентрированная) 2,0 мл/л Среду готовят на дистиллированной воде,рН доводят до 7,0 перед стерилизацией. Ее распределяют в объеме 220 мл в 500 мл бутыли и автоклавируют при 121 С в течение 15 мин. Жидкая среда для получения 2. Состав является таким же, как жидкая часть твердой среды для получения 1. Среду получают на дистиллированной воде, рН доводят до 7,0 перед стерилизацией. Глюкозу автоклавируют отдельно. Среду распределяют в объеме 50 мл в 250 мл колбе Эрленмейера без перегородки. Колбы закрывают ватой и автоклавируют при 121 С в течение 15 мин. Получение сордарина ферментациейRosellina subiculata (MF6239, AТСС 74386) 1. Культура. Часть косячка агара, содержащую культуру, в стерильных условиях переносят на питательную среду 1 (50 мл/250 мл колбы без перегородки). Инкубируют на 2 дюймовом встряхивателе с вращением, 220 об./мин в течение 5 дней при 25 С, 85% относительной влажности (о.в.), получая биомассу. Части биомассы переносят в стерильные ампулы, содержащие глицерин и замораживают (как замороженный вегетативный мицелий (FVM. Их хранят при конечной концентрации глицерина 10-15% при -75 С. Вторичные FVM получают из первичных FVM путем переноса 1,0 мл оттаявшего первичного FVM в питательную среду 2, инкубируя 7 дней при 25 С, 220 об./мин и замораживают, как описано выше. 2. Посевной материал. Замороженные ампулы (FVM) с MF6239 оттаивают до комнатной температуры и используют для инокулирования посевных культур, 1,0 мл на 50 мл питательной среды 2. Их выращивают на встряхивателе с вращением (220 об./мин) в течение 7 дней при 25 С, 85% о.в. 3. Производство. На твердой среде для получения. Аликвоту (10-12 мл) посевного материала помещают в 220 мл жидкой части твердой среды для получения 1. Эту колбу энергично перемешивают для распределения биомассы. Содержимое распределяют путем выливания в 2 л сосуд для культивирования клеток с круглым сечением, который содержит 675 см 3 вермикулита с большими частицами. Содержимое бутыли с круглым сечением встряхивают/ перемешивают для обеспечения гомогенной инокуляции и охвата. Бутыли с круглым сечением инкубируют горизонтально, вращая приблизительно при 4 об./мин на вращающем аппарате Wheaton, при 22 С, 70% о.в. в течение 17 дней, получая вторичный метаболит в ферментационной среде. 26 В жидкой среде для получения. Посевные культуры инокулируют, как описано выше. Аликвоту посевного материала (1,5 мл) используют для инокулирования каждой колбы для получения, содержащей 50 мл жидкой среды для получения 1 в 250 мл колбе. Колбы инкубируют на встряхивателе с вращением (220 об./мин) в течение 7-21 дней при 25 С, 50-85% о.в. Получение сордарина ферментацией МР 6232(АТСС 74387) 1. Культура. Часть косячка агара, содержащую MF6232, в стерильных условиях переносят на питательную среду 1 (50 мл/250 мл колбы без перегородки). Инкубируют на 2 дюймовом встряхивателе с вращением, 220 об./мин в течение 5 дней при 25 С, 85% относительной влажности (о.в.), получая биомассу. Части биомассы переносят в стерильные ампулы, содержащие глицерин и замораживают (какFVM). Их хранят при конечной концентрации глицерина 10-15% при -75 С. Вторичные FVM получают из первичных FVM путем переноса 1,0 мл оттаявшего первичного FVM в питательную среду 2 (состав, приведенный ниже), инкубируя 7 дней при 25 С, 220 об./мин и замораживают, как описано выше. 2. Посевной материал. Замороженные ампулы (FVM) с MF6232 оттаивают до комнатной температуры и используют для инокулирования посевных культур, 1,0 мл на 50 мл питательной среды 2. Их выращивают на встряхивателе с вращением (220 об./мин) в течение 7 дней при 25 С, 85% о.в. 3. Производство. На твердой среде для получения. Аликвоту (10-12 мл) посевного материала помещают в 220 мл твердой среды для получения 1. Энергично перемешивают для распределения биомассы. Содержимое распределяют путем выливания в 2 л сосуд для культивирования клеток с круглым сечением, который содержит 675 см 3 вермикулита с большими частицами. Содержимое бутыли с круглым сечением встряхивают/перемешивают для обеспечения гомогенной инокуляции и охвата. Бутыли с круглым сечением инкубируют горизонтально, вращая приблизительно при 4 об./мин на вращающем аппарате Wheaton, при 22 С, 70% о.в. в течение 21 дня, получая вторичный метаболит в ферментационной среде. В жидкой среде для получения. Посевные культуры инокулируют, как описано выше. Аликвоту посевного материала (1,5 мл) используют для инокулирования каждой колбы для получения, содержащей 50 мл жидкой среды для получения 2 в 250 мл колбе. Колбы инкубируют на встряхивателе с вращением (220 об./мин) в течение 7-21 дней при 25 С, 50-85% о.в. 27 Крупномасштабное получение сордарина с использованием MF6232 (АТСС 74387) Жидкую часть твердой среды для получения 1 используют как для ферментеров для посева, так и для производственных ферментеров. Количество церелозы, которую добавляют после стерилизации, в среду ферментера для посева составляет 30 г/л, тогда как добавляемое в среду производственного ферментера количество составляет 150 г/л. В ферментер для посева вносят 2 л культуры, выращенной в колбах при перемешивании. Рост в этих ферментерах происходит при 25 С в течение 30 ч до тех пор, пока скорость потребления кислорода не составит 3 ммоль/л/ч. Через 30 ч 25 л культуры ферментера для посева переносят в производственный ферментер. Рост в производственном ферментере достигает 8-10 ммоль/л/ч через 50 ч и уменьшается до величины, находящейся между 5-7, к концу культивации. Растворенный кислород контролируется усилением перемешивания. рН питательной среды не контролируется и обычно уменьшается до 5,3 через 200 ч. Температура составляет 25 С. После 280 ч роста ферментацию останавливают и начинают приготовления к выделению. рН доводят приблизительно до 12 с помощью гидроксида натрия и содержимое выдерживают в течение 20 ч при температуре ферментации. Затем рН доводят до 6,0 с помощью серной кислоты, после чего переносят в барабан для дальнейших процедур. Выделение сордарина Выделение I. Метилэтил кетоновый экстракт ферментации культуры MF6232 (АТСС 74387), соответствующий 64 мл цельной питательной среды,концентрируют досуха в вакууме (365 мг). Это вещество растворяют в 2 частях метанола и 98 частях метиленхлорида до конечного объема 4,6 мл. Порцию объемом 4,3 мл (341 мг) вносят в 60 мл колонку с силикагелем 60 (0,040-0,0630 мм,230-400 меш,Е.Merck) для флэшхроматографии, уравновешенную 2 процентным метанолом в метиленхлориде. Колонку элюируют ступенчатым градиентом 2-, 5-, 10- и 30 процентным метанолом в метиленхлориде, 240 мл каждый, затем 120 мл метанола. Собирают шестнадцать фракций объемом 15 мл, соответствующих каждой системе растворителей. Фракции 39-56, обогащенные продуктом, подвергают биологическим тестам. Неочищенные объединенные фракции концентрируют досуха в вакууме (103,1 мг). Порцию этого образца 34,4 мг далее очищают с помощью разделительной ВЭЖХ (Zorbax RxC8, 5 мкм, 9,4 мм 250 мм, элюируя подвижной фазой, состоящей из смеси 20% ацетонитрил/ 80% водн. раствор 0,01 М К 2 НРO4, с рН, доведенным до 6,9 концентрированной Н 3 РO4, со скоростью потока 4 мл/мин, при 40 С, детекти 002644 28 рование с диодным выпрямлением). Собирают четырехмиллилитровые фракции. Фракции 1620, обогащенные продуктом, объединяют и концентрируют в вакууме приблизительно до 25% от начального объема. Концентрат дважды экстрагируют равными объемами этилацетата и этилацетатные слои промывают равным объемом насыщенного солевого раствора, сушат над безводным Na2SO4 и концентрируют в вакууме,получая 3,7 мг сордарина. Выделение II. Метилэтил кетоновый экстракт партии-004Y ферментации культуры MF6232 (АТСС 74387), соответствующий 980 мл цельной питательной среды, концентрируют досуха в вакууме (4,9 г). Этот продукт растворяют в 1 части метанола и 9 частях метиленхлорида до конечного объема 21,5 мл. Порцию объемом 21 мл(4,8 мг) вносят в 500 мл хроматографическую колонку с силикагелем 60 (0,040-0,0630 мм, 230400 меш, Е. Merck), уравновешенную 2 процентным метанолом в метиленхлориде. Колонку элюируют со скоростью потока 25 мл/мин ступенчатым градиентом 2- и 5-процентным метанолом в метиленхлориде, начиная с 1 л каждого, затем 2 л 15-процентного метанола. Элюирование колонки завершают 30- и 100 процентным метанолом, по 1 л каждого. Собирают двадцатипятимиллилитровые фракции. Фракции 75-85 и 111-121, обогащенные продуктом, подвергают биологическим тестам, и фракции, содержащие соединение I, подвергают обращенно-фазовой ВЭЖХ в кислых условиях. Неочищенные объединенные фракции 7585 и 111-121 отдельно концентрируют досуха в вакууме (69,3 и 95,3 мг соответственно). Две порции фракций 75-85 величиной 34 мг далее очищают с помощью двух идентичных разделительных ВЭЖХ (Zorbax Rx-C8, 7 мкм, 21,2 мм 250 мм, элюируя подвижной фазой, состоящей из смеси 40% ацетонитрил/60% Н 2 О с 0,1% Н 3 РO4, общей, со скоростью потока 20 мл/мин при 25 С, 220 нм). Собирают десятимиллилитровые фракции. Фракции 27-31, обогащенные продуктом, из обоих порций объединяют вместе и концентрируют в вакууме приблизительно до сорока процентов от начального объема. Концентрат экстрагируют равным объемом этилацетата и промывают равным объемом насыщенного солевого раствора, сушат над безводным Na2SO4 и концентрируют в вакууме, получая 27 мг сордарина. Две порции по 46 мг пула 111-121 также далее очищают в идентичных условиях ВЭЖХ, описанных выше. Фракции 2528 обоих порций объединяют и обрабатывают,как описано выше, получая дополнительно 17 мг сордарина. Получение бензилового эфира сордарицина Сордарин (2 мг) растворяют в 1 мл ацетона. Добавляют концентрированную НСl (0,2 мл). Смесь перемешивают при комнатной температуре в течение 1 дня. После разбавления 29 водой и экстракции водной фракции (СН 2 Сl2),органическую фракцию сушат над Na2SO4,фильтруют и концентрируют в вакууме. Смесь растворяют в 2 мл DMF, к ней добавляют 0,1 мл бензилбромида, затем избыток твердогоNаНСО 3. Смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют в вакууме. К смеси добавляют хлороформ,фильтруют для удаления NaHCO3. Фильтрат концентрируют в вакууме и очищают с помощью препаративной тонкослойной хроматографии (ПТСХ), получая 1,0 мг бензилового эфира сордарицина. 1(1 Н, д, J = 11,0), 5,11 (1 Н, д, J = 11,7), 5,31 (1 Н,д, J= 11,7), 6,04 (1 Н, д, J = 2,1), 7,31-7,40 (5 Н, м),9,62 (1 Н, с). Получение п-метоксибензилового эфира сордарицина Используют методику, подобную методике получения бензилового эфира сордарицина, с использованием 4-метоксибензилхлорида вместо бензилбромида. 1(1H, д, J = 11,7), 6,03 (1H, д, J = 3,2), 6,88 (2 Н, д,J = 8,7), 7,28 (2 Н, д, J = 8,7), 9,60 (1H, с). Получение аллилового эфира сордарицина Используют методику, подобную методике получения бензилового эфира сордарицина, с использованием аллилбромида вместо бензилбромида. Таким образом может быть получено указанное в заголовке соединение. Получение сордарицина К раствору бензилового эфира сордарицина в (МеОН) (0,6 мг) добавляют катализатор Перлмана. Смесь перемешивают в атмосфере водорода (баллон под давлением) в течение 15 мин. После фильтрации через вату и концентрации в вакууме получают 0,4 мг сордарицина. 1(1H, д, J = 11,0), 6,05 (1H, д, J = 3,0), 9,75 (1H, с). Следующие примеры предоставляют более полную иллюстрацию изобретения и не должны быть истолкованы как ограничивающие какимлибо образом объем данного изобретения. Пример 1. Бензил[1R-(1,3a,4,4a,7,7a,8a)]8a-(гидроксиметил)-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)1,4-метано-s-индацен-3a(1 Н)-карбоксилат. 30 бромида, затем 200 мг гидрида натрия (60% дисперсия в минеральном масле). Смесь перемешивают в течение ночи при комнатной температуре. После обработки водной фракции (диэтиловым эфиром) и очистки с помощью ПТСХ получают бензиловый эфир 2',3'-ди-O-бензилсордарина. Раствор бензилового эфира 2',3'-диO-бензилсордарина (1 эквивалент) получают в смеси этанол/пиридин (2:1). К смеси добавляют избыток гидрохлорида гидроксиламина и нагревают до 70 С при перемешивании в течении 2 ч. Смесь концентрируют в вакууме, проводят обработку водной фазы (дихлорметаном). Очищение с помощью ПТСХ дает бензиловый эфир 2',3'-ди-O-бензил-4-альдоксимсордарина. К раствору бензилового эфира 2',3'-ди-Oбензил-4-альдоксимсордарина в толуоле добавляют избыток внутренней соли гидроксида (метоксикарбонилсульфамоил)триэтиламмония(реагент Берджеса). Смесь перемешивают в атмосфере азота при 70 С в течение 2 ч. После концентрации в вакууме и очистки с помощью ПТСХ получают бензиловый эфир 2',3'-ди-Oбензил-4-циано-4-деформилсордарина. Готовят раствор бензилового эфира 2',3'ди-O-бензил-4-циано-4-деформилсордарина в ацетоне. Добавляют концентрированную хлористо-водородную кислоту (20 об.% ацетона) и смесь перемешивают при комнатной температуре в течение приблизительно дня или пока реакция, в основном, не завершится, о чем делают заключение по данным аналитической хроматографии. После разбавления водой и обработки водной фазы (дихлорметаном), органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очистка методом ПТСХ дает указанное в заголовке соединение.(Способ В). Бензиловый эфир сордарицина (161,2 мг) растворяют в 6 мл N,N-диметилформамида, добавляют п-метоксибензилхлорид (1 мл) затем избыток гидрида натрия (50 мг 60% дисперсии в минеральном масле). Смесь перемешивают в течение ночи. Смесь разбавляют простым эфиром и тщательно промывают водой. Эфирный слой сушат над безводным сульфатом натрия и летучие вещества удаляют в вакууме. Остаток очищают методом хроматографии на силикагеле, получая 192,5 мг (93%) п-метоксибензилового эфира. Полученный выше эфир (150 мг) растворяют в 5 мл сухого этанола и добавляют 3 мл сухого пиридина. Добавляют гидрохлорид гидроксиламина (96 мг) и смесь и нагревают до 70 С в течение 3 ч. Реакционную смесь охлаждают и концентрируют в вакууме. Остаток растворяют в эфире, промывают водой, сушат над безводным сульфатом натрия. Остаток, полученный после удаления эфира в вакууме, очищают методом ПТСХ, получая 143,4 мг целевого альдоксима (93%). 31 Оксим (143 мг) растворяют в 5 мл толуола и добавляют избыток внутренней соли гидроксида (метоксикарбонилсульфамоил)триэтиламмония (700 мг). Смесь перемешивают при 70 С в течение 2 ч. После концентрации в вакууме остаток очищают путем ПТСХ, получая 116,6 мг целевого нитрила (84%). Нитрил, полученный выше (67,5 мг), растворяют в 5 мл дихлорметана, добавляют DDQ(43 мг) и 0,5 мл воды. Смесь перемешивают при комнатной температуре в течение 2 ч. После обработки водной фазы и очистки методом ПТСХ получают 47,6 мг (91%) указанного в заголовке соединения. Пример 2.(DMAP) добавляют и смесь перемешивают при комнатной температуре в течение приблизительно 60 мин. После концентрации в вакууме и очистки методом ПТСХ, получают бензиловый эфир указанного в заголовке соединения. Бензиловый эфир соединения растворяют в 1 мл МеОН, добавляют катализатор Перлмана. Смесь перемешивают в атмосфере водорода(баллон под давлением) в течение 15 мин. После фильтрации через вату и концентрации в вакууме получают указанное в заголовке соединение. Пример 3.[1R-(1,3a,4,4a,7,7 а,8a)]8a-[(ундеканоилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоновая кислота. К раствору ундекановой кислоты (30 мг) в тетрагидрофуране (ТГФ) добавляют триэтиламин (34 мкл), затем 2,4,6-трихлорбензоилхлорид(25 мкл). Смесь перемешивают при комнатной температуре в течение 15 мин. К этой смеси затем добавляют 4-циано-4-деформилсордарицина бензиловый эфир (1,0 мг) в 1 мл THF, после чего добавляют N,N-диметиламинопиридина (DMAP) (20 мг). Эту смесь перемешивают при комнатной температуре в течение приблизительно 1 ч. После очистки методом ПТСХ получают бензиловый эфир указанного в заголовке соединения. Этот ундеканоат растворяют в 1 мл МеОН, к этому раствору добавляют катализатор Перлмана. Смесь перемешивают в атмосфере водорода (баллон под давлением) в течение 15 мин. После фильтрации через вату и концентрации в вакууме получают указанное в заголовке соединение. Пример 4. [1R-(1,3a,4,4a,7,7a,8a)] 8a-[(пропаноилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. 32 К раствору бензилового эфира 4-циано-4 деформилсордарицина (0,5 мг) в дихлорметане добавляют триэтиламин (0,2 мл), затем пропионилхлорид (0,1 мл). Добавляют каталитическое количество DMAP. Смесь перемешивают при комнатной температуре в течение приблизительно 18 ч или до тех пор, пока реакция не завершится полностью, о чем делают заключение по данным аналитической хроматографии. После очистки методом ПТСХ получают бензиловый эфир указанного в заголовке соединения. Этот бензиловый эфир растворяют в 1 мл МеОН и добавляют катализатор Перлмана. Смесь перемешивают в атмосфере водорода (баллон под давлением) в течение приблизительно 15 мин. После фильтрации через вату и концентрации в вакууме получают указанное в заголовке соединение. Пример 5. [1R-(1,3 а,4,4 а,7,7 а,8 а)] 8 а-[(метоксикарбонилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоновая кислота. Повторяют методику примера 4, используя метилхлорформат вместо пропионилхлорида, с получением указанного в заголовке соединения. Пример 6. [1R-(1,3 а,4,4 а,7,7 а,8a)] 8 а-[(метоксикарбонилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. К раствору бензилового эфира 4-циано-4 деформилсордарицина (0,5 мг) в СНСl3 добавляют н-пропилизоцианат (0,1 мл) и каталитическое количество DMAP. Смесь кипятят с обратным холодильником в течение 4 ч. После концентрации в вакууме и очистки методом ПТСХ получают бензиловый эфир указанного в заголовке соединения. Это производное растворяют в 1 мл метанола и добавляют катализатор Перлмана. Эту смесь перемешивают в атмосфере водорода (баллон под давлением) в течение приблизительно 15 мин. После концентрации в вакууме и очистки методом ПТСХ получают указанное в заголовке соединение. Пример 7. [1R-(1,3 а,4,4 а,7,7 а,8 а)] 8 а-[(метоксиметокси)метил]-4-циано-4,4 а,5,6,7,7a,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. К раствору бензилового эфира 4-циано-4 деформилсордарицина (0,5 мг) в CH2Cl2 добавляют диизопропилэтиламин (0,2 мл), затем метоксиметилхлорид (МОМСl) (0,1 мл) при 0 С. Смесь перемешивают при комнатной температуре в течение приблизительно 18 ч. После концентрации в вакууме и очистки методом ПТСХ,получают бензиловый эфир указанного в заголовке соединения. Бензиловый эфир растворяют в МеОН и добавляют катализатор Перлмана. Эту смесь перемешивают в атмосфере водорода(баллон под давлением) до тех пор, пока удале 33 ние бензиловой группы не завершится, что определяют с помощью ТСХ. После концентрации в вакууме и очистки методом ПТСХ получают указанное в заголовке соединение. Пример 8. [1R-(1,3 а,4,4 а,7,7 а,8 а)] 8 а-[(метоксиэтокси)метокси)метил]-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 7, используя метоксиэтоксиметилхлорид вместо МОМСl, с получением указанного в заголовке соединения. Пример 9. [1R-(1,3a,4,4 а,7,7 а,8a)] 8a-[(октилоксиметокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 1, используя хлорметилоктиловый эфир вместо МОМСl, с получением указанного в заголовке соединения. Пример 10. [1R-(1,3a,4,4a,7,7a,8a)]8a-[(метокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. К раствору бензилового эфира сордарицина (30 мг) в N,N-диметилформамиде (3 мл) добавляют метилйодид (0,5 мл), затем гидрид натрия (100 мг, 60% дисперсия в минеральном масле). Смесь перемешивают в течение ночи при температуре окружающей среды. После обработки водной фазы (диэтиловым эфиром) и очистки методом ПТСХ, получают эфирное производное. К раствору эфирного производного, полученного выше (20 мг), в этаноле (3 мл) и пиридине (1,5 мл), добавляют гидрохлорид гидроксиламина (100 мг). Смесь нагревают до 80 С и перемешивают в течение 2 ч. После концентрации в вакууме, обработки водной фазы (дихлорметаном) и очистки методом ПТСХ получают альдоксимное производное. К раствору альдоксимного производного,полученного выше (15 мг), в толуоле (3 мл) добавляют внутреннюю соль гидроксида (метоксикарбонилсульфамоил)триэтиламмония (200 мг). Смесь перемешивают при 70 С в течение 2 ч. После концентрации в вакууме и очистки методом ПТСХ получают бензиловый эфир указанного в заголовке соединения. К раствору бензилового эфира, полученного выше (12 мг), в метаноле (2 мл) добавляют катализатор Перлмана (20 мг). Смесь перемешивают в атмосфере водорода (баллон под давлением) в течение 15 мин. После фильтрации через вату и концентрации в вакууме получают указанное в заголовке соединение. МС (ХИ): m/z=361(M+NH4) Пример 11. [1R-(1,3a,4,4 а,7,7a,8 а)]8 а-[(этокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. 34 Повторяют методику примера 10, используя этилиодид вместо метилиодида, с получением указанного в заголовке соединения. МС (ХИ): m/z =375 (M+NH4) Пример 12. [1R-(1,3a,4,4a,7,7a,8a)]8a-[(пропилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя аллилбромид вместо метилиодида, с получением указанного в заголовке соединения. МС (ХИ): m/z = 389 (M+NH4) Пример 13. [1R-(1,3 а,4,4 а,7,7a,8 а)]8 а-[(2-метилпропилокси)метил]-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя 2-бромметил-1-пропен вместо метилиодида,с получением указанного в заголовке соединения. МС (ХИ): m/z = 403 (M+NH4) Пример 14. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8 а-[(бутилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя 1-иодбутан вместо метилиодида, с получением указанного в заголовке соединения. МС (ХИ): m/z = 403 (M+NH4) Пример 15. [1R-(1,3a,4,4a,7,7a,8a)]8a-[(пентилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя 1-иодпентан вместо метилиодида, с получением указанного в заголовке соединения. МС (ХИ): m/z =417 (M+NH4) Пример 16. [1R-(1,3 а,4,4a,7,7 а,8 а)]8a-[(гексилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя 1-иодгексан вместо метилиодида, с получением указанного в заголовке соединения. МС (ХИ): m/z = 431 (M+NH4) Пример 17. [1R-(1,3a,4,4a,7,7 а,8 а)]8a-[(S-2-гидроксипропилокси)метил]-4 циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1 метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя бензолсульфонат (R)-глицидола вместо метилиодида, с получением указанного в заголовке соединения. Пример 18. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8a-[(R-2-гидроксипропилокси)метил]-4 циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1 метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоновая кислота. 35 Повторяют методику примера 10, используя бензолсульфонат (8)-глицидола вместо метилиодида, с получением указанного в заголовке соединения. Пример 19. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8a-[н-гептилоксиметил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя гепт-2-ин-1-ол бензолсульфонат вместо метилиодида, с получением указанного в заголовке соединения. Пример 20. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8 а-[октилоксиметил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя окт-2-ин-1-ол бензолсульфонат вместо метилиодида, с получением указанного в заголовке соединения. Пример 21. [1R-(1,3a,4,4a,7,7a,8a)]8a-[нонилоксиметил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя нон-2-ин-1-ол бензол сульфонат вместо метилиодида, с получением указанного в заголовке соединения. Пример 22. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8a-[децилоксиметил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя дец-2-ин-1-ол бензолсульфонат вместо метилиодида, с получением указанного в заголовке соединения. Пример 23. [1R-(1,3 а,4,4 а,7,7a,8 а)]8 а-[3-метилбут-1-оксиметил]-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. По способу, полностью аналогичному способу примера 10, за исключением того, что вместо метилиодида используют 1-иод-3 метилбутан, получают указанное в заголовке соединение. МС (ХИ): m/z =417 (M+NH4) Пример 24. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8 а-[2-пропилоксиметил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 10, используя 2-иодпропан вместо метилиодида, с получением указанного в заголовке соединения. Пример 25. [1R-(1,3a,4,4a,7,7a,8a)]8a-[2-(тетрагидропиранилокси)метил]-4 циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1 метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоновая кислота. К раствору бензилового эфира 4-циано-4 деформилсордарицина (10 мг) в 3 мл дихлорме 002644 36 тана добавляют 3,4-дигидро-2 Н-пиран (50 мкл) и каталитическое количество PPTS. Смесь перемешивают при комнатной температуре в течение ночи. Добавляют триэтиламин (1 мл) и смесь концентрируют в вакууме. После очистки методом ПТСХ получают бензиловый эфир указанного в заголовке соединения. К метанольному раствору этого бензилового эфира добавляют катализатор Перлмана. Смесь перемешивают в атмосфере водорода (баллон под давлением) в течение приблизительно 15 мин. Смесь фильтруют через вату и фильтрат концентрируют в вакууме, получая указанное в заголовке соединение. Пример 26. [1R-(1,3a,4,4 а,7,7 а,8a)]8a-[(1-этоксиэтокси)метил]-4-циано-4,4 а,5,6,7,7a,8,8 а-октагидро-7-метил-3-(1-метилэтил)1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику получения соединения примера 25, используя этилвиниловый эфир вместо 3,4-дигидро-2 Н-пирана, с получением указанного в заголовке соединения. Пример 27. п-Метоксибензил[1R-(1,3 а,4,4 а,7,7 а,8a)]8a-(гидроксиметил)-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоксилат. Повторяют такую же методику, как и в примере 1, за исключением того, что вместо бензилбромида используют п-метоксибензилхлорид, получая указанное в заголовке соединение. Пример 28. [1R-(1,3 а,4,4 а,7,7 а,8 а)]8 а-[(бензилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. К раствору п-метоксибензилового эфира 4 циано-4-деформилсордарицина в N,N-димeтилфopмaмидe добавляют избыток бензилбромида и гидрида натрия. Смесь перемешивают при комнатной температуре в течение ночи. После обработки водной фазы (эфиром) и очистки методом ПТСХ, получают 4-метоксибензиловый эфир указанного в заголовке соединения. Этот эфир затем растворяют в избытке муравьиной кислоты. Смесь перемешивают при комнатной температуре в течение приблизительно 3 ч. После концентрации в вакууме и очистки методом ПТСХ, получают указанное в заголовке соединение. Пример 29. [1R-(1,3a,4,4a,7,7 а,8a)]8a-[(4-бромбензилокси)метил]-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 28, используя 4-бромбензилбромид вместо бензилбромида, с получением указанного в заголовке соединения. Пример 30. [1R-(1,3a,4,4a,7,7 а,8 а)]8a-[(1-бут-2-енилокси)метил]-4-циано 37 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. Повторяют методику примера 28, используя кротилхлорид вместо бензилбромида, с получением указанного в заголовке соединения. Пример 31. [1R-(1,3a,4,4a,7,7a,8a)]8a-[(1-пент-2-енилокси)метил]-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3а(1 Н)-карбоновая кислота. Повторяют методику примера 28, используя транс-1-бром-2-пентен вместо бензилбромида, с получением указанного в заголовке соединения. Пример 32. [1R-(1,3a,4,4a,7,7a,8a)]8a-[(изобутенилокси)метил]-4-циано 4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4-метано-s-индацен-3 а(1 Н)-карбоновая кислота. Повторяют методику примера 28, используя 4-бромбензилбромид вместо бензилбромида, с получением указанного в заголовке соединения. Примеры 33-51. С помощью методики примера 4 могут быть получены следующие эфиры: Ацилирующий агент СН 3(СН 2)2 СОСl СH3 (СН 2)3 СОСl СH3(СH2)4 СОСl СH3(СН 2)5 СОСl СH3(СH2)6 СОСl СH3 (СН 2)7 СОСl СH3(СH2)8 СОСl Примеры 52-55. К раствору пметоксибензилового эфира 4-циано-4-деформилсордарина (0,5 мг) в дихлорметане добавляют NEt3 (0,2 мл), затем хлорангидрид соответствующей кислоты (10-100 мг). Добавляют каталитическое количество DMAP. Смесь перемешивают при комнатной температуре в течение ночи. После очистки методом ПТСХ получают п-метоксибензиловый эфир следующих продуктов. Этот эфир затем растворяют в избытке му 38 равьиной кислоты. Смесь перемешивают при комнатной температуре в течение 3 ч или времени, достаточного для удаления защитной группы. После концентрации в вакууме и очистки методом ПТСХ получают следующие продукты. Продукт (R) СH2=СНСОСH2=СН(СH2)2 СО(СH3)2 С=СНСОп-СlС 6 Н 4 СО Примеры 56-68. По методике примера 3 можно получить следующие эфиры: Ацилирующий агент циклогексанкарбоновая кислота циклопентанкарбоновая кислота циклобутанкарбоновая кислота п-СH3 С 6 Н 4 СO2 Н м-FС 6 Н 4 СO2 Н 4-бифенилкарбоновая кислота 3-бифенилкарбоновая кислота 4,4'-терфенилкарбоновая кислота 9-антраценкарбоновая кислота 2-пирролкарбоновая кислота Продукт (R) циклогексанкарбонил циклопентанкарбонил циклобутанкарбонил п-СH3 С 6 Н 4 СОм-FС 6 Н 4 СО 4-бифенилкарбонил 3-бифенилкарбонил 4,4'-терфенилкарбонил 9-антраценкарбонил 2-пирролкарбонил Примеры 69-71. К раствору кислот, перечисленных ниже (0,16 ммоль), в тетрагидрофуране добавляют триэтиламин (34 мкл), затем 2,4,6-трихлорбензоилхлорид (25 мкл). Смесь перемешивают при комнатной температуре в течение 15 мин. К этой смеси затем добавляют п-метоксибензиловый эфир 4-циано 4-деформилсордарина (1,0 мг) в 1 мл THF, затем добавляют DMAP (20 мг). Эту смесь перемешивают при комнатной температуре в течение приблизительно 1 ч. После очистки методом ПТСХ получают п-метоксибензиловый эфир следующего продукта. Эфир затем растворяют в избытке муравьиной кислоты. Смесь перемешивают при комнатной температуре в течение 3 ч или времени, достаточного для удаления защитной группы. После концентрации в вакууме и очистки методом ПТСХ получают следующие продукты. Примеры 72-82. По способу, аналогичному способу примера 5, могут быть получены следующие карбонаты: Ацилирующий агент этилхлорформат фенилхлорформат трет-бутилхлорформат циклопропилхлорформат н-бутилхлорформат(0,2 мл), затем хлорангидрид соответствующей кислоты (10-100 мг). Добавляют каталитическое количество N,N-диметиламинопиридина. Смесь перемешивают при температуре окружающей среды в течение приблизительно 18 ч. После очистки методом ПТСХ получают пметоксибензиловый эфир следующих продуктов. Этот эфир затем растворяют в избытке муравьиной кислоты. Смесь перемешивают при комнатной температуре в течение 3 ч или времени, достаточном для удаления защитной группы. После концентрации в вакууме и очистки методом ПТСХ получают следующие продукты. Ацилирующий агент бензилхлорформат п-метилбензилхлорформат 1-нафтилхлорформат 2-нафталинхлорформат аллилхлорформат кротилхлорформат СH2=СН(СH2)2OСОСl Продукт (R) бензилоксикарбонил п-метилбензилоксикарбонил 1-нафтилоксикарбонил 2-нафтоксикарбонил аллилоксикарбонил кротилоксикарбонил СH2=СН(СH2)2OСО Примеры 90-104. По способу, аналогичному способу примера 6, могут быть получены следующие карбаматы: Ацилирующий агент метилизоцианат фенилизоцианат трет-бутилизоцианат циклобутилизоцианат Пример 105-108. К раствору п-метоксибензилового эфира 4-циано-4-деформилсордарина (0,5 мг) СНСl3 добавляют соответствующий изоцианат (10-100 мг) и каталитическое количество DMAP. Смесь кипятят с обратным холодильником в течение 4 ч или до тех пор,пока реакция не перестанет протекать. После концентрации в вакууме и очистки методом ПТСХ получают п-метоксибензиловый эфир указанного в заголовке соединения. Эфир затем растворяют в избытке муравьиной кислоты. Смесь перемешивают при комнатной температуре в течение 3 ч или времени, достаточного для удаления защитной группы. После концентрации в вакууме и очистки методом ПТСХ получают указанное в заголовке соединение. Ацилирующий агент бензилизоцианат аллилизоцианат о-иодфенилизоцианат дибензиламинокарбонилхлорид Примеры 109-114. Следуя методике примера 28, можно получить следующие соединения: Пример 115. [1R-(1,3 а,4,4 а,7,7a,8a)]8 а-[(н-гептилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. По методике, подобной методике примера 10, используя 1-бензолсульфонилокси-2-гептин 41 вместо метилиодида, получают указанное в заголовке соединение. МС (ХИ): m/z = 445 (M+NH4) Пример 116. [1R-(1,3 а,4,4a,7,7 а,8 а)]8 а-[(н-октилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. По методике, подобной методике примера 10, используя 1-бензолсульфонилокси-2-октин вместо метилиодида, получают указанное в заголовке соединение. МС (ХИ): m/z = 459 (M+NH4) Пример 117. [1R-(1,3a,4,4a,7,7a,8a)]8a-[(н-нонилокси)метил]-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)1,4-метано-s-индацен-3a(1 Н)-карбоновая кислота. По методике, подобной методике примера 10, используя 1-бензолсульфонилокси-2-нонин вместо метилиодида, получают указанное в заголовке соединение. МС (ХИ): m/z = 473 (M+NH4) Пример 118.[1R-(1,3 а,4,4 а,7,7 а,8a)]8a-(гидроксиметил)-4-циано-4,4 а,5,6,7,7 а,8,8 а-октагидро-7-метил-3-(1-метилэтил)-1,4 метано-s-индацен-3a(1 Н)-карбоновая кислота. Бензиловый эфир 4-циано-4-деформилсордарицина из примера 1 (способ В) растворяют в 2 мл метанола и добавляют приблизительно 20 мг гигидроксида-палладия на угле (катализатор Перлмана). Смесь энергично перемешивают в атмосфере водорода в течение 15 мин. Реакционную смесь фильтруют через вату и фильтрат концентрируют в вакууме, получая 5,0 мг (94%) указанного в заголовке соединения. МС (ESI): m/z = 347 (M+NH4)z равно 0-6; или его фармацевтически приемлемая или приемлемая в сельском хозяйстве соль. 2. Соединение по п.1 формулы Iа или его фармацевтически приемлемая соль. 3. Соединение по п.2, где R представляет собой C(=O)OR1. 4. Соединение по п.2, где R представляет собой C(=O)NR2R3; или его фармацевтически приемлемая соль. 5. Соединение по п.2, где R представляет собой C(=O)R4; или его фармацевтически приемлемая соль. 6. Соединение по п.2, где R представляет собой CH(R2)OR5; или его фармацевтически приемлемая соль. 7. Соединение по п.2, где R представляет собой С(R6)(R7)(R8); или его фармацевтически приемлемая соль. 8. Соединение по п.2, где R представляет собой или его фармацевтически приемлемая соль. 9. Соединение по п.2, где R представляет собой CH(R6)(R7), R6 представляет собой(а) Н,(b) C1-C14 алкил,(c) арил,(d) арил C1-6 алкил,(e) -(СH2)yСН(ОН) (CH2)zH,(f) -(CH2)yC(R7)=CH(CH2)zH,R7 представляет собой Н или C1-6 алкил,R9 представляет собой ОН; или его фармацевтически приемлемая соль. 10. Соединение по п.2, где R представляет собой(b) -СH2 СH3,(c) -СH2 СH2 СH3,(d) -СH2 СH2 СH2 СH3,(e) -СH2 СH2 СH2 СH2 СH3,(f) -СH2 СH2 СH2 СH2 СH2 СH3,(g) -СH2 СH2 СH2 СH2 СH2 СH2 СH3,(h) -СH2 СH2 СH2 СH2 СH2 СH2 СH2 СH3,(i) -СH2 СH2 СH2 СH2 СH2 СH2 СH2 СH2 СH3,(j) -СH2 СH2 СН(СH3)2,(k) -СH2 С 6 Н 5,(l) -СН(СH3)2,(m) -СH2 СН(СH3)2,(n) -СH2 СН=СH2,(о) -СH2 СН=СНСH3,(p) -СH2 СН=СНСH2 СH3,(q) -СH2 СН=СНСH2 СH2 СH3; или его фармацевтически приемлемая соль. 11. Соединение по п.2, где R представляет собой(а) -СH3,(b) -СH2 СH3,(c) -СH2 СH2 СH3,(d) -СH2 СH2 СH2 СH3,(e) -СH2 СH2 СH2 СH2 СH3,(f) -СH2 СН(СH3)2,(g) -СH2 СH2 СН(СH3)2,(h) -СH2 СН=СНСH3,(i) -СH2 СН=СНСH2 СH3,(j) -СH2 СН=СНСH2 СH2 СH3; или его фармацевтически приемлемая соль. 12. Соединение по п.1, где R представляет собой Н; или его фармацевтически приемлемая соль. 13. Фармацевтическая композиция, которая включает соединение по п.1 и фармацевтически приемлемый носитель. 14. Агрохимическая композиция, которая включает соединение по п.1 и приемлемый в сельском хозяйстве носитель. 15. Способ лечения или профилактики грибковой инфекции у животных, который включает введение упомянутому животному антифунгицидно эффективного количества соединения по п.1. 16. Способ подавления фитопатогенных грибков, который включает обработку растения,нуждающегося в таком подавлении, антифунгицидно эффективным количеством соединения по п.1.
МПК / Метки
МПК: A61K 31/277, A01N 37/34, C07D 307/20, A61P 31/10
Метки: производные, 4-циано-4-деформилсордарицина
Код ссылки
<a href="https://eas.patents.su/23-2644-proizvodnye-4-ciano-4-deformilsordaricina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-циано-4-деформилсордарицина</a>
Предыдущий патент: Тартрат замещенного дипептида как средство, стимулирующее секрецию гормона роста
Следующий патент: Новые соединения 2,3-метаноаминокислоты, способ их получения и содержащие их фармацевтические композиции
Случайный патент: Турбулизатор












