Новые таксоиды,их получение и содержащие их фармацевтические композиции
Формула / Реферат
1. Новые таксоиды общей формулы
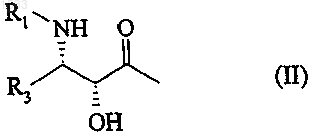
в которой Z обозначает радикал общей формулы

в которой R1 обозначает бензоильный радикал или радикал R2-О-СО-, в котором R2 представляет собой алкильный радикал с 1-8 атомами углерода и R3 обозначает фенил или a - или b -нафтил; и либо R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, либо R4 обозначает атом водорода или радикал алкокси с 1-6 атомами углерода в нормальной или разветвленной цепи; алкоксиацетил, в котором алкил содержит 1-6 атомов углерода в нормальной или разветвленной цепи; радикал карбамоилокси; алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода; или диалкилкарбамоилокси, каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода либо же R4 и R5 вместе образуют кетонную функцию, R6 обозначает атом водорода и R и R7 вместе образуют связь.
2. Новые промежуточные продукты формулы I'
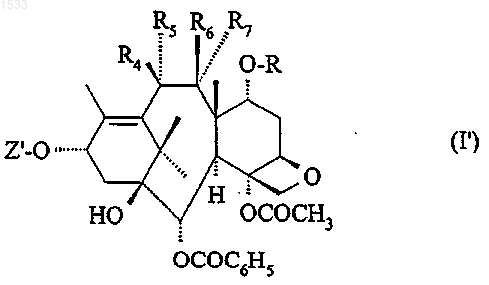
у которых Z' обозначает атом водорода и либо R4 обозначает атом водорода или радикал алкокси, содержащей 1-6 атомов углерода в нормальной или разветвленной цепи; алкоксиацетил, алкильная часть которого содержит 1-6 атомов углерода в нормальной или разветвленной цепи; радикал карбамоилокси; алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода; или диалкилкарбамоилокси, каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода либо R4 и R5 вместе образуют кетонную функцию, R6 обозначает атом водорода и R и R7 вместе образуют связь.
3. Способ получения продукта по п.1, у которого либо R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию, a R и R5 вместе образуют связь; либо R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что восстановительный агент вводят в реакцию с соединением общей формулы
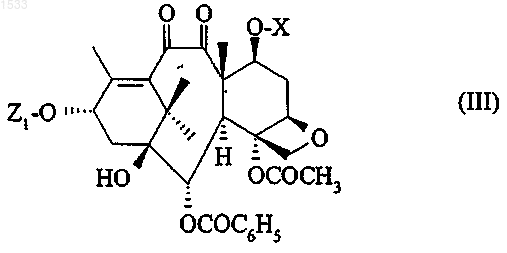
в которой Z1 обозначает радикал общей формулы

в которой R1 и R3 имеют значения, определенные в п.1, а R8 обозначает защитную группу для гидроксильной функции, Х вместе с атомом кислорода, с которым он связан, обозначает удаляемую группу, выбранную из числа следующих радикалов: алкилсульфонил с 1-4 атомами углерода, который может быть замещен одним или несколькими атомами галогена; арилсульфонил, арильная часть которого представляет собой фенил, который может быть замещен одним или несколькими одинаковыми или разными атомами или радикалами: атомами галогена, алкильными радикалами с 1-4 атомами углерода, нитро- или трифторметильной группами, с образованием соединения общей формулы
в которой Z1, R, R4, R5, R6 и R7 определены выше, в виде смеси соединения общей формулы I, в которой R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, и соединения общей формулы I, в которой R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, которые разделяют обычными способами, после чего R8 заменяют атомом водорода.
4. Способ по п.3, отличающийся тем, что восстанавливающий агент выбирают из алюмогидридов и борогидридов, таких как борогидриды щелочных или щелочно-земельных металлов, в присутствии алифатических спиртов с 1-4 атомами углерода, таких как этанол, проводя реакцию при температуре от 0 до 50шС.
5. Способ по п.3, отличающийся тем, что, когда защитной группой является силильный радикал, его заменяют атомом водорода с помощью минеральной кислоты в алифатическом спирте с 1-3 атомами углерода при температуре от -10 до 20шС или с помощью комплекса фтористоводородная кислота-триэтиламин, проводя реакцию в инертном органическом растворителе при температуре от 0 до 50шС.
6. Способ получения продукта по п.1, где R4 обозначает алкоксирадикал, содержащий 1-6 атомов углерода в нормальной или разветвленной цепи; алкоксиацетил, алкильная часть которого содержит 1-6 атомов углерода в нормальной или разветвленной цепи, или же R4 обозначает радикал карбамоилокси, алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода, или диалкилкарбамоилокси, каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что соединение общей формулы
R'4Y (IX)
в которой R'4 таково, что R'4-O- идентичен R4, определенному выше, a Y обозначает удаляемую группу, вводят в реакцию с соединением общей формулы
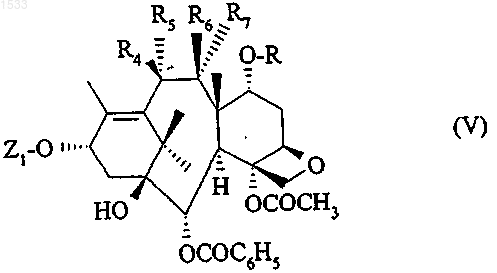
в которой Z1 определен выше, R4 обозначает гидроксильный радикал, R6 обозначает атом водорода, a R и R7 вместе образуют связь, после чего R8 заменяют атомом водорода в условиях по п.5.
7. Способ по п.6, отличающийся тем, что перед вводом в реакцию соединения общей формулы IX, гидроксильную функцию в положении 10 металлируют с помощью гидрида, амида или алкилпроизводного щелочного металла.
8. Способ получения продукта по п.1, в котором Z представляет собой радикал общей формулы (II), R4 и R5 вместе образуют кетонную функцию, R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что осуществляют окисление соединения общей формулы
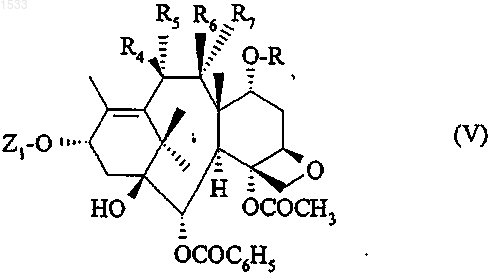
в которой Z1 такой, как определен в п.3, R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, после чего защитная группа может быть заменена атомом водорода в условиях по п.5.
9. Способ по п.8, отличающийся тем, что окисление проводят с помощью кислорода, перутената аммония, диоксида марганца, ацетата меди или хлорхромата пиридиния.
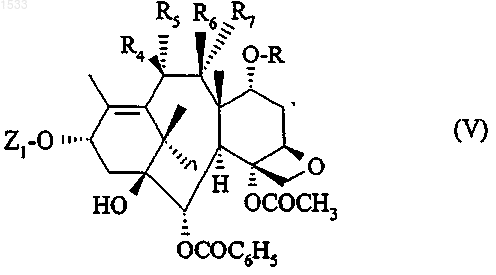
10. Способ получения продукта по п.1, где каждый из R4, R5 и R6 является атомом водорода, a R и R7 вместе образуют связь, который может быть получен из соединения общей формулы V, в которой Z1 такой, как он определен в п.1, R4 обозначает гидроксильный радикал, каждый из R5 и R6 обозначает атом водорода, a R и R7 вместе образуют связь, путем превращения гидроксильного радикала, обозначенного R4, в дитиокарбонат с последующим восстановлением полученного при этом продукта с помощью гидрида триалкилолова и, возможно, заменой защитной группы R8 атомом водорода в условиях по п.5.
11. Способ получения продукта по п.1, отличающийся тем, что продукт по п.2 этерифицируют кислотой общей формулы
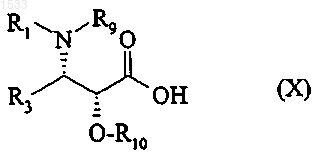
в которой либо R9 обозначает атом водорода, a R10 обозначает защитную группу для гидроксильной функции, лшсю R9 и R10 вместе образуют насыщенный пяти- или шестичленный гетероцикл, или производным этой кислоты с последующей заменой защитных групп атомами водорода в обычных условиях.
12. Способ получения продукта по п.2, в котором либо R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию, a R и R5 вместе образуют связь, либо R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что восстанавливающий агент вводят в реакцию с соединением общей формулы

в которой Z1 обозначает атом водорода или защитную группу для гидроксильной функции, а X вместе с атомом кислорода, с которым он связан, обозначает удаляемую группу, выбранную из числа следующих радикалов: алкилсульфонил с 1-4 атомами углерода, который может быть замещен одним или несколькими атомами галогена; арилсульфонил, арильная часть которого представляет собой фенил, который может быть замещен одним или несколькими одинаковыми или разными атомами или радикалами: атомами галогена, алкильными радикалами с 1-4 атомами углерода, нитро- или трифторметильной группами, с образованием соединения общей формулы
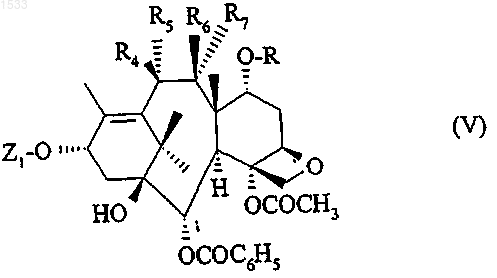
в которой Z1, R, R4, R5, R6 и R7 имеют значения, определенные выше, в виде смеси соединения общей формулы I', в которой R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, и соединения общей формулы I', в которой R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, которые разделяют обычными способами, после чего защитная группа Z1 может быть заменена атомом водорода.
13. Способ по п.12, отличающийся тем, что восстанавливающий агент выбирают из алюмогидридов и борогидридов, таких как борогидриды щелочных или щелочно-земельных металлов, в присутствии алифатических спиртов с 1-4 атомами углерода, таких как этанол, проводя реакцию при температуре от 0 до 50шС.
14. Способ по п.12, отличающийся тем, что когда защитной группой является силильный радикал, его заменяют атомом водорода с помощью минеральной кислоты в алифатическом спирте с 1-3 атомами углерода при температуре от -10 до 20шС или с помощью комплекса фтористоводородная кислота-триэтиламин, проводя реакцию в инертном органическом растворителе при температуре от 0 до 50шС.
15. Способ получения продукта по п.2, где R4 обозначает алкокси-радикал, содержащий 1-6 атомов углерода в нормальной или разветвленной цепи; алкоксиацетил, алкильная часть которого содержит 1-6 атомов углерода в нормальной или разветвленной цепи, или же R4 обозначает радикал карбамоилокси, алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода, или диалкилкарбамоилокси, каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода; R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что соединение общей формулы
R'4Y (IX)
в которой R'4 таково, что R'4-O- идентичен R4, определенному выше, a Y обозначает удаляемую группу, вводят в реакцию с соединением общей формулы
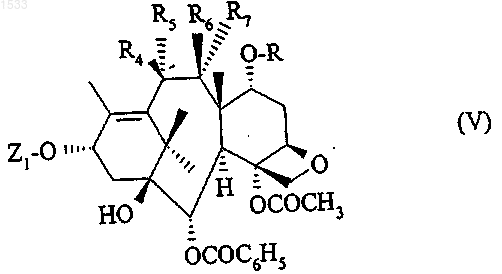
в которой Z1 такой, как он определен выше, R4 обозначает гидроксильный радикал, R6 обозначает атом водорода, a R и R7 вместе образуют связь, после чего защитную группу, обозначаемую Z1, заменяют атомом водорода в условиях по п.14.
16. Способ по п.15, отличающийся тем, что перед вводом в реакцию соединения общей формулы IX, гидроксильная функция в положении 10 может быть металлирована с помощью гидрида, амида или алкилпроизводного щелочного металла.
17. Фармацевтическая композиция, отличающаяся тем, что она содержит, по меньшей мере, один продукт по п.1, в котором Z обозначает радикал общей формулы II в комбинации с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и, возможно, с одним или несколькими совместимыми и фармакологически активными соединениями.
Текст
1 Настоящее изобретение относится к новым таксоидам общей формулы (I)Z означает радикал общей формулы (II) где R1 означает бензоильный радикал или радикал R2-O-CO-, в котором R2 означает аклкильный радикал с 1-8 атомами углерода,R3 означает фенил или -, или -нафтил, и либо R4 означает атом водорода,R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь; либо R4 означает атом водорода или алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи, алкоксиацетильный радикал, алкильная часть которого содержит 1-6 атомов углерода в линейной или разветвленной цепи; карбамоилоксирадикал, алкилкарбамоилоксирадикал с 1-4 атомами углерода в алкильной части, диалкилкарбамоилоксирадикал с 1-4 атомами углерода в каждой алкильной части иR5 означает атом водорода илиR4 и R5 вместе образуют кетонную функцию,R6 означает атом водорода иR и R7 вместе образуют связь. Более предпочтительно настоящее изобретение относится к продуктам общей формулы(I), в которой Z означает радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикал R2-O-CO-, где R2 означает трет.-бутильный радикал, и R3 означает фенильный радикал или R4 означает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь; или R4 означает алкоксильный радикал с 1-6 атомами углерода или алкоксиацетильный радикал с 1-6 атомами углерода в алкильной части; R5 означает атом водорода, R6 означает атом водорода и R и R7 вместе образуют связь; или R4 и R5 вместе образуют кетонную функцию, R6 означает атом водорода, R и R7 вместе образуют связь. Еще более предпочтительно, настоящее изобретение относится к продуктам общей формулы (I), в которой Z означает радикал общей формулы (II), в которой R1 означает бензоиль-ный радикал или радикал R2-O-CO-, где R2 означает трет.-бутильный радикал и R3 означает фенил, или R4 означает атом водорода, и R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, или R4 означает метоксирадикал, R5 означает атом водорода, R6 озна 001533 2 чает атом водорода и R и R7 вместе образуют связь. Эти соединения являются новыми и не имеют аналогов, которые были бы известны из уровня техники. Единственными структурно близкими соединениями оказываются соединения, описанные в заявке WO 93/21173; их отличие от соединений согласно настоящему изобретению состоит в том, что известные соединения не имеют эфирных мостиков между положениями 7 и 9 или 7 и 10. Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают заметными противоопухолевыми и антилейкемическими свойствами. Изобретение также относится к соединениям формулы (I') в которой Z обозначает атом водорода, a R, R4,R5, R6 и R7 имеют те же значения, как и в формуле (I) по п.1, в качестве промежуточных продуктов для получения соединений формулы (I). Согласно изобретению продукты общей формулы (I), в которой или R4 означает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь; илиR4 означает гидроксил, R5 означает атом водорода, R6 означает атом водорода и R и R7 вместе образуют связь, могут быть получены путем воздействия восстановителя на продукт общей формулы (III) в которой Z1 означает атом водорода или защитную для гидроксильной функции группу или радикал общей формулы (IV) в которой R8 означает защитную для гидроксильной функции группу и X вместе с атомом кислорода, с которым он связан, означает группу, выбираемую среди алкилсульфонила с 1-4 атомами углерода, незамещенного или замещенного одним или несколькими атомами галогена; арилсульфонила, арильной частью которого является фенил, незамещенный или замещенный одним или несколькими, одинаковыми или разными атомами или радикалами, выбираемыми среди атомов галогена и алкильного радикала с 1-4 атомами углерода, нитрогруппы 3 или трифторметильного радикала, с получением продукта общей формулы (V) в которой Z1, R, R4, R5, R6 и R7 имеют вышеуказанное значение с последующей заменой защитной группы, обозначаемой Z1 или R8, атомом водорода. Как правило, восстановитель выбирают среди алюмогидридов или боргидридов, таких как боргидриды щелочного или щелочноземельного металла, как, например, боргидрид натрия, в присутствии алифатического спирта с 1-4 атомами углерода, такого как этанол, причем реакцию осуществляют при температуре от 0 до 50 С, предпочтительно около 20 С. Защитную группу, обозначаемую как R8,предпочтительно выбирают из групп, которые могут быть легко введены и легко удалены без затрагивания остальной части молекулы, таких как кремнийсодержащие радикалы, как, например, триэтилсилил. Замену защитной группы атомом водорода, когда она означает кремнийсодержащий радикал, обычно осуществляют с помощью неорганической кислоты, такой как соляная кислота, в алифатическом спирте с 1-4 атомами углерода при температуре от -10 до 20 С, предпочтительно около 0 С, или в присутствии источника фтор-ионов, такого как комплекс триэтиламина с фтороводородом, работая в инертном органическом растворителе,таком как галогенированный алифатический углеводород, как дихлорметан, при температуре 0-50 С, предпочтительно около 20 С. Осуществление способа обычно приводит к смеси продукта общей формулы (I), в которойR4 означает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, с продуктом общей формулы (I), в которой R4 означает гидроксил, R5 означает атом водорода, R6 означает атом водорода и R иR7 вместе образуют связь, которые разделяют обычными методами, такими как хроматография. Продукт общей формулы (III) может быть получен путем воздействия окислителя на продукт общей формулы (VI) в которой Z1 и X имеют вышеуказанное значение. Обычно окислитель выбирают из агентов,которые позволяют окислять вторичную спир 001533 4 товую функцию без затрагивания остальной части молекулы, как, например, кислород, перутенат аммония, диоксид марганца, ацетат меди или пиридинийхлорхромат. Предпочтительно используют пиридинийхлорхромат, работая в органическом растворителе, таком как алифатические углеводороды, которые могут быть галогенированы, как дихлорметан, при температуре 0-50 С, предпочтительно около 25 С. Продукт общей формулы (VI), в которойZ1 и X имеют вышеуказанное значение, могут быть получены путем воздействия сульфонилгалогенида на продукт общей формулы (VII) в которой Z1 имеет вышеуказанное значение. Продукт общей формулы (VI), в которой X предпочтительно означает трифторметилсульфонильный радикал, может быть получен путем воздействия производного трифторметансульфокислоты, такого как ангидрид или N-фенилтрифторметансульфонимид, в инертном органическом растворителе, таком как алифатический углеводород, который может быть галогенирован, как, например, дихлорметан, работая в присутствии органического основания, такого как пиридин или третичный алифатический амин,как, например, триэтиламин, при температуре от -50 до 20 С, на продукт общей формулы(VII). Продукт общей формулы (VII), в которойZ1 означает радикал общей формулы (IV), где R8 имеет вышеуказанное значение, может быть получен путем воздействия силилирующего агента на продукт общей формулы (VIII) в которой R1 и R3 имеют вышеуказанное значение. Как правило, используют триалкилсилилгалогенид, такой как триэтилсилилхлорид, работая в углеводороде, который может быть галогенирован, таком как дихлорметан, в присутствии органического основания, такого как пиридин или третичный алифатический амин, такой как триэтиламин. Продукт общей формулы (VIII), в которомR3 означает фенил и R1 означает трет.бутильный радикал, известен под названием доцетаксел. Производные доцетаксела, которые соответствуют общей формуле (VIII), могут быть получены в условиях, описанных в международных заявках 92/09589, 93/16060 и 94/1284. 5 Продукт общей формулы (VII), в которойZ1 означает атом водорода, представляет собой 10-дезацетилбаккатин-III, который известным образом экстрагируют из листьев тиса (Taxusbaccata). Согласно изобретению продукты общей формулы (I), в которой Z имеет вышеуказанное значение; R4 означает алкоксильный радикал с 1-6 атомами углерода в линейной или разветвленной цепи, алкенилоксирадикал с 3-6 атомами углерода в линейной или разветвленной цепи,алкинилоксирадикал с 3-6 атомами углерода в линейной или разветвленной цепи, циклоалкилоксирадикал с 3-6 атомами углерода, циклоалкенилоксирадикал с 3-6 атомами углерода, алканоилоксирадикал, алканоильная часть которого содержит 1-6 атомов углерода в линейной или разветвленной цепи, алкеноилоксирадикал,алкенильная часть которого содержит 3-6 атомов углерода в линейной или разветвленной цепи,алкиноилоксирадикал,алкиноильная часть которого содержит 3-6 атомов углерода в линейной или разветвленной цепи, циклоалканоилоксирадикал с 1-6 атомами углерода, алкоксиацетильный радикал, алкильная часть которого содержит 1-6 атомов углерода в линейной или разветвленной цепи, алкилтиоацетильный радикал, алкильная часть которого содержит 1-6 атомов углерода в линейной или разветвленной цепи,алкилоксикарбонилоксирадикал, алкильная часть которого содержит 1-6 атомов углерода в линейной или разветвленной цепи, причем эти радикалы не замещены или замещены одним или несколькими атомами галогена или алкоксильным радикалом с 1-4 атомами углерода, алкилтиорадикалом с 1-4 атомами углерода; или карбоксил, алкилоксикарбонил с 1-4 атомами углерода в алкильной части,цианорадикал,карбамоил,N-алкилкарбамоил или N,N-диалкилкарбамоил, каждая алкильная часть которого содержит 1-4 атома углерода или с атомом азота, с которым она связана, образует пяти- или шестичленный насыщенный гетероциклический радикал, который может содержать второй гетероатом, выбираемый среди атомов кислорода, серы или азота, и который может быть замещен алкильным радикалом с 1-4 атомами углерода или фенилом или фенилалкилом, алкильная часть которого содержит 1-4 атома углерода; или R4 означает карбамоилоксирадикал, алкилкарбамоилоксирадикал с 1-4 атомами углерода в алкильной части, диалкилкарбамоилоксирадикал с 1-4 атомами углерода в каждой алкильной части или бензоилоксирадикал или гетероциклилкарбонилоксирадикал, в котором гетероциклическая часть означает пяти- или шестичленный ароматический гетероцикл с одним или несколькими гетероатомами, выбираемыми среди атомов кислорода, серы или азота; R5 означает атом водорода; R6 означает атом водорода; и R и R7 вместе 6 означают связь; могут быть получены путем воздействия продукта общей формулы (IX)(IX) в которой R'4 является таким, что R'4-O- идентичен имеющему вышеуказанное значение R4, и Y означает удаляемую группу, такую как атом галогена, на продукт общей формулы (V), в которой Z1 имеет вышеуказанное значение, R4 означает гидроксил, R6 означает атом водорода и R и R7 вместе образуют связь. Обычно продуктом общей формулы (IX) воздействуют на продукт вышеприведенной общей формулы (V) после возможной металлации гидроксильной функции в положении 10 с помощью гидрида щелочного или щелочноземельного металла, такого как гидрид натрия,амида щелочного металла, такого как диизопропиламид лития, или алкилпроизводного щелочного металла, такого как н-бутиллитий, работая в органическом растворителе, таком как диметилформамид или тетрагидрофуран или пиридин, при температуре 0-50 С, при необходимости с последующей заменой защитной для гидроксильной функции группы Z1 или R8 в вышеописанных условиях. Когда Z1 отличен от радикала общей формулы (IV), особенно предпочтительно осуществлять реакцию с продуктом общей формулы(V), в которой Z1 означает защитную для гидроксильной функции группу, которая представляет собой предпочтительно триэтилсилильный радикал. В этом случае защитную группу вводят путем воздействия триалкилсилилгалогенида,предпочтительно триэтилсилилгалогенида, на продукт общей формулы (VI), в которой Z1 означает атом водорода. Согласно изобретению, продукты общей формулы (I), в которой Z означает радикал общей формулы (II), R4 и R5 вместе образуют кетонную функцию, R6 означает атом водорода иR и R7 вместе образуют связь, могут быть получены путем окисления продукта общей формулы (V), в которой Z1 имеет вышеуказанное значение, R4 означает гидроксил, R5 означает атом водорода, R6 означает атом водорода и R и R7 вместе образуют связь, при необходимости с последующей заменой защитной группы, обозначаемой как Z1 или R8, атомом водорода в вышеописанных условиях. Как правило, окисление осуществляют в условиях, описанных выше для окисления продукта общей формулы (VI). Согласно изобретению продукты общей формулы (I), в которой Z означает радикал общей формулы (II), каждый из R4, R5 и R6 означает атом водорода и R и R7 вместе образуют связь, могут быть получены из продукта общей формулы (V), в которой Z1 имеет вышеуказанное значение, R4 означает гидроксил, каждый изR5 и R6 означает атом водорода и R и R7 вместе образуют связь, после превращения гидроксила,обозначаемого как R4, в дитиокарбонат с после 7 дующим восстановлением полученного продукта с помощью триалкилоловогидрида, такого как трибутилоловогидрид, при необходимости с последующей заменой защитной группы, обозначаемой как Z1 или R8, атомом водорода в вышеописанных условиях. Согласно изобретению продукты общей формулы (I) также могут быть получены путем этерификации с образованием сложного эфира продукта общей формулы (I), в которой Z означает атом водорода, с помощью кислоты общей формулы (X) в которой или R9 означает атом водорода и R10 означает защитную для гидроксильной функции группу, или R9 и R10 вместе образуют пяти- или шестичленный насыщенный гетероцикл, или с помощью производного этой кислоты, с последующей заменой защитных групп атомами водорода. Условия этерификации с образованием сложного эфира и замены защитных групп идентичны таковым, которые описываются, например, в международных заявках 92/09589,93/16060 и 94/12484. Новые продукты общей формулы (I), получаемые путем осуществления способов согласно изобретению, могут быть очищены известными методами, такими как кристаллизация или хроматография. Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают заметными биологическими свойствами. Ин витро определение биологической активности осуществляют при использовании тубулина, выделенного путем экстракции из головного мозга свиньи по методу M.L. Shelanski и др., Proc. Natl. Acad. Sci. USA, 70, 765-768(1973). Изучение деполимеризации микротрубочек до тубулина осуществляют по методу G.Chauviere и др., C.R. Acad. Sci., 293. серия II,501-503 (1981). При этом исследовании продукты общей формулы (I), в которой Z означает радикал общей формулы (II), оказываются, по крайней мере, такими же активными, как таксол и таксотер. Ин виво продукты общей формулы (I), в которой Z означает радикал общей формулы(II), оказываются активными у мышей, которым трансплантирована меланома В 16, в дозах 1-10 мг/кг внутрибрюшинно также, как в случае других жидких или твердых опухолей. Новые продукты обладают противоопухолевыми свойствами и в особенности активностью в отношении опухолей, которые резистентны к Таксолу или к Таксотеру. К таким опухолям относятся опухоли ободочной кишки,при которых наблюдается повышенная экспрес 001533 8 сия гена mdr 1 (ген множественной лекарственной устойчивости). Множественная лекарственная устойчивость представляет собой обычный термин, относящийся к устойчивости опухоли к различным продуктам различных структур и различных механизмов действия. Таксоиды вообще известны как в высокой степени распознаваемые экспериментальными опухолями, такими как P388/DOX, линия клеток, выбираемая по е резистентности к доксорубицину (DOX), который экспримирует mdr 1. Нижеследующие примеры иллюстрируют настоящее изобретение. Список сокращений, используемый в нижеследующих примерах к ЯМР-спектрам:S = с (синглет); d = д (дублет); t = т (триплет); q = к (квадруплет); dd = дд; mt = м (мультиплет); mf = массив; АВ limite = АВ ограниченный; large = уш. (уширенный); etale = растянутый; meta = мета-положение; раrа = параположение; ortho = орто-положение. Пример 1. К раствору 0,65 г (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-9,10 диоксо-7-трифторметансульфонилокси-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-3 фенил-2-триэтилсилилокси-пропионата в 6,5 см 3 абсолютного этанола, поддерживаемому в атмосфере аргона, при температуре около 20 С добавляют 117 мг боргидрида натрия. После выдерживания в течение 5 мин при температуре около 20 С реакционную смесь разбавляют с помощью 50 см этилацетата. Органическую фазу промывают 3 раза по 10 см 3 дистиллированной воды, затем 2 раза по 10 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 600 мг меренги белого цвета, которую комбинируют с 313 мг такой же сырой смеси, полученной из 500 мг(2R,3S)-4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-9,10-диоксо-7-трифторметансульфонилокси-такс-11-ен-13-ил-3-трет.бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионата в тех же условиях. Очистку осуществляют путем хроматографии при атмосферном давлении на 100 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 3,5 см, элюируя смесью этилацетата с дихлорметаном (градиент элюирования от 2:98 до 15:85 по объему) и собирая фракции по 20 см 3. Фракции, содержащие только целевые продукты, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом получают 153 мг (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7 а,10 эпокси-9-оксо-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси 9 пропионата в виде меренги белого цвета и 384 мг (2R,3S)-4-ацетокси-2-бензоилокси-5,20 эпокси-1,10-дигидрокси-7,9-эпокси-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-3 фенил-2-триэтилсилиокси-пропионата в виде меренги белого цвета. 10 пропионата в 1,7 см 3 0,1 н раствора хлороводорода в этаноле перемешивают в атмосфере аргона при температуре около 0 С в течение 1 ч. Затем реакционную смесь разбавляют с помощью 20 см 3 дихлорметана. Органическую фазу промывают 2 раза по 5 см 3 дистиллированной воды, затем 2 раза по 5 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,1 кПа) при температуре около 40 С. Таким образом получают 130 мг меренги цвета слоновой кости, которую очищают путем препаративной тонкослойной хроматографии (12 препаративных пластин Мерк; силикагель 60F254; 2020 см; толщина 0,25 мм; наносят в виде раствора в дихлорметане), элюируя 2 раза смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С получают 22,6 мг(2R,3S)-4-ацетокси-2-бензоилокси-5,20 эпокси-1,10-дигидрокси-7,9-эпокси-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-3 фенил-2-гидрокси-пропионата в виде меренги белого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; при температуре 60 С;в м. д.; константы связывания J в Гц): 1,14 (s, 3H: CH3); 1,25 (s, 3H: СН 3); 1,40 (s,9 Н: С(СН 3)3); 1,74 (s, 3H: СН 3); 1,86 (s, 1H: ОН(2R,3S)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-9,10-диоксо-7 трифторметансульфонилокси-такс-11-ен-13 ил-3-трет.-бутоксикарбониламино-3-фенил-2 триэтилсилилокси-пропионат может быть получен, следующим образом. К суспензии 1,87 г (2R,3S)-4-ацетокси 2-бензоилокси-5,20-эпокси-l,10-дигидрокси-9-оксо-7-трифторметансульфонилокситакс-11-ен-13-ил-3-трет.-бутоксикарбонил 11 амино-3-фенил-2-триэтилсилилокси-пропионата и 4 г активированного молекулярного сита 4 Ангстрема в 10 см 3 безводного дихлорметана,поддерживаемой в атмосфере аргона, при температуре около 20 С быстро добавляют 1,91 г пиридинийхлорхромата. Реакционную смесь перемешивают в течение 20 ч при температуре около 20 С, затем очищают прямо путем внесения в колонку для хроматографии при атмосферном давлении, содержащую 200 г диоксида кремния (0,063-0,2 мм; колонка диаметром 3,5 см), элюируя одним дихлорметаном, затем смесью метанола с дихлорметаном (в объемном соотношении 0,5:99,5) и собирая фракции по 15 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом получают 1,16 г (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-9,10 диоксо-7-трифторметансульфонилокси-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-3 фенил-2-триэтилсилилокси-пропионата в виде меренги бледно-желтого цвета, характеристики которого следующие: 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.; константы связывания J в Гц): 0,42 (mt, 6 Н: СН 2 триэтилсилил en 2'); 0,81(2R,3S)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1,10-дигидрокси-9-оксо-7 трифторметансульфонилокси-такс-11-ен-13 ил-3-трет.-бутоксикарбонилоамино-3-фенил-2 триэтилсилилокси-пропионат может быть получен следующим образом. К суспензии 8,85 г (2R,3S)-4-ацетокси 2-бензоилокси-5,20-эпокси-1,7,10-тригидрокси-9-оксо-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилоксипропионата и 2 г активированного молекулярного сита 4 Ангстрема в 50 см 3 безводного дихлорметана и 3,9 см 3 безводного пиридина, поддерживаемой в атмосфере аргона, при температуре около -30 С прикапывают раствор 3,2 см 3 ангидрида трифторметансульфокислоты в 3 см 3 безводного дихлорметана. Реакционную смесь перемешивают в течение пяти минут при тем 001533 12 пературе -35 С, затем в течение 1 ч при температуре около 0 С. После охлаждения до температуры около -10 С добавляют 6 см 3 дистиллированной воды. После фильтрации через содержащее целит фриттированное стекло, промывки фриттированного стекла с помощью 20 см 3 смеси этилацетата с дихлорметаном (в объемном соотношении 50:50) и декантации, органическую фазу промывают два раза по 10 см 3 дистиллированной воды, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 11,3 г меренги оранжевого цвета,которую очищают путем хроматографии при атмосферном давлении на 800 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 7 см, элюируя смесью метанола с дихлорметаном (в объемном соотношении 1:99,затем 2:98) и собирая фракции по 60 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом, получают 9,55 г(2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1,10-дигидрокси 9-оксо-7-трифторметансульфонилокси-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионата в виде смеси. Эту смесь очищают путем хроматографии при атмосферном давлении на 700 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 6 см, элюируя одним дихлорметаном,затем смесью этилацетата с дихлорметаном (в объемном соотношении 5:95) и собирая фракции по 60 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (0,27 кПа) при температуре 40 С в течение двух часов. Таким образом получают 4,09 г (2R,3S)-4 ацетокси-2-бензоилокси-5,20-эпокси-1,10 дигидрокси-9-оксо-7-трифторметансульфонилокси-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионата в виде меренги бледно-желтого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (300 МГц; дейтерохлороформ;в м. д.; константы связывания J в Гц): 0,38 (mt, 6 Н: СН 2 триэтилсилил en 2'); 0,79(2R,3S)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1,7,10-тригидрокси-9-оксотакс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионат может быть получен следующим образом. К раствору 8,6 г (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1,7,10-тригидрокси-9-оксо-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-гидрокси-пропионата в 40 см 3 безводного дихлорметана и 8,6 см 3 безводного пиридина, при температуре около 20 С и в инертной атмосфере аргона, прикапывают 8,05 см 3 триэтилсилилхлорида. Реакционную смесь перемешивают при температуре около 20 С в течение двух часов, затем добавляют 300 см 3 дихлорметана. Органическую фазу промывают два раза по 50 см 3 дистиллированной воды, 50 см 3 водного 0,1 н раствора соляной кислоты, 50 см 3 дистиллированной воды, затем 50 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 14,2 г меренги белого цвета, которую очищают путем хроматографии при атмосферном давлении на 800 г диоксида кремния (0,0630,2 мм), содержащихся в колонке диаметром 7 см, элюируя смесью метанола с дихлорметаном(в объемном соотношении 2:98) и собирая фракции по 30 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом получают 8,85 г (2R,3S)-4 ацетокси-2-бензоилокси-5,20-эпокси 1,7,10-тригидрокси-9-оксо-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилоксипропионата в виде меренги белого цвета. Пример 2. К раствору 200 мг (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1,10-дигидрокси 7,9-эпокси-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилоксипропионата в 2 см 3 безводного пиридина, поддерживаемому в атмосфере аргона, при температуре около 20 С добавляют 0,0125 см 3 уксусного ангидрида, затем 13,5 мг N,N'диметиламино-4-пиридина. После выдерживания в течение 30 мин при температуре около 20 С реакционную смесь разбавляют с помощью 40 см 3 этилацетата. Органическую фазу промывают 2 раза по 6 см 3 дистиллированной воды, затем 6 см 3 водного насыщенного раство 001533 14 ра хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 237,4 мг меренги бледно-желтого цвета, которую очищают путем хроматографии при атмосферном давлении на 20 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см, элюируя смесью этилацетата с дихлорметаном (градиент элюирования от 2:98 до 10:90 по объему) и собирая фракции по 10 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом получают 184,8 мг (2R,3S)-4,10 диацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,9-эпокси-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.; константы связывания J в Гц): 0,34 et 0,40 (2 mt, 6H: СН 2 триэтилсилил 2'); 0,76 (t, J = 7,5, 9 Н: СН 3 триэтилсилил en 2); 1,26 (s, 3H: СН 3); 1,28 (s, 3H: СН 3); 1,38 (s, 9H: С(СН 3)3); 1,72 (s, 3H: СН 3); 1,88 (s, 1H: ОН en 1); 2,01 (s, 3H: СН 3); 2,14 (s, 3H: СОСН 3); 2,23 et de 2,302,45 (соответств.; dd et mt, J = 15 et 9,1H каждый: СН 2 en 14); 2,39 (mt, 2 Н: СН 2 en 6); 2,48(d, J = 6, 1H: H en 2); 6,10 (t large, J = 9, 1H: H en 13); de 7,257,45 (mt, 5H: H ароматическ. 3'); 7,48 (t, J = 7,5, 2H: OCOC6H5 H en meta); 7,62 (t,J = 7,5, 1H: OCOC6H5 H en para); 8,15 (d, J = 7,5,2H: OCOC6H5 H en ortho). К раствору 180 мг (2R,3S)-4,10 диацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,9-эпокси-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионата в 1 см 3 безводного дихлорметана, поддерживаемому в атмосфере аргона, при температуре около 20 С прикапывают 0,93 см 3 комплекса триэтиламина с фтороводородом (3 HF. Et3N). После выдерживания в течение 7,5 ч при температуре около 20 С реакционную смесь разбавляют с помощью 30 см 3 этилацетата и 8 см 3 водного насыщенного раствора гидрокарбоната натрия. После декантации органическую фазу промывают 2 раза по 8 см 3 дистиллированной воды, затем 8 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре 15 около 40 С. Таким образом получают 167,5 мг меренги белого цвета, которую очищают путем препаративной тонкослойной хроматографии на диоксиде кремния (9 препаративных пластин Мерк, силикагель 60F254; 2020 см; толщина 0,5 мм; наносят в виде раствора в дихлорметане), элюируя смесью метанола с дихлорметаном(в объемном соотношении 4:96). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном(в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении(2,7 кПа) при температуре около 40 С, получают 143,6 мг (2R,3S)-4,10-диацетокси-2 бензоилокси-5, 20-эпокси-1 -гидрокси-7, 9 эпокси-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-гидрокси-пропионата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц, дейтерохлороформ;в м. д.; константы связывания J в Гц) 1,24 (s, 3H: СН 3); 1,32 (s, 3H: СН 3); 1,41 (s,9H: С(СН 3)3); 1,68 (s, 3H: СН 3); 1,91 (s, 1H: ОН(d, J = 7,5, 2H: H en ortho de ароматическ en 3'); 7,50 (t, J = 7,5, 2H: OCOC6H5 H en meta); 7,62 (t,J = 7,5, 1H: OCOC6H5 H en para); 8,13 (d, J = 7,5,2H: OCOC6H5 H en ortho). Пример 3. К раствору 149 мг (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-7,10 эпокси-9-оксо-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилоксипропионата, полученного в примере 1, в 1,5 см 3 безводного дихлорметана, поддерживаемому в атмосфере аргона, при температуре около 20 С прикапывают 0,805 см 3 комплекса триэтиламина с фтороводородом (3 HF.Et3N). После выдерживания в течение 1 ч при температуре около 20 С реакционную смесь разбавляют с помощью 50 см 3 дихлорметана, 5 см 3 водного насыщенного раствора гидрокарбоната натрия и 5 см 3 дистиллированной воды. После декантации органическую фазу промывают 3 раза по 8 см 3 дистиллированной воды, затем 8 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пони 001533 16 женном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 133,2 мг меренги бледно-желтого цвета, которую очищают путем препаративной тонкослойной хроматографии на диоксиде кремния (10 препаративных пластин Мерк, силикагель 60F254; 2020 см; толщина 0,5 мм; наносят в виде раствора в дихлорметане), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С, получают 114,2 мг (2R,3S)-4 ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,10-эпокси-9-оксо-такс-11-ен-13 ил-3-трет.-буток-сикарбониламино-3-фенил-2 гидрокси-пропио-ната в виде меренги белого цвета, которую очищают путем препаративной тонкослойной хроматографии на диоксиде кремния (8 препаративных пластин Мерк; силикагель 60F254; 2020 см; толщина 0,5 мм; нанесение в виде раствора в дихлорметане), злюируя смесью метанола с дихлорметаном (в объемном соотношении 2:98). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С получают 92,8 мг (2R,3S)-4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-7,10-эпокси-9-оксо-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-3 фенил-2-гидрокси-пропионата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; при температуре 60 С;в м. д.; константы связывания J в Гц): 1,23 (s, 3H: СН 3); 1,33 (s, 3H: СН 3); 1,41 (s,9 Н: С(СН 3)3): 1,78 (s, 3H: СН 3); 1,83 (s, 3H: СН 3); 1,88 (s, 1H: ОН en 1); 2,12 et 2,35 (2 dd, J = 15 et 8,1H каждый: CH2 en 14); 2,28 (s, 3H: COCH3); 2,33 et 2,43 (2 dd, H en 7); 3,85 (mf, 1H: OH en 2'); 4,28 (AB limite, J = 8, 2H: CH2 en 20); 4,52 (d,J = 6,5, 1H: H en 3); 4,63 (mt, 1H: H en 2'); 4,83 17 К раствору 10 мг (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1,10-дигидрокси 7,9-эпокси-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилоксипропионата в 0,1 см 3 метилиодида и 0,01 см 3 безводного диметилформамида, в атмосфере аргона, при температуре около 20 С добавляют 1 мг 50 %-ного гидрида натрия в масле. После выдерживания в течение 12 мин при температуре около 20 С сырую реакционную смесь очищают путем препаративной тонкослойной хроматографии на диоксиде кремния (1 препаративная пластина Мерк, силикагель 60F254; 2020 см; толщина 0,5 мм; наносят сырую реакционную смесь), элюируя смесью метанола с дихлорметаном (в объемном соотношении 3:97). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через вату, затем выпаривания растворителей при пониженном давлении(2,7 кПа) при температуре около 40 С получают 4,7 мг (2R,3S)-4-ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-10-метокси-7,9 эпокси-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилоксипропионата в виде белого лака. К раствору 4 мг (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-10 метокси-7,9-эпокси-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-3-фенил-2-триэтилсилилокси-пропионата в 0,1 см 3 безводного дихлорметана, поддерживаемому в атмосфере аргона, при температуре около 20 С прикапывают 0,01 см комплекса триэтиламина с фтороводородом (3HF.Et3N). После выдерживания в течение 35 мин при температуре около 20 С,сырую реакционную смесь очищают путем препаративной тонкослойной хроматографии на диоксиде кремния (1 препаративная пластина Мерк; силикагель 60F254; 2020 см; толщина 0,5 мм; наносят сырую реакционную смесь),элюируя смесью метанола с дихлорметаном (в объемном соотношении 4:96). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через вату, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С, получают 3,3 мг (2R,3S)-4 ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-10-метокси-7,9-эпокси-такс-11-ен 13-ил-3-трет.-бутоксикарбониламино-3-фенил 2-гидрокси-пропионата в виде белого лака, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ; при температуре 60 С;в м. д.; константы связывания J в Гц): 1,17 (s, 3H: СН 3); 1,22 (s, 3H: СН 3); 1,41 (s,9 Н: С(СН 3)3); 1,67 (s, 3H: СН 3); 1,94 (s, 1H: ОН(2R,3S)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-7,9-окса-10 пропаноилокси-такс-11-ен-13-ил-3-трет.бутоксикарбониламино-3-фенил-2-гидроксипропионат может быть получен следующим образом. К раствору 50 мг (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1-гидрокси 7,9-окса-10-пропаноилокси-такс-11-ен-13 ил-3-трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в 0,5 см 3 этилацетата, поддерживаемому при температуре около 20 С, добавляют 0,0053 см 3 концентрированной соляной кислоты (36%; d = 1,18). После выдерживания в течение двух часов при температуре около 20 С сырую реакционную смесь очищают путем препаративной тонкослойной хроматографии (1 препаративная пластина Мерк; силикагель 60F254; 2020 см; толщина 1 мм), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С получают 21 мг (2R,3S)-4 ацетокси-2-бензоилокси-5,20-эпокси-1 гидрокси-7,9-окса-10-пропаноилокси-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-3 фенил-2-гидрокси-пропионата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.): 1,18 (t, J = 7,5 Hz, 3H: СН 3 de 1'ethyle); 1,26(2R,4S,5R)-4-ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-7,9-окса-10 пропаноилокси-такс-11-ен-13-ил-3-трет.бутоксикарбониламино-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 100 мг (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1,10-дигидрокси-7,9-окса-такс-11-ен-13-ил-3-трет.бутоксикарбониламино-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата в 1 см 3 безводного пиридина, поддерживаемому в атмосфере аргона, при температуре около 20 С последовательно добавляют 20 мг N,N'диметиламино-4-пиридина, затем 0,042 см 3 пропионового ангидрида. После выдерживания в течение двух часов при температуре около 20 С реакционную смесь разбавляют с помощью 5 см 3 дихлорметана и 2 см 3 дистиллированной воды. После декантации органическую фазу сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают бесцветное масло, которое очищают путем препаративной тонкослойной хроматографии (3 препаративные пластины Мерк; силикагель 60F254; 2020 см; толщина 1 мм; наносят в виде раствора в минимальном количестве дихлорметана), элюируя смесью метанола с дихлорметаном(в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном(в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении(2,7 кПа) при температуре около 40 С, получают 51 мг (2R,4S,5R)-4-ацетокси-2-бензоилокси-5,20-эпокси-1-гидрокси-7,9-окса 10-пропаноилокси-такс-11-ен-13-ил-3-трет.бутоксикарбониламино-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.): 1,04 (t, J = 7,5 Hz, 3H: СН 3 de 1'ethyle); 1,05(2R,4S,5R)-4-ацетокси-2-бензоилокси 5,20-эпокси-1,10-дигидрокси-7,9-оксатакс-11-ен-13-ил-3-трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 1,1 г (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1-гидрокси-9,10 диоксо-7-трифторметансульфонат-такс-11-ен 13-ил-3-трет.-бутоксикарбониламино-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в 30 см 3 абсолютного этанола,поддерживаемому в атмосфере аргона, при температуре около 0 С добавляют 60 мг боргидрида натрия. После выдерживания в течение часа при температуре около 0 С реакционную смесь разбавляют с помощью 100 см 3 этилацетата. Органическую фазу промывают с помощью 50 см 3 дистиллированной воды, затем 2 раза по 25 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 1,04 г меренги бледно-желтого цвета, которую очищают путем хроматографии при атмосферном давлении на 50 г диоксида кремния(0,063-0,2 мм), содержащихся в колонке диаметром 2,5 см, элюируя смесью метанола с дихлорметаном (в объемном соотношении 2:98) и собирая фракции по 20 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом получают 230 мг(2R,4S,5R)-4-ацетокси-2-бензоилокси-5,20 эпокси-1,10-дигидрокси-7, 9-окса-такс-11 ен-13-ил-3-трет.-бутоксикарбониламино-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц, дейтерохлороформ;в м. д.): 1,05 (s, 9H: С(СН 3)3); 1,10 (s, 3H: СН 3); 1,25(2R,4S,5R)-4-ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-9,10-диоксо-7 трифторметансульфонат-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К суспензии 2,2 г (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1,10-дигидрокси-9-оксо-7-трифторметансульфонат-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата и 4,5 г активированного молекулярного сита 4 Ангстрема в 10 см 3 безводного дихлорметана, поддерживаемой в атмосфере аргона, при температуре около 20 С быстро добавляют 1,8 г пиридинийхлорхромата. Реакционную смесь перемешивают в течение 17 ч при температуре около 20 С, затем фильтруют черезClarcel. Твердый остаток промывают дихлорметаном, затем фильтрат концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают меренгу коричневого цвета, которую очищают путем хроматографии при атмосферном давлении на 200 г диоксида кремния (0,063-0,2 мм), содержащихся в колонке диаметром 4 см, элюируя смесью метанола с дихлорметаном (в объемном соотношении 0,5:99,5) и собирая фракции по 20 см 3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 40 С в течение двух часов. Таким образом получают 1,5 г (2R,4S,5R)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-9,10 диоксо-7-трифторметансульфонат-такс-11-ен 13-ил-3-трет.-бутоксикарбониламино-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в виде меренги желтого цвета,характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.): 1,07 (s, 9H: С(СН 3)3); 1,20 (s, 3H: СН 3); 1,27(2R,4S,5R)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1,10-дигидрокси-9-оксо-7 трифторметансульфонат-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат получают, например, по методике, описанной в патенте Франции 9408198 ( первая подача заявки 04. 07. 94). Пример 6.(2R,3S)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-10-метокси-ацетокси-7,9-окса-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-3-фенил-2-гидрокси-пропионат может быть получен следующим образом. К раствору 30 мг (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1-гидрокси-10 метоксиацетокси-7,9-окса-такс-11-ен-13-ил 3-трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата в 1 см 3 этилацетата, поддерживаемому при температуре около 20 С, добавляют 0,0053 см 3 концентрированной соляной кислоты (36 % ; d = 1,18). После выдерживания в течение 45 мин при температуре около 20 С добавляют 0,002 см 3 концентрированной соляной кислоты. После выдерживания в течение двух часов при температуре около 20 С сырую реакционную смесь очищают путем препаративной тонкослойной хроматографии (1 препаративная пластина Мерк; силикагель 60F254; 2020 см; толщина 0,5 мм), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85),фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С,получают 13 мг (2R,3S)-4-ацетокси-2 бензоилокси-5,20-эпокси-1-гидрокси-10 метоксиацетокси-7,9-окса-такс-11-ен-13-ил 3-трет.-бутоксикарбониламино-3-фенил-2 гидрокси-пропионата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.): 1,24 (s, 3H: СН 3); 1,31 (s, 3H: СН 3); 1,40 (s,9H: С(СН 3)3); 1,67 (s, 3H: СН 3); 1,86 (s, 3H: СН 3); 1,99 (s, 1 Н: ОН en 1); 2,20 et de 2,252,50 (соответствен. et mt, J = 16 et 8 Hz, 1H каждый: CH2 14); de 2,252,50 (mt, 2H: CH2 6); 2,31 (s, 3H:(2R,4S,5R)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-10-метоксиацетокси-7,9-окса-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 90 мг (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1,10-дигидрокси-7,9-окса-7-трифторметансульфонат-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в 2 см 3 безводного тетрагидрофурана, поддерживаемому в атмосфере аргона,при температуре около -78 С добавляют 0,093 см 3 н-бутиллития (в виде 1,6 М раствора в гексане), затем, спустя 8 мин, 0,023 см 3 метоксиацетилхлорида. Охлаждающую баню удаляют, затем сырую реакционную смесь после доведения е до температуры около 20 С очищают путем препаративной тонкослойной хроматографии (2 препаративные пластины Мерк; силикагель 60F254; 2020 см; толщина 1 мм), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С получают 31 мг(2R,4S,5R)-4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-10-метоксиацетокси 7,9-окса-такс-11-ен-13-ил-3-трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил 1,3-оксазолидин-5-карбоксилата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.): 1,05 (s, 9H : С(СН 3)3); 1,26(2R,3S)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-10-диметил-аминокарбонилокси-7,9-окса-такс-11 -ен-13-ил-3 трет.-бутоксикарбониламино-3-фенил-2-гидрокси-пропионат может быть получен следующим образом. К раствору 40 мг (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1-гидрокси-10 диметиламинокарбонилокси-7, 9 окса-такс 11-ен-13-ил-3-трет.-бутоксикарбониламино-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в 1 см 3 этилацетата, поддерживаемому при температуре около 20 С, добавляют 0,0043 см 3 концентрированной соляной кислоты(36 %; d = 1,18). После выдерживания в течение полутора часов при температуре около 20 С сырую реакционную смесь очищают путем препаративной тонкослойной хроматографии (2 препаративные пластины Мерк; силикагель 60F254; 2020 см; толщина 0,5 мм), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С, получают 20 мг(2R,3S)-4-ацетокси-2-бензоилокси-5,20 эпокси-1-гидрокси-10-диметиламинокарбонилокси-7,9-окса-такс-11-ен-13-ил-3-трет.бутоксикарбониламино-3-фенил-2-гидроксипропионата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.):(2R,4S,5R)-4-Ацетокси-2-бензоилокси 5,20-эпокси-1-гидрокси-10-диметиламинокарбонилокси-7,9-окса-такс-11-ен-13-ил-3 трет.-бутоксикарбониламино-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилат может быть получен следующим образом. К раствору 100 мг (2R,4S,5R)-4-ацетокси 2-бензоилокси-5,20-эпокси-1,10 дигидрокси-7,9-окса-такс-11-ен-13-ил-3 трет.-бутоксикарбонил-амино-2-(4 метоксифенил)-4-фенил-1,3-оксазолидин-5 карбоксилата в 2 см 3 безводного тетрагидрофурана,поддерживаемому в атмосфере аргона, при температуре около-78 С добавляют 0,103 см 3 н-бутиллития (в виде 1,6 М раствора в гексане), затем спустя 5 мин 0,0253 см 3 диметиламинокарбамоилхлорида. После выдерживания в течение 30 мин при температуре около -78 С охлаждающую баню удаляют, затем сырую реакционную смесь после доведения е до температуры около 20 С разбавляют с помощью 1 см 3 дистиллированной воды. После декантации водную фазу повторно экстрагируют с помощью 2 см 3 этилацетата. Объединенные органические фазы сушат над сульфатом магния, фильтруют через фриттированное стекло и концентрируют при пониженном давлении (2,7 кПа) при температуре около 40 С. Таким образом получают 99 мг бесцветного лака, который очищают путем препаративной тонкослойной хроматографии (2 препаративные пластины Мерк; силикагель 60F254; 2020 см; толщина 1 мм; наносят в виде раствора в минимальном количестве дихлорметана), элюируя смесью метанола с дихлорметаном (в объемном соотношении 5:95). После элюирования соответствующей целевому продукту зоны с помощью смеси метанола с дихлорметаном (в объемном соотношении 15:85), фильтрации через фриттированное стекло, затем выпаривания растворителей при пониженном давлении (2,7 кПа) при температуре около 40 С, получают 43 мг(2R,4S,5R)-4-ацетокси-2-бензоилокси-5,20 эпокси-l-гидрокси-10-диметиламинокарбонилокси-7,9-окса-такс-11-ен-13-ил-3 -трет.бутоксикарбониламино-2-(4-метоксифенил)-4 фенил-1,3-оксазолидин-5-карбоксилата в виде меренги белого цвета, характеристики которого следующие. 1 Н-ЯМР-спектр (400 МГц; дейтерохлороформ;в м. д.):OCOC6H5 H ortho). Новые продукты общей формулы (I), в которой Z означает радикал общей формулы (II),проявляют значительную ингибирующую активность в отношении отклоняющейся от нормы пролиферации клеток и обладают терапевтическими свойствами, позволяющими лечить заболевания, при которых имеются патологические состояния, ассоциированные с отклоняющейся от нормы пролиферацией клеток. Патологические состояния включают отклоняющуюся от нормы пролиферацию злокачественных и незлокачественных клеток различных тканей и/или органов, к которым относятся, причем этот перечень не является исчерпывающим,мышечные, костные или соединительные ткани,кожа, головной мозг, легкие, половые органы,лимфатические или почечные системы, клетки крови или грудные клетки, печень, пищеварительный аппарат, поджелудочная железа и щитовидные или надпочечные железы. Эти патологические состояния также могут включать псориаз, твердые (солидные) опухоли, злокачественные опухоли яичника, молочной железы,головного мозга, простаты, ободочной кишки,желудка, почки или яичек, ангиосаркоматоз Капоши, холангиокарциному, хориокарциному,нейробластому, опухоль Вильмса, болезнь Ходжкина, меланомы, множественные миеломы, хронические лимфоцитарные лейкемии,острые или хронические гранулоцитарные лимфомы. Новые продукты согласно изобретению особенно пригодны для лечения рака яичника. Продукты согласно изобретению могут быть использованы для предотвращения или замедления появления или повторного появления патологических состояний или для лечения этих патологических состояний. Продукты согласно изобретению можно вводить больному в различных формах, приспособленных к выбранному пути введения, которым предпочтительно является парентеральный или пероральный путь введения. Введение парентеральным путем включает внутривенное,интраперитонеальное, внутримышечное или 27 подкожное введения. Особенно предпочтительным является интраперитонеальное или внутривенное введение. Настоящее изобретение относится также к фармацевтическим композициям, которые содержат, по крайней мере, один продукт общей формулы (I) в достаточном количестве, применимом для использования в терапии человека или животного. Композиции могут быть получены обычными способами при использовании одной (одного) или нескольких фармацевтически приемлемых добавок, носителей или эксципиентов. Приемлемые носители включают разбавители, стерильные водные среды и различные нетоксичные растворители. Предпочтительно композиции находятся в форме водных растворов или суспензий, растворов для инъекций, которые могут содержать эмульгаторы,красители, консерванты или стабилизаторы. Однако композиции также могут находиться в форме таблеток, пилюль, порошков или гранул,вводимых перорально. Выбор добавок или эксципиентов можно определять в зависимости от растворимости и химических свойств продукта, конкретного способа введения и квалификации фармацевтов. Для парентерального введения используют стерильные водные или неводные растворы или суспензии. Для приготовления неводных растворов или суспензий можно использовать природные растительные масла, как например,оливковое масло, кунжутное масло, или парафиновое масло или сложные органические эфиры для инъекций, как например, этилолеат. Водные стерильные растворы могут представлять собой раствор фармацевтически приемлемой соли, растворенной в воде. Водные растворы пригодны для внутривенного введения в соответствии с тем, где надлежащим образом установлено значение рН и где реализована изотоничность, например с помощью достаточного количества хлорида натрия или глюкозы. Стерилизацию можно осуществлять путем нагревания или любым другим способом, который не ухудшает композицию. Разумеется, что все продукты, входящие в композицию согласно изобретению, должны быть чистыми и нетоксичными в используемых количествах. Композиции могут содержать, по крайней мере, 0,01% терапевтически активного продукта. Количество активного продукта в композиции является таким, чтобы можно было прописать пригодную дозировку. Композиции предпочтительно получают таким образом, что разовая доза содержит около 0,01-1000 мг активного продукта для введения парентеральным путем. Лечение можно проводить одновременно с другими терапевтическими обработками, при которых используют антинеопластические лекарственные средства, моноклональные антитела, иммунологические терапии или рентгеноте 001533 28 рапии или модификаторы биологических ответов. Модификаторы ответов включают, не исчерпывающим образом, лимфокины и цитокины, такие как интерлейкины, интерфероны (,или ) и фактор некроза опухоли. Другие химиотерапевтические агенты, пригодные для лечения нарушений, связанных с отклоняющейся от нормы пролиферацией клеток, представляют собой, не исчерпывающим образом, алкилирующие агенты, такие как горчичные газы, как мехлоретамин, циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, как бисульфан; нитрозомочевины, как кармустин, ломустин,семустин и стрептозоцин; триазены, как дакарбазин; антиметаболиты, как аналоги фолиевой кислоты, как метотрексат; аналоги пиримидина,как флуороурацил и цитарабин; аналоги пуринов, как меркаптопурин и тиогуанин; природные продукты, такие как алкалоиды барвинка,как винбластин, винкристин и ведезин; эпиподофиллотоксины, как этопосид и тенипосид; антибиотики, как дактиномицин, даунорубицин,доксорубицин, блеомицин, пликамицин и митомицин; ферменты, как L-аспарагиназа; различные агенты, как координационные платиновые комплексы, такой как цисплатина; замещенные мочевины, такие как гидроксимочевина; производные метилгидразина, как прокарбазин; адренокортикоидные супрессоры, как митотан и аминоглютетимид; гормоны и антагонисты, как адренокортикостероиды, как преднизолон, прогестины, как гидроксипрогестеронкапроат, метоксипрогестеронацетат и мегестролацетат; эстрогены, как диэтилстильбестрол и этинилэстрадиол; антиэстрогены, как тамоксифен; андрогены, как тестостеронпропионат и флюоксиместерон. Используемыми для осуществления способов согласно изобретению дозами являются такие, которые позволяют проводить профилактическую обработку или достигать максимума терапевтического ответа. Дозы изменяются в зависимости от формы введения, конкретного выбранного продукта и характеристик, присущих излечиваемому субъекту. Обычно дозы являются такими, которые терапевтически эффективны для лечения нарушений, возникающих вследствие отклоняющейся от нормы пролиферации клеток. Продукты согласно изобретению можно вводить настолько часто, насколько это необходимо для достижения желательного терапевтического эффекта. Некоторые больные могут быстро реагировать на относительно сильные или слабые дозы, затем нуждаясь в поддерживающих слабых дозах или вообще обходясь без лекарства. Обычно слабые дозы используют в начале лечения и, если необходимо, вводят вс более и более сильные дозы вплоть до достижения оптимального эффекта. Для других больных может оказаться необходимым введение поддерживающих доз 1-8 раз в 29 день, предпочтительно 1-4 раза, в зависимости от физиологических потребностей рассматриваемого больного. Также возможно, что для некоторых больных необходимо вводить лекарство 1-2 раза в день. Для человека дозы обычно составляют 0,01-200 мг/кг. Для интраперитонеального введения дозы обычно составляют 0,1-100 мг/кг и предпочтительно 0,5-50 мг/кг и ещ более специфически 1-10 мг/кг. Для введения внутривенно дозы обычно составляют 0,1-50 мг/кг и предпочтительно 0,1-5 мг/кг и ещ более специфически 1-2 мг/кг. Разумеется, что для выбора наиболее соответствующей дозировки нужно учитывать путь введения, массу больного, общее состояние его здоровья, его возраст и все факторы, которые могут влиять на эффективность лечения. Следующий пример иллюстрирует композицию согласно изобретению. Пример. 40 мг полученного в примере 1 продукта растворяют в 1 см 3 эмульфора EL 620 и 1 см 3 этанола, затем раствор разбавляют добавлением 18 см 3 физиологической сыворотки. Композицию вводят путем перфузии в течение 1 ч путем введения в физиологическом растворе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Новые таксоиды общей формулы 30 кетонную функцию, R6 обозначает атом водорода и R и R7 вместе образуют связь. 2. Новые промежуточные продукты формулы I' у которых Z' обозначает атом водорода и либоR4 обозначает атом водорода или радикал алкокси, содержащей 1-6 атомов углерода в нормальной или разветвленной цепи; алкоксиацетил, алкильная часть которого содержит 1-6 атомов углерода в нормальной или разветвленной цепи; радикал карбамоилокси; алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода; или диалкилкарбамоилокси,каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода либо R4 и R5 вместе образуют кетонную функцию, R6 обозначает атом водорода и R и R7 вместе образуют связь. 3. Способ получения продукта по п.1, у которого либо R4 обозначает атом водорода, R6 иR7 вместе образуют кетонную функцию, a R иR5 вместе образуют связь; либо R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что восстановительный агент вводят в реакцию с соединением общей формулы в которой Z обозначает радикал общей формулы в которой Z1 обозначает радикал общей формулы в которой R1 обозначает бензоильный радикал или радикал R2-О-СО-, в котором R2 представляет собой алкильный радикал с 1-8 атомами углерода и R3 обозначает фенил или - или нафтил; и либо R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию и R иR5 вместе образуют связь, либо R4 обозначает атом водорода или радикал алкокси с 1-6 атомами углерода в нормальной или разветвленной цепи; алкоксиацетил, в котором алкил содержит 1-6 атомов углерода в нормальной или разветвленной цепи; радикал карбамоилокси; алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода; или диалкилкарбамоилокси, каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода либо же R4 и R5 вместе образуют в которой R1 и R3 имеют значения, определенные в п.1, а R8 обозначает защитную группу для гидроксильной функции, Х вместе с атомом кислорода, с которым он связан, обозначает удаляемую группу, выбранную из числа следующих радикалов: алкилсульфонил с 1-4 атомами углерода, который может быть замещен одним или несколькими атомами галогена; арилсульфонил, арильная часть которого представляет собой фенил, который может быть замещен одним или несколькими одинаковыми или разными атомами или радикалами: атомами галогена, алкильными радикалами с 1-4 атомами углерода, нитро- или трифторметильной 31 группами, с образованием соединения общей формулы в которой Z1, R, R4, R5, R6 и R7 определены выше, в виде смеси соединения общей формулы I,в которой R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, и соединения общей формулы I, в которой R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, которые разделяют обычными способами, после чего R8 заменяют атомом водорода. 4. Способ по п.3, отличающийся тем, что восстанавливающий агент выбирают из алюмогидридов и борогидридов, таких как борогидриды щелочных или щелочно-земельных металлов, в присутствии алифатических спиртов с 1-4 атомами углерода, таких как этанол, проводя реакцию при температуре от 0 до 50 С. 5. Способ по п.3, отличающийся тем, что,когда защитной группой является силильный радикал, его заменяют атомом водорода с помощью минеральной кислоты в алифатическом спирте с 1-3 атомами углерода при температуре от -10 до 20 С или с помощью комплекса фтористо-водородная кислота - триэтиламин, проводя реакцию в инертном органическом растворителе при температуре от 0 до 50 С. 6. Способ получения продукта по п.1, гдеR4 обозначает алкоксирадикал, содержащий 1-6 атомов углерода в нормальной или разветвленной цепи; алкоксиацетил, алкильная часть которого содержит 1-6 атомов углерода в нормальной или разветвленной цепи, или же R4 обозначает радикал карбамоилокси, алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода, или диалкилкарбамоилокси,каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода,R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что соединение общей формулы 32 в которой Z1 определен выше, R4 обозначает гидроксильный радикал, R6 обозначает атом водорода, a R и R7 вместе образуют связь, после чего R8 заменяют атомом водорода в условиях по п.5. 7. Способ по п.6, отличающийся тем, что перед вводом в реакцию соединения общей формулы IX, гидроксильную функцию в положении 10 металлируют с помощью гидрида,амида или алкилпроизводного щелочного металла. 8. Способ получения продукта по п.1, в котором Z представляет собой радикал общей формулы (II), R4 и R5 вместе образуют кетонную функцию, R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем,что осуществляют окисление соединения общей формулы в которой Z1 такой, как определен в п.3, R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, после чего защитная группа может быть заменена атомом водорода в условиях по п.5. 9. Способ по п.8, отличающийся тем, что окисление проводят с помощью кислорода, перутената аммония, диоксида марганца, ацетата меди или хлорхромата пиридиния. 10. Способ получения продукта по п.1, где каждый из R4, R5 и R6 является атомом водорода, a R и R7 вместе образуют связь, который может быть получен из соединения общей формулы V, в которой Z1 такой, как он определен в п.1, R4 обозначает гидроксильный радикал, каждый из R5 и R6 обозначает атом водорода, a R иR7 вместе образуют связь, путем превращения гидроксильного радикала, обозначенного R4, в дитиокарбонат с последующим восстановлением полученного при этом продукта с помощью гидрида триалкилолова и, возможно, заменой защитной группы R8 атомом водорода в условиях по п.5. 11. Способ получения продукта по п.1, отличающийся тем, что продукт по п.2 этерифицируют кислотой общей формулыR10 обозначает защитную группу для гидроксильной функции, либо R9 и R10 вместе образуют насыщенный пяти- или шестичленный гетероцикл, или производным этой кислоты с последующей заменой защитных групп атомами водорода в обычных условиях. 12. Способ получения продукта по п.2, в котором либо R4 обозначает атом водорода, R6 иR7 вместе образуют кетонную функцию, a R иR5 вместе образуют связь, либо R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что восстанавливающий агент вводят в реакцию с соединением общей формулы в которой Z1 обозначает атом водорода или защитную группу для гидроксильной функции, аX вместе с атомом кислорода, с которым он связан, обозначает удаляемую группу, выбранную из числа следующих радикалов: алкилсульфонил с 1-4 атомами углерода, который может быть замещен одним или несколькими атомами галогена; арилсульфонил, арильная часть которого представляет собой фенил, который может быть замещен одним или несколькими одинаковыми или разными атомами или радикалами: атомами галогена, алкильными радикалами с 14 атомами углерода, нитро- или трифторметильной группами, с образованием соединения общей формулы в которой Z1, R, R4, R5, R6 и R7 имеют значения,определенные выше, в виде смеси соединения общей формулы I', в которой R4 обозначает атом водорода, R6 и R7 вместе образуют кетонную функцию и R и R5 вместе образуют связь, и соединения общей формулы I', в которой R4 обозначает гидроксильный радикал, R5 обозначает атом водорода, R6 обозначает атом водорода, a R и R7 вместе образуют связь, которые разделяют обычными способами, после чего защитная группа Z1 может быть заменена атомом водорода. 13. Способ по п.12, отличающийся тем, что восстанавливающий агент выбирают из алюмогидридов и борогидридов, таких как борогидриды щелочных или щелочно-земельных металлов, в присутствии алифатических спиртов с 1-4 атомами углерода, таких как этанол, проводя реакцию при температуре от 0 до 50 С. 34 14. Способ по п.12, отличающийся тем, что когда защитной группой является силильный радикал, его заменяют атомом водорода с помощью минеральной кислоты в алифатическом спирте с 1-3 атомами углерода при температуре от -10 до 20 С или с помощью комплекса фтористо-водородная кислота - триэтиламин, проводя реакцию в инертном органическом растворителе при температуре от 0 до 50 С. 15. Способ получения продукта по п.2, гдеR4 обозначает алкоксирадикал, содержащий 1-6 атомов углерода в нормальной или разветвленной цепи; алкоксиацетил, алкильная часть которого содержит 1-6 атомов углерода в нормальной или разветвленной цепи, или же R4 обозначает радикал карбамоилокси, алкилкарбамоилокси, алкильная часть которого содержит 1-4 атома углерода, или диалкилкарбамоилокси,каждая алкильная часть которого содержит 1-4 атома углерода; R5 обозначает атом водорода;R6 обозначает атом водорода, a R и R7 вместе образуют связь, отличающийся тем, что соединение общей формулы в которой Z1 такой, как он определен выше, R4 обозначает гидроксильный радикал, R6 обозначает атом водорода, a R и R7 вместе образуют связь, после чего защитную группу, обозначаемую Z1, заменяют атомом водорода в условиях по п.14. 16. Способ по п.15, отличающийся тем, что перед вводом в реакцию соединения общей формулы IX гидроксильная функция в положении 10 может быть металлирована с помощью гидрида, амида или алкилпроизводного щелочного металла. 17. Фармацевтическая композиция, отличающаяся тем, что она содержит, по меньшей мере, один продукт по п.1, в котором Z обозначает радикал общей формулы II в комбинации с одним или несколькими фармацевтически приемлемыми разбавителями или добавками и,возможно, с одним или несколькими совместимыми и фармакологически активными соединениями.
МПК / Метки
МПК: A61P 35/00, C07D 305/14, A61K 31/335
Метки: таксоиды,их, содержащие, получение, новые, композиции, фармацевтические
Код ссылки
<a href="https://eas.patents.su/18-1533-novye-taksoidyih-poluchenie-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые таксоиды,их получение и содержащие их фармацевтические композиции</a>
Предыдущий патент: Улучшенные пестицидные матрицы с покрытием, способ их получения и содержащие их композиции
Случайный патент: Способ определения объема напитка и соответствующая система












