Новые соединения 1 – аза – 2 – алкил – 6 – арилциклоалкана, способ их получения и содержащие их фармацевтические композиции
Номер патента: 2620
Опубликовано: 27.06.2002
Авторы: Рено Оливье, Лебрэн Мари-Сесиль, Даллемань Патрик, Лестаж Пьер, Ренар Пьер, Гийон Жан, Пфеффер Брюно, Ро Сильвен
Формула / Реферат
1. Соединения формулы (I)
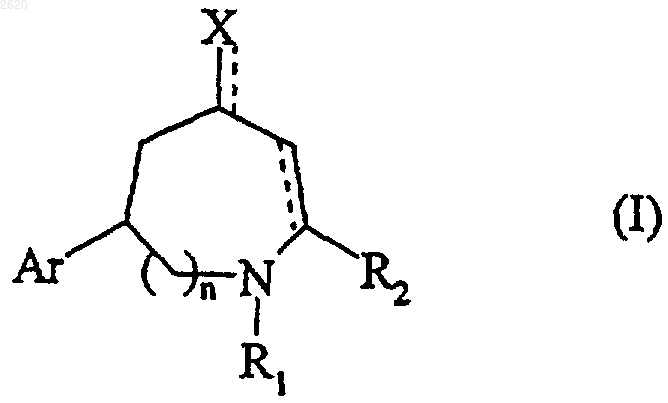
в которой
n равно 0 или 1,
R1 представляет атом водорода или арил-(C1-С6)алкильную группу, в которой алкильная часть является линейной или разветвленной, линейную или разветвленую (C1-С6)алкильную группу, линейную или разветвленную (C1-C6)ацильную группу, линейную или разветвленную (C1-C6)алкоксикарбонильную группу, арил-(C1-С6)алкоксикарбонильную группу, в которой алкокси часть является линейной или разветвленной, или трифторацетильную группу,
R2 является линейной или разветвленной (C1-C6)алкильной группой,
Х является атомом кислорода или хлора или группой OR3, SR4 или NOR5,
R3 является атомом водорода или линейной или разветвленной (C1-С6)алкильной группой, линейной или разветвленной (C1-С6)ацильной группой, линейной или разветвленной (C1-С6)алкоксикарбонильной группой или арил-(C1-C6)алкоксикарбонильной группой, в которой алкокси часть является линейной или разветвленной,
R4 является атомом водорoда или линейной, или разветвленной (C1-C6)алкильной группой, или арильной группой,
R5 является атомом водорода или линейной, или разветвленной (C1-С6)алкильной группой, необязательно замещенной одной или более одинаковыми или различными группами, выбранными из гидрокси, амино (необязательно замещенной одной или двумя линейными или разветвленными (C1-C6)алкильными группами) и линейной или разветвленной (C1-C6)алкокси,
--- является одинарной или двойной связью с учетом валентности атомов,
Аr является арильной группой или гетероарильной группой,
их изомеры и аддитивные соли с фармацевтически приемлемыми кислотами,
при условии, что соединения формулы (I) отличны от
6-метил-2-фенил-2,3-дигидро-4-пиридинона,
2-метил-6-фенил-4-пиперидинона,
N-бензил-2-(R'2)-6-фенил-4-пиперидинонов, в которых R'2 является метилом, этилом, пропилом или изопропилом, и
2-(R"2)-6-фенил-4-пиперидинолов, в которых R"2 является изопропилом или бутилом,
причем, термин "арил" означает фенил, бифенил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-С6)алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, тригалогенметила и амино (необязательно замещенного одной или более линейными или разветвленными (C1-C6)алкильными группами),
термин "гетероарил" обозначает ароматическую, моно- или бициклическую 5-12-членную группу, содержащую один, два или три гетероатома, выбранных из кислорода, азота и серы, при этом гетероарильная группа может быть необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-C6)алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, тригалогенметила и амино (необязательно замещенного одной или более линейными или разветвленными (C1-C6)алкильными группами).
2. Соединение формулы (I) по п.1, в котором n равно 0.
3. Соединение формулы (I) пo п.1, в котором Х является атомом кислорода или группой ОR3, в которой R3 имеет значения, определенные в п.1.
4. Соединение формулы (I) по п.1, в котором Х является группой NOR5, в которой R5 имеет значения, определенные в п.1.
5. Соединение формулы (I) по п.1, в котором Х является группой SR4, в которой R4 имеет значения, определенные в п.1.
6. Соединение формулы (I) по п.1, в котором Х является атомом хлора.
7. Соединение формулы (I) по п.3, в котором Х является атомом кислорода или группой ОR3, в которой R3 является атомом водорода.
8. Соединение формулы (I) по любому из пп.1-7, в котором R1 является атомом водорода.
9. Соединение формулы (I) по любому из пп.1-8, в котором Аr является необязательно замещенной фенильной группой.
10. Соединение формулы (I) по любому из пп.1-8, в котором Аr является необязательно замещенной тиенильной группой.
11. Соединение формулы (I) по любому из пп.1-8, в котором Аr является необязательно замещенной пиридильной группой.
12. Соединение формулы (I) по п.1, которое представляет (+)-2-(3-хлорфенил)-6-метил-2,3-дигидро-4(1Н)-пиридинон, его изомер и его аддитивную соль с фармацевтически приемлемой кислотой.
13. Соединение формулы (I) по п.1, которое представляет (2R*,4S*,6R*)-2-фенил-6-метил-4-пиперидинол, его изомер и его аддитивную соль с фармацевтически приемлемой кислотой.
14. Способ получения соединений формулы (I), отличающийся тем, что соединение формулы (II)
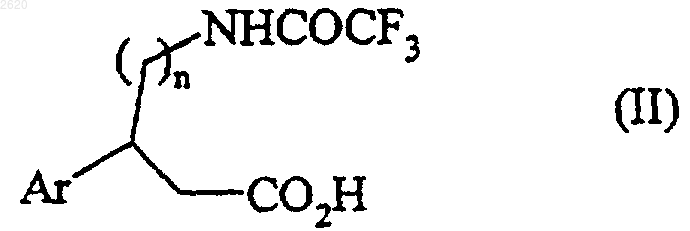
в которой Аr и n имеют значения, определенные для формулы (I),
подвергают взаимодействию с тионилхлоридом с получением соответствующего хлорангидрида кислоты, который подвергают реакции с соединением формулы (III)
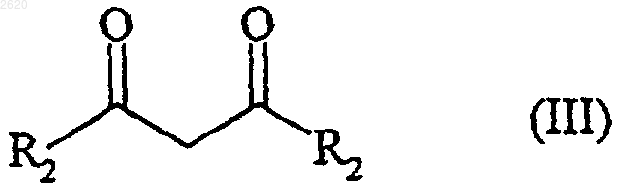
в которой R2 имеет значения, определенные для формулы (I), в присутствии трийодида самария,
с получением после снятия защиты с помощью кислоты НА соединения формулы (IV)
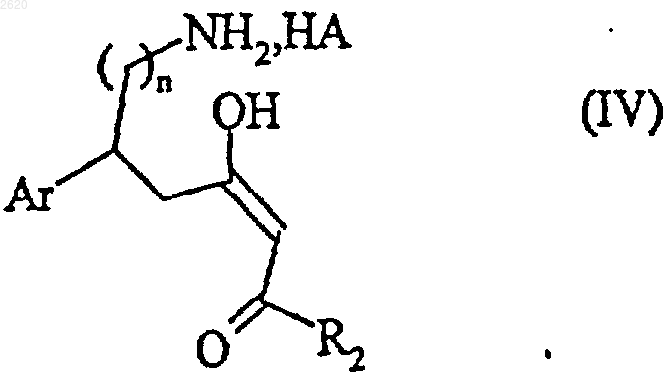
в которой Аr, n и R2 имеют значения, определенные выше, и НА является кислотой, донором протона,
соединение формулы (IV) затем подвергают реакции в основной среде с получением соединения формулы (Iа), частного случая соединения формулы (I)
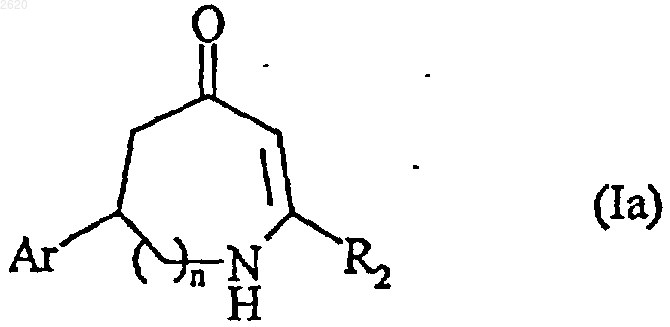
в которой Аr, n и R2 имеют значения, определенные выше,
соединение формулы (Iа) конденсируют, при желании, с соединением формулы R'1-Y, в которой R'1 представляет арил-(C1-С6)алкильную группу, в которой алкильная часть является линейной или разветвленной, линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C1-C6)ацильную группу, линейную или разветвленную (С1-С6)алкоксикарбонильную группу, арил-(C1-C6)алкоксикарбонильную группу, в которой алкокси часть является линейной или разветвленной, или трифторацетильную группу, и Y является уходящей группой, с получением соединения формулы (Ib), частного случая соединения формулы (I)
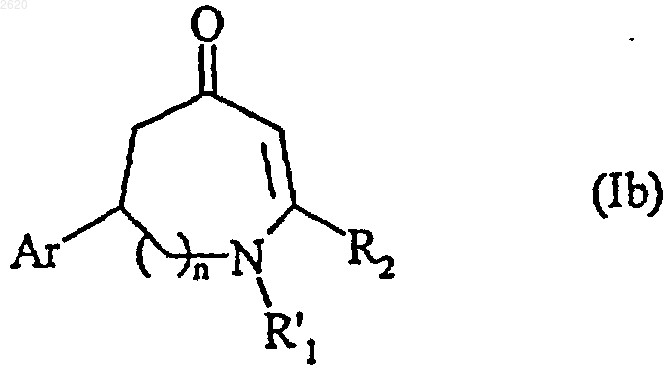
в которой Аr, n, R'1и R2 имеют значения, определенные выше,
соединение формулы (Iа) или (Ib) превращают, при желании, или частичным восстановлением с помощью подходящего восстанавливающего агента, с последующим, при желании, алкилированием, ацилированием или этерификацией гидроксильной функции с получением соединения формулы (Iс), частного случая соединения формулы (I)
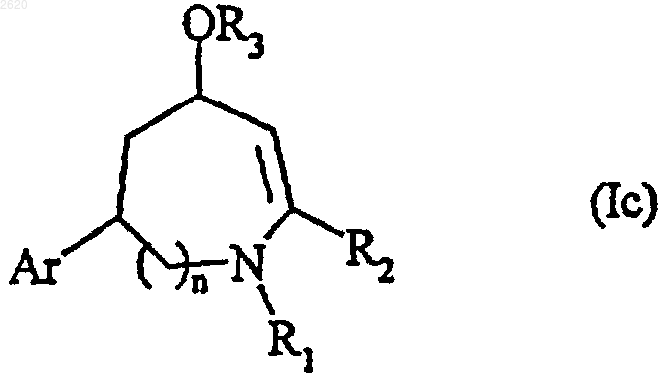
в которой Аr, n и R2 имеют значения, определенные выше, и R1 и R3 имеют значения, определенные для формулы (I),
или полным восстановлением с помощью подходящего восстанавливающего агента с получением соединения формулы (Id), частного случая соединения формулы (I)
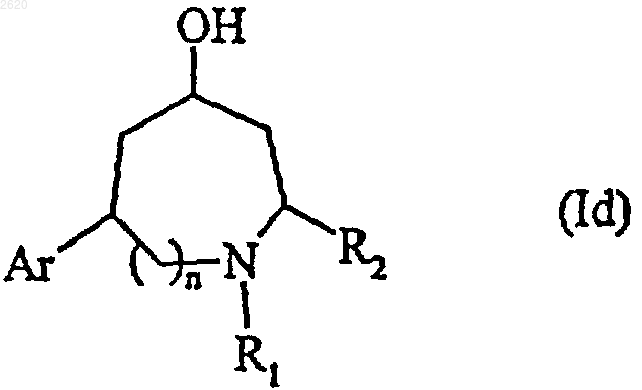
в которой Аr, n, R1и R2 имеют значения, определенные выше,
соединение формулы (Id) подвергают взаимодействию, при желании,
или с соединением формулы R'3-Y, в которой R'3 является линейной или разветвленной (C1-C6)алкильной группой, линейной или разветвленной (С1-С6)ацильной группой, линейной или разветвленной (C1-С6)алкоксикарбонильной группой или арил-(C1-С6)алкоксикарбонильной группой, в которой алкокси часть является линейной или разветвленной, и Y является уходящей группой, с получением соединения формулы (Iе), частного случая соединения формулы (I)
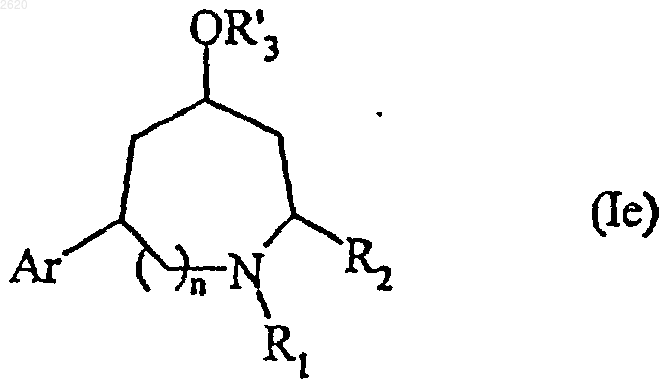
в которой Ar, n, R1, R2 и R'3 имеют значения, определенные выше,
или подвергают реакции окисления, используя подходящий окисляющий агент, с образованием оксогруппы, с получением соединения формулы (If), частного случая соединения формулы (I)
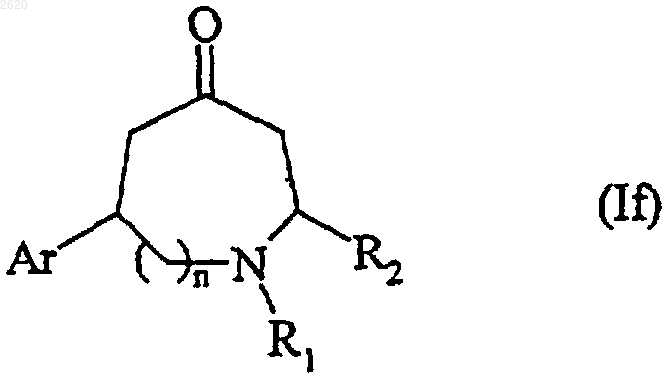
в которой Ar, n, R1 и R2 имеют значения, определенные выше,
соединения формул (Ia), (Ib) или (If) подвергают взаимодействию, при желании, или с хлорирующим агентом, таким как, например, тионилхлорид, с получением соединения формулы (1g), частного случая соединения формулы (I)
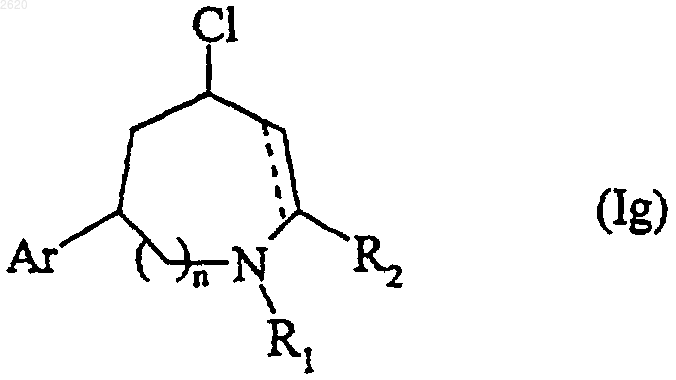
в которой Ar, n, R1 и R2 имеют значения, определенные выше, и --- имеет значения, определенные для формулы (I),
которое подвергают взаимодействию, при желании, с соединением формулы HSR4, в которой R4 имеет значения, определенные для формулы (I), с получением соединения формулы(Ih), частного случая соединения формулы (I)
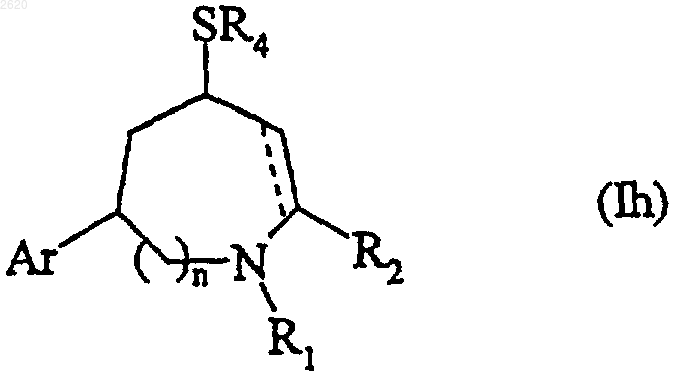
в которой Ar, n, R1, R2, R4, --- имеют значения, определенные для формулы (I),
или с соединением формулы H2N-OR5, в которой R5 имеет значения, определенные для формулы (I), с получением соединения формулы (Ii), частного случая соединения формулы (I)

в которой Аr, n, R1, R2, R5 и --- имеют значения, определенные выше,
соединения формул (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih) и (Ii), все составляющие соединения формулы (I), которые очищают, при необходимости, согласно обычным приемам очистки, разделяют, при желании, на их изомеры согласно обычным методикам разделения и превращают, при желании, в их аддитивные соли с фармацевтически приемлемыми кислотами.
15. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение по любому из пп.1-13 одно или в сочетании с одним или более инертными, нетоксичными фармацевтически приемлемыми носителями.
16. Фармацевтическая композиция по п.15, предназначенная в качестве агента, способствующего улучшению памяти и познавательной способности.
17. Фармацевтическая композиция по п.15, предназначенная в качестве антальгического агента.
Текст
1 Данное изобретение относится к новым 1 аза-2-алкил-6-арилциклоалканам, способу их получения, содержащим их фармацевтическим композициям и их использованию в качестве агентов, способствующих памяти и познавательной способности и в качестве антальгических агентов. Старение населения в результате увеличения средней продолжительности жизни приводит к значительному повышению расстройств познавательной способности, связанных с обычным церебральным старением и с патологическим церебральным старением, имеющим место при нейродегенеративных заболеваниях,таких как, например, болезнь Aпьцгеймера. Большинство веществ, используемых в настоящее время для лечения расстройств познавательной способности, связанных со старением, стимулируют центральные холинергические системы - либо непосредственно, например, как в случае ингибиторов ацетилхолинестеразы(такрин, донепезил) и холинергических агонистов (нефирацетам), либо косвенно, например,как в случае ноотропных агентов (пирацетам,прамирацетам) и церебральных вазодилататоров(винпоцетин). Помимо их свойств стимулирования познавательной способности, вещества, действующие непосредственно на центральные холинергические системы, часто имеют антальгические свойства, а также имеют и гипотермические свойства, которые могут быть нежелательны. Поэтому особую ценность представляет синтез новых соединений, которые способны противостоять расстройствам познавательной способности, связанным со старением, и/или улучшать познавательные процессы, и которые могут обладать антальгическими свойствами, не проявляя при этом гипотермической активности. 4-Гидрокси- или 4-оксозамещенные 1-аза 2-алкил-6-арилциклоалканы и 1-aзa-2-алкил-6 арилциклоалкены ранее уже были описаны в литературе (J. Org. Chem. 1988, 53, 2426; LiebigsTet. Lett. 1998, 39(3/4), 217), но никакая фармакологическая активность данных соединений описана не была. Более конкретно, данное изобретение относится к соединениям формулы (I)n равно 0 или 1,R1 представляет атом водорода или арил(C1-C6)алкильную группу, в которой алкильная часть является линейной или разветвленной,линейную или разветвленную (С 1-С 6)алкильную 2 группу, линейную или разветвленную (C1C6)ацильную группу, линейную или разветвленную (C1-C6)алкоксикарбонильную группу, арил(C1-C6)алкоксикарбонильную группу, в которой алкокси часть является линейной или разветвленной, или трифторацетильную группу,R2 является линейной или разветвленной(C1-C6)алкильной группой,Х является атомом кислорода или хлора или группой ОR3, SR4 или NOR5,R3 является атомом водорода или линейной или разветвленной (C1-C6)алкильной группой, линейной или разветвленной (C1-C6)ацильной группой, линейной или разветвленной(C1-С 6)алкоксикарбонильной группой или арил(C1-С 6)алкоксикарбонильной группой, в которой алкокси часть является линейной или разветвленной,R4 является атомом водорода или линейной или разветвленной (C1-С 6)алкильной группой или арильной группой,R5 является атомом водорода или линейной или разветвленной (C1-С 6)алкильной группой, необязательно замещенной одной или более одинаковыми или разными группами, выбранными из гидрокси, амино (необязательно замещенной одной или двумя линейными или разветвленными (C1-C6)алкильными группами) и линейной или разветвленной (C1-С 6)алкокси, является одинарной или двойной связью, с учетом валентности атомов,Аr является арильной группой или гетероарильной группой,их изомерам и аддитивным солям с фармацевтически приемлемыми кислотами,при условии, что соединения формулы (I) отличны от 6-метил-2-фенил-2,3-дигидро-4-пиридинона,2-метил-6-фенил-4-пиперидинона,N-бензил-2-(R'2)-6-фенил-4-пиперидинонов, в которых R'2 является метилом, этилом,пропилом или изопропилом, и 2-(R"2)-6-фенил-4-пиперидинолов, в которых R"2 является изопропилом или бутилом. Среди фармацевтически приемлемых солей могут быть упомянуты, не ограничиваясь ими, соляная, бромисто-водородная, серная,фосфоновая, уксусная, трифторуксусная, молочная, пировиноградная, малоновая, янтарная,глутаровая, фумаровая, винная, малеиновая,лимонная, аскорбиновая, щавелевая кислоты,метансульфокислота,бензолсульфокислота,камфорная кислота и так далее. Арильная группа понимается как являющаяся фенилом, бифенилилом, нафтилом или тетрагидронафтилом, причем каждая из этих групп необязательно замещена одной или более одинаковыми или разными группами, выбранными из галогена, линейного или разветвленного (C1-С 6)алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, тригалогенметила и 3 амино (необязательно замещенного одной или более линейными или разветвленными (C1C6)алкильными группами). Гетероарильная группа понимается как являющаяся ароматической, моно- или бициклической, 5-12-членной группой, содержащей один, два или три гетероатома, выбранных из кислорода, азота и серы, причем, имеется в виду, что гетероарильная группа может быть необязательно замещена одной или более одинаковыми или разными группами, выбранными из галогена, линейного или разветвленного (C1 С 6)алкила, гидрокси, линейного или разветвленного (C1-С 6)алкокси, тригалогенметила и амино(необязательно замещенного одной или более линейными или разветвленными(C1C6)алкильными группами). Среди гетероарильных групп могут быть упомянуты, не ограничиваясь ими, тиенил, пиридил, фурил, пирролил,имидазолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Предпочтительными соединениями формулы (I) являются соединения, в которых n равно 0. Группа X, определенная для формулы (I),предпочтительно является атомом кислорода или группой ОR3, где R3 является атомом водорода. Группа R1, определенная для формулы (I),предпочтительно является атомом водорода. Термин арил в применении к группе Аr,определенной для формулы (I), предпочтительно является необязательно замещенной фенильной группой. Термин гетероарил в применении к группе Аr, определенной для формулы (I),предпочтительно является необязательно замещенной тиенильной группой или необязательно замещенной пиридильной группой. Данное изобретение также относится к способу получения соединений формулы (I),который отличается тем, что соединение формулы (II) в которой Аr и n имеют значения, определенные для формулы (I),подвергается взаимодействию с тионилхлоридом с получением соответствующего хлорангидрида, который подвергается реакции с соединением формулы (III) в которой R2 имеет значения, определенные для формулы (I), в присутствии трийодида самария,с получением после снятия защиты с помощью кислоты НА соединения формулы (IV) в которой Аr, n и R2 имеют значения, определенные выше, и НА является кислотой, донором протона,соединение формулы (IV) далее подвергается реакции в основной среде, давая соединение формулы (Iа), частного случая соединений формулы (I)R'1 представляет арил-(C1C6)алкильную группу, в которой алкильная часть является линейной или разветвленной,линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C1C6)ацильную группу, линейную или разветвленную (C1-С 6)алкоксикарбонильную группу, арил(C1-C6)алкоксикарбонильную группу, в которой алкокси часть является линейной или разветвленной, или трифторацетильную группу и Y является уходящей группой, с получением соединения формулы (Ib), частного случая соединения формулы (I) в которой Аr, n и R2 имеют значения, определенные выше,соединение формулы (Ia) или (Ib) превращают, при желании, либо частичным восстановлением с помощью подходящего восстанавливающего агента, с последующим, при желании,алкилированием, ацилированием или этерификацией гидроксильной группы с получением соединения формулы (Iс), частного случая соединения формулы (I) в которой Аr, n и R2 имеют значения, определенные выше, и R1 и R3 имеют значения, определенные для формулы (I),либо полным восстановлением с помощью подходящего восстанавливающего агента с получением соединения формулы (Id), частного случая соединения формулы (I) в которой Аr, n и R2 имеют значения, определенные выше, соединение формулы (Id) подвергают взаимодействию, при желании,либо с соединением формулы R'3-Y, в которой R'3 является линейной или разветвленной(C1-C6)алкильной группой, линейной или разветвленной (C1-С 6)ацильной группой, линейной или разветвленной (C1-C6)алкоксикарбонильной группой или арил-(C1-C6)алкоксикарбонильной группой, в которой алкокси часть является линейной или разветвленной, и Y является уходящей группой, с получением соединения формулы (Iе), частного случая соединения формулы (I) в которой Аr, n, R1, R2 и R'3 имеют значения,определенные выше,либо подвергают реакции окисления, используя подходящий окисляющий агент, с образованием оксогруппы, с получением соединения формулы (If), частного случая соединения формулы (I) в которой Аr, n, R1 и R2 имеют значения, определенные выше, соединения формул (la), (Ib) или (If) подвергают взаимодействию, при желании,либо с хлорирующим агентом, таким как,например, тионилхлорид, с получением соединения формулы (Ig), частного случая соединения формулы (I) в которой Аr, n, R1 и R2 имеют значения, определенные выше, иимеет значения, определенные для формулы (I),которое подвергают взаимодействию, при желании, с соединением формулы HSR4, в которой R4 имеет значения, определенные для формулы (I), с получением соединения формулы(Ih), частного случая соединения формулы (I) в которой Аr, n, R1, R2, R4 иимеют значения,определенные для формулы (I),или с соединением формулы H2N-OR5, в которой R5 имеет значения, определенные для формулы (I), с получением соединения формулы (Ii), частного случая соединения формулы (I) в которой Аr, n, R1, R2, R5, иимеют значения,определенные выше,соединения формул (Ia), (Ib), (Ic), (Id), (Ie),(If), (Ig), (Ih) и (Ii), в целом составляющие соединения формулы (I), которые очищают, при необходимости, согласно обычным методикам очистки, разделяют, при желании, на их изомеры согласно обычным методикам разделения и превращают, при желании, в их аддитивные соли с фармацевтически приемлемыми кислотами. Соединение формулы (II) получают, исходя из соединения формулы (VI) Аr-СНОKeberle в описании к патенту СН 449046,соединение формулы (VII) необязательно разделяют (когда желательно получить соединение формулы (I) в энантиомерно чистой форме) по обычной методике разделения, до превращения в соединение формулы (II) взаимодействием с трифторуксусным ангидридом. В дополнение к тому, что соединения данного изобретения являются новыми, они проявляют свойства, способствующие познавательным процессам и антальгические свойства, что делает их полезными при лечении недостатка познавательной способности, связанного с церебральным старением и с нейродегенеративными патологиями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика,корсаковского психоза, деменции лобной доли и подкорковой деменции и при лечении боли. 7 Данное изобретение также относится к фармацевтическим композициям, содержащим в качестве активного ингредиента соединение формулы (I) вместе с одним или более подходящими инертными нетоксичными наполнителями или эксципиентами. Среди фармацевтических композиций данного изобретения более конкретно могут быть упомянуты те, которые подходят для перорального, парентерального(внутривенного или подкожного) и назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, инъецируемые препараты, суспензии для питья и так далее. Используемая дозировка может адаптироваться в соответствии с природой и тяжестью расстройства, способом введения и возрастом и весом пациента. Дозы варьируют от 1 до 500 мг в день для одного или более введений. Следующие примеры иллюстрируют данное изобретение, ни в коей мере не ограничивая его. ДМСО означает диметилсульфоксид. Соединение, имеющее относительную конфигурацию (2R, 4S, 6R) понимается как рацемическая смесь соединений, имеющих абсолютные конфигурации (2R, 4S, 6R) и (2S, 4R,6S). Используемые исходные материалы являются известными продуктами, или могут быть получены по известным методикам. Структуры соединений, описанных в примерах, определяли с помощью обычных приемов спектрофотометрии (инфракрасная, ЯМР,масс-спектрометрия). Пример 1. -2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Стадия А. -3-(3-Хлорфенил)аланин. Целевой продукт получают по методике,описанной в Веr. 1926, 59, 2952 и JACS 1936, 58,299, используя в качестве исходного соединения 3-хлорбензальдегид. Стадия В. -3-(3-Хлорфенил)-N-трифторацетилаланин. Трифторуксусный ангидрид (11 ммоль) добавляют к 10 ммоль соединения, полученного на предыдущей стадии. После перемешивания в течение 30 мин, растворитель и избыток реагента выпаривают при пониженном давлении с получением целевого соединения. Стадия С. Хлорангидрид-3-(3 хлорфенил)-3-трифторацетиламинопропионовой кислоты. 20 мл тионилхлорида добавляют к 10 ммоль соединения, описанного на предыдущей стадии, и смесь затем нагревают с обратным холодильником. Через 80 мин тионилхлорид выпаривают и остаток помещают в 50 мл петролейного эфира. Полученный осадок отфильтровывают и промывают петролейным эфиром. 8 Стадия D. -1-(3-Хлорфенил)-3-гидрокси-5-оксо-3-гексениламмонийхлорид. 11 ммоль самария и 16.5 ммоль йода подвергают взаимодействию в сухом ацетонитриле. После перемешивания в течение 12 ч при температуре окружающей среды раствор охлаждают до 0 С и затем добавляют хлорангидрид кислоты, полученный на предыдущей стадии (10 ммоль) и 11 ммоль пентан-2,4-диона. Реакционную смесь перемешивают в течение 6 ч при температуре 0 С. Добавляют 50 мл раствора соляной кислоты (6N), ацетонитрил выпаривают и затем добавляют 50 мл соляной кислоты (6N). Водную фазу экстрагируют эфиром. Объединенные органические фазы промывают насыщенным раствором бикарбоната натрия и затем насыщенным раствором тиосульфата натрия и затем их сушат и выпаривают. Твердый остаток берут в 50/50 смесь соляной кислоты и этанола; суспензию нагревают с обратным холодильником в течение 12 ч и затем выпаривают с получением целевого соединения в виде желтых кристаллов. Температура плавления: 97 С. ИК (КВr): ОН полоса при 3415 см-1NН 3+ полоса между 3255 и 2500 см-1 СО полоса при 1725 см-1 Стадия Е. -2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Концентрированный раствор гидроксида аммония по каплям добавляют к 10 ммоль соединения, полученного на предыдущей стадии,растворенного в дихлорметане, до тех пор, пока рН смеси не станет 10. Водную фазу экстрагируют дихлорметаном; объединенные органические фазы затем сушат и выпаривают. Масляный остаток берут в 50 мл эфира. Отфильтровыванием полученного осадка получают целевой продукт в виде бежевых кристаллов. Температура плавления: 163 С Элементный микроанализ:%N рассчитано 65.02 5.91 6.32 найдено 64.89 6.02 6.25 Пример 2. -N-Метил-2-(3-хлорфенил)-6 метил-2,3-дигидро-4-(1 Н)-пиридинон. 1,6 М раствор н-бутиллития в гексане (11 ммоль) по каплям добавляют при температуре-78 С к 10 ммоль соединения, описанного в примере 1, растворенного в тетрагидрофуране. После перемешивания в течение получаса при температуре -78 С добавляют 11 ммоль йодметана. Перемешивание продолжают при температуре -78 С в течение еще 30 мин и затем при температуре окружающей среды в течение 1 ч. После гидролиза с помощью добавления насыщенного раствора гидрокарбоната натрия водную фазу экстрагируют дихлорметаном. Объединенные органические фазы промывают, су 9 шат и выпаривают с получением целевого соединения в виде оранжевых кристаллов. Температура плавления: 82 С Элементный микроанализ:%N рассчитано 57.39 6.23 3.94 найдено 57.82 6.21 3.78 Пример 3. Фумарат (2R,4S,6R)-Nметил-2-(3-хлорфенил)-6-метил-4-пиперидинола. Стадия A. (2R,4S,6R)-N-Метил-2-(3 хлорфенил)-6-метил-4-пиперидинол. 80 ммоль боргидрида натрия добавляют к раствору 10 ммоль соединения, описанного в примере 2, в этаноле при температуре 0 С. После перемешивания в течение 12 ч при температуре окружающей среды этанол выпаривают и белый остаток помещают в дихлорметан. Органическую фазу промывают 2N раствором соляной кислоты; объединенные водные фазы затем насыщают хлоридом натрия, подщелачивают концентрированным раствором гидроксида аммония и затем экстрагируют дихлорметаном. Объединенные органические фазы сушат и затем выпаривают с получением целевого продукта в виде бесцветного масла. Стадия В. Фумарат (2R,4S,6R)-Nметил-2-(3-хлорфенил)-6-метил-4-пиперидинола. 11 ммоль фумаровой кислоты добавляют к раствору 10 ммоль соединения, полученного на предыдущей стадии, в изопропаноле. После перемешивания в течение 1 ч при температуре окружающей среды растворители выпаривают с получением целевого продукта в виде белых кристаллов. Температура плавления: 182 С. Пример 4. (2R,4S,6R)-N-Метил-2-(3 хлорфенил)-4-метокси-6-метилпиперидин. 10 ммоль соединения, описанного в примере 3, добавляют при температуре 0 С к 11 ммоль гидрида натрия, суспендированного в тетрагидрофуране. После перемешивания в течение получаса при 0 С добавляют 100 ммоль йодметана. Перемешивание затем продолжают при температуре окружающей среды в течение 2 дней; раствор затем гидролизуют добавлением 1N раствора соляной кислоты. Водную фазу экстрагируют дихлорметаном; объединенные органические фазы затем промывают, сушат и выпаривают с получением целевого продукта в виде бледно-желтого масла. Пример 5. (2R,4S)-N-Метил-2-(3-хлорфенил)-6-метил-1,2,3,4-тетрагидро-4-пиридинол. К раствору 10 ммоль соединения, описанного в примере 2, в этаноле добавляют 10 ммоль гептагидрата СеСl3 и затем порциями добавляют 10 ммоль боргидрида натрия при 0 С. После перемешивания в течение получаса при 0 С и затем в течение 1 ч при температуре окружаю 002620 10 щей среды этанол выпаривают и белый остаток помещают в дихлорметан. Органическую фазу промывают 2N раствором соляной кислоты; объединенные водные фазы затем насыщают хлоридом натрия, подщелачивают с помощью концентрированного раствора гидроксида аммония и затем экстрагируют дихлорметаном. Объединенные органические фазы сушат и затем выпаривают с получением целевого продукта. Пример 6. Гидрохлорид (2R,4S,6R)-2(3-хлорфенил)-6-метил-4-пиперидинола. Стадия А. (2R,4S,6R)-2-(3-Хлорфенил)6-метил-4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, описанного в примере 1. Стадия В. Гидрохлорид (2R,4S,6R)-2(3-хлорфенил)-6-метил-4-пиперидинола. 11 мл 1 М раствора эфирной НСl добавляют к раствору 10 ммоль соединения, полученного на предыдущей стадии, в изопропаноле. После перемешивания в течение 1 ч при температуре окружающей среды растворители выпаривают с получением целевого продукта в виде бежевых кристаллов. Температура плавления: 248 С Элементный микроанализ:%N рассчитано 45.82 6.53 5.34 найдено 45.54 6.62 5.41 Пример 7. Оксалат (2R,4S,6R)-2-(3 хлорфенил)-6-метил-4-пиперидинола. 11 ммоль щавелевой кислоты добавляют к раствору 10 ммоль соединения, полученного на стадии А примера 6, в изопропаноле. После перемешивания в течение 1 ч при температуре окружающей среды растворители выпаривают с получением целевого продукта в виде кристаллов. Температура плавления: 224 С Пример 8. Гидрохлорид (2R,4S,6R)-Nтрифторацетил-2-(3-хлорфенил)-6-метил-4 пиперидинола. Стадия А. -N-Трифторацетил-2-(3-хлорфенил)-6-метил-2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 2, исходя из соединения, описанного в примере 1 и заменяя йодметан трифторацетилхлоридом. Стадия В. Гидрохлорид (2R,4S,6R)-Nтрифторацетил-2-(3-хлорфенил)-6-метил-4 пиперидинола. Исходя из соединения, полученного на предыдущей стадии, целевой продукт получают по методике примера 6. Пример 9. (2R,4S)-2-(3-Хлорфенил)-6 метил-1,2,3,4-тетрагидро-4-пиридинол. Целевой продукт получают по методике примера 5, исходя из соединения, описанного в примере 1.(2R,4S,6R)-2-(3-хлорфенил)-6-метил-4-оксо 3,4-дигидро-1(2 Н)-пиридинкарбоновой кислоты. Целевой продукт получают по методике примера 2, исходя из соединения, описанного в примере 1, и заменяя йодметан бензилхлорформиатом. Пример 11. Бензиловый эфир (2R,4S)-2(3-хлорфенил)-4-гидрокси-6-метил-3,4-дигидро 1(2 Н)-пиридинкарбоновой кислоты. Целевой продукт получают по методике примера 5, исходя из соединения, описанного в примере 10. Пример 12. Оксалат (2R,6R)-2-(3 хлорфенил)-6-метил-4-пиперидинона. Стадия А. (2R,6R)-2-(3-Хлорфенил)-6 метил-4-пиперидинон. 20 ммоль ортофосфорной кислоты и затем 20 ммоль хромового ангидрида добавляют по каплям к раствору 10 ммоль соединения, описанного на стадии А примера 6, в ацетоне при температуре 0 С. После перемешивания в течение 1 ч при 0 С и затем в течение 12 ч при температуре окружающей среды ацетон выпаривают; остаток помещают в 20 мл льда и затем подщелачивают(рН 10) с помощью 28% раствора гидроксида аммония. Раствор затем экстрагируют дихлорметаном. Объединенные органические фазы сушат и выпаривают с получением целевого продукта. Стадия В. Оксалат (2R,6R)-2-(3-хлорфенил)-6-метил-4-пиперидинона. Целевой продукт получают по методике примера 7, исходя из соединения, полученного на предыдущей стадии. Температура плавления: 183 С Пример 13. Фумарат (2R,4R,6R)-4 хлор-2-(3-хлорфенил)-6-метилпиперидина. Стадия A. (2R,4R,6 В)-4-Хлор-2-(3 хлорфенил)-6-метилпиперидин. К раствору 10 ммоль соединения, описанного на стадии А примера 12, в хлороформе добавляют 20 ммоль триэтиламина с последующим добавлением 20 ммоль тионилхлорида. Реакционную смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения смеси до температуры окружающей среды органическую фазу промывают; объединенные водные фазы подщелачивают с помощью добавления раствора гидроксида аммония и затем экстрагируют дихлорметаном и объединенные органические фазы промывают, сушат и выпаривают с получением целевого продукта. Стадия В. Фумарат (2R,4R,6R)-4-хлор 2-(3-хлорфенил)-6-метилпиперидина. Целевой продукт получают по методике стадии В примера 3, исходя из соединения, полученного на предыдущей стадии. Температура плавления: 203 С Пример 14. Фумарат (2R,4S,6R)-2-(3 хлорфенил)-6-метил-4-фенилтиопиперидина. 12 Стадия А. (2R,4S,6R)-2-(3-Хлорфенил)6-метил-4-фенилтиопиперидин. К 30 ммоль гидрида натрия, суспендированного в диметилформамиде, добавляют 13 ммоль тиофенола при 0 С и затем, после перемешивания в течение 30 мин, 10 ммоль соединения, описанного на стадии А примера 13. Реакционную смесь затем нагревают с обратным холодильником в течение 2 ч и раствор впоследствии гидролизуют добавлением 1N раствора соляной кислоты. Водную фазу промывают эфиром и затем подщелачивают добавлением раствора гидроксида аммония и экстрагируют эфиром. Объединенные органические фазы промывают водой, сушат и затем выпаривают с получением целевого продукта. Стадия В. Фумарат (2R,4S,6R)-2-(3 хлорфенил)-6-метилфенилтиопиперидина. Целевой продукт получают по методике стадии В примера 3, исходя из соединения, полученного на предыдущей стадии. Температура плавления: 181 С. Пример 15. -2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридиноноксим. 40 ммоль гидрохлорида гидроксиламина и 40 ммоль ацетата натрия добавляют к раствору 10 ммоль соединения, описанного в примере 1, в этаноле, и реакционную смесь затем нагревают с обратным холодильником в течение 2 ч. После гидролиза водную фазу экстрагируют дихлорметаном; объединенные органические фазы затем промывают, сушат и выпаривают с получением целевого продукта в виде оранжевых кристаллов. Температура плавления: 88 С (Z/E смесь 20/80) Элементный микроанализ:%N рассчитано 60.89 5.54 11.83 найдено 60.95 5.62 11.15 Пример 16. (2R)-2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Стадия А. -N-Фенилацетил-3-(3-хлорфенил)аланин. К раствору 10 ммоль -3-(3-хлорфенил)-аланина, описанного на стадии А примера 1, в смеси 3/1 вода/ацетон добавляют 24 ммоль триэтиламина и затем 13 ммоль фенилацетилхлорида при -5 С. После перемешивания в течение 2 ч при -5 С и затем в течение 3 ч при температуре окружающей среды раствор фильтруют; ацетон выпаривают, водную фазу промывают эфиром и затем подкисляют до рН 1 и экстрагируют этилацетатом. Объединенные органические фазы сушат и выпаривают. Полученный остаток промывают гексаном, осаждают в минимальном количестве эфира и затем фильтруют с получением целевого продукта. Стадия В. Гидрохлорид (3R)-3-(3-хлорфенил)аланина. 13 Пенициллинамидазу (20 мг) вводят в 10 ммоль соединения, описанного на предыдущей стадии, в насыщенном растворе бикарбоната натрия при 37 С после доведения рН до 7,4-7,6 с использованием концентрированной соляной кислоты. После перемешивания в течение 24 ч при рН от 7,5 до 8 смесь доводят до рН 1 с помощью соляной кислоты. Водную фазу промывают эфиром и затем выпаривают. Полученное белое твердое вещество помещают в этанол и затем фильтруют. Фильтрат затем выпаривают с получением целевого продукта. Стадия С. (2R)-2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике стадий В-Е примера 1, исходя из соединения,полученного на предыдущей стадии. Способность вращать плоскость поляризации: []20D = -176.92 (с=0.0039; СН 3 ОН) Пример 17. Оксалат (2R,4S,6R)-2-(3 хлорфенил)-6-метил-4-пиперидинола. Стадия А. (2R,4S,6R)-2-(3-Хлорфенил)-6 метил-4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, полученного в примере 16. Стадия В. Оксалат (2R,4S,6R)-2-(3 хлорфенил)-6-метил-4-пиперидинола. Целевой продукт получают по методике примера 7, исходя из соединения, полученного на предыдущей стадии. Способность вращать плоскость поляризации: []20D = -9.58 (с=0.0024; Н 2 О) Пример 18. (2S)-2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Стадия А. Гидрохлорид (3S)-3-(3-хлорфенил)аланина. Пенициллинамидазу (20 мг) вводят в 10 ммоль соединения, описанного на стадии А примера 16, в насыщенном растворе бикарбоната натрия при 37 С после доведения рН до 7,47,6 с использованием концентрированной соляной кислоты. После перемешивания в течение 24 ч при рН от 7,5 до 8 смесь доводят до рН 1 с помощью соляной кислоты. Водную фазу экстрагируют эфиром и затем полученные органические фазы объединяют, сушат и выпаривают. Остаток помещают в гексан и осаждают, используя минимальное количество эфира. После фильтрования полученное твердое вещество нагревают при 50 С в течение 24 ч в 2N соляной кислоте с получением целевого продукта. Стадия В. (2S)-2-(3-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике стадий В-Е примера 1, исходя из соединения,полученного на предыдущей стадии. Способность вращать плоскость поляризации: []20D = +179.7 (с=0.080; СН 3 ОН) Пример 19. Фумарат (2S,4R,6S)-2-(3 хлорфенил)-6-метил-4-пиперидинола. 14 Стадия А. (2S,4R,6S)-2-(3-Хлорфенил)-6 метил-4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, полученного в примере 18. Стадия В. Фумарат (2S,4R,6S)-2-(3 хлорфенил)-6-метил-4-пиперидинола. Целевой продукт получают по методике стадии В примера 3, исходя из соединения, полученного на предыдущей стадии. Способность вращать плоскость поляризации: []20D = +9.8 (с=0.067; ДМСО) Пример 20. Оксалат (2S,6S)-2-(3-хлорфенил)-6-метил-4-пиперидинона. Целевой продукт получают по методике примера 12, исходя из соединения, полученного на стадии А примера 19. Температура плавления: 184 С Способность вращать плоскость поляризации: []20D = -24.2 (с=0.065; ДМСО) Пример 21. Гидрохлорид (2R,4S,6R)-2 фенил-6-метил-4-пиперидинола. Стадия А. -2-Фенил-6-метил-2,3-дигидро-1H-4-пиридинон. Целевой продукт получают по методике примера 1, исходя из бензальдегида. Желтые кристаллы. Температура плавления: 156 С Элементный микроанализ:%N рассчитано 76.97 7.00 7.18 найдено 76.69 7.11 7.39 Стадия В. (2R,4S,6R)-2-Фенил-6-метил 4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, полученного на предыдущей стадии. Стадия С. Гидрохлорид (2R,4S,6R)-2 фенил-6-метил-4-пиперидинола. Целевой продукт получают по методике стадии В примера 6, исходя из соединения, полученного на предыдущей стадии. Бежевые кристаллы. Температура плавления: 236 С Элементный микроанализ:%N рассчитано 63.29 7.97 6.15 найдено 62.95 8.09 5.99 Пример 22. Оксалат (2R,4S,6R)-2 фенил-6-метил-4-пиперидинола. Целевой продукт получают по методике примера 7, исходя из соединения, описанного на стадии В примера 21. Пример 23. -2-(2-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из 2-хлорбензальдегида. Бежевые кристаллы. Температура плавления: 98 С Пример 24. -2-(4-Хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из 4-хлорбензальдегида. Бежевые кристаллы Температура плавления: 104 С Элементный микроанализ:%N рассчитано 65.02 5.91 6.32 найдено 64.90 5.92 6.31 Пример 25. -6-(4-Хлорфенил)-2-метил 1,5,6,7-тетрагидро-4 Н-азепин-4-он. 4-Амино-3-(4-хлорфенил)масляную кислоту (баклофен) подвергают операциям, описанным на стадиях В-Е примера 1, с получением целевого продукта в виде кремовых кристаллов. Температура плавления: 118 С Элементный микроанализ:%N рассчитано 66.24 5.99 5.84 найдено 66.25 5.84 6.17 Пример 26. -2-(3,4-Дихлорфенил)-6 метил-2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из 3,4-дихлорбензальдегида. Бежевые кристаллы Температура плавления: 163 С Элементный микроанализ:%N рассчитано 56.27 4.33 5.47 найдено 56.27 4.33 5.45 Пример 27. -2-(3-Метоксифенил)-6 метил-2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из 3-метоксибензальдегида. Бежевые кристаллы. Температура плавления: 98 С Элементный микроанализ:%N рассчитано 71.87 6.96 6.45 найдено 71.82 6.66 6.72 Пример 28. -6-Метил-2-(2-тиенил)-2,3 дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из тиофен-2-карбоксальдегида. Бежевые кристаллы. Температура плавления: 114 С Элементный микроанализ: 16 Пример 29. Гидрохлорид (2R,4S,6R)-6 метил-2-(2-тиенил)-4-пиперидинола. Целевой продукт получают по методике примера 6, исходя из соединения, описанного в примере 28. Бежевые кристаллы. Температура плавления: 248 С Элементный микроанализ:%N рассчитано 51.38 6.90 5.99 найдено 51.16 7.01 5.79 Пример 30. -6-Метил-2-(3-тиенил)-2,3 дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из тиофен-3-карбоксальдегида. Коричневые кристаллы. Температура плавления: 103 С Элементный микроанализ:%N рассчитано 62.15 5.74 7.25 найдено 62.27 5.82 7.20 Пример 31. Гидрохлорид (2R,4S,6R)-6 метил-2-(3-тиенил)-4-пиперидинола. Стадия A. (2R,4S,6R)-6-Метил-2-(3 тиенил)-4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, описанного в примере 30. Стадия В. Гидрохлорид (2R,4S,6R)-6 метил-2-(3-тиенил)-4-пиперидинола. Целевой продукт получают по методике стадии В примера 6, исходя из соединения, описанного на предыдущей стадии. Бежевые кристаллы. Температура плавления: 241 С Элементный микроанализ:%N рассчитано 51.38 6.90 5.99 найдено 51.26 6.81 5.81 Пример 32. Оксалат (2R,4S,6R)-6 метил-2-(3-тиенил)-4-пиперидинола. Целевой продукт получают по методике примера 1, исходя из соединения, описанного на стадии А примера 31. Температура плавления: 246 С Пример 33. Оксалат (2R,6R)-6-метил-2(3-тиенил)-4-пиперидинона. Целевой продукт получают по методике примера 12, исходя из соединения, описанного на стадии А примера 31. Температура плавления: 184 С Пример 34. -2-(4-Бром-2-тиенил)-6 метил-2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из 4-бромтиофен-2-карбоксальдегида. Бежевые кристаллы. Температура плавления: 170 С Пример 35. -2-(4-Хлор-2-тиенил)-6 метил-2,3-дигидро-4(1H)-пиридинон. Целевой продукт получают по методике примера 1, исходя из 4-хлортиофен-2 карбоксальдегида. Бежевые кристаллы. Температура плавления: 141 С Элементный микроанализ:%N рассчитано 52.75 4.43 6.15 найдено 52.52 4.49 6.01 Пример 36. -6-Метил-2-(3-пиридил)-2,3 дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из никотинальдегида. Желтые кристаллы. Температура плавления: 141 С Элементный микроанализ:%N рассчитано 52.75 4.43 6.15 найдено 52.52 4.49 6.01 Пример 37. Диоксалат (2R,4S,6R)-6 метил-2-(3-пиридил)-4-пиперидинола. Стадия A. (2R,4S,6R)-6-Метил-2-(3 пиридил)-4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, описанного в примере 36. Стадия В. Диоксалат (2R,4S,6R)-6 метил-2-(3-пиридил)-4-пиперидинола. 22 ммоль щавелевой кислоты добавляют к раствору 10 ммоль соединения, полученного на предыдущей стадии, в изопропаноле. После перемешивания в течение 1 ч при температуре окружающей среды растворители выпаривают с получением целевого соединения в виде кристаллов. Элементный микроанализ:%N рассчитано 48.39 5.41 7.52 найдено 48.26 5.46 7.55 Пример 38. -N-Ацетил-6-метил-2-(3 пиридил)-2,3-дигидро-4(1H)-пиридинон. Целевой продукт получают по методике примера 2, исходя из соединения, описанного в примере 36, и заменяя йодметан ацетилхлоридом. Пример 39. (2R,4S,6R)-N-Ацетил-6 метил-2-(3-пиридил)-4-пиперидинол. Целевой продукт получают по методике стадии А примера 3, исходя из соединения, описанного в примере 38. Пример 40. (2R,4R,6R)-N-Ацетил-4 хлор-6-метил-2-(3-пиридил)-пиперидин. 18 Стадия А. (2R,4S,6R)-N-Ацетил-6 метил-2-(3-пиридил)-4-пиперидинон. Целевой продукт получают по методике стадии А примера 12, исходя из соединения,описанного в примере 39. Стадия В. (2R,4R,6R)-N-Ацетил-4 хлор-6-метил-2-(3-пиридил)пиперидин. Целевой продукт получают по методике стадии А примера 13, исходя из соединения,описанного на предыдущей стадии. Пример 41. (2R,4S,6R)-N-Ацетил-6 метил-4-метилтио-2-(3-пиридил)пиперидин. Целевой продукт получают по методике стадии А примера 14, исходя из соединения,описанного в примере 40 и метантиола. Пример 42. (2R,4S,6R)-N-Ацетил-4 метоксикарбонилокси-6-метил-2-(3-пиридил)пиперидин. Целевой продукт получают по методике примера 4, исходя из соединения, описанного в примере 39, и заменяя йодметан метилхлорформиатом. Пример 43. -N-Бензил-6-пропил-2-(3 пиридил)-2,3-дигидро-4(1 Н)-пиридинон. Стадия А. -6-Пропил-2-(3-пиридил)-2,3 дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 1, исходя из никотинальдегида и нонан-4,6-диона. Стадия В. -N-Бензил-6-пропил-2-(3 пиридил)-2,3-дигидро-4(1 Н)-пиридинон. Целевой продукт получают по методике примера 2, исходя из соединения, описанного на предыдущей стадии, и заменяя йодметан бензилхлоридом. Пример 44. -N-Бензил-6-пропил-2-(3 пиридил)-2,3-дигидро-4(1 Н)-пиридинон-O-[2(диметиламино)этил]оксим. Целевой продукт получают по методике примера 15, исходя из соединения, описанного в примере 43, и заменяя гидрохлорид гидроксиламина 2-(аминоокси)-N,N-диметилэтанамином. Фармакологические исследования соединений изобретения Пример 45. Локомоция на крысах Wistar. Действие соединений изобретения на двигательную активность оценивают на взрослых самцах крыс Wistar. Крысам Wistar (180-200 г) вводят (внутрибрюшинно) исследуемые соединения или их носители (2 мл/кг). Через тридцать минут после фармакологической обработки животных помещают в камеру открытое поле (404060 см), расположенную в экспериментальной комнате с контролируемой окружающей средой. Двигательную активность животных оценивают с помощью измерения расстояния, которое они проходят (см) в течение более 30 мин в камере открытое поле. Измерения проводят автоматически с помощью системы видео-патрулирования, присоединенной к микрокомпьютеру (система Videotrack, View-Point, 19France). Результаты выражают в средних величинах плюс-минус стандартная ошибка, а сравнения внутри групп проводят с помощью подходящего однофакторного дисперсионного анализа, с последующим, когда это соответствует,тестом Даннета. Результаты показывают, что соединения данного изобретения не оказывают какого-либо влияния на локомоцию крыс при дозе 10 мг/кг или ниже. Пример 46. Температура тела у мышейNMRI. Действие соединений данного изобретения на температуру тела оценивают на взрослых самцах мышей NMRI. Ректальную температуру мышей (18-20 г) измеряют непосредственно перед фармакологической обработкой (внутрибрюшинное введение) исследуемыми соединениями или их носителями (20 мг/кг). Мышей помещают в отдельные клетки (101010 см) и их ректальную температуру измеряют каждые 30 мин в течение 2 ч после обработки. Величины выражали в средних значениях (С) плюсминус стандартная ошибка, сравнения внутри групп осуществляли с помощью подходящего однофакторного дисперсионного анализа, с последующим, когда это соответствует, тестом Даннета. Результаты показывают, что соединения данного изобретения не оказывают гипотермического действия при дозе 20 мг/кг или ниже. Пример 47. Абдоминальные сокращения,вызываемые фенил-п-бензохиноном (PBQ) у мышей NMRI. Внутрибрюшинное введение спиртового раствора PBQ вызывает брюшные судороги у мышей (SIEGMUND et al., Рrос. Sоc. Ехр. Biol.,1957, 95, 729-731). Судороги характеризуются повторяющимися сокращениями брюшной мускулатуры, сопровождающимися вытягиванием задних конечностей. Большинство анальгетиков являются антагонистами таких брюшных судорог (COLLIER et al., Brit. J. Pharmacol. Chem.,1968, 32, 295-310). В момент времени t=0 мин животных взвешивают и исследуемое соединение вводят внутрибрюшинно. Группе контрольных животных дают растворитель, используемый для данных соединений. В момент времениt=30 мин спиртовой раствор PBQ (0,2%) вводят внутрибрюшинно в объеме 0,25 мл/мышь. Немедленно после введения PBQ или ФБХ животных помещают в цилиндры из плексигласа(L=19,5 см, вн. диаметр = 5 см). В момент времени от t=35 до t=45 мин наблюдают реакцию животных, и проводящий эксперимент сотрудник отмечает общее количество брюшных судорог у каждого животного. В представленной ниже таблице дан процент ингибирования количества брюшных судорог, измеренного у контрольных животных, при активной дозе исследуемого соединения. Полученные результаты 20 показывают, что соединения данного изобретения обладают антальгическими свойствами. Пример 1 25 26 30 Пример 48. Распознавание себе подобных у крыс Wistar. Первоначально описанный в 1982 г. авторами THOR и HOLLOWAY, (J. Соmр. Physiol,1982, 96, 1000-1006), тест на распознавание себе подобных впоследствии был предложен разными авторами (DANTZER et al., Psychopharmacology, 1987, 91, 363-368; PERIO et al., Psychopharmacology, 1989, 97, 262-268) для исследования мнемоузнавательного действия новых соединений. Тест основывается на естественном выражении обонятельной памяти крыс и их естественной тенденции забывать и позволяет оценивать степень запоминания через узнавание молодых животных того же рода взрослыми крысами. Молодых крыс (21 день), отобранных в произвольном порядке, помещают на 5 мин в клетку, содержащую взрослых крыс. С помощью видеоустройства сотрудник, проводящий эксперимент, наблюдает за распознаванием себе подобных взрослых крыс и измеряет его общую продолжительность. Молодых крыс затем удаляют из клетки со взрослыми крысами и помещают в их собственную клетку до второго знакомства. Взрослым крысам дают тестируемое соединение внутрибрюшинно и через 2 ч к ним снова запускают молодых крыс (5 мин). Затем снова наблюдают за распознаванием себе подобных и измеряют его продолжительность. В представленной ниже таблице дано различие (T2-T1), выраженное в секундах, между временем узнавания во время 2 встреч. Полученные результаты показывают, что соединения данного изобретения значительно улучшают запоминание, даже при низких дозах. Пример 1 21 24 36Wistar. Тест на распознавание объектов у крысWistar первоначально был разработан авторамиENNACEUR и DELACOUR (Behav. Brain Res.,1988, 31, 47-59). Данный тест основывается на спонтанной исследовательской активности животных и имеет характеристики эпизодической памяти человека. Данный тест на память очень чувствителен к старению (SCALI et al., Eur. J.Biochem. Behav., 1996, 53(2), 277-283) и основан на различиях между исследованием 2 объектов практически одинаковой формы - одного знакомого, а другого нового. До тестирования животным дают привыкнуть к окружающей обстановке (огороженное место без объекта). В ходе первой сессии крыс помещают (3 мин) в огороженное пространство, в котором находятся 2 идентичных предмета. Длительность изучения измеряют для каждого объекта. В ходе второй сессии(3 мин), через 24 ч, 1 из 2 объектов заменяют новым объектом. Длительность изучения измеряют для каждого объекта. Критерием оценки является разница, дельта, выраженная в секундах, между временем изучения нового объекта и знакомого объекта в ходе второй сессии. Контрольные животные, которым предварительно внутрибрюшинно или перорально был введен носитель за 30 мин до каждой сессии, изучают знакомый и новый объект идентичным образом,что показывает, что объект, введенный ранее,был забыт. Животные, получившие соединение,способствующее мнемоузнаванию, преимущественно исследуют новый объект, что указывает на то, что объект, введенный ранее, был узнан. В представленной ниже таблице даны различия. Дельта, выраженная в секундах, между временем изучения 2 объектов. Полученные результаты показывают, что соединения изобретения значительно улучшают запоминание, даже при очень низких дозах, при введении не только внутрибрюшинно, но и перорально. Пример 1 18 22 24 27 Введение ВБ ПО ПО ВБ ПО ВБ ВБ Пример 50. Фармацевтическая композиция. Композиция для препаративной формы в виде 1000 таблеток, каждая из которых содержит 10 мг активного ингредиента: Соединение примера 1 Гидроксипропилцеллюлоза Пшеничный крахмал Лактоза Стеарат магния Тальк ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)n равно 0 или 1,R1 представляет атом водорода или арил(C1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной,линейную или разветвленую (C1-С 6)алкильную группу, линейную или разветвленную (C1C6)ацильную группу, линейную или разветвленную (C1-C6)алкоксикарбонильную группу, арил(C1-С 6)алкоксикарбонильную группу, в которой алкокси часть является линейной или разветвленной, или трифторацетильную группу,R2 является линейной или разветвленной(C1-C6)алкильной группой,Х является атомом кислорода или хлора или группой OR3, SR4 или NOR5,R3 является атомом водорода или линейной или разветвленной (C1-С 6)алкильной группой, линейной или разветвленной (C1 С 6)ацильной группой, линейной или разветвленной (C1-С 6)алкоксикарбонильной группой или арил-(C1-C6)алкоксикарбонильной группой,в которой алкокси часть является линейной или разветвленной,R4 является атомом водорoда или линейной, или разветвленной (C1-C6)алкильной группой, или арильной группой,R5 является атомом водорода или линейной, или разветвленной (C1-С 6)алкильной группой, необязательно замещенной одной или более одинаковыми или различными группами,выбранными из гидрокси, амино (необязательно замещенной одной или двумя линейными или разветвленными (C1-C6)алкильными группами) и линейной или разветвленной (C1-C6)алкокси, является одинарной или двойной связью с учетом валентности атомов,Аr является арильной группой или гетероарильной группой,их изомеры и аддитивные соли с фармацевтически приемлемыми кислотами,при условии, что соединения формулы (I) отличны от 6-метил-2-фенил-2,3-дигидро-4-пиридинона,2-метил-6-фенил-4-пиперидинона,N-бензил-2-(R'2)-6-фенил-4-пиперидинонов, в которых R'2 является метилом, этилом,пропилом или изопропилом, и 2-(R"2)-6-фенил-4-пиперидинолов, в которых R"2 является изопропилом или бутилом,причем, термин арил означает фенил,бифенил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена одной или более одинаковыми или различными груп 23 пами, выбранными из галогена, линейного или разветвленного (C1-С 6)алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, тригалогенметила и амино (необязательно замещенного одной или более линейными или разветвленными (C1-C6)алкильными группами),термин гетероарил обозначает ароматическую, моно- или бициклическую 5-12 членную группу, содержащую один, два или три гетероатома, выбранных из кислорода, азота и серы, при этом гетероарильная группа может быть необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена, линейного или разветвленного (C1-C6)алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, тригалогенметила и амино (необязательно замещенного одной или более линейными или разветвленными(C1-C6)алкильными группами). 2. Соединение формулы (I) по п.1, в котором n равно 0. 3. Соединение формулы (I) пo п.1, в котором Х является атомом кислорода или группой ОR3, в которой R3 имеет значения, определенные в п.1. 4. Соединение формулы (I) по п.1, в котором Х является группой NOR5, в которой R5 имеет значения, определенные в п.1. 5. Соединение формулы (I) по п.1, в котором Х является группой SR4, в которой R4 имеет значения, определенные в п.1. 6. Соединение формулы (I) по п.1, в котором Х является атомом хлора. 7. Соединение формулы (I) по п.3, в котором Х является атомом кислорода или группой ОR3, в которой R3 является атомом водорода. 8. Соединение формулы (I) по любому из пп.1-7, в котором R1 является атомом водорода. 9. Соединение формулы (I) по любому из пп.1-8, в котором Аr является необязательно замещенной фенильной группой. 10. Соединение формулы (I) по любому из пп.1-8, в котором Аr является необязательно замещенной тиенильной группой. 11. Соединение формулы (I) по любому из пп.1-8, в котором Аr является необязательно замещенной пиридильной группой. 12. Соединение формулы (I) по п.1, которое представляет -2-(3-хлорфенил)-6-метил 2,3-дигидро-4(1 Н)-пиридинон, его изомер и его аддитивную соль с фармацевтически приемлемой кислотой. 13. Соединение формулы (I) по п.1, которое представляет (2R,4S,6R)-2-фенил-6 метил-4-пиперидинол, его изомер и его аддитивную соль с фармацевтически приемлемой кислотой. 14. Способ получения соединений формулы (I), отличающийся тем, что соединение формулы (II) в которой Аr и n имеют значения, определенные для формулы (I),подвергают взаимодействию с тионилхлоридом с получением соответствующего хлорангидрида кислоты, который подвергают реакции с соединением формулы (III) в которой R2 имеет значения, определенные для формулы (I), в присутствии трийодида самария,с получением после снятия защиты с помощью кислоты НА соединения формулы (IV) в которой Аr, n и R2 имеют значения, определенные выше, и НА является кислотой, донором протона,соединение формулы (IV) затем подвергают реакции в основной среде с получением соединения формулы (Iа), частного случая соединения формулы (I)R'1 представляет арил-(C1 С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной,линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C1C6)ацильную группу, линейную или разветвленную (С 1-С 6)алкоксикарбонильную группу, арил(C1-C6)алкоксикарбонильную группу, в которой алкокси часть является линейной или разветвленной, или трифторацетильную группу, и Y является уходящей группой, с получением соединения формулы (Ib), частного случая соединения формулы (I) в которой Аr, n, R'1 и R2 имеют значения, определенные выше,соединение формулы (Iа) или (Ib) превращают, при желании, или частичным восстановлением с помощью подходящего восстанавливающего агента, с последующим, при желании, 25 алкилированием, ацилированием или этерификацией гидроксильной функции с получением соединения формулы (Iс), частного случая соединения формулы (I) в которой Аr, n и R2 имеют значения, определенные выше, и R1 и R3 имеют значения,определенные для формулы (I),или полным восстановлением с помощью подходящего восстанавливающего агента с получением соединения формулы (Id), частного случая соединения формулы (I) в которой Аr, n, R1 и R2 имеют значения, определенные выше,соединение формулы (Id) подвергают взаимодействию, при желании,или с соединением формулы R'3-Y, в которой R'3 является линейной или разветвленной(C1-C6)алкильной группой, линейной или разветвленной (С 1-С 6)ацильной группой, линейной или разветвленной (C1-С 6)алкоксикарбонильной группой или арил-(C1-С 6)алкоксикарбонильной группой, в которой алкокси часть является линейной или разветвленной, и Y является уходящей группой, с получением соединения формулы (Iе), частного случая соединения формулы (I) в которой Ar, n, R1, R2 и R'3 имеют значения,определенные выше,или подвергают реакции окисления, используя подходящий окисляющий агент, с образованием оксогруппы, с получением соединения формулы (If), частного случая соединения формулы (I)(1g), частного случая соединения формулы (I) в которой Ar, n, R1 и R2 имеют значения, определенные выше, иимеет значения, определенные для формулы (I),которое подвергают взаимодействию, при желании, с соединением формулы HSR4, в которой R4 имеет значения, определенные для формулы (I), с получением соединения формулы(Ih), частного случая соединения формулы (I) в которой Ar, n, R1, R2, R4,имеют значения,определенные для формулы (I),или с соединением формулы H2N-OR5, в которой R5 имеет значения, определенные для формулы (I), с получением соединения формулы (Ii), частного случая соединения формулы (I) в которой Аr, n, R1, R2, R5 иимеют значения,определенные выше,соединения формул (Ia), (Ib), (Ic), (Id), (Ie),(If), (Ig), (Ih) и (Ii), все составляющие соединения формулы (I), которые очищают, при необходимости, согласно обычным приемам очистки, разделяют, при желании, на их изомеры согласно обычным методикам разделения и превращают, при желании, в их аддитивные соли с фармацевтически приемлемыми кислотами. 15. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение по любому из пп.1-13 одно или в сочетании с одним или более инертными, нетоксичными фармацевтически приемлемыми носителями. 16. Фармацевтическая композиция по п.15,предназначенная в качестве агента, способствующего улучшению памяти и познавательной способности. 17. Фармацевтическая композиция по п.15,предназначенная в качестве антальгического агента.
МПК / Метки
МПК: A61K 31/44, C07D 211/38, A61P 25/04
Метки: новые, содержащие, способ, аза, арилциклоалкана, получения, алкил, фармацевтические, композиции, соединения
Код ссылки
<a href="https://eas.patents.su/14-2620-novye-soedineniya-1-aza-2-alkil-6-arilcikloalkana-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения 1 – аза – 2 – алкил – 6 – арилциклоалкана, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Бициклические бензамиды производных 3- или 4-замещенного 4- (аминометил) пиперидина с гастрокинетическими свойствами
Следующий патент: Соединения пиперидиниламинометил трифторметил циклических эфиров в качестве антагонистов вещества р
Случайный патент: Способ и устройство для заполнения емкости












