Рекомбинантная псевдоаденовирусная наночастица, фармацевтическая композиция для профилактики или терапии гриппа (варианты), способ профилактики или терапии гриппа
Номер патента: 16517
Опубликовано: 30.05.2012
Авторы: Грибова Ирина Юрьевна, Рутовская Марина Владимировна, Логунов Денис Юрьевич, Васильев Лев Анатольевич, Саакян Седа Аветиковна, Седова Елена Сергеевна, Гинцбург Александр Леонидович, Иванова Татьяна Ильинична, Шмаров Максим Михайлович, Народицкий Борис Савельевич, Тутыхина Ирина Леонидовна, Тиллиб Сергей Владимирович
Формула / Реферат
1. Рекомбинантная псевдоаденовирусная наночастица, несущая экспрессирующую кассету, содержащую нуклеотидную последовательность, которая кодирует однодоменное мини-антитело, связывающееся с вирусом гриппа типа А или типа В.
2. Псевдоаденовирусная наночастица по п.1, причем вирус гриппа типа А характеризуется антигенной формулой H1N(1-9).
3. Псевдоаденовирусная наночастица по п.1, причем вирус гриппа типа А характеризуется антигенной формулой H3N(1-9).
4. Псевдоаденовирусная наночастица по п.1, причем вирус гриппа типа А характеризуется антигенной формулой H5N(1-9).
5. Фармацевтическая композиция для профилактики или терапии гриппа, представляющая собой суспензию рекомбинантных псевдоаденовирусных наночастиц по любому из пп.1-4 в фармацевтически приемлемом растворителе или наполнителе.
6. Фармацевтическая композиция по п.5, в которой указанные псевдоаденовирусные наночастицы несут экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные мини-антитела одного, двух или трех видов.
7. Фармацевтическая композиция для профилактики или терапии гриппа, представляющая собой суспензию рекомбинантных псевдоаденовирусных наночастиц по любому из пп.1-4 и однодоменных мини-антител, связывающихся с вирусом гриппа того же типа и антигенной формулы (тех же типов и антигенных формул), что и однодоменные мини-антитела, кодируемые экспрессирующими кассетами, содержащимися в указанных рекомбинантных псевдоаденовирусных наночастицах, в фармацевтически приемлемом растворителе или наполнителе.
8. Фармацевтическая композиция по п.7, содержащая однодоменные мини-антитела одного, двух или трех видов и рекомбинантные псевдоаденовирусные наночастицы по любому из пп.1-4, несущие экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные мини-антитела того же вида (тех же видов).
9. Способ профилактики или терапии гриппа, предусматривающий введение нуждающемуся в этом пациенту профилактически или терапевтически эффективного количества фармацевтической композиции по любому из пп.5-8.
10. Способ по п.9, в котором указанную фармацевтическую композицию вводят интраназально.
11. Способ по п.10, в котором интраназальное введение осуществляют в форме капель.
12. Способ по п.10, в котором интраназальное введение осуществляют в форме спрея.
Текст
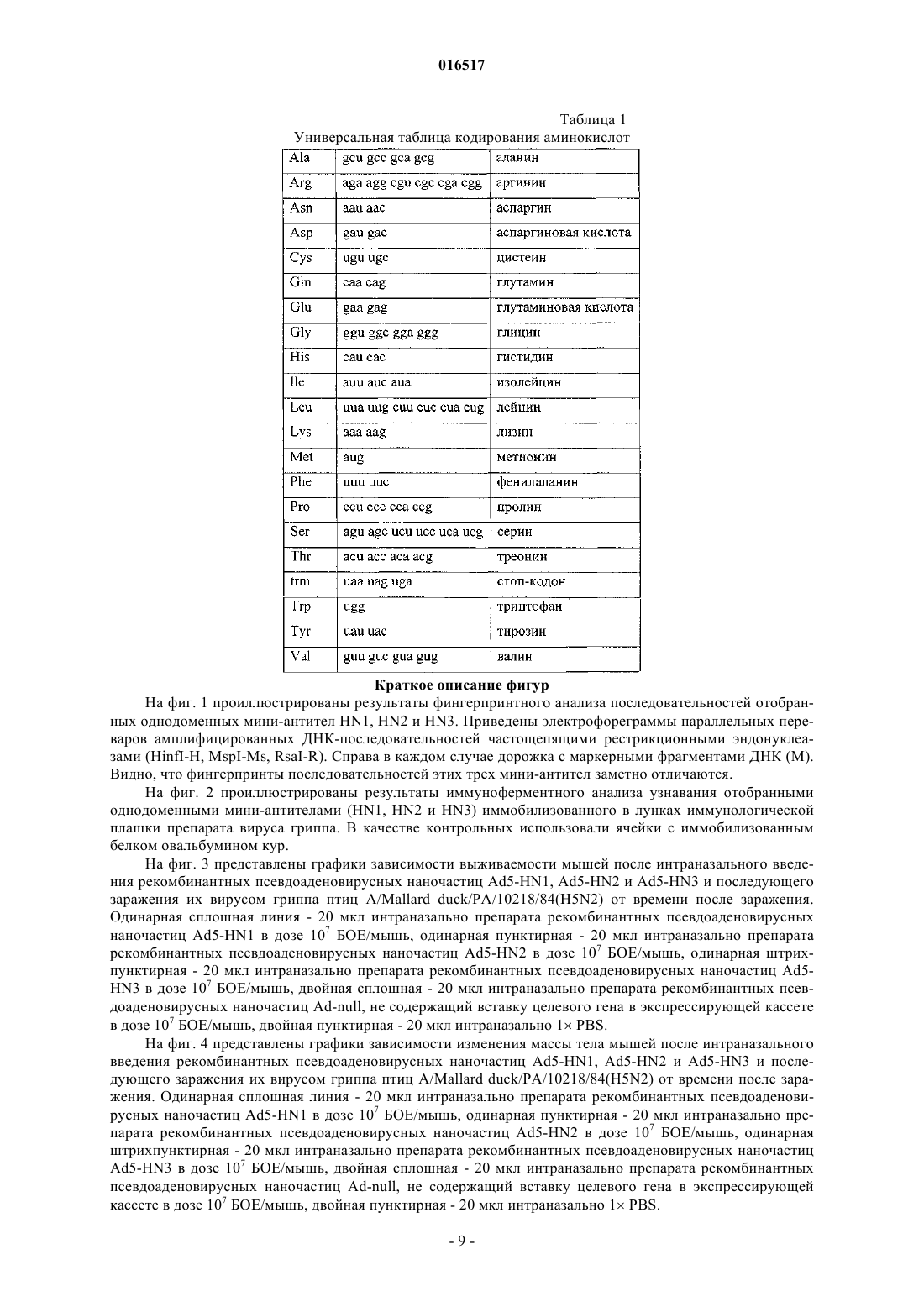
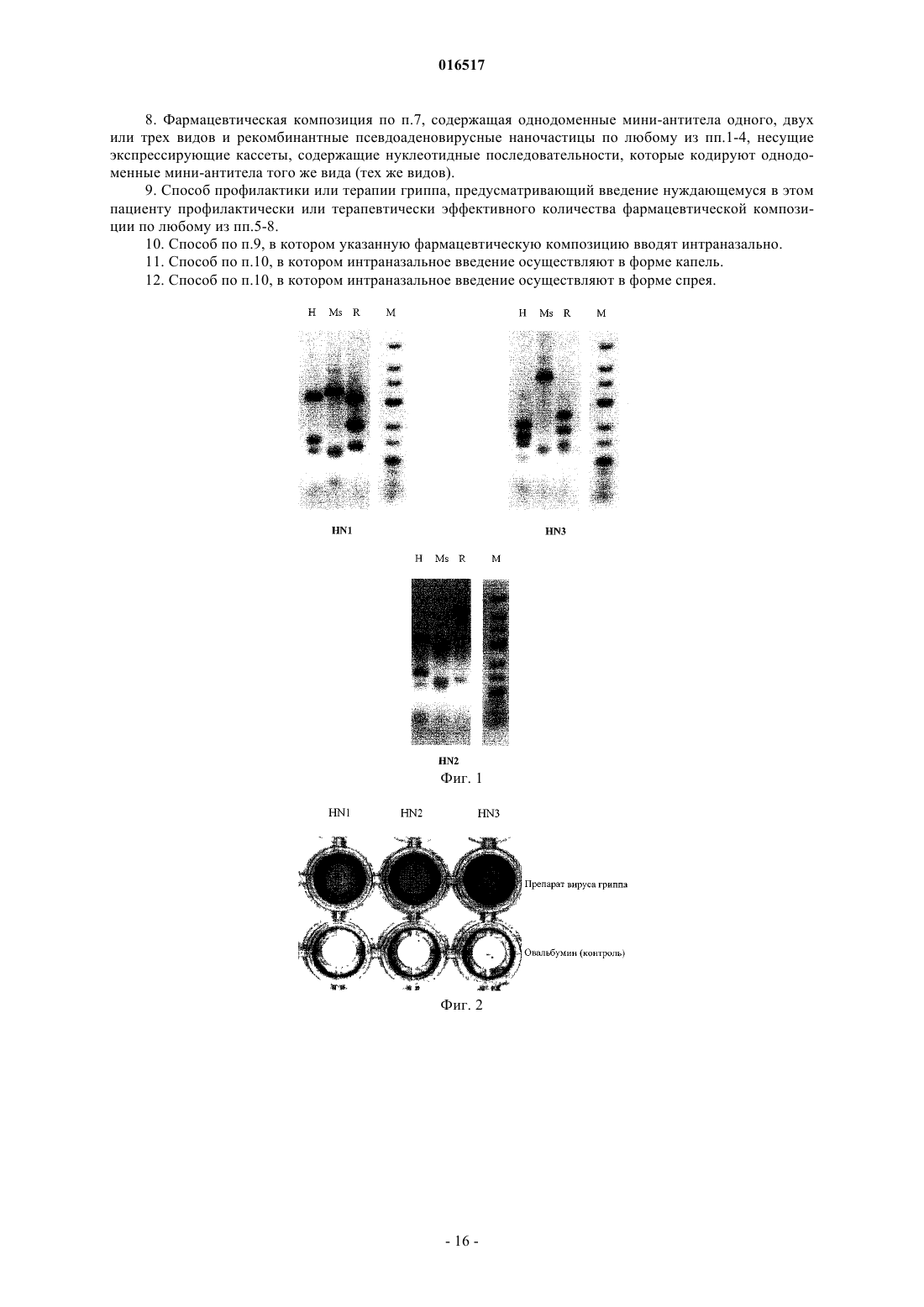
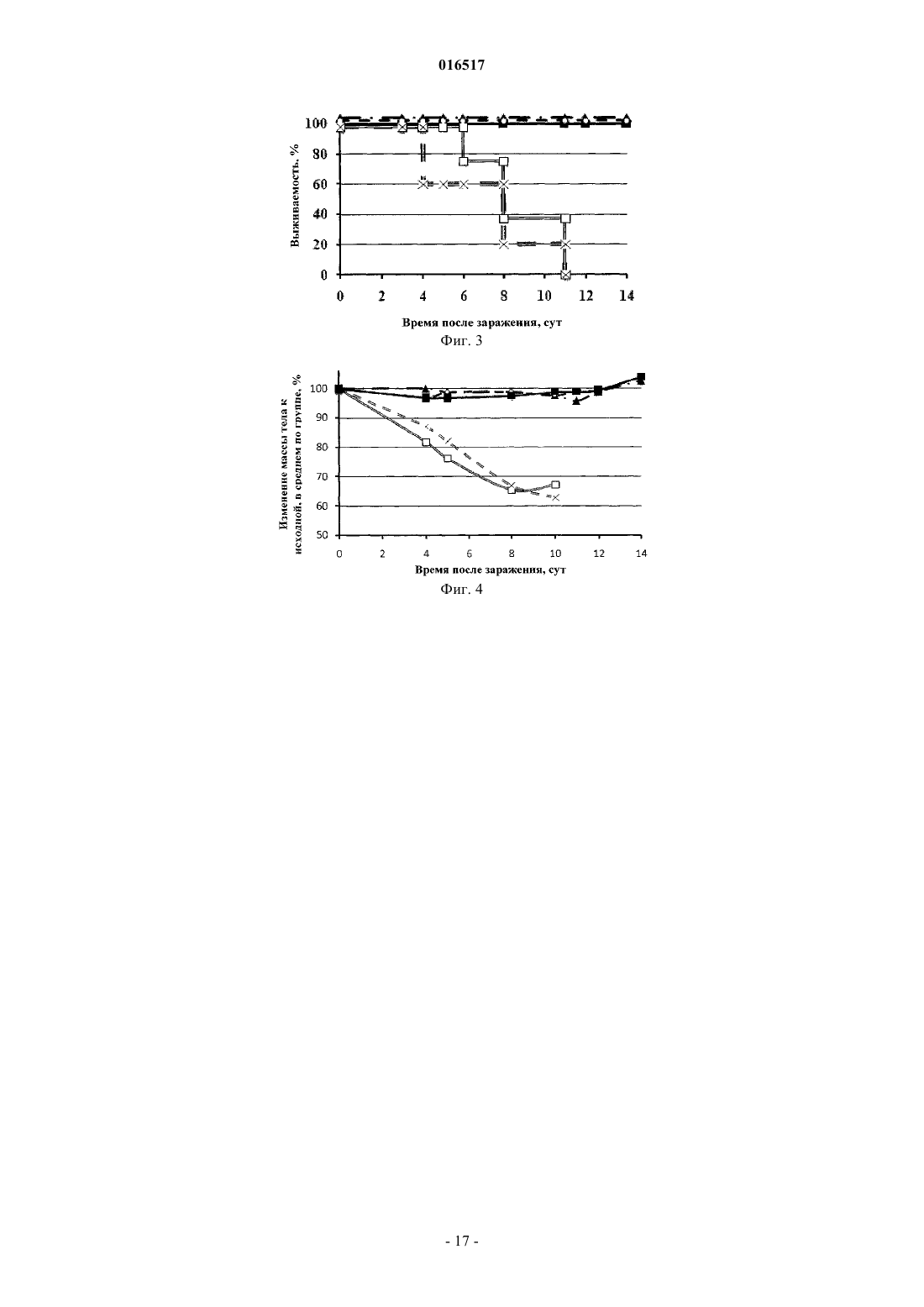
РЕКОМБИНАНТНАЯ ПСЕВДОАДЕНОВИРУСНАЯ НАНОЧАСТИЦА,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА (ВАРИАНТЫ), СПОСОБ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА Тутыхина Ирина Леонидовна,Васильев Лев Анатольевич, Логунов Денис Юрьевич, Саакян Седа Аветиковна, Шмаров Максим Михайлович, Рутовская Марина Владимировна, Седова Елена Сергеевна, Грибова Ирина Юрьевна Настоящее изобретение относится к рекомбинантной псевдоаденовирусной наночастице, несущей экспрессирующую кассету, содержащую нуклеотидную последовательность, которая кодирует однодоменное мини-антитело, связывающееся с вирусом гриппа, и применимой для профилактики и терапии гриппа. Предусмотрены фармацевтические композиции как содержащие только указанные псевдоаденовирусные наночастицы, так и содержащие дополнительно кодируемые ими однодоменные мини-антитела против вируса гриппа, например, относящегося к типу А (и характеризующегося антигенными формулами H1N(1-9), H3N(1-9) или H5N(1-9 или к типу В. Композиции предпочтительно вводят интраназально.(71)(73) Заявитель и патентовладелец: ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ"НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ЭПИДЕМИОЛОГИИ И МИКРОБИОЛОГИИ ИМЕНИ ПОЧЕТНОГО АКАДЕМИКА Н.Ф. ГАМАЛЕИ" МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ (RU) 016517 Область техники настоящего изобретения Настоящее изобретение относится к использованию однодоменных мини-антител ("наноантител") в комбинации с аденовирусной системой внутриклеточной доставки и экспрессии кодирующих наноантитела генов для профилактики и терапии инфекционных заболеваний, в частности гриппа. Получаемые наноантитела также могут быть использованы для диагностики соответствующих инфекционных заболеваний. Предшествующий уровень техники настоящего изобретения Вирус гриппа является опасным инфекционным агентом, вызывающим острые респираторные заболевания, течение которых может происходить с различными легочными (например, пневмония) и внелегочными осложнениями, некоторые из которых могут привести к смертельному исходу. Клиническая картина заболевания может варьировать в зависимости от штамма вируса гриппа, возраста и иммунного статуса хозяина. В среднем, в мире за сезон вирусом гриппа бывает вызвано 3-5 млн случаев острых респираторных заболеваний (из них 200-500 тыс. случаев со смертельным исходом) (World Health Organization, April, 2009). Кроме сезонных эпидемий, вирус гриппа может вызывать также пандемии. Например,пандемии вируса гриппа были зарегистрированы в 1918, 1957 и 1968 гг. (Деева Э.Г. Грипп. На пороге пандемии. М., ГЭОТАР-Медиа, 2008). Во время пандемий вирусом было поражено более 50% человеческой популяции. В результате пандемии вируса гриппа 1918 г. погибло около 100 млн человек (JohnsonBulletin of the History of Medicine 76:105-115). Одной из причин возникновения пандемий вируса гриппа является его высокая антигенная изменчивость (антигенный шифт и антигенный дрейф), затрагивающая мажорные белки его оболочки - гемагглютинин и нейраминидазу, на которые происходит формирование иммунного ответа. Поэтому зачастую в организме хозяина нет антител, способных нейтрализовать новый (с измененными антигенами) вирус гриппа, т.е. предсуществующий иммунитет отсутствует. Эффективным способом снижения уровня заболеваемости вирусом гриппа является иммунизация. Однако современные препараты, предназначенные для иммунизации, зачастую содержат антигенный материал(или набор антигенов), отличный от набора антигенов циркулирующего штамма вируса гриппа. Достижение соответствия между антигенным набором вакцинного препарата и циркулирующего штамма является затруднительным по нескольким причинам. Во-первых, вирусы гриппа постоянно претерпевают изменение: каждые 3-5 лет преобладающий штамм вируса гриппа заменяется разновидностью, которая подверглась достаточному антигенному дрейфу, чтобы иметь способность уклониться от уже сформировавшегося иммунного ответа. В связи с этим набор антигенов, входящих в состав вакцинного препарата,должен меняться ежегодно в соответствии с данными о циркулирующих штаммах вируса гриппа, регистрируемыми Всемирной организацией здравоохранения (ВОЗ). Во-вторых, время, затрачиваемое на изготовление новой вакцины, составляет около 6 месяцев. То есть, чтобы иметь достаточное количество вакцины к началу периода сезонной иммунизации против вируса гриппа, необходимо начать работу над ней еще в предыдущем сезоне. Зачастую предварительные оценки ВОЗ, касающиеся штамма, который будет циркулировать в следующем сезоне, оказываются неточными, а сроки получения новой актуальной вакцины оказываются слишком жесткими. Таким образом, в условиях возникновения новых пандемий проведение стандартных профилактических мероприятий, направленных на индукцию протективного адаптивного иммунитета, может быть неэффективным. В таких случаях целесообразно применять иные профилактические или терапевтические средства. В настоящее время на фармацевтическом рынке присутствуют 2 класса препаратов, предназначенных для профилактики и лечения заболеваний, вызванных вирусом гриппа: препараты-блокаторы ионных каналов (направлены на белок вируса гриппа М 2) и препараты-ингибиторы нейраминидазы вируса гриппа. Ремантадин и амантадин функционируют посредством блокирования активности белка М 2 образовывать ионные каналы, что является ключевым моментом на ранней фазе цикла размножения вируса, и предотвращают тем самым проникновение вируса гриппа внутрь клетки. Оба препарата эффективны при лечении заболеваний, вызванных вирусом гриппа типа А, но характеризуются побочными эффектами со стороны ЦНС, печени и почек. Также в экспериментах in vitro и in vivo было показано, что штаммы вируса гриппа, ранее чувствительные к этим препаратам, могут впоследствии стать к ним резистентными. Озельтамивир и цанамивир являются блокаторами действия нейраминидазы, предотвращая выход новых вирусных частиц из инфицированной клетки и их распространение в организме. Озельтамивир является ингибитором нейраминидаз вирусов гриппа типа А и В. Цанамивир характеризуется сходным действием,но меньшей эффективностью при пероральном приеме. Хотя озельтамивир приводит к облегчению общей симптоматики заболевания, количество носовых выделений (насморк) не уменьшается. Таким образом, можно заключить, что в настоящее время нет терапевтических или профилактических препаратов против вируса гриппа, сочетающих в себе эффективность и безопасность. Недавние вспышки заболеваний, вызванные вирусом гриппа типа A H5N1 ("chicken") и H1N1 ("swine") подтверждают высокую потребность в подобных препаратах. Одним из наиболее быстрых и эффективных способов защиты от патогенов, наряду с антибиотикотерапией, является пассивная иммунизация. Этот способ заключается в том, что вместо антигена хозяину вводят антитела, полученные к протективному антигену патогена, которые способны защищать организм-1 016517 хозяина от развития инфекции. Специальные строго контролируемые исследования показали, что отчетливое противовирусное и терапевтическое действие при гриппе оказывают лишь донорская сыворотка и противогриппозный гамма-глобулин, содержащие высокие титры антител. Гамма-глобулин необходимо назначать по возможности в более ранние сроки внутримышечно: детям по 0,15-0,2 мг/кг, взрослым по 6 мг. В тех же дозах можно использовать нормальный (плацентарный) гамма-глобулин и сывороточный полиглобулин(А.П. Казанцев, В.С. Матковский. Справочник по инфекционным болезням. М., "Медицина", 1979, с. 49). До конца 1960-х гг. в СССР сравнительно широко применялась гипериммунная лошадиная сыворотка для профилактики и лечения гриппа. Интраназальное (внутриносовое) вдувание сухой сыворотки,смешанной с норсульфазолом, создавало опасность массовой аллергизации населения, и от этого препарата пришлось отказаться. Но сама идея использования противовирусных антител, содержащихся в крови людей, остается и реализуется в виде препаратов крови, называемых в настоящее время иммуноглобулинами. В России выпускаются 2 вида иммуноглобулинов. Один из плацентарной и абортной крови называется "иммуноглобулин человека нормальный", содержит все антитела, которые присущи женщинам детородного возраста в период сбора крови в определенной местности. Но его, к сожалению, не удается полностью освободить от некоторых гормонов и других биологически активных веществ. Этого недостатка лишен другой препарат - "специфический противогриппозный иммуноглобулин" из крови доноров,специально и многократно вакцинированных против гриппа. Помимо противогриппозных антител, специально стимулируемых вакцинацией, в донорском иммуноглобулине содержатся антитела ко многим широко распространенным инфекционным агентам, в том числе и к респираторным вирусам. Иммуноглобулины обычно вводят внутримышечно. С целью профилактики гриппа нормальный иммуноглобулин человека (специально отобранные серии с высоким титром антител) применяют также интраназально в виде капель или в мелкодисперсном виде (спрее). До недавнего времени иммуноглобулины человеческой крови считались полностью безопасными, не обладающими каким-либо нежелательным побочным действием на организм человека. В последние годы появились сообщения о формировании антител к введенному человеческому белку, особенно при использовании плацентарного препарата, в котором происходит агрегация белковых молекул. Высказываются также опасения, что у часто болеющих детей возможна аллергизация организма. Все эти опасения требуют строгой обоснованности показаний к применению иммуноглобулина, особенно плацентарного. Только высокая вероятность развития заболевания у человека, находившегося в контакте с источником инфекции, оправдывает профилактическую инъекцию препарата. При этом не следует забывать о возможности побочных реакций, клиническое проявление которых разнообразно: от небольшого повышения температуры тела или появления сыпи до развития тяжелого состояния и анафилактического шока. В определенной степени преодолеть эти недостатки позволяет использование иммуноглобулинов,полученных генно-инженерными методами. В недавних работах было показано, что для защиты животных от действия белка-токсина сибирской язвы (anthrax) можно использовать scFv - моноклональные одноцепочечные антитела (которые могут быть легко гуманизированы). Однако применение scFv для лечения людей имеет существенные ограничения. scFv имеют короткое время полужизни в организме,которое составляет только 10,4 мин. Более того, даже стабилизированные путем конъюгирования с ПЭГ антитела не являются достаточно эффективными. Они имеют увеличенное до 108 ч время полужизни, но для достижения эффективности действия, равной 60%, необходимо использование экстремально высоких доз препарата [Mabry R., Infect Immun. 2005; 73:8362-8368]. Использование специфических антител к вирусу гриппа для профилактики и лечения вызываемых им заболеваний является одним из наиболее перспективных подходов. Одноцепочечные мини-антитела (scFv) представляют собой минимальный фрагмент молекулы иммуноглобулина, который обладает достаточно хорошей антигенсвязывающей активностью. Они включают только вариабельные домены легких (VL) и тяжелых (VH) цепей иммуноглобулина, ковалентно соединенные гибким пептидным линкером, и полностью лишены константных доменов исходного мышиного антитела. Гуманизированные одноцепочечные мини-антитела не отторгаются организмом человека и не вызывают аллергической реакции. Однако данный тип антител имеет ряд недостатков: высокие затраты на их производство и ограниченность генно-инженерных манипуляций. Другой тип антител, который может применяться для лечения и профилактики заболеваний, вызываемых вирусом гриппа, - это однодоменные мини-антитела, полученные на основе антител животных семейства Верблюдовых. Эти антитела состоят из димера только одной укороченной (без первого константного района СН 1) тяжелой цепи иммуноглобулина и полнофункциональны в отсутствие легкой цепи иммуноглобулина. Для собственно специфического узнавания и связывания антигена при этом необходим и достаточен лишь один вариабельный домен этого антитела. Генерируемые одноцепочечные мини-антитела, в отличие от большинства чисто рекомбинантных антител, обычно обладают весьма высоким сродством к заданному антигену благодаря тому, что первая стадия их получения протекает в организме животного (из сем. Верблюдовые), где происходит их аффинное созревание in vivo. По сравнению с традиционными антителами верблюжьи мини-антитела обладают рядом преимуществ, что позволяет предполагать большой потенциал их будущего использования в различных исследованиях и при созда-2 016517 нии новых биотехнологических устройств, а также в клинических целях для диагностики и лечения заболеваний. Характерными особенностями однодоменных мини-антител, определяющими большой потенциал их использования для самых разнообразных практических приложений в иммунобиотехнологии, являются следующие [см. обзор: Тиллиб С.В. "Верблюжьи наноантитела" - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология 2011; 45(1): 77-85]. 1) Наличие высокоэффективного способа генерирования и селекции наноантител. 2) Малый размер, 24 нм, 13-15 кДа (улучшенная проницаемость клеток). 3) Структурные особенности (способность образовывать необычные для классических антител паратопы, позволяющие связываться с углублениями и активными центрами белков); могут использоваться для выявления "скрытых" эпитопов или эпитопов, которые не могут быть узнаны существенно более крупными обычными антителами. 4) Высокая растворимость и стабильность (в широком диапазоне температур и кислотности среды). 5) Высокий экспрессионный выход, экономичность наработки в больших количествах. Обычно наноантитела нарабатывают в периплазме бактерий E.coli (в количестве 1-10 мг из 1 л культуры). Продемонстрирована возможность их эффективной наработки в дрожжах, растениях и клетках млекопитающих. 6) Простота всевозможных генно-инженерных манипуляций, адаптаций для конкретных задач, возможность создания многовалентных и многофункциональных производных. 7) Низкая иммуногенность; возможность экономично "гуманизировать" антитела без заметной потери их специфической активности. Возможность получения рекомбинантных однодоменных мини-антител с заданной специфичностью определяется существованием у представителей семейства Camelidae функциональных и обладающих достаточно широким спектром узнавания неканонических антител. Неканонические антитела состоят из димера только одной укороченной тяжелой цепи иммуноглобулина (без легких цепей), специфичность узнавания которых определяется лишь одним вариабельным доменом [Hamers-Casterman С., Atarhouch T., Muyldermans S., et al. Naturally occurring antibodies devoid of light chains. Nature 1993; 363:446448]. Техническая реализация отбора однодоменных мини-антител, являющихся генно-инженерными производными антиген-распознающих доменов одноцепочечных антител верблюда, основана на высокоэффективной процедуре селекции антиген-узнающих полипептидов, экспонированных на поверхности частицы нитчатого фага ("фаговый дисплей"). Метод фагового дисплея является весьма эффективной и широко используемой технологией для отбора из больших рекомбинантных библиотек пептидов и белков, экспрессирующихся в составе поверхностного белка нитчатых фагов [Brissette RGoldstein N.I. The use of phage display peptide librariesfor engineering and analyzing protein interaction interfaces. Curr Opin Struct Biol. 2007; 17:481-7]. Одно из особо важных приложений этой технологии - генерирование специфических рекомбинантных антител для самых различных антигенов [Hoogenboom H.R. Selecting and screening recombinant antibody libraries.Nat Biotechnol. 2005; 23:1105-16]. Обычно, вместо больших целых молекул классических антител для экспонирования на поверхности фага используют гибридные рекомбинантные одноцепочечные белки,представляющие собой случайные комбинации клонированных последовательностей вариабельных районов тяжелой и легкой цепей иммуноглобулинов, соединенные короткой серин/глицин-богатой линкерной последовательностью. Такая химерная молекула в случае правильного сочетания доменов способна сохранять специфичность исходного иммуноглобулина, несмотря на введенные по сравнению с нативной молекулой антител изменениями. Одной из проблем традиционных рекомбинантных технологий является необходимость работы с очень большими библиотеками рекомбинантных антител, в которых должны быть представлены всевозможные комбинации двух случайных вариабельных районов (тяжелой и легкой цепей иммуноглобулинов), соединенных линкерной последовательностью. Помимо проблемы представленности здесь также очевидна и проблема формирования правильной относительной конформации этих двух доменов, а также проблема растворимости индивидуальных вариабельных доменов,которые часто имеют тенденцию к аггрегации. Упомянутые проблемы возможно избежать при использовании однодоменных мини-антител, так как практически каждый клонированный вариабельный домен одноцепочечных антител будет в этом случае обладать определенной антиген-узнающей специфичностью, соответствующей одному из антител иммунизированного животного, и можно эффективно проводить селекцию из относительно небольших библиотек таких доменов. Однодоменные мини-антитела с заданной специфичностью или их производные могут использоваться, как и классические антитела, в различных приложениях, включающих в себя, но не ограниченных, детекцию антигенов (как в исследовательских, так и в диагностических целях), блокирование активности белка-антигена, специфическую доставку за счет связывания с антигеном желаемых молекул,конъюгированных с антителом. Также было показано [Vincke С., Loris R., Saerens D., et al.//J. Biol. Chem. 2009.V. 284.5. P. 32733284], что можно "гуманизировать" такие верблюжьи мини-антитела без заметной потери их специфиче-3 016517 ской активности, проведя небольшое число точечных замен аминокислот. Это открывает потенциальную возможность широкого использования мини-антител в качестве средств пассивной иммунизации для предотвращения развития различных опасных инфекционных заболеваний [Wesolowski J., Alzogaray V.,Reyelt J. et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med. Microbiol. Immunol. 2009; 198, 157-174]. Так, было показано (международная патентная публикация WO 2007/052242; Prendergast Patrick;Composition and method for the treatment of viral infection using camelid heavy chain antibodies), что такие антитела способны ингибировать нейраминидазу вирусов гриппа различных штаммов и защищать птиц от развития заболеваний, вызываемых данными вирусами. Данное техническое решение как наиболее близкое к заявляемому по составу действующего вещества фармацевтической композиции и способу введения его в организм выбрано авторами настоящего изобретения за прототип. Недостатками прототипа являются: 1) всем препаратам (в том числе и антителам), представляющим собой белковые препараты, свойственен такой общий недостаток, как быстрая деградация в организме за счет действия протеолитических ферментов и клеток иммунной системы. Период полураспада чужеродного белка в организме в среднем составляет 2-3 ч. Это приводит к необходимости введения в организм больших доз препаратов для достижения положительного эффекта; 2) для достижения заявляемого эффекта используется схема, состоящая как минимум из 2 этапов: введение препарата, содержащего антитело, а затем его совместное введение с препаратом, ингибирующим ФНО-. Такая схема служит для предотвращения возникновения различных иммунных реакций на чужеродный белок (антитело). Зачастую повторное введение является затруднительным для пациентов. Таким образом, в уровне техники существует острая потребность в разработке эффективной и универсальной фармацевтической композиции, служащей для профилактики и терапии гриппа, что и явилось задачей настоящего изобретения. Раскрытие настоящего изобретения Указанная выше задача настоящего изобретения решается тем, что разработку препарата проводят с использованием в качестве носителя для действующего вещества (антитела) рекомбинантной псевдоаденовирусной наночастицы (РПАН), экспрессирующей гены однодоменных мини-антител, способных связывать и/или нейтрализовывать вирус гриппа. Также для решения задачи предложены композиции, содержащие РПАН, несущие гены одного или нескольких однодоменных мини-антител, и композиции,состоящие как из РПАН, так и из однодоменных мини-антител (белков). Выбор путей реализации с целью получения фармацевтической композиции с заявляемыми свойствами обусловлен следующими факторами. 1) Предлагаемое техническое решение предусматривает использование РПАН в качестве носителя для действующего вещества вакцины и адъюванта. РПАН - это природная, биосовместимая наноструктура, созданная на основе аденовируса. Каждая РПАН содержит ДНК, заключенную в гетерогенную по составу белков оболочку. При этом в состав ДНК РПАН осуществляют одну или несколько вставок чужеродной ДНК, которая представляет собой ген антитела против патогенного организма. Также в состав ДНК РПАН осуществляют вставку целевого гена в составе экспрессирующей кассеты. При введении в организм РПАН проникают в различные типы клетки, где осуществляют экспрессию встроенных в ДНК генов. В этой связи РПАН являются широко используемым инструментом для доставки генов в клетки человека и животных [R. Harrop, et al., Advanced Drug Delivery Reviews, V. 58,1. 8, 2006, P. 931-947]. Наряду с вышеперечисленным, РПАН отличаются высокой эффективностью экспрессии целевого гена в различных типах клеток, безопасностью для человека и животных, большой пакующей емкостью вектора и т.д. Таким образом, использование РПАН в качестве носителя для действующего вещества заявляемой композиции позволяет доставлять в организм гены целевых белков, что, в свою очередь, обеспечивает продление периода циркуляции продукта целевого гена в организме. 2) В качестве носителя используют РПАН, полученные на основе рекомбинантного аденовируса человека 5-го серотипа. Известно, что такие РПАН используются на практике наиболее часто. В настоящее время на основе РПАН разрабатываются вакцины против различных бактериальных (туляремия,туберкулез, бруцеллез и др.) и вирусных (вирус иммунодефицита человека, папилломавирус человека,вирус бешенства, вирус Эбола и др.) патогенов человека [Wang J., Thorson L., Stokes R.W., SantosuossoInduction of protective immunity by topic application of a recombinant adenovirus expressing rabies virus glycoprotein. Vet Microbiol. 2002 Apr 2; 85(4):295-303]. Так, были получены РПАН, содержащие нуклеотид-4 016517 ную последовательность гемагглютинина вируса гриппа человека, для дальнейшего использования в качестве вакцины для человека и животных против патогенного штамма вируса гриппа (Vaccine. 2005,V. 23, р. 1029-1036). Ген гемагглютинина вируса гриппа птиц H5N1 включали в ДНК РПАН на основе аденовируса человека 5-го серотипа также с целью использования полученного продукта как вакцины для человека, млекопитающих животных и птиц (Vaccine 2007, J. of Virology, 2006, V. 80,4, p. 19591964). Также РПАН использовали для генной терапии опухолей в случае, когда в ДНК РПАН был клонирован ген опухолевого супрессора р 53 (US 7033750). Кроме того, два препарата РПАН на основе аденовируса человека 5-го серотипа разрешены к применению в онкологии. Поскольку в природе проникновение аденовирусов в организм осуществляется через слизистые оболочки респираторного тракта, в последнее время данный тип вектора активно используется при разработке на его основе мукозальных (назальных) вакцин (международная патентная публикацияvectored vaccines). 3) С помощью РПАН может быть решена проблема нестабильности препаратов антител (вводимых в организм в виде белков). 4) РПАН стабильны, могут быть лиофилизованы, могут храниться при 4 С длительное время без потери активности. 5) Технологии получения рекомбинантных псевдоаденовирусных наночастиц в промышленных масштабах являются экономически оправданными и позволяют получать препараты РПАН с высоким титром (в среднем 1010 БОЕ/мл). Процесс получения нового вида РПАН занимает несколько недель, что может позволить быстро реагировать на меняющуюся эпидемиологическую обстановку в максимально сжатые сроки [R. Harrop, et al., Advanced Drug Delivery Reviews, V. 58, 1.8, 2006, P. 931-947]. 6) Использование такой конструкции позволяет обеспечивать наработку протективного уровня антител уже через 96 ч после введения. Более того, протективный уровень антител поддерживается в организме не менее 2 недель [Kasuya K., Mol Ther. 2005 Feb;11(2):237-44; Sofer-Podesta С., Infect Immun. 2009Apr; 77(4): 1561-8; Chiuchiolo M.J., J. Infect Dis. 2006 Nov 1; 194(9): 1249-57]. Использование вакцины, представляющей собой РПАН, несущую в составе ДНК ген антитела, способного нейтрализовать вирус гриппа типа актуального штамма, позволяет обеспечить уже через 48-96 ч защиту организма от циркулирующего на данный момент штамма вируса гриппа. Использование композиции, состоящей из нескольких РПАН, позволяет обеспечить уже через 48-96 ч защиту организма как от циркулирующего на данный момент штамма вируса гриппа, так и от штамма, наиболее часто вызывающего пандемии. Более того, использование фармацевтической композиции, состоящей из нескольких РПАН и белковых препаратов соответствующих однодоменных мини-антител, позволяет обеспечить защиту организма как от циркулирующего на данный момент штамма вируса гриппа, так и от штамма,наиболее часто вызывающего пандемии, непосредственно после введения препарата. Настоящее изобретение объединяет преимущества различных упомянутых подходов и относится к рекомбинантной псевдоаденовирусной наночастице, несущей экспрессирующую кассету, содержащую нуклеотидную последовательность, которая кодирует однодоменное мини-антитело, связывающееся с вирусом гриппа. В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения вирус гриппа представляет собой вирус гриппа типа А, характеризующийся антигенной формулойH1N(1-9). В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения вирус гриппа представляет собой вирус гриппа типа А, характеризующийся антигенной формулой H3N(19) или H5N(1-9). В соответствии со следующим предпочтительным вариантом осуществления настоящего изобретения вирус гриппа представляет собой вирус гриппа типа В. Несмотря на то что, главным образом, в иллюстративных целях авторами настоящего изобретения делается некоторый акцент на борьбу с вирусами гриппа наиболее актуальных в настоящее время типов и антигенных формул, среднему специалисту в данной области техники будет очевидно, что под объем настоящего изобретения подпадают и другие варианты заявленных объектов настоящего изобретения,прямо не заявленные в настоящем документе. Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики или терапии гриппа, представляющей собой суспензию раскрытых выше рекомбинантных псевдоаденовирусных наночастиц в фармацевтически приемлемом растворителе или наполнителе. Применение такой фармацевтической композиции позволяет добиться транзиторной экспрессии у пациента однодоменных мини-антител, которые за счет своих уникальных свойств, подробно описанных выше, способны обеспечивать достаточно надежную иммунную защиту против вируса гриппа. Среднему специалисту в данной области техники будет понятно, что применение такой фармацевтической композиции эффективно в основном для профилактики инфекции. В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения указанные псевдоаденовирусные наночастицы несут экспрессирующие кассеты, содержащие нуклеотид-5 016517 ные последовательности, которые кодируют однодоменные мини-антитела одного, двух или трех видов. Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики или терапии гриппа, представляющей собой суспензию раскрытых выше рекомбинантных псевдоаденовирусных наночастиц и однодоменных мини-антител, связывающихся с вирусом гриппа того же типа и антигенной формулы (тех же типов и антигенных формул), что и однодоменные мини-антитела, кодируемые экспрессирующими кассетами, содержащимися в указанных рекомбинантных псевдоаденовирусных наночастицах, в фармацевтически приемлемом растворителе или наполнителе. Применение такой фармацевтической композиции позволяет обеспечить достаточно надежную иммунную защиту против вируса гриппа не только в порядке профилактики, но и после инфицирования пациента вирусом гриппа. Разумеется, чем на более ранней стадии инфекции будет применена заявленная фармацевтическая композиция, тем более эффективным окажется такое лечение. В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения указанная фармацевтическая композиция содержит однодоменные мини-антитела одного, двух или трех видов и раскрытые выше рекомбинантные псевдоаденовирусные наночастицы, несущие экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные миниантитела того же вида (тех же видов). Термин "фармацевтически приемлемый" для целей настоящего изобретения означает, что растворитель или наполнитель не оказывает каких-либо неблагоприятных действий на пациентов, которым его вводят. Такие фармацевтически приемлемые растворители и наполнители хорошо известны из предшествующего уровня техники (Remington's Pharmaceutical Sciences, 18th edition, A.R. Gennaro, Ed., MackPublishing Company [1990]; Pharmaceutical Formulation Development of Peptides and Proteins, S. Frokjaer and L.Hovgaard, Eds., TaylorFrancis [2000]; Handbook of Pharmaceutical Excipients, 3rd edition, A. Kibbe, Ed.,Pharmaceutical Press [2000]). Кроме того, настоящее изобретение относится к способу профилактики или терапии гриппа, предусматривающему введение нуждающемуся в этом пациенту профилактически или терапевтически эффективного количества одной из раскрытых выше фармацевтических композиций. Если иное не оговорено специально, термин "лечение" и использован как родовой для обозначения нанесения на участок тела пациента или введение в его организм лекарственного средства по любым показаниям и не предназначен для проведения различий между профилактическими, терапевтическими,диагностическими, паллиативными или иными процедурами. Термин "терапевтически эффективное количество" означает такое количество нанесенного лекарственного средства, которое обеспечивает необходимый терапевтический эффект, например, в данном случае - проявление противовирусной активности. В термин "терапевтически эффективное количество" входит понятие о единичной дозе лекарственного средства, использованного в ходе лечения в течение времени, требуемого для достижения желаемого терапевтического эффекта. Значение сходного термина "профилактически эффективное количество" отличается лишь тем, что в этом количестве лекарственное средство должно быть применено не для купирования развившегося заболевания (здесь - гриппа), а для недопущения его развития. В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения указанную фармацевтическую композицию вводят интраназально. В соответствии с более конкретными вариантами осуществления настоящего изобретения интраназальное введение осуществляют в форме капель или в форме спрея (аэрозоля). Авторы настоящего изобретения исходят из того, что, как известно среднему специалисту в данной области техники, первичные, исходно получаемые последовательности однодоменных мини-антител могут быть затем адаптированы или "форматированы" различным образом для последующего практического использования в составе заявленных в соответствии с настоящим изобретением фармацевтических композиций. Так, однодоменные мини-антитела могут быть исходными модулями (блоками) более сложных многомодульных препаратов. Возможно объединение в одном мультивалентном производном двух, трех и более моновалентных первичных однодоменных мини-антител. Эти объединяемые в одну конструкцию однодоменные мини-антитела могут связываться как с одним и тем же эпитопом антигена-мишени,так и с его разными эпитопами, или далее с различными антигенами-мишенями. Возможно также комбинированное объединение в одну конструкцию однодоменных мини-антител и других молекул или лекарств с получением многофункциональных препаратов [Conrath K.E., Lauwereys M., Wyns L., Muyldermans S. Camel single-domain antibodies as modular building units in bispecific and bivalent antibodyFormatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis Rheum. 2006 Jun; 54 (6): 1856-66]; мультимеризация с помощью введения дополнительных аминокислотных последовательностей, взаимодействующих белковых доменов, таких как лейциновые зипперы [Harbury P.В., Zhang T.,Kim P.S., et al. A switch between two-, three- and four-stranded coiled coils in GCN4 leucine zipper mutants.A., Gudkov A., Komarov A., Natarajan V. Reagents and methods for producing bioactive secreted peptides. 2010. US Patent Application 20100305002], последовательностей небольших белков, образующих стабильные комплексы [Deyev S.M., Waibel R., Lebedenko E.N., Schubiger A.P., Plckthun A. Design of multivalentcomplexes using the barnasebarstar module. Nat Biotechnol. 2003, 21(12): 1486-92]. Для модулирования свойств препарата однодоменного мини-антитела, например увеличения времени жизни in vivo (в крови пациента), в состав конечного соединения могут быть введены дополнительные аминокислотные последовательности, последовательности белков (таких, например, как сывороточный альбумин) или другое однодоменное мини-антитело, специфически связывающееся с мажорным и долгоживущим белком в крови человека (например, альбумином или иммуноглобулином) [Gibbs W.W.Rheum. 2006 Jun; 54 (6): 1856-66]. Среднему специалисту в данной области техники будет очевидно, что такие модификации и прочие варианты антител, лежащих в основе настоящего изобретения, подпадают под объем настоящего изобретения, поскольку являются структурными и функциональными вариантами однодоменных мини-антител. Таким образом, авторы настоящего изобретения понимают под термином "однодоменные миниантитела" как первичные, исходно получаемые, "минимальные" аминокислотные последовательности однодоменных мини-антител, так и их модификации, полученные в результате упомянутых адаптаций или "форматирования" и их варианты. Полным эквивалентом термина "однодоменные мини-антитела" для целей настоящего изобретения является вошедшее в широкое употребление обозначение "нанотело"("наноантитело"), введенное фирмой ABLYNX (NANOBODY). Термин "вариант антитела" для целей настоящего изобретения означает полипептид, который содержит изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности белка,например, как минимум 10% от активности исходного однодоменного мини-антитела. Ряд изменений в варианте белка зависит от положения или от типа аминокислотного остатка в трехмерной структуре белка. Количество изменений может составлять, например, от 1 до 30, более предпочтительно от 1 до 15 и наиболее предпочтительно от 1 до 5 изменений в последовательности исходного однодоменного миниантитела. Эти изменения могут иметь место в областях полипептида, которые не являются критичными для его функции. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг с другом, и поэтому третичная структура или активность белка не нарушаются при таком изменении. Поэтому в качестве варианта белка может выступать белок, который характеризуется гомологией не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90% и наиболее предпочтительно не менее 95% по отношению к аминокислотной последовательности исходного однодоменного мини-антитела при условии сохранения активности полипептида. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью выравнивания последовательностей в компьютерной программе BLAST 2.0, которая вычисляет три параметра: счет, идентичность и сходство. Замена, делеция, вставка, добавление или замена одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность белка при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники определены семейства аминокислот, имеющих сходные боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин),кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Та-7 016517 ким образом, примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln,His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile,Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, заменуPhe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu. Фрагменты ДНК, которые кодируют, по существу, тот же функциональный полипептид, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК, кодирующего исходное однодоменное мини-антитело, например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут делетированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные, как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации. Фрагменты ДНК, которые кодируют, по существу, тот же функциональный полипептид исходного однодоменного мини-антитела, могут быть получены путем экспрессирования фрагментов ДНК, имеющих мутацию, описанную выше, в соответствующей клетке, и установления активности экспрессируемого продукта. Организация вариабельных доменов неканонических антител (VHH, наноантител) в значительной степени подобна той, что у вариабельных доменов (VH) классических антител (у человека VH-домены иммуноглобулинов подкласса IgG3 имеют особо выраженную гомологию с VH и VHH верблюдовых). В обоих случаях V-домены состоят из четырех консервативных каркасных участков (FR, "framework regions"), окружающих три гипервариабельных участка (определяющие комплементарность, CDR, от"complementarity determining regions"). В обоих случаях домены формируют типичную для V-домена иммуноглобулина пространственную структуру из двух бета-слоев (-листов), один - из четырех аминокислотных цепочек, и второй - из пяти [Padlan E.A. X-Ray crystallography of antibodies. Adv. Protein Chem. 1996; 49: 57-133. Muyldermans S., Cambillau C., Wyns L. Recognition of antigens by single-domain antibodyfragments: the superfluous luxury of paired domains. TIBS 2001; 26: 230-235]. В этой структуре все три гипервариабельных участка кластеризуются с одной стороны V-домена (где они участвуют в узнавании антигена) и располагаются в петлях, соединяющих бета-структуры. Однако имеются и важные отличия,связанные с функционированием VHH в формате одного домена. Так, гипервариабельные участки CDR1 и CDR3 заметно увеличены в случае VHH. Часто в гипервариабельных участках VHH обнаруживаются цистеиновые остатки, причем присутствующие сразу в двух участках (чаще всего в CDR1 и CDR3, реже в CDR2 и CDR3). При исследовании кристаллических структур VHH было показано, что эти цистеиновые остатки формируют дисульфидные связи, что приводит к дополнительной стабилизации структуры петель данного антигена. Наиболее явным и воспроизводимым отличительным признаком VHH являются четыре замены гидрофобных аминокислотных остатков на гидрофильные во втором каркасном участке (Val37Phe, Gly44Glu, Leu45Arg, Trp47Gly, согласно нумерации Кабат). Этот каркасный участок в случае VH домена является высоко консервативным, обогащен гидрофобными аминокислотными остатками и особо важен для образования связи с вариабельным доменом VL легкой цепи. VHH-домен в этом плане сильно отличается: указанные замены гидрофобных аминокислот на гидрофильные делают невозможной ассоциацию VHH и VL. Эти замены также объясняют высокую растворимость VHH, наноантитела, когда его получают в виде рекомбинантного белка [Тиллиб С.В. "Верблюжьи наноантитела" - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология 2011; 45(1): 77-85]. Именно гипервариабельные районы мини-антител определяют их специфическое взаимодействие с антигеном, и именно гомологичные замены аминокислот в этих участках могут приводить к получению несколько различающихся по последовательности мини-антител, которые обладают идентичными или близкими свойствами. Таким образом, среднему специалисту в данной области техники будет очевидно,что под объем настоящего изобретения подпадают не только указанные в приложении последовательности мини-антител, но и те, которые могут быть получены путем замен аминокислот в гипервариабельных участках (указанных в перечне последовательностей как CDR) на другие, но очень близкие по свойствам,аминокислоты (консервативных замен). Замена, делеция, вставка или добавление нуклеотидов, описанных выше, также включают мутации,которые имеют место в природе и, например, обусловлены изменчивостью. Полипептиды однодоменных мини-антител согласно настоящему изобретению могут кодироваться большим множеством молекул нуклеиновых кислот, что является результатом хорошо известного в данной области техники явления вырожденности генетического кода. Суть феномена состоит в том, что любая аминокислота (за исключением триптофана и метионина), входящая в состав природных пептидов,может кодироваться более чем одним триплетным нуклеотидным кодоном (см. табл. 1). Любая из этих вырожденных кодирующих молекул нуклеиновых кислот может входить в состав экспрессирующих кассет, содержащихся в заявленных в соответствии с настоящим изобретением рекомбинантных псевдоаденовирусных наночастицах, подпадающих под объем настоящего изобретения.-8 016517 Таблица 1 Универсальная таблица кодирования аминокислот Краткое описание фигур На фиг. 1 проиллюстрированы результаты фингерпринтного анализа последовательностей отобранных однодоменных мини-антител HN1, HN2 и HN3. Приведены электрофореграммы параллельных переваров амплифицированных ДНК-последовательностей частощепящими рестрикционными эндонуклеазами (HinfI-H, MspI-Ms, RsaI-R). Справа в каждом случае дорожка с маркерными фрагментами ДНК (М). Видно, что фингерпринты последовательностей этих трех мини-антител заметно отличаются. На фиг. 2 проиллюстрированы результаты иммуноферментного анализа узнавания отобранными однодоменными мини-антителами (HN1, HN2 и HN3) иммобилизованного в лунках иммунологической плашки препарата вируса гриппа. В качестве контрольных использовали ячейки с иммобилизованным белком овальбумином кур. На фиг. 3 представлены графики зависимости выживаемости мышей после интраназального введения рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 и последующего заражения их вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2) от времени после заражения. Одинарная сплошная линия - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1 в дозе 107 БОЕ/мышь, одинарная пунктирная - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN2 в дозе 107 БОЕ/мышь, одинарная штрихпунктирная - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5HN3 в дозе 107 БОЕ/мышь, двойная сплошная - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad-null, не содержащий вставку целевого гена в экспрессирующей кассете в дозе 107 БОЕ/мышь, двойная пунктирная - 20 мкл интраназально 1 PBS. На фиг. 4 представлены графики зависимости изменения массы тела мышей после интраназального введения рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 и последующего заражения их вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2) от времени после заражения. Одинарная сплошная линия - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1 в дозе 107 БОЕ/мышь, одинарная пунктирная - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN2 в дозе 107 БОЕ/мышь, одинарная штрихпунктирная - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастицAd5-HN3 в дозе 107 БОЕ/мышь, двойная сплошная - 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad-null, не содержащий вставку целевого гена в экспрессирующей кассете в дозе 107 БОЕ/мышь, двойная пунктирная - 20 мкл интраназально 1 PBS.-9 016517 Примеры осуществления настоящего изобретения Пример 1. Получение библиотеки вариабельных доменов одноцепочечных антител. Иммунизация. Двугорбого верблюда Camelus bactrianus (самку 6 лет) последовательно иммунизировали 4 раза путем подкожного введения антигенного материала, смешанного с равным объемом неполного адъюванта Фройнда. В качестве антигена использовали препарат инактивированного вируса гриппа птиц A/Mallardduck/PA/10218/84(H5N2) из музея ФГБУ "НИИЭМ им. Н.Ф. Гамалеи" Минздравсоцразвития России и препарата вируса гриппа птиц H5N2 (штамм А/17/Утка/Потсдам/86/92), полученного от ФГУП НПО"Микроген" Минздравсоцразвития России, г. Иркутск. Вторую иммунизацию проводили через 3 недели после первой, затем с интервалом в две недели проводили еще две иммунизации. Взятие крови (150 мл) проводили через 6 дней после последней инъекции. Для предотвращения свертывания взятой крови добавляли 50 мл стандартного солевого раствора (PBS), содержащего гепарин (100 ед./мл) и ЭДТА (3 мМ). Выделение В-лимфоцитов. Кровь разводили в 2 раза стандартным солевым раствором (PBS), содержащим 1 мМ ЭДТА. 35 мл разбавленного раствора крови наслаивали на ступеньку специальной среды (Histopaque-1077, Sigma) с плотностью 1,077 г/мл объемом 15 мл и проводили центрифугирование в течение 20 мин при 800 g. Мононуклеарные клетки (лимфоциты и моноциты) отбирали из интерфазной зоны плазма/Histopaque,после чего промывали раствором PBS, содержащим 1 мМ ЭДТА. Выделение РНК из В-лимфоцитов. Суммарную РНК из В-лимфоцитов выделяли с помощью реагента TRIzol (Invitrogen). Затем, на колонке с олиго(dT)-целлюлозой из тотальной РНК очищали поли(А)-содержащую РНК. Концентрацию РНК определяли с помощью биофотометра (Eppendorf) и проверяли качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле с формальдегидом. Реакция обратной транскрипции: синтез кДНК на матрице поли(А)+РНК, выделенной из Влимфоцитов. Реакцию обратной транскрипции проводили в 40 мкл по стандартному протоколу [Sambrook et al.,1989] с использованием обратной транскриптазы Н-М-MuLV, 1 мкг РНК и 1 мкг праймера олиго(dT)15 в качестве затравки. Амплификация фрагментов кДНК, кодирующих вариабельные домены антител. Продукты обратной транскрипции (1 мкл) использовали в качестве матрицы в полимеразной цепной реакции объемом 50 мкл, содержащей два праймера CALL001 (5'-gtcctggctgctcttctacaagg-3'; SEQ IDNO: 1) и CALL002 (5'-ggtacgtgctgttgaactgttcc-3'; SEQ ID NO: 2) в количестве 20 пикомолей в следующих условиях 95 С, 90 с, (95 С - 30 с, 59 С - 120 с, 72 С - 90 с)30 циклов, 72 С, 300 с. Продукты амплификации разделяли в агарозном геле, содержащем бромистый этидий. Продукты амплификации размером 600-800 п.н., соответствующие неканоническим антителам, выделялись из геля с помощью набора QIAEX II (QIAGEN, США) и использовались в качестве матрицы в аналогичной реакции амплификации с праймерами 5'-ccagccggccatggctgatgtgcagctggtggagtctgg-3' (SEQ ID NO: 3) и 5'-ggactagtgcggccgcttgaggagacggtgacctgggt-3' (SEQ ID NO: 4), содержащими дополнительные последовательности, соответствующие участкам узнавания рестрикционных эндонуклеаз, соответственно NcoI иNotI. Создание библиотеки вариабельных доменов одноцепочечных антител. Полученные продукты амплификации клонировали по сайтам NcoI и NotI в фагмидный векторpHEN4 и, используя в качестве фага-помощника бактериофаг M13KO7 (New England Biolabs, США), получали фаговую библиотеку с поверхностной экспрессией вариабельных доменов одноцепочечных антител, как описано [Hamers-Casterman et al., 1993; Nguyen et al, 2001; Saerens et al., 2004; Rothbauer et al.,2006]. Пример 2. Селекция однодоменных мини-антител, специфически узнающих вирус гриппа. Селекцию однодоменных мини-антител проводили методом фагового дисплея с использованием препарата инактивированного вируса гриппа птиц A/Mallard duck/PA/10218/84(H5N2), иммобилизованного на дне лунок 96-луночного ИФА-планшета. Использовали полистироловые иммунологические плашки с высокой сорбцией MICROLON 600 (Greiner Bio-One). Для блокировки использовали 1% БСА(Sigma-Aldrich, США) и/или 1% обезжиренное молоко (Bio-Rad, США) в PBS. Процедуру селекции и последующей амплификации отбираемых фаговых частиц (содержащих ген однодоменного миниантитела внутри, а экспрессирующееся однодоменное мини-антитело - в составе поверхностного фагового белка pIII) повторяли, как правило, последовательно три раза. Все манипуляции проводили, как описано в публикациях Тиллиб С.В., Иванова Т.И., Васильев Л.А. 2010. Фингерпринтный анализ селекции"наноантител" методом фагового дисплея с использованием двух вариантов фагов-помощников. ActaBosnians E., Wernery U., Muyldermans S., Conrath K. J. Biol. Chem. 2004; 279: 51965-51972; Rothbauer U.,Zolghadr K., Tillib S., et al. Nature Methods 2006; 3: 887-889]. Последовательности клонов отобранных однодоменных мини-антител, находящихся в составе плазмиды pHEN4, группировали согласно схожести их фингерпринтов, получаемых при электрофоретическом разделении продуктов гидролиза амплифицированных последовательностей однодоменных мини-антител параллельно тремя частощепящими рестрикционными эндонуклеазами (HinfI, MspI, RsaI). Были отобраны три группы последовательностей однодоменных мини-антител (HN1, HN2 и HN3), характеризующихся паттернами рестрикции, приведенными на фиг. 1. Последовательности кДНК однодоменных мини-антител (SEQ ID NO: 5-7) были определены для представителей каждой из этих трех групп. В указанных последовательностях подчеркнуты соответственно (слева направо) гипервариабельные участки CDR1, CDR2 и CDR3 антигенузнающих последовательностей отобранных однодоменных мини-антител (наноантител). В наноантителе HN1 (SEQ ID NO: 5) несколько более чем у двух других наноантител, распространен в сторону N-конца участок CDR1. Во всех трех наноантителах присутствует дополнительная пара аминокислотных остатков цистеина в гипервариабельных участках (соответственно в CDR2 и CDR3 в HN1 наноантителе (SEQ ID NO: 5) и в CDR1 иCDR3 - в случае HN2 и HN3 наноантител (SEQ ID NO: 6 и 7, что является характерным часто обнаруживаемым отличием наноантител от вариабельных доменов классических антител. Было показано, что эти дополнительные остатки цистеина образуют между собой связь, которая стабилизирует получающуюся при этом конформацию мини-антитела. Продукция наноантител. Последовательности кДНК каждого из трех вариантов отобранных однодоменных мини-антител,HN1, HN2 и HN3, переклонировали в экспрессионный плазмидный вектор - модифицированный векторAgents Chemother. 2001; 45:2807-12], позволяющий присоединение к С-концу однодоменного миниантитела (His)6-эпитопа (сразу вслед за НА-эпитопом, кодируемым в векторе pHEN6). Благодаря наличию на N-конце экспрессируемой последовательности сигнального пептида (pelB) нарабатываемый рекомбинантный белок (однодоменное мини-антитело) накапливается в периплазме бактерий, что позволяет эффективно его выделять методом осмотического шока, не разрушая собственно бактериальные клетки. Продукцию однодоменных мини-антител проводили в Е.coli (штамм BL21). Экспрессию индуцировали добавлением 1 мМ индолил-бета-D-галактопиранозида и клетки инкубировали при интенсивном перемешивании в течение 7 ч при 37 С или в течение ночи при 29 С. Однодоменные мини-антитела выделяли из периплазматического экстракта с использованием аффинной хроматографии на Ni-NTAагарозе с использованием системы для очистки QIAExpressionist (QIAGEN, США). Демонстрация связывания однодоменных мини-антител с вирусом гриппа. Способность однодоменных мини-антител HN1, HN2 и HN3 связывать вирус гриппа проверяли с использованием метода иммуноферментного анализа с иммобилизованным рекомбинантным инактивированным вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2), по стандартному протоколу. В качестве контроля использовали лунки с иммобилизованным белком овальбумином кур (неспецифический белок). Детекцию связавшихся с вирусом гриппа однодоменных мини-антител проводили с помощью анти-НА антител мыши, вторичных антител к иммуноглобулинам мыши, конъюгированных с пероксидазой хрена, и хромогенного субстрата АБТС (2,2'-азино-бис(3-этилбензтиазолин)-6-сульфоновой кислоты,Sigma). На фиг. 2 представлены результаты анализа, из которых следует, что однодоменные мини-антителаHN1, HN2 и HN3 специфически связываются с препаратом вируса гриппа, но не связываются с овальбумином или БСА, использованным в качестве блокирующего агента. Отобранные последовательности однодоменных мини-антител HN1, HN2 и HN3 затем клонировали в геном рекомбинантной псевдоаденовирусной частицы. Пример 3. Создание плазмидных конструкций pShuttle-CMV-HN1, pShuttle-CMV-HN2 и pShuttle-CMV-HN3 с участками генома аденовируса человека 5-го серотипа для получения рекомбинантных псевдоаденовирусных наночастиц, несущих экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные мини-антитела HN1, HN2 и HN3 соответственно, связывающиеся с вирусом гриппа. Для получения плазмидных конструкций pShuttle-CMV-HN1, pShuttle-CMV-HN2 и pShuttle-CMVHN3 в качестве вектора используют плазмидную конструкцию pShuttle-CMV с участками генома аденовируса человека 5-го серотипа для получения рекомбинантных псевдоаденовирусных наночастиц, входящую в набор к системе "AdEasy Adenoviral vector system" ("Stratagene" Cat. No. 240009). Плазмидную конструкцию pShuttle-CMV гидролизуют по сайту для эндонуклеазы рестрикции EcoRV, а затем осуществляют вставку нуклеотидных последовательностей однодоменных мини-антител, получая, соответственно, конструкции pShuttle-CMV-HN1, pShuttle-CMV-HN2 и pShuttle-CMV-HN3. Нуклеотидные последовательности однодоменных мини-антител HN1, HN2 и HN3 для вставки в pShuttle-CMV получают пу- 11016517 тем гидролиза соответствующих плазмидных конструкций pAL-HN1, pAL-HN2 и pAL-HN3 по сайтам для эндонуклеазы рестрикции EcoRV. Наличие генов однодоменных мини-антител HN1, HN2 и HN3 в составе соответствующих плазмидных конструкций pShuttle-CMV-HN1, pShuttle-CMV-HN2 и pShuttleCMV-HN3 подтверждают рестрикционным анализом при использовании эндонуклеазы EcoRI, NotI иEcoRV и методом ПЦР. Пример 4. Получение рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3, несущих экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные мини-антитела HN1, HN2 и HN3 соответственно, связывающиеся с вирусом гриппа. Получение рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 проводят согласно методике "AdEasy Adenoviral vector system" ("Stratagene" Cat. No. 240009). Наличие генов однодоменных мини-антител HN1, HN2 и HN3 в составе соответствующих рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 подтверждают методом ПЦР. Далее определяют титры препаратов рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1,Ad5-HN2 и Ad5-HN3 методом бляшкообразования на культуре клеток 293 (клетки эмбриональной почки человека). Пример 5. Нейтрализация вируса гриппа однодоменными мини-антителами HN1, HN2 и HN3 в культуре клеток in vitro. Постановку реакции вирус-нейтрализации проводят с использованием линии клеток MDCK, культивируемых в 96-луночных культуральных планшетах (Costar, США) до конфлюэнтности клеточного монослоя 80%. Перед проведением реакции в культуральных планшетах с клетками среду заменяют на бессывороточную. Для проведения реакции используют вирус гриппа птиц A/MallardHN1, HN2 и HN3 производят в бессывороточной среде DMEM. В лунки 96-луночного планшета вносят по 50 мкл суспензии вируса, затем добавляют в каждую лунку равные объемы двукратных разведений сывороток, начиная с 1:10. Планшет инкубируют при 37 С 1 ч. После инкубации смесь вируса и сывороток добавляют в каждую лунку планшета с клетками для адсорбции вируса на клетках. Клетки инкубируют при 37 С и 5% СО 2 в течение 2 ч. Затем из планшетов отбирают бессывороточную среду и заменяют ее на содержащую эмбриональную сыворотку КРС среду MEM с 0,2% БСА и трипсином в концентрации 1 мкг/мл. Результаты реакции вирус-нейтрализации учитывают через 72 ч по наступлению ЦПД в культуре клеток по методу Рида и Менча. Антитела HN1, HN2 и HN3 обеспечивают нейтрализацию вируса гриппа в интервале концентраций от 0,009 до 2,5 мкг/мл. Пример 6. Нейтрализация вируса гриппа однодоменными мини-антителами HN1, HN2 и HN3, экспрессируемыми рекомбинантными псевдоаденовирусными наночастицами Ad5-HN1, Ad5-HN2 и Ad5-HN3 в культуре клеток in vitro. Экспрессию однодоменных мини-антител HN1, HN2 и HN3 производят в клетках линии А 549. Для этого клетки А 549 рассевают на лунки 48-луночного планшета (Costar, США) в количестве 104 клеток на лунку, после чего к клеткам добавляют бессывороточную среду 293AGT ("Invitrogen", США) и инкубируют при 37 С и 5% CO2 в течение 20-24 ч. Затем клетки трансдуцируют препаратами рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 в дозе 5 БОЕ/клетку. Клетки инкубируют при 37 С и 5% CO2 в течение 2 ч, после чего из лунок отбирают среду и заменяют ее новой порцией среды 293AGT. Трансдуцированные клетки инкубируют в течение 72 ч, затем производят отбор культуральной среды. Таким образом, получают препараты культуральной среды, содержащей экспрессированные рекомбинантными псевдоаденовирусными наночастицами Ad5-HN1, Ad5-HN2 и Ad5-HN3 однодоменные мини-антитела HN1, HN2 и HN3. Постановку реакции вирус-нейтрализации проводят с использованием линии клеток MDCK, культивируемых в 96-луночных культуральных планшетах (Costar, США) до конфлюэнтности клеточного монослоя 80%. Перед проведением реакции в культуральных планшетах с клетками среду заменяют на бессывороточную. Для проведения реакции используют вирус гриппа птиц A/Mallardduck/PA/10218/84(H5N2) в дозе, равной 100 ТЦД 50 на лунку. Разведения вируса и культуральной среды,содержащей исследуемые антитела HN1, HN2 и HN3 производят в бессывороточной среде DMEM. В лунки 96-луночного планшета вносят по 50 мкл суспензии вируса, затем добавляют в каждую лунку равные объемы двукратных разведений сывороток, начиная с 1:10. Планшет инкубируют при 37 С в течение 1 ч. После инкубации смесь вируса и сывороток добавляют в каждую лунку планшета с клетками для адсорбции вируса на клетках. Клетки инкубируют при 37 С и 5% CO2 в течение 2 ч. Затем из планшетов отбирают бессывороточную среду и заменяют ее на содержащую эмбриональную сыворотку КРС средуMEM с 0,2% БСА и трипсином в концентрации 1 мкг/мл. Результаты реакции вирус-нейтрализации учитывают через 72 ч по наступлению ЦПД в культуре клеток по методу Рида и Менча. Препараты культуральной среды, содержащей экспрессированные рекомбинантными псевдоаденовирусными наночастицами Ad5-HN1, Ad5-HN2 и Ad5-HN3 однодоменные мини-антитела HN1, HN2 и HN3 обеспечивают ней- 12016517 трализацию вируса гриппа в разведении 1:100. Пример 7. Применение рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 для профилактики и терапии заболеваний, вызываемых вирусом гриппа. С целью профилактики заболеваний, вызываемых вирусом гриппа мышей линии Balb/c, самок весом 18 г разделяют на 5 групп по 50 мышей в каждой группе: первой группе мышей вводят 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1 в дозе 107 БОЕ/мышь,второй группе мышей вводят 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN2 в дозе 107 БОЕ/мышь,третьей группе мышей вводят 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad5-HN3 в дозе 107 БОЕ/мышь,четвертой группе мышей вводят 20 мкл интраназально препарата рекомбинантных псевдоаденовирусных наночастиц Ad-null, не содержащий вставку целевого гена в экспрессирующей кассете в дозе 107 БОЕ/мышь,пятой группе мышей 20 мкл интраназально 1 PBS. Через 72 ч после введения вышеуказанных препаратов мышей заражают 25 ЛД 50 адаптированным по своим вирулентным свойствам для модели мышей вирусом гриппа птиц A/Mallardduck/PA/10218/84(H5N2). Заражение производят интраназально под легким эфирным наркозом. В течение 14 дней после заражения учитывают выживаемость мышей и изменение их веса. Протекция мышей против вируса A/Mallard duck/PA/10218/84(H5N2) составляет 95-100% в группах,которым вводили препараты рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 иAd5-HN3 (см. фиг. 3). Также у этих мышей не наблюдается уменьшение массы тела. Кривые уменьшения массы тела у мышей каждой из пяти вышеуказанных групп после инфекции вирусом гриппа представлены на фиг. 4. Таким образом, интраназальное введение однодоменных мини-антител HN1, HN2 и HN3 полностью защищает от заражения вирусом гриппа. Пример 8. Применение фармакологической композиции, состоящей из однодоменных мини-антител HN1,HN2 и HN3 и рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3 для профилактики и терапии заболеваний, вызываемых вирусом гриппа. С целью проведения профилактики и терапии заболеваний, вызываемых вирусом гриппа мышей линии Balb/c, самок весом 18 г разделяют на 36 групп по 20 мышей в каждой группе: 1, 2 и 3 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг однодоменных мини-антител HN1 и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5HN1; 4, 5 и 6 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг однодоменных мини-антител HN2 и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5HN2; 7, 8 и 9 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг однодоменных мини-антител HN3 и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5HN3; 10, 11 и 12 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг БСА и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1; 13, 14 и 15 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг БСА и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5-HN2; 16, 17 и 18 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг БСА и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5-HN3; 19, 20 и 21 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг однодоменных мини-антител HN1 и 10 БОЕ рекомбинантных псевдоаденовирусных наночастицAd5-null; 22, 23 и 24 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг однодоменных мини-антител HN2 и 107 БОЕ рекомбинантных псевдоаденовирусных наночастицAd5-null; 25, 26 и 27 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг однодоменных мини-антител HN3 и 107 БОЕ рекомбинантных псевдоаденовирусных наночастицAd5-null; 28, 29 и 30 группа - каждому животному вводят 20 мкл интраназально препарата, содержащего 3 мкг БСА и 107 БОЕ рекомбинантных псевдоаденовирусных наночастиц Ad5-null; 31, 32 и 33 группа - каждому животному вводят 20 мкл интраназально 1PBS; 34, 35 и 36 группа - интактные мыши.- 13016517 В группах 1, 4, 7, 10, 13, 16, 19, 22, 25, 28, 31 и 34 через 1 ч после введения вышеуказанных препаратов мышей заражают 25 ЛД 50 адаптированным по своим вирулентным свойствам для модели мышей вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2). Заражение производят интраназально под легким эфирным наркозом. В течение 14 дней после заражения учитывают выживаемость мышей и изменение их массы тела. В группах 2, 4, 8, 11, 14, 17, 21, 23, 26, 29, 32 и 35 через 72 ч после введения вышеуказанных препаратов мышей заражают 25 ЛД 50 адаптированным по своим вирулентным свойствам для модели мышей вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2). Заражение производят интраназально под легким эфирным наркозом. В течение 14 дней после заражения учитывают выживаемость мышей и изменение их массы тела. В группах 3, 6, 9, 12, 15, 18, 22, 24, 27, 30, 33 и 36 через 14 дней после введения вышеуказанных препаратов мышей заражают 25 ЛД 50 адаптированным по своим вирулентным свойствам для модели мышей вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2). Заражение производят интраназально под легким эфирным наркозом. В течение 14 дней после заражения учитывают выживаемость мышей и изменение их массы тела. Протекция мышей против вируса A/Mallard duck/PA/10218/84(H5N2) составляет 95-100% в группах 1-9, 11, 12, 14, 15, 17, 18, 19, 22 и 25 (см. табл.1). Также у этих мышей не наблюдается уменьшение массы тела (см. табл. 2). Таблица 2 Выживаемость и изменение веса мышей после интраназального введения фармакологической композиции, состоящей из однодоменных мини-антител HN1, HN2 и HN3 и рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1, Ad5-HN2 и Ad5-HN3, и последующего заражения их вирусом гриппа птиц Таким образом, интраназальное введение фармакологической композиции, состоящей из однодоменных мини-антител HN1, HN2 и HN3 и рекомбинантных псевдоаденовирусных наночастиц Ad5-HN1,Ad5-HN2 и Ad5-HN3 полностью защищает от заражения вирусом гриппа. Таким образом, заявленные в соответствии с настоящим изобретением фармацевтические композиции доказали свою применимость для терапии и профилактики гриппа. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантная псевдоаденовирусная наночастица, несущая экспрессирующую кассету, содержащую нуклеотидную последовательность, которая кодирует однодоменное мини-антитело, связывающееся с вирусом гриппа типа А или типа В. 2. Псевдоаденовирусная наночастица по п.1, причем вирус гриппа типа А характеризуется антигенной формулой H1N(1-9). 3. Псевдоаденовирусная наночастица по п.1, причем вирус гриппа типа А характеризуется антигенной формулой H3N(1-9). 4. Псевдоаденовирусная наночастица по п.1, причем вирус гриппа типа А характеризуется антигенной формулой H5N(1-9). 5. Фармацевтическая композиция для профилактики или терапии гриппа, представляющая собой суспензию рекомбинантных псевдоаденовирусных наночастиц по любому из пп.1-4 в фармацевтически приемлемом растворителе или наполнителе. 6. Фармацевтическая композиция по п.5, в которой указанные псевдоаденовирусные наночастицы несут экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные мини-антитела одного, двух или трех видов. 7. Фармацевтическая композиция для профилактики или терапии гриппа, представляющая собой суспензию рекомбинантных псевдоаденовирусных наночастиц по любому из пп.1-4 и однодоменных мини-антител, связывающихся с вирусом гриппа того же типа и антигенной формулы (тех же типов и антигенных формул), что и однодоменные мини-антитела, кодируемые экспрессирующими кассетами,содержащимися в указанных рекомбинантных псевдоаденовирусных наночастицах, в фармацевтически приемлемом растворителе или наполнителе.- 15016517 8. Фармацевтическая композиция по п.7, содержащая однодоменные мини-антитела одного, двух или трех видов и рекомбинантные псевдоаденовирусные наночастицы по любому из пп.1-4, несущие экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют однодоменные мини-антитела того же вида (тех же видов). 9. Способ профилактики или терапии гриппа, предусматривающий введение нуждающемуся в этом пациенту профилактически или терапевтически эффективного количества фармацевтической композиции по любому из пп.5-8. 10. Способ по п.9, в котором указанную фармацевтическую композицию вводят интраназально. 11. Способ по п.10, в котором интраназальное введение осуществляют в форме капель. 12. Способ по п.10, в котором интраназальное введение осуществляют в форме спрея.
МПК / Метки
МПК: A61P 31/16, C12N 15/44, C07K 16/10, C12N 7/01, A61K 39/145
Метки: способ, фармацевтическая, рекомбинантная, гриппа, псевдоаденовирусная, композиция, наночастица, варианты, терапии, профилактики
Код ссылки
<a href="https://eas.patents.su/20-16517-rekombinantnaya-psevdoadenovirusnaya-nanochastica-farmacevticheskaya-kompoziciya-dlya-profilaktiki-ili-terapii-grippa-varianty-sposob-profilaktiki-ili-terapii-grippa.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантная псевдоаденовирусная наночастица, фармацевтическая композиция для профилактики или терапии гриппа (варианты), способ профилактики или терапии гриппа</a>
Предыдущий патент: Получение основного гидролизата гидролизом растительных целлюлозных материалов концентрированной серной кислотой
Следующий патент: 4-замещенные пирролидин-2-оны и их применение
Случайный патент: Пирролопиримидины и их применение