Аминокислотные соединения и их применение в качестве ингибиторов nep, ace и ece
Номер патента: 5004
Опубликовано: 28.10.2004
Авторы: Фурнье-Залуски Мари-Клод, Скальбер Элизабет, Ингимбер Никола, Беннжан Каролина, Пора Эрве, Ренар Пьер, Рок Бернар П.
Формула / Реферат
1. Соединения формулы (I)
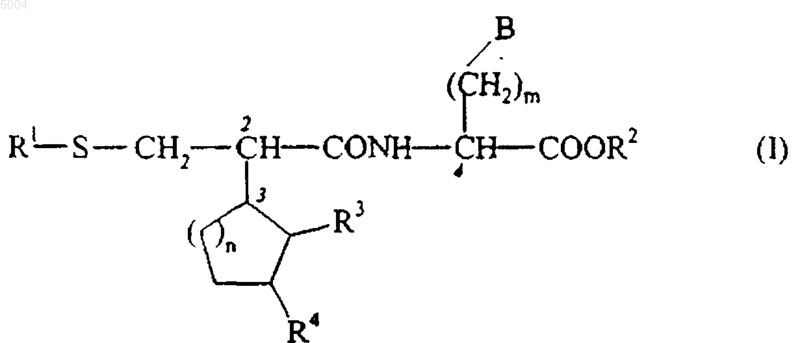
в которой
n представляет собой коэффициент, в котором 0_n_3,
m представляет собой коэффициент, в котором 0_m_6,
R3 и R4 совместно образуют с двумя атомами углерода, которые их несут, фенильную группу, которая незамещена или замещена от 1 до 3 одинаковыми или различными группами, выбираемыми из алкила, алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила, формила, ацила, арила, гетероарила и атомов галогенов,
B представляет собой гетероарильную группу,
R2 представляет собой атом водорода или алкильную, алкенильную, циклоалкильную, циклоалкилалкильную, ацильную, арильную, арилалкил или ароильную группу,
R1 представляет собой атом водорода ацильную, ароильную или циклоалкилкарбонильную группу или группу формулы (II)
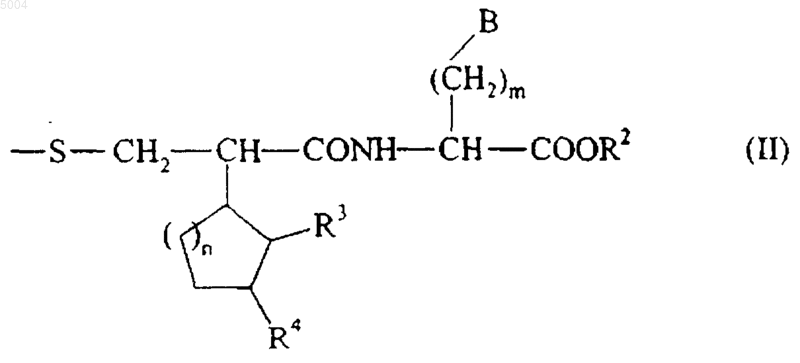
в которой m, n, R2, R3, R4 и B имеют значения, указанные здесь ранее,
"алкил" следует понимать как обозначающий алкильную группу, имеющую линейную или разветвленную цепочку, содержащую от 1 до 6 атомов углерода,
"алкенил" следует понимать как обозначающий алкильную группу, содержащую от 2 до 6 атомов углерода и содержащую одну или более двойных связей,
"алкинил" следует понимать как обозначающий алкильную группу, содержащую от 2 до 6 атомов углерода и содержащую одну или более тройных связей,
"циклоалкил" следует понимать как обозначающий циклическую алкильную группу, содержащую от 3 до 8 атомов углерода,
"ацил" следует понимать как обозначающий группу RCO, в которой R представляет собой алкильную группу, как указано здесь ранее,
для групп "алкил", "алкенил" и "алкинил" возможно, чтобы они были замещены одной или более одинаковыми или различными группами, выбираемыми из гидрокси, алкокси, полигалоалкила, амино и атомов галогенов,
для групп "циклоалкил" и "циклоалкилалкил" возможно, чтобы они были замещены на циклической части одной или более одинаковыми или различными группами, выбираемыми из гидрокси, алкокси, полигалоалкила, амино и атомов галогенов,
"арил" следует понимать как обозначающий фенильную или нафтильную группу, незамещенную или замещенную одной или более одинаковыми или различными группами, выбираемыми из алкила, алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила, формила, ацила и атомов галогенов,
"гетероарил" следует понимать как обозначающий какую-либо моно- или полициклическую ароматическую группу, содержащую от 1 до 3 гетероатомов, выбираемых из кислорода, серы и азота, эти группы незамещены или замещены одной или более одинаковыми или различными группами, выбираемыми из алкила, алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила, формила, ацила и атомов галогенов,
для полициклических групп возможно также, чтобы они были частично или полностью гидрогенизированы на одном из колец,
их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1 в которой R1 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, в которой R1 представляет собой ацильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, в которой R2 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, в которой R2 представляет собой алкильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, в которой R3 и R4 совместно образуют замещенную фенильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, в которой R3 и R4 совместно образуют фенильную группу, замещенную атомом галогена или метоксигруппой, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, в которой n представляет собой 1, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, в которой m представляет собой 1, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, в которой B представляет собой гетероарильную группу, содержащую группу NH, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по п.1, в которой B представляет собой индолильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по п.1, в которой B представляет собой пирролопиридинильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по п.1, в которой B представляет собой пирролохинолинильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по п.1 конфигурации 2S-3R, их диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
15. Соединения формулы (I) по п.1 конфигурации 2S-3R-4S, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
16. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил] триптофан, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
17. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]триптофан (2S-3R-4S), а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
18. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-метилтио-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]триптофан, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
19. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-метокси-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]триптофан его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
20. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]-3-(1H-пирроло[2,3-b]пиридин-3-ил)аланин, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
21. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]-3-(1H-пирролю[2,3-b]пиридин-3-ил)аланин (2S-3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
22. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]-5-метокситриптофан (2S-3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
23. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]-5-фторотриптофан (2S-3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
24. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]-3-(1H-пирроло[3,2-h]хинолин-3-ил)аланин (2S-3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
25. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала применяют соединение формулы (III)
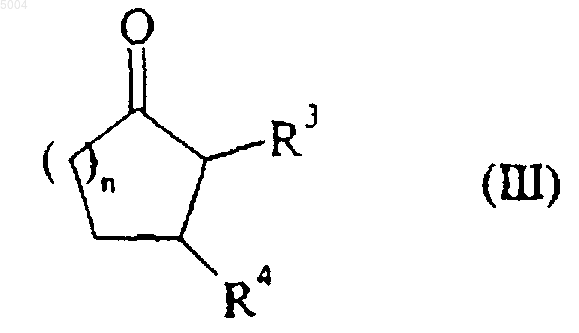
в которой R3, R4 и n имеют значения, указанные для формулы (I),
которое подвергают воздействию восстанавливающего агента, такого как NaBH4, например, с получением соединения формулы (IV)
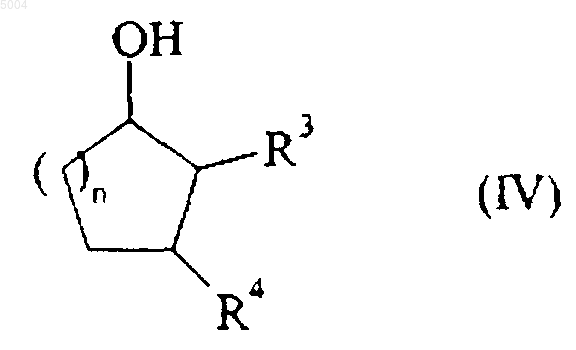
в которой n, R3 и R4 имеют значения, указанные здесь ранее,
которое переводят при помощи галогенирующего агента, такого как Me3SiBr, например, в соответствующее галогеновое соединение формулы (V)
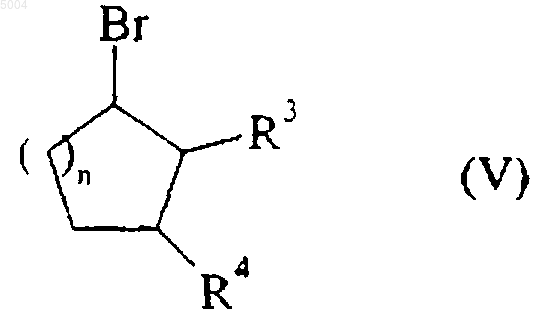
в которой R3, R4 и n имеют значения, указанные здесь ранее,
которое конденсируют, в основной среде,
с этил 2-(диэтоксифосфорил)ацетатом с получением соединения формулы (VI)
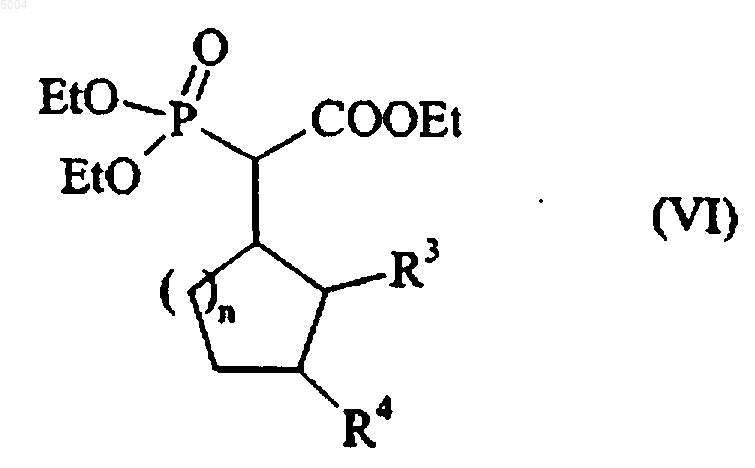
в которой R3, R4 и n имеют значения, указанные здесь ранее,
которое подвергают реакции с формальдегидом в основной среде с получением соединения формулы (VII)
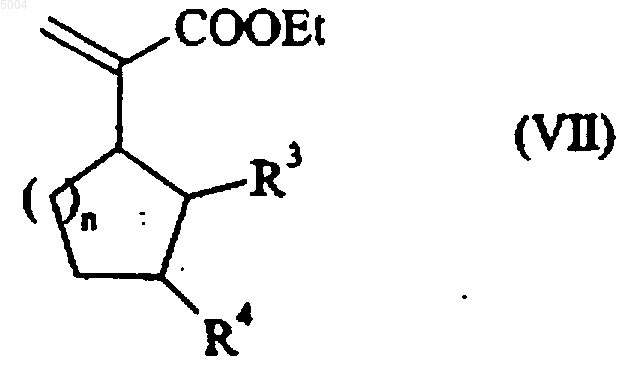
в которой R3, R4 и n имеют значения, указанные здесь ранее,
которое гидролизируют в присутствии гидроксида натрия с получением соединения формулы (VIII)

в которой R3, R4 и n имеют значения, указанные здесь ранее,
которое конденсируют с соединением формулы (IX)
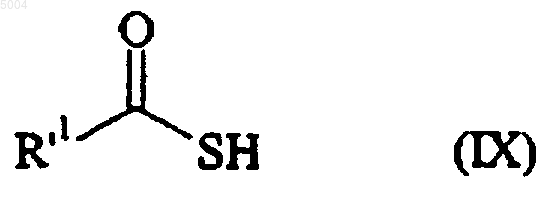
в которой R'1 представляет собой алкильную, арильную или циклоалкильную группу, с получением соединения формулы (X)
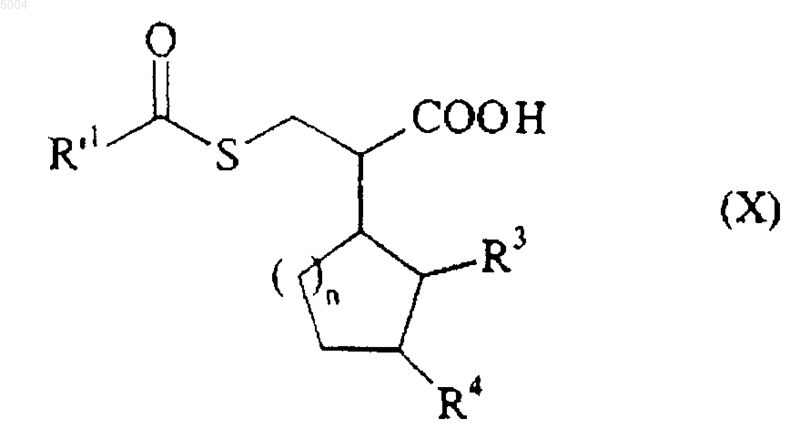
в которой R3, R4, R'1 и n имеют значения, указанные здесь ранее,
которое конденсируют, в присутствии связывающего агента, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид, например, с соединением формулы (XI)
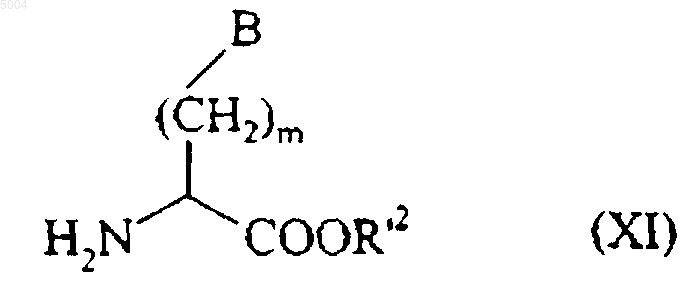
в которой B и m имеют значения, указанные для формулы (I), и R'2 представляет собой алкильную, алкенильную, циклоалкильную, циклоалкилалкильную, арильную, ацильную, арилалкильную или ароильную группу,
с получением соединения формулы (I/a), частного случая соединений формулы (I)
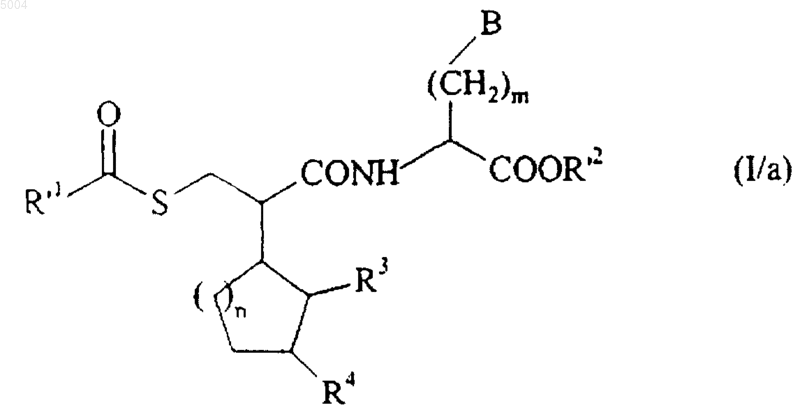
в которой R'1, R3, R4, R'2, m, n и B имеют значения, указанные здесь ранее,
которое может быть частично или полностью гидролизировано в основной среде с получением соединения формулы (I/b), частного случая соединений формулы (I)
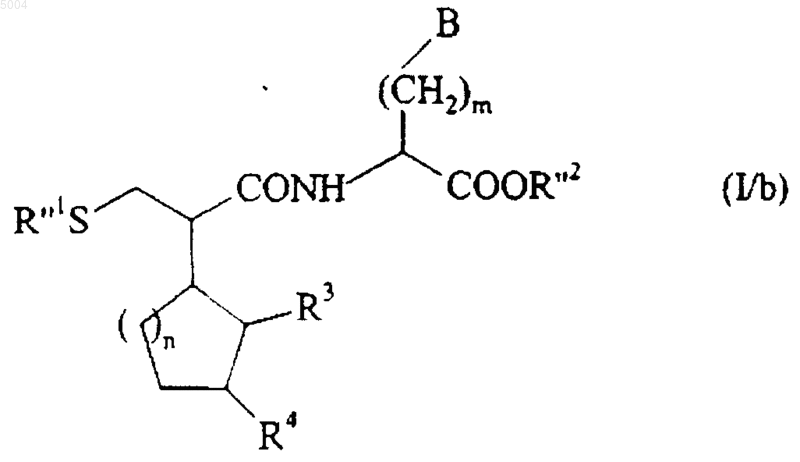
в которой R3, R4, m, n и B имеют значения, указанные здесь ранее, R"1 представляет собой группу R'1 или атом водорода, и R"2 представляет собой группу R'2 или атом водорода, при условии, что по меньшей мере одна из групп R"1 и R"2 представляет собой атом водорода,
это соединение формулы (I/b), если R"1 представляет собой атом водорода, можно поместить в кислую среду с получением соединения формулы (I/c), частного случая соединений формулы (I)

в которой R2, R3, R4, m, n и B имеют значения, указанные здесь ранее, и R'"1 представляет собой группу формулы (II),
эти соединения формул с (I/a) по (I/c) составляют совокупность соединений по изобретению и могут, при желании, быть очищены по традиционной методике разделения, при желании, их переводят в их аддитивные соли с фармацевтически приемлемой кислотой или основанием, и их необязательно разделяют на их стереоизомеры по традиционной методике разделения.
26. Способ по п.25 получения соединения формулы (I) по п.1, который отличается тем, что в качестве исходного материала применяют соединение формулы (X), как указано здесь ранее, диастереоизомеры которого разделяют при помощи хроматографии с получением соединений формул (Xa) и (Xb)
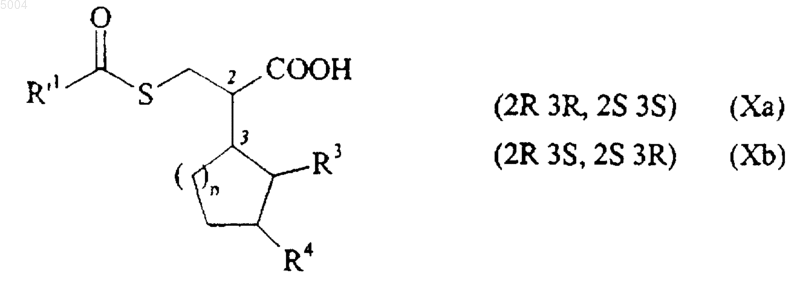
в которых R'1, R3, R4 и n имеют значения, указанные здесь ранее,
с этим соединением формулы (Xb) можно образовать соль с хиральным амином, таким как (R)-(+)-a-метилбензиламин, например, с получением после разделения при помощи последовательных операций рекристаллизации соединения формулы (Xb')
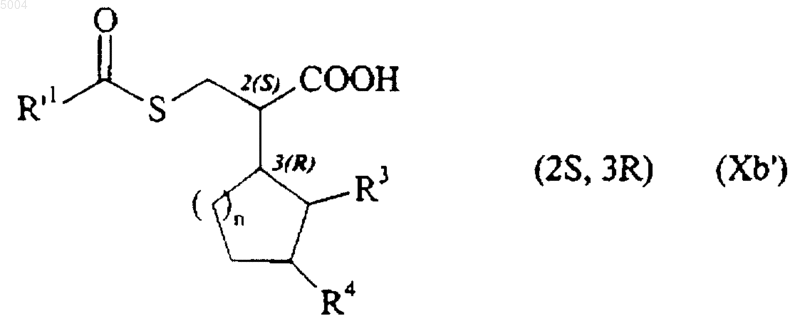
в которой R'1, R3, R4 и n имеют значения, указанные здесь ранее,
которое конденсируют в присутствии связывающего агента, такого как EDCI, с соединением формулы (XIa)
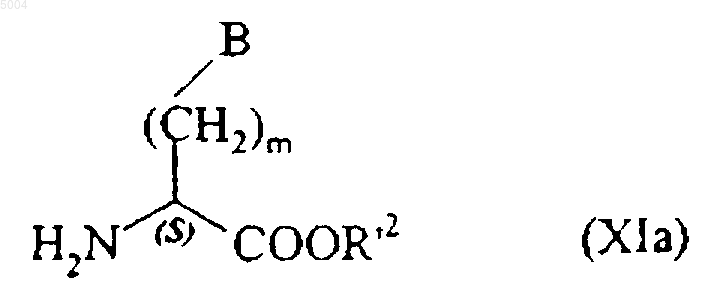
в которой R'2, m и B имеют значения, указанные здесь ранее, с получением соединения формулы (I/a), частного случая соединений формулы (I/a)

в которой R'2, R'2, R3, R4, m, n и B имеют значения, указанные здесь ранее,
диастереоизомеры (2R, 3S), (2R, 3R) и (2S, 3R) получают аналогично, исходя из соответствующих соединений (Xa) и (Xb),
также эти соединения можно получать при помощи конденсации соединения формулы (XIa) с соединением формулы (Xa) или (Xb), после которой следует разделение при помощи хроматографии.
27. Фармацевтические композиции, которые включают в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп.1-24, либо его аддитивную соль с фармацевтически приемлемой кислотой или основанием, отдельно или в сочетании с одним или более фармацевтически приемлемыми эксципиентами.
28. Применение фармацевтических композиций по п.27 для производства лекарственного препарата для лечения артериальной гипертензии, включая легочную артериальную гипертензию, ишемии миокарда, стенокардии, сердечной недостаточности, васкулопатий, включая диабетические васкулопатий, атеросклероза и пост-ангиопластического рестеноза, острой или хронической почечной недостаточности, сосудистых заболеваний головного мозга, включая удар и субарахноидальное кровоизлияние, периферийной ишемии и токсичности к циклоспорину.
Текст
1 Настоящее изобретение относится к новымN-меркаптоацил аминокислотным соединениям,к способу их получения и к фармацевтическим композициям, их содержащим. Различные патентные заявки описывают аминокислотные соединения для применения в качестве ингибиторов нейтральной эндопептидазы (NEP) (ЕР 449 523), в качестве ингибиторов эндотелин-преобразующего энзима (ЕСЕ)(WO 97/32874), или в качестве смешанных ингибиторов NEP и ангиотензин I преобразующего энзима (АСЕ). Фармакологическая роль, которую играют эти энзимы, представляет собой для АСЕ - перевод ангиотензина I в ангиотензин II и разложение брадикинина до неактивных пептидов,для NEP - разложение брадикинина и натрийуретического пептида предсердия до неактивных пептидов,для ЕСЕ - перевод большого эндотелина-1 в эндотелин-1. Ангиотензин II, эндотелии, брадикинин и натрийуретический пептид предсердия являются до настоящего времени наиболее важными пептидами, вовлеченными в регулирования тонуса сосудов, сердечно-сосудистое ремодулирование и гидроэлектрический гомеостаз. Их метаболизм существенно контролируется этими тремя энзимами. Ингибирование одного и/или другого из этих энзимов дает возможность восстанавливать оптимальный пептидергичекий баланс при помощи преобладания сосудорасширяющих, антитрофических и натрийуретических пептидов (брадикинин, натрийуретический пептид предсердия) над сосудосжимающими,трофическими и противонатрийуретическими пептидами (ангиотензин II, эндотелин-1), таким образом оказывая сердечно-сосудистое терапевтическое благоприятное влияние. Фармакологические свойства смешанных ингибиторов ACE/NEP, описанные в ранее известном уровне техники, предрекли большую сердечно-сосудистую роль эндотелиновой системы (Haynes W. G. и др., Journal ofHypertension, 1998,16 (8), сс. 1081-1098) и показали импликацию NEP при разложении эндотелина-1 (Vijayaraghavan J. и др., J. Biol. Chem.,1990, 265, сс. 14150-14155). Таким образом, лечение при помощи смешанных ингибиторовACE/NEP приводит в к повышению уровней эндотелина-1, который, на протяжении долгого времени, может иметь неблагоприятное воздействие на ожидаемое терапевтическое преимущество. Эта проблема решается получением трех типов ингибирования в рамках одной и той же молекулы, позволяя контррегуляцию такой активации и таким образом приводя к продолжительной терапевтической эффективности. Разработка молекул, которые ингибируют эти три энзима, таким образом, вносит очень существенное преимущество в лечение артериальной 2 гипертензии и сердечно-сосудистых заболеваний. Соединения по настоящему изобретению новы и являются отличными тройными ингибиторами, что говорит о том, что они способны ингибировать NEP, АСЕ и ЕСЕ одновременно. Настоящее изобретение относится более конкретно к соединениям формулы (I):n представляет собой коэффициент, в котором 0n3,m представляет собой коэффициент, в котором 0m6,R3 и R4 совместно образуют с двумя атомами углерода, которые их несут, фенильную группу, которая незамещена или замещена от 1 до 3 одинаковыми или различными группами,выбираемыми из алкила, алкенила, алкинила,алкокси, гидрокси, алкилтио, меркапто, циано,нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила,амидо, карбамоила, формила, ацила, арила, гетероарила и атомов галогенов,В представляет собой гетероарильную группу,R2 представляет собой атом водорода или алкильную, алкенильную, циклоалкильную,циклоалкилалкильную, ацильную, арильную,арилалкил или ароильную группу,R1 представляет собой атом водорода ацильную, ароильную или циклоалкилкарбонильную группу или группу формулы (II) в которой m, n, R2, R3, R4 и В имеют значения,указанные здесь ранее,"алкил" следует понимать как обозначающий алкильную группу, имеющую линейную или разветвленную цепочку, содержащую от 1 до 6 атомов углерода,"алкенил" следует понимать как обозначающий алкильную группу, содержащую от 2 до 6 атомов углерода и содержащую одну или более двойных связей,"алкинил" следует понимать как обозначающий алкильную группу, содержащую от 2 до 6 атомов углерода и содержащую одну или более тройных связей,"циклоалкил" следует понимать как обозначающий циклическую алкильную группу,содержащую от 3 до 8 атомов углерода, 3"ацил'" следует понимать как обозначающий группу RCO, в которой R представляет собой алкильную группу, как указано здесь ранее,для групп "алкил", "алкенил" и "алкинил" возможно, чтобы они были замещены одной или более одинаковыми или различными группами,выбираемыми из гидрокси, алкокси, полигалоалкила, амино и атомов галогенов,для групп "циклоалкил" и "циклоалкилалкил" возможно, чтобы они были замещены в цикле одной или более одинаковыми или различными группами, выбираемыми из гидрокси,алкокси, полигалоалкила, амино и атомов галогенов,"арил" следует понимать как обозначающий фенильную или нафтильную группу, незамещенную или замещенную одной или более одинаковыми или различными группами, выбираемыми из алкила, алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро,амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила, формила, ацила и атомов галогенов,"гетероарил" следует понимать как обозначающий какую-либо моно- или полициклическую ароматическую группу, содержащую от 1 до 3 гетероатомов, выбираемых из кислорода,серы и азота, эти группы незамещены или замещены одной или более одинаковыми или различными группами, выбираемыми из алкила,алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила,формила, ацила и атомов галогенов, для полициклических групп возможно также, чтобы они были частично или полностью гидрогенизированы на одном из колец, к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно упомянуть, без внесения ограничений, соляную кислоту, бромоводородную кислоту, серную кислоту, фосфоновую кислоту,уксусную кислоту, трифтороуксусную кислоту,молочную кислоту, пировиноградную кислоту,малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, виннокаменную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту, щавелевую кислоту др. Среди фармацевтически приемлемых оснований можно упомянуть, без привнесения каких-либо ограничений, гидроксид натрия,гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями по изобретению являются соединения формулы (I), 005004 4 в которой R1 представляет собой атом водорода или ацильную группу. Предпочтительным значением для m и n является 1. Предпочтительными группами R2 являются атом водорода и группы алкил и арилалкил. Преимущественно, изобретение относится к соединениям формулы (I), в которой R3 и R4 образуют совместно с двумя атомами углерода,их несущими, замещенную фенильную группу. Более преимущественно, изобретение относится к соединениям формулы (I), в которойR3 и R4 образуют совместно с двумя атомами углерода, их несущими, замещенную фенильную группу, замещенную атомом галогена, и более конкретно, атомом брома, или замещенную алкокси или алкилтиогруппой, и более конкретно - группами метокси или метилтио. Еще более преимущественно, изобретение относится к соединениям формулы (I), замещенным во 2 позиции индановой группой, замещенной в 5 позиции атомом галогена, и более конкретно, атомом брома, или алкоксигруппой,и более конкретно, метоксигруппой. Предпочтительными группами В являются гетероарилы, содержащие группу NH, такие как,например, группы индолил, имидазолил, пирролопиридинил, пирролохинолинил, пирролил и пирролопиразинил, более конкретно, группы индолил, 1 Н-пирроло[2,3-b]пиридин и 1Hпирроло[3,2-h]хинолинил. Предпочтительной конфигурацией соединений формулы (I) является 2S-3R, и более конкретно, 2S-3R-4S. Еще более преимущественно, изобретение относится к(2S-3R-4S),N-[2-(5-бромо-2,3-дигидро-1 Н-инден-1 ил)-3-меркаптопропаноил]-3-(1 Н-пирроло[3,2h]хинолин-3-ил)аланину (2S-3R-4S). Настоящее изобретение также относится к способу получения соединений формулы (I),отличающемуся тем, что в качестве исходного материала применяют соединение формулы (III) в которой R3, R4 и n имеют значения, указанные для формулы (I), которое подвергают воздействию восстанавливающего агента, такого как NaBH4, например, с получением соединения формулы (IV) в которой n, R3 и R4 имеют значения, указанные здесь ранее, которое переводят при помощи галогенирующего агента, такого какMe3SiBr, например, в соответствующее галогеновое соединение формулы (V) в которой R3, R4 и n имеют значения, указанные здесь ранее, которое подвергают реакции с формальдегидом в основной среде с получением соединения формулы (VII) в которой R3, R4 и n имеют значения, указанные здесь ранее, которое гидролизируют в присутствии гидроксида натрия с получением соединения формулы (VIII) в которой R3, R4 и n имеют значения, указанные здесь ранее, которое конденсируют с соединением формулы (IX) в которой R'1 представляет собой алкильную, арильную или циклоалкильную группу, с получением соединения формулы (X) в которой В и m имеют значения, указанные для формулы (I), и R'2 представляет собой алкильную, алкенильную, циклоалкильную,циклоалкилалкильную, арильную, ацильную,арилалкильную или ароильную группу, с получением соединения формулы (I/а), частного случая соединений формулы (I) в которой R'1, R3, R4, R'2, m, n и В имеют значения, указанные здесь ранее, которое может быть частично или полностью гидролизировано в основной среде с получением соединения формулы (I/b), частного случая соединений формулы (I) в которой R3, R4, m, n и В имеют значения,указанные здесь ранее, R"1 представляет собой группу R'1 или атом водорода, и R"2 представляет собой группу R'2 или атом водорода, при ус 7 ловии, что по меньшей мере одна из групп R"1 иR"2 представляет собой атом водорода, это соединение формулы (I/b), если R"1 представляет собой атом водорода, можно поместить в кислую среду с получением соединения формулы(I/c), частного случая соединений формулы (I) в которой R2, R3, R4, m, n и В имеют значения, указание здесь ранее, и R'"1 представляет собой группу формулы (II), эти соединения формул с (I/a) по (I/с) составляют совокупность соединений по изобретению и могут, при желании, быть очищены по традиционной методике разделения, при желании, их переводят в их аддитивные соли с фармацевтически приемлемой кислотой или основанием, и их необязательно разделяют на их стереоизомеры по традиционной методике разделения. Настоящее изобретение также относится к способу получения соединений формулы (I),который отличается тем, что в качестве исходного материала применяют соединение формулы (X), как указано здесь ранее, диастереоизомеры которого разделяют при помощи хроматографии с получением соединений формул (Ха) и в которых R'1, R3, R4 и n имеют значения,указанные здесь ранее, с этим соединением формулы (Хb) можно образовать соль с хиральным амином, таким как (R)-(+)-а-метилбензиламин, например, с получением, после разделения при помощи последовательных операций рекристаллизации, соединения формулы (Хb') в которой R'2, m и В имеют значения, указанные здесь ранее, с получением соединения формулы (I/а), частного случая соединений формулы (I/а) в которой R'1. R'2, R3, R4, m, n и В имеют значения, указанные здесь ранее,диастереоизомеры (2R, 3S), (2R, 3R) и (2S,3R) получают аналогично, исходя из соответствующих соединений (Ха) и (Хb),также эти соединения можно получать при помощи конденсации соединения формулы(ХIа) с соединением формулы (Ха) или (Хb),после которой следует разделение при помощи хроматографии. Соединения формулы (III) являются либо коммерчески доступными, либо легко получаемыми специалистом при помощи традиционных химических реакций. Соединения по настоящему изобретению имеют очень ценные фармакологические свойства, так как они позволяют одновременное ингибирование: ангиотензин I преобразующего энзима(АСЕ), который несет ответственность за преобразование ангиотензина I в ангиотензин II и за разложение брадикинина до неактивных пептидов,нейтральной эндопептидазы (NEP), которая несет ответственность за разложение брадикинина и натрийуретического пептида предсердия до неактивных пептидов, и эндотелин-преобразующего энзима (ЕСЕ),который отвечает за преобразование большого эндотелина-1 в эндотелии-1. Эти энзимы играют ключевую роль в установлении соотношений между сосудорасширяющими, антитрофическими и натрийуретическими пептидами с одной стороны (брадикинин,натрийуретический пептид предсердия) и сосудосжимающими, трофическими и противонатрийуретическими пептидами с другой стороны(ангиотензин II, эндотелии-1). Более того, недавно было показано, что нейтральная эндопептидаза вовлечена в механизмы разложения эндотелина-1. Ингибирование одного и/или другого из этих энзимов делает возможным модулирование пептидергического баланса. Различные смешанные ингибиторыACE/NEP, описанные в литературе, таким образом повышают часть сосудорасширяющих пептидов по отношению к сосудосжимающим пептидам. Однако этот подход предвидит роль, которую играет эндотелиновая система, которая является более вредной, потому что смешанные ингибиторы, ингибируя NEP, повышают уровни эндотелина-1, что приводит к снижению ожидаемого терапевтического благоприятного эффекта. 9 Тройное ингибирование позволяет избежать накопления эндотелина-1, и таким образом ведет к усиленной терапевтической эффективности и к расширению спектра активности соединений. Эти свойства обозначают, что их можно применять терапевтически при лечении артериальной гипертензии, включая легочную артериальную гипертензию, ишемии миокарда, стенокардии, сердечной недостаточности, васкулопатий, включая диабетические васкулопатий, атеросклероза и постангиопластического рестеноза, острой или хронической почечной недостаточности, сосудистых заболеваний головного мозга, включая удар и субарахноидальное кровоизлияние, периферийной ишемии и токсичности к циклоспорину. Настоящее изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I), отдельно или в комбинации с одним или более фармацевтически приемлемыми эксципиентами. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно те, которые пригодны для орального, парентерального, назального, на- или чрескожного, ректального, наязычного, глазного или респираторного применения, и, например, таблетки или драже, подъязычные таблетки, саше, пакетики,желатиновые капсулы, глазированные таблетки,пастилки, суппозитории, кремы, мази, кожные гели и питьевые или инъекционные капсулы. Полезная дозировка может варьироваться в зависимости от пола, возраста и веса пациента,способа приема и природы терапевтического показания, а также любых связанных лечений и варьируется от 0,1 мг до 1 г в 24 ч за один или более приемов. Нижеследующие примеры иллюстрируют изобретение, но не ограничивают его никоим образом. Следующие получения дают соединения по изобретению или промежуточные продукты синтеза для применения в получении по изобретению. Получение 1. 5-Бромо-1-инданон. Стадия А. 1-(4-Бромофенил)-3-хлоро-1 пропанон. 45,3 г хлорида алюминия перемешивают при комнатной температуре в 80 мл СН 2 Сl2. Поддерживая энергичное перемешивание, раствор хлорида п-пропионовой кислоты (38,09 г,28,7 мл, 0,3 моль) медленно выливают в 20 мл СН 2 Сl2. Быстро образуется СН 2 Сl2-АlCl3 кислотно-хлоридный комплекс и раствор окрашивается в темно-красный цвет. Раствор бромобензола (47,1 г, 31,6 мл, 0,3 моль) затем вводят по каплям в 20 мл СН 2 Сl2. Раствор затем перемешивают на протяжении 15 ч при комнатной температуре. Смесь гидролизируют над 190 г льда, к которому добавлено 7,6 мл концентрированной уксусной кислоты. Органическую фа 005004 10 зу нейтрально промывают и растворитель удаляют при помощи выпаривания при сниженном давлении. Получают темно-красное масло, из которого получают заглавное соединение в виде желтоватого твердого вещества при помощи экстрагирования в горячем состоянии петролейным эфиром. Точка плавления: 60-61 С. Стадия В. 5-Бромо-1-инданон. Смесь 448 г АlСl3 (335,98 ммоль) и 112 гNaCl доводят до 180 С в реакторе. Смесь медленно перемешивают во время введения соединения, полученного на стадии А (44,77 г, 180,9 ммоль), используя шпатель. Температуру поддерживают при 180-220 С. Реакция продолжается на протяжении 30 мин. Гидролиз над 4,5 кг льда в присутствии 135 мл уксусной кислоты дает темно-коричневый осадок, который отфильтровывают, промывают водой и сушат invacua. Заглавное соединение выделяют при помощи рекристаллизации из метанола. Точка плавления: 126-127 С. Получение 2. 1-Оксо-5-инданкарбонитрил. Смесь 5 г соединения, полученного в получении 1 (23 ммоль), и 2,65 г CuCN в 6 мл.DMF нагревают с обратным холодильником в атмосфере аргона. После перемешивания при 120 С на протяжении 15 ч, смесь добавляют к раствору 11,2 г FeCl3 в 35 мл воды и 6 мл концентрированной соляной кислоты. Смесь выдерживают при 60-71 С на протяжении 15 мин. Смесь экстрагируют 3 х 20 мл 10% NaHCO3,сушат над Na2SO4 и концентрируют in vacua с получением заглавного соединения в виде слегка желтоватого твердого вещества. Точка плавления: 129-130 С. Получение 3. 5-(Метилтио)-1-инданон. 1,27 г CH3SNa (18,13 ммоль; 1,2 экв.) помещают в 30 мл DMF при 0 С. Соединение, полученное в получении 1 (3,19 г; 15,11 ммоль),вводят и смесь перемешивают при комнатной температуре на протяжении 3 ч. Реакционную смесь затем выливают в 150 мл воды и экстрагируют AcOEt. Органическую фазу сушат надNa2SO4 и концентрируют in vacua с получением заглавного соединения в виде коричневатого кристаллического продукта. Точка плавления: 99-102 С. Получение 4. 5-Гидрокси-1-инданон. 5 г 5-метокси-1-инданона (30,9 ммоль) добавляют в атмосфере аргона к суспензии 10,31 г хлорида алюминия в 150 мл безводного толуола. Суспензию энергично перемешивают при температуре флегмы. После реагирования на протяжении 30 мин смеси дают вернуться к комнатной температуре и добавляют 30 г льда. Органическую фазу отделяют. Водную фазу промывают 2 х 30 мл этилацетата. Органические фазы объединяют, промывают 4 х 50 мл воды,сушат над Na2SO4 и концентрируют in vacua с получением заглавного соединения в виде слег 11 ка коричневатого твердого вещества. Точка плавления: 183 С. Получение 5. 5-Этокси-1-инданон. 3 г соединения, полученного в получении 4(20,2 ммоль), 5 мл этил йодида и 8,4 г карбоната калия в 200 мл ацетона нагревают с обратным холодильником при перемешивании. После реагирования на протяжении трех часов, суспензию фильтруют, и осадок промывают ацетоном. Ацетон удаляют при сниженном давлении. Твердый остаток отбирают в 25 мл хлороформа,промывают 2 х 10 мл воды, предварительно сушат при помощи концентрированного раствора хлорида натрия, фильтруют над Na2SO4, и концентрируют in vacua. Заглавное соединение получают в виде оранжеватого твердого вещества. Точка плавления: 82-83 С. Получение 6. 5-Хлоро-1-инданон. Способ такой же, как и для получения 1,исходя из хлоробензола. Получение 7. 5-(Диметиламино)-1-инданон. Стадия А. N-(2,3-Дигидро-1 Н-инден-5 ил)ацетамид. Смесь 70 мл уксусного ангидирда и 15 г ацетата натрия добавляют по каплям, при перемешивании, к 50 г 5-аминоиндана. В конце экзотермической реакции раствор нагревают при 100 С на протяжении одного часа. Раствор затем выливают в 500 г льда; наблюдают образование осадка, который собирают при помощи фильтрации и отбирают в 400 мл этилацетата. Раствор промывают 2 х 250 мл воды, 2 х 200 мл. 20% раствора гидрогенкарбоната натрия, сушат над Na2SO4 и концентрируют in vacua. Заглавное соединение получают в виде желтого твердого вещества. Точка плавления: 105-106 С. Стадия В. N-(1-Оксо-2,3-дигидро-1Hинден-5-ил)ацетамид. Раствор 50 г триоксида хроминия, растворенного в смеси 35 мл воды и 150 мл уксусной кислоты добавляют по каплям, при перемешивании, к 62 г соединения, полученного на стадии А в смеси 175 мл уксусной кислоты и 50 мл уксусного ангидирда таким образом, чтобы реакционная смесь оставалась при температуре ниже 10 С. После ночи при комнатной температуре раствор выливают в 1 л ледяной воды. Наблюдают образование осадка, который собирают при помощи фильтрации. Осадок промывают водой до нейтрализации и затем сушат в эксикаторе с получением заглавного соединения в виде желтого твердого вещества. Точка плавления: 172 С. Стадия С. 5-Амино-1-инданон. 47 г соединения, полученного на стадии В,растворенного в 700 мл 1,5 Н соляной кислоты доводят до температуры флегмы. После реагирования на протяжении одного часа исходный материал полностью переходит в раствор, раствору дают вернуться к комнатной температуре. Реакционную смесь выливают в 800 мл 2 М рас 005004 12 твора гидроксида натрия. Осадок отфильтровывают и промывают водой до нейтрализации с получением заглавного соединения в виде желтого твердого вещества. Точка плавления: 184 С. Стадия D. 5-(Диметиламино)-1-инданон. 5 г соединения, полученного на стадии С(20,2 ммоль), 8,1 мл метил йодида и 7,2 г карбоната натрия в 30 мл ацетона доводят до температуры флегмы при перемешивании. После одной ночи растворитель удаляют in vacua, получая твердое вещество, которое отбирают в смесь 100 мл этилацетата и 50 мл воды. Органическую фазу отделяют, промывают 4 х 50 мл воды, и затем 50 мл концентрированного раствора хлорида натрия, сушат над Nа 2SO4, и концентрируют in vacua. Получают оранжеватый кристаллический продукт, который очищают при помощи хроматографии над нейтральным глиноземом. Точка плавления: 116 С. Пример 1. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)-пропаноил] амино-3-(1 Н-индол-3-ил)пропаноат. Стадия А. 5-Бромо-1-инданол. Соединение, полученное в получении 1(72,99 ммоль), суспендируют в 380 мл МеОН, и по порциям добавляют борогидрид натрия(145,97 ммоль, 5,54 г) при комнатной температуре. Как только начинается высокоэкзотермическая реакция, температуру контролируют,применяя ледяную баню (Т 40 С). Реакционную смесь затем перемешивают на протяжении 4 ч при комнатной температуре, добавляют 60 мл воды, и проводят концентрирование при сниженном давлении. К получившемуся маслу добавляют 100 мл воды, его экстрагируют 1 х 200 мл AcOEt. Органическую фазу отделяют,промывают концентрированным NaCl, сушат над Na2SO4 и затем концентрируют при сниженном давлении с получением заглавного соединения в виде масла, которое кристаллизируется. Точка плавления: 79-80 С. Стадия В. 1,5-Дибромоиндан. Соединение, полученное на стадии А(70,19 ммоль), растворяют в 420 мл СНСl3, и бромотриметилсилан (13,90 мл, 105,28 ммоль,1,5 экв.) добавляют при комнатной температуре. Реакционную смесь перемешивают на протяжении ночи при комнатной температуре. Растворитель и избыток бромотриметилсилана удаляют при помощи выпаривания при сниженном давлении. Масло отбирают в 150 мл СНСl3,промывают 2 х 80 мл воды и 3 х 100 мл концентрированного NaCl и сушат над Na2SO4. Органическую фазу затем концентрируют при сниженном давлении с получением заглавного соединения в виде коричневого масла. Стадия С. Этил 2-(5-бромо-2,3-дигидро 1 Н-инден-1-ил)-2-(диэтоксифосфорил)ацетат. Триэтил фосфоноацетат (15,47 г, 13,63 мл,69,06 ммоль) растворяют, при 0 С в атмосфере аргона, в 345 мл дегазированного DMF, и затем 13 добавляют 60% NaH (3,04 г, 75,97 ммоль, 1,1 экв.) в небольших количествах. Реакционную смесь перемешивают на протяжении 30 мин при комнатной температуре и единоразово добавляют соединение, полученное на стадии В(69,06 ммоль). Смесь перемешивают на протяжении ночи при комнатной температуре. Растворитель выпаривают при сниженном давлении и остаток отбирают в 150 мл воды и экстрагируют 2 х 200 мл AcOEt. Органическую фазу промывают водой (2 х 100 мл), концентрированным NaCl (2 х 150 мл), сушат над Na2SO4 и затем концентрируют при сниженном давлении с получением заглавного соединения в виде масла. Стадия D. Этил 2-(5-бромо-2,3-дигидро 1 Н-инден-1-ил)акрилат. Соединение, полученное на стадии С(76,18 ммоль), параформальдегид (4,60 г, 152,36 ммоль, 2 экв.), и K2 СО 3 (20,98 г, 2 экв.) нагревают с обратным холодильником в 350 мл THF на протяжении 15 ч. Смесь концентрируют до трех четвертей, добавляют 100 мл воды и смесь экстрагируют эфиром. Органическую фазу промывают водой, концентрированным NaCl, сушат над Na2SO4 и затем концентрируют при сниженном давлении с получением заглавного соединения в виде масла. Стадия Е. 2-(5-Бромо-2,3-дигидро-1 Нинден-1-ил)акриловая кислота. Сложный эфир, полученный на стадии D(114,27 ммоль, 1,5 экв.) перемешивают в 240 мл. ацетона при комнатной температуре на протяжении 24 ч. Растворители удаляют при помощи выпаривания и остаток отбирают в воду. Водную фазу экстрагируют эфиром и затем подкисляют 3 Н НСl и в конце экстрагируют эфиром. Органическую фазу промывают водой, концентрированным NaCl, сушат над Na2SO4 и затем концентрируют при сниженном давлении с получением заглавной кислоты. Стадия F. 3-(Ацетилтио)-2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)пропановая кислота. Этиленовое соединение, полученное на Стадии Е (48,83 ммоль) растворяют в 100 мл СНСl3 и добавляют тиоуксусную кислоту(170,89 ммоль, 3,5 экв.). Смесь перемешивают с обратным холодильником на протяжении 16 ч. Растворитель и избыток тиоуксусной кислоты удаляют при помощи выпаривания при сниженном давлении с получением заглавного соединения в виде четырех стереоизомеров, которые можно разделить на две пары энантиомеров:- при помощи ЖХВР хроматографии: ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 60-40,Rt (2S-3S/2R-3R)=11,44 мин,Rt (2S-3R/2R-3S)=12,05 мин ЭСИ масс: 343-345 (МН+);- при помощи разделения хиральным амином: 14 8,36 г (24,37 ммоль) полученной смеси растворяют в 50 мл Et2O и затем добавляютR(+)-(a)-метилбензиламина (1,05 экв., 25,59 ммоль, 3,30 мл). Смесь помещают в холодную камеру при 4 С на 7 дней. Осадок собирают в суспензию в эфире и добавляют 2 Н НСl до достижения рН 1. Органическую фазу промывают водой и затем сушат над Na2SO4, с получением изомера (2S-3R). Стадия G. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-м-инден-1-ил)-пропаноил] амино-3-(1 Н-индол-3-ил)пропаноат. Общий способ применим к смести четырех диастереоизомеров или к энантиомерным парам: Соединение, полученное на стадии F(смесь пар энантиомеров) (100 мг) растворяют в 2 мл смеси THF-CHCl3, 1-1. К этому раствору добавляют 1,5 экв. EDCl, 1,5 экв. НОВТ, 1,5 экв.(L)триптофана. Полученную смесь перемешивают при комнатной температуре на протяжении 4 ч. Растворители удаляют при сниженном давлении. Остаток отбирают в 15 мл этилацетата, и органическую фазу промывают 3 х 10 мл 10% раствора гидрогенкарбоната натрия, 3x10 мл 10% раствора лимонной кислоты и 3 х 10 мл концентрированного раствора хлорида натрия,сушат над Na2SO4 и концентрируют in vacua. Пример 1 a) 2S-3S-4S. Масло, выделенное при помощи ЖХВР хроматографии. Пример 1 b) 2R-3R-4S. Пример 1 с) 2S-3R-4S. Масло, выделенное при помощи ЖХВР хроматографии. Пример 1 d) 2R-3S-4S. Пример 2. Метил 2-(3-(ацетилтио)-2-(5 циано-23-дигидро-1 Н-инден-1-ил)-пропаноил] амино-3-(1H-индол-3-ил)пропаноат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 2. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 3. Метил 2-3-(ацетилтио)-2-(5 метилтио-2,3-дигидро-1 Н-инден-1-ил)пропаноил]амино-3-(1H-индол-3-ил)пропаноат. Стадия А. 5-Метилтио-1-инданол. Способ такой же, как для стадии А примера 1, исходя из соединения, полученного в получении 3. Стадия В. Этил 2-(5-метилтио-2,3-дигидро 1 Н-инден-1-ил)-2-(диэтоксифосфорил) ацетат. 22 ммоль бромотриметилсилана добавляют, при перемешивании в атмосфере аргона, к раствору 20 ммоль соединения, полученного на стадии А в 50 мл безводного THF при -78 С. Температуре смеси дают подняться до -20 С. Этот раствор добавляют к раствору триэтил фосфоноацетатного аниона, полученному действием гидрида натрия (20 ммоль) триэтил фосфоноацетатацетат (22 ммоль). После ночи при 15 комнатной температуре, растворитель удаляют и остаток очищают при помощи хроматографии на силикагеле. Заглавное соединение получают в виде масла. Стадия С. Метил 2-[3-(ацетилтио)-2-(5 метилтио-2,3-дигидро-1 Н-инден-1-ил)-пропаноил]амино-3-(1 Н-индол-3-ил)пропаноат. Способ такой же, как для стадий D, E, F иG примера 1. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 4. Метил 2-[3-(ацетилтио)-2-(5 метокси-23-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(1H-индол-3-ил)пропаноат. Способ такой же, как в примере 3, исходя из 5-метокси-1-инданона. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 5. Метил 2-[3-(ацетилтио)-2-(4 метокси-2,3-дигидро-1 Н-инден-1-ил)-пропаноил]амино-3-(1 Н-индол-3-ил)пропаноат. Способ такой же, как в примере 1, исходя из 4-метокси-1-инданона. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 6. Метил 2-[3-(ацетилтио)-2-(6 метокси-2,3-дигидро-1H-инден-1-ил)-пропаноил]амино-3-(1H-индол-3-ил)пропаноат. Способ такой же, как в примере 3, исходя из 6-метокси-1-инданона. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 7. Метил 2-[3-(ацетилтио)-2-(5 гидрокси-23-дигидро-1 Н-инден-1-ил)пропаноил]амино-3-(1 Н-индол-3-ил)пропаноат. Стадия А. 3-(Ацетилтио)-2-(5-гидрокси 2,3-дигидро-1 Н-инден-1-ил)пропановая кислота. Соединение, полученное на стадии F примера 1 (смесь из четырех диастереоизомеров)(0,4 г, 1,4 ммоль), растворяют в 3 мл СН 2 Сl2 и полученный раствор охлаждают до 0 С. К смеси добавляют 1,3 мл 1 М раствора трибромида бора в CH2Cl2. После перемешивания на протяжении 15 мин при комнатной температуре смесь выдерживают при 40 С на протяжении 30 мин. Раствор затем гидролизируют 6 мл воды, и затем подкисляют при помощи 2 мл 1 Н НСl. Раствор экстрагируют 2x15 мл эфира. Органические фазы объединяют, дважды промывают 20 мл воды и затем предварительно сушат при помощи 15 мл концентрированного раствора хлорида натрия, и сушат над Na2SO4 и затем концентрируют in vacua, с получением масла, которое очищают при помощи пролу-препаративной ЖХВР. Стадия В. Метил 2-[3-(ацетилтио)-2-(5 гидрокси-2,3-дигидро-1 Н-инден-1-ил)пропаноил]амино-3-(1 Н-индол-3-ил)пропаноат. Способ такой же, как для стадии G примера 1. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. 16 Пример 8. Метил 2-[3-(ацетилтио)-2-(5 этокси-2,3-дигидро-1H-инден-1-ил)пропаноил] амино-3-(1H-индол-3-ил)пропаноат. Способ такой же, как в примере 3, исходя из соединения, полученного в получении 5. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 9. Метил 2-[3-(ацетилтио)-2-(5 хлоро-2,3-дигидро-1H-инден-1-ил)пропаноил] амино-3-(1 Н-индол-3-ил)пропаноат. Способ такой же, как в примере 1, исходя из соединения, полученного в получении 6. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 10. Метил 2-[3-(ацетилтио)-2-(5 диметиламино-2,3-дигидро-1H-инден-1-ил)пропаноил]амино-3-(1H-индол-3-ил)пропаноат. Способ такой же, как в примере 3, исходя из соединения, полученного в получении 7. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 11. Метил 2-[3-(ацетилтио)-2(2,3-дигидро-1 Н-инден-1-ил)пропаноил]амино-3-(1H-индол-3-ил)пропаноат. Способ такой же, как в примере 1, исходя из инданона. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 12. Метил 2-(3-(ацетилтио)-2(1,2,3,4-тетрагидро-1-нафталенил)пропаноил] амино-3-(1 Н-индол-3-ил)пропаноат. Способ такой же, как в примере 1, исходя из 3,4-дигидро-1(2 Н)-нафталенона. Последнюю стадию проводят в смеси из четырех диастереоизомеров. Масло. Пример 13. N-[2-(5-Бромо-2,3-дигидро-1 Нинден-1-ил)-3-меркаптопропаноил]триптофан. Соединение, полученное в примере 1 растворяют в 2 мл дегазированного метанола. После 10 минутного перемешивания при комнатной температуре к раствору добавляют 6 экв. дегазированного 1 М раствора гидроксида натрия. Полученный раствор перемешивают при комнатной температуре в атмосфере аргона. Протекание реакции отслеживают при помощи ЖХВР. Когда реакция завершается, раствор подкисляют до рН = 1 при помощи 1 Н соляной кислоты. Метанол удаляют in vacua, к остатку добавляют 10 мл воды и проводят экстрагирование при помощи 10 мл хлороформа. Органическую фазу сушат над Na2SO4 и концентрируют in vacua. Пример 13 a): 2S-3S-4S [a]15D=+8,80. Точка плавления (разложение)= 163-165 С. Пример 13 b): 2R-3R-4S [a]I5D=-27,20. Точка плавления (разложение)=135-136 С. Пример 13 с): 2S-3R-4S [a]15D = +20,80. Точка плавления (разложение)=126-128 С. Пример 13 d): 2R-3S-4S [a]15D = -66,80. Точка плавления (разложение)=130-132 С. Примеры с 14 по 24 получают, следуя примеру 13, исходя из соответствующих соединений. 18 Пример 25. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(2-хинолил)пропаноат. Соединение, полученное на стадии F примера 1 (смесь из четырех диастереоизомеров)(100 мг), растворяют в 2 мл смеси THF-CHCl3,1-1. К этому раствору добавляют 1,5 экв. EDCI,1,5 экв. НОВТ, 1,5 экв. Et3N и 1,5 экв. метил (S)2-амино-3-(2-хинолил)пропаноата. Полученную смесь перемешивают при комнатной температуре на протяжении 4 ч. Растворители удаляют при сниженном давлении. Остаток отбирают в 15 мл этилацетата и органическую фазу промывают 3 х 10 мл 10% раствора гидрогенкарбоната натрия 3x10 мл 10% раствора лимонной кислоты и 3 х 10 мл концентрированного раствора хлорида натрия. сушат над Na2SO4 и концентрируют in vacua. Заглавное соединение получают при помощи ЖХВР хроматографии. Масло. Пример 26. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1H-инден-1-ил)пропаноил] амино-3-(1-метил-1H-индол-3-ил)пропаноат. Способ такой же, как в примере 25, заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил (S)-2-амино-3-(1-метил-1 Н-индол-3 ил)пропаноат. Масло. Пример 27. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(1 Н-пирроло[2,3-b]пиридин-3-ил) пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2R-3S) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат метил 2-амино-3-(1 Н-пирроло[2,3-b]пиридин-3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР Kromasil 19 Способ такой же, как в примере 25, заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил (S)-2-амино-3-(3-пиридинил)пропаноат. Пример 31. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-3-(2-хинолил)аланин. Соединение, полученное в примере 25,растворяют в 2 мл дегазированного метанола. После 10 минутного перемешивания при комнатной температуре к раствору добавляют 6 экв. дегазированного 1 М раствора гидроксида натрия. Полученный раствор перемешивают при комнатной температуре в атмосфере аргона. Протекание реакции отслеживают при помощи ЖХВР. По завершении реакции раствор подкисляют до рН = 1 при помощи 1 Н соляной кислоты. Метанол удаляют in vacua, к остатку добавляют 10 мл воды и проводят экстракцию при помощи 10 мл хлороформа. Органическую фазу отделяют, сушат над Na2SO4, концентрируют invacua, и очищают при помощи ЖХВР хроматографии. Твердое вещество. ЭСИ масс = 499-501(МН+). Примеры с 32 по 36 получают, следуя примеру 31, исходя из соответствующего субстрата. Пример 32. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-1-метилтриптофан. Исходный материал: пример 26. Твердое вещество. ЭСИ масс: 501-503 (МН+). Пример 33. N-[2-(5-Бромо-2,3-дигидро-1 Нинден-1-ил)-3-меркаптопропаноил]-3-(1H-пирроло[2,3-b]пиридин-3-ил)аланин. Исходный материал: пример 27 а) или пример 27b). Твердое вещество. ЭСИ масс: 488-490 (МН+). Пример 33 a) 2S-3R-4S : Rt = 4,99 мин. Пример 33 b) 2S-3R-4R : Rt = 5,49 мин. Пример 34. 3-(1-Бензотиен-3-ил)-N-(5 бромо-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]аланин. Исходный материал: пример 28. Твердое вещество. ЭСИ масс: 500-502 (МН+). Пример 35. N-[2-(5-Бромо-2,3-дигидро-1 Нннден-1-ил)-3-меркаптопропаноил]гистидин. Исходный материал: пример 29. Твердое вещество. ЭСИ масс: 438-440 (MH+). Пример 36. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-3-(3-пиридинил)аланин. Исходный материал: пример 30. Твердое вещество. ЭСИ масс: 448-450 (MH+). Пример 37. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(1-тритил-1 Н-имидазол-4-ил)пропаноат. 20 Соединение, полученное на стадии F примера 1 (300 мг), растворяют в 8 мл смеси THFCHCl3, 1-1. К этому раствору добавляют 1,5 экв.EDCI, 1,5 экв. НОВТ, 1,5 экв. Et3N и 1,5 экв. метил (S)-2-амино-3-(1-тритил-1 Н-имидазол-4 ил)пропаноата. Полученную смесь перемешивают при комнатной температуре на протяжении 4 ч. Растворители удаляют при сниженном давлении. Остаток отбирают в 15 мл этилацетата, и органическую фазу промывают 3 х 20 мл 10% раствора гидрогенкарбоната натрия, 3 х 20 мл 10% раствора лимонной кислоты, и 3 х 20 мл концентрированного раствора хлорида натрия,сушат над Na2SCO4, концентрируют in vacua и очищают при помощи ЖХВР хроматографии. Масло. Пример 38. N-[2-(5-Бромо-2,3-дигидро-1 Нинден-1-ил)-3-меркаптопропаноил]-1-тритилгистидин. Соединение, полученное в примере 37,растворяют в 5 мл дегазированного метанола. После 10-минутного перемешивания при комнатной температуре к этому раствору добавляют 4 экв. дегазированного 1 М раствора гидроксида натрия. Полученный раствор перемешивают при комнатной температуре в атмосфере аргона на протяжении 5 ч. Протекание реакции отслеживают при помощи ЖХВР. По завершении реакции, раствор подкисляют до рН = 1 при помощи 1 Н соляной кислоты. Метанол удаляютin vacua, к остатку добавляют 10 мл воды и проводят экстракцию при помощи 10 мл хлороформа. Органическую фазу отделяют, сушат надNa2SO4, концентрируют in vacua и очищают при помощи ЖХВР хроматографии. Твердое вещество. Примечание: соединение примера 35 можно получить, исходя из соединения примера 38,по следующему способу. Соединение, полученное в примере 38,растворяют в 10 мл смеси 95/2.5/2,5 TFА/ Н 2 О/этандитиол. После 30-минутного перемешивания при комнатной температуре в атмосфере аргона, растворители удаляют in vacua. Продукт очищают при помощи ЖХВР. Пример 39. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(7-метокси-1 Н-индол-3-нл)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(7-метокси-1 Н-индол-3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматoграфии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм. СН 3 СN-Н 2 О 21 Пример 40. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(5-гидрокси-1H-нндол-3-ил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(5-гидрокси-1 Ниндол-3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВРKromasil С 18 5 100 А, 250 х 4,6 мм, CH3CNH2O (0,05% TFA) 60-40. Пример 40 а) (1-ый диастереоизомер): Rt = 9,20 мин - масло. Пример 40b) (2-ой диастереоизомер): Rt = 9,29 мин - масло. Пример 41. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(5-метокси-1H-индол-3-ил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил) пропаноат на метил 2-амино-3-(5-метокси-1 Ниндол-3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВРKromasil C18 5 100 А, 250 х 4,6 мм. CH3CNH2O (0,05% TEA) 70-30. Пример 41 а) (1-ый диастереоизомер): Rt = 9,54 мин - масло. Пример 41b) (2-ой диастереоизомер): Rt = 10,11 мин - масло. Пример 42. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1H-инден-1-ил)пропаноил] амино-3-(5-бромо-1 Н-индол-3-ил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(5-бромо-1 Н-индол 3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil С 18 5 100 А, 250 х 4,6 мм, CH3CN-H2O(0.05%TFA) 70-30. Пример 42 а) (1-ый диастереоизомер): Rt = 16,36 мин - масло. Пример 42b) (2-ой диастереоизомер): Rt = 16,83 мин - масло. Пример 43. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-м-инден-1-ил)пропаноил] амино-3-(5-метил-1H-индол-3-ил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(5-метил-1 Н-индол 3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при по 005004 22 мощи ЖХВР хроматографии : ЖХВР Kromasil С 18 5 100 А, 250 х 4,6 мм, CH3CN-H2O (0,05%TFA) 70-30. Пример 43 а) (1-ый диастереоизомер): Rt = 14,10 мин - масло. Пример 43b) (2-ой диастереоизомер): Rt = 14,53 мин - масло. Пример 44. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1H-инден-1-ил)пропаноил] амино-3-(6-метил-1 Н-индол-3-ил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(6-метил-1 Н-индол 3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР KromasilTFA) 70-30. Пример 44 а) (1-ый диастереоизомер): Rt = 14,00 мин - масло. Пример 44b) (2-ой диастереоизомер): Rt = 14,54 мин - масло. Пример 45. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(6-фторо-1 Н-индол-3-ил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(6-фторо-1 Н-индол 3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР KromasiiTFA) 60-40. Пример 45 а) (1-ый диастереоизомер): Rt = 11,09 мин - масло. Пример 45b) (2-ой диастереоизомер): Rt = 11,90 мин - масло. Пример 46. Метил 2-[3-(ацетилтио)-2-(5 бромо-23-дигидро-1H-инден-1-ил)пропаноил] амино-3-(5-фторо-1 Н-индол-3-ил)пропаноат. Способ такой же. как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(5-фторо-1 Н-индол 3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil 23 Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(1 Н-индазол-3 ил)пропаноат (рацемическая смесь). Rt смесьCH3CN-Н 2O (0,05% TFА) 70-30) = 7,87 мин. Масло. Пример 48. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(1H-пирроло[2,3-с]пирндин-3-ил) пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(1 Н-пирроло[2,3-с] пиридин-3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВРKromasil C18 5 100 А, 250 х 4,6 мм, CH3CNH2O (0,05% TFA) 50-50. Пример 48 а) (1-ый диастереоизомер): Rt = 4,70 мин - масло. Пример 48b) (2-ой диастереоизомер): Rt = 5,62 мин - масло. Пример 49. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1 Н-инден-1-ил)пропаноил] амино-3-(9-акридинилил)пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 3-(9-акридинил)-2-аминопропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм, CH3CN-H2O (0,05% TFA) 50-50. Пример 49 а) (1-ый диастереоизомер) : Rt = 6,48 мин - масло. Пример 49b) (2-ой диастереоизомер): Rt = 7,00 мин - масло. Пример 50. Метил 2-[3-(ацетилтио)-2-(5 бромо-2,3-дигидро-1H-инден-1-ил)пропаноил] амино-3-(1 Н-пирроло[3,2-h]хинолин-3-ил) пропаноат. Способ такой же, как в примере 25, исходя из очищенного диастереоизомера (2S-3R) соединения, полученного на стадии F примера 1, и заменяя метил (S)-2-амино-3-(2-хинолил)пропаноат на метил 2-амино-3-(1 Н-пирроло[3,2-h] хинолин-3-ил)пропаноат (рацемическая смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР 24 Пример 51. Метил 2-[3-(ацетилтио)-2-(5 метокси-2,3-Дигидро-1 Н-инден-1-ил)пропаноил]амино-3-(5-гидрокси-1H-индол-3-ил) пропаноат. Способ такой же, как в примере 1, исходя из 5-метокси-1-инданон и, на стадии G, конденсируя гидрохлорид метилового эфира 5 гидрокситриптофана с очищенным диастереоизомером (2S-3R) соединения, полученного на стадии F. Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 60-40. Пример 51 а) (1-ый диастереоизомер): Rt = 5,80 мин - масло. Пример 51 b) (2-ой диастереоизомер): Rt = 6,10 мин - масло. Пример 52. N-[2-(5-Бромо-2,3-дигидро-1 Нинден-1-ил)-3-меркаптопропаноил]-7-метокситриптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 39(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0.05% TFA) 70-30. Пример 52 а) (1-ый диастереоизомер): Rt = 6,57 мин - твердое вещество пример 52b) (2-ой диастереоизомер): Rt = 6,16 мин - твердое вещество ЭСИ масс: 517-519 (MH+). Пример 53. N-[2-(5-Бромо-23-дигидро-1 Нинден-1-ил)-3-меркаптопропаноил]-5-гидрокситриптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 40 а): Пример 53 а) (2S-3R-4S): Rt = 3,91 мин.(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 70-30. Пример 54 а) (2S-3R-4S): Rt = 5,55 мин твердое вещество - ЭСИ масс: 517-519 (МН+). Пример 54b) (2S-3R-4R): Rt = 5,77 мин твердое вещество - ЭСИ масс : 517-519 (MH+). Пример 55. 5-Бромо-N-[2-(5-бромо-23 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил] триптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 42(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 70-30. Пример 55 а) (1-ый диастереоизомер): Rt = 7,94 мин - твердое вещество ЭСИ масс: 565-567569 (МН+). Пример 55b) (2-ой диастереоизомер): Rt = 8,63 мин - твердое вещество - ЭСИ масс: 565567-569 (МH+). Пример 56. N-[2-(5-Бромо-2,3-дигидро-1 Нинден-1-ил)-3-меркаптопропноил]-5-метилтриптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 43(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 70-30. Пример 56 а) (1-ый диастереоизомер): Rt = 6,94 мин -твердое вещество - ЭСИ масс: 501-503(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 70-30. Пример 57 а) (1-ый диастереоизомер): Rt = 7,13 мин - твердое вещество - ЭСИ масс: 501503 (МН+). Пример 57b) (2-ой диастереоизомер): Rt = 7,67 мин - твердое вещество - ЭСИ масс: 501503 (МН+). Пример 58. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-6-фторотриптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 45(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 70-30. Пример 58 а) (1-ый диастереоизомер): Rt = 6,10 мин - твердое вещество - ЭСИ масс: 505507 (МН+). Пример 58b) (2-ой диастереоизомер): Rt = 6,40 мин - твердое вещество - ЭСИ масс: 505507 (МН+). Пример 59. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-5-фторотриптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 46(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 70-30. Пример 59 а) (2S-3R-4S): R, = 6,09 мин твердое вещество - ЭСИ масс : 505-507 (МН+). Пример 59b) (2S-3R-4R): Rt = 5,99 мин твердое вещество - ЭСИ масс : 505-507 (МН+). Пример 60. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-3-(1 Н-индазол-3-ил)аланин. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 47(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 60-40. Пример 60 а) (2S-3R-4S): Rt = 7,22 мин твердое вещество - ЭСИ масс : 488-490 (МН+). Пример 60b) (2S-3R-4R): Rt= 7,75 мин твердое вещество - ЭСИ масс : 488-490 (МН+). Пример 61. N-[2-(5-Бромо-2,3-дигидро-1Hинден-1-ил)-3-меркаптопропаноил]-3-(1 Н-пирроло[2,3-с]пиридин-3-ил)аланин. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 48(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии: ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм,CH3CN-H2O (0,05% TFA) 50-50. Пример 61 а) (1-ый диастереоизомер): Rt = 3,35 мин - твердое вещество -ЭСИ масс: 488-490Rt смесь (ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм, CH3CN-H2O(0,05%TFA)50-50)=4,02 мин Твердое вещество - ЭСИ масс: 546-548(смесь). Два полученных диастереоизомера разделяют при помощи ЖХВР хроматографии : ЖХВР Kromasil C18 2 100 А, 250 х 4,6 мм.CH3CN-H2O (0,05% TFA) 60-40. Пример 63 а) (2S-3R-4S): Rt = 3,50 мин твердое вещество - ЭСИ масс : 538-540 (МH+). Пример 63b) (2S-3R-4R): Rt = 3,19 мин твердое вещество - ЭСИ масс : 538-540 (МH+). Пример 64. 5-Гидрокси-N-[3-меркапто-2(5-метокси-2,3-дигидро-1 Н-инден-1-ил)пропаноил]триптофан.Rt смесь (ЖХВР Kromasil C18 5 100 А, 250 х 4,6 мм, CH3CN-H2O (0,05% TFA) 60-40)=4,00 мин - твердое вещество. Пример 65. Метил 2-[3-(ацетилтио)-2(5,6-диметокси-2,3-дигидро-1H-инден-1-ил) пропаноил]амино-3-(5-гидрокси-1 Н-индол-3 ил)пропаноат. Способ такой же, как в примере 1, исходя из 5,6-диметокси-1-инданона и, на стадии G. конденсируя гидрохлорид метилового эфира 5 гидрокситриптофана с соединением, полученным на стадии F (смесь). Масло. Пример 66. N-[2-(5,6-Диметокси-2,3-дигидро-1H-инден-1-ил)-3-меркаптопропаноил]-5 гидрокситриптофан. Способ такой же, как в примере 13, исходя из соединения, полученного в примере 65Rt смесь (ЖХВР Kromasil С 18 5 100 А. 250 х 4,6 мм, CH3CN-H2O(0.05%TFA)60-40) - 5,16 мин - твердое вещество. Фармакологическое изучение Пример А. Ингибирование нейтральной эндопептидазы. Нейтральную эндопептидазу очищают из кроличьей почки по способу, описанному Aubry и др. (Biochem. Cell Biol., 1987, 65, сс. 10371042). Энзиматическую активность измеряют,используя флуоресцентный субстрат, DansylGly-(p-NO2)PheAla-(DGNPA), Km = 37 М(Goudreau N. и др., Anal. Biochem., 1994, 219, cc 87-95). Соединения по изобретению проявляют отличную способность ингибировать нейтральную эндопептидазу при значениях Ki от 2 до 50 нМ. В качестве примера, соединения примеров 33 (2S-3R-4S), 13 (2S-3R-4S) и 63 (2S-3R-4S) имеют значения Ki 2,910,67 нМ, 3,280,35 нМ и 10,20,3 нМ, соответственно. Пример В. Ингибирование ангиотензин I преобразующего энзима. АСЕ очищают из крысиного яичка по способу, описанном) Pantaliano и др (Biochemistry,1984,23, сс. 1037-1042). Энзиматическую активность измеряют,используя субстрат N-Cbz-Phe-His-Leu, Km = 50 нМ (Piquilloud Y. и др., Biochem. Biophys. Acta,1970, 206, сс. 136-142). Соединения по изобретению проявляют отличную способность ингибировать нейтральную эндопептидазу при значениях Ki от 2 до 50 нМ. В качестве примера, соединения примеров 33 (2S-3R-4S), 13 (2S-3R-4S) и 63 (2S-3R-4S) имеют значения Ki 1,320,17 нМ, 4,090,49 нМ и 3,70,38 нМ, соответственно. Пример С. Ингибирование эндотелин (ЕТ) преобразующего энзима.J., 1997, 328. сс. 871-877), инсертировали в эукраиотический вектор экспрессии пцДНК 3(pcDNA3) и затем заражали электропорацией и экспрессировали в клетках Cos-7. Чтобы измерить активность ЕСЕ клетки гомогенизировали и мембранную фракцию восстанавливали. Энзим экстрагировали при помощи растворения в -октилглюкозе (1%).a) Синтез субстрата Пептид BigET-1 (19-35) получали при помощи твердофазного синтеза в химии Fmoc и очищали при помощи полупрепаративной ЖХВР. На пропионилирование пептида оказывали влияние воздействием N-сукцинимидил[2,3-3 Н]-пропионата на пептид BigET-1 (19-35) и радиомаркированный продукт очищали при помощи ЖХВР. Специфическая активность субстрата составляла 97 Ci/ммоль.b) Энзиматический анализ. ЕСЕ-1 с (10 л раствора, разведенного до 1/10) растворяют в 400 л Трисмалеата 50 мМ,рН 6,5, в присутствии 250 мМ NaCl. Реакцию инициируют при помощи добавления 10 л радиоактивного субстрата (конечная концентрация 1 х 10-9 М). После инкубирования на протяжении 1 ч при 37 С, реакцию прекращали, добавляя 600 л этилацетата. Метаболит отделяли от неповрежденного субстрата при помощи экстрагирования типа жидкость-жидкость. Радиоактивность метаболита определяли при помощи жидкой сцинтилляции. Кинетические константы субстрата представляли собой:Km = 17,10,6 М и Vmax = 2,980,24 нмоль/мг. прот./мин. Для определения значений Ki ингибиторов, последние предварительно инкубировали на протяжении 10 мин при 37 С при различных концентрациях (от 10-4 до 10-10 М) перед прибавлением к субстрату. Получали контроли с разложением 0% и 100%, соответственно, инкубируя субстрат с неактивированным энзимом и с природным энзимом в отсутствии ингибиторов. Соединения по изобретению проявляют отличную способность ингибировать нейтральную эндопептидазу при значениях Ki от 2 до 50 нМ. В качестве примера, соединения примеров 33 (2S-3R-4S), 13 (2S-3R-4S) и 63 (2S-3R-4S) имеют значения Ki 23,33,2 нМ, 24,41,4 нМ и 21,2 2,5 нМ, соответственно. Пример D. Фармацевтическая композиция. 1000 таблеток, содержащих дозу в 5 мг(2S-3R-4S) (пример 13 с Пшеничный крахмал Кукурузный крахмал Лактоза Стеарат магния Кремнезем Гидроксипропилцеллюлозаn представляет собой коэффициент, в котором 0n3,m представляет собой коэффициент, в котором 0m6,R3 и R4 совместно образуют с двумя атомами углерода, которые их несут, фенильную группу, которая незамещена или замещена от 1 до 3 одинаковыми или различными группами,выбираемыми из алкила, алкенила, алкинила,алкокси, гидрокси, алкилтио, меркапто, циано,нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила,амидо, карбамоила, формила, ацила, арила, гетероарила и атомов галогенов,В представляет собой гетероарильную группу,R2 представляет собой атом водорода или алкильную, алкенильную, циклоалкильную,циклоалкилалкильную, ацильную, арильную,арилалкил или ароильную группу,R1 представляет собой атом водорода ацильную, ароильную или циклоалкилкарбонильную группу или группу формулы (II) в которой m, n, R2, R3, R4 и В имеют значения,указанные здесь ранее,"алкил" следует понимать как обозначающий алкильную группу, имеющую линейную или разветвленную цепочку, содержащую от 1 до 6 атомов углерода,"алкенил" следует понимать как обозначающий алкильную группу, содержащую от 2 до 6 атомов углерода и содержащую одну или более двойных связей,"алкинил" следует понимать как обозначающий алкильную группу, содержащую от 2 до 6 атомов углерода и содержащую одну или более тройных связей,"циклоалкил" следует понимать как обозначающий циклическую алкильную группу,содержащую oт 3 до 8 атомов углерода,"ацил" следует понимать как обозначающий группу RCO, в которой R представляет собой алкильную группу, как указано здесь ранее,для групп "алкил", "алкенил" и "алкинил" возможно, чтобы они были замещены одной или более одинаковыми или различными группами, 005004 30 выбираемыми из гидрокси, алкокси, полигалоалкила, амино и атомов галогенов,для групп "циклоалкил" и "циклоалкилалкил" возможно, чтобы они были замещены на циклической части одной или более одинаковыми или различными группами, выбираемыми из гидрокси, алкокси, полигалоалкила, амино и атомов галогенов,"арил" следует понимать как обозначающий фенильную или нафтильную группу, незамещенную или замещенную одной или более одинаковыми или различными группами, выбираемыми из алкила, алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро,амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила, формила, ацила и атомов галогенов,"гетероарил" следует понимать как обозначающий какую-либо моно- или полициклическую ароматическую группу, содержащую от 1 до 3 гетероатомов, выбираемых из кислорода,серы и азота, эти группы незамещены или замещены одной или более одинаковыми или различными группами, выбираемыми из алкила,алкенила, алкинила, алкокси, гидрокси, алкилтио, меркапто, циано, нитро, амино, алкиламино, диалкиламино, полигалоалкила, азидо, карбокси, алкоксикарбонила, амидо, карбамоила,формила, ацила и атомов галогенов,для полициклических групп возможно также, чтобы они были частично или полностью гидрогенизированы на одном из колец,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1 в которой R1 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, в которой R1 представляет собой ацильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, в которой R2 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, в которой R2 представляет собой алкильную группу,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, в которой R3 и R4 совместно образуют замещенную фенильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 31 7. Соединения формулы (I) по п.1, в которой R3 и R4 совместно образуют фенильную группу, замещенную атомом галогена или метоксигруппой, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по п.1, в которой n представляет собой 1, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по п.1, в которой m представляет собой 1, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по п.1, в которой В представляет собой гетероарильную группу, содержащую группу NH, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по п.1, в которой В представляет собой индолильную группу,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по п.1, в которой В представляет собой пирролопиридинильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по п.1, в которой В представляет собой пирролохинолинильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по п.1 конфигурации 2S-3R, их диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 15. Соединения формулы (I) по п.1 конфигурации 2S-3R-4S, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 16. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил] триптофан, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 17. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил] триптофан (2S-3R-4S), а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 18. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-метилтио-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил] триптофан, его энантиомеры и диастереоизоме 005004 32 ры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 19. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-метокси-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил] триптофан, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 20. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил]3-(1 Н-пирроло[2,3-b]пиридин-3-ил)аланин, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 21. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1H-инден-1-ил)-3-меркаптопропаноил]3-(1 Н-пирроло[2,3-b]пиридин-3-ил)аланин (2S3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 22. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил]5-метокситриптофан (2S-3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 23. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил]5-фторотриптофан (2S-3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 24. Соединение формулы (I) по п.1, которое представляет собой N-[2-(5-бромо-2,3 дигидро-1 Н-инден-1-ил)-3-меркаптопропаноил]3-(1 Н-пирроло[3,2-h]хинолин-3-ил)аланин (2S3R-4S) и его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 25. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала применяют соединение формулы (III) в которой R3, R4 и n имеют значения, указанные для формулы (I), которое подвергают воздействию восстанавливающего агента, такого как NaBH4, например, с получением соединения формулы (IV) в которой n, R3 и R4 имеют значения, указанные здесь ранее, которое переводят при помощи галогенирующего агента, такого как Ме 3SiBr, например, в соответствующее галогеновое соединение формулы (V) в которой R3, R4 и n имеют значения, указанные здесь ранее, которое конденсируют в основной среде с этил 2-(диэтоксифосфорил)ацетатом с получением соединения формулы (VI) в которой R , R и n имеют значения, указанные здесь ранее, которое подвергают реакции с формальдегидом в основной среде с получением соединения формулы (VII) в которой R3, R4 и n имеют значения, указанные здесь ранее, которое гидролизируют в присутствии гидроксида натрия с получением соединения формулы (VIII) в которой R'1 представляет собой алкильную, арильную или циклоалкильную группу, с получением соединения формулы (X) в которой В и m имеют значения, указанные для формулы (I), и R'2 представляет собой алкильную, алкенильную, циклоалкильную,циклоалкилалкильную, арильную, ацильную,арилалкильную или ароильную группу, с получением соединения формулы (I/a), частного случая соединений формулы (I) 34 в которой R'1, R3, R4, R'2, m, n и В имеют значения, указанные здесь ранее, которое может быть частично или полностью гидролизировано в основной среде с получением соединения формулы (I/b), частного случая соединений формулы (I) в которой R3, R4, m, n и В имеют значения,указанные здесь ранее, R"1 представляет собой группу R'1 или атом водорода, и R"2 представляет собой группу R'2 или атом водорода, при условии, что по меньшей мере одна из групп R"1 иR"2 представляет собой атом водорода,это соединение формулы (I/b), если R"1 представляет собой атом водорода, можно поместить в кислую среду с получением соединения формулы (I/с), частного случая соединений формулы (I) в которой R2, R3, R4, m, n и В имеют значения, указанные здесь ранее, и R'"1 представляет собой группу формулы (II),эти соединения формул с (I/а) по (I/с) составляют совокупность соединений по изобретению и могут, при желании, быть очищены по традиционной методике разделения, при желании, их переводят в их аддитивные соли с фармацевтически приемлемой кислотой или основанием, и их необязательно разделяют на их стереоизомеры по традиционной методике разделения. 26. Способ по п.25 получения соединения формулы (I) по п.1, который отличается тем, что в качестве исходного материала применяют соединение формулы (X), как указано здесь ранее,диастереоизомеры которого разделяют при помощи хроматографии с получением соединений формул (Ха) и (Хb) в которых R'1, R3 , R4 и n имеют значения, указанные здесь ранее,с этим соединением формулы (Хb) можно образовать соль с хиральным амином, таким как(R)-(+)метилбензиламин, например, с получением после разделения при помощи последовательных операций рекристаллизации соединения формулы (Хb') в которой R12, m и В имеют значения, указанные здесь ранее, с получением соединения формулы (I/а), частного случая соединений формулы (I/а) в которой R'1, R'2, R3, R4, m, n и В имеют значения, указанные здесь ранее, диастереоизомеры (2R, 3S), (2R, 3R) и (2S, 3R) получают ана 36 логично, исходя из соответствующих соединений (Ха) и (Хb),также эти соединения можно получать при помощи конденсации соединения формулы(ХIа) с соединением формулы (Ха) или (Хb),после которой следует разделение при помощи хроматографии. 27. Фармацевтические композиции, которые включают в качестве активного ингредиента по меньшей мере одно соединение формулы(I) по любому из пп.1-24, либо его аддитивную соль с фармацевтически приемлемой кислотой или основанием, отдельно или в сочетании с одним или более фармацевтически приемлемыми эксципиентами. 28. Применение фармацевтических композиций по п.27 для производства лекарственного препарата для лечения артериальной гипертензии, включая легочную артериальную гипертензию, ишемии миокарда, стенокардии, сердечной недостаточности, васкулопатий, включая диабетические васкулопатии, атеросклероза и постангиопластического рестеноза, острой или хронической почечной недостаточности, сосудистых заболеваний головного мозга, включая удар и субарахноидальное кровоизлияние, периферийной ишемии и токсичности к циклоспорину.
МПК / Метки
МПК: C07D 209/20, A61P 43/00, C07D 471/04, A61K 31/33
Метки: ингибиторов, соединения, качестве, применение, аминокислотные
Код ссылки
<a href="https://eas.patents.su/19-5004-aminokislotnye-soedineniya-i-ih-primenenie-v-kachestve-ingibitorov-nep-ace-i-ece.html" rel="bookmark" title="База патентов Евразийского Союза">Аминокислотные соединения и их применение в качестве ингибиторов nep, ace и ece</a>
Предыдущий патент: Новый полиморф v торасемида
Следующий патент: Гибридный полипептид &beta 1 &alpha-интерферона человека, его мутантные формы и производные и содержащая их фармацевтическая композиция
Случайный патент: Ингибиторы глицинового переносчика-1























