Простые бисэфиры 1-окса- и 1- азанафталин-2-онов в качестве ингибиторов фосфоламбана
Номер патента: 3084
Опубликовано: 26.12.2002
Авторы: Тиайнен Эйя, Карьялайнен Арто, Пюстюнен Ярмо, Левийоки Йоуко, Пархи Сеппо, Хайкала Хеймо, Леннберг Кари, Норе Пентти
Формула / Реферат
1. Соединение формулы (I)
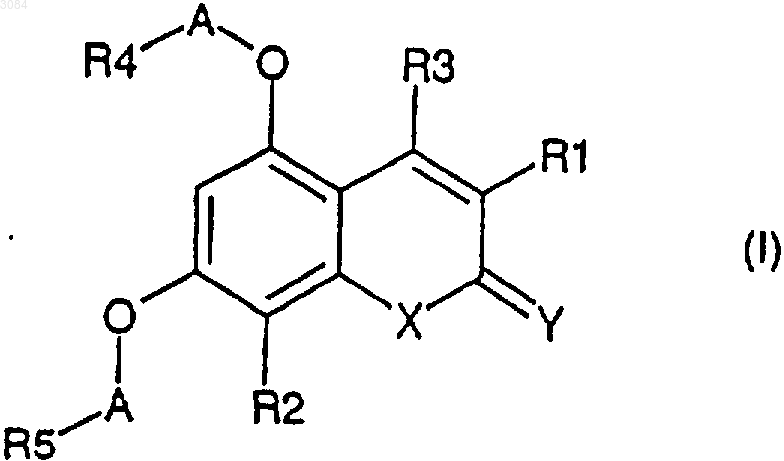
где R1 обозначает водород, C1-7 алкил, С6-10 арил C1-7 алкил, возможно замещенный галогеном или нитро,
R2 обозначает водород,
R3 обозначает водород, C1-7 алкил, С6-10 арил,
А обозначает C1-3 алкилен;
R1+R3 являются бутиленом, возможно замещенным С6-10 арилом,
Y обозначает О,
Х обозначает О, NR11, где R11 обозначает Н, C1-7 алкил или С6-10 арил C1-7 алкил, возможно замещенный галогеном,
R4, R5 обозначают независимо одну из следующих групп
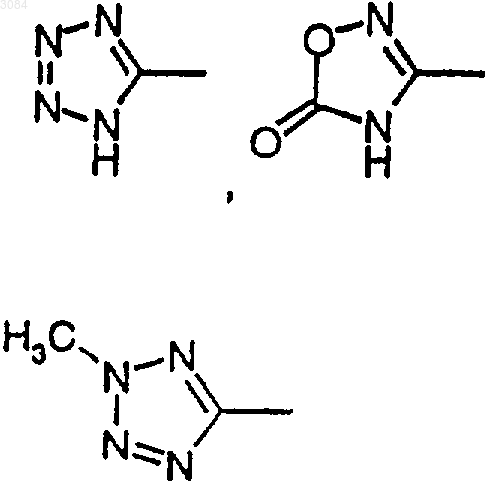
или 6-гидроксипиридазинил, в этом случае А является валентной связью, или в случае, когда Х обозначает NR11, R4, R5 могут также независимо обозначать НООС-, R12OOC-, H2NCO- или HOHNCO-, где R12 обозначает C1-7 алкил,
и их фармацевтически приемлемые соли и сложные эфиры.
2. Соединение по п.1, где указанное соединение имеет формулу (I) и R2 обозначает водород.
3. Соединение по п.2, где R1 обозначает водород, C1-6 алкил, С2-6 алкенил, С6-10 арил, C7-12 арилалкил, C1-6 гидроксиалкил, C1-6 галогеналкил или C1-6 алкокси.
4. Соединение по п.3, где Х обозначает О.
5. Соединение по п.3, где Х обозначает NR11, где R11 обозначает водород, C1-6 алкил, C6-10 арил, C7-12 арилалкил, C1-6 алкокси, С6-10 арилокси, гидрокси, C1-6 алканоил или C1-6 карбоксиалкил.
6. Соединение по п.5, где R3 обозначает водород, C1-6 алкил, С6-10 арил или C7-12 арилалкил.
7. Соединение по п.6, где R3 обозначает C1-6 алкил.
8. Соединение по п.7, где А обозначает C1-4 алкилен с линейной или разветвленной цепью и R4 и R5 каждый обозначают
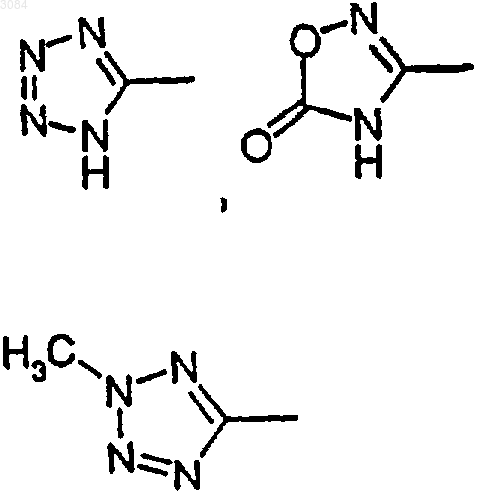
или, когда Х обозначает NR11, тогда R4 и R5 могут также обозначать НООС-, R12OOC-, H2NCO- или HOHNCO-, где R12 обозначает C1-6 алкил.
9. Фармацевтический препарат, содержащий соединение по п.1 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем.
10. Способ лечения сердечной недостаточности, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
11. Способ лечения и профилактики поражения миокарда, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
12. Соединение формулы (XXV)
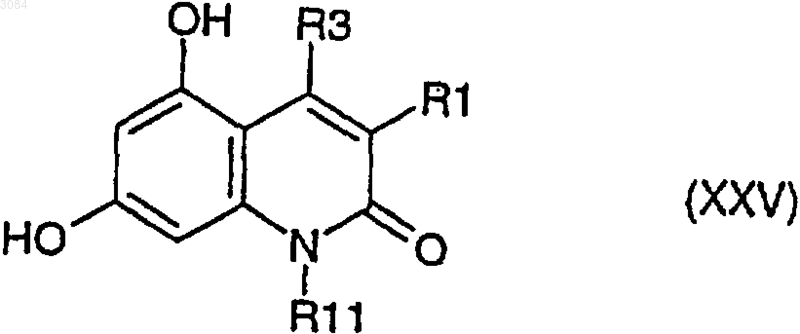
где R1 обозначает водород, C1-7 алкил, С6-10 арил C1-7 алкил, возможно замещенный галогеном или нитро,
R3 обозначает водород, C1-7 алкил, С6-10 арил,
R11 обозначает водород, C1-7 алкил, С6-10 арил C1-7 алкил, возможно замещенный галогеном.
Текст
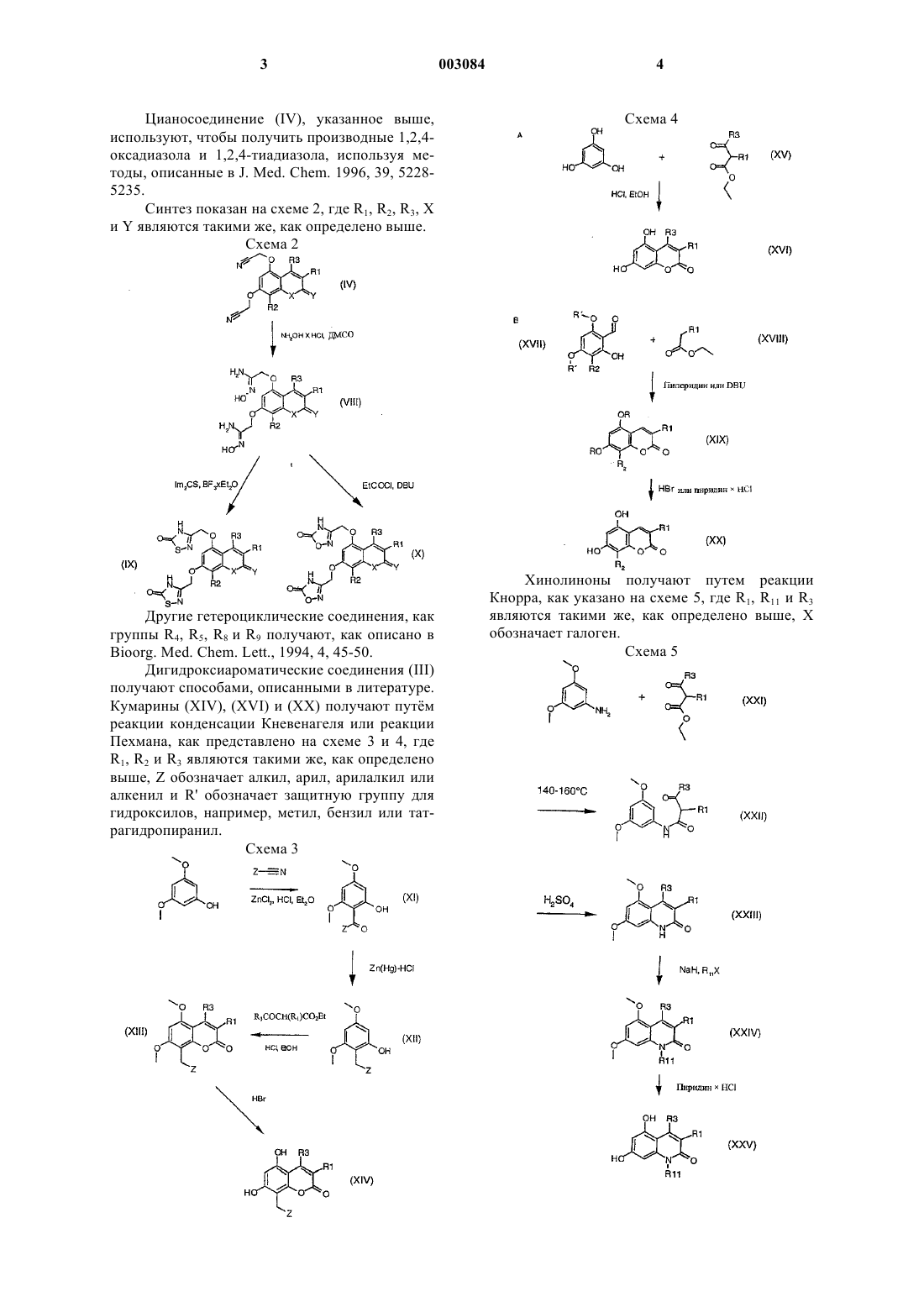
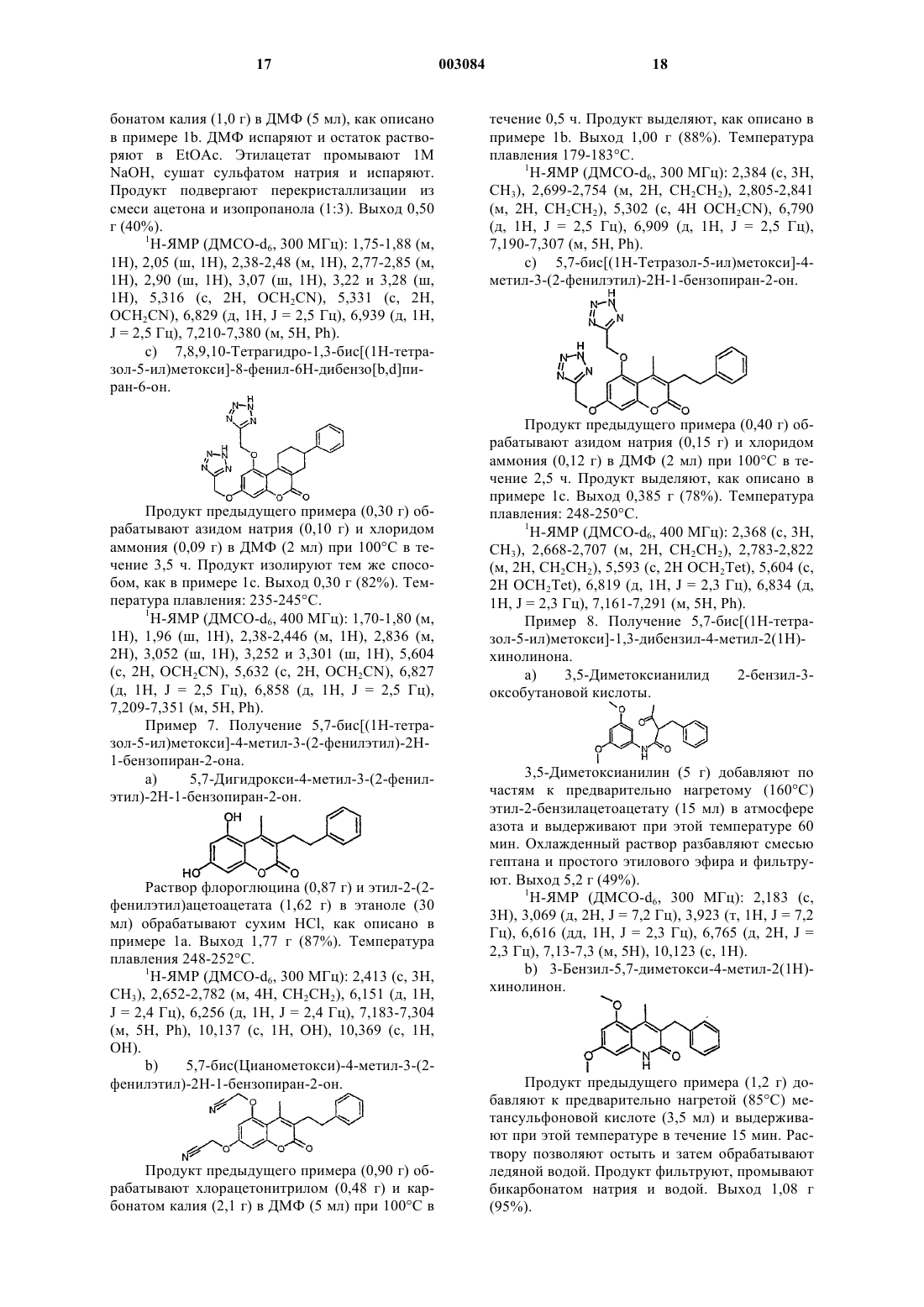
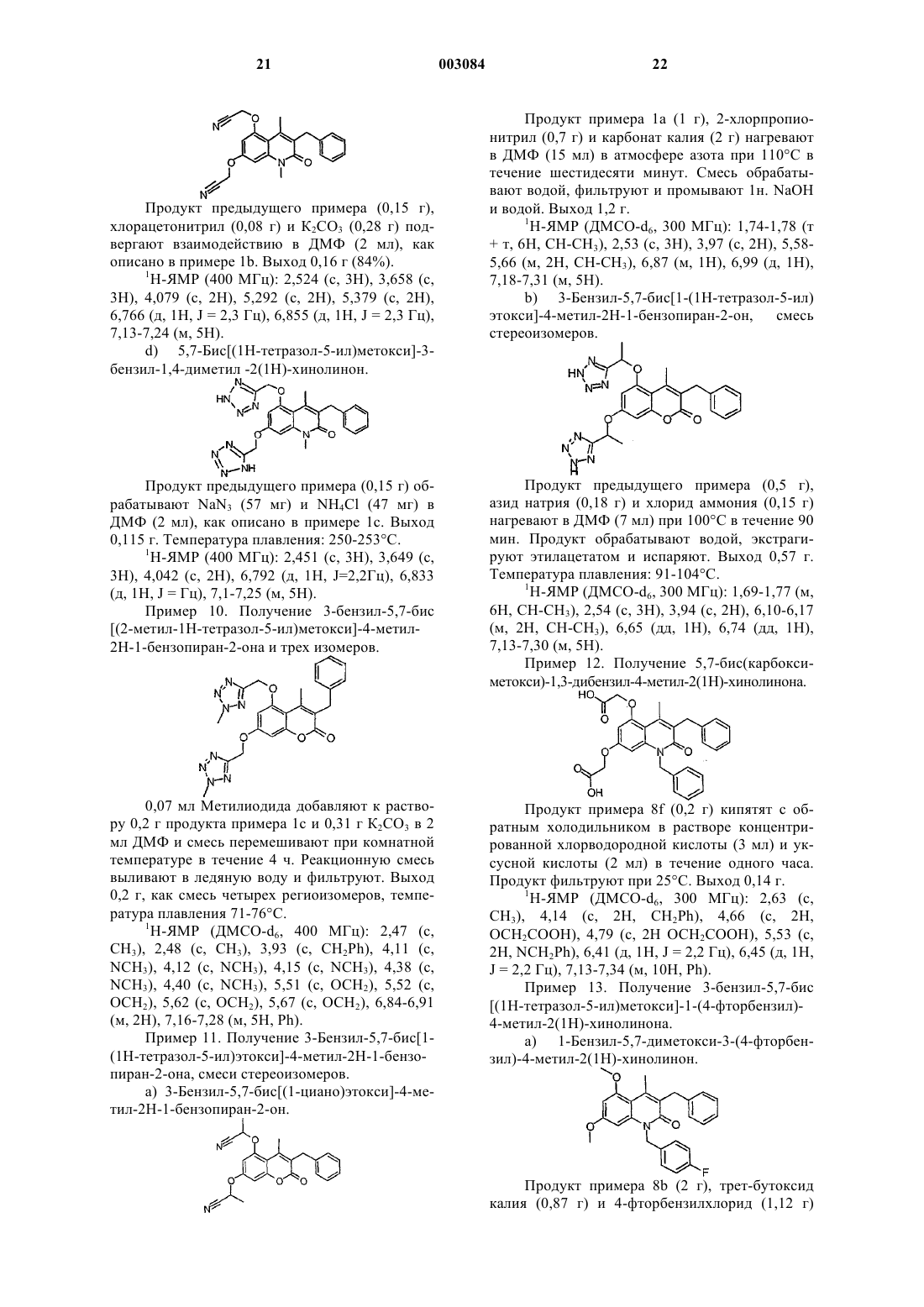
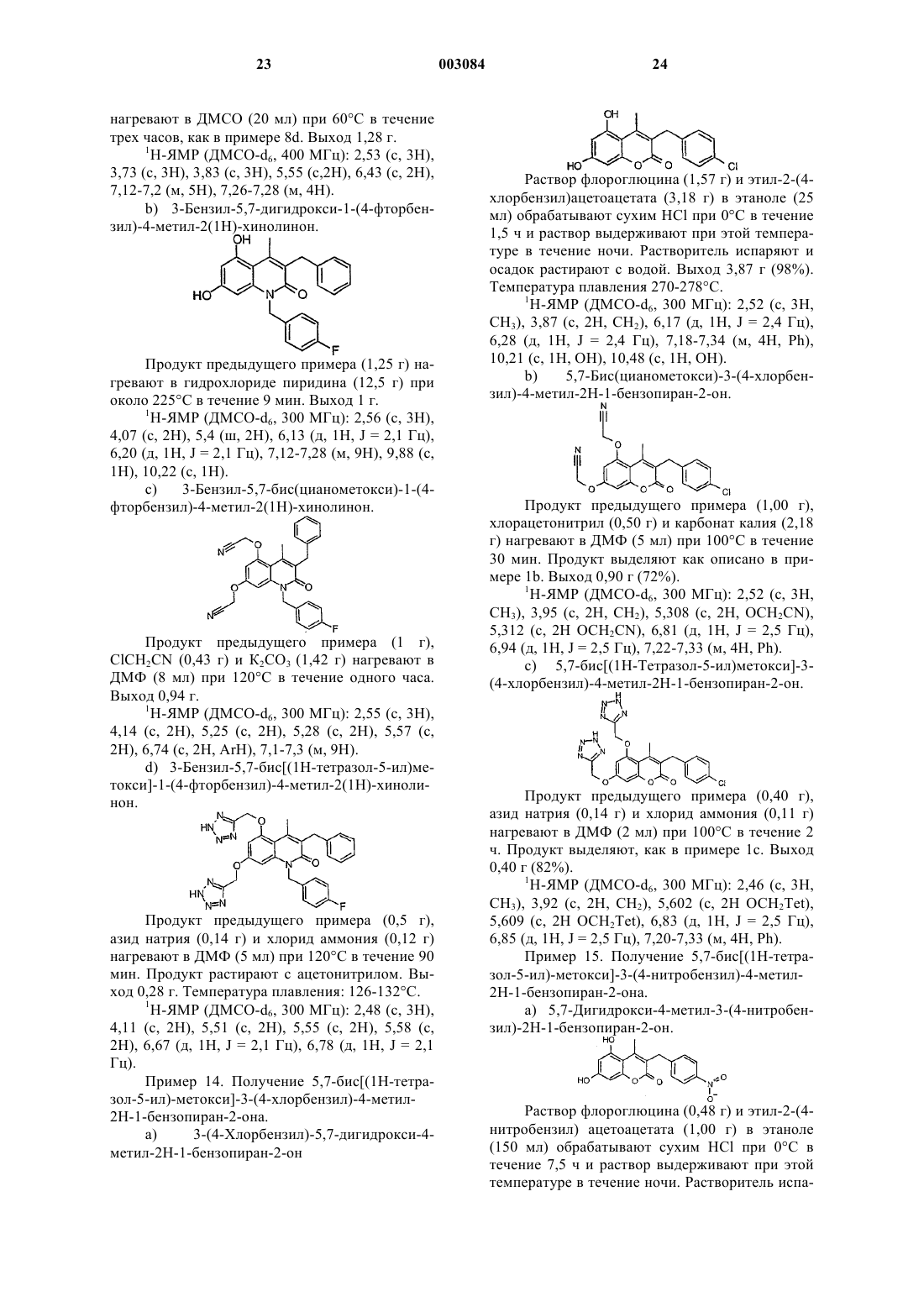
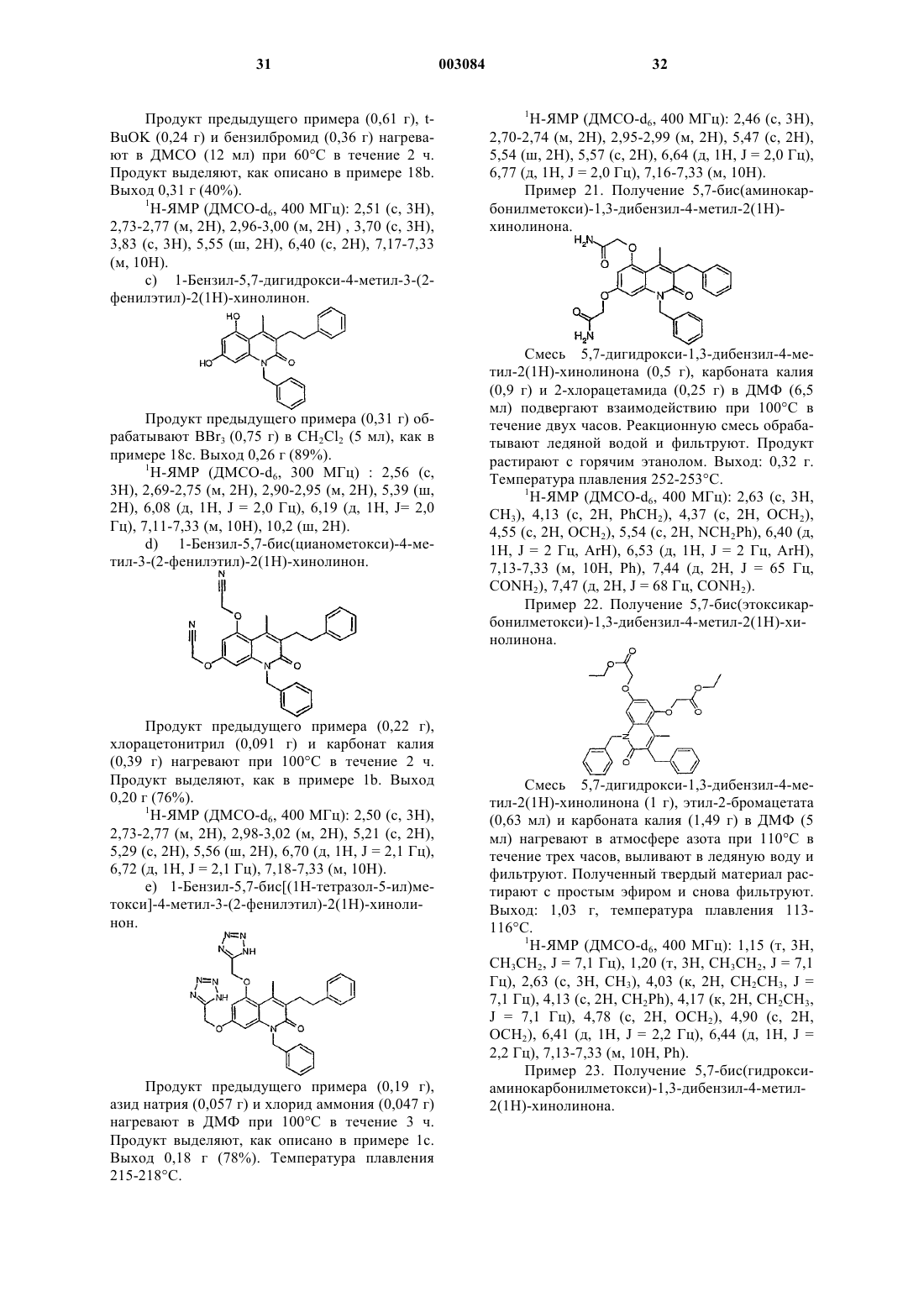
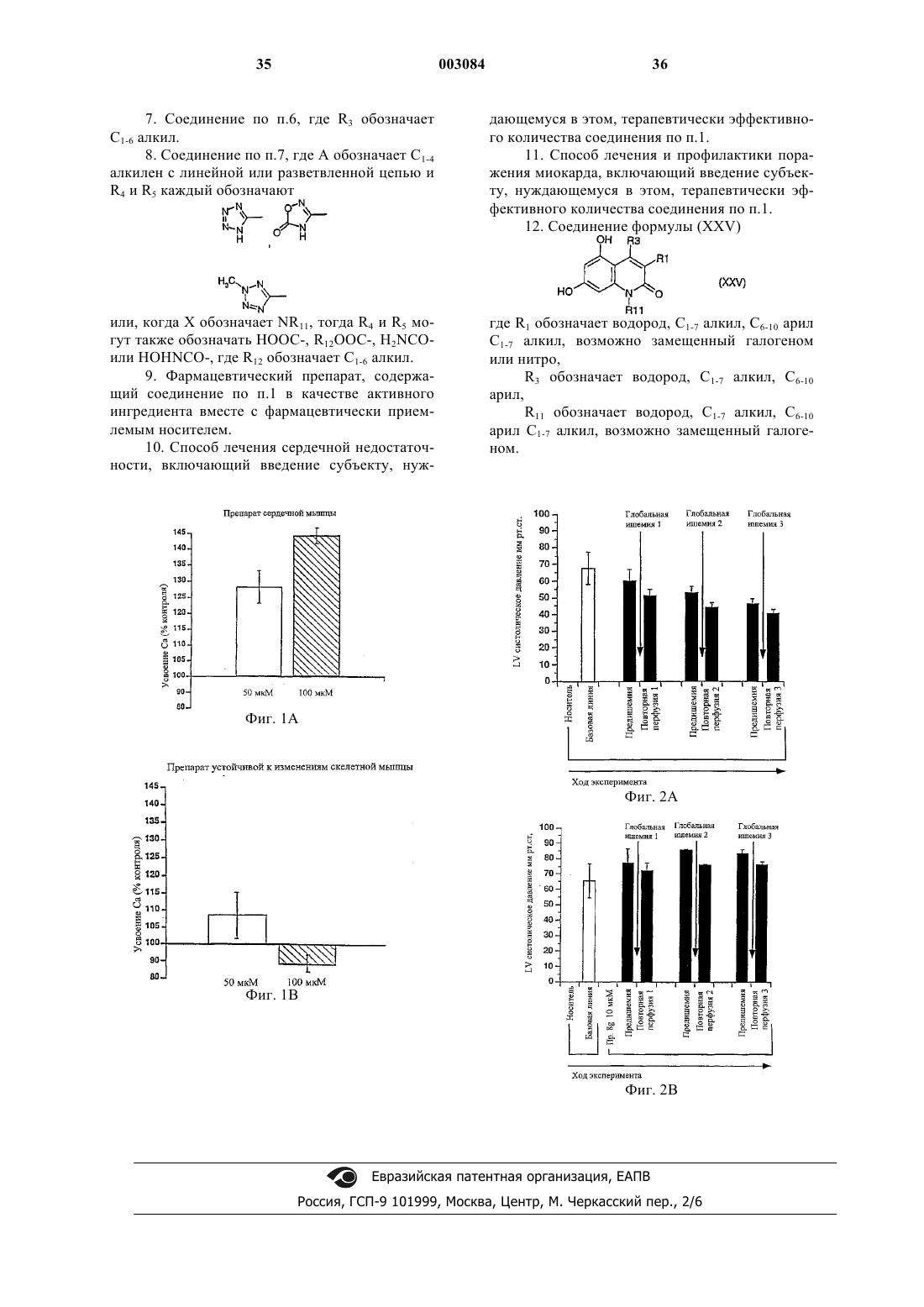
1 Данное изобретение относится к новым терапевтически активным соединениям и их солям и сложным эфирам, а также к новым промежуточным соединениям. Изобретение также относится к фармацевтическим препаратам, содержащим эти соединения в качестве активных ингредиентов. Соединения изобретения имеют свойства ингибирования фосфоламбана и являются полезными для лечения сердечной недостаточности и поражения миокарда. Соединения данного изобретения имеют структуру, представленную формулой (I)C1-7 алкил, возможно замещенный галогеном или нитро,R2 обозначает водород,R3 обозначает водород, C1-7 алкил, С 6-10 арил,А обозначает C1-3 алкилен;R1+R3 являются бутиленом, возможно замещенным С 6-10 арилом,Y обозначает О,Х обозначает О, NR11, где R11 обозначает Н, C1-7 алкил или С 6-10 арил C1-7 алкил, возможно замещенный галогеном,R4, R5 обозначают независимо одну из следующих групп: или 6-гидроксипиридазинил, в этом случае А является валентной связью,или в случае, когда Х обозначает NR11, R4,R5 могут также независимо обозначать НООС-,R12OOC-, H2NCO- или HOHNCO-, где R12 обозначает C1-7 алкил,и их фармацевтически приемлемые соли и сложные эфиры. В одном классе предпочтительных соединений и их фармацевтически приемлемых солей и сложных эфиров находятся соединения формулы (I), где R2 обозначает водород. В подклассе этого класса соединений и их фармацевтически приемлемых солей и сложных эфиров R1 обозначает водород, C1-6 алкил, С 2-6 алкенил, С 610 арил, С 7-12 арилалкил, C1-6 гидроксиалкил, C1-6 галогеналкил или C1-6 ал-кокси. В группе этого подкласса соединений и их фармацевтически приемлемых солей и сложных эфиров Y обозначает О или S, предпочтительно О; и Х обозначает О. В другой группе этого подкласса соединений и их фармацевтически приемлемых солей и сложных эфиров Y обозначает О или S, пред 003084 2 почтительно О, и Х обозначает NR11, где R11 обозначает водород,C1-6 алкил, С 6-10 арил, C7-12 арилалкил, C1-6 алкокси, С 6-10 арилокси, гидрокси, C1-6 алканоил или C1-6 карбоксиалкил. В подгруппе этой группы соединений и их фармацевтически приемлемых солей и сложных эфиров R3 обозначает водород, C1-6 алкил, С 6-10 арил или C7-12 арилалкил, предпочтительно C1-6 алкил, наиболее предпочтительно метил. В семействе этих подгрупп соединений и их фармацевтически приемлемых солей и сложных эфиров А предпочтительно обозначает C1-4 алкилен с линейной или разветвленной цепью. Каждый остаток арил в каждом из этих предпочтительных классов соединений, сам по себе или как часть другой группы, может быть замещен 1-3, предпочтительно 1 или 2, наиболее предпочтительно одним из таких заместителей,как фтор, хлор, бром, иод, нитро. Краткое описание рисунков Фиг. 1 А показывает влияние соединения из примера 1 с (50 и 100 мкМ) на скорость поглощения Са 2+ везикулами SR сердечной мышцы. Фиг. 1 В показывает влияние соединения из примера 1 с (50 и 100 мкМ) на скорость поглощения Ca2+ везикулами SR устойчивой к изменениям скелетной мышцы. Фиг. 2 А показывает развитие поражения миокарда и последующее снижение систолического давления левого желудочка (LV). Фиг. 2 В показывает полное ингибирование соединением из примера 8g развития поражения миокарда. Соединения изобретения могут быть получены из 1,3-дигидрокси-замещенных гетероароматических соединений путем алкилирования дигидроксисоединений подходящими агентами алкилирования, например хлорацетонитрилом или бромуксусным сложным эфиром, согласно следующей схеме 1, где R1, R2, R3, Х и Y являются такими же, как определено выше, R' обозначает защитную группу для гидроксила, например, метил, бензил или тетрагидропиранил. Схема 1 3 Цианосоединение (IV), указанное выше,используют, чтобы получить производные 1,2,4 оксадиазола и 1,2,4-тиадиазола, используя методы, описанные в J. Med. Chem. 1996, 39, 52285235. Синтез показан на схеме 2, где R1, R2, R3, Х и Y являются такими же, как определено выше. Схема 2Bioorg. Med. Chem. Lett., 1994, 4, 45-50. Дигидроксиароматические соединения (III) получают способами, описанными в литературе. Кумарины (XIV), (XVI) и (XX) получают путм реакции конденсации Кневенагеля или реакции Пехмана, как представлено на схеме 3 и 4, гдеR1, R2 и R3 являются такими же, как определено выше, Z обозначает алкил, арил, арилалкил или алкенил и R' обозначает защитную группу для гидроксилов, например, метил, бензил или татрагидропиранил. Схема 3 Хинолиноны получают путем реакции Кнорра, как указано на схеме 5, где R1, R11 и R3 являются такими же, как определено выше, Х обозначает галоген. Схема 5 5 Циклические соединения (II) могут быть получены соотвественно из соединения (XXXI),которое может быть получено согласно схеме 6,где R2 и R6 являются такими же, как определено выше, R' обозначает защитную группу для гидроксилов, например, метил, бензил или татрагидропиранил. Схема 6 Циклические соединения хинолинона (II) могут быть получены соответственно из (XXVI) по схеме 5. Соли и сложные эфиры соединений, когда они применимы, могут быть получены известными способами. Физиологически приемлемые соли являются полезными в качестве активных медикаментов, однако, предпочтительны соли со щелочными или щелочно-земельными металлами. Физиологически приемлемые сложные эфиры также полезны в качестве активных медикаментов. Примерами служат сложные эфиры с алифатическими или ароматическими спиртами. Термин "алкил", как используется здесь,сам по себе или как часть другой группы, включает радикалы как с прямой, разветвленной, так и с циклизованной цепью вплоть до 18 атомов углерода, предпочтительно 1-8 атомов углерода,наиболее предпочтительно 1-4 атома углерода. Термин "низший алкил", как используется здесь, сам по себе или как часть другой группы,включает радикалы как с прямой, разветвленной, так и с циклизованной цепью из 1 до 7,предпочтительно 1-4, наиболее предпочтительно 1-2 атомов углерода. Конкретными примерами для остатков алкила и низшего алкила являются, соответственно, метил, этил, пропил, изо 003084 6 пропил, бутил, трет-бутил, пентил, циклопентил, гексил, циклогексил, октил, децил и додецил, включая различные их изомеры с разветвленной цепью. Термин "ацил", как используется здесь,сам по себе или как часть другой группы, относится к алкилкарбонил- или алкенилкарбонилгруппе, алкил- и алкенилгруппы определены выше. Термин "арил", как используется здесь,сам по себе или как часть другой группы, относится к моноциклической или бициклической группе, содержащей от 6 до 10 атомов углерода в кольцевой части. Конкретными примерами арилгрупп являются фенил, нафтил и тому подобное. "Ароил" обозначает в соответствующем случае арилкарбонилгруппу. Термин "алкокси", как используется здесь,сам по себе или как часть другой группы, включает алкилгруппу, как определено выше, связанную с атомом кислорода. "Арилокси" обозначает в соответствующем случае арилгруппу,связанную с атомом кислорода. Термин "замещенный", как используется здесь в связи с различными остатками, относится к галоген-заместителям, таким как фтор,хлор, бром, иод, или к таким заместителям, как трифторметилгруппа, амино, алкил, алкокси,арил, алкиларил, галогенарил, циклоалкил, алкилциклоалкил, гидрокси, алкиламино, алканоиламино, арилкарбониламино, нитро, циано,тиол или алкилтио."Замещенные" группы могут содержать 13, предпочтительно 1-2, наиболее предпочтительно 1 из указанных выше заместителей. Соединения изобретения могут быть введены пациенту в терапевтически эффективных количествах, которые находятся в пределах обычно от около 0,1 до 500 мг в сутки в зависимости от возраста, массы, состояния пациента,пути введения и используемого ингибитора фосфоламбана. Соединения изобретения могут быть введены в состав лекарственных форм,известными в этой области методами. Они могут быть даны пациенту как таковые или в сочетании с подходящими фармацевтическими разбавителями в виде таблеток, драже, капсул,суппозиториев, эмульсий, суспензий или растворов. Выбор подходящих ингредиентов для препарата является рутинным для специалистов в этой области. Очевидно, что могут быть также использованы подходящие носители, растворители, гелеобразующие ингредиенты, образующие дисперсию ингредиенты, антиоксиданты,красители, подслащиватели, смачивающие соединения и другие ингредиенты, обычно используемые в этой области техники. Препараты,содержащие активное соединение, могут быть даны энтерально или парентерально, предпочтительным является пероральный путь. Содержание активного соединения в композиции составляет от около 0,5 до 100%, предпочтительно 7 от около 0,5 до около 20% от массы всего препарата. Эксперименты Эксперимент 1. Влияние на поглощение кальция везикулами SR, полученными из сердечной и устойчивой к изменениям скелетной мышцы. Ингибирующее действие данного соединения на фосфоламбан может быть продемонстрировано путем измерения влияния соединения на поглощение кальция везикулами SR, полученными из сердечной ткани, и везикулами SR,полученными из устойчивой к изменениям скелетной мышцы (поясничной мышцы). Оба вида везикул SR содержат Са 2+-АТФазу, но везикулы из устойчивой к изменениям скелетной мышцы не содержат фосфоламбана (Hoh JFY, "MuscleRheumatology, 4:801-808, 1992). Усиление поглощения кальция везикулами SR, полученными из сердечной ткани, но не везикулами SR, полученными из устойчивой к изменениям скелетной мышцы, показывает, что соединение ослабляет ингибирующее действие фосфоламбана наSR Са 2+-АТФазу и, следовательно, действует как ингибитор фосфоламбана. Так как фосфоламбан подавляет интенсивности как расслабления, так и сокращения сердца млекопитающего, путем его ингибирующего действия на сердечную SR С 2+-АТФазу, соединение, ослабляющее эти эффекты, является потенциально полезным для лечения сердечной недостаточности. Метод Морских свинок (10-12) обезглавливают. Их сердца или поясничные мышцы вырезают,промывают в холодном со льдом 0,9% NaCl и режут на куски в буфере, содержащем 20 мМ Трис-малеат, 0,3 М сахарозу, рН 7,0. После этого куски ткани гомогенизируют с помощью Polytron и далее Potter (10 приемов). Гомогенат центрифугируют при 1000 g в течение 15 мин при 4 С. Супернатант собирают и осадок повторно суспендируют в 5 мл буфера (20 мМ Трисмалеат, 0,3 М сахароза, рН 7,0) и повторно центрифугируют при 1000 g в течение 10 мин при 4 С. Полученный супернатант объединяют с ранее собранным супернатантом и снова центрифугируют при 10000 g в течение 20 мин при 4 С. Окончательный супернатант фильтруют в бутылку, снабженную магнитной мешалкой. К отфильтрованному супернатанту добавляют КСl до достижения конечной концентрации 0,6 М(при 4 С). Полученный раствор центрифугируют при 100000 g в течение 60 мин при 4 С. Осадок суспендируют в 5 мл буфера, содержащего 20 мМ Трис-малеат, 0,3 М сахарозу, рН 7,0 и центрифугируют при 100000 g в течение 60 мин при 4 С. Полученный осадок суспендируют в 5 мл буфера, содержащего 20 мМ Трис-малеат,0,3 М сахарозу, 0, 1 М КСl, рН 7,0 и хранят при 8 также измеряют для того, чтобы нормализовать раздельно полученные препараты везикул. В анализе поглощения кальция используют флуоресцентный индикатор, fluo-3, чтобы определить снижение экстравезикулярной концентрации Са 2+, когда SR Са 2+-АТФаза переносит Са 2+ из экстравезикулярного пространства в SRвезикулы.SR-везикулы, полученные выше, (50 мкг белка/мл) предварительно инкубируют с испытуемым соединением или без него при 37 С в течение 5 мин в буфере для анализа, содержащем 40 мМ имидазола, 95 мМ КСl, 5 мМ NaN3,5 мМ MgCl2, 0,5 мМ EGTA, 5 мМ оксалата калия, 2 мкМ рутениевого красного, 5 мкМ fluo-3,pH 7,0. Свободный кальций доводят до 0,1 мкМ или до 0,04 мкМ с помощью CaCl2. Реакцию инициируют путем добавления АТФ (5 мМ). Конечный объем реакционной смеси - 1,5 мл. Флуоресценцию реакционной смеси измеряют для 3 мин путем использования длин волн свечения и эмиссии 510 нм и 530 нм, соответственно. Результаты Фиг. 1 А и 1 В показывают влияние соединения из примера 1 с (50 и 100 мкМ) на скорость поглощения Са 2+ везикулами SR сердечной (А) и устойчивой к изменениям скелетной мышцы(В). Как можно видеть, соединение изобретения ускоряет поглощение кальция сердечными везикулами SR, но не изменяет поглощение кальция везикулой SR, полученной из устойчивой к изменениям скелетной мышцы. Табл. 1 показывает влияние различных других ингибиторов фосфоламбана формулы (I) или (II) на скорость поглощения Са 2+ везикулами SR сердечной (А) и устойчивой к изменениям скелетной мышцы (В). Эксперименты проводят при концентрациях свободного кальция 0,1 мкМ и 0,04 мкМ, соответственно. Стимуляция (%) поглощения Са 2+ препаратами везикул, полученными из вентрикулярного миокарда (А) и устойчивой к изменениям скелетной мышцы (В) сердца морской свинки Таблица 1 Стимуляция (%) поглоСоединение из прищения Са 2+ мера(100 мкМ) А В 3 с 51 0 2 с 26 9 Эксперимент 2. Влияния на производные давления левого желудочка. Метод В исследовании используют морских свинок любого пола, весящих 300-400 г. После умерщвления морской свинки ударом по черепу и обезглавливания быстро извлекают сердце. Сердце затем промывают в холодном оксигенированном перфузионном буфере. В аорту вставляют канюлю и закрепляют лигатурой. Ретроградную перфузию начинают сразу же, как только сердце поместят в термостатически контролируемую влажную камеру аппарата Лангендорфа. Модифицированный раствор Tyrode(37 С), уравновешенный в термостатически контролируемом оксигенаторе пузырькового типа карбогеном (95% О 2 и 5% СО 2), используют в качестве перфузионного буфера. Состав раствора Tyrode (в мМ): NaCl 135, MgCl2 x 6H2O 1, KCl 5, CaCl2 x 2 Н 2 О 2, NаНСО 3 15, Na2HPO4x 2H2O 1, глюкоза 10, рН 7,3-7,4. Эксперименты проводят в условиях постоянного давления (50 мм рт.ст.). После короткой предварительной стабилизации (10 мин) латексный баллон (размер 4) осторожно помещают в левый желудочек через левую легочную вену и левое предсердие. Латексный баллон прикрепляют к канюле из нержавеющей стали, соединенной с датчиком давления. Латексный баллон, канюлю и камеру датчика давления заполняют смесью этиленгликоля и воды (1:1), избегая попадания какогонибудь воздушного пузырька. Давление левого желудочка при постоянном объеме регистрируют по датчику давления. В начале эксперимента объем баллона доводят так, чтобы достичь диастолического давления приблизительно 5 мм рт.ст. Перед началом эксперимента сердцу позволяют стабилизироваться дополнительно 3050 мин с носителем (0,1% ДМСО) в перфузионном буфере. После регистрации в течение 15 мин базовой линии к перфузионному буферу добавляют различные концентрации испытуемого соединения с интервалами 15 мин. Испытывают концентрации в пределах 0,3-30 мкМ. Концентрацию носителя (0,1% ДМСО) поддерживают постоянной на протяжении эксперимента. Результаты Величины EC50 и максимальные эффекты(% изменения от базовой линии) различных соединений изобретения на систолическое давление левого желудочка даны в табл. 2. Величины ЕС 50 и максимальные эффекты (% изменения от базовой линии) на систолическое давление левого желудочка Таблица 2 Соединение Максимальный ЕС 50 (мкМ) из примераэффект (%) 1 с 9 Эксперимент 3. Эффект на развитие поражения миокарда в изолированном по Лангендорфу сердце морской свинки. Метод В исследовании используют морских свинок любого пола, весящих 300-400 г. После умерщвления морской свинки ударом по черепу и обезглавливания быстро извлекают сердце. Сердце затем промывают в оксигенированном перфузионном буфере. В аорту вставляют канюлю и закрепляют лигатурой. Ретроградную перфузию начинают сразу же, как только сердце поместят в термостатически контролируемую влажную камеру аппарата Лангендорфа. Модифицированный раствор Tyrode (37 С), уравновешенный в термостатически контролируемом оксигенаторе пузырькового типа карбогеном(95% O2 и 5% СО 2) используют в качестве перфузионного буфера. Состав раствора Tyrode (в мМ): NaCl 135,МgСl2 х 6 Н 2 О 1, КСl 5, CaCl2 x 2H2O 2, NaHCO3 15, Na2HPO4 х 2H2O 1, глюкоза 10, рН 7,3-7,4. Эксперименты проводят в условиях постоянного давления (50 мм рт.ст.). После короткой предварительной стабилизации (10 мин) латексный баллон, прикрепленный через канюлю из нержавеющей стали к датчику давления, осторожно помещают в левый желудочек через левую легочную вену и левое предсердие. Латексный баллон, канюлю и камеру датчика давления заполняют смесью этиленгликоля и воды (1:1),избегая какого-либо воздушного пузырька. Давление левого желудочка при постоянном объеме регистрируют по датчику давления. В начале эксперимента объем баллона доводят так, чтобы достичь конечного диастолического давления приблизительно 5 мм рт.ст. Перед началом эксперимента самопроизвольно бьющемуся сердцу позволяют стабилизироваться дополнительно 30-50 мин с носителем (0,1% ДМСО) в перфузионном буфере. После 15 мин регистрации базовой линии к перфузионному буферу добавляют соединение из примера 8g (10 мкМ). Спустя 15 мин, сердце подвергают 8-минутному периоду глобальной ишемии с последующей реперфузией. Эту процедуру затем повторяют дважды с интервалами 35 мин. Другую серию экспериментов проводят 11 с носителем вместо соединения из примера 8g. Концентрацию носителя (0,1% ДМСО) поддерживают постоянной на протяжении экспериментов. Величина базовой линии является средней из двух минутных замеров, полученных сразу перед тем, как соединение примера 8g или носитель добавляют к перфузионному буферу. Величины предишемии являются средними из двух минутных замеров, полученных непосредственно перед каждым периодом ишемии, и величины повторной перфузии являются средними из двух минутных замеров, полученных на 8 мин во время каждого периода повторной перфузии. Результаты показаны на фиг. 2 А и В. Фиг. 2 А показывает развитие поражения миокарда и последующего снижения систолического давления левого желудочка в контрольной группе. Фиг. 2 В показывает, что ингибитор фосфоламбана из примера 8g полностью ингибирует развитие поражения миокарда. Данные являются средними SEM из 2-3 экспериментов. Примеры Пример 1. Получение 3-бензил-5,7-бис Раствор дигидрата флороглюцина (20 г) и этил-2-бензилацетоацетата (27,5 мл) в этаноле(320 мл) обрабатывают сухим НСl при 0 С в течение пяти часов и раствор выдерживают при этой температуре в течение ночи. Желтый раствор концентрируют и растирают с водой, твердые вещества отфильтровывают, промывают водой и сушат. Полученный гидрат трижды выпаривают досуха из толуола, растирают с петролейным эфиром (т.кип. 40-60 С) и фильтруют. Выход 33,4 г (96%). Температура плавления 258-260 С. 1(23,9 г) и 12,2 г продукта из примера 1 а перемешивают в 120 мл ДМФ при 100 С в атмосфере азота в течение двух часов. Реакционную смесь охлаждают и выливают в ледяную воду. 12 Твердые вещества отфильтровывают и промывают водой. Выход 13,8 г (88%). Температура плавления 147-154 С. 1(0,42 г) и хлорид аммония (0,34 г) перемешивают в ДМФ (5 мл) в атмосфере азота при 100 С в течение 5 ч. Реакционной смеси позволяют охладиться и затем выливают в ледяную воду. Доводят рН раствора до 10-11 и затем раствор либо экстрагируют один раз этилацетатом, либо фильтруют через целит. Раствор подкисляют до рН 2 хлорводородной кислотой, выдерживают при 5 С и фильтруют. Выход 0,96 г (81%). Температура плавления 229-233 С. 1 Раствор флороглюцина (0,7 г) и 2 этоксикарбонил-3-фенилциклогексанона (1,5 г) в этаноле обрабатывают сухим НСl, как описано в примере 1 а. Продукт вначале подвергают перекристаллизации из смеси этанола и воды (1:1) и затем растирают с простым эфиром. Выход 0,61 г. 1 Н-ЯМР (ДМСО-d6, 400 МГц): 1,38-1,52 (м,1 Н), 1,57-1,66 (м, 1 Н), 1,69-1,78 (м, 1 Н), 1,861,96 (м, 1 Н), 2,9-3,02 (м, 1 Н), 3,3-3,4 (м, 1 Н),4,050 (ш, 1 Н), 6,157 (д, 1 Н, J = 2,4 Гц), 6,297 (д,1 Н, J = 2,4 Гц), 7,076-7,265 (м, 5 Н), 10,153 (с,1 Н), 10,456 (с, 1 Н). Продукт примера 2b (0,6 г) обрабатывают азидом натрия (0,2 г) и хлоридом аммония (0,17 г) в ДМФ (5 мл), как в примере 1 с. Продукт подвергают перекристаллизации из смеси ДМФ,этанола и воды (приблизительно 1:2:3). Выход 0,41 г. Температура плавления: 153-154 С. 1 Триэтиламин (1,94 мл) добавляют к суспензии гидрохлорида гидроксиламина (0,97 г) в ДМСО (2 мл) и полученную смесь перемешивают при комнатной температуре тридцать минут. Кристаллы отфильтровывают и промывают ТГФ. Фильтрат концентрируют и добавляют продукт примера 1b (0,5 г). Этот раствор выдерживают при 75 С в течение ночи. Реакционную смесь обрабатывают ледяной водой, рН доводят до 11 и твердые вещества отфильтровывают, промывают водой и сушат. Выход 0,5 г. Температура плавления: 155-160 С. 1 Этилхлорформиат (0,45 мл) добавляют к раствору продукта примера 3 а (1 г) и пиридина(0,38 мл) в ДМФ (5 мл) при 0 С. Реакционную смесь выдерживают при этой температуре дополнительные 30 мин и затем добавляют ледяную воду. Твердые вещества отфильтровывают и промывают водой. Выход 1,63 г. Температура плавления: 87-92 С. 1 Продукт предыдущего примера (1,5 г) иDBU (1,5-диазабицикло[5.4.0]ундец-5-ен) (0,8 мл) в ДМФ (5 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь обрабатывают ледяной водой и подкисляют. Твердые вещества отфильтровывают и промывают водой. Полученную твердую массу забирают в 0,1 н. раствор гидроксида натрия,обрабатывают активированным углем и окончательно подкисляют. Выход 0,64 г. Температура плавления: 130-136 С. 1 Продукт предыдущего примера (0,5 г),хлорацетонитрил (0,34 г) и карбонат калия (1,5 г) в ДМФ (5 мл) подвергают взаимодействию,как в примере 1b. Выход 0,44 г. 1 Продукт предыдущего примера (0,4 г) обрабатывают азидом натрия (0,18 г) и хлоридом аммония (0,14 г) в ДМФ (2,5 мл), как в примере 1 с. Продукт подвергают перекристаллизации из смеси этанола и ДМФ (1:1). Выход 0,17 г. Температура плавления: 283-286 С. 1 Раствор флороглюцина (2,0 г) и карбоксилата этилбензоилацетата (3,05 г) в этаноле (30 мл) обрабатывают сухим НСl, как описано в примере 1 а. Продукт подвергают перекристаллизации из смеси этанола и воды (1:1). Выход 3,0 г. (75%). 1 16 Продукт предыдущего примера (1,00 г) обрабатывают хлорацетонитрилом (0,62 г) и карбонатом калия (2,72 г) в ДМФ (5 мл), как описано в примере 1b. Реакционную смесь выливают в ледяную воду и смесь экстрагируют этилацетатом. Этилацетат промывают 1 М NaOH, сушат сульфатом натрия и испаряют. Продукт подвергают перекристаллизации из изопропанола. Выход 0,41 г (31%). 1 Продукт предыдущего примера (0,40 г) обрабатывают азидом натрия (0,16 г) и хлоридом аммония (0,14 г) в ДМФ (2 мл) при 100 С в течение 2 ч. Продукт выделяют, как описано в примере 1 с. Выход 0,40 г,(79%). Температура плавления: 222-224 С. 1 Н-ЯМР (ДМСО-d6, 400 МГц): 5,148 (с, 2 Н Продукт предыдущего примера (1,0 г) обрабатывают хлорацетонитрилом (0,57 г) и кар 17 бонатом калия (1,0 г) в ДМФ (5 мл), как описано в примере 1b. ДМФ испаряют и остаток растворяют в EtOAc. Этилацетат промывают 1 МNaOH, сушат сульфатом натрия и испаряют. Продукт подвергают перекристаллизации из смеси ацетона и изопропанола (1:3). Выход 0,50 г (40%). 1 Продукт предыдущего примера (0,30 г) обрабатывают азидом натрия (0,10 г) и хлоридом аммония (0,09 г) в ДМФ (2 мл) при 100 С в течение 3,5 ч. Продукт изолируют тем же способом, как в примере 1 с. Выход 0,30 г (82%). Температура плавления: 235-245 С. 1 Продукт предыдущего примера (0,90 г) обрабатывают хлорацетонитрилом (0,48 г) и карбонатом калия (2,1 г) в ДМФ (5 мл) при 100 С в Продукт предыдущего примера (0,40 г) обрабатывают азидом натрия (0,15 г) и хлоридом аммония (0,12 г) в ДМФ (2 мл) при 100 С в течение 2,5 ч. Продукт выделяют, как описано в примере 1 с. Выход 0,385 г (78%). Температура плавления: 248-250 С. 1 Н-ЯМР (ДМСО-d6, 400 МГц): 2,368 (с, 3 Н,СН 3), 2,668-2,707 (м, 2 Н, СН 2 СН 2), 2,783-2,822 3,5-Диметоксианилин (5 г) добавляют по частям к предварительно нагретому (160 С) этил-2-бензилацетоацетату (15 мл) в атмосфере азота и выдерживают при этой температуре 60 мин. Охлажденный раствор разбавляют смесью гептана и простого этилового эфира и фильтруют. Выход 5,2 г (49%). 1 Продукт предыдущего примера (1,2 г) добавляют к предварительно нагретой (85 С) метансульфоновой кислоте (3,5 мл) и выдерживают при этой температуре в течение 15 мин. Раствору позволяют остыть и затем обрабатывают ледяной водой. Продукт фильтруют, промывают бикарбонатом натрия и водой. Выход 1,08 г Продукт предыдущего примера (1 г) кипятят с обратным холодильником в атмосфере азота в гидрохлориде пиридина (5 г) в течение двадцати минут. Реакционную смесь обрабатывают водой и продукт фильтруют. Выход 0,9 г Продукт примера 8b (1 г), трет-бутоксид калия (0,62 г) и бензилбромид (0,68 мл) перемешивают в ДМСО (10 мл) при 60 С в течение 4 ч. Реакционную смесь обрабатывают водой,экстрагируют толуолом и испаряют. Продукт растирают с простым этиловым эфиром и фильтруют. Выход 0,5 г (39%). 1 Н-ЯМР (400 МГц): 2,537 (с, 3 Н), 3,708 (с,3 Н), 3,826 (с, 3H), 4,124 (с, 2 Н), 5,56 (ш, 2 Н),6,413-6,434 (м, 2 Н), 7,154-7, 332 (м, 10 Н). е) 1,3-Дибензил-5,7-дигидрокси-4-метил 2(1 Н)-хинолинон. Продукт предыдущего примера (2 г) обрабатывают гидрохлоридом пиридина (10 г), как описано в примере 8 с. Продукт экстрагируют этилацетатом и испаряют. Выход 1,4 г (75%). 1 Продукт предыдущего примера (1,4 г) обрабатывают хлорацетонитрилом (0,76 г) и Продукт предыдущего примера (1,3 г) обрабатывают азидом натрия (0,41 г) и хлоридом аммония (0,34 г), как описано в примере 1 с. Выход 0,69 г (45%). 1 Продукт примера 8b (0,5 г), t-BuOK (третбутоксид калия) (0,2 г) и метилиодид (0,4 мл) перемешивают в ДМСО (5 мл) при 35 С в течение двух дней. Реакционную смесь обрабатывают водой и экстрагируют толуолом. Продукт очищают колоночной хроматографией с использованием смеси толуолэтилацетатуксусная кислота 8:2:1 в качестве элюента. Выход 0,24 г Продукт предыдущего примера (0,2 г) обрабатывают гидрохлоридом пиридина (2 г), как описано в примере 8 с, и продукт экстрагируют этилацетатом. Выход 0,16 г (89%). 1 Продукт предыдущего примера (0,15 г),хлорацетонитрил (0,08 г) и К 2 СО 3 (0,28 г) подвергают взаимодействию в ДМФ (2 мл), как описано в примере 1b. Выход 0,16 г (84%). 1 22 Продукт примера 1 а (1 г), 2-хлорпропионитрил (0,7 г) и карбонат калия (2 г) нагревают в ДМФ (15 мл) в атмосфере азота при 110 С в течение шестидесяти минут. Смесь обрабатывают водой, фильтруют и промывают 1 н. NaOH и водой. Выход 1,2 г. 1 Продукт предыдущего примера (0,15 г) обрабатывают NaN3 (57 мг) и NH4Cl (47 мг) в ДМФ (2 мл), как описано в примере 1 с. Выход 0,115 г. Температура плавления: 250-253 С. 1 Продукт предыдущего примера (0,5 г),азид натрия (0,18 г) и хлорид аммония (0,15 г) нагревают в ДМФ (7 мл) при 100 С в течение 90 мин. Продукт обрабатывают водой, экстрагируют этилацетатом и испаряют. Выход 0,57 г. Температура плавления: 91-104 С. 1 0,07 мл Метилиодида добавляют к раствору 0,2 г продукта примера 1 с и 0,31 г К 2 СО 3 в 2 мл ДМФ и смесь перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь выливают в ледяную воду и фильтруют. Выход 0,2 г, как смесь четырех региоизомеров, температура плавления 71-76 С. 1 Продукт примера 8f (0,2 г) кипятят с обратным холодильником в растворе концентрированной хлорводородной кислоты (3 мл) и уксусной кислоты (2 мл) в течение одного часа. Продукт фильтруют при 25 С. Выход 0,14 г. 1 Н-ЯМР (ДМСО-d6, 300 МГц): 2,63 (с,СН 3), 4,14 (с, 2 Н, CH2Ph), 4,66 (с, 2 Н,ОСН 2 СООН), 4,79 (с, 2 Н ОСН 2 СООН), 5,53 (с,2 Н, NCH2Ph), 6,41 (д, 1 Н, J = 2,2 Гц), 6,45 (д, 1 Н,J = 2,2 Гц), 7,13-7,34 (м, 10 Н, Ph). Пример 13. Получение 3-бензил-5,7-бис Продукт предыдущего примера (1,25 г) нагревают в гидрохлориде пиридина (12,5 г) при около 225 С в течение 9 мин. Выход 1 г. 1 Н-ЯМР (ДМСО-d6, 300 МГц): 2,56 (с, 3 Н),4,07 (с, 2 Н), 5,4 (ш, 2 Н), 6,13 (д, 1 Н, J = 2,1 Гц),6,20 (д, 1 Н, J = 2,1 Гц), 7,12-7,28 (м, 9 Н), 9,88 (с,1 Н), 10,22 (с, 1 Н). с) 3-Бензил-5,7-бис(цианометокси)-1-(4 фторбензил)-4-метил-2(1 Н)-хинолинон. Продукт предыдущего примера (1 г),ClCH2CN (0,43 г) и К 2 СО 3 (1,42 г) нагревают в ДМФ (8 мл) при 120 С в течение одного часа. Выход 0,94 г. 1 Продукт предыдущего примера (0,5 г),азид натрия (0,14 г) и хлорид аммония (0,12 г) нагревают в ДМФ (5 мл) при 120 С в течение 90 мин. Продукт растирают с ацетонитрилом. Выход 0,28 г. Температура плавления: 126-132 С. 1 Раствор флороглюцина (1,57 г) и этил-2-(4 хлорбензил)ацетоацетата (3,18 г) в этаноле (25 мл) обрабатывают сухим НСl при 0 С в течение 1,5 ч и раствор выдерживают при этой температуре в течение ночи. Растворитель испаряют и осадок растирают с водой. Выход 3,87 г (98%). Температура плавления 270-278 С. 1 Н-ЯМР (ДМСО-d6, 300 МГц): 2,52 (с, 3 Н,СН 3), 3,87 (с, 2 Н, СН 2), 6,17 (д, 1 Н, J = 2,4 Гц),6,28 (д, 1 Н, J = 2,4 Гц), 7,18-7,34 (м, 4 Н, Ph),10,21 (с, 1 Н, ОН), 10,48 (с, 1 Н, ОН). Продукт предыдущего примера (1,00 г),хлорацетонитрил (0,50 г) и карбонат калия (2,18 г) нагревают в ДМФ (5 мл) при 100 С в течение 30 мин. Продукт выделяют как описано в примере 1b. Выход 0,90 г (72%). 1 Н-ЯМР (ДМСО-d6, 300 МГц): 2,52 (с, 3 Н,СН 3), 3,95 (с, 2 Н, СН 2), 5,308 (с, 2 Н, OCH2CN),5,312 (с, 2 Н OCH2CN), 6,81 (д, 1 Н, J = 2,5 Гц),6,94 (д, 1 Н, J = 2,5 Гц), 7,22-7,33 (м, 4 Н, Ph). с) 5,7-бис[(1 Н-Тетразол-5-ил)метокси]-3(4-хлорбензил)-4-метил-2 Н-1-бензопиран-2-он. Продукт предыдущего примера (0,40 г),азид натрия (0,14 г) и хлорид аммония (0,11 г) нагревают в ДМФ (2 мл) при 100 С в течение 2 ч. Продукт выделяют, как в примере 1 с. Выход 0,40 г (82%). 1(150 мл) обрабатывают сухим НСl при 0 С в течение 7,5 ч и раствор выдерживают при этой температуре в течение ночи. Растворитель испа 25 ряют и осадок растирают с водой. Выход 0,63 г Продукт предыдущего примера (0,57 г),хлорацетонитрил (0,27 г) и карбонат калия (1,20 г) нагревают в ДМФ (2 мл) при 100 С в течение 50 мин. Продукт выделяют, как описано в примере 1b. Выход 0,47 г (67%). Температура плавления 178-185 С. 1 Н-ЯМР (ДМСО-d6, 400 МГц): 2,53 (с, 3 Н,СН 3), 4,11 (с, 2 Н, СН 2), 5,319 (с, 2 Н, OCH2CN),5,323 (с, 2 Н OCH2CN), 6,83 (д, 1 Н, J = 2,4 Гц),6,96 (д, 1 Н, J = 2,4 Гц), 7,48-7,53 и 8,12-8,16 (м,4 Н, Ph). с) 5,7-Бис[(1 Н-тетразол-5-ил)-метокси]-3(4-нитробензил)-4-метил-2 Н-1-бензопиран-2-он. Продукт предыдущего примера (0,38 г),азид натрия (0,12 г) и хлорид аммония (0,11 г) нагревают в ДМФ (3 мл) при 100 С в течение 2 ч. Продукт выделяют, как описано в примере 1 с. Выход 0,25 г (54%). Температура плавления 240-244 С. 1 Н-ЯМР (ДМСО-d6, 400 МГц): 2,47 (с, 3 Н,СН 3), 4,08 (с, 2 Н, СН 2), 5,611 (с, 2 Н, OCH2Tet),5,623 (с, 2 Н, OCH2Tet), 6,85 (д, 1 Н, J = 2,4 Гц),6,87 (д, 1 Н, J = 2,4 Гц), 7,46-7,50 и 8,12-8,16 (м,4 Н, Ph). Пример 16. Получение 5,7-бис[(1 Н-тетразол-5-ил)-метокси]-3-циклопентил-4-метил-2 Н 1-бензопиран-2-она. а) 3-Циклопентил-5,7-дигидрокси-4-метил 2 Н-1-бензопиран-2-он. Раствор флороглюцина (2,00 г) и этил-2 циклопентилацетоацетата (3,14 г) в этаноле (40 мл) обрабатывают сухим НСl при 0 С в течение 2,5 ч и раствор выдерживают при этой температуре в течение ночи. Растворитель испаряют и осадок очищают флэш-хроматографией, элюируя толуолом-EtOAc-AcOH (8:1:1). Выход 1,22 г Продукт предыдущего примера (0,50 г),хлорацетонитрил (0,31 г) и карбонат калия (0,61 г) нагревают в ДМФ (2 мл) при 80 С в течение 40 мин. Продукт выделяют, как описано в примере 1b. Выход 0,56 г (86%). 1 Продукт предыдущего примера (0,30 г),азид натрия (0,13 г) и хлорид аммония (0,11 г) нагревают в ДМФ (1 мл) при 100 С в течение 1,5 ч. Продукт выделяют, как в примере 1 с. Выход 0,30 г (80%). Температура плавления 248252 С. 1(20 мл) обрабатывают сухим НСl при 0 С в течение 3 ч и раствор выдерживают при этой температуре в течение ночи. Растворитель испаряют и осадок растирают с водой и подвергают перекристаллизации из смеси изопропанол-вода 27 Продукт предыдущего примера (0,80 г),хлорацетонитрил (0,36 г) и карбонат калия (0,66 г) нагревают в ДМФ (4 мл) при 100 С в течение 1 ч. Продукт выделяют, как в примере 1b. Выход 0,30 г (30%). 1 28 воду и продукт экстрагируют в EtOAc. EtOAc сушат и испаряют досуха. Продукт подвергают перекристаллизации из толуола. Выход 0,80 г Продукт предыдущего примера (0,25 г),азид натрия (0,080 г) и хлорид аммония (0,072 г) нагревают в ДМФ (2 мл) при 100 С в течение 2,5 ч. Продукт выделяют, как описано в примере 1 с. Выход 0,11 г (36%). Температура плавления 164-174 С. 1 Продукт предыдущего примера (0,69 г) растворяют в СН 2 Сl2 (14 мл) и реакционную смесь охлаждают до -20 С. Добавляют ВВr3 (2,4 г) в СН 2 Сl2 (1 М раствор) и смеси позволяют нагреваться до температуры окружающей среды в течение ночи. Осадок отфильтровывают, промывают СН 2 Сl2 и растворяют в EtOAc. EtOAc промывают разбавленной НСl, сушат и испаряют досуха. Выход 0,34 г (54%). 1 Н-ЯМР (ДМСО-d6, 300 МГц): 2,56 (д, 3 Н,J = 1,0 Гц, СН 3), 5,33 (ш, 2 Н, NCH2), 6,11 (д, 1 Н,J = 2,1 Гц), 6,13 (д, 1 Н, J = 1,0 Гц, СН=С), 6,17(1,53 г), растворенный в ксилоле (4 мл). Смесь нагревают до 120-130 С в течение 20 мин и затем охлаждают до комнатной температуры. Добавляют метансульфоновую кислоту (2 мл) и смесь перемешивают при температуре окружающей среды 10 мин. Добавляют воду (40 мл) и осадок отфильтровывают и сушат. Выход 1,31 г (60%). 1 Н-ЯМР (ДМСО-d6, 300 МГц): 2,50 (с, 3 Н,СН 3), 3,79 (с, 3 Н, ОСН 3), 3,83 (с, 3 Н, ОСН 3), 6,03 Продукт предыдущего примера (0,34 г),хлорацетонитрил (0,13 г) и карбонат калия (0,34 г) нагревают в ДМФ (2 мл) при 100 С в течение 1,5 ч. Добавляют воду и осадок отфильтровывают и сушат. Продукт подвергают перекристаллизации из изопропанола. Выход 0,20 г Продукт предыдущего примера (1,20 г) суспендируют в ДМСО (15 мл) и добавляют tBuOK (0,68 г) и бензилбромид (1,03 г). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Добавляют Продукт предыдущего примера (0,20 г),азид натрия (0,072 г) и хлорид аммония (0,060 г) нагревают в ДМФ (2 мл) при 100 С в течение 3 ч. Продукт выделяют, как описано в примере 1 с. Этил-2-(2-фторбензил)ацетоацетат (2,5 г) в ксилоле (1 мл) нагревают до 150 С и добавляют 3,5-диметоксианилин (1,46 г) в ксилоле (4 мл) малыми порциями в течение 30 мин. Реакционную смесь нагревают до 160 С в течение 3 ч и затем охлаждают до комнатной температуры. Добавляют метансульфоновую кислоту (1,7 мл) и смесь перемешивают при температуре окружающей среды 30 мин. Добавляют воду и осадок отфильтровывают и сушат. Продукт растирают с теплым этанолом. Выход 0,64 г (21%). 1 Продукт предыдущего примера (0,62 г) обрабатывают t-BuOK (0,23 г) и бензилбромидом Продукт предыдущего примера (0,34 г) обрабатывают ВВr3 (8,48 г) в CH2Cl2 (7 мл), как описано в примере 18 с. Выход 0,30 г (82%). 1 Продукт предыдущего примера (0,21 г),хлорацетонитрил (0,086 г) и карбонат калия Продукт предыдущего примера (0,17 г),азид натрия (0,051 г) и хлорид аммония (0,042 г) нагревают в ДМФ при 100 С в течение 3 ч. Продукт выделяют, как описано в примере 1 с. Выход 0,17 г (85%). Температура плавления 135-140 С. 1 Этил-2-(2-фенилэтил)ацетоацетат (2,70 г) в ксилоле (5 мл) обрабатывают 3,5-диметоксианилином (1,60 г) при 150 С, как описано в примере 19 а. Добавляют метансульфоновую кислоту (4,0 мл) при комнатной температуре и смесь нагревают при 80 С в течение 1 ч. Продукт выделяют, как описано в примере 19 а. Выход 1,38 г 31 Продукт предыдущего примера (0,61 г), tBuOK (0,24 г) и бензилбромид (0,36 г) нагревают в ДМСО (12 мл) при 60 С в течение 2 ч. Продукт выделяют, как описано в примере 18b. Выход 0,31 г (40%). 1 Продукт предыдущего примера (0,31 г) обрабатывают ВВr3 (0,75 г) в CH2Cl2 (5 мл), как в примере 18 с. Выход 0,26 г (89%). 1 Продукт предыдущего примера (0,22 г),хлорацетонитрил (0,091 г) и карбонат калия Продукт предыдущего примера (0,19 г),азид натрия (0,057 г) и хлорид аммония (0,047 г) нагревают в ДМФ при 100 С в течение 3 ч. Продукт выделяют, как описано в примере 1 с. Выход 0,18 г (78%). Температура плавления 215-218 С.(0,9 г) и 2-хлорацетамида (0,25 г) в ДМФ (6,5 мл) подвергают взаимодействию при 100 С в течение двух часов. Реакционную смесь обрабатывают ледяной водой и фильтруют. Продукт растирают с горячим этанолом. Выход: 0,32 г. Температура плавления 252-253 С. 1(0,63 мл) и карбоната калия (1,49 г) в ДМФ (5 мл) нагревают в атмосфере азота при 110 С в течение трех часов, выливают в ледяную воду и фильтруют. Полученный твердый материал растирают с простым эфиром и снова фильтруют. Выход: 1,03 г, температура плавления 113116 С. 1 Продукт предыдущего примера (0,3 г),гидрохлорид гидроксиламина (0,32 г) и 5 н.NaOH (1,05 мл) подвергают взаимодействию в этаноле (8 мл) при 50 С в течение шести часов. Реакционную смесь обрабатывают водой и подщелачивают (рН 10) и фильтруют. Фильтрат подкисляют до рН 2 и фильтруют. Выход: 0,2 г,температура плавления 121-127 С. 1H-ЯМР (ДМСО-d6, 400 МГц): таутомерные формы гидроксамовой кислоты видны по ОСН 2-сигналам: 2,63 (с, 3 Н, СН 3), 4,13 (с, 2 Н,CH2Ph), 4,41 (с, 2 Н, ОСН 2), 4,54 (с, 2 Н, ОСН 2),4,64 (с, 2 Н, HON=C(OH)CH2O), 4,65 (с, 2 Н,HON=C(ОН)СН 2O), 4,77 (с, 2 Н, HON=C(OH)(12,5 мл) перемешивают при 80 С в течение 4 ч. Реакционную смесь обрабатывают водой при рН 8 и фильтруют. Твердые вещества подвергают перекристаллизации из этанола-ДМФ (2:1). Выход: 0,5 г. Температура плавления 208-218 С. 1 Продукт предыдущего примера (0,2 г) и ацетат калия (0,13 г) в уксусной кислоте (5 мл) кипятят с обратным холодильником в течение 4 34 ч. Смесь испаряют, обрабатывают водой при рН 10 и фильтруют. Фильтрат подкисляют до рН 6 и фильтруют. Выход 70 мг. 1C1-7 алкил, возможно замещенный галогеном или нитро,R2 обозначает водород,R3 обозначает водород, C1-7 алкил, С 6-10 арил,А обозначает C1-3 алкилен;R1+R3 являются бутиленом, возможно замещенным С 6-10 арилом,Y обозначает О,Х обозначает О, NR11, где R11 обозначает Н, C1-7 алкил или С 6-10 арил C1-7 алкил, возможно замещенный галогеном,R4, R5 обозначают независимо одну из следующих групп или 6-гидроксипиридазинил, в этом случае А является валентной связью, или в случае, когда Х обозначает NR11, R4, R5 могут также независимо обозначать НООС-, R12OOC-, H2NCO- илиHOHNCO-, где R12 обозначает C1-7 алкил,и их фармацевтически приемлемые соли и сложные эфиры. 2. Соединение по п.1, где указанное соединение имеет формулу (I) и R2 обозначает водород. 3. Соединение по п.2, где R1 обозначает водород, C1-6 алкил, С 2-6 алкенил, С 6-10 арил,C7-12 арилалкил, C1-6 гидроксиалкил, C1-6 галогеналкил или C1-6 алкокси. 4. Соединение по п.3, где Х обозначает О. 5. Соединение по п.3, где Х обозначаетC1-6 алкил. 8. Соединение по п.7, где А обозначает C1-4 алкилен с линейной или разветвленной цепью и дающемуся в этом, терапевтически эффективного количества соединения по п.1. 11. Способ лечения и профилактики поражения миокарда, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1. 12. Соединение формулы (XXV) или, когда Х обозначает NR11, тогда R4 и R5 могут также обозначать НООС-, R12OOC-, H2NCOили HOHNCO-, где R12 обозначает C1-6 алкил. 9. Фармацевтический препарат, содержащий соединение по п.1 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем. 10. Способ лечения сердечной недостаточности, включающий введение субъекту, нуж где R1 обозначает водород, C1-7 алкил, С 6-10 арилC1-7 алкил, возможно замещенный галогеном или нитро,R3 обозначает водород, C1-7 алкил, С 6-10 арил,R11 обозначает водород, C1-7 алкил, С 6-10 арил C1-7 алкил, возможно замещенный галогеном.
МПК / Метки
МПК: A61P 9/04, A61K 31/4709, C07D 407/14
Метки: фосфоламбана, ингибиторов, азанафталин-2-онов, бисэфиры, 1-окса, простые, качестве
Код ссылки
<a href="https://eas.patents.su/19-3084-prostye-bisefiry-1-oksa-i-1-azanaftalin-2-onov-v-kachestve-ingibitorov-fosfolambana.html" rel="bookmark" title="База патентов Евразийского Союза">Простые бисэфиры 1-окса- и 1- азанафталин-2-онов в качестве ингибиторов фосфоламбана</a>
Предыдущий патент: Способ переработки смешанных нефтяных отходов и установка для его осуществления
Случайный патент: Новый кристаллический ангидрат с антихолинергическим действием