Производные лептомицина
Формула / Реферат
1. Производное лептомицина формулы (I)
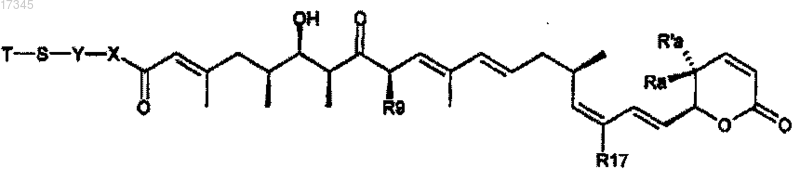
где Ra и R'a представляют собой Н или линейный или разветвленный С1-С20-алкил;
R17 представляет собой линейный или разветвленный C1-C20-алкил;
R9 представляет собой линейный или разветвленный C1-C20-алкил;
X означает -NR-, где R является водородом;
Y представляет собой линейный или разветвленный С1-С20-алкил;
Т представляет собой Н, R1 или SR1, где R1 представляет собой Н или линейный или разветвленный С1-С20-алкил;
или фармацевтически приемлемые соли указанного производного лептомицина или их рацематы, диастереомеры или энантиомеры.
2. Производное лептомицина по п.1, в котором Ra является линейным или разветвленным C1-C20-алкилом и R'a является Н.
3. Производное лептомицина по пп.1, 2, в котором Т представляет собой Н или SR1, где R1 является линейным или разветвленным C1-C20-алкилом.
4. Производное лептомицина, выбранное из группы, содержащей:
(2-метилсульфанилэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
бис-[(2-меркаптоэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-меркаптоэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-метилдисульфанилэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-метил-2-метилдисульфанилпропил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-меркапто-2-метилпропил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты
или их фармацевтически приемлемые соли или их рацематы, диастереомеры или энантиомеры.
5. Фармацевтическая композиция, предназначенная для ингибирования роста избранных популяций клеток, содержащая производное лептомицина по пп.1-4 и фармацевтически приемлемый носитель.
6. Применение производного лептомицина по пп.1-4 для получения лекарственного средства для лечения рака.
7. Способ получения соединения по пп.1-4, включающий стадию взаимодействия соответствующих соединений формул (II) и (III):
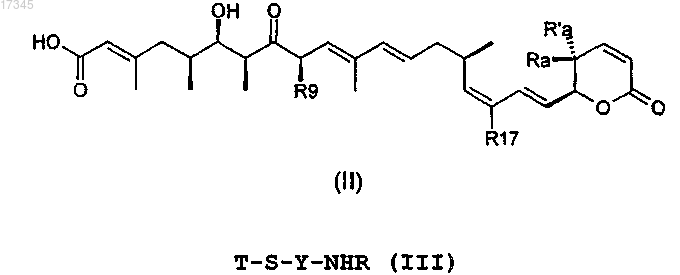
где Ra, Ra', R17, R9, Y, T, n определены в пп.1-4.
8. Способ получения соединения по любому из пп.1-4, где в формуле (I) T является Н, включающий восстановление соответствующего соединения формулы (I)
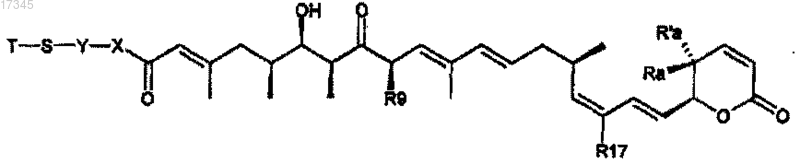
где Т является S-R1;
Ra, Ra', R17, R9, X, Y, R1 определены в п.1,
в присутствии средства, восстанавливающего дисульфидные связи.
9. Способ получения конъюгата, включающий стадию взаимодействия производного лептомицина по любому из пп.1-4 с модифицированным связывающимся с клеткой средством, содержащим функциональную группу, реакционноспособную в отношении соединяющей группы производного лептомицина, так что данное производное и связывающееся с клеткой средство соединены друг с другом через линкер, где модифицированное связывающееся с клеткой средство выбрано из группы, состоящей из пептидов, не пептидов, антител, моноклональных антител, фрагментов антител, которые содержат по меньшей мере один связывающий сайт, лимфокинов, гормонов, факторов роста и молекул, транспорта питательных веществ.
10. Способ по п.9, при котором указанное связывающееся с клеткой средство, содержащее функциональную группу, реакционноспособную в отношении указанной соединяющей группы производного лептомицина, получают путем взаимодействия указанного связывающегося с клеткой средства с реагентом, выбранным из N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилата (SMCC), N-сульфосукцинимидил-4-(5-нитро-2-пиридилдитио)бутаноата (SSNPB), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбокси-(6-амидокапроата) (LC-SMCC), N-сукцинимидил-4-(йодацетил)аминобензоата (SIAB), N-сукцинимидилйодацетата (SIA), N-сукцинимидилбромацетата (SBA) и N-сукцинимидил-3-(бромацетамидо)пропионата (SBAP).
11. Способ по п.9, где конъюгат представляет собой конъюгат с тиоэфирным линкером и способ включает стадию взаимодействия тиолсодержащего производного лептомицина по любому из пп.1-4 с антителом или связывающимся с клеткой средством, модифицированным N-сульфосукцинимидил-4-(5-нитро-2-пиридилдитио)бутаноатом, N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилатом, N-сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбокси-(6-амидокапроатом), N-сукцинимидил-4-(йодацетил)аминобензоатом, N-сукцинимидилйодацетатом, N-сукцинимидилбромацетатом или N-сукцинимидил-3-(бромацетамидо)пропионатом.
12. Способ по п.9, включающий стадию взаимодействия дисульфид- или тиолсодержащего производного лептомицина по любому из пп.1-4 с пептидом или антителом, модифицированным реагентом, выбранным из N-сукцинимидил-4-(2-пиридилдитио)пентаноата, 4-сукцинимидилоксикарбонил-α-метил-α-(2-пиридилдитио)толуола, N-сукцинимидил-3-(2-пиридилдитио)бутирата, сукцинимидилпиридилдитиопропионата, сложного эфира N-гидросукцинимида 4-(2-пиридилдитио)бутановой кислоты, сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилата, N-сульфосукцинимидил-3-(2-(5-нитропиридилтио))бутират, 2-иминотиолана или S-ацетилянтарного ангидрида.
13. Терапевтическое средство для лечения патологических состояний посредством подавления роста избранных клеточных популяций, содержащее:
(a) конъюгат, полученный по любому из пп.9-12, и
(b) фармацевтически приемлемый носитель, разбавитель или эксципиент.
14. Терапевтическое средство по п.13, где патологическое состояние является злокачественным заболеванием.
15. Терапевтическое средство по п.13, где патологическое заболевание является раком легкого, молочных желез, толстого кишечника, простаты, почек, поджелудочной железы, яичников и лимфатических органов или меланомы.
Текст
Представлены производные лептомицина, имеющие группу, такую как сульфидная или дисульфидная, которые могут соединяться со связывающимся с клеткой реагентом, таким как антитела. Описано также терапевтическое применение конъюгатов производного лептомицина; такие конъюгаты находят терапевтическое применение, так как они могут доставлять цитотоксические производные лептомицина к конкретной популяции клеток направленным образом. 017345 Область изобретения Данное изобретение относится к производным лептомицина и их терапевтическому использованию. Более конкретно, данное изобретение относится к новым производным лептомицина, которые содержат группу (связывающую группу), которая может ковалентно связываться со связывающимся с клеткой веществом, и соответствующие конъюгаты, содержащие указанное производное лептомицина, связанное через линкер с указанным связывающимся с клеткой веществом. Указанные конъюгаты обеспечивают терапевтические средства, способные активироваться и высвобождаться in vivo и доставляемые к конкретным популяциям клеток целевым образом. Предпосылки создания изобретения Имеется много сообщений, которые касаются направленной доставки к опухолевым клеткам с помощью конъюгатов моноклональное антитело-лекарственное средство Sela et al., in Immunoconjugates,p. 189-216 (C. Vogel, ed. 1987); Ghose et al., in Targeted Drugs, p. 1-22 (E. Goldberg, ed. 1983); Diener et al.,in Antibody Mediated Delivery Systems, p. 1-23 (J. Rodwell, ed. 1988); Pietersz et al., in Antibody MediatedCancer Chemotherapy, 317-338, ACS Symposium Series 796; and I. Ojima et al. eds, American Chemical Society 2001. Цитотоксические лекарственные средства, такие как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил, калихеамицин и майтанзиноиды,были конъюгированы с рядом мышиных моноклональных антител. В некоторых случаях молекулы лекарств были связаны с молекулами антител посредством промежуточной молекулы-носителя, такой как сывороточный альбумин Garnett et al., 46 Cancer Res. 2407-2412 (1986); Ohkawa et al., 23 CancerImmunol. Immunother. 81-86 (1986); Endo et al., 47 Cancer Res. 1076-1080 (1980), декстран Hurwitz et al.,2 Appl. Biochem. 25-35 (1980); Manabi et al., 34 Biochem. Pharmacol. 289-291 (1985); Dillman et al., 46 Cancer Res. 4886-4891 (1986); и Shoval et al., 85 Proc. Natl. Acad. Sci. U.S.A. 8276-8280 (1988) или полиглутаминовая кислота Tsukada et al., 73 J. Natl. Canc. Inst. 721-729 (1984); Kato et al., 27 J. Med. Chem. 16021607 (1984); Tsukada et al., 52 Br. J. Cancer 111-116 (1985). Существует широкий выбор линкеров из доступной в настоящее время номенклатуры для получения таких иммуноконъюгатов, включая как отщепляемые, так и не отщепляемые линкеры. Испытания на цитотоксичность in vitro, однако, выявили, что с конъюгатами антитело-лекарственное вещество редко достигается такой же уровень цитотоксического действия, что и со свободными неконъюгированными лекарственными веществами. Это свидетельствует о том, что механизмы, с помощью которых молекулы лекарственного средства высвобождаются из конъюгированных антител, являются очень неэффективными. Ранняя работа в области иммунотоксинов показала, что конъюгаты, образованные посредством дисульфидных мостиков между моноклональными антителами и каталитически активными белковыми токсинами, были более цитотоксичными, чем конъюгаты, содержащие другие линкеры Lambert et al.,260 J. Biol. Chem. 12035-12041 (1985); Lambert et al., in Immunotoxins 175-209 (A. Frankel, ed. 1988);Ghetie et al., 48 Cancer Res. 2610-2617 (1988). Повышенная цитотоксичность была связана с высокой внутриклеточной концентрацией восстановленного глютатиона, способствующего эффективному расщеплению дисульфидной связи между молекулой антитела и токсином. Майтанзиноиды и калихеамицин были первыми примерами высокоцитотоксичных лекарственных средств, которые были связаны с моноклональными антителами с помощью дисульфидных связей. Конъюгаты антител и этих лекарственных средств, как показано, обладают высокой активностью in vitro и исключительной противоопухолевой активностью на моделях ксенотрансплантатов человеческих опухолей на мышах R.V.J. Chari et al., 52 является природным продуктом, первоначально выделенным из Streptomyces spp., о чем сообщено вUS 4771070 и US 4792522. Первоначально он был идентифицирован в результате массового тестирования на антимикробную активность, а затем идентифицирован как противоопухолевое средство(Komiyama et al., J. Antibiotics 1985, 38(3), 427-429 и US 2003/0162740). Ha молекулярном уровне лептомицин В действует как ингибитор рецепторов ядерного экспорта CRM1, который связывается с "транспортными белками" и воздействует на ядерное перемещение "транспортных белков". На клеточном уровне лептомицин В действует путем остановки клеток в конце фаз G1 и G2 клеточного цикла (Kalesseet al., Synthesis 2002, 8, 981-1003). Однако его чрезвычайная токсичность в отношении клеток млекопитающих (Hamamoto et al., J. Antibiotics 1983, 36(6), 639-645) сделала его клиническое применение невоз-1 017345 можным. Таким образом, очень желательно снизить токсичность производных лептомицина в отношении нецелевых клеток. Терапевтическая эффективность производных лептомицина могла быть значительно повышена путем изменения распределения in vivo путем направленной доставки в место опухоли, дающей в результате сниженную токсичность в отношении нецелевых тканей и, таким образом, более низкую системную токсичность. Чтобы достичь этой цели, рассмотрено получение конъюгатов производных лептомицина В со связывающимися с клеткой средствами, которые специфически направляются к опухолевым клеткам,имея в виду проявление высокой целевой специфической цитотоксичности. Краткое описание изобретения Задача, на решение которой направлено данное изобретение, состоит в получении производных лептомицина формулы (I) где Ra и R'a представляют собой Н или линейный или разветвленный C1-C20-алкил;R17 представляет собой линейный или разветвленный C1-C20-алкил;R9 представляет собой линейный или разветвленный C1-C20-алкил;Y представляет собой линейный или разветвленный C1-С 20-алкил; Т представляет собой Н, R1 или SR1, где R1 представляет собой Н или линейный или разветвленный С 1-С 20-алкил; или фармацевтически приемлемых солей указанного производного лептомицина или их рацематов, диастереомеров или энантиомеров. Ещ одним объектом настоящего изобретения является фармацевтическая композиция, предназначенная для ингибирования роста избранных популяций клеток, содержащая вышеуказанное производное лептомицина формулы (I) и фармацевтически приемлемый носитель. Ещ одним объектом настоящего изобретения является применение указанного выше производного лептомицина формулы (I) для получения лекарственного средства для лечения рака. Охарактеризованные выше производные лептомицина формулы (I) могут быть получены способом,включающим стадию взаимодействия соответствующих соединений формул (II) и (III): где Ra, Ra', R17, R9, Y, T, n определены выше. В другом варианте охарактеризованные выше производные лептомицина формулы (I), где Т является Н, могут быть получены путем восстановления соответствующего соединения формулы (I)Ra, Ra', R17, R9, X, Y, R1 определены выше,в присутствии средства, восстанавливающего дисульфидные связи. Оба описанных выше способа являются объектами настоящего изобретения. Ещ одним другим объектом настоящего изобретения является способ получения конъюгата, включающий стадию взаимодействия описанного выше производного лептомицина формулы (I) с модифицированным связывающимся с клеткой средством, содержащим функциональную группу, реакционноспособную в отношении соединяющей группы производного лептомицина, так что данное производное и связывающееся с клеткой средство соединены друг с другом через линкер, где модифицированное свя-2 017345 зывающееся с клеткой средство выбрано из группы, состоящей из пептидов, не пептидов, антител, моноклональных антител, фрагментов антител, которые содержат по меньшей мере один связывающий сайт,лимфокинов, гормонов, факторов роста и молекул, транспорта питательных веществ. Другим объектом настоящего изобретения является терапевтическое средство для лечения патологических состояний посредством подавления роста избранных клеточных популяций, содержащее:(a) конъюгат, полученный по любому из пп.9-12, и(b) фармацевтически приемлемый носитель, разбавитель или эксципиент. Краткое описание чертежа Чертеж представляет цитотоксичность in vitro и специфичность конъюгата huC242-SSNPBпроизводное лептомицина из примера 6. Подробное описание изобретения Были найдены производные лептомицина, которые способны к соединению со связывающимися с клеткой средствами, в результате чего терапевтическая эффективность таких производных повышается путем изменения распределения in vivo посредством направленной доставки данных производных в место опухоли, что дает в результате сниженную токсичность для нецелевых тканей и, следовательно, более низкую системную токсичность. Чтобы достичь этой цели, синтезированы образцы производных лептомицина, которые содержат связывающую группу для конъюгации производного лептомицина со связывающимся с клеткой средством. Связывающая группа может содержать разделяющую полиэтиленгликолевую группу. Связывающую группу используют для соединения со связывающимися с клеткой средствами, и она предпочтительно содержит дисульфидную связь или сульфидную (или называемую здесь тиоэфирной) связь. Ранее было показано, что эта связь высокотоксичных лекарственных средств с антителами с использованием расщепляемой связи, такой как дисульфидная связь, обеспечивает полное высвобождение активного лекарственного вещества в клетке, и что такие конъюгаты являются цитотоксичными в зависимости от антигенной специфичности R.V.J. Chari et al., 52 Cancer Res. 127-131 (1992); R.V.J. Chari etal., 55 Cancer Res. 4079-4084 (1995) и патенты США 5208020 и 5475092. В данном изобретении описан синтез производных лептомицина, способы их соединения с моноклональными антителами и определения цитотоксичности in vitro и специфичности таких конъюгатов. Таким образом, данное изобретение представляет соединения, применимые для получения терапевтических средств, направленные на устранение больных и аномальных клеток, которые нужно уничтожить или лизировать, таких как опухолевые клетки, инфицированные вирусом клетки, инфицированные микроорганизмами клетки, инфицированные паразитами клетки, аутоиммунные клетки (клетки, которые продуцируют аутоантитела), активированные клетки (те, которые участвуют в отторжении трансплантата или в реакции трансплантат против хозяина) или любой другой вид больных или аномальных клеток, в то же время проявляющие минимальные побочные действия. Таким образом, в данном изобретении представлен синтез производных лептомицина, которые могут быть химически соединены со связывающим с клеткой средством, и показано, что они сохраняют высокую цитотоксичность при освобождении от защитной группы исходных производных лептомицина. Эти соединения, когда они соединены со связывающим с клеткой средством, являются цитотоксическими для клеток, с которыми связываются связывающиеся с клеткой средства, и значительно менее токсичны для нецелевых клеток. Производные лептомицина данного изобретения. Производные лептомицина по данному изобретению содержат связывающую группу, способную к соединению данного производного со связывающимся с клеткой средством. В соответствии с данным изобретением "производные лептомицина" относятся к представителям семейства лептомицина, как определено Kalesse et al. in Synthesis 2002, 8, 981-1003, и включают лептомицины, такие как лептомицин А и лептомицин В, каллистатины, ратьядоны, такие как ратьядон А и ратьядон В, ангуиномицины, такие как ангуиномицины А, В, С, D, казузамицины, лептостатины, лептофуранины, такие как лептофуранины А, В, С, D. Производные лептомицина А и В являются предпочтительными. Чтобы соединить данное производное со связывающимся с клеткой средством, данное производное должно включать группу (соединяющую группу), которая дает возможность присоединить данные производные со связывающимся с клеткой средством путем такой связи, как дисульфидная связь, сульфидная (или называемая здесь тиоэфирной) связь, посредством нестойкой в кислой среде группы, нестойкой к свету группы, нестойкой к пептидазе группы или нестойкой к эстеразе группы. Данные производные создают так, что они содержат группу, необходимую для соединения производного лептомицина со связывающимся с клеткой средством через, например, дисульфидную связь, тиоэфирную связь, нестойкую в кислой среде группу, нестойкую к свету группу, нестойкую к пептидазе группу или нестойкую к эстеразе группу. Чтобы дополнительно повысить растворимость в водных растворах, соединяющая группа может содержать полиэтиленгликолевый разделитель. Предпочтительно используют сульфидную или дисульфидную связь, потому что восстанавливающая среда целевых клеток приводит к расщеплению сульфида или дисульфида и высвобождению данных-3 017345 производных с повышением в результате этого цитотоксичности. В соответствии с предпочтительным аспектом данное изобретение представляет производные лептомицина, причем концевая карбонильная функциональная группа представляет собой группу, которая делает возможным соединение данного производного со связывающимся с клеткой средством. Соединяющая группа может содержать полиэтиленгликолевый разделитель. Примеры включают группы, которые делают возможными соединения через дисульфидную связь, тиоэфирную связь, нестойкую в кислой среде группу, нестойкую к свету группу, нестойкую к пептидазе группу или нестойкую к эстеразе группу и хорошо известны специалистам в данной области см., например, патент США 5846545, который включен сюда в виде ссылки. Предпочтительными группами являются те, которые делают возможным соединение через дисульфидную связь, например тиол или дисульфид. Можно использовать смешанные дисульфиды, содержащие любую концевую удаляемую группу, такую как глютатион, алкилтио, такую как метилтио, пиридилтио, арилтио, нитропиридилтио, гидроксикарбонилпиридилтио, (нитро)гидроксикарбонилпиридилтио и т.п., при условии, что такие дисульфиды способны подвергаться реакции дисульфидного обмена для соединения производного со связывающим с клеткой средством. Более конкретно, производные данного изобретения имеют формулу (I) где Ra и R'a представляют собой Н или линейный или разветвленный C1-C20-алкил;R17 представляет собой линейный или разветвленный C1-C20-алкил;R9 представляет собой линейный или разветвленный С 1-С 20-алкил;Y представляет собой линейный или разветвленный С 1-С 20-алкил; Т представляет собой Н, R1 или SR1, где R1 представляет собой Н или линейный или разветвленный С 1-С 20-алкил; или фармацевтически приемлемые соли указанного производного лептомицина или их рацематы, диастереомеры или энантиомеры. В предпочтительном варианте Ra является линейным или разветвленным C1-C20-алкилом и R'a является Н. В другом предпочтительном варианте Т представляет собой Н или SR1, где R1 является линейным или разветвленным С 1-С 20-алкилом. Наиболее предпочтительные производные лептомицина представляют собой соединения, выбранные из группы, содержащей:(2-меркапто-2-метилпропил)амид (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил 19-2S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты или их фармацевтически приемлемые соли или их рацематы, диастереомеры или энантиомеры. В соответствии с описанием алкил включает линейные или разветвленные C1-C20-алкилы. Примеры линейных алкилов включают метил, этил, пропил, бутил, пентил и гексил. Примеры разветвленных алкилов включают изопропил, изобутил, вторичный бутил, трет-бутил, изопентил и 1-этилпропил. Примеры циклоалкилов, т.е. циклических алкилов, включают циклопропил, циклобутил, циклопентил и циклогексил. Примеры арилов включают фенил и нафтил. Примеры замещенных арилов включают арилы, такие как фенил или нафтил, замещенные алкильными группами, галогенами, такими как Cl, Br, F, нитрогруппами, аминогруппами, группами сульфоновой кислоты, группами карбоновой кислоты, гидроксильными группами или алкоксигруппами. Гетероциклилы относятся к, необязательно, ароматическим кольцам, содержащим один или более гетероатомов, выбранных из О, N и S, и их примеры включают фурил,пирролил, пиридил (например, 2-замещенную пиримидиновую группу) и тиофен.-4 017345 Сульфидо- или дисульфидосодержащие и меркаптосодержащие производные данного изобретения можно оценивать по их способности подавлять пролиферацию линий различных нежелательных клетокin vitro в условиях инкубации. Линии клеток, такие как, например, линии клеток Ramos и HL60, можно легко использовать для оценки цитотоксичности этих соединений. Клетки, которые нужно оценить, могут быть подвергнуты воздействию данных соединений в течение 24 ч, и выжившую часть клеток оценивали в прямых исследованиях известными методами. Значения IC50 затем можно рассчитать по результатам этих исследований. В соответствии с описанием выражение "соединяемое со связывающимся с клеткой средством" относится к производным лептомицина, содержащим по меньшей мере одну связывающую группу или ее предшественник, подходящие для соединения указанных производных со связывающимся с клеткой средством; предпочтительными соединяющими группами являются тиольные, сульфидные или дисульфидные связывающие группы или их предшественники. В соответствии с описанием выражение "соединенное со связывающимся с клеткой средством" относится к конъюгатной молекуле, содержащей по меньшей мере одно производное лептомицина, соединенное со связывающимся с клеткой средством через подходящую соединяющую группу или ее предшественник; предпочтительными соединяющими группами являются тиольные, сульфидные или дисульфидные связывающие группы или их предшественники. В соответствии с описанием термин "пациент" относится или к животному, такому как животное,ценное для разведения, или предпочтительно человеку или ребенку, которые поражены одним или более из заболеваний и патологических состояний, описанных здесь, или имеют потенциальную угрозу их проявления. В соответствии с описанием "терапевтически эффективное количество" относится к количеству соединения данного изобретения, которое эффективно для предотвращения, снижения, устранения, лечения или контроля симптомов описанных здесь заболеваний и патологических состояний. Термин "контроль", как подразумевается, относится ко всем процессам, по которым может быть замедление, прерывание, приостановка или остановка прогрессирования заболеваний и патологических состояний, описанных здесь, но нет необходимости показывать полное устранение симптомов заболевания и патологического состояния, и, как подразумевается, включает профилактическое лечение. В соответствии с описанием термины "фармацевтически приемлемый" относится к тем соединениям, веществам, эксципиентам, композициям или дозированным формам, которые в рамках здравого медицинского суждения пригодны для контакта с тканями человека и животных без излишней токсичности, раздражения, аллергических реакций или других проблемных осложнений, соответствующих разумному соотношению благотворное действие/риск неблагоприятного действия. В соответствии с описанием "фармацевтически приемлемые соли" относятся к производным описанных соединений, для которых исходное соединение модифицируется путем получения их солей с кислотами или основаниями. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичного аммония исходного соединения, образуемые, например, с нетоксичными неорганическими или органическими кислотами. Например, такие общепринятые нетоксичные соли включают те, которые получают с неорганическими кислотами, такими как соляная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, получаемые с органическими кислотами, такими как уксусная, пропионовая, янтарная, вино-каменная, лимонная, метансульфоновая, бензолсульфоновая,глюкуроновая, глютаминовая, бензойная, салициловая, толуолсульфоновая, щавелевая, фумаровая, малеиновая, молочная и т.п. Кроме того, соли присоединения включают аммониевые соли, такие как трометаминовая, меглуминовая, эполаминовая и т.д., соли металлов, такие как соли натрия, калия, кальция,цинка или магния. Фармацевтически приемлемые соли данного изобретения можно синтезировать из исходного соединения, которое содержит щелочную или кислотную группу, обычными химическими методами. Обычно такие соли можно получить по реакции форм свободных кислоты или основания этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе, или в смеси этих двух растворителей. Обычно предпочтительны неводные среды,подобные эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу. Списки подходящих солей представлены в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985,p. 1418, описание которого включено сюда в виде ссылки. В соответствии с еще одним объектом данное изобретение относится к способу получения соединений данного изобретения. Соединения и способ данного изобретения можно осуществить различными путями, хорошо известными специалистам в данной области. Данные соединения можно синтезировать, например, путем применения или адаптации способов, описанных ниже, или их вариантов, что понятно специалисту в данной области. Соответствующие модификации и замены легко увидеть, и они хорошо известны, или их легко найти в научной литературе специалистам в данной области. В частности, такие методы можно найти в R.C. Larock, Comprehensive Organic Transformations,Wiley-VCH Publishers, 1999.-5 017345 Будет понятно, что соединения данного изобретения могут содержать один или более асимметрически замещенных атомов углерода, и их можно выделить в оптически активной или рацемической форме. Таким образом, если конкретно не указана специфическая стереохимия или изомерная форма, то подразумеваются хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры. Специалистам в данной области хорошо известно, как получить и выделить такие оптически активные формы. Например, смеси стереоизомеров можно разделить по стандартным методикам, включая, но не ограничивая этим, разделение рацемических форм, нормальную, с обращенной фазой и хиральную хроматографию, преимущественное образование соли, перекристаллизацию и т.п., или путем хирального синтеза из хиральных исходных веществ или путем направленного синтеза целевых хиральных центров. Соединения данного изобретения можно получить с использованием различных методик синтеза. Реагенты и исходные материалы доступны для приобретения или их легко синтезировать хорошо известными методами специалисту в данной области. Все замены, если не указано иначе, определены ранее. В ходе реакций, описанных здесь далее, может возникнуть необходимость защитить реакционноспособные функциональные группы, например гидроксильные, амино-, имино-, тио- или карбоксильные группы, когда они желательны в конечном продукте, чтобы избежать их нежелательного участия в реакциях. В соответствии со стандартной практикой можно использовать обычные защитные группы, например, см., T.W. Greene and P.G.M. Wuts in Protective Groups in Organic Chemistry, 3rd ed., John Wiley andSons, 1999; J.F. WmcOmie in Protective Groups in Organic Synthesis, Plenum Press, 1973. Некоторые реакции можно проводить в присутствии основания. Не существует конкретного ограничения основания, которое можно использовать в данной реакции, и любое основание, обычно используемое при реакциях этого типа, равным образом можно использовать здесь при условии, что оно не обладает побочным действием на другие части молекулы. Примеры подходящих оснований включают гидроксид натрия, карбонат калия, триэтиламин, гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; соединения алкиллития, такие как метиллитий и бутиллитий; и алкоксиды щелочных металлов, такие как метоксид натрия и этоксид натрия. Обычно реакции осуществляют в подходящем растворителе. Можно использовать ряд растворителей при условии, что он не оказывает побочного действия на реакцию или на участвующие в ней реагенты. Примеры подходящих растворителей включают углеводороды, которые могут быть ароматическими,алифатическими или циклоалифатическими углеводородами, такими как гексан, циклогексан, бензол,толуол и ксилол; амиды, такие как диметилформамид; спирты, такие как этанол и метанол, и эфиры, такие как диэтиловый эфир и тетрагидрофуран. Реакции могут происходить в широком интервале температур. В общем обнаружено, что удобно проводить реакцию при температуре от 0 до 150 С (более предпочтительно от примерно комнатной температуры до 100 С). Время, необходимое для реакции, может также колебаться в широких пределах, в зависимости от многих факторов, особенно от температуры реакции и природы реагентов. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, обычно будет достаточным период от 3 до 20 ч. Данное соединение, полученное таким образом, можно выделить из реакционной смеси обычными способами. Например, данные соединения можно выделить путем отгонки растворителя из реакционной смеси или, если необходимо, после отгонки растворителя из реакционной смеси выливания остатка в воду с последующим экстрагированием с не смешиваемым с водой органическим растворителем и отгонкой растворителя из экстракта. Кроме того, данный продукт можно, если желательно, дополнительно очистить разнообразными хорошо известными методами, такими как перекрестализация, переосаждение или различные хроматографические методики, особенно колоночной хроматографией или препаративной тонкослойной хроматографией. Способ получения соединений формулы (I) включает стадию взаимодействия соответствующих соединений формул (II) и (III): где Ra, Ra', R17, R9, X, Y, Z, T, n имеют значения, указанные к формуле (I). В основном эту реакцию можно провести в присутствии обычных соединяющих реагентов, включая реагенты, которые подавляют рацемизацию, таких как НОВТ и/или дегидратирующие средства, ис-6 017345 пользуемые для активации карбоновой кислоты в отношении образования амида или сложного эфира,такого как DIC, DCC. Обычно эту реакцию можно осуществить в подходящем органическом растворителе, таком как дихлорметан. Когда в формуле (I) T является Н, реакцию альтернативно можно осуществить с N-ацилирующим веществом, таким как пивалоилхлорид, в присутствии основания, включая органические основания, такие как триэтиламин. Альтернативно, когда в формуле (I) T является Н, соединения формулы (I) можно получить из соответствующих соединений формулы (I), где Т является S-R1, в присутствии вещества, восстанавливающего дисульфидные связи, такого как триалкилфосфины, более конкретно ТСЕР. Эту реакцию можно обычно провести в водной среде, такой как смеси органического растворителя и воды, например ТГФ/воды. Димерные соединения формулы (I) могут быть получены по реакции соответствующего соединения формулы (II) с соответствующим соединением формулы (IV) в присутствии обычных соединяющих реагентов, включая реагенты для подавления рацемизации,таких как НОВТ, и/или средств дегидратации, используемых для активации карбоновой кислоты в отношении образования амида и сложного эфира, таких как DIC, DCC. Обычно эту реакцию можно осуществить в подходящем органическом растворителе, таком как дихлорметан. Данный способ может также включать дополнительную стадию выделения полученного продукта. Данное изобретение относится также к конъюгату производного лептомицина, включающему связывающееся с клеткой средство, соединенное с одним или более из производных лептомицина по данному изобретению посредством линкера, содержащего указанную соединяющую группу. Предпочтительно связывающиеся с клеткой средства являются антителами или их фрагментами. Предпочтительно линкер содержит группу -S- или -S-S-. Получение связывающихся с клеткой средств. Связывающиеся с клеткой средства могут предоставлять собой любые известные в настоящее время средства такого вида или которые станут известными и включают пептиды и не пептиды. В основном этими средствами могут быть антитела (в частности, моноклональные антитела) или фрагменты антител,которые содержат по меньшей мере один связывающий сайт, лимфокины, гормоны, факторы роста, молекулы транспорта питательных веществ (такие как трансферрин) или любые другие связывающиеся с клеткой молекулы или вещества. Более конкретные примеры связывающихся с клеткой веществ, которые можно использовать,включают моноклональные антитела; одноцепочечные антитела; фрагменты антител, такие как Fab, Fab', F(ab')2 и Fv Parham, 131 J. Immunol. 2895-2902 (1983);Spring et al., 113 J. Immunol. 470-478 (1974); Nisonoff et al., 89 Arch. Biochem. Biophys. 230-244 (1960); интерфероны; пептиды; лимфокины, такие как IL-2, IL-3, IL-4, IL-6; гормоны, такие как инсулин, TRH (релизинг-гормоны тиротропина), MSH (меланоцитостимулирующий гормон), стероидные гормоны, такие как андрогены и эстрогены; факторы роста и колониестимулирующие факторы, такие как EGF, TGF, инсулиноподобный фактор роста (IGF-I, IGF-II), G-CSF, M-CSF и GM-CSF Burgess, 5 Immunology Today 155-158 (1984); витамины, такие как фолат, и трансферрин O'Keefe et al., 260 J. Biol. Chem. 932-937 (1985). Технология моноклональных антител дает возможность продукции чрезвычайно селективных связывающихся с клеткой средств в виде специфических моноклональных антител. В частности, специалистам хорошо известны методики создания моноклональных антител, продуцируемых иммунизированными мышами, крысами, хомячками или любыми другими млекопитающими с помощью интересующего антигена, такого как интактные целевые клетки, антигены, выделенные из целевых клеток, целые вирусы, ослабленные целые вирусы и вирусные белки, такие как белки вирусной оболочки. Выбор соответствующего связывающегося с клеткой средства является делом предпочтения, которое зависит от конкретной популяции клеток, на которые оно должно быть направлено, но в основном предпочтительны моноклональные антитела, если доступно для приобретения соответствующие одни из них. Например, моноклональные антитела MY9 являются мышиными антителами IgG1, которые специфически связываются с антигеном CD33 J.D. Griffin et al., 8 Leukemia Res., 521 (1984), и их можно использовать, если целевые клетки экспрессируют CD33, как при заболевании острой миелогенной лейкемией (ОМЛ). Подобным же образом моноклональные антитела к В 4 являются мышиным IgG1, который-7 017345 связывается с антигеном CD19 на В-клетках Nadler et al., 131 J. Immunol. 244-250 (1983), и его можно использовать, если целевые клетки являются В-клетками или больными клетками, которые экспрессируют этот антиген, такие как лимфомы не-Ходжкина или хронической лимфобластной лейкемии. Кроме того, GM-CSF, который связывается с миелоидными клетками, можно использовать в качестве средства, связывающегося с больными клетками при острой миелогенной лейкемии. IL-2, который связывается с активированными Т-клетками, можно использовать для профилактики отторжения пересаженного трансплантата, для терапии и предупреждения реакции трансплантат против хозяина и для лечения острой Т-клеточной лейкемии. MSH, которые связываются с меланоцитами, можно использовать для лечения меланомы. Получение конъюгатов. Конъюгаты производных и связывающего с клеткой средства могут быть образованы с использованием любых методик, известных в настоящее время или которые будут разработаны позднее. Обычно способ получения конъюгатов данного изобретения включает стадию взаимодействия производного лептомицина данного изобретения со связывающимся с клеткой средством в присутствии реагента, содержащего функциональные группы, реакционноспособные в отношении соединяющей группы производного и связывающегося с клеткой средства, так что данное производное и связывающееся с клеткой средство соединены друг с другом через линкер, содержащий указанную соединяющую группу. Предпочтительно указанный линкер содержит сульфидную или дисульфидную связь. Можно получить производные, которые содержат свободную аминогруппу, а затем соединить с антителами или другим связывающим с клеткой средством через неустойчивый в кислой среде линкер или нестойким к свету линкером. Производные можно конденсировать с пептидом, имеющим соответствующую последовательность, а затем соединить со связывающимся с клеткой средством с получением нестойкого к пептидазе линкера. Можно получить цитотоксические соединения, которые содержат первичную гидроксильную группу, которая может быть сукцинилирована и соединена со связывающимся с клеткой средством с получением конъюгата, который может быть расщеплен внутриклеточными эстеразами с освобождением свободного производного лептомицина. Предпочтительно производные синтезируют так, что они содержат свободную или защищенную тиоловую группу с ПЭГ-содержащей разделительной группой или без нее, и затем одно или более из содержащих сульфидную, дисульфидную или тиоловую группу производных, каждое, ковалентно соединены со связывающимся с клеткой средством через дисульфидную или тиоэфирную связь. Типичными конъюгатами данного изобретения являются конъюгаты производных лептомицина с антителами, фрагментами антител, эпидермальным фактором роста (EGF), стимулирующим меланоциты гормоном (MSH), тиреоидным стимулирующим гормоном (TSH), эстрогеном, аналогами эстрогена, андрогеном и аналогами андрогена. Типичные примеры получения различных конъюгатов производных лептомицина и связывающихся с клеткой веществ описаны ниже. Дисульфидные линкеры. Антитела huMy-9-6 являются генетически гуманизированной формой мышиных моноклональных антител Му-9-6, направленные против CD33 антигена, обнаруженного на поверхности человеческих миелоидных клеток, включая большинство случаев острой миелоидной лейкемии (ОМЛ) (Е.J. Favaloro,K.F. Bradstock, A. Kabral, P. GrimsleyM.C.Berndt, Disease Markers, 5(4):215 (1987); M.G. Hoffee, D. Tavares, R.J. Lutz, Robert J., PCT Int. Appl. (2004), WO 2004043344). Му-9-6 можно использовать для получения конъюгатов. Антитела модифицируют N-сукцинимидил-3-пиридилдитиопропионатом, как описано ранее J. Carlsson, H. DrevinR.Axen, Biochem. J., 173-723 (1978), чтобы ввести, в среднем 4 пиридилдитиогруппы на молекулу антитела. Модифицированные антитела приводят во взаимодействие с тиолосодержащим производным лептомицина с получением соединенного через дисульфид конъюгата. Тиоэфирные линкеры. Тиолосодержащие производные данного изобретения могут быть соединены с антителами и другими связывающими с клеткой средствами через тиоэфирную связь, как описано ранее (патент США 5208020). Антитела или другие связывающие с клеткой средства могут быть модифицированы известным или доступным для приобретения соединением, таким как N-сульфосукцинимидил-4-(5-нитро-2 пиридилдитио)бутаноат(SMCC), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбокси-(6-амидокапроат), который является "длинноцепочечным" аналогом SMCC (LC-SMCC). Эти сшивающие реагенты образуют нерасщепляемые линкеры, получаемые из малеимидосодержащих групп. Сшивающие реагенты, содержащие группу на основе галогенацетила, включают N-сукцинимидил 4-(йодацетил)аминобензоат (SIAB), N-сукцинимидилйодацетат (SIA), N-сукцинимидилбромацетат (SBA) и N-сукцинимидил-3-(бромацетамидо)пропионат (SBAP). Эти сшивающие реагенты образуют нерасщепляемые линкеры из групп на основе галогенацетила. Модифицированное связывающее с клеткой средство можно приводить во взаимодействие с тиолосодержащим лекарственным веществом с получением соединенного через тиоэфир конъюгата.-8 017345 Неустойчивые в кислоте линкеры. Содержащие аминогруппу производные лептомицина данного изобретения могут быть соединены с антителами и другими связывающими с клеткой средствами через нестойкий к кислоте линкер, как описано ранее W.A. Blatter et al., Biochemistry 24, 1517-1524 (1985); патенты США 4542225; 4569789; 4618492; 4764368. Подобным же образом содержащее гидразидную группу производное лептомицина данного изобретения может быть соединением с углеводной частью антител и других связывающих с клеткой средств через нестойкий к кислоте гидразоновый линкер в отношении примеров гидразоновых линкеров см.(1990). Нестойкие к свету линкеры. Содержащие аминогруппу производные лептомицина данного изобретения могут быть соединены с антителами и другими связывающими с клеткой средствами через нестойкий к свету линкер, как описано ранее P. Senter et al., Photochemistry and Photobiology, 42, 231-237 (1985); патент США 4625014. Нестойкие к пептидазе линкеры. Содержащие аминогруппу производные лептомицина данного изобретения могут быть соединены с антителами и другими связывающими с клеткой средствами через пептидные разделительные группы. Ранее показано, что короткие пептидные разделительные группы между лекарственными средствами и макромолекулярными белковыми носителями стабильны в сыворотке, но легко гидролизуются внутриклеточными пептидазами A. Trouet et al., Proc. Natl. Acad. Sci., 79, 626-629 (1982). Содержащие аминогруппу производные лептомицина данного изобретения можно конденсировать с пептидами, используя конденсирующие средства, такие как 1-этил-3-(3-диметиламинопропил)карбодиимид-HCl (EDC-HCl) с получением пептидного производного, которое может быть соединено со связывающим с клеткой средством. Нестойкие к эстеразе линкеры. Производные лептомицина данного изобретения, несущие гидроксиалкильную группу, могут быть сукцинилированы янтарным ангидридом, а затем соединены со связывающим с клеткой средством с получением конъюгата, который может быть расщеплен внутриклеточными эстеразами с освобождением свободного лекарственного вещества в отношении примеров см.: Е. Aboud-Pirak et al., Biochem. Pharmacol., 38, 641-648 (1989). Конъюгаты антител, фрагменты антител, белковых или пептидных гормонов, белковых или пептидных факторов роста и других белков получают таким же образом по известным методикам. Например, пептиды и антитела могут быть модифицированы с помощью сшивающих реагентов, таких как Nсукцинимидил-3-(2-пиридилдитио)пропионат, N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP), 4 сукцинимидилоксикарбонилметил(2-пиридилдитио)толуолet al., 18, Biochem., 690 (1979), Blakey and Thorpe, 1 Antibody, ImmunoconjugatesRadio-pharmaceuticals,1-16 (1988), Worrell et al. 1 Anti-Cancer Drug Design 179-184 (1986). Свободное или защищенное содержащее тиол связывающее с клеткой вещество, полученное таким образом, затем приводят во взаимодействие с содержащим дисульфидную или тиоловую группу производным лептомицина с получением конъюгатов. Конъюгаты, полученные указанными выше способами, могут быть очищены стандартной колоночной хроматографией или ВЭЖХ. Предпочтительными конъюгатами между моноклональными антителами или связывающимися с клеткой средствами и производными лептомицина данного изобретения являются те, которые соединены через дисульфидную связь или тиоэфирную связь, как обсуждено выше. Такие связывающиеся с клеткой конъюгаты получают известными методами, такими как модификация моноклональных антител сукцинимидилпиридилдитиопропионатом (SPDP) Carlsson et al., 173, Biochem. J., 723-737 (1978). Получаемую тиопиридильную группу затем перемещают путем обработки содержащим тиол производным лептомицина с получением конъюгатов, связанных через дисульфид. Конъюгаты, содержащие от 1 до 10 производных лептомицина, присоединенных через дисульфидный мостик, легко получить этим способом. Конъюгация по этому способу полностью описана в патенте США 5585499, который включен в виде ссылки. Цитотоксичность in vitro конъюгатов между связывающимися с клеткой средствами и производными лептомицина данного изобретения. Цитотоксичность производных лептомицина данного изобретения и их конъюгатов со связывающимися с клеткой средствами можно оценить после отщепления защитной группы и превращения в ак-9 017345 тивное лекарственное вещество. Цитотоксичность в отношении не связывающихся линий клеток, таких как Namalwa и HL60, может быть оценена путем обратной экстраполяции по кривым пролиферации клеток, как описано у Goldmacher et al., 135, J. Immunol., 3648-3651 (1985). Цитотоксичность этих соединений в отношении связывающих линий клеток, таких как А-375 и SCaBER, можно определить с помощью клоногенных исследований, как описано у Goldmacher et al., 102 J. Cell Biol. 1312-1319 (1986). Терапевтическое средство и способ подавления роста избранных клеточных популяций. Данное изобретение представляет также терапевтическое средство для подавления роста избранных клеточных популяций, содержащее:(a) цитотоксическое количество одного или более из описанных выше производных лептомицина,соединенных со связывающимся с клеткой средством, и(b) фармацевтически приемлемый носитель, разбавитель или эксципиент. Подобным же образом данное изобретение представляет способ подавления роста избранных популяций клеток, включающий контактирование клеточной популяции или ткани, в которой предполагается содержание клеток из указанной клеточной популяции с цитотоксическим количеством цитотоксического средства, содержащего один или более из описанных выше производных лептомицина, соединенных со связывающимся с клеткой средством. Цитотоксическое средство получают, как описано выше. Подходящие фармацевтически приемлемые носители, разбавители и эксципиенты хорошо известны и могут быть установлены специалистами в данной области, как того требуют клинические обстоятельства. Примеры подходящих носителей, разбавителей и/или эксципиентов включают:(1) фосфатно-буферный физиологический раствор Dulbecco, pH примерно 7,4, содержащий примерно от 1 до 25 мг/мл человеческого сывороточного альбумина,(2) 0,9% физиологический раствор (0,9% в/о NaCl) и(3) 5% (в/о) раствор декстрозы. Способ подавления роста избранных клеточных популяций может быть практически осуществленin vitro, in vivo или ex vivo. Примеры использования in vitro включают обработку клеточных культур, чтобы уничтожить все клетки за исключением желаемых вариантов, которые не экспрессируют антиген-мишень; или чтобы уничтожить варианты, которые экспрессируют нежелательный антиген. Условия неклинического использования in vitro легко определят специалисты в данной области. Примеры использования ex vivo включают обработку аутологичного костного мозга перед их трансплантацией тому же самому пациенту, чтобы уничтожить больные или злокачественные клетки: обработка костного мозга перед его трансплантацией, чтобы уничтожить компетентные Т-клетки и предотвратить реакцию трансплантат против хозяина (GVHD). Клиническую обработку ex vivo для удаления опухолевых клеток или лимфоидных клеток из костного мозга перед аутологичной трансплантацией при лечении рака или при лечении аутоиммунного заболевания, или для удаления Т-клеток и других лимфоидных клеток из аллогенного костного мозга или ткани перед трансплантацией, чтобы предотвратить GVHD, можно осуществлять следующим образом. Костный мозг берут у пациента или другого лица и затем инкубируют в среде, содержащей сыворотку, в которую добавляют цитотоксическое средство данного изобретения, концентрации в интервале от примерно 10 мкМ до 1 пМ, в течение от примерно 30 мин до примерно 48 ч при примерно 37 С. Точные условия концентрации и времени инкубации (=доза) легко определит специалист в данной области. После инкубации клетки костного мозга промывают средой, содержащей сыворотку, и возвращают пациенту путем внутривенного вливания известными методами. При обстоятельствах, когда пациент получает другое лечение, такое как курс разрушающей химиотерапии или общего облучения организма между временем забора костного мозга и обратного вливания обработанных клеток, обработанные клетки костного мозга хранят замороженными в жидком азоте с использованием стандартного медицинского оборудования. Для клинического использования in vivo цитотоксическое средство данного изобретения будет применяться в виде растворов, которые испытывают на стерильность и уровни эндотоксина, или в виде лиофилизированного твердого препарата, который может быть снова растворен в стерильной воде для инъекции. Примеры соответствующих методик введения конъюгата представлены следующим. Конъюгаты дают еженедельно в течение 6 недель в виде быстрого в/в введения. Нагрузочные дозы дают в 50400 мл нормального физиологического раствора, к которому может быть добавлен человеческий сывороточный альбумин (например, 0,5-1 мл концентрированного раствора человеческого сывороточного альбумина, 100 мг/мл). Дозировки будут составлять примерно от 50 мкг до 10 мг/кг веса тела в неделю, в/в(в интервале от 10 мкг до 100 мг/кг на инъекцию). Через шесть недель после лечения пациент может получить второй курс терапии. Конкретные клинические режимы и методики в отношении пути введения,эксципиентов, разбавителей, дозировок, сроков и т.д. могут быть определены специалистом в данной области, как того требует клиническая ситуация. Примеры патологических состояний, которые можно лечить по методам уничтожения избранных- 10017345 клеточных популяций in vivo или ex vivo, включают злокачественное заболевание любого типа, включая,например, рак легкого, молочных желез, толстого кишечника, простаты, почек, поджелудочной железы,яичников и лимфатических органов; меланом; аутоиммунных заболеваний, таких как системная красная волчанка, ревматоидный артрит и рассеянный склероз; отторжение трансплантата, такое как отторжение пересаженной почки, отторжение трансплантата печени, отторжение трансплантата легкого, отторжение трансплантата сердца и отторжение трасплантата костного мозга; реакцию трансплантат против хозяина; вирусные инфекции, такие как ЦМВ (цитомегаловирусная инфекция), инфицирование ВИЧ, СПИД и т.д.; бактериальную инфекцию; и паразитарные инфекции, такие как лямблиоз, амебиаз, шистосомиаз и другие, что определяется специалистом в данной области. Примеры Данное изобретение теперь будет проиллюстрировано путем обращения к неограничивающим примерам. Если не указано иначе, все проценты, соотношения, части и т.д. даны по весу. Материалы и методы. Температуру плавления определяли, применяя электротермический прибор, и не корректировали. Спектры ЯМР регистрировали на спектрометре Bruker AVANCE400 (400 МГц). Химические сдвиги представлены в м.д. по отношению к ТМС в качестве внутреннего стандарта. Масс-спектры получали,используя систему Bruker Esquire 3000. Ультрафиолетовые спектры регистрировали на спектрофотометре Hitachi U1200. ВЭЖХ выполняли, используя систему Beckman Coulter GOLD 125, оборудованную системой детектора вариабельной длины волны Backman Coulter GOLD 168 и Waters RADIALPAK (колонка С-18 с обращенной фазой). Тонкослойную хроматографию выполняли на пластинках силикагеля для ТСХ Analtech GF. Силикагель для колоночной флэш-хроматографии получен от Baker. Тетрагидрофуран сушили отгонкой над металлическим натрием. Диметилактамид и диметилформамид сушили дистилляцией над гидридом кальция под пониженным давлением. Все использованные растворители были марки для реактивов или марки для ВЭЖХ. Линии раковых клеток человека HL60, Namalwa, A-375, COLO205 и Ramos получены из Американской коллекции типовых культур (АТСС). Kara представляет собой линию клеток мышиной опухоли,которая была стабильно трансфицирована человеческим CD33 антигеном. Экспериментальная часть. Масс-спектрометрический анализ проводили следующим образом. В раствор 20 мг (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3 метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты и 5,6 мг 1 гидроксибензотриазола в 0,3 мл дихлорметана вводят при температуре примерно 20 С 7,65 мкл ДИК(N,N'-диизопропилкарбодиимид), затем 5,2 мг 2-(тиометил)этиламина. Реакционную смесь перемешивают при температуре около 20 С в течение 20,5 ч, затем очищают прямым нанесением на 2 пластины для препаративной ТСХ на силикагеле (толщина 0,5 мм, 2020 см). Пластины для препаративной ТСХ элюируют смесью метанола/дихлорметана (5/95 по объему), затем желаемый продукт экстрагируют с силикагеля смесью метанола/дихлорметана (15/85 по объему). Получают 1,4 мг (2-метилсульфанилэтил)амида(2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3-метил-6-оксо-3,6 дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты в виде желтого твердого вещества, характеристики которого являются следующими. Масс-спектр:m/z=600 [М+Н]+. 1 Н ЯМР спектры при 600 МГц получили на спектрометре Bruker Avance DMX-600 со следующими химическими сдвигами ( в м.д.) - в хлороформе в качестве растворителя - d1(CDCl3-d1) эталон на 7,27 К раствору 20 мг (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3 метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты и 5,6 мг 1 гидроксибензотриазола в 0,3 мл дихлорметана вводят при температуре примерно 20 С 12,8 мг дихлоргидрата цистамина, 7,65 мкл N,N'-диизопропилкарбодиимида, затем 11,6 мкл триэтиламина. Реакционную смесь перемешивают при температуре около 20 С в течение 22 ч, затем очищают прямым нанесением на 2 пластины для препаративной ТСХ на силикагеле (толщина 0,5 мм, 2020 см). Пластины для препаративной ТСХ элюируют смесью метанола/дихлорметана (5/95 по объему), затем желаемый продукт экстрагируют с силикагеля смесью метанола/дихлорметана (15/85 по объему). Получают 4,6 мг бис-[(2 тиоэтил)амида (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3-метил-6 оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты] в виде белого чистого твердого вещества, характеристики которого являются следующими. Масс-спектр: К раствору 20 мг (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3 метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты и 8 мкл триэтиламина в 0,15 мл дихлорметана вводят при температуре около 0 С 6,1 мкл пивалоилхлорида. Через 15 мин при температуре около 0 С добавляют раствор 4,4 мг 2-аминоэтантиола в 0,15 мл дихлорметана и 0,05 мл этанола. Реакционную смесь перемешивают при температуре около 20 С в течение 1 ч,затем очищают прямым нанесением на 2 пластины для препаративной ТСХ на силикагеле (толщина 0,5 мм, 2020 см). Пластины для препаративной ТСХ элюируют смесью метанола/дихлорметана (8/92 по объему), затем желаемый продукт экстрагируют с силикагеля смесью метанола/дихлорметана (15/85 по объему). Получают 2,3 мг (2-меркаптоэтил)амида (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17 гептаметил-19-2S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18 пентаеновой кислоты в виде бесцветного стекловидного вещества, характеристики которого являются следующими. Масс-спектр:H ЯМР спектры при 400 МГц получили на спектрометре Bruker Avance DRX-400 со следующими химическими сдвигами ( в м.д.) - в хлороформе в качестве растворителя - d1(CDCl3-d1) эталон на 7,27 при температуре 303 К: 0,80 (д, J=6,5 Гц, 3 Н); 0,98 (д, J=6,5 Гц, 3 Н); 1,08 (д, J=7,5 Гц, 3 Н); 1,14 (д, J=6,5 Гц, 3 Н); 1,16 (д, J=7,0 Гц, 3 Н); 1,72 (м, 1 Н); от 1,80 до 1,87 (м замаскированный, 1 Н); 1,82 (с, 3 Н); 1,84 (с,3 Н); 2,09 (м, 2 Н); 2,11 (с, 3 Н); 2,16 (дд, J=6,5 и 13,5 Гц, 1 Н); 2,54 (м, 1 Н); от 2,65 до 2,74 (м, 3 Н); 2,83 (м,1 Н); 3,48 (кв, J=6,5 Гц, 2 Н); от 3,60 до 3,70 (м, 2 Н); 5,00 (дд, J=4,0 и 7,0 Гц, 1 Н); 5,10 (д, J=10,5 Гц, 1 Н); 5,27 (д, J=10,5 Гц, 1 Н); 5,58 (с, 1 Н); 5,60 (тд частично замаскированный, J=7,5 и 15,5 Гц, 1 Н); 5,70 (дд,J=7,0 и 15,5 Гц, 1 Н); от 5,96 до 6,06 (м, 3 Н); 6,75 (д ушир., J=15,5 Гц, 1 Н); 6,97 (дд, J=6,0 и 10,0 Гц, 1 Н). К раствору 20 мг (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3 метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты и 5,6 мг 1 гидроксибензотриазола в 0,15 мл дихлорметана вводят при температуре около 20 С 7,65 мкл N,N'диизопропилкарбодиимида, затем раствор 8 мг 2-метилдитиоэтиламина в 0,15 мл дихлорметана. Реакционную смесь перемешивают при температуре около 20 С в течение 2 ч, затем очищают прямым нанесением на 2 пластины для препаративной ТСХ на силикагеле (толщина 0,5 мм, 2020 см). Пластины для препаративной ТСХ элюируют смесью метанола/дихлорметана (7/93 по объему), затем желаемый продукт экстрагируют с силикагеля смесью метанола/дихлорметана (15/85 по объему). Получают 3,4 мг (2 метилдисульфанилэтил)амида(2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-192S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты в виде бледно-желтого масла, характеристики которого являются следующими. Масс-спектр:m/z=676 [М-Н+НСООН]-. 1 Н ЯМР спектры при 400 МГц получили на спектрометре Bruker Avance DRX-400 со следующими химическими сдвигами ( в м.д.) - в хлороформе в качестве растворителя - d1(CDCl3-d1) эталон на 7,27 при температуре 303 К: 0,81 (д, J=6,5 Гц, 3 Н); 0,98 (д, J=6,5 Гц, 3 Н); 1,08 (д, J=7,5 Гц, 3 Н); 1,14 (д, J=6,5 Гц, 3 Н); 1,16 (д, J=7,0 Гц, 3 Н); 1,72 (м, 1 Н); от 1,79 до 1,86 (м, 1 Н); 1,82 (с, 3 Н); 1,84 (с, 3 Н); 2,09 (м, 2 Н); 2,11 (с ушир., 3 Н); 2,15 (дд, J=5,5 и 13,5 Гц, 1 Н); 2,35 (с ушир., 1 Н); 2,43 (м, 3 Н); 2,54 (м, 1 Н); 2,70 (м,1 Н); 2,83 (м, 1 Н); 2,86 (т, J=6,5 Гц, 2 Н); от 3,59 до 3,70 (м, 4 Н); 5,01 (дд, J=4,0 и 7,0 Гц, 1 Н); 5,11 (д,J=10,0 Гц, 1 Н); 5,27 (д, J=10,0 Гц, 1 Н); 5,56 (с, 1 Н); 5,60 (тд частично замаскированный, J=7,5 и 15,5 Гц,1 Н); 5,70 (дд, J=7,0 и 15,5 Гц, 1 Н); 5,93 (т, J=6,0 Гц, 1 Н); 6,00 (д, J=10,0 Гц, 1 Н); 6,02 (д, J=15,5 Гц, 1 Н); 6,75 (д, J=15,5 Гц, 1 Н); 6,96 (дд, J=6,0 и 10,0 Гц, 1 Н). Пример 5. К раствору 225,4 мг (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3 метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты в 1,5 мл дихлорметана вводят при температуре около 0 С раствор 63,6 мг 1-гидроксибензотриазола и 110 мг 2 метил-2-метилдисульфанилпропиламина в 1,5 мл дихлорметана, затем 86,2 мкл N,N'диизопропилкарбодиимида. Реакционную смесь перемешивают при температуре около 0 С в течение 15 ч, затем разбавляют 30 мл дихлорметана. Органическую фазу промывают дважды 10 мл воды, сушат над сульфатом натрия, фильтруют через стеклянный фильтр, затем концентрируют под пониженным давлением при температуре около 40 С. Полученный таким образом остаток очищают колоночной хроматографией на силикагеле (20 г SiO2 15-35 мкм, элюирование градиентом метанол/дихлорметан от 0/100 до 10/90 (по объему. Фракции, содержащие желаемый продукт, концентрируют под пониженным давлением при температуре около 40 С. Получают 212,1 мг (2-метил-2-метилдисульфанилпропил)амида(2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,6,7,9,11,15,17-гептаметил-19-2S,3S)-3-метил-6-оксо-3,6 дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты в виде желтого стекловидного вещества, характеристики которого являются следующими. Масс-спектр:m/z=704: [М-Н+НСООН]-. 1 Н ЯМР спектры при 400 МГц получили на спектрометре Bruker Avance DRX-400 со следующими химическими сдвигами ( в м.д.) - в хлороформе в качестве растворителя - d1(CDCl3-d1) эталон на 7,27 К раствору 200 мг (2-метил-2-метилдисульфанилпропил)амида (2E,10E,12E,16Z,18E)-(R)-6 гидрокси-3,5,7,9,11,15,17-гептаметил-19-2S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8 оксононадека-2,10,12,16,18-пентаеновой кислоты в 7,7 мл тетрагидрофурана и 3,85 мл воды при температуре около 20 С добавляют 217,2 мг хлоргидрата трис-(2-карбоксиэтил)фосфина. Через 16 ч при температуре около 20 С реакционную смесь разбавляют 30 мл этилацетата, промывают дважды 15 мл воды,15 мл насыщенного раствора соли, сушат над сульфатом магния, фильтруют через стеклянный фильтр и концентрируют под пониженным давлением при температуре около 40 С. Полученное таким образом желтое масло очищают колоночной хроматографией на силикагеле (25 г SiO2 15-35 мкм, элюирование градиентом метанола/дихлорметана от 1/99 до 10/90 (по объему. Фракции, содержащие желаемый продукт, концентрируют под пониженным давлением при температуре около 40 С. Получают 122,6 мг (2 меркапто-2-метилпропил)амида(2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-192S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты в виде желтого стекловидного вещества, характеристики которого являются следующими. Масс-спектр:m/z=658 [М-Н+НСООН]-. 1 Н ЯМР спектры при 500 МГц получили на спектрометре Bruker Avance DMX-500 со следующими химическими сдвигами ( в м.д.) - в хлороформе в качестве растворителя - d1(CDCl3-d1) эталон на 7,27 при температуре 303 К: 0,80 (д, J=6,5 Гц, 3 Н); 0,97 (д, J=6,5 Гц, 3 Н); 1,07 (д, J=7,5 Гц, 3 Н); 1,13 (д, J=6,5 Гц, 3 Н); 1,16 (д, J=6,5 Гц, 3 Н); 1,38 (с, 6 Н); 1,72 (м, 1 Н); 1,82 (с, 3 Н); 1,84 (с, 3 Н); 1,85 (м частично замаскированный, 1 Н); 2,09 (м, 2 Н); 2,11 (с, 3 Н); 2,17 (дд, J=6,5 и 13,5 Гц, 1 Н); 2,54 (м, 1 Н); 2,70 (м, 1 Н); 2,83(м, 1 Н); 3,38 (д, J=6,5 Гц, 2 Н); от 3,61 до 3,70 (м, 2 Н); 5,01 (дд, J=4,0 и 7,0 Гц, 1 Н); 5,09 (д, J=10,0 Гц, 1 Н); 5,26 (д, J=10,0 Гц, 1 Н); 5,59 (дт частично замаскированный, J=7,5 и 15,5 Гц, 1 Н); 5,63 (с, 1 Н); 5,69 (дд,J=7,0 и 15,5 Гц, 1 Н); 6,00 (д, J=10,0 Гц, 1 Н); 6,02 (д, J=15,5 Гц, 1 Н); 6,04 (т частично замаскированный,J=6,5 Гц, 1 Н); 6,75 (д, J=15,5 Гц, 1 Н); 6,97 (дд, J=6,0 и 10,0 Гц, 1 Н). Конъюгация антител с производными лептомицина Конъюгация антител huC242 к раку толстого кишечника с производными лептомицина Получали связанные дисульфидом конъюгаты гуманизированных антител (huC242) к опухоли толстого кишечника с соединением из примера 6 (называемые здесь huC242-SSNPB-лептомицин из примера 6). Антитела huC242 приводили во взаимодействие с 6-кратным молярным избытком модифицирующего антитела средства SSNPB (N-сульфосукцинимидил-4-(5-нитро-2-пиридилтио)бутаноат) при концентрации антител, равной 9 мг/мл, в 50 мМ калий-фосфатном буфере (рН 6,5, содержащий 50 мМ NaCl, 2 мМ ЭДТА, 5% диметилацетамида) в течение 90 мин при комнатной температуре. Реакционную смесь очищают с помощью гель-хроматографии на Sephadex G-25 с уравновешиванием в 50 мМ калий-фосфатном буфере рН 6,5, содержащем 50 мМ NaCl и 2 мМ ЭДТА. Образец модифицированных антител анализировали с добавлением -меркаптоэтанола или без него и определили, что они имеют 6 нитропиридилдитиогрупп, включенных в антитело. К образцу модифицированных антител при концентрации 2 мг/мл в 50 мМ калий-фосфатном буфере (рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА, 10% диметилацетамида) добавляли 2-кратный молярный избыток лекарственного вещества лептомицин-SH на соединяющую группу. Реакцию отслеживали спектрофотометрически (394 нм) и с помощью ВЭЖХ в отношении 5- 14017345 нитропиридин-2-тиона. После взаимодействия при комнатной температуре в течение примерно 90 мин смесь очищали гель-хроматографией на Sephadex G-25 в 50 мМ фосфатном буфере (рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА). Отношение поглощения при 250 нм/280 нм, равное 0,78, для конъюгата по сравнению с 0,37 для немодифицированных антител показывало включение группы лептомицина в конъюгат (приводящее к повышенному поглощению при 250 нм). Масс-спектрометрический анализ дегликозилированного конъюгата пиС 242-лептомицина показал пики конъюгата при 147492, 148212, 148936 и 149660 Да, соответствующие 1, 2, 3 и 4 включенным молекулам лептомицина на молекулу антитела. Конъюгирование анти-CD19 (huB4) антител с производными лептомицина. Конъюгаты анти-CD19 антител (гуманизированных В 4 антител) с лептомицином получали с помощью дисульфидных и нерасщепляемых тиоэфирных линкеров. Первый образец (-S-S- линкер) состоял из анти-CD19 (huB4) антител, связанных с соединением из примера 6 через дисульфидный линкер (SSNPB;N-сульфосукцинимидил-4-(5-нитро-2-пиридилдитио)бутаноат). Второй образец состоял из huB4 антитела, связанного с соединением из примера 6 через малеимидный линкер (SMCC; N-сукцинимидил-4(мелеимидометил)циклогексанкарбоксилат). Конъюгат HuB4-SSNPB-лептомицин (HuB4-SSNPB-лептомицин из примера 6) 4 мг антител huB4 приводили во взаимодействие с 7,5-кратным молярным избытком линкераSSNPB при концентрации антител, равной 8 мг/мл в 50 мМ калий-фосфатном буфере (рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА, 5% диметилацетамида) в течение 90 мин при комнатной температуре. Реакционную смесь очищали гель-хроматографией на Sephadex G-25 в 50 мМ калий-фосфатном буфере(рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА). Образец модифицированных антител анализировали с добавлением -меркаптоэтанола или без него и определили, что они имеют 5,3 нитропиридилдитиогруппы, включенных в антитело. К образцу модифицированных антител при концентрации 1 мг/мл в 50 мМ калий-фосфатном буфере (рН 6,5, содержащем 50 мМ NaCll, 2 мМ ЭДТА, 10% диметилацетамида) добавляли 3-кратный молярный избыток лекарственного вещества из примера 6 на соединяющую группу. Реакцию отслеживали спектрофотометрически (394 нм) и с помощью ВЭЖХ в отношении выделения 5-нитропиридин-2-тиона. После взаимодействия при комнатной температуре в течение ночи смесь очищали гельхроматографией на Sephadex G-25 в 10 мМ цитратного буфера (рН 5,5, содержащем 135 мМ NaCl). Образец анализировали с добавлением -меркаптоэтанола или без него и определили, что имеется 4,3 прореагировавших линкера на антитело. Анализ гель-хроматографией (ГХ) показал 95% мономерных антител. Конъюгат HuB4-SMCC-лептомицин 4 мг антител huB4 приводили во взаимодействие с 7,5-кратным молярным избытком линкера СМЦК при концентрации антител, равной 8 мг/мл в 50 мМ калий-фосфатном буфере (рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА, 5% диметилацетамида) в течение 90 мин при комнатной температуре. Реакционную смесь очищали гель-хроматографией на Sephadex G-25 в 50 мМ калий-фосфатном буфере(рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА). Число малеимидных групп, включаемых в образец, устанавливали путем добавления избытка тиола (цистеина) и определили, что имеется 3,3 линкерных группы на антитело. К образцу модифицированных антител при концентрации 1 мг/мл в 50 мМ калийфосфатном буфере (рН 6,5, содержащем 50 мМ NaCl, 2 мМ ЭДТА, 10% диметилацетамида) добавляли 3 кратный молярный избыток лекарственного вещества из примера 6 на малеимидную группу. После взаимодействия при комнатной температуре в течение ночи смесь очищали гель-хроматографией (ГХ) наSephadex G-25 в 10 мМ цитратном буфере (рН 5,5, содержащем 135 мМ NaCl). ГХ анализ показал 98% мономерных антител. Масс-спектрометрический анализ дегликозилированных конъюгатов HuB4-SMCC-лептомицина показал пики конъюгата при 145138, 145860 и 146566 Да, соответствующих 1, 2 и 3 включенным молекулам лептомицина на молекулу антитела.- 15017345 Биологические результаты. Оценка цитотоксичности HuB4-SSNPB-лептомицина, конъюгата из примера 6, на раковых клеткахWST показала значения IC50, равные 1,410-9 M и 4,210-9 M соответственно, демонстрируя таким образом антигеноспецифическую цитотоксическую активность конъюгата лептомицин-антитело. Оценка цитотоксичности HuB4-SSNPB-лептомицина, конъюгата из примера 6, на раковых клеткахCOLO 205 (положительных на антиген CanAg) и клетках А 375 показала значения IC50, равное 1,310-10 M и 5,010-9 M соответственно (фиг. 1). В данном описании сделаны ссылки на некоторые патенты и печатные публикации, идеи и указания которых, тем самым, включены путем ссылки во всей их соответствующей полноте. Хотя данное изобретение было описано в деталях и со ссылками на его конкретные воплощения,специалисту в данной области будет очевидно, что в нем могут быть произведены различные изменения и модификации без выхода из его сущности и объема. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное лептомицина формулы (I) где Ra и R'a представляют собой Н или линейный или разветвленный С 1-С 20-алкил;R17 представляет собой линейный или разветвленный C1-C20-алкил;R9 представляет собой линейный или разветвленный C1-C20-алкил;Y представляет собой линейный или разветвленный С 1-С 20-алкил; Т представляет собой Н, R1 или SR1, где R1 представляет собой Н или линейный или разветвленный С 1-С 20-алкил; или фармацевтически приемлемые соли указанного производного лептомицина или их рацематы, диастереомеры или энантиомеры. 2. Производное лептомицина по п.1, в котором Ra является линейным или разветвленным C1-C20 алкилом и R'a является Н. 3. Производное лептомицина по пп.1, 2, в котором Т представляет собой Н или SR1, где R1 является линейным или разветвленным C1-C20-алкилом. 4. Производное лептомицина, выбранное из группы, содержащей:(2-меркапто-2-метилпропил)амид (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил 19-2S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты или их фармацевтически приемлемые соли или их рацематы, диастереомеры или энантиомеры. 5. Фармацевтическая композиция, предназначенная для ингибирования роста избранных популяций клеток, содержащая производное лептомицина по пп.1-4 и фармацевтически приемлемый носитель. 6. Применение производного лептомицина по пп.1-4 для получения лекарственного средства для лечения рака. 7. Способ получения соединения по пп.1-4, включающий стадию взаимодействия соответствующих соединений формул (II) и (III): где Ra, Ra', R17, R9, Y, T, n определены в пп.1-4. 8. Способ получения соединения по любому из пп.1-4, где в формуле (I) T является Н, включающий восстановление соответствующего соединения формулы (I)Ra, Ra', R17, R9, X, Y, R1 определены в п.1,в присутствии средства, восстанавливающего дисульфидные связи. 9. Способ получения конъюгата, включающий стадию взаимодействия производного лептомицина по любому из пп.1-4 с модифицированным связывающимся с клеткой средством, содержащим функциональную группу, реакционноспособную в отношении соединяющей группы производного лептомицина,так что данное производное и связывающееся с клеткой средство соединены друг с другом через линкер,где модифицированное связывающееся с клеткой средство выбрано из группы, состоящей из пептидов,не пептидов, антител, моноклональных антител, фрагментов антител, которые содержат по меньшей мере один связывающий сайт, лимфокинов, гормонов, факторов роста и молекул, транспорта питательных веществ. 10. Способ по п.9, при котором указанное связывающееся с клеткой средство, содержащее функциональную группу, реакционноспособную в отношении указанной соединяющей группы производного лептомицина, получают путем взаимодействия указанного связывающегося с клеткой средства с реагентом, выбранным из N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилата (SMCC), Nсульфосукцинимидил-4-(5-нитро-2-пиридилдитио)бутаноата(SBA) и N-сукцинимидил-3-(бромацетамидо)пропионата (SBAP). 11. Способ по п.9, где конъюгат представляет собой конъюгат с тиоэфирным линкером и способ включает стадию взаимодействия тиолсодержащего производного лептомицина по любому из пп.1-4 с антителом или связывающимся с клеткой средством, модифицированным N-сульфосукцинимидил-4-(5 нитро-2-пиридилдитио)бутаноатом, N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилатом, Nсукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбокси-(6-амидокапроатом), N-сукцинимидил-4(йодацетил)аминобензоатом, N-сукцинимидилйодацетатом, N-сукцинимидилбромацетатом или Nсукцинимидил-3-(бромацетамидо)пропионатом. 12. Способ по п.9, включающий стадию взаимодействия дисульфид- или тиолсодержащего производного лептомицина по любому из пп.1-4 с пептидом или антителом, модифицированным реагентом,выбранным из N-сукцинимидил-4-(2-пиридилдитио)пентаноата, 4-сукцинимидилоксикарбонилметил-(2-пиридилдитио)толуола, N-сукцинимидил-3-(2-пиридилдитио)бутирата, сукцинимидилпиридилдитиопропионата, сложного эфира N-гидросукцинимида 4-(2-пиридилдитио)бутановой кислоты, сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилата,N-сульфосукцинимидил-3-(2-(5 нитропиридилтиобутират, 2-иминотиолана или S-ацетилянтарного ангидрида. 13. Терапевтическое средство для лечения патологических состояний посредством подавления роста избранных клеточных популяций, содержащее:(a) конъюгат, полученный по любому из пп.9-12, и(b) фармацевтически приемлемый носитель, разбавитель или эксципиент. 14. Терапевтическое средство по п.13, где патологическое состояние является злокачественным заболеванием. 15. Терапевтическое средство по п.13, где патологическое заболевание является раком легкого, молочных желез, толстого кишечника, простаты, почек, поджелудочной железы, яичников и лимфатических органов или меланомы.
МПК / Метки
МПК: A61P 35/00, A61K 47/48
Метки: производные, лептомицина
Код ссылки
<a href="https://eas.patents.su/19-17345-proizvodnye-leptomicina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные лептомицина</a>
Предыдущий патент: Способ повышения адаптивности организма к физическим нагрузкам
Следующий патент: Фармацевтическая композиция для контрацепции
Случайный патент: Промежуточные соединения для получения ациклических нуклеозидов












