Алифатические аминокарбоновые и аминосульфоновые кислоты, аминонитрилы и аминотетразолы как агенты сохранения клеток
Номер патента: 3677
Опубликовано: 28.08.2003
Авторы: Дэвис Брюс А., Баултон Алан А., Патерсон Элик И., Лиу Я-Донг, Дерден Дэвид А., Дайк Лилиан Э.
Формула / Реферат
1. Соединение формулы I
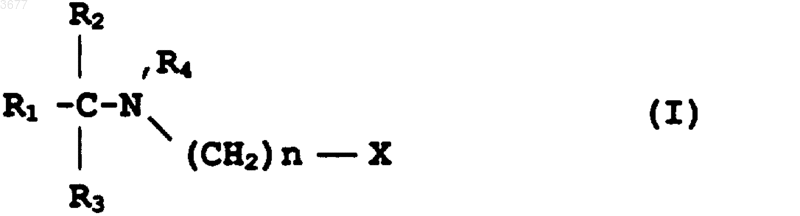
в которой R1 представляет собой (CH2)mCH3, где m равно 0 или целому числу от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода; причем R1 может быть необязательно замещен одним или несколькими заместителями, выбранными из гидроксила, альдегида, оксо, низшего ацилокси, галогена, тио, сульфоксида, сульфона,
R2=H, CH3 или CH2CH3,
R3=H или CH3, причем все заместители R1, R2 и R3 имеют различные значения,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH), карбалкокси (COOR5), циано (Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол, в виде практически чистого энантиомера R- или S-конфигурации при атоме углерода, к которому присоединены заместители R1, R2 и R3,
или его фармацевтически приемлемая соль.
2. Соединение формулы I по п.1, отличающееся тем, что
R1=(CH2)mCH3, где m равно 0 или целому числу от 1 до 16,
R2=CH3, причем заместители R1 и R2 имеют различные значения,
R3=H,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH) или карбалкокси (COOR5), циано(Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
или его фармацевтически приемлемая соль.
3. Соединение формулы I по п.1, отличающееся тем, что
R1=(CH2)mCH3, где m равно 0 или целому числу от 1 до 16,
R2=CH3,
причем заместители R1 и R2 имеют различные значения,
R3=H,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH) или карбалкокси (COOR5), циано (Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
в виде практически чистого энантиомера R-конфигурации или его фармацевтически приемлемая соль.
4. Соединение формулы I по п.1, отличающееся тем, что
R1=(CH2)mCH3, где m равно 0 или целому числу от 1 до 16,
R2=CH3, причем заместители R1 и R2 имеют различные значения,
R3=H,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH) или карбалкокси (COOR5), циано(Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
в виде практически чистого энантиомера S-конфигурации или его фармацевтически приемлемая соль.
5. Соединение по п.3, отличающееся тем, что указанное соединение формулы I выбирают из группы, состоящей из
(R)-3-(2-гептиламино)пропионовой кислоты;
(R)-3-(2-гептилметиламино)пропионовой кислоты;
метил (R)-3-(2-гептиламино)пропионата;
метил (R)-3-(2-гептилметиламино)пропионата;
(R)-2-(2-пентиламино)ацетонитрила;
(R)-2-(2-пентилметиламино)ацетонитрила;
(R)-3-(2-гептиламино)пропионитрила;
(R)-3-(2-гептилметиламино)пропионитрила;
(R)-2-(2-пентиламино)этанфосфоновой кислоты;
(R)-2-(2-пентилметиламино)этанфосфоновой кислоты и
(R)-2-(2-гептиламино)этан-5-тетразола.
6. Соединение по п.4, отличающееся тем, что указанное соединение формулы I выбирают из группы, состоящей из
(S)-2-(2-гептиламино)уксусной кислоты;
(S)-2-(2-гептилметиламино)уксусной кислоты;
метил (S)-2-(2-гептиламино)ацетата;
метил (S)-2-(2-гептилметиламино)ацетата;
(S)-2-(2-гептиламино)ацетонитрила;
(S)-2-(2-гептилметиламино)ацетонитрила;
(S)-2-(2-гептиламино)этанфосфоновой кислоты и
(S)-2-(2-гептилметиламино)этанфосфоновой кислоты.
7. Соединение, отличающееся тем, что его выбирают из группы, состоящей из
2-(1-гексилметиламино)уксусной кислоты;
3-(2-пропилметиламино)пропионовой кислоты;
метил 2-(2-пропилметиламино)ацетата;
метил 2-(1-гексилметиламино)ацетата;
метил 3-(1-гексилметиламино)пропионата;
2-(1-гексиламино)ацетонитрила;
2-(1-гексилметиламино)ацетонитрила;
3-(3-пентиламино)пропионитрила;
3-(3-пентилметиламино)пропионитрила;
2-(2-пропиламино)этанфосфоновой кислоты и
2-(2-пропилметиламино)этанфосфоновой кислоты.
8. Соединение по любому из пп.1-7, отличающееся тем, что находится в виде гидрохлоридной соли.
9. Соединение по любому из пп.1-4, отличающееся тем, что m равно целому числу от 1 до 12.
10. Соединение по любому из пп.1-4, отличающееся тем, что m равно целому числу от 1 до 9.
11. Композиция для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза, отличающаяся тем, что включает эффективное количество соединения формулы I
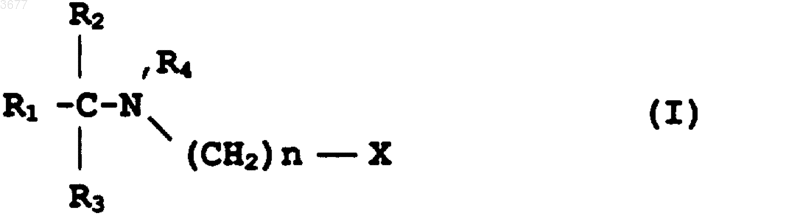
в которой R1 представляет собой (CH2)mCH3, где m равно 0 или целому числу от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода;
причем R1 может быть необязательно замещен одним или несколькими заместителями, выбранными из гидроксила, альдегида, оксо, низшего ацилокси, галогена, тио, сульфоксида, сульфона,
R2=H, CH3 или CH2CH3,
R3=H или CH3, причем все заместители R1, R2 и R3 имеют различные значения,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH), карбалкокси (COOR5), циано (Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
в виде практически чистого энантиомера R- или S-конфигурации при атоме углерода, к которому присоединены заместители R1, R2 и R3, или его фармацевтически приемлемой соли в смеси с подходящим разбавителем или носителем.
12. Композиция по п.11, отличающаяся тем, что включает указанное соединение, в котором
R1 представляет собой (CH2)mCH3, где m равно 0 или целому числу от 1 до 16,
R2=CH3, причем заместители R1 и R2 имеют различные значения,
R3=H,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH) или карбалкокси (COOR5), циано (Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
или его фармацевтически приемлемую соль в смеси с подходящим разбавителем или носителем.
13. Композиция по п.11, отличающаяся тем, что в ней указанное соединение формулы I выбирают из группы, состоящей из
(R)-3-(2-гептиламино)пропионовой кислоты;
(R)-3-(2-гептилметиламино)пропионовой кислоты;
метил (R)-3-(2-гептиламино)пропионата;
метил (R)-3-(2-гептилметиламино)пропионата;
(R)-2-(2-пентиламино)ацетонитрила;
(R)-2-(2-пентилметиламино)ацетонитрила;
(R)-3-(2-гептиламино)пропионитрила;
(R)-3-(2-гептилметиламино)пропионитрила;
(R)-2-(2-пентиламино)этанфосфоновой кислоты;
(R)-2-(2-пентилметиламино)этанфосфоновой кислоты и
(R)-2-(2-гептиламино)этан-5-тетразола.
14. Композиция по п.11, отличающаяся тем, что в ней указанное соединение формулы I выбирают из группы, состоящей из
(S)-2-(2-гептиламино)уксусной кислоты;
(S)-2-(2-гептилметиламино)уксусной кислоты;
метил (S)-2-(2-гептиламино)ацетата;
метил (S)-2-(2-гептилметиламино)ацетата;
(S)-2-(2-гептиламино)ацетонитрила;
(S)-2-(2-гептилметиламино)ацетонитрила;
(S)-2-(2-гептиламино)этанфосфоновой кислоты и
(S)-2- (2-гептилметиламино)этанфосфоновой кислоты.
15. Композиция для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза, отличающаяся тем, что указанная композиция включает эффективное количество соединения, выбранного из группы, состоящей из
2-(1-гексилметиламино)уксусной кислоты;
3-(2-пропилметиламино)пропионовой кислоты;
метил 2-(2-пропилметиламино)ацетата;
метил 2-(1-гексилметиламино)ацетата;
метил 3-(1-гексилметиламино)пропионата;
2-(1-гексиламино)ацетонитрила;
2-(1-гексилметиламино)ацетонитрила;
3-(3-пентиламино)пропионитрила;
3-(3-пентилметиламино)пропионитрила;
2-(2-пропиламино)этанфосфоновой кислоты и
2-(2-пропилметиламино)этанфосфоновой кислоты,
в смеси с подходящим разбавителем или носителем.
16. Композиция по любому из пп.11-15, отличающаяся тем, что указанное соединение формулы I находится в виде гидрохлоридной соли.
17. Применение соединения формулы I
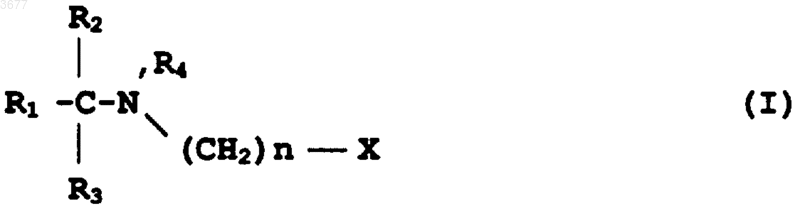
в которой R1 представляет собой (CH2)mCH3, где m равно 0 или целому числу от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода;
причем R1 может быть необязательно замещен одним или несколькими заместителями, выбранными из гидроксила, альдегида, оксо, низшего ацилокси, галогена, тио, сульфоксида, сульфона,
R2=H, CH3 или CH2CH3,
R3=H или CH3,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH), карбалкокси (COOR5), циано (Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
или является его фармацевтически приемлемой солью,
для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза.
18. Применение по п.17, отличающееся тем, что применяют соединение, в котором
R1=(CH2)mCH3, где m равно 0 или целому числу от 1 до 16,
R2=CH3,
R3=H,
R4=H или CH3,
R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,
n равно целому числу от 1 до 3 и
X представляет собой карбоксил (COOH) или карбалкокси (COOR5), циано (Cу N), фосфоновую кислоту (PO3H2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,
или его фармацевтически приемлемую соль.
19. Применение по п.17 или 18, отличающееся тем, что соединение формулы I представляет собой практически чистый энантиомер R-конфигурации.
20. Применение по пп.17 или 18, отличающееся тем, что соединение формулы I представляет собой практически чистый энантиомер S-конфигурации.
21. Применение по п.17, отличающееся тем, что указанное соединение формулы I выбирают из группы, состоящей из
2-(2-пропиламино)уксусной кислоты;
2-(1-гексиламино)уксусной кислоты;
(S)-2-(2-гептиламино)уксусной кислоты;
3-(2-пропиламино)пропионовой кислоты;
3-(1-гексиламино)пропионовой кислоты;
(R)-3-(2-гептиламино)пропионовой кислоты;
2-(2-пропилметиламино)уксусной кислоты;
2-(1-гексилметиламино)уксусной кислоты;
(S)-2-(2-гептилметиламино)уксусной кислоты;
3-(2-пропилметиламино)пропионовой кислоты;
3-(1-гексилметиламино)пропионовой кислоты;
(R)-3-(2-гептилметиламино)пропионовой кислоты;
2-(2-пропиламино)ацетонитрила;
(R)-2-(2-пентиламино)ацетонитрила;
2-(1-гексиламино)ацетонитрила;
(S)-2-(2-гептиламино)ацетонитрила;
(R)-3-(2-гептиламино)пропионитрила;
2-(2-пропилметиламино)ацетонитрила;
(R)-2-(2-пентилметиламино)ацетонитрила;
2-(1-гексилметиламино)ацетонитрила;
(S)-2-(2-гептилметиламино)ацетонитрила;
(R)-3-(2-гептилметиламино)пропионитрила;
2-(2-пропиламино)этанфосфоновой кислоты;
(R)-2-(2-пентиламино)этанфосфоновой кислоты;
(S)-2-(2-гептиламино)этанфосфоновой кислоты;
2-(2-пропилметиламино)этанфосфоновой кислоты;
(S)-2-(2-гептилметиламино)этанфосфоновой кислоты и
(R)-2-(2-гептиламино)этан-5-тетразола.
22. Применение по любому из пп.17-21, отличающееся тем, что заболевание выбирают из группы, которая включает удар, травму головы, паралич Белла, повреждение спинного мозга, болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, амиотрофический латеральный склероз, болезнь Хантингтона, множественный склероз, сердечную миопатию, нефропатию, ретинопатию, осложнения, вызванные диабетом, глаукому и идиопатические невропатии.
23. Применение по любому из пп.17-22 для лечения человека.
24. Коммерческая упаковка лекарства для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза, включающая фармацевтическую композицию по любому из пп.11-16 вместе с инструкциями по применению для лечения или профилактики указанных заболеваний.
Текст
1 Область изобретения Настоящее изобретение касается новых алифатических аминокарбоновых и аминофосфоновых кислот, аминонитрилов и аминотетразолов, их солей, композиций, содержащих такие соединения, и применения таких соединений в качестве агентов сохранения клеток при лечении человека и в ветеринарии. Предпосылки изобретения В настоящее время считают, что нейродегенеративные нарушения (например, хронические заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона(Huntington's disease), болезнь Пика и глаукома,а также острые нарушения, такие как припадок,травма головы, паралич Белла и повреждения спинного мозга), включают процессы апоптоза. Показано, что депренил (deprenyl), алифатические пропаргиламины, их соответствующие дезметиловые аналоги и разагилин (rasagiline) защищают и сохраняют поврежденные нейроны при некоторых моделях дегенерации [1-16]. Полагают, что для защитной и сохранной активности таких лекарственных препаратов необходимо наличие пропаргильной группы. В предыдущих исследованиях изучали N-деметилирование и/или депропаргилирование этих лекарственных препаратов [7, 17]. С некоторых пор известно, что определенные алифатические и ароматические ацетиленовые соединения реагируют с ферментами Р 450. Одна из таких реакций приводит к окислению конечного углерода ацетиленовой функциональной группы с образованием соответствующей кислоты [18-20]. О возможности окисленияN-ацетиленовых групп алифатических пропаргиламинов с образованием метаболитов карбоновых кислот ранее не сообщалось. Потенциальные возможности родственных кислотных соединений (таких как аминофосфоновые кислоты и аминотетразолы) и предшественников таких соединений (аминонитрилы и сложные аминоэфиры) в качестве агентов против апоптоза ранее также не рассматривались. Заявители настоящего изобретения обнаружили, что алифатические аминокарбоновые и аминофосфоновые кислоты, аминонитрилы и аминотетразолы являются агентами против апоптоза и могут быть полезны в качестве агентов сохранения клеток при лечении людей и животных. Краткое содержание изобретения Настоящее изобретение относится к соединению общей формулы (I)m равно 0 или целому числу в диапазоне от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 2 до 17 атомов углерода. R1 может быть незамещенным или замещенным, по меньшей мере,одним заместителем, выбранным из гидроксила,альдегида, оксо, низшего ацилокси, галогена,тио, сульфоксида, сульфона, фенила, галогензамещенного фенила, гидроксизамещенного фенила, циклоалкила, имеющего от 3 до 6 атомов углерода, и гетероциклических заместителей, имеющих от 3 до 6 атомов, среди которых от 1 до 3 являются гетероатомами, выбранными из О, S и/или N,R2=Н, СН 3 или СН 2 СН 3,R3=Н или СН 3,R4=Н или СН 3,R5 представляет собой низший алкил,имеющий от 1 до 5 атомов углерода,n равно целому числу в диапазоне от 1 до 3 и Х представляет собой карбоксил (СООН),карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), сложный фосфонатный эфир (РО 3[R5]2) или 5-тетразол,и его солям, в особенности фармацевтически приемлемым солям. Соединения общей формулы I, в которыхR1, R2 и R3 отличаются друг от друга, являются хиральными. Обнаружено, что R-энантиомеры соединений некоторых этих классов или подклассов (и S-энантиомеры других классов или подклассов) полезны в качестве агентов сохранения клеток для лечения и профилактики заболеваний, при которых происходит гибель клеток вследствие апоптоза, что случается при многих нейродегенеративных нарушениях. Для конкретного класса или подкласса соединений неактивные энантиомеры не предотвращают апоптоз, но могут противодействовать противоапоптозным действиям активных энантиомеров и полезны для применения в исследованиях. Ахиральные соединения также проявляют способности по сохранению клеток. Настоящее изобретение касается также применения соединений определенной выше общей формулы I и их солей в качестве агентов сохранения клеток с целью лечения и предотвращения заболеваний, в которых происходит гибель клеток вследствие апоптоза, включая (но не ограничиваясь этим) удар, травму головы,паралич Белла, повреждения спинного мозга и других нервов, болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, амиотрофический латеральный склероз, болезнь Хантингтона,множественный склероз, сердечную миопатию,нефропатию, ретинопатию, осложнения, вызванные диабетом, глаукому, а также идиопатические невропатии. Таким образом, в настоящем изобретении предлагается способ лечения состояния, при котором происходит гибель клеток вследствие апоптоза, включающий введение нуждающемуся в этом животному эффективного количества соединения формулы I. 3 Подробное содержание предпочтительных вариантов соединения данного изобретения Настоящее изобретение относится к соединениям общей формулы Im равно 0 или целому числу в диапазоне от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода; R1 может быть незамещенным или замещенным, по меньшей мере,одним из заместителей, выбранных из гидроксила, альдегида, оксо, низшего ацилокси, галогена, тио, сульфоксида, сульфона, фенила, галогензамещенного фенила, гидроксизамещенного фенила, циклоалкила, имеющего от 3 до 6 атомов углерода, и гетероциклических заместителей, имеющих от 3 до 6 атомов, среди которых от 1 до 3 являются гетероатомами, выбранными из О, S и/или N,R2=Н, СН 3 или СН 2 СН 3,R3=Н или СН 3,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу в диапазоне от 1 до 3 и Х представляет собой карбоксил (СООН),карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), сложный фосфонатный эфир (РО 3[R5]2) или 5-тетразол,и их солям. В предпочтительном варианте настоящее изобретение предлагает соединение формулы IR1=(СН 2)mСН 3, где m равно 0 или целому числу в диапазоне от 1 до 16,R2=СН 3,R3=Н,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу в диапазоне от 1 до 3 и Х представляет собой карбоксил (СООН) или карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), сложный фосфонатный эфир (РО 3[R5]2) или 5-тетразол,и его фармацевтически приемлемую соль. Предпочтительные соединения данного изобретения включают 2-(2-пропиламино)уксусную кислоту; 2-(1-гексиламино)уксусную кислоту;(R)-2-(2-гептиламино)этан-5-тетразол. Соединения формулы I, представляющие собой оптически чистые энантиомеры, являются новыми. Ахиральные и рацемические соединения являются новыми, за исключением указанных далее случаев, хотя их свойства как агентов сохранения клеток не известны а) для Х=СООН; n=1; R3=R4=Н, исключаются соединения, в которыхR- и S-конфигурации являются особо предпочтительными в зависимости от подкласса соединения. Способы разделения рацематов известны. Подходящие способы включают дробную кристаллизацию, получение производных рацемата с последующим стереоспецифическим ферментативным удалением присоединенной группы и хроматографию. Однако предпочти-тельно получать хиральные соединения формулы I из хиральных реагентов, используя реакции, которые не нарушают стереохимии. Что касается энантиомеров, предпочтительно, чтобы энантиомер не содержал более 3% соединения противоположной конфигурации. Особо предпочтительно, чтобы энантиомер содержал менее 1% соответствующего энантиомера противоположной конфигурации. Некоторые из неактивных энантиомеров соединений данного класса или подкласса сильно противодействуют противоапоптозному действию активных энантиомеров и полезны в качестве средств для проведения исследований. 6 Данное изобретение распространяется на соли соединений формулы I. Применяемые для введения соли должны быть фармацевтически приемлемыми, но могут быть полезны и другие соли, например при синтезе или для очистки. Способы получения соединений данного изобретения Соединения данного изобретения можно получить рядом различных способов. Один способ включает присоединение первичного амина формулы (II) по олефиновой двойной связи эфиров ,ненасыщенных карбоновых кислот (таких как метилакрилат), эфиров винилфосфоновых кислот или ,-ненасыщенных нитрилов (таких как акрилонитрил) формулы (III) [21](III) где X обозначает поляризованную группу, такую как эфир карбоновой кислоты, эфир фосфоновой кислоты или нитрил, с получением соответствующих N-алкиламинопропионовых эфиров, этанфосфоновых эфиров и пропионитрилов. Можно применять амин формулы (II), в котором R1 отличается от R2, в виде рацемата и затем разделять энантиомеры, но предпочтительно использовать практически чистый энантиомер амина. Хиральные первичные амины (R- или Sформы) получали путем перекристаллизации тартратов рацематов из метанола [22], за исключением (R)- и (S)-2-бутиламинов, которые приобретали от Aldrich Chemical Co. Энантиомерную чистоту определяли, применяя способ газовой хроматографии с хиральной капиллярной колонкой и хиральным агентом дериватизации [23]. По аналогии с описанным выше хиральные первичные амины можно также присоединять по двойной С-С связи метилакрилата,диэтилвинилфосфоната или акрилонитрила,получая соответствующий хиральный метил-Nалкиламинопропионат, хиральный диэтил-Nалкиламиноэтанфосфонат или хиральный Nалкиламинопропионитрил. В одном варианте по олефиновой связи акрилонитрила присоединяют избыток хирального амина, как указано на следующей схеме. Избыток амина и акрилонитрил где R1=водород, метил или этил иR2=метил, этил, пропил, бутил, пентил, гексил. В другом варианте избыток амина можно присоединять к олефиновой двойной связи диэтилвинилфосфоната, получая соответствующий диэтил-N-алкиламиноэтанфосфонат. Гидролиз диэфира аминофосфоновой кислоты при помощи соляной кислоты дает соответствующую аминофосфоновую кислоту в виде гидрохлоридной соли. Еще в одном варианте избыток амина можно присоединять к олефиновой двойной связи метилакрилата, получая соответствующий метил-N-алкиламинопропионат [24]. Гидролиз сложного эфира карбоновой кислоты посредством соляной кислоты в соответствии со следующей реакционной схемой дает аминокислоту в виде ее гидрохлоридной соли. Гидролиз сложных эфиров Второй способ получения соединений данного изобретения, которые содержат только один атом углерода между атомом азота и функциональной группой, включает конденсацию первичного алифатического амина формулы (II) с бромметильным реагентом формулы(IV) где L обозначает уходящую группу, например галоген, тозил или мезил (предпочтителен бромид), и Х обозначает карбоалкоксигруппу(предпочтительны карбометокси или карбоэтокси), нитрил или фосфодиэтоксигруппу. Опять-таки, амин можно применять в виде рацемата или энантиомерно чистой формы. В одном предпочтительном варианте два эквивалента амина реагируют с одним эквивалентом бромметильного аналога формулы (IV) с образованием необходимого аминометанкарбоксилата (глицина) и бромисто-водородной соли амина, которую можно выделить и повторно использовать в соответствии со следующей реакционной схемой. Два эквивалента амина и один эквивалент бромзамещенного сложного метилового эфира в эфире (Et2O) В другом предпочтительном варианте два эквивалента амина реагируют с одним эквивалентом бромметильного аналога формулы (IV) с образованием необходимого нитрила аминометана 8 выделить и повторно использовать в соответствии со следующей реакционной схемой. Два эквивалента амина и один эквивалент бромацетонитрила в эфире Другой способ получения соединений данного изобретения включает трифторацетилирование амина с последующей реакцией с бромметильными, бромэтильными или бромпропильными аналогами эфиров карбоновых кислот или нитрилов формулы (V)(V) где L обозначает уходящую группу, например галоген, тозильную или мезильную группу(предпочтителен бромид), n равно 1, 2 или 3 и Х обозначает карбоалкоксигруппу (предпочтительны метокси или этокси), нитрил или фосфодиэтоксигруппу. Амин можно применять в виде рацемата или в виде энантиомерно чистой формы. Амин реагирует с ангидридом трифторуксусной кислоты или галогенидом трифторуксусной кислоты в инертном органическом растворителе,например, хлорированном углеводороде, таком как дихлорметан, хлороформ или четыреххлористый углерод, и основании, например органическом основании, таком как триэтиламин. Затем N-трифторацетиламин кипятят с обратным холодильником вместе с бромированным соединением формулы (V), лучше в присутствии основания, такого как трет-бутилат калия, в полярном растворителе, например ацетонитриле, и в присутствии краун-эфира, например 18-краун 6, в качестве катализатора. Продукт этой реакции далее гидролизуют, лучше посредством реакции с основанием, таким как гидроксид щелочного металла, в спиртовом растворителе. Тетразольные соединения данного изобретения получают посредством присоединения азид-иона по нитрильной тройной связи [25]. В данном случае амин также можно применять в виде рацемата или энантиомерно чистой формы. В одном предпочтительном варианте азид-ион генерируют, медленно добавляя хлорид алюминия к раствору/суспензии азида натрия в тетрагидрофуране при 0 С. К полученному раствору азида алюминия добавляют нитрил (полученный описанным выше способом) в тетрагидрофуране при комнатной температуре, затем перемешивают реакционную смесь в течение 2 ч и осторожно кипятят с обратным холодильником в течение нескольких часов в соответствии со следующей схемой.N-Метилирование различных описанных выше вторичных аминов осуществляют посредством восстановительного метилирования, используя формальдегид и фосфит натрия [26]. Опять-таки, амин можно применять в виде рацемата или энантиомерно чистой формы. Сложный эфир аминокарбоновой кислоты или аминонитрил (в виде гидрохлоридной соли или свободного основания) растворяют в водном дигидрофосфите натрия и проводят реакцию с избытком 37% водного формальдегида при 60 С в течение 15 мин. Продукт выделяют посредством экстракции эфиром после подщелачивания охлажденной на льду реакционной смеси гидроксидом натрия. Предпочтительный вариант представлен на следующей реакционной схеме. Еще один предпочтительный вариант показан на следующей реакционной схеме. Терапевтические способы данного изобретения Как упоминалось здесь ранее, описанные выше соединения формулы I имеют много терапевтических применений. 10 В одном аспекте настоящее изобретение обеспечивает способ лечения или профилактики состояния, при котором происходит гибель клеток вследствие апоптоза, включающий введение эффективного количества соединения формулыI нуждающемуся в этом животному. Используемый здесь термин "эффективное количество" обозначает количество, эффективное при применении в дозировке и в течение периода времени, необходимых для достижения требуемого результата. Используемый здесь термин "животное" включает всех членов животного мира, включая людей. В другом аспекте настоящее изобретение обеспечивает применение соединения формулыI для лечения или профилактики состояния, при котором происходит гибель клеток вследствие апоптоза. Еще в одном аспекте настоящее изобретение обеспечивает применение соединения формулы I с целью получения лекарственного средства для лечения или профилактики состояния,при котором происходит гибель клеток вследствие апоптоза. Состояния, при которых происходит гибель клеток вследствие апоптоза, включают (но не ограничены этим) удар, травму головы, паралич Белла, повреждения спинного мозга и других нервов, болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, амиотрофический латеральный склероз, болезнь Хантингтона, множественный склероз, сердечную миопатию, нефропатию, ретинопатию, осложнения, вызванные диабетом, глаукому, а также идиопатические невропатии. Фармацевтические композиции Из соединений общей формулы I можно составлять фармацевтические композиции для введения пациентам в биологически совместимой форме, подходящей для введения in vivo. Композиции, содержащие соединения данного изобретения, можно получать известными, как таковые, способами для получения фармацевтически приемлемых композиций для введения пациенту, таким образом, что эффективное количество активного вещества объединяют в виде смеси с фармацевтически приемлемым носителем. Подходящие носители описаны, например, в Remington's Pharmaceutical Sciences(Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., USA, 1985). На основании этого композиции включают, не ограничиваясь этим, растворы веществ в ассоциации с одним или более фармацевтически приемлемыми носителями или разбавителями и содержатся в забуференных растворах, имеющих подходящий рН, и изоосмотических с физиологическими жидкостями. Активное вещество можно вводить обычным образом, например путем инъекции (подкожной, внутривенной и др.), перорально, по 11 средством ингаляции, трансдермально или ректально. При пероральном введении соединения можно вводить в виде таблеток, таблеток с оболочкой, желатиновых капсул, капсул, облаток и растворов или суспензий, предназначенных для перорального применения. Соединения можно также вводить парентерально или любым другим подходящим способом, например внутривенно, подкожно, в виде инъекции с замедленным всасыванием, внутримышечно, внутриоболочечным способом,интравентрикулярно,внутрисуставно,ректально(суппозитории,клизма), подъязычно, трансбуккально, внутриглазным способом, внутрь стекловидного тела,трансдермально (пластырь), в виде капель для носа (ингаляция, вдувание), в виде липосомных систем доставки. Дневную дозировку, вероятно,можно варьировать от 1 до 100 мг. Таким образом, еще один аспект настоящего изобретения обеспечивает фармацевтическую композицию, включающую соединение общей формулы (I) в смеси с подходящим разбавителем или носителем. Соединение может быть ахиральным или в виде практически чистого R- или S-энантиомера или его фармацевтически приемлемой солью в смеси с фармацевтически приемлемым разбавителем или носителем. Эти композиции полезны при лечении или профилактике состояний, при которых происходит гибель клеток вследствие апоптоза. Еще один аспект настоящего изобретения обеспечивает коммерческую упаковку, содержащую в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль вместе с инструкциями по его применению для лечения или профилактики состояний, при которых происходит гибель клеток вследствие апоптоза. Примеры Пример 1. Процедура in vitro для оценки способности различных соединений противодействовать апоптозу мозжечковых тучных клеток. Следующие биологические данные показывают, что соединения данного изобретения демонстрируют способность противодействовать апоптозу. В культурах мозжечковых тучных клеток(CGC) можно индуцировать апоптоз, добавляя высокую концентрацию цитозинарабинозида(АrаС) [27]. Показано, что это р 53-зависимый апоптоз [28]. Используя эту систему, авторы определяли эффект противодействия апоптозу некоторых аминокислот, аминоэфиров, аминофосфоновых кислот, аминонитрилов и аминотетразолов. Культуры CGC получали от 6-8-дневных крысят Wistar. Культуры культивировали на стекле в 35-миллиметровых чашках Петри в течение 3 дней и далее использовали для экспериментов. К питательной среде этой культуры 12 добавляли аликвоты (20 мкл) лекарственного раствора (АrаС, средства против апоптоза, носители). Спустя 24 ч культуры фиксировали при помощи FAM и подкрашивали бис-бензамидом. Подсчитывали нормальные ядра и ядра погибших клеток при общем количестве 90-120 клеток на культуру. Было найдено, что оптимальная концентрация АrаС составляет 300 мкМ. Результаты суммированы в табл. 1-4. Таблица 1Cохранение клеток при помощи аминокислот и сложных эфиров в CGC-исследованииCохранение клеток при помощи аминофосфоновых кислот в CGC-исследовании Соединение 2-Пропил Возможно, присутствие в R-энантиомере 0,5% S-энантиомера (который сильно действует при 10-12 М) ответственно за кажущееся сохранение при помощи R-энантиомера при 10-6 М. Таблица 3 Сохранение клеток при помощи аминотетразолов в CGC-исследовании Соединение Таблица 4 Сохранение клеток при помощи аминонитрилов в CGC-исследовании Соединение 2-Пропил нет нет нет нет нет да нет нет да да нетR=сохранено; Х=не сохранено; Т=токсичен Подробная процедура синтеза Далее приведены не являющиеся ограничивающими примеры методик синтеза. Пример 2. Метил 3-(1-гексиламино) пропионат гидрохлорид [метил N-(1-гексил)-аланинат]. К охлажденному на бане с водой и льдом 1-гексиламину (7,58 г, 75 ммоль) добавляют по каплям метилакрилат (4,3 г, 50 ммоль). По завершении добавления температуре дают подняться до комнатной и перемешивают раствор в течение 5 ч, а затем кипятят 90 мин с обратным холодильником. После перемешивания в течение ночи при 20 С продукт, метил-3-(1 гексиламино)пропионат, отгоняют (т.кип. 8588 С/2 мм; лит. т.кип. 80-84 С/0,5 мм) в виде прозрачной бесцветной жидкости с выходом 55%. Гидрохлоридную соль получают, добавляя НСl (15%) в метаноле к эфирному раствору свободного основания; т.пл. 204-205 С; лит. т.пл. 190-192 С. Масс-спектр: m/е 187 (М+); 116 (M-С 5 Н 11); 84. Пример 3. (R)-Метил 3-(2-гептиламино) пропионат гидрохлорид [(R)-метил-N-(2-гептил)аланинат]. Получают в соответствии с примером 2. Гидрохлоридную соль перекристаллизовывают из метанола/эфира; т.пл. 89,5-90,5 С. Масс-спектр: m/е 201 (М+); 186 (М-СН 3); 130 (М-С 5 Н 11). Пример 4. Метил 3-(2-пропиламино)пропионат гидрохлорид [метил-N-(2-пропил)аланинат]. Получают в соответствии с примером 2. Гидрохлоридную соль кристаллизуют из метанола/эфира; т.пл. 108-110 С (лит.т.пл. 107 С). Масс-спектр: m/е 145 (М+); 130 (М-СН 3); 98; 72; 56. Пример 5. Гидрохлорид (R)-3-(2-гептиламино)пропионовой кислоты [(R)-N-(2-гептил)-аланин].(R)-3-(2-Гептиламино)пропионитрил (7,5 г,44,6 ммоль), полученный согласно примеру 18,кипятят с обратным холодильником с концентрированной соляной кислотой (50 мл) в течение 4 ч. Отфильтровывают нерастворимый хлорид аммония, после чего водный раствор выпаривают досуха на роторном испарителе. Остаток перемешивают с дихлорметаном (120 мл) в течение 2 ч и отфильтровывают нерастворимый хлорид аммония. Фильтрат концентрируют,снова фильтруют и затем выпаривают, получая бесцветное масло, которое кристаллизуется при охлаждении. Выход белого гигроскопичного продукта количественный; т.пл. 57-58 С. Масс-спектр: m/e 187 (М+); 172 (М-СН 3); 116 (M-C5H11); 72 . 1(д, 3 Н); 1,1-1,3 (м, 6 Н); 1,42/1,60 (2 м, каждый 1 Н); 2,67 (т, 2 Н); 3,17 (м, 3 Н; СН и СН 2 СООН). Указанное в заголовке соединение можно также получить посредством гидролиза соляной кислотой метилового эфира (полученного согласно примеру 3). Пример 6. Гидрохлорид (S)-3-(2-гептиламино)пропионовой кислоты [(S)-N-(2-гептил)-аланин]. Получают согласно примеру 5. Гидрохлоридная соль гигроскопична, т.пл. 56-58 С. Масс-спектр: m/е 187 (М+); 172 (М-СН 3); 128 (М-СН 2 СООН); 116 (M-C5H11). 1(д, 3 Н); 1,1-1,3 (м, 6 Н); 1,45/1,60 (2 м, каждый 1 Н); 2,68 (т, 2 Н); 3,20 (м, 3 Н; СН и СН 2 СООН). Пример 7. 3-(1-Гексиламино)пропионовая кислота [N-(1-гексил)аланин]. Метил 3-(1-гексиламино)пропионат гидрохлорид (получение см. в примере 2) гидролизуют при кипячении с обратным холодильником в 2 н. НСl в течение 24 ч, а затем выпаривают досуха; т.пл. 95-97 С (лит. данных нет). Масс-спектр: m/е 173 (М+); 102 (М-С 5 Н 11); 84; 72. 1(м, 6 Н); 1,52 (м, 2 Н); 2,68 (т, 2 Н); 2,93 (т, 2 Н); 3,18 (т, 2 Н). Пример 8. Гидрохлорид 3-(2-пропиламино) пропионовой кислоты [N-(2-пропил)аланин]. Получают посредством гидролиза сложного эфира (пример 7). Продукт представляет собой белый порошок; т.пл. 154-155 С (в литературе данных нет). Масс-спектр: m/е 131 (М+); 116 (М-СН 3); 98; 56. 1 К раствору 2-пропиламина (4,4 г, 75 ммоль) в эфире (100 мл) добавляют этилбромацетат (6,26 г, 37,5 ммоль). Раствор перемешивают при 20 С в течение 3 дней. Выпавший в осадок 2-пропиламин гидробромид отфильтровывают, а фильтрат выпаривают на роторном испарителе, получая 5,4 г прозрачной светложелтой жидкости (выход сырого продукта 99%). Получают гидрохлоридную соль и перекристаллизовывают ее из смеси этанол/эфир; т.пл. 120121 С (в литературе данных нет). Масс-спектр: m/е 145 (М+); 130 (М-СН 3); 72 (M-COOC2H5). Пример 10. Гидрохлорид 2-(2-пропиламино)уксусной кислоты [N-(2-пропил)глицин]. Образец получают из нитрила, полученного согласно примеру 25, с выходом 72%, применяя методику гидролиза, аналогичную описанной в примере 12. Гидрохлоридную соль перекристаллизовывают из ацетона; т.пл. 180-184 С(м, 1 Н); 3,79 (с, 2 Н). Пример 11. Гидрохлорид 2-(1-гексиламино)уксусной кислоты [N-(1-гексил)глицин] 1HxActAc. Образец получают из нитрила (методика аналогична описанной в примере 10) с выходом 72%, применяя такую же методику гидролиза,как описана в примере 12. Гидрохлоридную соль перекристаллизовывают из ацетона; т.пл. 162-164 С (лит. т.пл. 215-218 С). Масс-спектр: m/е 159 (М+); 114 (М-СO2 Н); 88 (M-С 5 Н 11). 1 Раствор (R)-2-(2-гептиламино)ацетонитрила (1,20 г, 7,79 ммоль), полученного согласно примеру 23, в концентрированной НСl (12 мл) и воде (5 мл) нагревают в течение 48 ч при 90 С. После охлаждения до комнатной температуры реакционную смесь концентрируют досуха,фильтруют и промывают этанолом, удаляяNH4Cl. Полученный фильтрат концентрируют,получая неочищенный продукт (1,40 г). Раствор неочищенного продукта (0,60 г) в концентрированной НСl (20 мл) и воде (10 мл) нагревают в 16 течение 24 ч при 90 С. После охлаждения до комнатной температуры реакционную смесь высушивают и растирают в эфире, получая гидрохлоридную соль в виде кристаллического твердого вещества (0,60 г, общий выход 37%); т.пл. 162-164 С. Масс-спектр: m/e (химическая ионизация) 174 (М+1); 158 (М-СН 3); 102 (M-C5H11). 1(д, 3 Н); 1,1-1,3 (м, 6 Н); 1,45/1,60 (2 м, каждый 1 Н); 3,21 (м, 1 Н); 3,79 (с, 2 Н). Пример 13. Гидрохлорид (S)-2-(2-гептиламино)уксусной кислоты [(S)-N-(2-гептил)глицин]. Образец получают, как описано в примере 12, с общим выходом 72%, применяя гидролиз гидрохлорид ной соли нитрила; т.пл. 161-163 С. Масс-спектр: m/e (химическая ионизация) 174 (М+1); 156 (М-ОН); 128 (М-СO2 Н). 1 К раствору метил 3-(2-пропиламино)пропионат гидрохлорида (пример 10) (0,907 г, 5 ммоль) в 1 н. дигидрофосфите натрия (25 мл) добавляют 37% формальдегид (2,1 мл, 23 ммоль). Раствор перемешивают при 60 С в течение 10 мин, затем охлаждают на бане из воды со льдом и подщелачивают 10% гидроксидом натрия (10 мл). Полученный раствор насыщают хлоридом натрия (9 г) и сразу экстрагируют эфиром (3 х 15 мл). Объединенные фильтраты сушат над безводным сульфатом магния и выпаривают досуха, получая прозрачную бесцветную жидкость. Гидрохлоридная соль, полученная при добавлении НСl в метаноле к эфирному раствору свободного основания, осаждается в виде вязкого масла с выходом 83%. Масс-спектр: m/e 159 (М+); 144 (М-СН 3); 86 (М-СН 2 СООСН 3). Пример 15. (R)-Метил 3-(2-гептилметиламино)пропионат гидрохлорид [(R)-метил N-(2 гептил)-N-метилаланинат]. Гидрохлоридную соль получают с выходом 93% в виде бесцветной вязкой жидкости. Масс-спектр: m/е 215 (М+); 200 (М-СН 3); 144 (М-С 5 Н 11). Пример 16. Гидрохлорид (R)-3-(2-гептилметиламино)пропионовой кислоты [N-(2-гептил)-N-метилаланин]. Гидрохлоридную соль получают в виде бесцветного вязкого масла. Масс-спектр: m/е 215 (М+); 186 (М-СН 3); 130 (M-C5H11).(м, 9 Н); 1,47, 1,59 (2 м, каждый 1 Н); 2,65 (д, 3 Н); 2,74 (т, 2 Н); 3,11 (м, 1 Н); 3,34 (м, 2 Н). Пример 17. (R)-3-(2-Гептиламино)пропионитрилгидрохлорид. К охлажденному на бане с водой и льдом(R)-2-гептиламину (99,4% R) (9,28 г, 80,7 ммоль) добавляют по каплям акрилонитрил(2,85 г, 3,543 мл, 54 ммоль). По завершении добавления температуре дают подняться до комнатной и перемешивают реакционный раствор в течение 5 ч, а затем 90 мин кипятят с обратным холодильником. После перемешивания в течение ночи при 20 С отгоняют полученный (R)-3(2-гептиламино)пропионитрил в виде прозрачной бесцветной жидкости, т.кип. 101-102 С/2 мм, с выходом 85%. Гидрохлоридную соль получают, добавляя НСl в этаноле (15%) к эфирному раствору свободного основания; т.пл. 134135 С. Масс-спектр: m/е (химическая ионизация) 169 (М+Н); 153 (М-СН 3); 97 (М-С 5 Н 11). 1(д, м, 9 Н); 1,45, 1,61 (2 м, каждый 1 Н); 2,85 (т,2 Н); 3,3 (м, 3 Н). Элементный анализ: рассчитано: С 58,66; Н 10,34; N 13,68; найдено: С 58,73; Н 10,53; N 13,47. Исходное вещество (R)-2-гептиламин отделяют от рацемата посредством неоднократной перекристаллизации из метанола его соли Lтартрата. Восемь перекристаллизаций с использованием отношения объема (метанола) к весу(соли тартрата) от 2,4 до 2,6 (увеличивающегося с увеличением оптической чистоты) дают Rэнантиомер с оптической чистотой 99,4%. Оптическую чистоту оценивают путем получения производного со свежеприготовленным хиральным реагентом (S)-N-трифторацетилпропилхлоридом и последующей газовой хроматографии на хиральной колонке [23]. Пример 18. (S)-3-(2-Гептиламино)пропионитрилгидрохлорид.(S)-2-Гептиламин в виде его соли Dтатртрата получают посредством перекристаллизации рацемата (S-обогащенный, выделенный и полученный перекристаллизациями из объединенных фильтратовRэнантиомера, как описано в примере 17). Оптическая чистота составляет 99,4% S. S-2HECN получают с выходом 85% (т.кип. 99-100 С/2 мм), как описано для R-энантиомера в примере 17. Гидрохлоридную соль перекристаллизовывают из смеси метанол/эфир; т.пл. 133-134 С. Масс-спектр: m/е (химическая ионизация) 169 (М+Н); 153 (М-СН 3); 128 (M-CH2CN); 97(лит. т.кип. 86-87 С/17 мм), получают согласно методике примера 17 и затем превращают в гидрохлоридную соль, которую перекристаллизовывают из смеси метанол/эфир; т.пл. 145,5146 С (лит. данных нет). Масс-спектр: m/е 140 (М+); 97 (М-СН 3); 72(т, 2 Н); 3,29 (т, 2 Н); 3,36 (м, 1 Н). Пример 20. 3-(1-Гексиламино)пропионитрилгидрохлорид. Гидрохлоридную соль перекристаллизовывают из смеси этанол/эфир; т.пл. 188-189 С(0,92 мл, 13,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч и еще 14 ч при 80 С. После охлаждения до комнатной температуры реакционную смесь фильтруют и фильтрат промывают НСl (3 н.,3 х 10 мл). Водный слой подщелачивают посредством NaOH (6 н.) и экстрагируют эфиром (3 х 25 мл). Полученный эфирный раствор сушат надNa2SO4 и выпаривают досуха. Остаток фракционируют с помощью колоночной флэшхроматографии (25% EtOAc/гексан, эфир), по 19 лучая бесцветное масло (2,10 г, 82%). Гидрохлоридную соль получают, добавляя НСl в этаноле (15%) к эфирному раствору свободного основания; т.пл. 152-153 С. Масс-спектр: m/e (химическая ионизация) 155 (М+1); 128 (М-CN); (ионизация электронами) 139 (М-СН 3); 83 (М-С 5 Н 11). 1(д, 3 Н); 1,15-1,35 (м, 6 Н); 1,47/1,62 (2 м, каждый 1 Н); 3,35 (м, 1 Н); 4,18 (с, 2 Н). Элементный анализ: рассчитано: С 56,68; Н 10,04; N 14,69; найдено: С 56,81; Н 10,20; N 14,46. Пример 24. (S)-2-(2-Гептиламино)ацетонитрилгидрохлорид. Образец получают с выходом 96%, применяя описанную выше методику (пример 23). Гидрохлоридную соль получают добавлением НСl в этаноле (15%) к эфирному раствору свободного основания, и перекристаллизовывают из смеси этанол/эфир. Эта соль сублимируется при плавлении; т.пл. 140 С. Масс-спектр: m/e 154 (М+); 139 (М-СН 3). 1(д, м, 9 Н); 1,43, 1,59 (2 м, каждый 1 Н); 3,31 (м,1 Н); 4,15 (с, 2 Н). Элементный анализ: рассчитано: С 56,68; Н 10,04; N 14,69; найдено: С 56,51; Н 9,71; N 14,79. Пример 25. 2-(2-Пропиламино)ацетонитрилгидрохлорид. Гидрохлоридную соль перекристаллизовывают из смеси метанол/эфир; т.пл. 166-167 С(м, 1 Н); 4,17 (с, 2 Н). Пример 26. 2-(1-Гексиламино)ацетонитрилгидрохлорид. Образец свободного основания получают с выходом 62%, применяя описанную выше методику (пример 23). Гидрохлоридную соль получают, добавляя НСl в этаноле (15%) к эфирному раствору свободного основания, и перекристаллизовывают из смеси этанол/эфир; т.пл. 114115 С (лит. т.пл. 84-86 С) . Масс-спектр; m/e (химическая ионизация) 141(М+1)+; 126 (М-CN). 1(R)-3-(2-Гептиламино)пропионитрил (пример 17) (0,85 г, 5,0 ммоль) растворяют в 1 н. дигидрофосфите натрия (NаН 2 РО 3) (25 мл) и добавляют 37% формальдегид (2,1 мл, 23 ммоль). Добавляют диоксан в количестве, достаточном для получения прозрачного раствора(10 мл). Раствор перемешивают при 60 С 15 мин, в течение которых он становится мутным. Затем к охлажденному раствору добавляют 20% гидроксид натрия (20 мл) и хлорид натрия (9 г). Щелочной раствор экстрагируют эфиром (3 х 15 мл). Объединенные экстракты сушат над безводным сульфатом магния и затем выпаривают,получая прозрачную бесцветную жидкость с количественным выходом. Гидрохлоридную соль получают, добавляя НСl в метаноле к эфирному раствору свободного основания; т.пл. 98-98,5 С. Общий выход 85%. Масс-спектр: m/е 182 (М+); 167 (М-СН 3); 142 (M-CH2CN); 111 (М-С 5 Н 11). 1CH2CN). Элементный анализ: рассчитано: С 60,93; Н 10,60; N 12,80; найдено: С 59,55; Н 10,29; N 13,67. Пример 28. 3-(2-Пропиламино)пропионитрилгидрохлорид. Гидрохлоридную соль получают с выходом 90%; т.пл. 121-121,5 С (лит. данных нет)(м, 1 Н). Пример 29. 3-(трет-Амилметиламино)пропионитрилгидрохлорид. Гидрохлоридную соль получают с выходом 87%; т.пл. 137-138 С (лит. данных нет) (см. пример 27). Масс-спектр: m/е 154 (М+); 139 (М-СН 3); 125 (М-С 2 Н 5); 72. 1(6 Н); 1,67 (квартет, 2 Н); 2,10 (с, 2 Н); 2,73 (с,3 Н); 2,94 (широкий т, 2 Н). Элементный анализ: рассчитано: С 56,68; Н 10,04; N 14,69; найдено: С 56,62; Н 10,12; N 14,62 Пример 30. 3-(1-Гексилметиламино)пропионитрилгидрохлорид. Гигроскопичную гидрохлоридную соль получают с выходом 75%; т.пл. 77-78,5 С (лит. данных нет) (см. пример 27). Масс-спектр: m/е 168 (М+); 128 (MCH2CN); 97 (M-C5H11). 1 К охлажденному на льду 2-пропиламину (0,53 мл, 6,2 ммоль) добавляют по каплям диэтилвинилфосфонат (0,4 мл, 3,1 ммоль) в атмосфере N2. Реак 21 ционную смесь перемешивают в течение 2 ч при 0 С, 14 ч при комнатной температуре и 10 ч при 100 С. После охлаждения до комнатной температуры реакционную смесь концентрируют, получая бесцветное масло (0,89 г). К раствору сырого продукта (0,89 г) в эфире (40 мл) добавляют НСl в этаноле (15%) и затем перемешивают в течение 2 ч при комнатной температуре. Полученный кристаллический гидрохлорид отфильтровывают, промывают эфиром, получая белое твердое вещество (0,76 г, общий выход 95%); т.пл. 9697 С (лит. данных нет). Масс-спектр: m/е 208 (М-СН 3)+; 180 (МС 3 Н 7)+. Пример 32. Гидрохлорид 2-(2-пропиламино)этанфосфоновой кислоты. Гидрохлоридную соль указанного продукта получают (исходя из диэфира, пример 31) с общим выходом 32%, применяя методику, описанную в примере 37; т.пл. 164-166 С (лит. данных нет). Масс-спектр: m/е (химическая ионизация) 168 (М+1)+. 1(м, 2 Н); 3,08 (квартет, 2 Н); 3,27 (м, 1 Н). Пример 33. Диэтил 2-(1-гексиламино)этанфосфонатгидрохлорид. Сырой продукт получают с выходом 100%,применяя описанную выше методику. Гидрохлоридную соль этого продукта получают, добавляя НСl в этаноле (15%) к эфирному раствору продукта; эта соль представляет собой вязкое масло. Масс-спектр: m/е 265 (М)+; 194 (MC5H11)+. Пример 34. Гидрохлорид 2-(1-гексиламино)этанфосфоновой кислоты. Гидрохлоридную соль получают путем гидролиза диэтилового эфира, применяя способ,описанный в примере 37; т.пл. 145-150 С (лит. данных нет). Масс-спектр: m/е слишком нелетучее. 1(м, 6 Н); 1,50 (м, 2 Н); 1,90 (м, 2 Н); 2,88 (т, 2 Н); 3,08 (квартет, 2 Н). Элементный анализ: рассчитано: С 39,11; Н 8,62; N 5,70; найдено: С 39,34; Н 8,53; N 5,89. Пример 35. (R)-Диэтил 2-(2-гептиламино) этанфосфонатгидрохлорид. Свободное основание получают с выходом 93%, применяя описанную выше методику. Гидрохлоридную соль получают, добавляя НСl в этаноле (15%) к эфирному раствору продукта; эта соль представляет собой вязкое масло. Масс-спектр: m/е (химическая ионизация) 280 (М+1)+; 264 (М-СН 3)+; 208 (M-C5H11)+. Пример 36. (S)-Диэтил 2-(2-гептиламино) этанфосфонатгидрохлорид. Свободное основание получают с выходом 91%, применяя описанную выше методику. Гидрохлоридную соль получают, добавляя НСl 22 в этаноле (15%) к эфирному раствору продукта; эта соль представляет собой вязкое масло. Масс-спектр: m/е (химическая ионизация) 280 (М+1)+; 208 (М-C5H11)+. Пример 37. Гидрохлорид (R)-2-(2-гептиламино)этанфосфоновой кислоты. Раствор (R)-диэтил 2-(2-гептиламино)этанфосфоната гидрохлорида (0,19 г, 0,68 ммоль) в концентрированной НСl (7 мл) нагревают при 90 С в течение 48 ч. Реакционную смесь выпаривают досуха, а остаток растирают с ацетоном. Белое твердое вещество отфильтровывают и сушат на воздухе, что дает общий выход 86%; т.пл. 106-112 С (лит. данных нет). Масс-спектр:H-ЯМР (D2O, 300 МГц): 0,73 (т, 3 Н); 1,251,10 (м, 12 Н); 1,43 (м, 1 Н); 1,58 (м, 1 Н); 1,891,78 (м, 2 Н); 3,22-3,05 (м, 3 Н). Элементный анализ: рассчитано: С 41,62; Н 8,93; N 5,39; найдено: С 41,68; Н 9,10; N 5,23. Пример 38. Гидрохлорид (S)-2-(2-гептиламино)этанфосфоновой кислоты. Гидрохлоридную соль получают с выходом 71%, применяя описанную выше методику; т.пл. 106-113 С (лит. данных нет). Масс-спектр: m/е слишком нелетучее. 1 Соединение в виде его гидрохлоридной соли получают с выходом 28%, применяя методику, описанную ниже в примере 40; эта соль представляет собой вязкое масло. Масс-спектр: m/е (химическая ионизация) 140 (М-С 5 Н 11)+; 128 (М-С 2 Н 3N4)+. 1(м, 9 Н); 1,44, 1,60 (2 м, каждый 1 Н); 3,30 (т+м,3 Н); 3,45 (м, 2 Н). Пример 40. (S)-2-(2-Гептиламино)этан-5 тетразолгидрохлорид. К охлажденной на льду суспензии NаN3(2,60 г, 40 ммоль) в безводном ТГФ (20 мл) добавляют порциями АlСl3 (1,36 г, 10 ммоль) в атмосфере N2 и перемешивают в течение 30 мин. К полученной суспензии добавляют раствор (S)-3-(2-гептиламино)пропионитрила (1,68 г, 10 ммоль) в ТГФ (10 мл) и перемешивают в течение 2 ч при 0 С, а затем осторожно кипятят с обратным холодильником в течение 24 ч. После охлаждения до комнатной температуры реакционную смесь гасят, осторожно добавляя НСl (3 н., 15 мл), воду (5 мл), и разделяют на два слоя. Нижний водный слой экстрагируют этилацетатом (3 х 15 мл). Верхний органический 23 слой и органические экстракты объединяют и сушат над Na2SO4, доведение до полной сухости дает сырой продукт (масло, 1,36 г). Это масло разбавляют эфиром (30 мл) и этанолом (5 мл),перемешивают в течение 2 ч и фильтруют, получая гидрохлоридную соль (0,21 г, общий выход 9%); т.пл. 112-113 С (лит. данных нет). Масс-спектр: m/е (химическая ионизация) 140 (М-С 5 Н 11)+; 128 (М-С 2 Н 3N4)+. 1(д, 3 Н); 1,15-1,35 (м, 6 Н); 1,45/1,62 (2 м, каждый 1 Н); 3,30 (т+м, 3 Н); 3,43 (м, 2 Н). Элементный анализ: рассчитано: С 48,47; Н 8,95; N 28,27; найдено; С 48,24; Н 8,85; N 28,40. Полный перечень цитированных в описании работ 1. Ansari K.S. и др. Сохранение посредством R(-)-депренила лицевых мотонейронов молодых крыс после аксотомии: стереоспецифичность и независимость от ингибирования моноаминоксидазы. Journal of Neuroscience, 1993, 13: стр. 4042-4053. 2. Davis В.А. и др. Сохранение нейронов посредством оптически активных энантиомеров некоторых алифатических N-метилпропаргиламинов. Abstract, American Society for Neurochemistry, 1995, Santa Monica, CA. 3. Oh С. и др. (-)-Депренил изменяет жизнеспособность лицевых мотонейронов взрослых крыс после аксотомии: увеличивает у чувствительного штамма C57BL, но снижает у дегенерационных мутантов двигательных нейронов. J.Neurosci. Res., 1994, 38: стр. 64-74. 4. Paterson I.A., Davis В.А. и Boulton А.А. Алифатические пропаргиламины предотвращают гибель нейронов гиппокампа, вызванную гипоксией-ишемией. J. Neurochem., 1997, 69(Дополнение): стр. S137. 5. Paterson I.А. и др. (-)-Депренил снижает замедленную гибель пирамидальных нейронов гиппокампа. Neurosci. Biobehav. Rev., 1997, 21: стр. 181-186. 6. Paterson I.А. и др. R-Депренил и R-2 гептил-N-метилпропаргиламин предотвращают апоптоз мозжечковых тучных нейронов, индуцированный цитозинарабинозидом, но не низким уровнем внеклеточного калия.Neurochem., 1998, 98: стр. 515-523. 7. Paterson I.А. и др. Противоапоптозные эффекты 2 НМР обусловлены дезметильным метаболитом. Society for Neuroscience Abstracts,1997, 23 (часть 2): стр. 2254 (880.6). 8. Paterson I.A. и др. Алифатические пропаргиламины в качестве агентов сохранения клеток, патент США от 14 июля 1997. 9. Tatton W.G. и Greenwood C.E. Сохранение погибающих нейронов: новое действие депренила при паркинсонизме МРТР. J. Neurosci.Res., 1991, 30; стр. 666-672. 10. Tatton W.G. и др. (-)-Депренил снижает апоптоз клеток РС 12, индуцируя синтез новых 24 протеинов. J. Neurochem., 1994, 63: стр. 15721575. 11. Salo P.Т. и Tatton W.G. Депренил снижает гибель мотонейронов, вызванную аксотомией. J. Neurosci. Res., 1992, 31: стр. 394-400. 12. Wu R.-M., Murphy D.L. и Chiueh С.С. Эффекты депренила по защите и сохранению нейронов против допаминергической токсичности МРР+. J. Neural Transm. [Gen Sect], 1995,100: стр. 53-61. 13. Yoles Е. и Schwartz M. N-Пропаргил-1(R)-аминоиндан (TVP-1012), предполагаемый нейрозащитный агент, усиливает in vitro жизнеспособность нейронов после глютаматной токсичности. Abstract, American Society for Neuroscience, 1995, San Diego, CA. 14. Zhang X. и др. Иммуногистохимическое доказательство нейрозащитного действия(R)-(-)-депренила и N-(2-гексил)-N-метилпропаргиламина на DSP-4-индуцированную дегенерацию норадренергических аксонов мозга крыс и нервных окончаний. Journal of Neuroscience Research, 1996, 43: стр. 482-489. 15. Yu P.H., Davis В.A., Boulton А.А. Алифатические пропаргиламины как специфические МАО-В-ингибиторы и нейрозащитные агенты. Патент США 5508311 (1992). 16. Durden D.A. и др. Алифатические пропаргиламины как агенты сохранения клеток. Патент США 5840979 (1997). 17. Grace J.M., Kinter M.T. и MacdonaldT.L. Атипичный метаболизм депренила и его энантиомера, (S)-(+)-N,альфа-диметил-N-пропинилфенилэтиламина, посредством цитохрома Р 450 2D6. Chem. Res. Toxicol., 1994, 7: стр. 286290. 18. Komives E.A. и Ortiz de Montellano P.R. Механизм окисления -связей посредством цитохрома Р-450. J. Biol. Chem., 1987, 262: стр. 9793-9802. 19. Roberts E.S. и др. Основанная на механизме инактивация цитохрома 450 2 В 1 посредством 9-этинилфенантрена. Arch. Biochem. Biophys., 1995, 323; стр. 295-302. 20. Valoti M. и др. Взаимодействия между замещенными аналогами триптамина, ингибиторами МАО и цитохромом Р-450. J. NeuralJ. Amer. Chem. Soc., 1946, 68: стр. 1217-1219. 22. Mazur R.H. Абсолютная конфигурация 1-метилалкиламинов. J. Organic. Chemistry,1970, 35; стр. 2050-2051. 23. Durden D.A., Davis В.А. и Boulton A.A. Энантиоселективное газохроматографическое исследование 2-алкиламинов с применением N(трифторацетил)пропильных производных и хиральной капиллярной колонки. Journal of 25 24. Robinson J.B. и Thomas J. Получение Nтрет-бутил-4-пиперидона. J. Chem. Soc., 1965: стр. 2270-2271. 25. Arnold С. и Thatcher D.N. Получение и реакции 5-винилтетразола. J. Org. Chem., 1969,34; стр. 1141-1142. 26. Loibner H., Pruckner А. и Stutz А. Восстановительное метилирование аминов. Tetrahedron Lett., 1984, 25: стр. 2535-2536. 27. Dessi F. и др. Цитозинарабинозид индуцирует апоптоз мозжечковых нейронов в культуре. J. Neurochem., 1995, 64; стр. 19801987. 28. Enokido Y. и др. Р 53 вызывает индуцируемый цитозинарабинозидом апоптоз культивируемых мозжечковых тучных нейронов. Neurosci. Lett., 1996, 203; стр. 1-4. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы Im равно 0 или целому числу от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода; причем R1 может быть необязательно замещен одним или несколькими заместителями, выбранными из гидроксила, альдегида, оксо, низшего ацилокси, галогена, тио,сульфоксида, сульфона,R2=Н, СН 3 или СН 2 СН 3,R3=Н или СН 3, причем все заместители R1,R2 и R3 имеют различные значения,R4=H или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН),карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (РО 3[R5]2) или 5-тетразол, в виде практически чистого энантиомера R- или Sконфигурации при атоме углерода, к которому присоединены заместители R1, R2 и R3,или его фармацевтически приемлемая соль. 2. Соединение формулы I по п.1, отличающееся тем, чтоR1=(СН 2)mСН 3, где m равно 0 или целому числу от 1 до 16,R2=СН 3, причем заместители R1 и R2 имеют различные значения,R3=Н,R4=H или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН) или карбалкокси (COOR5), циано(CN), фосфо 003677 26 новую кислоту (РО 3 Н 2), фосфонатный сложный эфир (РО 3[R5]2) или 5-тетразол,или его фармацевтически приемлемая соль. 3. Соединение формулы I по п.1, отличающееся тем, чтоR1=(СН 2)mСН 3, где m равно 0 или целому числу от 1 до 16,R2=СН 3,причем заместители R1 и R2 имеют различные значения,R3=Н,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН) или карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (РО 3[R5]2) или 5-тетразол,в виде практически чистого энантиомера Rконфигурации или его фармацевтически приемлемая соль. 4. Соединение формулы I по п.1, отличающееся тем, чтоR1=(СН 2)mСН 3, где m равно 0 или целому числу от 1 до 16,R2=СН 3, причем заместители R1 и R2 имеют различные значения,R3=Н,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН) или карбалкокси (COOR5), циано(CN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (РО 3[R5]2) или 5-тетразол,в виде практически чистого энантиомера Sконфигурации или его фармацевтически приемлемая соль. 5. Соединение по п.3, отличающееся тем,что указанное соединение формулы I выбирают из группы, состоящей из 27 6. Соединение по п.4, отличающееся тем,что указанное соединение формулы I выбирают из группы, состоящей из(S)-2-(2-гептилметиламино)этанфосфоновой кислоты. 7. Соединение, отличающееся тем, что его выбирают из группы, состоящей из 2-(1-гексилметиламино)уксусной кислоты; 3-(2-пропилметиламино)пропионовой кислоты; метил 2-(2-пропилметиламино)ацетата; метил 2-(1-гексилметиламино)ацетата; метил 3-(1-гексилметиламино)пропионата; 2-(1-гексиламино)ацетонитрила; 2-(1-гексилметиламино)ацетонитрила; 3-(3-пентиламино)пропионитрила; 3-(3-пентилметиламино)пропионитрила; 2-(2-пропиламино)этанфосфоновой кислоты и 2-(2-пропилметиламино)этанфосфоновой кислоты. 8. Соединение по любому из пп.1-7, отличающееся тем, что находится в виде гидрохлоридной соли. 9. Соединение по любому из пп.1-4, отличающееся тем, что m равно целому числу от 1 до 12. 10. Соединение по любому из пп.1-4, отличающееся тем, что m равно целому числу от 1 до 9. 11. Композиция для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза, отличающаяся тем, что включает эффективное количество соединения формулы Im равно 0 или целому числу от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода; причем R1 может быть необязательно замещен одним или несколькими заместителями,выбранными из гидроксила, альдегида, оксо,низшего ацилокси, галогена, тио, сульфоксида,сульфона,R2=Н, СН 3 или СН 2 СН 3,R3=Н или СН 3, причем все заместители R1,R2 и R3 имеют различные значения,R4=Н или СН 3, 003677R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН),карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,в виде практически чистого энантиомера R- илиS-конфигурации при атоме углерода, к которому присоединены заместители R1, R2 и R3, или его фармацевтически приемлемой соли в смеси с подходящим разбавителем или носителем. 12. Композиция по п.11, отличающаяся тем, что включает указанное соединение, в которомR1 представляет собой (СН 2)mСН 3, где m равно 0 или целому числу от 1 до 16,R2=СН 3, причем заместители R1 и R2 имеют различные значения,R3=Н,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН) или карбалкокси (COOR5), циано (СN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (РО 3[R5]2) или 5-тетразол,или его фармацевтически приемлемую соль в смеси с подходящим разбавителем или носителем. 13. Композиция по п.11, отличающаяся тем, что в ней указанное соединение формулы I выбирают из группы, состоящей из(R)-2-(2-гептиламино)этан-5-тетразола. 14. Композиция по п.11, отличающаяся тем, что в ней указанное соединение формулы I выбирают из группы, состоящей из(S)-2-(2-гептилметиламино)этанфосфоновой кислоты. 15. Композиция для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза, отличающаяся тем, что указанная композиция включает эффективное количество соединения, выбранного из группы, состоящей из 2-(1-гексилметиламино)уксусной кислоты; 3-(2-пропилметиламино)пропионовой кислоты; метил 2-(2-пропилметиламино)ацетата; метил 2-(1-гексилметиламино)ацетата; метил 3-(1-гексилметиламино)пропионата; 2-(1-гексиламино)ацетонитрила; 2-(1-гексилметиламино)ацетонитрила; 3-(3-пентиламино)пропионитрила; 3-(3-пентилметиламино)пропионитрила; 2-(2-пропиламино)этанфосфоновой кислоты и 2-(2-пропилметиламино)этанфосфоновой кислоты,в смеси с подходящим разбавителем или носителем. 16. Композиция по любому из пп.11-15, отличающаяся тем, что указанное соединение формулы I находится в виде гидрохлоридной соли. 17. Применение соединения формулы Im равно 0 или целому числу от 1 до 16, или алкенил, алкинил, алкокси, алкилтио или алкилсульфинильную группу, имеющую от 2 до 17 атомов углерода; причем R1 может быть необязательно замещен одним или несколькими заместителями,выбранными из гидроксила, альдегида, оксо,низшего ацилокси, галогена, тио, сульфоксида,сульфона,R2=Н, СН 3 или СН 2 СН 3,R3=Н или СН 3,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН),карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (РО 3[R5]2) или 5-тетразол,или является его фармацевтически приемлемой солью,для лечения или профилактики заболевания,при котором происходит гибель клеток вследствие апоптоза.R1=(СН 2)mСН 3, где m равно 0 или целому числу от 1 до 16,R2=СН 3,R3=Н,R4=Н или СН 3,R5 является низшим алкилом, имеющим от 1 до 5 атомов углерода,n равно целому числу от 1 до 3 и Х представляет собой карбоксил (СООН) или карбалкокси (COOR5), циано (CN), фосфоновую кислоту (РО 3 Н 2), фосфонатный сложный эфир (PO3[R5]2) или 5-тетразол,или его фармацевтически приемлемую соль. 19. Применение по п.17 или 18, отличающееся тем, что соединение формулы I представляет собой практически чистый энантиомер Rконфигурации. 20. Применение по п.17 или 18, отличающееся тем, что соединение формулы I представляет собой практически чистый энантиомер Sконфигурации. 21. Применение по п.17, отличающееся тем, что указанное соединение формулы I выбирают из группы, состоящей из 2-(2-пропиламино)уксусной кислоты; 2-(1-гексиламино)уксусной кислоты; 22. Применение по любому из пп.17-21, отличающееся тем, что заболевание выбирают из группы, которая включает удар, травму головы,паралич Белла, повреждение спинного мозга,болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, амиотрофический латеральный склероз, болезнь Хантингтона, множественный склероз, сердечную миопатию, нефропатию,ретинопатию, осложнения, вызванные диабетом, глаукому и идиопатические невропатии. 32 23. Применение по любому из пп.17-22 для лечения человека. 24. Коммерческая упаковка лекарства для лечения или профилактики заболевания, при котором происходит гибель клеток вследствие апоптоза, включающая фармацевтическую композицию по любому из пп.11-16 вместе с инструкциями по применению для лечения или профилактики указанных заболеваний.
МПК / Метки
МПК: A61K 31/197, C07C 229/12, C07F 9/38, A61P 3/10, C07D 257/04
Метки: агенты, сохранения, алифатические, аминокарбоновые, аминонитрилы, аминосульфоновые, клеток, аминотетразолы, кислоты
Код ссылки
<a href="https://eas.patents.su/18-3677-alifaticheskie-aminokarbonovye-i-aminosulfonovye-kisloty-aminonitrily-i-aminotetrazoly-kak-agenty-sohraneniya-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Алифатические аминокарбоновые и аминосульфоновые кислоты, аминонитрилы и аминотетразолы как агенты сохранения клеток</a>
Предыдущий патент: Гербицидная смесь, содержащая замещенное 3-гетероциклилом производное бензоила и вспомогательный агент
Следующий патент: Способ введения таксана пациенту, нуждающемуся в лечении таксаном, способ лечения человека таксаном
Случайный патент: Способ улучшения качества дактилоскопического изображения






















