Кристаллы, содержащие соль n-[2-(диэтиламино)этил]-5-[(5-фторо-2-оксо- 1,2-дигидро-3h-индол-3-илиден)метил]-2,4 -диметил-1н-пиррол-3- карбоксамида с яблочной кислотой, способы их получения и их композиции
Номер патента: 6445
Опубликовано: 29.12.2005
Авторы: Холи Майкл, Прескотт Стивен П., Малоуни Марк Т., Флек Томас Дж.
Формула / Реферат
1. Безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида, имеющего структуру
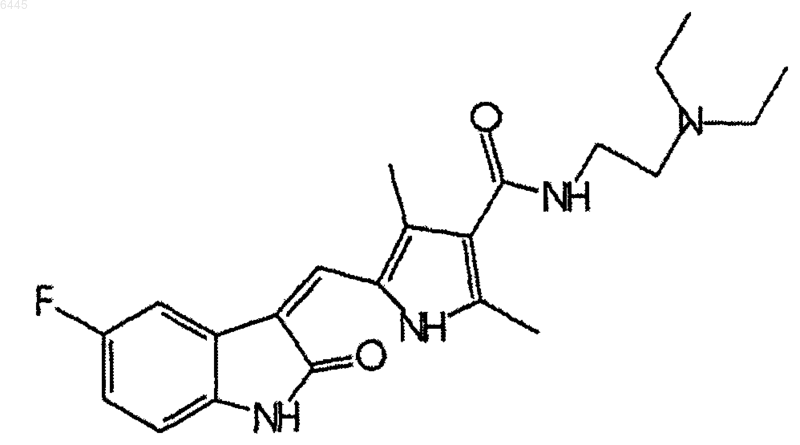
с яблочной кислотой.
2. Кристалл по п.1, где яблочной кислотой является L-яблочная кислота.
3. Безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет характеристические дифракционные пики вблизи приблизительно 13.2 и 24.2° 2q на порошковой рентгеновской дифрактограмме.
4. Кристалл по п.3, имеющий характеристические дифракционные пики вблизи приблизительно 13.2, 19.4, 24.2 и 25.5° 2q на порошковой рентгеновской дифрактограмме.
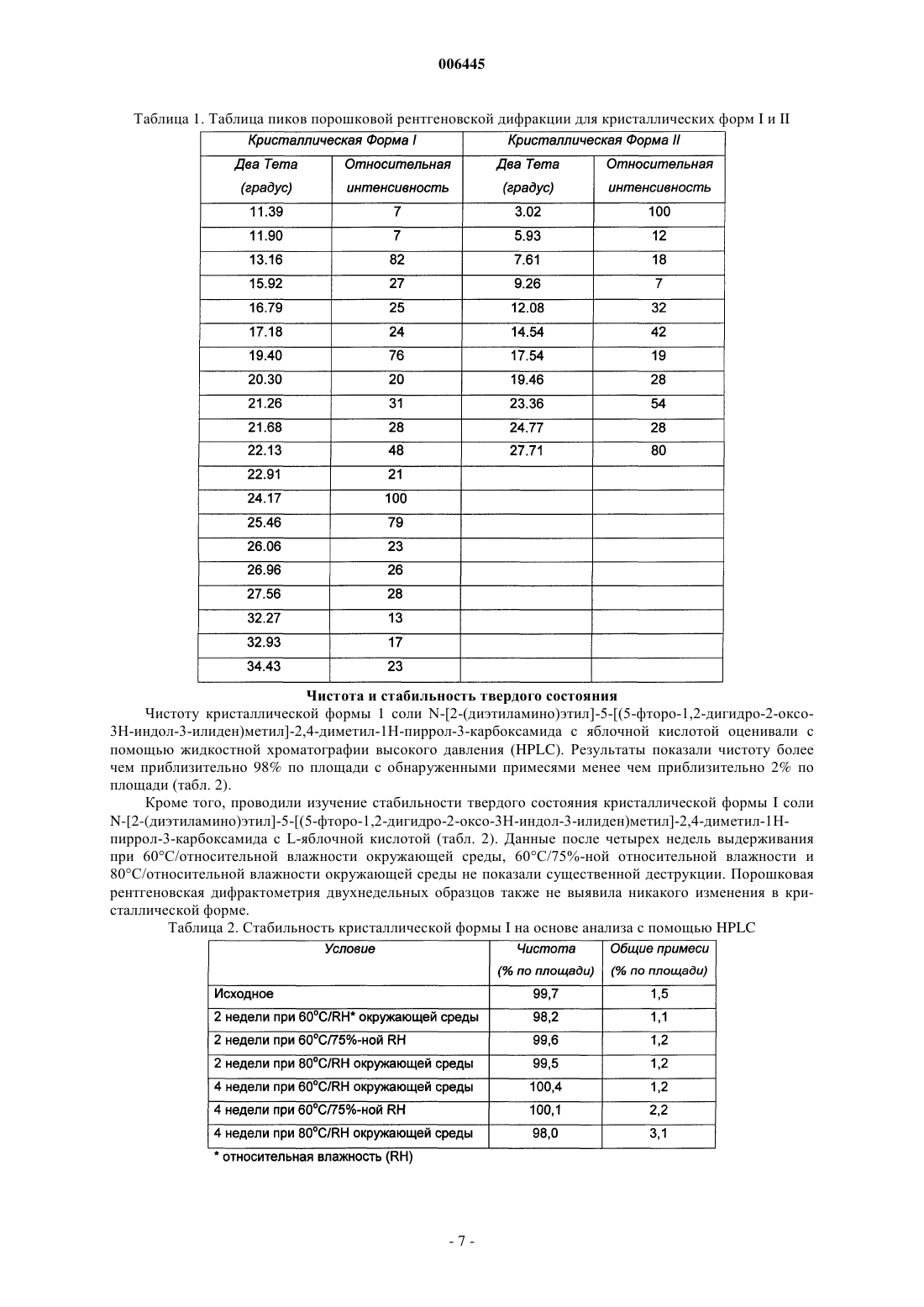
5. Кристалл по п.4, имеющий характеристические дифракционные пики на порошковой рентгеновской дифрактограмме, как перечислено в табл. 1 для кристаллической формы I.
6. Кристалл по п.3, содержащий не более чем приблизительно 2% по массе воды.
7. Кристалл по п.6, содержащий не более чем приблизительно 0,5% по массе воды.
8. Кристалл по п.7, содержащий не более чем приблизительно 0,2% по массе воды.
9. Безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет точку плавления по меньшей мере приблизительно 190шC.
10. Кристалл по п.9, имеющий точку плавления по меньшей мере приблизительно 195шC.
11. Кристалл по п.9, содержащий не более чем приблизительно 2% по массе воды.
12. Кристалл по п.11, содержащий не более чем приблизительно 0,5% по массе воды.
13. Кристалл по п.12, содержащий не более чем приблизительно 0,2% по массе воды.
14. Кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7° 2q на порошковой рентгеновской дифрактограмме.
15. Кристалл по п.14, имеющий характеристические дифракционные пики вблизи приблизительно 3.0, 12.1, 14.5 и 27.7° 2q на порошковой рентгеновской дифрактограмме.
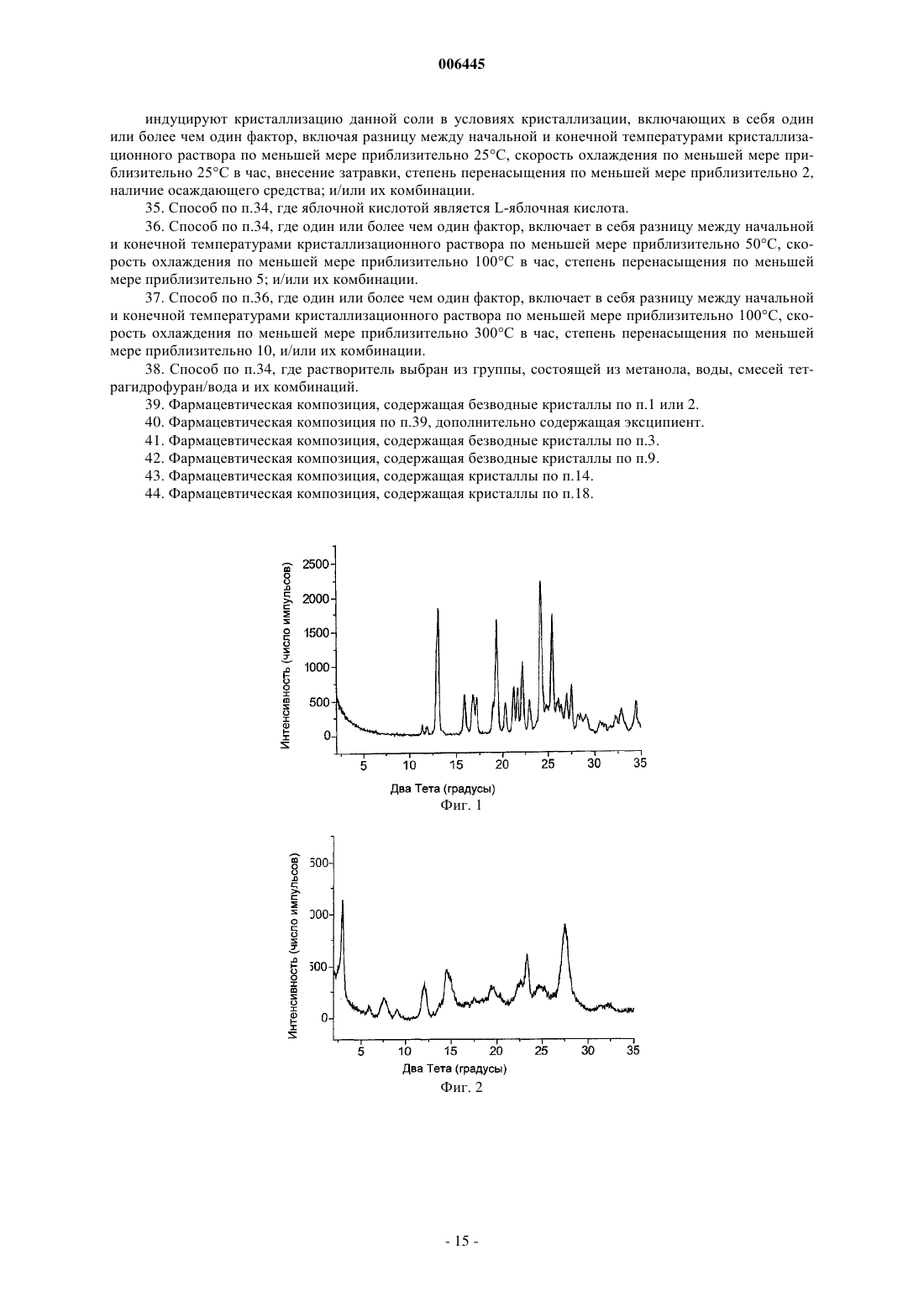
16. Кристалл по п.15, имеющий характеристические дифракционные пики на порошковой рентгеновской дифрактограмме, как перечислено в табл. 1 для кристаллической формы II.
17. Кристалл по п.14, абсорбирующий по меньшей мере приблизительно 5% по массе воды при экспонировании в условиях 80%-ной относительной влажности.
18. Кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет точку плавления не более чем приблизительно 185шC.
19. Кристалл по п.18, абсорбирующий по меньшей мере приблизительно 5% по массе воды при экспонировании в условиях 80%-ной относительной влажности.
20. Способ получения безводного кристалла по любому из пп.1-13, при котором
объединяют яблочную кислоту, N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид и растворитель и
индуцируют кристаллизацию данной соли в условиях кристаллизации, включающих в себя один или более чем один фактор, включая разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 100шC; скорость охлаждения не более чем приблизительно 50шC в час; отсутствие затравки; степень перенасыщения не более чем приблизительно 10; отсутствие осаждающего средства; и/или их комбинации.
21. Способ по п.20, где яблочной кислотой является L-яблочная кислота.
22. Способ по п.20, где один или более чем один фактор включает в себя разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 50шC; скорость охлаждения не более чем приблизительно 20шC в час; степень перенасыщения не более чем приблизительно 5; и/или их комбинации.
23. Способ по п.22, где один или более чем один фактор, включает в себя разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 25шC; скорость охлаждения не более чем приблизительно 2шC в час; степень перенасыщения не более чем приблизительно 1,5; и/или их комбинации.
24. Способ по п.23, где начальная и конечная температуры кристаллизационного раствора являются одинаковыми.
25. Способ по п.20, где растворитель выбран из группы, состоящей из ацетонитрила, метанола, этанола, изопропанола, толуола, н-бутанола, тетрагидрофурана, N,N-диметилформамида, ацетона, воды и их комбинаций.
26. Способ получения безводного кристалла по любому из пп.1-13, при котором приводят в контакт кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамида с яблочной кислотой, с растворителем, в котором приводимый в контакт кристалл имеет существенную растворимость, причем приводимый в контакт кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7° 2q на порошковой рентгеновской дифрактограмме.
27. Способ по п.26, где приводимый в контакт кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0, 12.1, 14.5 и 27.7° 2q на порошковой рентгеновской дифрактограмме.
28. Способ по п.27, где приводимый в контакт кристалл имеет характеристические дифракционные пики на порошковой рентгеновской дифрактограмме, как перечислено в табл. 1 для кристаллической формы II.
29. Способ по п.26, где растворитель выбран из группы, состоящей из ацетонитрила, этанола, метанола и их комбинаций.
30. Способ по п.26, где приведение в контакт кристалла с растворителем приводит к образованию суспензии.
31. Способ по п.30, где дополнительно осуществляют перемешивание суспензии.
32. Способ по п.30, где дополнительно осуществляют нагревание суспензии.
33. Способ по п.30, где дополнительно осуществляют удаление безводного кристалла из суспензии.
34. Способ получения кристалла по любому из пп.14-19, при котором
объединяют яблочную кислоту, N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид и растворитель и
индуцируют кристаллизацию данной соли в условиях кристаллизации, включающих в себя один или более чем один фактор, включая разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 25шC, скорость охлаждения по меньшей мере приблизительно 25шC в час, внесение затравки, степень перенасыщения по меньшей мере приблизительно 2, наличие осаждающего средства; и/или их комбинации.
35. Способ по п.34, где яблочной кислотой является L-яблочная кислота.
36. Способ по п.34, где один или более чем один фактор, включает в себя разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 50шC, скорость охлаждения по меньшей мере приблизительно 100шC в час, степень перенасыщения по меньшей мере приблизительно 5; и/или их комбинации.
37. Способ по п.36, где один или более чем один фактор, включает в себя разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 100шC, скорость охлаждения по меньшей мере приблизительно 300шC в час, степень перенасыщения по меньшей мере приблизительно 10, и/или их комбинации.
38. Способ по п.34, где растворитель выбран из группы, состоящхщ из метанола, воды, смесей тетрагидрофуран/вода и их комбинаций.
39. Фармацевтическая композиция, содержащая безводные кристаллы по п.1 или 2.
40. Фармацевтическая композиция по п.39, дополнительно содержащая эксципиент.
41. Фармацевтическая композиция, содержащая безводные кристаллы по п.3.
42. Фармацевтическая композиция, содержащая безводные кристаллы по п.9.
43. Фармацевтическая композиция, содержащая кристаллы по п.14.
44. Фармацевтическая композиция, содержащая кристаллы по п.18.
Текст
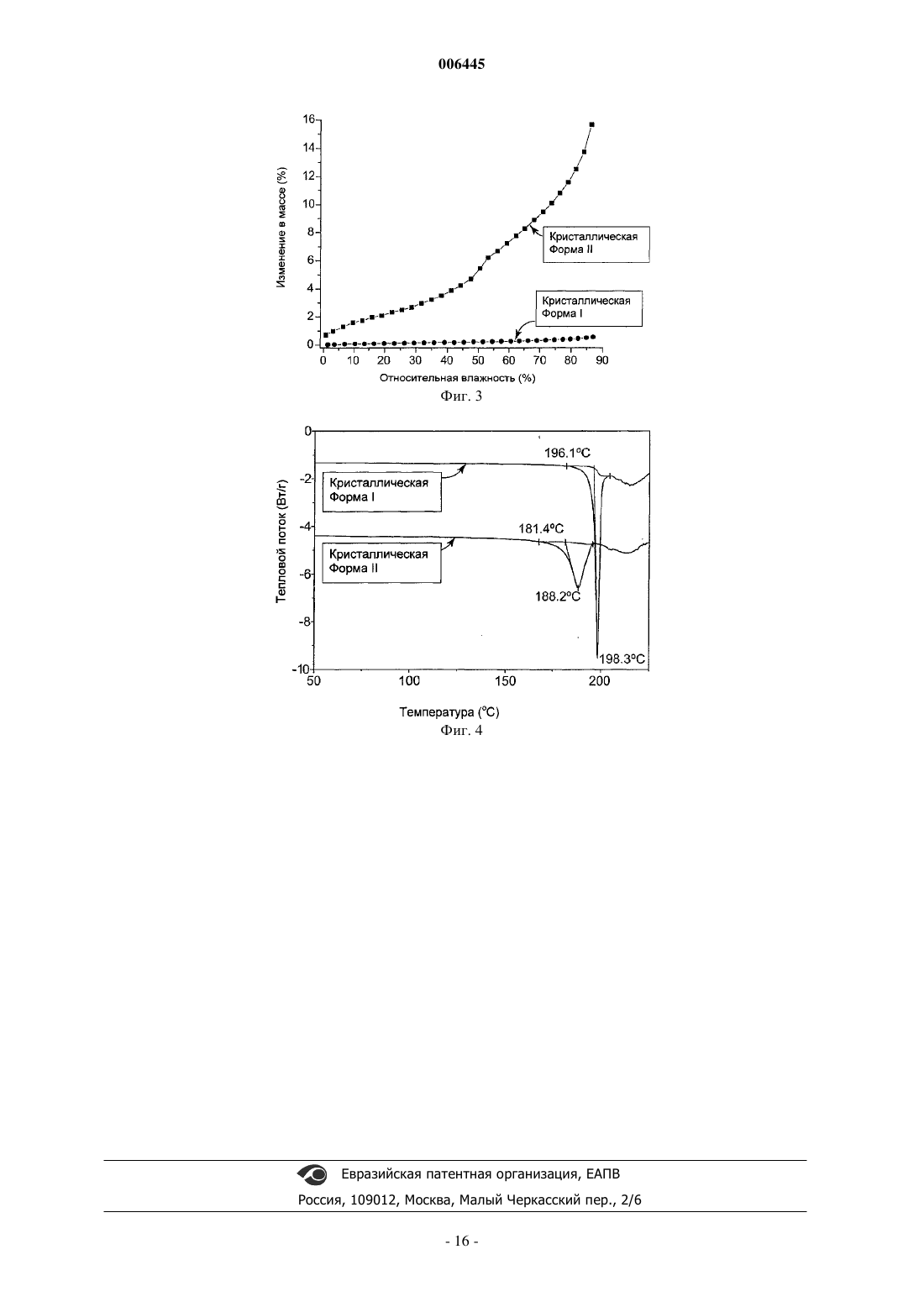
006445 Эта заявка подана на основе предварительной заявки на патент США 60/312353, поданной 15 августа 2001 г., которая введена сюда во всей своей полноте путем ссылки на нее. Область изобретения Настоящее изобретение относится к кристаллам и их композициям, причем данные кристаллы включают соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4 диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой. Кроме того, настоящее изобретение относится к способам получения таких кристаллов. Сведения о предшествующем уровне техники РК являются ферментами, которые катализируют фосфорилирование гидроксильных групп на тирозиновых, сериновых и треониновых остатках белков. Последствия этой казалось бы простой активности являются ошеломляющими: клеточный рост, дифференцировка и пролиферация, то есть фактически все аспекты жизни клетки в одном или другом направлении зависят от активности РК. Кроме того, установлена связь абнормальной активности РК с большим количеством заболеваний, лежащих в диапазоне от относительно не угрожающих жизни заболеваний, таких как псориаз, до чрезвычайно опасных, таких как глиобластома (рак мозга). РК удобным образом можно разделить на два класса - протеинтирозинкиназы (РТК, protein tyrosine kinase) и серин-треонинкиназы (STK, serine-threonine kinases). Одним из важнейших аспектов активности РТК является вовлечение их в работу рецепторов ростовых факторов. Рецепторы ростовых факторов являются белками клеточной поверхности. Будучи связанными с лигандом - ростовым фактором, рецепторы ростовых факторов превращаются в активную форму,которая взаимодействует с белками на внутренней поверхности клеточной мембраны. Это приводит к фосфорилированию по тирозиновым остаткам рецептора и других белков и к образованию внутри клетки комплексов с рядом цитоплазматических сигнальных молекул, которые, в свою очередь, осуществляют многочисленные клеточные ответы, такие как деление клетки (пролиферация), дифференцировка клетки,клеточный рост, экспрессия метаболических воздействий на внеклеточное микроокружение и т.д. Идентифицированы небольшие молекулы, действующие как ингибиторы РК, и они включают в себя, например 3-пиррол-замещенные 2-индолиноновые соединения, которые описаны в международной публикации РСТWO 01/60814 (Tang et al.). 3-Пиррол-замещенные 2-индолиноновые соединения включают в себя, например N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамид, который описан в международной публикации РСТWO 01/60814 (Tang et al.). Однако в данном описании ничего не сообщается о получении и природе специфических кристаллических форм солей N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2 оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида. Существует необходимость в кристаллических формах таких материалов, имеющих превосходные химические и/или физические свойства, которые являются полезными для доставки лекарства. Краткое описание сущности изобретения Согласно одному аспекту настоящим изобретением предложен кристалл, включающий соль яблочной кислоты соединения, имеющего структуру Соединение с представленной выше структурой также известно как N-[2-(диэтиламино)этил]-5-[(5 фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамид. Соль яблочной кислоты может быть солью D-яблочной кислоты, D,L-яблочной кислоты, L-яблочной кислоты,или их комбинациями. Предпочтительно соль яблочной кислоты является солью L-яблочной кислоты. Кристалл предпочтительно является безводным. Предпочтительно кристалл имеет характеристические дифракционные пики вблизи приблизительно 13.2 и 24.2 градуса два-тета, более предпочтительно вблизи приблизительно 13.2, 19.4, 24.2 и 25.5 градуса два-тета и наиболее предпочтительно, как перечислено в табл. 1 для кристаллической формы I на порошковой рентгеновской дифрактограмме. Предпочтительно кристалл содержит не более чем приблизительно 2% по массе воды, более предпочтительно не более чем приблизительно 0,5% по массе воды и наиболее предпочтительно не более чем приблизительно 0,2% по массе воды. Предпочтительно кристалл имеет точку плавления по меньшей мере приблизительно 190 С и более предпочтительно по меньшей мере приблизительно 195 С. Кроме того, предложены композиции,содержащие описанные здесь кристаллы. Данные композиции предпочтительно содержат терапевтически эффективное количество кристаллов. Возможно композиции содержат эксципиент, предпочтительно фармацевтически приемлемый эксципиент. Согласно другому аспекту настоящим изобретением предложен кристалл, включающий соль N-[2(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-1 006445 3-карбоксамида с яблочной кислотой, причем данный кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7 градуса два-тета, более предпочтительно вблизи приблизительно 3.0, 12.1, 14.5 и 27.7 градуса два-тета и наиболее предпочтительно, как перечислено в табл. 1 для кристаллической формы II на порошковой рентгеновской дифрактограмме. Обычно данный кристалл абсорбирует по меньшей мере приблизительно 5% по массе воды при экспонировании в условиях 80%ной относительной влажности и имеет точку плавления не более чем приблизительно 185 С. Также предложены композиции, содержащие описанные здесь кристаллы. Данные композиции предпочтительно содержат терапевтически эффективное количество кристаллов. Возможно композиции содержат эксципиент, предпочтительно фармацевтически приемлемый эксципиент. Согласно еще одному аспекту настоящим изобретением предложены способы получения безводного кристалла, содержащего соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой (например, кристаллической формы I). В одном воплощении способ включает в себя: объединение яблочной кислоты, N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3Hиндол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида и растворителя и индуцирование кристаллизации данной соли в условиях кристаллизации (например, условиях кристаллизации кристаллической формы I), включающих в себя один или более чем один фактор, включая разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 100 С; скорость охлаждения не более чем приблизительно 50 С в час; отсутствие затравки; степень перенасыщения не более чем приблизительно 10; отсутствие осаждающего средства; и/или их комбинации. Предпочтительно яблочной кислотой является L-яблочная кислота. Предпочтительно растворитель включает в себя один или более чем один растворитель, включая, например ацетонитрил,метанол, этанол, изопропанол, толуол, н-бутанол, тетрагидрофуран, N,N-диметилформамид, ацетон, воду и их комбинации. Согласно другому воплощению способ получения безводного кристалла, содержащего соль N-[2(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол 3-карбоксамида с яблочной кислотой (например, кристаллической формы I) включает в себя приведение в контакт кристалла, содержащего соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3Hиндол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, с растворителем, в котором приводимый в контакт кристалл имеет существенную растворимость, причем приводимый в контакт кристалл (например, кристаллическая форма II) имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7 градуса два-тета на порошковой рентгеновской дифрактограмме. Предпочтительно растворитель включает в себя один или более чем один растворитель, включая,например, ацетонитрил, этанол, метанол и их комбинации. Предпочтительно в результате приведения в контакт кристалла с растворителем образуется суспензия, и данную суспензию предпочтительно перемешивают и/или нагревают. Возможно безводный кристалл может быть удален из суспензии. Согласно еще одному аспекту настоящим изобретением предложен способ получения кристалла,содержащего соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой (например, кристаллической формы II). Способ включает в себя: объединение яблочной кислоты, N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2 дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида и растворителя и индуцирование кристаллизации данной соли в условиях кристаллизации (например, условиях кристаллизации кристаллической формы II), включающих в себя один или более чем один фактор, включая разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 25 С; скорость охлаждения по меньшей мере приблизительно 25 С в час; внесение затравки; степень перенасыщения по меньшей мере приблизительно 2; наличие осаждающего средства; и/или их комбинации. Предпочтительно яблочной кислотой является L-яблочная кислота. Предпочтительно растворитель включает в себя один или более чем один растворитель, включая, например, метанол, воду,смеси тетрагидрофуран/вода и их комбинации. Предпочтительно данный кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7 градуса два-тета на порошковой рентгеновской дифрактограмме. Безводная кристаллическая форма I имеет преимущества над кристаллической формой II в отношении многих приложений, поскольку свойства, предлагаемые кристаллической формой I, предпочтительно включают в себя, например более высокую термодинамическую стабильность, более высокую кристалличность и более низкую гигроскопичность, чем соответствующие свойства кристаллической формы II. Многочисленные факторы влияют на условия кристаллизации, и они хорошо известны специалисту в данной области техники. Такие факторы включают в себя, например: концентрацию соли в кристаллизационном растворе; разницу, если она имеется, между начальной и конечной температурами кристаллизационного раствора; скорость охлаждения, если оно имеет место; скорость выпаривания растворителя,если оно имеет место; внесение затравки; степень перенасыщения; и наличие осаждающего средства. С помощью руководства из предложенного здесь описания специалист в данной области техники без чрезмерного экспериментирования может выбрать и/или отрегулировать один или более чем один соответст-2 006445 вующий фактор, чтобы придти к условиям кристаллизации для получения кристаллической формы I и/или кристаллической формы II. Определения Как использовано здесь, степень перенасыщения относится к отношению концентрации материала в растворе к концентрации данного материала в насыщенном растворе при температуре кристаллизации. Как использовано здесь, внесение затравки относится к методике добавления затравочного кристалла в кристаллизационный раствор с целью стимулирования образования кристаллов. Предпочтительно состав затравочного кристалла аналогичен составу образуемых кристаллов. Как использовано здесь, осаждающее средство означает субстанцию, которая приводит к индуцированию кристаллизации при добавлении в кристаллизационный раствор. Полезные осаждающие средства включают в себя, например не-растворители для соли и растворы, содержащие избыток противоионов. Как использовано здесь, не-растворителем является растворитель, в котором данная соль предпочтительно имеет растворимость не более чем приблизительно 1% по массе, более предпочтительно не более чем приблизительно 0,1% по массе и наиболее предпочтительно не более чем приблизительно 0,01% по массе. Как использовано здесь, безводный кристалл означает кристалл, в котором вода не связана специфически. Безводные кристаллы предпочтительно не содержат существенных количеств воды. Содержание воды может быть определено с помощью известных в данной области техники способов, включая, например, титрование по Карлу Фишеру. Предпочтительно безводный кристалл содержит не более чем 2% по массе воды, более предпочтительно не более чем 0,5% по массе воды и наиболее предпочтительно не более чем 0,2% по массе воды. Как использовано здесь, кристаллический означает материал, имеющий упорядоченную, с дальним порядком, молекулярную структуру. Степень кристалличности кристаллической формы может быть определена с помощью многих методик, включая, например порошковую рентгеновскую дифрактометрию, влагопоглощение, дифференциальную сканирующую калориметрию, калориметрию в растворе и характеристики растворимости. Как использовано здесь, более кристаллический означает, что материал имеет более высокую степень кристалличности, чем материал, с которым его сравнивают. Как правило, материалы с более высокими степенями кристалличности имеют высоко упорядоченную, с дальним порядком, молекулярную структуру с меньшим количеством дефектов в кристаллической структуре, чем материалы с более низкими степенями кристалличности. Более высокая степень кристалличности может быть оценена относительно другой формы с помощью методик, включая, например, более узкие рефлексы на порошковой рентгеновской дифрактограмме, более низкое влагопоглощение для частиц похожего размера при определенной относительно влажности, более низкую теплоту растворения, более высокую теплоту плавления, более медленную скорость растворения и их комбинации. Как использовано здесь, менее кристаллический означает, что материал имеет более низкую степень кристалличности, чем материал, с которым его сравнивают. Как правило, материалы с более низкими степенями кристалличности имеют меньшую степень дальнего порядка и большее количество дефектов в кристаллической структуре, чем материалы с более высокими степенями кристалличности. Более низкая степень кристалличности может быть оценена относительно другой формы с помощью методик,включающих, например, более широкие рефлексы и/или меньшее число рефлексов на порошковой рентгеновской дифрактограмме, более высокое влагопоглощение для частиц похожего размера при определенной относительно влажности, более высокую теплоту растворения, более низкую теплоту плавления,более быструю скорость растворения и их комбинации. Как означено в настоящей заявке, стабильный в тестах по стабильности лекарственного средства(фармацевтической субстанции) означает, что по меньшей мере приблизительно 97% по массе, предпочтительно по меньшей мере приблизительно 98% по массе и более предпочтительно по меньшей мере приблизительно 99% по массе лекарственного средства (фармацевтической субстанции) остается неизмененным после хранения в указанных условиях в течение указанного времени. Краткое описание графических материалов Фиг. 1 представляет собой иллюстрацию данных порошковой рентгеновской дифрактометрии(PXRD) для кристаллической формы I соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3Hиндол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой. Данный образец отличается от других кристаллических форм соли и свободного основания и является более кристаллическим, чем кристаллическая форма II (например, фиг. 2). Фиг. 2 представляет собой иллюстрацию данных порошковой рентгеновской дифрактометрии(PXRD) для кристаллической формы II соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо 3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой. Данный образец отличается от других кристаллических форм соли и свободного основания и является менее кристаллическим, чем кристаллическая форма I, что подтверждено более широкими рефлексами на порошковой рентгеновской дифрактограмме (например, фиг. 2).-3 006445 Фиг. 3 представляет собой иллюстрацию изотермы сорбции динамической влагосорбционной гравиметрии (DMSG) для профилей влагопоглощения для кристаллической формы I и кристаллической формы II соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4 диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой. Более кристаллический полиморф, кристаллическая форма I, имеет низкую гигроскопичность, абсорбируя менее 0,5% воды в диапазоне относительной влажности 0-90%. Менее кристаллический полиморф, кристаллическая форма II, очень гигроскопичен, абсорбируя свыше 15% воды в диапазоне относительной влажности 0-90%. Фиг. 4 представляет собой иллюстрацию данных дифференциальной сканирующей калориметрии(DSC), демонстрируя DSC-профили для кристаллической формы I и кристаллической формы II соли N[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Нпиррол-3-карбоксамида с L-яблочной кислотой. Экзотермические переходы показаны в восходящем направлении. Кристаллическая форма I плавится при более высокой температуре (приблизительно 196 С) с более высокой энтальпией плавления (приблизительно 141 Дж/г), нежели кристаллическая форма II, которая плавится при приблизительно 181 С с энтальпией плавления приблизительно 105 Дж/г. Это означает, что данные две кристаллические формы монотропны, хотя после плавления кристаллов имеет место деструкция. Монотропизм подтверждается превращением кристаллической формы II в кристаллическую форму I в суспензии комнатной температуры, как описано здесь. Подробное описание предпочтительных воплощенийN-[2-(Диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил 1 Н-пиррол-3-карбоксамид может быть получен в виде свободного основания с помощью стандартных способов синтеза, включая, например, описанные в международной публикации РСТWO 01/60814(Tang et al.). Хотя данное свободное основание может быть закристаллизовано в виде небольших частиц,для крупномасштабных процессов желательно, например, иметь кристаллы большего размера для облегчения фильтрования. С этой целью осуществляли получение солей N-[2-(диэтиламино)этил]-5-[(5-фторо 1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида для оценки получающихся свойств, влияющих на обработку соли и изготовление из нее пероральных фармацевтическых композиций. Проводили скрининг кристаллических форм N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2 оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида, включая свободное основание и его соли (например соли цикламиновой кислоты, малеиновой кислоты, бромисто-водородной кислоты,миндальной кислоты, винной кислоты, фумаровой кислоты, аскорбиновой кислоты, фосфорной кислоты,соляной кислоты, п-толуолсульфоновой кислоты, лимонной кислоты и яблочной кислоты), по свойствам,касающимся процесса обработки соли и изготовления из нее пероральных фармацевтических композиций, включая, например, кристалличность (например кристаллический или аморфный, степень кристалличности, безводные или гидратированные кристаллы), токсичность, гигроскопичность, стабильность и морфологию. На основании упомянутого выше скрининга определено, что соль N-[2(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол 3-карбоксамида с яблочной кислотой обеспечивает наилучший баланс желаемых свойств. Дальнейшее исследование показало, что соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой кристаллизуется в виде множественных кристаллических форм. Согласно настоящему изобретению предложены способы получения кристаллических форм, содержащих соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4 диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, и идентификация этих кристаллических форм. Здесь описано получение безводных кристаллов, содержащих соль яблочной кислоты. Безводная кристаллическая форма I имеет лучшие свойства в отношении многих приложений. Кристаллическая форма I В одном воплощении соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой получали в виде безводных кристаллов (например, кристаллической формы I). Безводная кристаллическая форма I термодинамически более стабильна, чем другие кристаллические формы (например, кристаллическая форма II). В одном-4 006445 способе кристаллическая форма I может быть получена, например путем индуцирования кристаллизации соли яблочной кислоты в условиях кристаллизации кристаллической формы I из перенасыщенного раствора. Как использовано здесь, условия кристаллизации кристаллической формы I относятся к условиям кристаллизации, которые обеспечивают получение термодинамической кристаллической формы (например, кристаллической формы I). Такие условия обычно называют условиями медленной кристаллизации. Специалист в данной области техники может выбрать один или более чем один фактор, включая,например: разницу между начальной и конечной температурами кристаллизационного раствора предпочтительно не более чем приблизительно 100 С, более предпочтительно не более чем приблизительно 50 С, еще более предпочтительно не более чем приблизительно 25 С и наиболее предпочтительно не более чем приблизительно 0 С; скорость охлаждения предпочтительно не более чем приблизительно 50 С в час, более предпочтительно не более чем приблизительно 20 С в час, еще более предпочтительно не более чем приблизительно 2 С в час и наиболее предпочтительно не более чем приблизительно 0 С в час; отсутствие затравки; степень перенасыщения предпочтительно не более чем приблизительно 10,более предпочтительно не более чем приблизительно 5 и наиболее предпочтительно не более чем приблизительно 1,5; отсутствие осаждающего средства; и/или их комбинации для обеспечения условий кристаллизации кристаллической формы I. Полезные растворители для получения кристаллизационного раствора включают в себя, например, ацетонитрил, метанол, этанол, изопропанол, толуол, н-бутанол, тетрагидрофуран, N,N-диметилформамид, ацетон, воду и их комбинации. В другом способе кристаллическая форма I может быть получена, например путем создания суспензии кристаллической формы II в растворителях, в которых кристаллическая форма II имеет существенную растворимость. Как использовано здесь, существенная растворимость означает, что кристалл предпочтительно растворим в данном растворителе в концентрациях по меньшей мере приблизительно 0,1% по массе, более предпочтительно по меньшей мере приблизительно 1% по массе и наиболее предпочтительно по меньшей мере приблизительно 10% по массе приблизительно при комнатной температуре (например приблизительно от 15 С до приблизительно 30 С). Возможно данный кристалл может быть растворен в данном растворителе в указанной концентрации при комнатной температуре. Такие растворители включают в себя, например, ацетонитрил, этанол, метанол и их комбинации. Кристаллическая форма II В другом воплощении соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой получали в другой кристаллической форме (например, кристаллической форме II). Кристаллическая форма II полезна, например в качестве промежуточного соединения при получении безводной кристаллической формы I. Кристаллическая форма II может быть получена, например, путем индуцирования кристаллизации соли яблочной кислоты в условиях кристаллизации кристаллической формы II из перенасыщенного раствора. Как использовано здесь, условия кристаллизации кристаллической формы II относятся к условиям кристаллизации, которые обеспечивают получение кристаллической формы, отличающейся от термодинамической формы. Такие условия обычно называют условиями быстрой кристаллизации. Специалист в данной области техники может выбрать один или более чем один фактор, включая, например, разницу между начальной и конечной температурами кристаллизационного раствора предпочтительно по меньшей мере приблизительно 25 С, более предпочтительно по меньшей мере приблизительно 50 С и наиболее предпочтительно по меньшей мере приблизительно 100 С; скорость охлаждения предпочтительно по меньшей мере приблизительно 25 С в час, более предпочтительно по меньшей мере приблизительно 100 С в час и наиболее предпочтительно по меньшей мере приблизительно 300 С в час; введение затравки; степень перенасыщения предпочтительно по меньшей мере приблизительно 2, более предпочтительно по меньшей мере приблизительно 5 и наиболее предпочтительно по меньшей мере приблизительно 10; наличие осаждающего средства; и/или их комбинации для обеспечения условий кристаллизации кристаллической формы II. Полезные растворители для кристаллизационного раствора включают в себя, например, метанол,воду, смеси тетрагидрофуран/вода и их комбинации. Порошковая рентгеновская дифракция Кристаллические органические соединения состоят из большого числа атомов, которые расположены периодично в трехмерном пространстве. Обычно такая периодичность структуры обнаруживает индивидуальные физические свойства, такие как четкие, точные спектральные характеристики, в большинстве спектроскопических исследований (например рентгеновская дифракция, инфракрасная спектроскопия и ЯМР твердого тела). Общепризнано, что рентгеновская дифракция (XRD) является одним из наиболее чувствительных методов определения кристалличности твердых веществ. Кристаллы дают точные дифракционные максимумы, которые появляются вблизи специфических углов, согласующихся с межплоскостными расстояниями решетки, как предсказано согласно закону Брэгга (Вragg). Аморфные материалы, наоборот, не обладают дальним порядком. Зачастую они сохраняют дополнительный объем меж-5 006445 ду молекулами, как в жидком состоянии. Аморфные твердые вещества обычно дают невыразительную рентгенограмму с уширенными, размытыми ореолами вследствие отсутствия дальнего порядка повторяющейся кристаллической решетки. Как сообщают, порошковую рентгеновскую дифракцию использовали для характеристики различных кристаллических форм органических соединений (например соединений, полезных в фармацевтических композициях). Смотри, например патенты США 5504216 (Holohan et al.), 5721359 (Dunn et al.),5910588 (Wangnick et al.), 6066647 (Douglas et al.), 6225474 (Matsumoto et al.), 6239141 (Allen et al.),6251355 (Murata et al.), 6288057 (Harkness), 6316672 (Stowell et al.), 6329364 (Groleau) и публикации заявок на патент США 2001/0003752 (Talley et al.), 2002/0038021 (Barton et al.) и 2002/0045746 (Bartonet al.). Кристаллические материалы предпочтительны для многих фармацевтических приложений. Как правило, кристаллические формы термодинамически более стабильны, нежели аморфные формы той же самой субстанции. Эта термодинамическая стабильность предпочтительно выражена в более низкой растворимости и улучшенной физической стабильности кристаллической формы. Регулярная упаковка молекул в кристаллическом твердом веществе предпочтительно препятствует внедрению химических примесей. Следовательно, кристаллические материалы, как правило, имеют более высокую химическую чистоту, нежели их аморфные копии. Упаковка в кристаллическом твердом веществе, как правило, вынуждает молекулы занимать вполне определенные положения в кристаллической решетке и уменьшает молекулярную подвижность, которая является необходимым условием для химических реакций. Следовательно, кристаллические твердые вещества при очень небольшом количестве заметных исключений более стабильны химически, нежели аморфные твердые вещества того же молекулярного состава. Кристаллические формы солей N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, описанные в настоящей заявке, предпочтительно обладают одним или более чем одним преимущественным химическим и/или физическим свойством, описанным здесь. Кристаллические формы солей N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол 3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, описанные в настоящей заявке, предпочтительно имеют индивидуальные профили порошковой рентгеновской дифракции. Например, безводные кристаллы, содержащие соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2 оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, предпочтительно могут отличаться от другой кристаллической формы, содержащей описанную здесь соль яблочной кислоты, наличием характеристических дифракционных пиков. Характеристические дифракционные пики, как использовано здесь, являются пиками, выбранными из наиболее интенсивных пиков снятой дифрактограммы. Предпочтительно характеристические пики выбраны приблизительно из 20 наиболее интенсивных пиков, более предпочтительно из 10 наиболее интенсивных пиков и наиболее предпочтительно из 5 наиболее интенсивных пиков дифрактограммы. На фиг. 1 и 2 показаны порошковые рентгеновские дифрактограммы для кристаллических форм I иII, соответственно, соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-и ндол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой. В табл. 1 дается перечень наиболее интенсивных пиков на каждой дифрактограмме между 2 и 35 градусами два тета. Свободное основание, кристаллическая форма I и кристаллическая форма II все легко различимы по их уникальным ренгеновским порошковым дифрактограммам. Предпочтительно безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2 дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой(например, кристаллическая форма I), имеет характеристические дифракционные пики вблизи приблизительно 13.2 и 24.2 градуса два-тета, более предпочтительно вблизи приблизительно 13.2, 19.4, 24.2 и 25.5 градуса два-тета и наиболее предпочтительно имеет характеристические дифракционные пики, перечисленные в табл. 1 для кристаллической формы I. Предпочтительно кристаллическая форма II соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро 2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7 градуса два-тета, более предпочтительно вблизи приблизительно 3.0, 12.1, 14.5 и 27.7 градуса два-тета и наиболее предпочтительно имеет характеристические дифракционные пики, перечисленные в табл. 1 для кристаллической формы II.-6 006445 Таблица 1. Таблица пиков порошковой рентгеновской дифракции для кристаллических форм I и II Чистота и стабильность твердого состояния Чистоту кристаллической формы 1 соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо 3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой оценивали с помощью жидкостной хроматографии высокого давления (HPLC). Результаты показали чистоту более чем приблизительно 98% по площади с обнаруженными примесями менее чем приблизительно 2% по площади (табл. 2). Кроме того, проводили изучение стабильности твердого состояния кристаллической формы I солиN-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Нпиррол-3-карбоксамида с L-яблочной кислотой (табл. 2). Данные после четырех недель выдерживания при 60 С/относительной влажности окружающей среды, 60 С/75%-ной относительной влажности и 80 С/относительной влажности окружающей среды не показали существенной деструкции. Порошковая рентгеновская дифрактометрия двухнедельных образцов также не выявила никакого изменения в кристаллической форме. Таблица 2. Стабильность кристаллической формы I на основе анализа с помощью HPLC-7 006445 Данные по влагопоглощению Данные по влагопоглощению при 25 С для кристаллических форм I и II соли N-[2(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол 3-карбоксамида с L-яблочной кислотой показаны на фиг. 3. Более кристаллический полиморф, кристаллическая форма I, имеет низкую гигроскопичность, абсорбируя менее 0,5% воды в диапазоне относительной влажности 0-90%. Менее кристаллический полиморф, кристаллическая форма II, очень гигроскопичен, абсорбируя свыше 15% воды в диапазоне относительной влажности 0-90%. Данные термического анализа Данные дифференциальной сканирующей калориметрии показаны на фиг. 4. Безводная кристаллическая формаN-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой плавится при приблизительно 196 С, в то время как кристаллическая форма II плавится при приблизительно 181 С. События,наблюдаемые после первоначального расплавления, говорят о вероятном наличии некоторой деструкции,ассоциированной с расплавлением. Поэтому точное значение теплоты плавления не может быть легко измерено.TGA-данные для кристаллической формы I (не показаны) не показывали значительной потери в массе вплоть до точки плавления, демонстрируя отсутствие оставшихся растворителя и/или воды, удерживаемых в кристаллах. Способы введения и фармацевтические композиции Кристаллы по настоящему изобретению могут быть введены пациенту человеку как таковые или могут быть введены в фармацевтических композициях, в которых упомянутые выше кристаллы смешаны с подходящими носителями или эксципиентом(ами). Методики приготовления и введения лекарств могут быть найдены в последнем издании Remington's Pharmacological Sciences, Mack Publishing Co.,Easton, PA. Как использовано здесь, вводить или введение относится к доставке кристалла по настоящему изобретению или его фармацевтической композиции организму с целью предупреждения или лечения связанного с РК расстройства. Подходящие способы введения могут включать в себя пероральное, ректальное введение, введение через слизистые или через кишечник, либо внутримышечную, подкожную, интрамедулярную, интратекальную, прямую внутрижелудочковую, внутривенную, интравитреальную, внутрибрюшинную, интраназальную или внутриглазную инъекции, но ими не ограничиваются. Предпочтительными способами введения являются пероральный и парентеральный. Альтернативно, кристалл по настоящему изобретению или его фармацевтическую композицию можно скорее ввести локальным, чем системным образом, например посредством инъекции кристалла по настоящему изобретению или его фармацевтической композиции непосредственно в твердую опухоль,зачастую в виде депо или препарата непрерывного высвобождения. Кроме того, данное лекарственное средство можно ввести в системе целевой доставки лекарственного средства, например в липосоме с покрытием, содержащим опухолеспецифическое антитело. Данные липосомы будут нацелены на опухоль и селективно ею поглощены. Фармацевтические композиции по настоящему изобретению могут быть изготовлены согласно способам, хорошо известным в данной области техники, например посредством традиционных способов смешивания, растворения, гранулирования, дражирования, растирания в порошок, эмульгирования, инкапсулирования, включения (внутрь чего-либо) или лиофилизации. Фармацевтические композиции для использования в соответствии с настоящим изобретением могут быть изготовлены традиционным образом с использованием одного или более чем одного физиологически приемлемого носителя, включая эксципиенты и вспомогательные вещества, облегчающие обработку кристаллов по настоящему изобретению при приготовлении препаратов, которые могут быть использованы фармацевтически. Надлежащая форма препарата зависит от выбранного пути введения. Для инъекции кристалл по настоящему изобретению или его фармацевтическая композиция могут быть изготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический солевой буфер. Для введения через слизистые в препарате используют способствующие проникновению вещества, соответствующие барьеру, через который следует проникать. В целом, такие способствующие проникновению вещества известны в данной области техники. Для перорального введения кристалл по настоящему изобретению или его фармацевтическая композиция могут быть изготовлены посредством объединения кристалла по настоящему изобретению с фармацевтически приемлемыми носителями, хорошо известными в данной области техники. Такие носители делают возможным приготовление кристаллов по настоящему изобретению в виде таблеток, пилюль, лепешек, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и им подобного для перорального приема внутрь пациентом. Фармацевтические препараты для перорального применения могут быть изготовлены с использованием твердого эксципиента, возможно размалывания получающейся смеси и обработки смеси гранул после добавления, при желании, других подходящих вспомогательных ве-8 006445 ществ с целью получения таблеток или сердцевин драже. Полезными эксципиентами являются, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит, препараты целлюлозы, такие как, например, кукурузный крахмал, зерновой крахмал, рисовый крахмал и картофельный крахмал, и другие материалы, такие как желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон (PVP). При желании могут быть добавлены разрыхлители, такие как перекрестно-сшитый поливинилпирролидон,агар или альгиновая кислота. Также может быть использована такая соль, как альгинат натрия. Сердцевины драже снабжены подходящими покрытиями. Для этой цели могут быть использованы концентрированные сахарные растворы, которые возможно могут содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, глазировочные растворы и подходящие органические растворители либо смеси растворителей. Для идентификации или для характеристики различных комбинаций активных доз в таблетки или покрытия для драже могут быть добавлены красящие вещества или пигменты. Фармацевтические композиции, которые могут быть использованы перорально, включают в себя капсулы push-fit, изготовленные из желатина, равно как и мягкие, запечатанные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Push-fit капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующим, таким как крахмал, и/или смазывающим веществом, таким как тальк или стеарат магния, и возможно, стабилизаторами. В мягких капсулах кристаллы по настоящему изобретению могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, в эти препараты могут быть добавлены стабилизаторы. Капсулы могут быть упакованы в стеклянные или пластиковые бутылки коричневого цвета для защиты кристаллов по настоящему изобретению или их фармацевтических композиций от света. Контейнеры, содержащие активный препарат в капсулах, должны храниться при контролируемой комнатной температуре (например от приблизительно 15 С до приблизительно 30 С). Для введения путем ингаляции кристалл по настоящему изобретению или его фармацевтическую композицию удобно доставлять в форме аэрозольного спрея, используя находящуюся под давлением упаковку или небулайзер и подходящий пропеллант, например дихлордифторметан, трихлорфторметан,дихлортетрафторэтан или двуокись углерода, но не ограничиваясь ими. В случае находящейся под давлением аэрозоли стандартная дозировка может регулироваться обеспечением клапаном с целью доставки отмеренного количества. Капсулы и картриджи, например желатина, для использования в ингаляторе или инсуффляторе могут быть изготовлены содержащими порошковую смесь кристалла по настоящему изобретению или его фармацевтической композиции и подходящей порошковой основы, такой как лактоза или крахмал. Кроме того, кристалл по настоящему изобретению или его фармацевтическая композиция могут быть приготовлены для парентерального введения, например путем болюс-инъекции или непрерывной инфузии. Препараты для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или мульти-дозовых контейнерах, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в маслянистых либо водных носителях,и могут содержать такие составляющие препарат материалы, как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические композиции для парентерального введения включают в себя водные растворы водорастворимой формы кристалла по настоящему изобретению или его фармацевтической композиции. Вдобавок, суспензии кристаллов по настоящему изобретению или их фармацевтических композиций могут быть приготовлены в липофильном наполнителе. Подходящие липофильные наполнители включают в себя жирные масла, такие как кунжутное масло, синтетические эфиры жирных кислот, такие как этилолеат и триглицериды, или такие материалы, как липосомы. Водные суспензии для инъекций могут содержать вещества, увеличивающие вязкость суспензии, такие как натриевая соль карбоксиметилцеллюлозы, сорбит или декстран. Возможно суспензии также могут содержать подходящие стабилизаторы и/или агенты, увеличивающие растворимость кристалла по настоящему изобретению или его фармацевтической композиции, что позволяет получить высоко концентрированные растворы. Альтернативно, активный ингредиент может быть в порошковой форме для составления (препарата) с подходящим носителем, например со стерильной апирогенной водой, перед использованием. Кроме того, кристалл по настоящему изобретению или его фармацевтическая композиция могут быть приготовлены в виде ректальной композиции, такой как суппозитории или удерживающие клизмы,с использованием, например, традиционных основ для суппозиториев, таких как масло какао или другие глицериды. В дополнение к описанным ранее препаратам кристалл по настоящему изобретению или его фармацевтическая композиция также могут быть приготовлены как препараты в виде депо. Такие препараты длительного действия могут быть введены посредством имплантации (например подкожно или внутримышечно) или посредством внутримышечной инъекции. Кристалл по настоящему изобретению или его фармацевтическая композиция могут быть изготовлены для данного способа введения с подходящими-9 006445 полимерными или гидрофобными материалами (например в виде эмульсии с фармакологически приемлемым маслом), с ионообменными смолами или в виде труднорастворимого производного. Вдобавок, кристалл по настоящему изобретению или его фармацевтическая композиция могут быть доставлены с использованием системы поддерживаемого высвобождения, такой как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих терапевтический агент. Различные материалы поддерживаемого высвобождения определены и хорошо известны специалистам в данной области техники. Капсулы поддерживаемого высвобождения могут, в зависимости от их химической природы,высвобождать соль или ее фармацевтическую композицию в продолжение от нескольких недель вплоть до более 100 суток. В зависимости от химической природы и биологической стабильности терапевтического реагента могут быть использованы дополнительные стратегии стабилизации белков. Представленные здесь фармацевтические композиции также могут включать в себя подходящие твердо- или гелефазные носители или эксципиенты. Примеры таких носителей или эксципиентов включают в себя карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы,желатин и такие полимеры, как полиэтиленгликоли, но не ограничиваются ими. Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают в себя композиции, в которых активные ингредиенты содержатся в количестве, достаточном для достижения планируемой цели, то есть регулирования активности РК или лечения либо предупреждения связанного с РК расстройства. Более конкретно, терапевтически эффективное количество означает количество кристаллов по настоящему изобретению или их фармацевтических композиций, эффективных для предупреждения, смягчения или улучшения симптомов заболевания или пролонгирования жизнеспособности подвергаемого лечению субъекта. Определение терапевтически эффективного количества находится в пределах способности специалистов в данной области техники, в особенности в свете предложенного здесь подробного описания. Для любых кристаллов по настоящему изобретению или их фармацевтических композиций, используемых в способах по изобретению, терапевтически эффективное количество или доза могут быть оценены сначала из анализов на клеточных культурах. Затем данная дозировка может быть приготовлена в виде препарата для использования в животных моделях с тем, чтобы достичь интервала концентрации в кровотоке, который включает в себя IC50, определенную на клеточной культуре (то есть концентрацию кристаллов по настоящему изобретению или их фармацевтических композиций, при которой достигается ингибирование половины от максимальной активности РК). Затем такая информация может быть использована для более точного определения полезных для людей доз. Токсичность и терапевтическая эффективность кристаллов по настоящему изобретению или их фармацевтических композиций может быть определена с помощью стандартных фармацевтических способов на клеточных культурах или экспериментальных животных, например путем определения IC50 иLD50 (обе из которых обсуждены здесь в другом месте) для подвергаемого испытанию кристалла по настоящему изобретению или его фармацевтической композиции. Данные, полученные из этих анализов на клеточных культурах и исследованиях на животных, могут быть использованы при определении интервала дозирования для использования на людях. Дозировка может варьировать в зависимости от используемой лекарственной формы и применяемого способа введения. Точный состав препарата, способ введения и дозировка могут быть выбраны персональным врачом, принимая во внимание состояние пациента (См., например Fingl, et al., 1975, в The Pharmacological Basis of Therapeutics, Ch. 1, p. 1). Количество дозы и интервал дозирования могут быть подобраны индивидуально с целью обеспечения уровней активного вещества в плазме, достаточных для поддержания регулирующих киназу эффектов. Эти уровни в плазме относятся к минимально эффективным концентрациям (МЕС). МЕС будет различна для каждого кристалла по настоящему изобретению или его фармацевтической композиции, но может быть оценена из данных in vitro, например концентрация, необходимая для достижения 50-90%ного ингибирования киназы, может быть установлена с использованием описанных здесь анализов. Дозировки, необходимые для достижения данной МЕС, будут зависеть от индивидуальных характеристик и способа введения. Для определения концентраций в плазме могут быть использованы анализы с помощью HPLC или биологические испытания. Дозировочные интервалы также могут быть определены с использованием значения МЕС. Кристалл по настоящему изобретению или его фармацевтическую композицию следует вводить с использованием схемы, которая поддерживает уровни в плазме выше МЕС в течение 10-90% определенного времени,предпочтительно между 30-90% и наиболее предпочтительно между 50-90%. В случаях местного введения или селективного поглощения эффективная местная концентрация лекарственного средства может быть не связана с концентрацией в плазме, и для определения корректного количества дозы и интервала дозирования могут быть использованы другие способы, известные в данной области техники. Количество вводимой композиции, несомненно, будет зависеть от подвергаемого лечению субъекта, серьезности недуга, способа введения, мнения назначающего лекарства врача и т.д.- 10006445 При желании композиции могут быть представлены в виде упаковки или дозатора, такого как одобренный FDA набор, который может включать в себя одну или более чем одну стандартную лекарственную форму, содержащую активный ингредиент. Упаковка может, например включать в себя металлическую или пластиковую фольгу, как например блистерная упаковка. Упаковка или дозатор могут быть снабжены инструкциями по применению. Упаковка или дозатор могут снабжаться прикрепленным к контейнеру уведомлением в форме, предписанной правительственной службой, регулирующей производство, применение или продажу фармацевтических средств, причем в этом уведомлении отражено одобрение данной службой формы композиций или применения для людей или ветеринарного применения. Такое уведомление, например, может быть с маркировкой, утвержденной Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств США, для прописываемых по рецептам лекарств или в виде утвержденной листовки-вкладыша на продукт. Композиции, содержащие кристалл по настоящему изобретению, изготовленный в виде препарата в совместимом фармацевтическом носителе, также могут быть приготовлены, помещены в соответствующий контейнер и промаркированы для лечения показанного состояния. Подходящие состояния, указанные на маркировке,могут включать в себя лечение опухоли, ингибирование ангиогенеза, лечение фиброза, диабета и им подобного. Кроме того, аспект данного изобретения состоит в том, что кристалл по настоящему изобретению или его фармацевтическая композиция могли бы быть скомбинированы с другими химиотерапевтическими агентами для лечения заболеваний и расстройств, обсужденных выше. Например, кристалл по настоящему изобретению или его фармацевтическая композиция могли бы быть скомбинированы с алкилирующими агентами, такими как фторурацил (5-FU) или дополнительно в комбинации с лейковорином; или другими алкилирующими агентами, такими как другие пиримидиновые аналоги, например UFT, капецитабин, гемцитабин и цитарабин, алкилсульфонаты, например бисульфан (используемый при лечении хронического гранулоцитарного лейкоза), импросульфан и пипосульфан; азиридинами, например бензодепа, карбоквоном, метуредепа и уредепа; этилениминами и метилмеламинами, например алтретамином, триэтиленмеламином, триэтиленфосфорамидом, триэтилентиофосфорамидом и триметилолмеламином; и мустинами, например хлорамбуцилом (используемым при лечении хронического лимфоцитарного лейкоза, первичной макроглобулинемии и лимфомы не по типу болезни Ходжкина), циклофосфамидом (используемым при лечении болезни Ходжкина, множественной миеломы, нейробластомы,рака молочной железы, рака яичников, рака легких, опухоли Вильмса и рабдомиосаркомы), эстрамустином, ифосфамидом, новэмбрихином, преднимустином и урацилсодержащим мустином (используемой при лечении первичного тромбоцитоза, лимфомы не по типу болезни Ходжкина, болезни Ходжкина и рака яичников); и триазинами, например дакарбазином (используемым при лечении саркомы мягких тканей), но этим списком агенты не ограничиваются. Кроме того, кристалл по настоящему изобретению или его фармацевтическая композиция могут быть использованы в комбинации с другими антиметаболическими химиотерапевтическими агентами,такими как аналоги фолиевой кислоты, например метатрексат (используемый при лечении острого лимфоцитарного лейкоза, хориокарциномы, грибовидных микозов, рака молочной железы, рака головы и шеи и остеогенной саркомы) и птероптерин, и пуриновые аналоги, такие как меркаптопурин и тиогуанин, которые находят применение при лечении острого гранулоцитарного, острого лимфоцитарного и хронического гранулоцитарного лейкозов, но этим списком агенты не ограничиваются. Также предполагается, что кристалл по настоящему изобретению или его фармацевтическая композиция могут быть использованы в комбинации с химиотерапевтическими агентами на основе природных продуктов, такими как винкаалкалоиды, например винбластин (используемый при лечении рака молочной железы и тестикулярного рака), винкристин и виндезин; эпиподофилотоксины, например этопозид и тенипозид, каждый из которых полезен при лечении тестикулярного рака и саркомы Капоши; антибиотические химиотерапевтические агенты, например даунорубицин, доксорубицин, эпирубицин, митомицин (используемый при лечении рака желудка, шеи, толстой кишки, молочной железы, мочевого пузыря и поджелудочной железы), дактиномицин, темозоломид, пликамицин, блеомицин (используемый при лечении рака кожи, пищевода и мочеполового тракта); и ферментные химиотерапевтические агенты, такие как L-аспарагиназа, но не ограничиваются ими. В дополнение к упомянутому выше кристалл по настоящему изобретению или его фармацевтическая композиция также могли бы быть использованы в комбинации с координационными комплексами на основе платины (цисплатином и т.д.); замещенными мочевинами, такими как гидроксимочевина; метилгидразиновыми производными, например прокарбазином; адренокортикальными супрессантами, например митотаном, аминоглутетимидом; и гормонами и антагонистами гормонов, такими как адренокортикостероиды (например преднизон), прогестины (например гидроксипрогестерона капроат); эстрогенами (например диэтилстилбестролом); антиэстрогенами, такими как тамоксифен; андрогенами, например тестостерона пропионат; и ингибиторами ароматазы, такими как анастрозол. И наконец, также предполагается, что комбинация кристалла по настоящему изобретению или его фармацевтической композиции будет эффективна в комбинации с митоксантроном или паклитакселем- 11006445 для лечения рака в виде солидной опухоли или лейкозов, таких как острый миелогенный (нелимфоцитарный) лейкоз, но не ограничиваются ими. Настоящее изобретение проиллюстрировано следующими далее примерами. Очевидно, что конкретные примеры, материалы, количества и способы следует интерпретировать широко в соответствии с объемом и сущностью данного изобретения, как они сформулированы здесь. Примеры Рентгеновские дифрактограммы (XRD) снимали на дифрактометре Scintag Х 2 (Тhеrmо ARL,Ecublens, Швейцария), оборудованном тета-тета гониометром. Точки плавления определяли, используя дифференциальный сканирующий калориметр ТА Instruments 2920 (ТА Instruments, New Castle, DE) со стандартными гофрированными кюветами и скоростью нагревания 10 С/мин. Гигроскопичность оценивали с помощью динамической влагосорбционной гравиметрии (DMSG), используя микровесы с управляемой газовой средой (атмосферой) (Pharmacia Corp., Kalamazoo, MI). Все используемые химические реактивы, если не оговорено особо, от фирмы Aldrich Chemical Co., Milwaukee, WI. N-[2(Диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол 3-карбоксамид получали в виде свободного основания с помощью методики, подобной описанной в примере 80 международной публикации РСТWO 01/60814 (Tang et al.). Методы Порошковая рентгеновская дифракция. Порошковую рентгеновскую дифрактометрию осуществляли, используя Scintag X2 Advanced Diffraction System, действующую с программным обеспечением Scintag DMS/NT 1.30 а и Microsoft Windows NT 4.0. Система использует медный источник рентгеновских лучей, эксплуатируемый при 45 кВ и 40 МА для обеспечения СuK(1)-излучения на длине волны 1,5406 ,и твердотельный охлаждаемый детектор Peltier. Апертуру луча контролировали, используя ширину щелей расхождения трубки и противорассеивающей щели трубки равными 2 и 4 мм, а ширину противорассеивающей и приемной щелей детектора равными 0,5 и 0,2 мм. Данные собирали для интервала от 2 до 35 два-тета, используя шаговое сканирование 0,03/точка со временем счета одна секунда на шаг. В экспериментах использовали круглые, загружаемые сверху чашки Scintag для образца из нержавеющей стали со вставками диаметром 12 мм. Лекарственную субстанцию использовали в качестве образца в том виде, в котором оно было, и помещали в поддон для образца без какой-либо подготовки. Некоторые отдельные образцы кроме этого перед измерением растирали вручную пестиком в ступке. Анализ данных завершали с использованием Origin 6.0 (Microcal Software, Northampton MA). Динамическая влагосорбционная гравиметрия (DMSG) Изотермы DMSG снимали на микровесах с управляемой по температуре газовой средой (атмосферой). Для взвешивания использовали приблизительно 10 мг образцов. Измерения образцов производили по мере их получения. Влажность последовательно устанавливали между 0 и 90%-ной относительной влажностью (RH) с шагом RH 3%. Затем каждые две минуты производили измерение массы. Значение RH изменяли на следующее, когда масса образца оставалась стабильной в пределах 0,5 мкг в течение 480 с. Для управления сбором данных и выведения информации в электронную таблицу Excel применяли программу Visual Basic. Термический анализ Данные дифференциальной сканирующей калориметрии (DSC) получали путем опрессовки порошкового образца в алюминиевом сосуде для DCS. Измерения образцов производили по мере их получения,размер образцов составлял приблизительно 1 мг. Температуру обычно изменяли до 320 С со скоростью сканирования 10 С в минуту. DSC проводили на калориметре ТА Instruments 2920. В качестве программного обеспечения для анализа данных использовали Universal Analysis V 1. 1 OВ для ТА. Данные термогравиметрического анализа (TGA) получали на ТА Instruments TGA 2950. Образцы уравновешивали в TGA при 25 С с точкой росы 20 С в течение 30 мин перед началом температурной программы. Температурный уклон составлял 10 С/мин, но сканировался в условиях собственного высокого разрешения ТА. Данная методика уменьшает скорость сканирования при наличии перехода, улучшая возможность прибора разрешать независимые события, связанные с потерей массы. Пример 1. Получение безводной кристаллической формы I соли N-[2-(диэтиламино)этил]-5-[(5 фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида сLяблочной кислотой Способ получения А: N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамид (130 мг; 0,326 ммоль) добавляют к 20 мл метанола и смесь перемешивают. Добавляют L-яблочную кислоту (47,2 мг; 0,352 ммоль), что приводит к быстрому растворению всех твердых материалов. Метанол удаляют при пониженном давлении, получая твердое вещество оранжевого цвета с плохой кристалличностью. Добавляют ацетонитрил (5 мл) и суспензию перемешивают и нагревают в течение приблизительно 10 мин. Перемешивание продолжают до тех пор, пока суспензия не охладится до комнатной температуры. Кристаллы отфильтровывают и высушивают, получая в результате 149 мг твердого вещества (86%-ный выход) кристаллической формы I. Способ получения Б. N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамид перед образованием соли с L-яблочной кислотой может быть очищен с помощью водной промывки при рН=11. Раствор свободного основания в смеси 80:20 н- 12006445 бутанол/вода (%) получают при 80 С. После охлаждения до 20 С и перемешивания в течение 1 ч наблюдают значительную кристаллизацию. Образец анализируют с помощью PXRD и анализ показывает, что это кристаллическая форма I. Фильтрование, высушивание и совместное размельчение кристаллов приводит к 99%-ному выходу. Пример 2. Получение кристаллической формы II соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2 дигидро-2-оксо-3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой. Кристаллы кристаллической формы I соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2 оксо-3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой (25 мг) добавляют к тетрагидрофурану (2 мл) с последующим добавлением воды (250 мкл). Смесь нагревают для растворения кристаллов. Растворитель оставляют выпариваться в течение ночи, получая в результате кристаллы кристаллической формы II. Пример 3. Получение безводной кристаллической формы I соли N-[2-(диэтиламино)этил]-5-[(5 фторо-1,2-дигидро-2-оксо-3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида сLяблочной кислотой из кристаллической формы II. Ацетонитрил (приблизительно 5 мл) добавляют к кристаллической форме II (150 мг). Суспензию перемешивают и нагревают в течение приблизительно 10 мин. Перемешивание продолжают, позволяя суспензии охладиться до комнатной температуры. Кристаллы отфильтровывают и высушивают, получая в результате кристаллы кристаллической формы I. Пример 4. Растворимость кристаллической формы I соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2 дигидро-2-оксо-3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой. Растворимость кристаллической формы I соли N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2 оксо-3H-индол-3-илиден)-метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с L-яблочной кислотой в воде по результатам измерения составляет 5 мг/мл при 25 С. Это указывает на то, что растворимость не будет являться лимитирующим фактором биодоступности данного материала. Полное описание всех цитируемых здесь патентов, заявок на патент и публикаций, и материалов,доступных в электронном виде (например представления аминокислотных и нуклеотидных последовательностей GenBank; и представления банка данных по белкам (pdb введено посредством ссылки. Предшествующее подробное описание и примеры даны только для доходчивости понимания. Их не следует понимать как какие-либо ненужные ограничения. Данное изобретение не ограничено в отношении показанных и описанных точных деталей, вариации, очевидные специалисту в данной области техники,будут включены в пределы данного изобретения, определенного посредством формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо 3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида, имеющего структуру с яблочной кислотой. 2. Кристалл по п.1, где яблочной кислотой является L-яблочная кислота. 3. Безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо 3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет характеристические дифракционные пики вблизи приблизительно 13.2 и 24.2 2 на порошковой рентгеновской дифрактограмме. 4. Кристалл по п.3, имеющий характеристические дифракционные пики вблизи приблизительно 13.2, 19.4, 24.2 и 25.5 2 на порошковой рентгеновской дифрактограмме. 5. Кристалл по п.4, имеющий характеристические дифракционные пики на порошковой рентгеновской дифрактограмме, как перечислено в табл. 1 для кристаллической формы I. 6. Кристалл по п.3, содержащий не более чем приблизительно 2% по массе воды. 7. Кристалл по п.6, содержащий не более чем приблизительно 0,5% по массе воды. 8. Кристалл по п.7, содержащий не более чем приблизительно 0,2% по массе воды. 9. Безводный кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо 3H-индол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет точку плавления по меньшей мере приблизительно 190 С. 10. Кристалл по п.9, имеющий точку плавления по меньшей мере приблизительно 195 С.- 13006445 11. Кристалл по п.9, содержащий не более чем приблизительно 2% по массе воды. 12. Кристалл по п.11, содержащий не более чем приблизительно 0,5% по массе воды. 13. Кристалл по п.12, содержащий не более чем приблизительно 0,2% по массе воды. 14. Кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол 3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7 2 на порошковой рентгеновской дифрактограмме. 15. Кристалл по п.14, имеющий характеристические дифракционные пики вблизи приблизительно 3.0, 12.1, 14.5 и 27.7 2 на порошковой рентгеновской дифрактограмме. 16. Кристалл по п.15, имеющий характеристические дифракционные пики на порошковой рентгеновской дифрактограмме, как перечислено в табл. 1 для кристаллической формы II. 17. Кристалл по п.14, абсорбирующий по меньшей мере приблизительно 5% по массе воды при экспонировании в условиях 80%-ной относительной влажности. 18. Кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол 3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, причем данный кристалл имеет точку плавления не более чем приблизительно 185 С. 19. Кристалл по п.18, абсорбирующий по меньшей мере приблизительно 5% по массе воды при экспонировании в условиях 80%-ной относительной влажности. 20. Способ получения безводного кристалла по любому из пп.1-13, при котором объединяют яблочную кислоту, N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3Hиндол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамид и растворитель, и индуцируют кристаллизацию данной соли в условиях кристаллизации, включающих в себя один или более чем один фактор, включая разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 100 С; скорость охлаждения не более чем приблизительно 50 С в час; отсутствие затравки; степень перенасыщения не более чем приблизительно 10; отсутствие осаждающего средства; и/или их комбинации. 21. Способ по п.20, где яблочной кислотой является L-яблочная кислота. 22. Способ по п.20, где один или более чем один фактор включает в себя разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 50 С; скорость охлаждения не более чем приблизительно 20 С в час; степень перенасыщения не более чем приблизительно 5; и/или их комбинации. 23. Способ по п.22, где один или более чем один фактор, включает в себя разницу между начальной и конечной температурами кристаллизационного раствора не более чем приблизительно 25 С; скорость охлаждения не более чем приблизительно 2 С в час; степень перенасыщения не более чем приблизительно 1,5; и/или их комбинации. 24. Способ по п.23, где начальная и конечная температуры кристаллизационного раствора являются одинаковыми. 25. Способ по п.20, где растворитель выбран из группы, состоящей из ацетонитрила, метанола, этанола, изопропанола, толуола, н-бутанола, тетрагидрофурана, N,N-диметилформамида, ацетона, воды и их комбинаций. 26. Способ получения безводного кристалла по любому из пп.1-13, при котором приводят в контакт кристалл, содержащий соль N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3H-индол-3 илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамида с яблочной кислотой, с растворителем, в котором приводимый в контакт кристалл имеет существенную растворимость, причем приводимый в контакт кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0 и 27.7 2 на порошковой рентгеновской дифрактограмме. 27. Способ по п.26, где приводимый в контакт кристалл имеет характеристические дифракционные пики вблизи приблизительно 3.0, 12.1, 14.5 и 27.7 2 на порошковой рентгеновской дифрактограмме. 28. Способ по п.27, где приводимый в контакт кристалл имеет характеристические дифракционные пики на порошковой рентгеновской дифрактограмме, как перечислено в табл. 1 для кристаллической формы II. 29. Способ по п.26, где растворитель выбран из группы, состоящей из ацетонитрила, этанола, метанола и их комбинаций. 30. Способ по п.26, где приведение в контакт кристалла с растворителем приводит к образованию суспензии. 31. Способ по п.30, где дополнительно осуществляют перемешивание суспензии. 32. Способ по п.30, где дополнительно осуществляют нагревание суспензии. 33. Способ по п.30, где дополнительно осуществляют удаление безводного кристалла из суспензии. 34. Способ получения кристалла по любому из пп.14-19, при котором объединяют яблочную кислоту, N-[2-(диэтиламино)этил]-5-[(5-фторо-1,2-дигидро-2-оксо-3Hиндол-3-илиден)метил]-2,4-диметил-1 Н-пиррол-3-карбоксамид и растворитель, и- 14006445 индуцируют кристаллизацию данной соли в условиях кристаллизации, включающих в себя один или более чем один фактор, включая разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 25 С, скорость охлаждения по меньшей мере приблизительно 25 С в час, внесение затравки, степень перенасыщения по меньшей мере приблизительно 2,наличие осаждающего средства; и/или их комбинации. 35. Способ по п.34, где яблочной кислотой является L-яблочная кислота. 36. Способ по п.34, где один или более чем один фактор, включает в себя разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 50 С, скорость охлаждения по меньшей мере приблизительно 100 С в час, степень перенасыщения по меньшей мере приблизительно 5; и/или их комбинации. 37. Способ по п.36, где один или более чем один фактор, включает в себя разницу между начальной и конечной температурами кристаллизационного раствора по меньшей мере приблизительно 100 С, скорость охлаждения по меньшей мере приблизительно 300 С в час, степень перенасыщения по меньшей мере приблизительно 10, и/или их комбинации. 38. Способ по п.34, где растворитель выбран из группы, состоящей из метанола, воды, смесей тетрагидрофуран/вода и их комбинаций. 39. Фармацевтическая композиция, содержащая безводные кристаллы по п.1 или 2. 40. Фармацевтическая композиция по п.39, дополнительно содержащая эксципиент. 41. Фармацевтическая композиция, содержащая безводные кристаллы по п.3. 42. Фармацевтическая композиция, содержащая безводные кристаллы по п.9. 43. Фармацевтическая композиция, содержащая кристаллы по п.14. 44. Фармацевтическая композиция, содержащая кристаллы по п.18.
МПК / Метки
МПК: A61P 35/00, C07D 403/06, A61K 31/404
Метки: композиции, содержащие, кристаллы, диметил-1н-пиррол-3, соль, способы, n-[2-(диэтиламино)этил]-5-[(5-фторо-2-оксо, 1,2-дигидро-3h-индол-3-илиден)метил]-2,4, кислотой, карбоксамида, яблочной, получения
Код ссылки
<a href="https://eas.patents.su/17-6445-kristally-soderzhashhie-sol-n-2-dietilaminoetil-5-5-ftoro-2-okso-12-digidro-3h-indol-3-ilidenmetil-24-dimetil-1n-pirrol-3-karboksamida-s-yablochnojj-kislotojj-sposoby-ih-polucheniy.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллы, содержащие соль n-[2-(диэтиламино)этил]-5-[(5-фторо-2-оксо- 1,2-дигидро-3h-индол-3-илиден)метил]-2,4 -диметил-1н-пиррол-3- карбоксамида с яблочной кислотой, способы их получения и их композиции</a>