Новый способ получения эфира 3-амино-5-фтор-4-диалкоксипентановой кислоты
Номер патента: 16854
Опубликовано: 30.08.2012
Авторы: Чои Хиеонг Воок, Ли Киу-Воонг, Шин Хиун-Ик, Ли Дзае-Хоон
Формула / Реферат
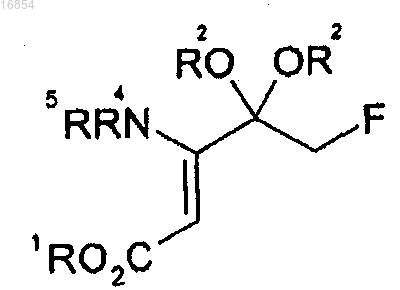
1. Способ получения соединения формулы 6, включающий следующие стадии:
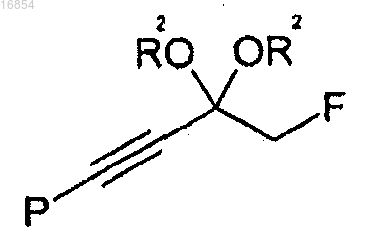
(a) получение соединения формулы 4 удалением защитной группы в соединении формулы 3;
(b) получение соединения формулы 9 взаимодействием соединения формулы 4 с R1OC(=O)OR3 и
(c) взаимодействие соединения формулы 9 с NH(R4)(R5)
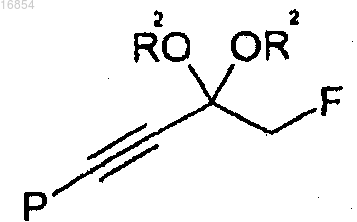
[Формула 3]
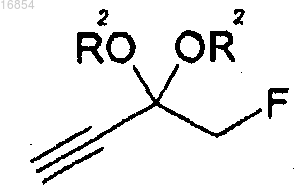
[Формула 4]
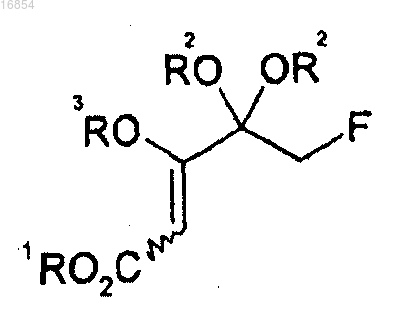
[Формула 9]
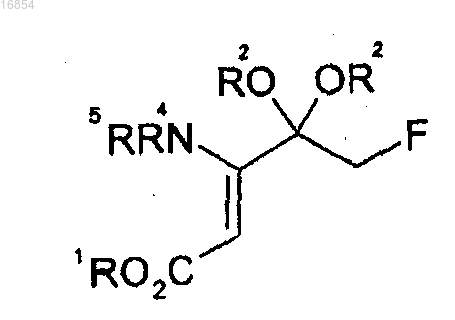
[Формула 6]
где R1 и R3 независимо представляют собой алкильную группу;
R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;
R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу и Р представляет собой защитную группу;
алкил означает С1-8углеводородный радикал и
арил означает бензол, бифенил или нафталин.
2. Способ по п.1, в котором стадию (а) проводят в присутствии одного или более оснований, выбранных из группы, состоящей из M1OH, M2(OH)2, (M1)2CO3, (M1)HCO3 и M2CO3, где M1 представляет собой щелочной металл, а М2 представляет собой щелочно-земельный металл.
3. Способ по п.1, в котором стадию (b) проводят в присутствии одного или более оснований, выбранных из группы, состоящей из первичных, вторичных или третичных алкоголятов щелочного металла или щелочно-земельного металла; реактива Гриньяра; алкиллития; диалкиламида лития; гексаметилсилазида лития; гексаметилсилазида натрия и гексаметилсилазида калия.
4. Способ по п.3, в котором количество основания составляет от 0,05 до 1,5 экв. по отношению к соединению формулы 4.
5. Способ по п.1, в котором R1 и R3 на стадии (b) независимо выбраны из группы, состоящей из метила, этила, пропила, бутила и изопропила.
6. Способ по п.1, в котором количество R1OC(=O)OR3 на стадии (b) составляет 1-5 экв. по отношению к соединению формулы 4.
7. Способ по п.1, в котором стадию (b) проводят в одном или более растворителях, выбранных из группы, состоящей из диметилформамида, диметилсульфоксида и N-метилпирролидона, или растворителе, смешанном с тетрагидрофураном.
8. Способ по п.1, в котором R4 и R5 на стадии (с) независимо друг от друга выбраны из группы, состоящей из водорода, три(C1-8алкил)силила, бензила, 1-фенилэтила и 1-нафтилэтила.
9. Способ по п.1, включающий после стадии (с) дополнительную стадию, на которой соединение формулы 6 кристаллизуют из одного или более растворителей, выбранных из группы, состоящей из C1-C5-спирта и C3-C5-кетона, и воды.
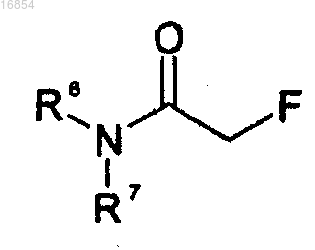
10. Способ по п.1, в котором способ получения соединения формулы 3 предусматривает:
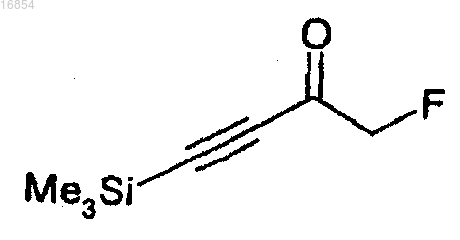
(d) получение соединения формулы 2 взаимодействием соединения формулы 8 с анионом триметилсилилацетилена и
(e) взаимодействие соединения формулы 2 с защитной группой
[Формула 8]
[Формула 2]
[Формула 3]
где R2 независимо представляет собой C1-8алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;
R6 и R7 независимо представляют собой С1-8алкильную группу или C1-8алкоксильную группу или вместе с атомом азота, к которому они присоединены, могут образовывать гетероцикл, выбранный из пиперидина, морфолина, тиаморфолина, пирролидина, имидазолидина и пиперазина; и
Р представляет собой защитную группу.
11. Способ по п.10, в котором количество аниона триметилсилилацетилена на стадии (d) составляет 1-3 экв. по отношению к соединению формулы 8.
12. Способ получения соединения формулы 1, включающий следующие стадии:
(e) получение соединения формулы 7 восстановлением соединения формулы 6, полученного способом по п.1, в присутствии восстановителя, способного селективно восстанавливать двойную связь между атомами углерода; и
(f) гидрирование соединения формулы 7
[Формула 6]
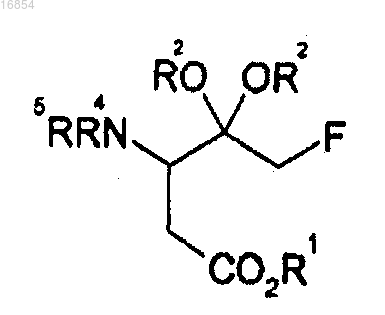
[Формула 7]
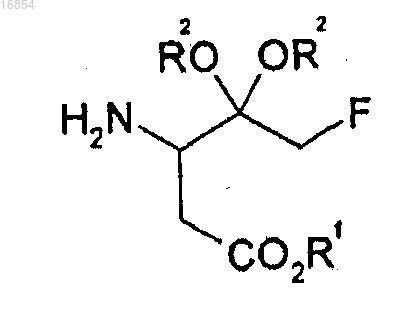
[Формула 1]
где R1 представляет собой алкильную группу;
R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;
R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу;
алкил означает С1-8углеводородный радикал и
арил означает бензол, бифенил или нафталин.
13. Способ по п.12, в котором восстановитель на стадии (е) выбран из группы, состоящей из (i) триацетоксиборгидрида натрия, (ii) уксусной кислоты и цианоборгидрида натрия или (iii) уксусной кислоты и боргидрида натрия.
14. Способ по п.12, в котором процесс гидрирования на стадии (f) ведут в присутствии металлического катализатора.
15. Способ получения соединения формулы 10, включающий взаимодействие соединения формулы 1, полученного согласно п.12, с производными винной кислоты
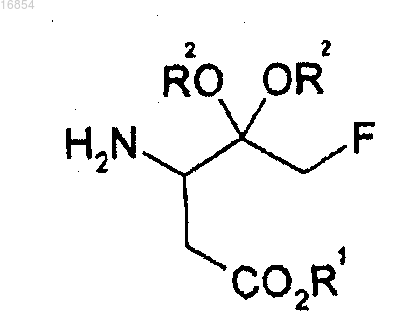
[Формула 1]
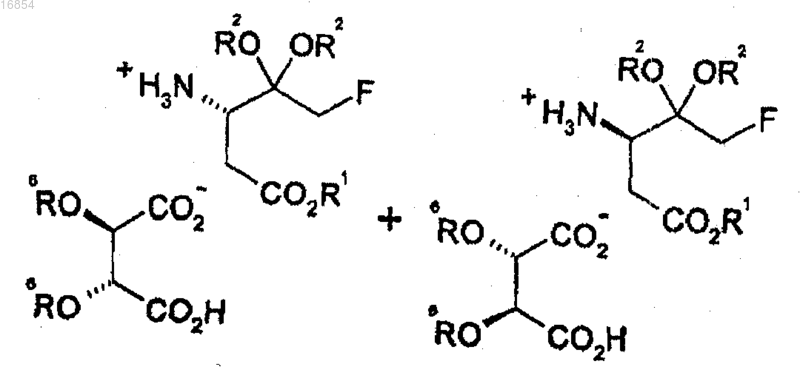
[Формула 10]
где R1 представляет собой алкильную группу;
R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;
R6 представляет собой водород, алкильную группу или ацильную группу, где ацильная группа имеет формулу RC(=O)-, и
R представляет собой алкильную группу или арильную группу;
алкил означает C1-8углеводородный радикал и
арил означает бензол, бифенил или нафталин.
16. Способ по п.15, в котором количество производных винной кислоты составляет 0,9-1,5 экв. по отношению к соединению формулы 1.
17. Способ по п.15, в котором производное винной кислоты представляет собой винную кислоту.
18. Способ по п.15, в котором один тип стереоизомера в соединении формулы 10 получают с применением оптически активной винной кислоты или O,O'-дибензоилвинной кислоты в качестве производного винной кислоты.
19. Соединение формулы 6
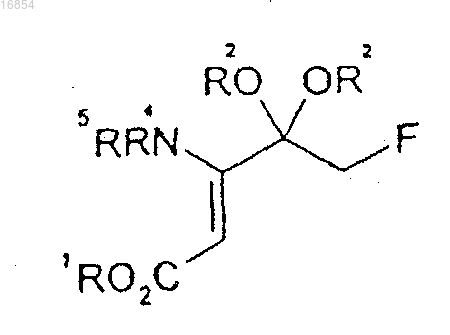
[Формула 6]
в которой R1 представляет собой алкильную группу;
R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан;
R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу;
алкил означает С1-8углеводородный радикал и
арил означает бензол, бифенил или нафталин.
20. Соединение формулы 9
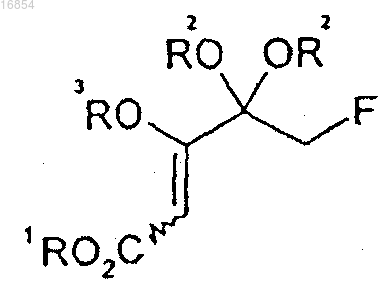
[Формула 9]
в которой R1 и R3 независимо представляют собой алкильную группу и
R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан;
алкил означает С1-8углеводородный радикал.
Текст
НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ЭФИРА 3-АМИНО-5-ФТОР-4 ДИАЛКОКСИПЕНТАНОВОЙ КИСЛОТЫ Данное изобретение относится к новому способу получения эфира 3-амино-5-фтор-4 диалкоксипентановой кислоты, применимого в качестве предшественника 3-амино-5-фтор-4 оксопентановой кислоты, представленной следующей формулой (I), в которой R1 и R2 определены в описании. Шин Хиун Ик, Чои Хиеонг Воок, Ли Дзае Хоон, Ли Киу Воонг (KR) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЭЛ ДЖИ ЛАЙФ САЙЕНСИЗ ЛТД. 016854 Область техники, к которой относится изобретение Данное изобретение относится к новому способу получения сложного эфира 3-амино-5-фтор-4 диалкоксипентановой кислоты, представленного следующей формулой 1: в которой R1 и R2 определены ниже. Уровень техники Группа Revesz сообщает о способе получения производного 3-амино-5-фтор-4-оксопентановой кислоты, которая хорошо известна в технике как играющая важную роль в ингибировании каспазы (Reveszet al., Tetrahedron Lett. 1994, 35, 9693). Однако в указанном способе в качестве промежуточного продукта используют 2-фторацетальдегид, который является летучим, и альдольная реакция с ним требует большого количества органического растворителя. Более того, очистка продукта трудна, так как отсутствуют промежуточные продукты в форме твердого вещества. Для преодоления указанных проблем заявители данного изобретения разработали способ получения соединения формулы 1 согласно схеме реакции 1,которая осуществима на практике и обеспечивает хороший выход (см. KR 10-2005-016203). Схема реакции 1 Хотя по сравнению со способом Revesz сделаны значительные улучшения, еще существует возможность для дополнительного усовершенствования путем устранения очень низких температур при получении соединения формулы 2 конденсацией аниона лития триметилсилилацетилена и этилфторацетата и при получении соединения формулы 5 конденсацией аниона соединения формулы 4 и этилхлорформиата (от -25 до приблизительно -65 С и ниже -40 С соответственно). Более того, промежуточные продукты, полученные по указанной выше схеме реакции, не могут быть легко очищены, и, таким образом, вышеуказанный способ трудно использовать для синтеза соединений в крупном масштабе. Поэтому существует необходимость в новом способе, который не требует очень низкотемпературных условий и предусматривает легкий способ очистки. Сущность изобретения Данное изобретение относится к новому способу получения сложного эфира 3-амино 5-фтор-4 диалкоксипентановой кислоты с использованием в качестве предшественника 3-амино-5-фтор-4 оксопентановой кислоты, представленной следующей формулой 1:-1 016854 Подробное описание изобретения Предметом данного изобретения является усовершенствование способа получения соединения формулы 1, который не требует условий очень низких температур и подходит для крупномасштабного синтеза, в котором промежуточные продукты могут быть легко очищены. Данное изобретение относится к способу получения соединения формулы 6, который предусматривает следующие стадии:(a) получение соединения формулы 4 удалением защитной группы в соединении формулы 3;(b) получение соединения формулы 9 взаимодействием соединения формулы 4 с R1OC(=O)OR3 и(c) взаимодействие соединения формулы 9 с NH(R4)(R5):[Формула 6] где R1 и R3 независимо представляют собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу и Р представляет собой защитную группу; где алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. В предпочтительном варианте стадию (а) проводят в присутствии одного или более оснований, выбранных из группы, состоящей из М 1 ОН, М 2(ОН)2, (M1)2CO3, (M1)HCO3 и M2CO3, где М 1 представляет собой щелочной металл, а М 2 представляет собой щелочно-земельный металл. Предпочтительно стадию (b) проводят в присутствии одного или более оснований, выбранных из группы, состоящей из первичных, вторичных или третичных алкоголятов щелочного металла или щелочно-земельного металла; реактива Гриньяра; алкиллития; диалкиламида лития; гексаметилсилазида лития; гексаметилсилазида натрия и гексаметилсилазида калия. При этом количество основания предпочтительно составляет от 0,05 до 1,5 экв. по отношению к соединению формулы 4. В одном из предпочтительных вариантов осуществления способа согласно изобретению R1 и R3 на стадии (b) независимо выбраны из группы, состоящей из метила, этила, пропила, бутила и изопропила. Ещ в одном предпочтительном варианте осуществления способа согласно изобретению количествоR1OC(=O)OR3 на стадии (b) составляет 1-5 экв. по отношению к соединению формулы 4. В другом предпочтительном варианте осуществления способа согласно изобретению стадию (b) проводят в одном или более растворителях, выбранных из группы, состоящей из диметилформамида,диметилсульфоксида и N-метилпирролидона, или растворителе, смешанном с тетрагидрофураном. В другом предпочтительном варианте осуществления способа согласно изобретению R4 и R5 на стадии (Ь) независимо друг от друга выбраны из группы, состоящей из водорода, три(С 1-8 алкил)силила, бензила, 1-фенилэтила и 1-нафтилэтила.-2 016854 Способ согласно изобретению может включать после стадии (c) дополнительную стадию, на которой соединение формулы 6 кристаллизуют из одного или более растворителей, выбранных из группы,состоящей из C1-C5-спирта и C3-C5-кетона, и воды. Согласно настоящему изобретению соединение формулы 3 может быть получено способом, который предусматривает:(d) получение соединения формулы 2 взаимодействием соединения формулы 8 с анионом триметилсилилацетилена и(е) взаимодействие соединения формулы 2 с защитной группой[Формула 3] где R2 независимо представляет собой C1-8 алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R6 и R7 независимо представляют собой C1-8 алкильную группу или C1-8 алкоксильную группу или вместе с атомом азота, к которому они присоединены, могут образовывать гетероцикл, выбранный из пиперидина, морфолина, тиаморфолина, пирролидина, имидазолидина и пиперазина; и Р представляет собой защитную группу. Предпочтительно количество аниона триметилсилилацетилена на стадии (d) составляет 1-3 экв. по отношению к соединению формулы 8. Настоящее изобретение обеспечивает способ получения соединения формулы 1, включающий следующие стадии:(e) получение соединения формулы 7 восстановлением соединения формулы 6, полученного способом по п.1, в присутствии восстановителя, способного селективно восстанавливать двойную связь между атомами углерода; и(f) гидрирование соединения формулы 7[Формула 1] где R1 представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу;-3 016854 алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. В предпочтительном варианте восстановитель на стадии (е) выбран из группы, состоящей из (i) триацетоксиборгидрида натрия, (ii) уксусной кислоты и цианоборгидрида натрия или (iii) уксусной кислоты и боргидрида натрия. Кроме того, предпочтительно процесс гидрирования на стадии (f) проводить в присутствии металлического катализатора. Настоящее изобретение обеспечивает способ получения соединения формулы 10, включающий взаимодействие соединения формулы 1, полученного описанным выше способом, с производными винной кислоты[Формула 10] где R1 представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R6 представляет собой водород, алкильную группу или ацильную группу, где ацильная группа имеет формулу RC(=O)-; иR представляет собой алкильную группу или арильную группу; алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. Предпочтительно количество производных винной кислоты составляет 0,9-1,5 экв. по отношению к соединению формулы 1. Предпочтительно производное винной кислоты представляет собой винную кислоту. Предпочтительно один тип стереоизомера в соединении формулы 10 получают с применением оптически активной винной кислоты или O,O'-дибензоилвинной кислоты в качестве производного винной кислоты. Ещ одним объектом настоящего изобретения является соединение формулы 6[Формула 6] в которой R1 представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу; алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин.-4 016854 Другим объектом настоящего изобретения является соединение формулы 9[Формула 9] в которой R1 и R3 независимо представляют собой алкильную группу иR2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан; алкил означает С 1-8 углеводородный радикал. При использовании способа данного изобретения не требуются очень низкотемпературные условия и способ очистки является простым. Механизм реакции данного изобретения может быть изображен следующей схемой реакции 2. Схема реакции 2 Способ получения соединения формулы 2 по схеме реакции 2 с использованием реакции конденсации амида формулы 8 и триметилсилилацетилена и способ получения соединения формулы 6 из соединения формулы 9 через соединение формулы 4 не требуют очень низкотемпературных условий. Таким образом, вышеуказанным способом могут быть получены твердые кристаллические формы соединений формул 6, 10 а и 10b и, таким образом, может быть получено соединение формулы 1 высокой степени чистоты. Кроме того, соединение формулы 9 представляет собой новое соединение. Данное изобретение может быть объяснено более детально в свете последующих примеров. Однако они приведены с целью иллюстрации и никоим образом не могут быть истолкованы для ограничения данного изобретения. Определения В описании соединений и способов данного изобретения основные термины имеют следующие значения, если не указано иначе. Термин "алкил" означает C1-8 углеводородные радикалы или С 3-10 циклические углеводородные радикалы, которые могут быть линейными или разветвленными и, таким образом, могут представлять собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил,изогексил, гептил, октил, 2,2,4-триметилпентил, циклопропил, циклобутил, циклопентил, циклогексил,циклогептил, циклооктил и подобные, но без ограничения. Термин "арил" означает ароматическую группу, гетероароматическую группу или их частично восстановленные производные. Ароматическая группа относится к 5-15-членным ненасыщенным углеводородам, которые могут представлять собой неконденсированные циклы или конденсированные циклы. Ароматическая группа включает бензол, бифенил, нафталин и подобные, но без ограничения. Вышеуказанная гетероароматическая группа представляет собой 5-15-членную ароматическую группу, содержащую от 1 до 5 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, которая может-5 016854 представлять собой неконденсированный цикл или конденсированный цикл. Моноциклическая гетероароматическая группа включает тиазол, оксазол, тиофен, фуран, пиррол, имидазол, изоксазол, пиразол,триазол, тиадиазол, тетразол, оксадиазол, пиридин, пиридазин, пиримидин, пиразин и подобные, но без ограничения. Бициклическая гетероароматическая группа включает индол, бензотиофен, бензофуран,бензимидазол, бензоксазол, бензизоксазол, бензтиазол, бензтиадиазол, бензтриазол, хинолин, изохинолин, пурин, фуропиридин и подобные, но без ограничения. Термин "гетероцикл" означает насыщенный 4-8-членный цикл или 4-8-членный цикл, содержащий 1 или 2 двойные связи, который может быть сконденсирован с бензолом или C3-C8-циклоалкилом и включает 1 или 2 гетероатома, выбранных из группы, состоящей из кислорода, серы и азота. Гетероцикл включает пиперидин, морфолин, тиаморфолин, пирролидин, имидазолидин, тетрагидрофуран, пиперазин и подобные, но без ограничения. Здесь один или более атомов водорода алкильной группы и арильной группы могут быть замещены другими заместителями, включая ацил, аминогруппу, карбалкоксигруппу, карбоксигруппу,карбоксиаминогруппу, цианогруппу, галоген, гидроксигруппу, нитрогруппу, тиогруппу, алкил, циклоалкил, алкоксигруппу, арил, арилоксигруппу, сульфоксигруппу и гуанидиногруппу, но без ограничения. Синтез соединения формулы 2. Как показано на схеме реакции 3, соединение формулы 2 получают согласно следующим стадиям:(i) получение соединения формулы 8 взаимодействием А-OC(=O)CH2F с NH(R6)(R7) и(ii) взаимодействие соединения формулы 8 с триметилсилилацетиленом. Вышеуказанная реакция не требует создания низкотемпературных условий. Схема реакции 3R6 и R7 независимо представляют собой замещенный или незамещенный алкил, такой как метил,фенилметил; или замещенную или незамещенную алкоксигруппу, такую как метоксигруппа, фенилметоксигруппа; или вместе с атомом азота, к которому они присоединены, могут образовывать 4-8-членный гетероцикл, такой как морфолин. На стадии (i) амид формулы 8 получают конденсацией фторуксусной кислоты и NH(R6)(R7),предпочтительно N,O-диметилгидроксиламина или морфолина. Желательно реакцию конденсации проводить после активирования A-OC(=O)CH2F дициклогексилкарбодиимидом или гидрохлоридомN-(3-диметиламинопропил)-N'-этилкарбодиимида (EDC). В случае реакции конденсации с использованием морфолина соединение формулы 8 может быть легко получено взаимодействием морфолина со сложным эфиром фторуксусной кислоты, включая этилфторацетат и метилфторацетат, без конденсирующего реагента. Количество использованного в реакцииNH(R6)(R7) составляет 1,5-5 экв., предпочтительно 1,5-3 экв. по отношению к А-ОС(=O)CH2F. Если количество NH(R6)(R7) менее 1,5 экв., скорость реакции уменьшается, а если количество представляет собой избыток 5 экв., трудно удалять избыток амина. Предпочтительно реакцию конденсации проводят в присутствии одного или более растворителей, выбранных из группы, состоящей из толуола и ацетонитрила, но без ограничения. С точки зрения скорости реакции более предпочтительно проводить реакцию в отсутствие растворителя. Температура реакции предпочтительно равна 60-100 С, более предпочтительно 65-90 С. Если температура реакции ниже 60 С, скорость реакции замедлена, а если она выше 100 С,вследствие побочной реакции уменьшается выход. Для стадии (ii) соединение формулы 8 может быть использовано без ограничений. Однако в крупномасштабном синтезе, с точки зрения стабильности и экономичности, предпочтительно использовать соединение формулы 8, которое содержит морфолиновый цикл с атомом азота, к которому присоединены R6 и R7. Количество триметилсилилацетилена составляет 1-3 экв., предпочтительно 1,1-1,5 экв. по отношению к соединению формулы 8. Если количество триметилсилилацетилена более 3 экв., образуется большое количество побочного продукта реакции с 2 молекулами триметилсилилацетилена. Предпочтительно использовать триметилсилилацетилид лития, который конвертируют из триметилсилилацетилена,используя алкиллитий, предпочтительно метиллитий, н-гексиллитий или н-бутиллитий. Предпочтительно реакцию ведут в присутствии одного или более растворителей, выбранных из группы, состоящей из тетрагидрофурана, простого диэтилового эфира, простого трет-бутилметилового эфира и-6 016854 1,2-диметоксиэтана, специально без ограничения, пока они не оказывают отрицательного действия на реакцию. Температура реакции равна от -30 до 20 С, предпочтительно от -10 до 20 С. Синтез соединения формулы 4. Соединение формулы 4 получают взаимодействием соединения формулы 2 с защитной группой с образованием соединения формулы 3 (как показано на схеме реакции 4) и удалением защитной группы в соединении формулы 3. Схема реакции 4 где R2 независимо означает алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан. Для вышеуказанной реакции введения защитной группы триалкилортоформиат используют в растворителе метаноле или этаноле. Предпочтительно используют триметилортоформиат или триэтилортоформиат, но без ограничения. Реакцию введения защитной группы предпочтительно ведут в присутствии одного или более оснований, выбранных из группы, состоящей из M1OH, M2(OH)2, (M1)2CO3, (M1)HCO3 и M2CO3, предпочтительно гидроксида натрия, гидроксида калия, карбоната натрия и гидрокарбоната натрия, причем М 1 представляет собой щелочной металл, М 2 представляет собой щелочно-земельный металл. Количество использованного основания в реакции введения защитной группы составляет от 1 до 2 экв. по отношению к соединению формулы 2. Кроме того, предпочтительно проводить реакцию удаления защиты в C1-C8-спирте, таком как метанол или этанол; дихлорметане или в смеси хлороформа и воды. Синтез соединения формулы 9. Соединение формулы 9 получают взаимодействием соединения формулы 4 с R1OC(=O)OR3 (как показано на схеме реакции 5). Предпочтительно реакцию ведут в присутствии основания. Полученное в результате взаимодействия соединение формулы 9 является новым соединением. Схема реакции 5 где R1 и R3 независимо представляют собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан. Использованные в реакции основания не лимитированы, пока соединение формулы 4 может взаимодействовать с R1OC(=O)OR3, и основание предпочтительно представляет собой щелочной металл; первичный, вторичный или третичный алкоголят щелочно-земельного металла; реактив Гриньяра; алкиллитий; диалкиламид лития; гексаметилсилазид лития; гексаметилсилазид натрия или гексаметилсилазид калия. Количество использованного здесь основания составляет 0,05-1,5 экв., предпочтительно 0,1-0,5 экв. по отношению к соединению формулы 4. Если количество основания меньше 0,05 экв., скорость реакции уменьшается, а если более 1,5 экв., с одной молекулой R1OC(=O)OR3 взаимодействуют две молекулы соединения формулы 4 с образованием нежелательного побочного продукта. Предпочтительно соединение R1OC(=O)OR3 представляет собой соединение, в котором R1 и R3 независимо выбраны из группы, состоящей из метила, этила, пропила, бутила и изопропила. Более предпочтительно соединение R1OC(=O)OR3 представляет собой диметилкарбонат, диэтилкарбонат, дипропилкарбонат, дибутилкарбонат или диизопропилкарбонат, но без ограничения. Количество использованного R1OC(=O)OR3 составляет 1-5 экв., предпочтительно 1-2,5 экв., более предпочтительно 1,05-1,15 экв. по отношению к соединению формулы 4. Если количество использованного R1OC(=O)OR3 более 5 экв.,реакция замедляется и не может быть завершена. Пока растворитель реакции не оказывает негативного эффекта, он специально не ограничен, причем растворитель реакции включает один или более растворителей, выбранных из группы, состоящей из диметилформамида, диметилсульфоксида и N-метилпирролидона или их смеси с тетрагидрофураном. Однако с точки зрения скорости реакции использование одного тетрагидрофурана в качестве растворителя реакции не является предпочтительным. Количество растворителя реакции специально не ограничено, но составляет более 5-кратного, предпочтительно 10-кратного в расчете на количество R1OC(=O)OR3. Если количество растворителя реакции меньше 5-кратного, скорость реакции замедляется. Температура реакции равна от -20 до 50 С, предпочтительно от -5 до 30 С. Если температура выше 50 С, выход снижается.-7 016854 Соединение формулы 9, полученное по схеме реакции 2, представляет собой смесь изомеров Е и Z,и соотношение Е и Z варьируется в зависимости от условий реакции. Однако оба указанных изомера могут взаимодействовать с амином с образованием соединения формулы 6, и, таким образом, выделения отдельных изомеров не требуется. Синтез соединения формулы 6. Соединение формулы 6 получают взаимодействием соединения формулы 9 с NH(R4)(R5), как показано на схеме реакции 6. Схема реакции 6 где R1 и R3 независимо представляют собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу. Использованный здесь NH(R4)(R5) специально не ограничен, поскольку он может быть превращен восстановлением в аминогруппу, но предпочтительно представляет собой арилметиламин, такой как аммиак или бензиламин; первичный амин, включая 1-арилэтиламин, такой как 1-фенилэтиламин или 1-нафтилэтиламин или их защищенные триалкилсилильные формы; и вторичный амин, включая ди(арилметил)амин, такой как дибензиламин, или ди(арилэтил)амин, такой как дифенилэтиламин. Количество NH(R4)(R5) составляет 1-20 экв., предпочтительно 3-8 экв Если количество NH(R4)(R5) меньше 1 экв., скорость реакции уменьшается. Если оно больше 20 экв., это неблагоприятно из-за того, что для удаления образовавшегося после взаимодействия амина должно быть использовано избыточное количество кислоты. Растворитель реакции специально не ограничен, пока растворитель не оказывает отрицательного действия на реакцию, но предпочтительно ее проводят в присутствии растворителя, выбранного из группы, состоящей из простого трет-бутилметилового эфира, толуола, диметилформамида и ацетонитрила. Более предпочтительно с точки зрения скорости реакции проводить ее в отсутствие растворителя. Температура реакции равна от 30 до 150 С, предпочтительно от 80 до 110 С. Если температура реакции ниже 30 С, это неблагоприятно с точки зрения скорости реакции. Если она выше 150 С, возникает проблема побочных реакций. Полученный в результате реакции продукт может быть использован для последующего взаимодействия после удаления избытка амина. Однако соединение формулы 6 предпочтительно очищают кристаллизацией с целью получения соединения формулы 1 высокой степени чистоты. Продукт, полученный после удаления амина, нагревают и растворяют в одном или более растворителях, предпочтительно выбранных из группы, состоящей из метанола, этанола, изопропанола и ацетона, затем прибавляют воду,чтобы вызвать начало кристаллизации соединения формулы 6. Дополнительный способ очистки, такой как перекристаллизация, не требуется, так как полученный осадок содержит соединение 6 высокой степени чистоты. Синтез соединения формулы 7. Соединение формулы 7 получают восстановлением в присутствии восстановителя, способного селективно восстанавливать двойную связь между атомами углерода, существующую в соединении формулы 6, как показано на следующей схеме реакции 7. Схема реакции 7 где R1 независимо представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе в атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу. Пока восстановитель не оказывает негативного эффекта на реакцию восстановления, в реакции может быть использован обычный восстановитель, способный селективно восстанавливать двойную связь между углеродом и азотом. Предпочтительно, но без ограничения, могут быть использованы (i) триаце-8 016854 токсиборгидрид натрия, (ii) уксусная кислота и цианоборгидрид натрия или (iii) уксусная кислота и боргидрид натрия. Количество восстановителя составляет от 1 до 5 экв., предпочтительно 1,5-3 экв. по отношению к соединению формулы 6. Если количество восстановителя меньше 1 экв., реакция не может быть завершена. Если оно больше 5 экв., это может быть опасным, так как при гашении реакции водой из избытка восстановителя образуется избыток газообразного водорода. В случае использования в качестве восстановителя уксусной кислоты и боргидрида натрия предпочтительно использовать каждый из них в количестве от 1 до 20 экв. и от 1 до 5 экв. соответственно. Предпочтительно также проводить реакцию в присутствии одного или более растворителей, выбранных из группы, состоящей из этилацетата, тетрагидрофурана, простого диэтилового эфира и простого трет-бутилметилового эфира. Синтез соединения формулы 1. Соединение формулы 1 получают гидрированием соединения формулы 7, как показано на следующей схеме реакции 8. Схема реакции 8 где R1 независимо представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу. Реакцию проводят в присутствии металлического катализатора, предпочтительно катализатора на основе палладия или катализатора на основе никеля Ренея, без ограничения; но катализатор на основе палладия с содержанием палладия (Pd) в интервале от 1 до 20 мас.% или катализатор на основе никеля Ренея с содержанием никеля в интервале более 1 экв. могут быть использованы в количестве от 0,01 до 13 мас.% в соединении формулы 7 в расчете на металлический компонент; причем указанные катализаторы используют в виде нанесенных на подложку, выбранную из группы, состоящей из углерода, диоксида кремния и оксида алюминия. Растворители реакции гидрирования не лимитированы, но предпочтительно процесс ведут в присутствии одного или более растворителей, выбранных из группы, состоящей из уксусной кислоты, метанола, этанола, н-пропанола, изопропанола, тетрагидрофурана, диметоксиэтана,диоксана, этилацетата и дихлорметана. Кроме того, реакцию гидрирования предпочтительно проводят при 0-50 С и давлении водорода от 1 до 100 атм. Синтез соединения формулы 10, очистка и оптическое расщепление использованного соединения формулы 10. Соединение формулы 10 (изомеры формулы 10 а, стереоизомеры формулы 10b или рацематы формулы 10 а и формулы 10b) получают взаимодействием соединения формулы 1 с производными винной кислоты (если необходимо, рацематами или оптическими изомерами), как показано на схеме реакции 9. Полученное соединение формулы 10 может быть использовано для очистки и оптического расщепления соединения формулы 1. Схема реакции 9 где R1 независимо представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R6 представляет собой водород, алкильную группу или ацильную группу, в которой ацил имеет формулу RC(=O)-, R представляет собой алкильную группу или арильную группу.-9 016854 Соединение формулы 1 взаимодействует с производными винной кислоты в присутствии воды и одного или более растворителей, выбранных из C1-C5-спиртов, предпочтительно выбранных из группы,состоящей из метанола, этанола и изопропанола, с образованием соединения формулы 10 (стереоизомеров формулы 10 а, стереоизомеров формулы 10b или рацемической смеси формулы 10 а и формулы 10b). Реакцию проводят в температурном интервале от 40 до 80 С. После завершения реакции, если температуру реагентов охлаждают до низкотемпературных значений, предпочтительно ниже температуры окружающей среды, соединение формулы 10 кристаллизуется. Полученный осадок состоит из соединения формулы 10 достаточной степени чистоты. Однако в случае необходимости перекристаллизацией в присутствии воды и одного или более растворителей, выбранных из группы C1-C5-спиртов, предпочтительно выбранных из группы, состоящей из метанола, этанола и изопропанола, может быть получено соединение формулы 10 более высокой степени чистоты. Количество использованных производных винной кислоты составляет 0,9-1,5 экв. по отношению к соединению формулы 1. Использованные в реакции производные винной кислоты включают винную кислоту,O,O'-дибензоилвинную кислоту и подобные, но без ограничения. Соединение формулы 10 может быть легко разделено на соединение формулы 1 и производные винной кислоты с использованием обычного способа отделения соли в соединении. Таким образом, может быть выделено соединение формулы 1 высокой степени чистоты. Если требуются рацематы или энантиомеры соединения формулы 1, рацемическую смесь формулы 10 а и формулы 10b, стереоизомеры формулы 10 а или стереоизомеры формулы 10b получают путем селективного применения рацемических производных винной кислоты или оптически активных производных винной кислоты. В частности, в случае использования оптически активных производных винной кислоты соединение формулы 1 может быть оптически расщеплено, поскольку один энантиомер соединения формулы 1 может образовывать диастереомерную соль формулы 10 а или 10b. Использованные в реакции оптически активные производные винной кислоты включают оптически активную винную кислоту, такую как D,L-винная кислота,O,O'-дибензоилвинную кислоту, но без ограничения. Лучшее понимание данного изобретения может быть достигнуто в свете следующих примеров, которые приведены с целью иллюстрации, но никоим образом не могут быть истолкованы для ограничения данного изобретения. Полезные эффекты. Данное изобретение обеспечивает преимущества по сравнению с известным состоянием техники,поскольку не требует очень низкотемпературных условий и промежуточный продукт 6 легко очистить кристаллизацией, что позволяет получать соединение формулы 1 высокой степени чистоты. Наилучший способ. Данное изобретение относится к способу получения соединения формулы 6, описанному ниже, который предусматривает следующие стадии:(a) получение описанного ниже соединения формулы 4 удалением защиты в соединении формулы 3;(b) получение описанного ниже соединения формулы 9 взаимодействием соединения формулы 4 с(c) взаимодействие соединения формулы 9 с NH(R4)(R5):[Формула 6] в которых R1 и R3 независимо представляют собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу и Р представляет собой защитную группу. Примеры осуществления изобретения Пример 1. 2-Фтор-1-морфолин-4-илэтанон (8). Смесь этилфторацетата (50 г, 472 ммоль) и морфолина (82 г, 944 ммоль) нагревали при 70 С в течение 20 ч. После охлаждения до температуры окружающей среды смесь в течение 20 мин прибавляли к перемешиваемой смеси 2 н. HCl (240 мл) и метиленхлорида (200 мл). Органический слой отделяли и водный слой экстрагировали дихлорметаном (2200 мл). Объединенную органическую фазу сушили над безводным MgSO4 и концентрировали в вакууме, получая 51,7 г (74,6%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3):4,96 (д, J=47,2 Гц, 2 Н), 3,70 (ушир.с, 4 Н), 3,64 (ушир.с, 2 Н), 3,47(ушир.с, 2 Н). Пример 2. 1-Фтор-4-триметилсиланилбут-3-ин-2-он (2). Охлажденный до 0 С раствор триметилсилилацетилена (42,0 г, 429 ммоль) в ТГФ (400 мл) в течение 20 мин обрабатывали н-BuLi (2,5 М в н-гексане; 171 мл, 428 ммоль), поддерживая температуру ниже 10 С, используя баню с сухим льдом и ацетоном (-20 С). После перемешивания в течение 30 мин при 0 С смесь обрабатывали раствором 2-фтор-1-морфолин-4-илэтанона (8, 48,4 г, 329 ммоль) в ТГФ (50 мл+ 10 мл для промывки) и перемешивание при 0 С продолжали еще в течение 1 ч. Реакцию гасили прибавлением при 0 С смеси уксусной кислоты (250 мл) и воды (150 мл) в течение 1 ч, поддерживая температуру ниже 5 С. После прибавления дополнительного количества воды (150 мл) органический слой отделяли, промывали водой (200 мл), сушили над безводным MgSO4 и концентрировали в вакууме. Остаток снова упаривали с толуолом (200 мл) для удаления остатка уксусной кислоты и перегоняли в вакууме(8 мбар, т.кип. 54 С), получая указанное в заголовке соединение (33,7 г, 64,8%). 1 Н ЯМР (500 МГц, CDCl3):4,90 (д, J=47,1 Гц, 2 Н), 0,26 (с, 9 Н). 13 С ЯМР (125 МГц, CDCl3):181,0 (д, J=21,5 Гц), 104,0, 98,1, 84,8 (д, J=187 Гц). Пример 3. 4-Фтор-3,3-диметоксибут-1-ин (4, R2 = метил). Раствор 1-фтор-4-триметилсиланилбут-3-ин-2-она (2, 50,0 г, 316 ммоль) в метаноле (260 мл) обрабатывали триметилортоформиатом (33,6 г, 316 ммоль) и napa-TsOH-H2O (6,0 г, 31,5 ммоль) и в течение 6 ч кипятили с обратным холодильником (температура бани: 80 С). После упаривания около 130 мл растворителя при пониженном давлении остаток разбавляли дихлорметаном (260 мл) и 10%-ным растворомNaHCO3 (130 мл). Органический слой отделяли и водный слой экстрагировали дихлорметаном (130 мл). Органические фазы объединяли и концентрировали при пониженном давлении, получая неочищенное соединение формулы 3 (59,0 г, 92%). Соединение использовали как таковое для следующей реакции. 1 Н ЯМР (500 МГц, CDCl3):4,38 (д, J=47,1 Гц, 2 Н), 3,40 (с, 6 Н), 0,20 (с, 9 Н). К раствору неочищенного соединения формулы 3 (59,0 г, 289 ммоль) в дихлорметане (280 мл) прибавляли бромид тетра-н-бутиламмония (59 мг, 0,183 ммоль) и 1 н. NaOH (347 мл, 347 ммоль). Смесь перемешивали при обычной температуре в течение 2 ч. Органический слой отделяли и водный слой экстрагировали дихлорметаном (110 мл). Объединенную органическую фазу промывали рассолом (110 мл) и концентрировали при пониженном давлении, получая неочищенное указанное в заголовке соединение (4,R2 = метил, 40,9 г, 107%). 1 Н ЯМР (500 МГц, CDCl3):4,43 (д, J=47,1 Гц, 2H), 3,42 (с, 6 Н), 2,64 (с, 1 Н). 13 С ЯМР (125 МГц, CDCl3):96,1 (д, J=20,3 Гц), 82,9 (д, J=180 Гц), 77,5, 75,5, 51,0. Пример 4. Этил-3-этокси 5-фтор-4,4-диметоксипент-2-еноат (9, R1 и R3 = этил, R2 = метил). Смесь 4-фтор-3,3-диметоксибут-1-ина (4, R2 = метил, 20,0 г, 152 ммоль) и диэтилкарбоната (20,1 мл,167 ммоль) в ДМФА (150 мл) охлаждали до 0 С и обрабатывали этилатом калия (3,8 г, 45,2 ммоль). После перемешивания при 0 С в течение 4 ч к раствору прибавляли смесь 1:1 насыщенного водного NH4Cl и воды (200 мл) и экстрагировали простым трет-бутилметиловым эфиром (2200 мл). Объединенную органическую фазу промывали водой (100 мл) и сушили над безводным MgSO4, получая неочищенное указанное в заголовке соединение (9, R1 и R3 = этил, R2 = метил, 37,8 г, 99,7%, Z:E=6,5:1).R = бензил, R5 = водород). Смесь этил-3-этокси-5-фтор-4,4-диметоксипент-2-еноата (9, R1 и R3 = этил, R2 = метил, 37,8 г,151 ммоль) и бензиламина (99 мл, 907 ммоль) нагревали при 100 С в течение 20 ч. После охлаждения до 0 С смесь разбавляли этилацетатом (300 мл) и обрабатывали 1 н. HCl (360 мл), поддерживая температуру ниже 20 С. Отделенный органический слой обрабатывали 1 н. HCl (330 мл), доводя рН примерно до 4. Органический слой отделяли, промывали насыщенным водным NH4Cl (60 мл), сушили над безводнымMgSO4 и концентрировали в вакууме. Остаток растворяли в этаноле (150 мл) при нагревании до 80 С и обрабатывали водой (70 мл). После удаления масляной бани смесь перемешивали в течение 4 ч при температуре окружающей среды и более 1 ч при 0 С. Полученный осадок отфильтровывали, промывали смесью 2:1 этанола и воды (120 мл) и сушили продуванием азота, получая указанное в заголовке соединение (6, R1 = этил, R2 = метил, R4 = бензил, R5 = водород, 30,2 г, 64,0% в расчете на две стадии из соединения формулы 4). 1 Н ЯМР (500 МГц, CDCl3):8,53 (ушир.с, 1 Н), 7,33 (м, 5 Н), 5,07 (с, 1 Н), 4,64 (д, J=5,5 Гц, 2 Н), 4,48(97 мл) прибавляли боргидрид натрия (NaBH4; 7,34 г, 194 ммоль) и уксусную кислоту (58 г, 970 ммоль) в течение 30 мин, поддерживая температуру смеси ниже 0 С. Через 30 мин медленно, за 30 мин прибавляли водный 3 н. раствор NaOH (194 мл, 582 ммоль). Органический слой отделяли, промывали рассолом(97 мл) и концентрировали при пониженном давлении, получая указанное в заголовке соединение (7,R1 = этил, R2 = метил, R4 = бензил, R5 = водород, 32,1 г, 106%), которое использовали в следующей реакции. 1 Н ЯМР (400 МГц, CDCl3):7,35-7,21 (м, 5 Н), 4,53 (2 дд, J=46,8, 10,4 Гц, 2 Н), 4,13 (кв, J=7,2 Гц,2 Н), 3,80 (2 д, J=12,8 Гц, 2 Н), 3,53 (дд, J=8,4, 4,0 Гц, 1 Н), 3,30 (с, 3 Н), 3,22 (с, 3 Н), 2,79 (дд, J=15,6, 3,6 Гц,1 Н), 2,40 (ддд, J=15,6, 8,0, 1,6 Гц, 1 Н), 1,25 (т, J=7,2 Гц, 3 Н). Пример 7. Этил-3-амино-5-фтор-4,4-диметоксипентаноат (1, R1 = этил, R2 = метил). Раствор этил-3-(бензиламино)-5-фтор-4,4-диметоксипентаноата (7, R1 = этил, R2 = метил, R4 = бензил, R5 = водород, 32,1 г, 103 ммоль) в метаноле (321 мл) обрабатывали 10%-ным палладиевым катализатором (10%-ный Pd/C) в атмосфере водорода (1 атм) в течение 4 ч. Неочищенную смесь фильтровали через слой целита (Celite) (96 г), промывали метанолом (160 мл) и фильтрат концентрировали при пониженном давлении, получая указанное в заголовке соединение (1, R1 = этил, R2 = метил, 21,4 г, 94%),которое было использовано в следующей реакции. 1 Н ЯМР (500 МГц, CDCl3):4,53 (2 дд, J=46,5, 10,4 Гц, 2 Н), 4,14 (кв, J=7,3 Гц, 2 Н), 3,57 (дд, J=11,0,1,9 Гц, 1 Н), 3,29 (д, J=11,7 Гц, 6 Н), 2,73 (дд, J=16,5, 2,5 Гц, 1 Н), 2,36 (ддд, J=16,5, 10,4, 2,5 Гц, 1 Н), 1,25(т, J=7,3 Гц, 3 Н). Пример 8. Тартрат 1-этокси-5-фтор-4,4-диметокси-1-оксопентан-3-аминия (10, R1 = этил, R2 = метил, R6 = Н). Раствор этил-3-амино-5-фтор-4,4-диметоксипентаноата (1, R1 = этил, R2 = метил, 4,33 г, 19,4 ммоль) в изопропаноле (40 мл) нагревали до 50 С и обрабатывали раствором D,L-винной кислоты (2,91 г,19,4 ммоль) в воде (6,6 мл). Масляную баню удаляли и смесь перемешивали при температуре окружающей среды в течение 2 ч. Полученную суспензию разбавляли смесью изопропанола (47 мл) и воды (2 мл) и перемешивание продолжали в течение еще 2 ч. Осадок отфильтровывали, промывали изопропанолом- 12016854 Применимость в промышленности Данное изобретение относится к способу получения соединения формулы 1. Синтетический способ получения не требует очень низкотемпературных условий, и промежуточный продукт 6 легко очистить кристаллизацией для обеспечения высокой степени чистоты соединения формулы 1, что делает его более подходящим для крупномасштабного синтеза. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы 6, включающий следующие стадии:(a) получение соединения формулы 4 удалением защитной группы в соединении формулы 3;(b) получение соединения формулы 9 взаимодействием соединения формулы 4 с R1OC(=O)OR3 и(c) взаимодействие соединения формулы 9 с NH(R4)(R5)[Формула 6] где R1 и R3 независимо представляют собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу и Р представляет собой защитную группу; алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. 2. Способ по п.1, в котором стадию (а) проводят в присутствии одного или более оснований, выбранных из группы, состоящей из M1OH, M2(OH)2, (M1)2CO3, (M1)HCO3 и M2CO3, где M1 представляет собой щелочной металл, а М 2 представляет собой щелочно-земельный металл. 3. Способ по п.1, в котором стадию (b) проводят в присутствии одного или более оснований, выбранных из группы, состоящей из первичных, вторичных или третичных алкоголятов щелочного металла или щелочно-земельного металла; реактива Гриньяра; алкиллития; диалкиламида лития; гексаметилсилазида лития; гексаметилсилазида натрия и гексаметилсилазида калия. 4. Способ по п.3, в котором количество основания составляет от 0,05 до 1,5 экв. по отношению к соединению формулы 4. 5. Способ по п.1, в котором R1 и R3 на стадии (b) независимо выбраны из группы, состоящей из метила, этила, пропила, бутила и изопропила. 6. Способ по п.1, в котором количество R1OC(=O)OR3 на стадии (b) составляет 1-5 экв. по отношению к соединению формулы 4. 7. Способ по п.1, в котором стадию (b) проводят в одном или более растворителях, выбранных из группы, состоящей из диметилформамида, диметилсульфоксида и N-метилпирролидона, или растворителе, смешанном с тетрагидрофураном. 8. Способ по п.1, в котором R4 и R5 на стадии (с) независимо друг от друга выбраны из группы, состоящей из водорода, три(C1-8 алкил)силила, бензила, 1-фенилэтила и 1-нафтилэтила. 9. Способ по п.1, включающий после стадии (с) дополнительную стадию, на которой соединение формулы 6 кристаллизуют из одного или более растворителей, выбранных из группы, состоящей изC1-C5-спирта и C3-C5-кетона, и воды. 10. Способ по п.1, в котором способ получения соединения формулы 3 предусматривает:(d) получение соединения формулы 2 взаимодействием соединения формулы 8 с анионом триметилсилилацетилена и(e) взаимодействие соединения формулы 2 с защитной группой[Формула 3] где R2 независимо представляет собой C1-8 алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R6 и R7 независимо представляют собой С 1-8 алкильную группу или C1-8 алкоксильную группу или вместе с атомом азота, к которому они присоединены, могут образовывать гетероцикл, выбранный из пиперидина, морфолина, тиаморфолина, пирролидина, имидазолидина и пиперазина; и Р представляет собой защитную группу. 11. Способ по п.10, в котором количество аниона триметилсилилацетилена на стадии (d) составляет 1-3 экв. по отношению к соединению формулы 8. 12. Способ получения соединения формулы 1, включающий следующие стадии:(e) получение соединения формулы 7 восстановлением соединения формулы 6, полученного способом по п.1, в присутствии восстановителя, способного селективно восстанавливать двойную связь между атомами углерода; и(f) гидрирование соединения формулы 7[Формула 1] где R1 представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу; алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. 13. Способ по п.12, в котором восстановитель на стадии (е) выбран из группы, состоящей из (i) триацетоксиборгидрида натрия, (ii) уксусной кислоты и цианоборгидрида натрия или (iii) уксусной кислоты- 14016854 и боргидрида натрия. 14. Способ по п.12, в котором процесс гидрирования на стадии (f) ведут в присутствии металлического катализатора. 15. Способ получения соединения формулы 10, включающий взаимодействие соединения формулы 1, полученного согласно п.12, с производными винной кислоты[Формула 10] где R1 представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан или диоксан;R6 представляет собой водород, алкильную группу или ацильную группу, где ацильная группа имеет формулу RC(=O)-, иR представляет собой алкильную группу или арильную группу; алкил означает C1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. 16. Способ по п.15, в котором количество производных винной кислоты составляет 0,9-1,5 экв. по отношению к соединению формулы 1. 17. Способ по п.15, в котором производное винной кислоты представляет собой винную кислоту. 18. Способ по п.15, в котором один тип стереоизомера в соединении формулы 10 получают с применением оптически активной винной кислоты или O,O'-дибензоилвинной кислоты в качестве производного винной кислоты. 19. Соединение формулы 6[Формула 6] в которой R1 представляет собой алкильную группу;R2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан;R4 и R5 независимо представляют собой водород, триалкилсилильную группу, арилметильную группу или 1-арилэтильную группу; алкил означает С 1-8 углеводородный радикал и арил означает бензол, бифенил или нафталин. 20. Соединение формулы 9[Формула 9] в которой R1 и R3 независимо представляют собой алкильную группу иR2 независимо представляет собой алкильную группу или вместе с атомом кислорода, к которому он присоединен, может образовывать диоксолан; алкил означает С 1-8 углеводородный радикал. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07C 229/24
Метки: получения, способ, кислоты, новый, эфира, 3-амино-5-фтор-4-диалкоксипентановой
Код ссылки
<a href="https://eas.patents.su/16-16854-novyjj-sposob-polucheniya-efira-3-amino-5-ftor-4-dialkoksipentanovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ получения эфира 3-амино-5-фтор-4-диалкоксипентановой кислоты</a>




















