N-гидроксиамиды, w- замещенные трициклическими группами, как ингибиторы гистондеацетилазы, их получение и применение в фармацевтических формах
Номер патента: 13015
Опубликовано: 26.02.2010
Авторы: Джаннотти Данило, Димоулас Тула, Гуиди Антонио, Хармат Николас
Формула / Реферат
1. Соединения общей формулы I
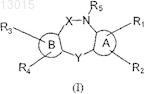
где X выбран из группы СО, SO2;
Y выбран из группы О, S, SO, SO2, C=O, N-R6;
А и В выбраны независимо из 5- или 6-членных колец, ароматических групп типа фенила или гетероароматических групп, выбранных из группы: тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксатиазол, 1,2,3-триазол, пиридин;
R1, R2, R3, R4 выбраны независимо из группы: Н, галоген, CF3, NO2, NR9R10, CN, C1-6-алкил, ОН, О-С1-6-алкил, O-(CH2)2-NR9R10, CH2-Z-R8, COR9, CR9R13R14, SR9, SOR15, SO2R15, Q-(CH2)nCONHOH;
R5 и R6 могут независимо означать группу, выбранную из Н, C1-6-алкила, Q1-(CH2)nCONHOH;
R8 означает группу (CH2)p-R11, где R11может означать метил или гидроксил;
Z выбран из группы О, NR12, S;
Q может означать химическую связь или может быть выбран из группы -О-, -S-, -NR12-, -NR9CO-, -CONR9-, -COW-, где W означает группу, выбранную из пиперидина или пирролидина;
Q1 может означать химическую связь или -СО-;
R9 и R10 могут независимо означать Н или C1-6-алкил;
R12 означает Н или группу R8;
R13 и R14могут либо одновременно означать атом фтора, либо означать атомы кислорода, соединенные алкильной цепочкой, состоящей из 2 или 3 СН2;
R15 означает C1-6-алкил;
n означает целое число между 2 и 6;
р означает целое число между 0 и 5;
с теми ограничениями, что
в молекуле всегда должна быть только одна группа, содержащая гидроксамат (CH2)nCONHOH; и
если X=СО, а А и В одновременно означают группу бензола, то R3и R4 не могут означать Q-(CH2)nCONHOH.
2. Соединения по п.1
гидроксиамид 6-(11-оксо-5,11-дигидродибензо[b,е][1,4]диазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(11-оксо-11H-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-метокси-11-оксо-5,11-дигидродибензо[b,е][1,4]диазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-метокси-11-оксо-11Н-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-хлор-11-оксо-5,11-дигидродибензо[b,е][1,4]диазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-хлор-11-оксо-11Н-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-метил-11-оксо-5,11-дигидродибензо[b,е][1,4]диазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(5,5,11-триоксо-5,11-дигидро-5l6-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-метокси-5,5,11-триоксо-5,11-дигидро-5l6-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-хлор-5,5,11-триоксо-5,11-дигидро-5l6-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-метокси-5,11-диоксо-5,11-дигидро-5l4-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(11-оксо-11H-дибензо[b,f][1,4]оксазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-метокси-11-оксо-11H-дибензо[b,f][1,4]оксазепин-10-ил)гексановой кислоты;
гидроксиамид 6-(8-хлор-11-оксо-11Н-дибензо[b,f][1,4]оксазепин-10-ил)гексановой кислоты;
гидроксиамид 7-(11-оксо-11Н-дибензо[b,f][1,4]оксазепин-10-ил)гептановой кислоты;
гидроксиамид 6-(5-оксо-5,11-дигидробензо[b]пиридо[2,3-е][1,4]диазепин-6-ил)гексановой кислоты;
гидроксиамид 6-(6,7-дихлор-10-оксо-4Н,10Н-2-тиа-4,9-диазабензо[f]азулен-9-ил)гексановой кислоты;
гидроксиамид 6-(8-метокси-5-оксо-5,11-дигидробензо[b]пиридо[2,3-е][1,4]диазепин-6-ил)гексановой кислоты;
гидроксиамид 6-(8,9-диметил-5-оксо-5,11-дигидробензо[b]пиридо[2,3-е][1,4]диазепин-6-ил)гексановой кислоты;
гидроксиамид 6-(8-диметиламино-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(3-метокси-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(10,10-диоксо-10Н-5-окса-10l6-тиа-11-азадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(8-амино-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(2-фтор-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(8-диметиламино-3-гидрокси-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(8-диметиламино-3-метокси-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(7-метил-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(2-метокси-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[a,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(7-метокси-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(11-метил-10,10-диоксо-10,11-дигидро-5Н-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-7-илокси)гексановой кислоты;
гидроксиамид 6-(4-амино-10,10-диоксо-5,10-дигидро-10l6-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты;
гидроксиамид 6-(10-оксо-4Н,10Н-2-тиа-4,9-диазабензо[f]азулен-9-ил)гексановой кислоты;
гидроксиамид 6-(6,7-дихлор-10-оксо-4Н,10Н-2-тиа-4,9-диазабензо[f]азулен-9-ил)гексановой кислоты;
N-гидрокси-4-[1-(11-оксо-10,11-дигидро-5Н-дибензо[b,е][1,4]диазепин-6-карбонил)пиперидин-4-ил]бутирамид.
3. Применение соединений по п.1 для получения фармацевтических композиций, применимых в качестве ингибиторов гистондеацетилазы.
4. Применение по п.3 для получения фармацевтических композиций, применимых для лечения воспалительных заболеваний, диабета, осложнений диабета, гомозиготной талассемии, фиброза, цирроза, острой промиелоцитарной лейкемии (APL), отторжения трансплантатов, аутоиммунных заболеваний, протозойных инфекций и опухолевых патологий.
5. Применение по п.4 для получения фармацевтических композиций, применимых для лечения опухолевых патологий.
6. Применение соединений по п.1 в комбинации с одним или несколькими активными началами, выбранными из химиотерапевтических средств, для получения фармацевтических композиций, применимых для лечения опухолевых патологий.
7. Применение соединений по п.1 для получения фармацевтических композиций, применимых в комбинации с радиотерапевтическим лечением для лечения опухолевых патологий.
8. Применение по п.6 в комбинации с одним или несколькими соединениями, выбранными из группы обычных цитотоксических средств, деметилирующих средств, ингибиторов циклинзависимых киназ, веществ, способствующих дифференцировке, модуляторов передачи сигналов, антагонистов HSP-90, ингибиторов протеасом.
9. Применение по п.8 для получения комбинации с одним или несколькими соединениями, выбранными из обычных цитотоксических средств: флударабина, гемцитабина, децитабина, паклитакселя, карбоплатина и ингибиторов топоизомеразы I/II, в том числе этопозида, иринотекана, топотекана, Т-128, и таких антрациклинов, как доксорубицин, сабарубицин, даунорубицин; из деметилирующих средств: 5-аза-2'-дезоксицитидина (5-аза-dC), 5-азацитидина; из ингибиторов циклинзависимых киназ: флавопиридола, оломоуцина, росковитина, пурваланола В, GW9499, GW5181, CGP60474, CGP74514, AG12286, AG12275, стауроспорина, UCN-01; из веществ, способствующих дифференцировке: ретиноевой кислоты и ее производных (полностью транс-ретиноевой кислоты (ATRA), 13-цис-ретиноевой кислоты (CRA)), РМА (форболмиристат-ацетата); из модуляторов передачи сигналов: TRAIL, иматиниб-мезилата, LY-294002, бортезомиба; из антагонистов HSP-90: гелданамицина и его аналогов (17-AAG); из ингибиторов протеасом: лактацистина, MG132, бортезомиба (Velcadeä).
10. Фармацевтические композиции, содержащие в качестве активного начала соединение общей формулы I по пп.1-4, для лечения воспалительных заболеваний, диабета, осложнений диабета, гомозиготной талассемии, фиброза, цирроза, острой промиелоцитарной лейкемии (APL), отторжения трансплантатов, аутоиммунных заболеваний, протозойных инфекций и опухолевых патологий.
Текст
013015 Область техники, к которой относится изобретение Настоящее изобретение касается -замещенных N-гидроксиамидов N-алкилкарбоновых кислот, которые являются соединениями-ингибиторами гистондеацетилазы, способов их получения и применения их для получения фармацевтических композиций, предназначенных для лечения тех патологий, в которых важную роль играет механизм генной регуляции. Предпочтительный аспект настоящего изобретения составляют соединения общей формулы (I) где X выбран из группы СО, CS, SO2, CH2;Y выбран из группы О, S, SO, SO2, СН 2, С=О, С=СН 2, N-R6, CH-OR6, CN-NR6R9, C=CH-CO-R7; А и В выбраны независимо из 5- или 6-членных колец, ароматических групп типа фенила или гетероароматических групп, выбранных из группы: фуран, тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксатиазол, 1,2,3-триазол, пиридин, пиридазин, пиримидин и пиразин;R1, R2, R3, R4 выбраны независимо из группы: Н, галоген, CF3, NO2, NR9R10, CN, СООН,(CH2)m-CONR9R10, C1-6-алкил, ОН, О-С 1-6-алкил, О-циклопропил, O-(CH2)2-O-C1-6-алкил, O-(CH2)2NR9R10, O-CONHR9, CH2-Z-R8, COR9, CR9R13R14, SR9, SOR15, SO2R15, CR9NOR9, CR9NNR9R10,Q-(CH2)nCONHOH или означают 5- или 6-членное кольцо, выбранное из группы: фуран, тиофен, пиррол,оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксатиазол, 1,2,3-триазол, пиридин, пиридазин, пиримидин, пиразин, морфолин, тиоморфолин, пиперидин, пирролидин;R5 и R6 могут независимо означать группу, выбранную из Н, C1-6-алкила, Q1-(CH2)nCONHOH;R8 означает группу (CH2)p-R11, где R11 может означать метил или гидроксил;Z выбран из группы О, NR12, S;Q может означать химическую связь или может быть выбран из группы -О-, -S-, -NR12-, -NR9CO-,-CONR9-, -W-, -COW-, где W означает группу, выбранную из пиперидина или пирролидина;Q1 может означать химическую связь или -СО-;R9 и R10 могут независимо означать Н или С 1-6-алкил;R13 и R14 могут либо одновременно означать атом фтора, либо означать атомы кислорода, соединенные алкильной цепочкой, состоящей из 2 или 3 СН 2;n означает целое число между 2 и 9;m означает целое число между 0 и 2; р означает целое число между 0 и 5; с теми ограничениями, что в молекуле всегда должна быть только одна группа, содержащая гидроксамат (CH2)nCONHOH; и если X=СО, а А и В одновременно означают группу бензола, то R3 и R4 не могут означать Q(CH2)nCONHOH. В настоящее изобретение также входят все возможные оптические изомеры, как то энантиомеры и/или диастереоизомеры, возникающие вследствие возможного присутствия хиральных центров или иных стереогенных элементов в соединениях общей формулы (I), a также их возможные смеси как рацемические, так и в разных пропорциях. Также входят и соли неорганических и органических кислот или оснований, если в молекуле присутствует группа основного или кислотного характера. Уровень техники Гистондеацетилаза, как известно, играет важную роль в механизме, регулирующем экспрессию генов. Ингибиторы гистондеацетилазы (HDAC) вызывают гиперацетилирование гистонов с последующим изменением самой экспрессии генов. Следовательно, такие ингибиторы полезны как средства для терапии или профилактики патологических состояний, вызванных нарушением экспрессии генов, как то воспалительных заболеваний, диабета, осложнений диабета, гомозиготной талассемии, фиброза, цирроза,острой промиелоцитарной лейкемии (APL), отторжения трансплантатов, аутоиммунных заболеваний,протозойных инфекций, опухолей и др. Фермент гистондеацетилаза уже хорошо изучен и, при исследовании различных классов ингибиторов методами рентгенографии и SAR (Stracture-Activity-Relationship-исследование, которое позволяет связать структурную модификацию молекул и их активность), были установлены структурные характеристики, которыми должен обладать потенциальный ингибитор; в частности, это: а) домен, способный связывать металл (а именно Zn), b) линкер, способный занимать канал фермента, и с) домен поверхностного узнавания, который взаимодействует со структурами, находящимися на кромке активного центра фермента (J. Med. Chem. 2003, 46(24), 5097-5116). За последние несколько лет появилось много примеровBioorganicMedicinal Chem. Letters (2004), 14, 449-453. В других публикациях отмечены гидроксамовые кислоты, у которых линкер не является линейным; в BioorganicMedicinal Chem. Letters (2001), 11,2847-2890 линкер представлен фенилэтилом или стирилом, в BioorganicMedicinal Chem. Letters (2002),12, 1347-1349 линкер представлен фенилом или циклогексилом, а в соединениях, описанных вWO 2004/013130, присутствует линкер, состоящий из тиофена. Другие авторы показали возможность замены гидроксамовой кислоты другими группами, способными связывать металл из активного центра фермента, к примеру, амидами (J. Med. Chem. (2003) 46, 820-830; или в ЕР 847992) либо электрофильными кетонами. В WO 2004/069133 описаны соединения, у которых в соответствии с вышеприведенной схемой металлосвязывающая группа представлена фенилендиаминамидом, а линкер представлен гетероциклом, выбранным из индола, бензотиофена или бензофурана. В WO 02/085883 описаны алкилгидроксаматы, -замещенные трициклическими группами. В общем, там заявлены гидроксаматы, у которых трициклическая группа представлена системами 6-5-6 или 6-7-6, в которых оба 6-членные кольца всегда представлены кольцами фенила. Из тех соединений, которые получены и описаны в примерах, фактически отмечается лишь одно соединение с трициклической группой типа 6-7-6, у которого в качестве центральной 7-членной группы фигурирует оксепинон; более того, у этого соединения ингибирующая активность при 10 нМ равна 62%, так что она определенно является самой низкой из всех протестированных соединений. Несмотря на вс то что уже известно по этой тематике, вс еще существует большая потребность в выявлении новых ингибиторов HDAC, что даст возможность получить новые лекарства для лечения многих патологий, которые потенциально излечимы по этому механизму действия. Осуществление изобретения Целью настоящего изобретения является получение новых ингибиторов HDAC общей формулы (I),полезных в качестве лекарств, и фармацевтических композиций, содержащих их в качестве активных ингредиентов, для лечения или профилактики таких патологий, как воспалительные заболевания, диабет,осложнения диабета, гомозиготная талассемия, фиброз, цирроз, острая промиелоцитарная лейкемия(APL), отторжение трансплантатов, аутоиммунные заболевания, протозойные инфекции, опухоли и др. Группу предпочтительных соединений настоящего изобретения составляют такие соединения общей формулы (I), у которыхX выбран из группы СО, SO2;Y выбран из группы О, S, SO, SO2, СН 2, С=О, С=СН 2, N-R6, C=CH-CO-R7; А и В выбраны независимо из 5- или 6-членных колец, ароматических групп типа фенила или гетероароматических групп, выбранных из группы: тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксатиазол, 1,2,3-триазол, пиридин;R1, R2, R3, R4 выбраны независимо из группы: Н, галоген, CF3, NO2, NR9R10, CN, СООН, (CH2)mCONR9R10, C1-6-алкил, ОН, О-С 1-6-алкил, О-циклопропил, O-(CH2)2-O-C1-6-алкил, O-(CH2)2-NR9R10,O-CONHR9, CH2-Z-R8, COR9, CR9R13R14, SR9, SOR15, SO2R15, CR9NOR9, CR9NNR9R10, Q-(CH2)nCONHOH;R5 и R6 могут независимо означать группу, выбранную из Н, C1-6-алкила, Q1-(CH2)nCONHOH;R8 означает группу (CH2)P-R11, где R11 может означать метил или гидроксил;Z выбран из группы О, NR12, S;Q может означать химическую связь или может быть выбран из группы -О-, -S-, -NR12-, -NR9CO-,-CONR9-, -COW-, где W означает группу, выбранную из пиперидина или пирролидина;Q1 может означать химическую связь или -СО-;R9 и R10 могут независимо означать Н или C1-6-алкил;R13 и R14 могут либо одновременно означать атом фтора, либо означать атомы кислорода, соединенные алкильной цепочкой, состоящей из 2 или 3 СН 2;n означает целое число между 2 и 9;m означает целое число между 0 и 2; р означает целое число между 0 и 5; с теми ограничениями, что в молекуле всегда должна быть только одна группа, содержащая гидроксамат (CH2)nCONHOH; и если X=СО, а А и В одновременно означают группу бензола, то R3 и R4 не могут означать Q(CH2)nCONHOH. Особенно предпочтительны такие соединения общей формулы (I), у которыхX выбран из группы СО, SO2;Y выбран из группы О, S, SO, SO2, C=O, N-R6; А и В выбраны независимо из 5- или 6-членных колец, ароматических групп типа фенила или гете-2 013015 роароматических групп, выбранных из группы: тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксатиазол, 1,2,3-триазол, пиридин;R1, R2, R3, R4 выбраны независимо из группы: Н, галоген, CF3, NO2, NR9R10, CN, С 1-6-алкил, ОН, OC1-6-алкил, О-(CH2)2-NR9R10, CH2-Z-R8, COR9, CR9R13R14, SR9, SOR15, SO2R15, Q-(CH2)nCONHOH;R5 и R6 могут независимо означать группу, выбранную из Н, C1-6-алкила, Q1-(CH2)nCONHOH;R8 означает группу (CH2)p-R11, где R11 может означать метил или гидроксил;Z выбран из группы О, NR12, S;Q может означать химическую связь или может быть выбран из группы -О-, -S-, -NR12-, -NR9CO-,-CONR9-, -COW-, где W означает группу, выбранную из пиперидина или пирролидина;Q1 может означать химическую связь или -СО-;R9 и R10 могут независимо означать Н или C1-6-алкил;R13 и R14 могут либо одновременно означать атом фтора, либо означать атомы кислорода, соединенные алкильной цепочкой, состоящей из 2 или 3 СН 2;n означает целое число между 2 и 6; р означает целое число между 0 и 5; с теми ограничениями, что в молекуле всегда должна быть только одна группа, содержащая гидроксамат (CH2)nCONHOH; и если X=СО, а А и В одновременно означают группу бензола, то R3 и R4 не могут означать Q(CH2)nCONHOH. В настоящем изобретении предпочтительными значениями для C1-6-алкила являются группы, выбранные из метила, этила, пропила, изопропила, н-бутила, 2-бутила, трет-бутила, пентила, гексила, 3 гексила; галоген означает группу, выбранную из F, Cl, Br, I. Ингибиторы HDAC настоящего изобретения могут быть синтезированы в соответствии с теми реакциями, которые известны в этой области (Hargrave K.D. et al. in J. Med. Chem. 1991, 34. 2231-2241;Giannotti D. et al. in J. Med. Chem. 1991, 1356-1362; Press J.B. in J. Med. Chem., 1979, 22(6), 725-731; CA 73:87951 (1970) JP-45015983), но могут сильно варьировать, исходя из последовательности стадий синтеза, необходимых для получения индивидуальных соединений, представленных общей формулой (I). Описательная схема приводится ниже в качестве примера. В случае настоящего изобретения важно, чтобы образование трициклической системы проводилось,к примеру, по одному из путей, представленных на схемах 1 и 2, или по их вариантам, известным специалистам в этой области. Общая схема. Схема 1 То, что представлено на схеме 1, может быть легче осуществить по схеме 2. Далее изложены некоторые неограничивающие примеры настоящего изобретения. Пример 1. Синтез по схеме 2(А) и (С). Гидроксиамид 6-(11-оксо-5,11-дигидродибензо[b,е][1,4]диазепин-10-ил)гексановой кислоты. Стадия 1. Смешивали антраниловую кислоту (10 г, 72,20 ммоль) с амиловым спиртом (100 мл) и эту смесь нагревали с перемешиванием на масляной бане до 140 С. При доведении до этой температуры добавляли о-бромнитробензол (12,89 г, 64,40 ммоль), затем карбонат калия (9 г, 65 ммоль) и потом порошковую медь (0,4 г, 6,2910-3 моль). После нагревания смеси менее 30 мин при 140 С выпадала в осадок твердая масса, отчего перемешивание становилось невозможным. Твердую массу держали при этой температуре еще 3 ч, а затем охлаждали до комнатной температуры. Твердую массу переносили на воронку из пористого стекла с помощью диэтилового эфира (100 мл), разбивая е на мелкие кусочки. Твердые частицы дополнительно промывали эфиром (3100 мл) и сушили под разрежением. Затем кирпичнокрасное вещество растворяли в воде (ок. 500 мл) и из образовавшегося красного раствора отфильтровывали катализатор. Фильтрат переносили в стакан на 1 л и подкисляли конц. HCl (50 мл). Образовавшийся ярко-оранжевый осадок продукта отфильтровывали и сушили под разрежением в течение ночи. Выход: 15,82 г (96%) продукта реакции конденсации.HPLC (А)=4,03 мин; MS[Ices+] MH+=259,0. Стадия 2. Полученный выше промежуточный продукт (16,46 г, 63,53 ммоль) смешивали с абсолютным этанолом (500 мл) и эту смесь нагревали до 78 С. Растворяли дитионит натрия (52 г, около 85%,технический, 253,99 ммоль, 4 мольэкв.) в воде (230 мл) и по каплям добавляли в горячий спиртовой раствор субстрата. Затем добавляли еще одну порцию этанола (100 мл), чтобы растворить весь оставшийся субстрат, и заключительную смесь держали при 78 С в течение 1 ч. После охлаждения до комнатной температуры из смеси отфильтровывали нерастворимый неорганический материал, который промывали этанолом (2150 мл). Объединенные фильтраты опять фильтровали, чтобы удалить остающийся осадок неорганического материала. Эту операцию повторяли еще раз с промывкой объединенных нерастворимых фракций этанолом (300 мл) и фильтрованием объединенного фильтрата в третий раз, чтобы удалить весь остающийся осадок неорганического материала. Заключительный объединенный фильтрат избавляли от этанола при пониженном давлении, получая взвесь требуемого продукта, которую суспендировали в воде (140 мл). Наконец, эту взвесь продукта фильтровали, получая после высушивания под разрежением 11,06 г (с выходом 76%) требуемого амина в виде горчично-желтого вещества.-4 013015 Стадия 3. Суспендировали 2-(2-амино-фениламино)бензойную кислоту (2,50 г, 10,96 ммоль) в ацетонитриле (200 мл) и добавляли HOBt (4,40 г, 32,90 ммоль). После перемешивания в течение 10 мин добавляли EDCHCl (3,10 г, 16,12 ммоль), при этом после добавления конденсирующего реагента отмечалось усиление окраски реакционной смеси до желто-золотого цвета вместе с растворением суспензии. Смесь оставляли с перемешиванием на 3 ч, после чего удаляли ацетонитрил при пониженном давлении. К остатку добавляли этилацетат (200 мл), а затем 10% раствор лимонной кислоты (100 мл). Обе фазы энергично взбалтывали в колбе, а затем разделяли. Водную фракцию еще раз экстрагировали этилацетатом (200 мл). Объединенные экстракты в этилацетате промывали насыщенным раствором бикарбоната натрия (200 мл) и осушали над сульфатом натрия. После удаления растворителя при пониженном давлении получали 2,12 г (с выходом 92%) 5,10-дигидродибензо[b,е][1,4]диазепин-11-она в виде желтого вещества.DMF при комнатной температуре в течение 36 ч (55%-е превращение в продукт) с последующим добавлением дополнительных порций гидрида натрия (43 мг, затем 16 мг) получали, по данным анализа неочищенного продукта методом HPLC, превращение около 89% предшественника в требуемое производное N-гексилкарбоксилата. Продукт выделяли и обрабатывали смесью метанола (10 мл) и тионилхлорида(0,5 мл), чтобы метилировать побочный продукт - карбоновую кислоту, образовавшуюся на стадии Nалкилирования. После выделения получали 790 мг (с выходом 98,5%) требуемого производного гексаноата - дибензодиазепинилметилового эфира в виде темно-коричневого масла. Полученный выше промежуточный продукт использовали непосредственно для превращения метилового эфира в гидроксамид при обработке метанольного раствора субстрата гидроксиламином (образовавшимся in situ при обработке гидроксиламина гидрохлорида свежеприготовленным метоксидом натрия в безводном метаноле). Выход: 105 мг (53%) требуемой гидроксамовой кислоты. Конечный продукт подвергали дополнительной очистке препаративным методом HPLC. Растворяли в MeCN/H2O+0,1% TFA (1/1, v/v, 5 мл) и вводили двумя порциями (22,50 мл) прямо в препаративную систему HPLC Shimadzu на колонку Symmetry (С 18, 7 м, 300, 19300 мм), элюируя по системеH2O+0,l%TFA/MeCN+0,1% TFA, от 70/30 до 10/90 за 60 мин, Ф=20 мл/мин, =220, 254 нм. Объем фракций: 10 мл. Время элюирования для данного продукта составило 22,39-25,76 мин. После сбора и лиофилизации фракций получали 84,70 мг гидроксиамида 6-(11-оксо-5,11 дигидродибензо[b,е][1,4]диазепин-10-ил)гексановой кислоты (титр 95% по данным HPLC).(2H, m) - 7,14 (1H, m) - 7,09-7,04 (3H, m) - 6,94 (1H, t) - 3,96 (2H, t) - 2,19 (mc, t) - 1,87 (2H, t) - 1,47 (2H,m) - 1,42 (2H, m) - 1,23 (2H, m). Следующие продукты получали аналогичным образом по вышеприведенной схеме, используя подходящие коммерческие реагенты, но с модификациями, хорошо известными специалистам в этой области. Пример 2. Гидроксиамид 6-(11-оксо-11 Н-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты.(1H, dd) - 7,29 (1H, td) - 7,15 (1H, s) - 7,01 (2H, m) - 6,92 (1H, t) - 6,88 (1H, d) - 3,96 (2H, t) - 2,24 (3H, s) 1,88 (2H, t) -1,47 (2H, m) - 1,43 (2H, m) - 1,24 (2H, m). При необходимости трициклический остов подвергали дополнительной обработке перед тем, как перейти к введению боковой группы, содержащей гидроксамовую кислоту, во всех случаях при помощи реакций и способов, известных специалистам в этой области. Один из самых важных из этих способов приводится в качестве неограничивающего примера. Пример 8. Гидроксиамид 6-(5,5,11-триоксо-5,11-дигидро-56-дибензо[b,f][1,4]тиазепин-10 ил)гексановой кислоты. Метиловый эфир 6-(11-оксо-5,11-дигидро-56-дибензо[b,f][1,4]тиазепин-10-ил)гексановой кислоты(500 мг, 1,41 ммоль), полученный, как описано в примере 1, растворяли в метаноле (32 мл), а раствор обрабатывали реагентом Oxone (0,97 г, 2,83 ммоль), растворенным в воде (16 мл). Сначала смесь перемешивали 48 ч при комнатной температуре с добавлением еще одного эквивалента окислительного реагента (0,40 г) через 24 ч. Однако, как показал анализ методом HPLC, реакция останавливалась главным образом на стадии сульфоксида (t=3,90 мин), и только 28% превращалось в дальнейший продукт типа сульфона (t=4,15 мин). Затем смесь нагревали при 50 С с добавлением еще одной порции оксона (0,40 г) через 7 ч и продолжали реакцию в течение ночи при той же температуре. Нагревание реакционной смеси продолжали и на следующий день с добавлением дополнительных порций оксона (20,40 г), а затем прерывали на выходные. После этого нагревание реакционной смеси при 50 С продолжали еще 24 ч, пока не достигали 94% превращения сульфоксида в сульфон. Смесь разбавляли добавлением воды и удаляли метанол при пониженном давлении. Продукт экстрагировали этилацетатом (250 мл) и объединенные органические экстракты осушали над сульфатом натрия. После удаления растворителя при пониженном давлении получали 480 мг бледно-желтого масла. Этот материал обрабатывали метанолом (50 мл) и 4NHCl в диоксане (10 мл), а раствор перемешивали 3 ч при комнатной температуре. При этом находившийся в исходной реакционной смеси побочный продукт типа кислоты (t=3,53 мин) превращался в нужный продукт типа метилового эфира. Смесь избавляли от метанола при пониженном давлении, остаток растворяли в этилацетате (50 мл), а раствор промывали водой (50 мл). Органическую фракцию осушали над сульфатом натрия и удаляли растворитель при пониженном давлении, получая 0,462 г (выход 85%) требуемого продукта в виде желтого масла, которое при хранении быстро превращалось в воскообразное вещество.HPLC (А): 4,16 мин; MS[Ices+] MH+=388,1. Стадия 2. Промежуточный сульфон (462 мг, 1,19 ммоль) растворяли в метаноле (35 мл) и добавляли в раствор гидроксиламин гидрохлорид (858 мг, 12,35 ммоль). Раствор охлаждали до 0 С на ледяной бане,а затем обрабатывали свежеприготовленным метоксидом натрия (770 мг натрия, 33,50 ммоль, в 15 мл безводного метанола). После перемешивания в течение 10 мин ледяную баню убирали, а реакцию продолжали еще 3 ч при комнатной температуре. Затем реакцию останавливали добавлением воды (25 мл) и удаляли метанол упариванием при пониженном давлении. Водный остаток разбавляли водой и нейтрализировали добавлением 1 М HCl (50 мл). Выпавший в осадок продукт экстрагировали этилацетатом(250 мл) и объединенный экстракт промывали водой (25 мл). После осушивания над сульфатом натрия и удаления растворителя при пониженном давлении получали 355 мг неочищенного продукта типа гидроксамовой кислоты. После третьей экстракции промывочных вод этилацетатом количество полученного продукта возрастало до 386 мг (выход 83%).HPLC (А): 3,06 мин; MS[Ices+] MH+=389,1. 1 Н-ЯМР (DMSO-d6, 600 МГц) : 10,30 (1H, s) - 10,07 (mc, s) - 8,95-8,57 (1H, bs) - 7,95 (1H, dd) - 7,867,82 (3H, m) - 7,79 (1H, td) - 7,76 (1H, t) - 7,72 (1H, td) - 7,49 (1H, t) - 4,49 (1H, m) - 3,80 (1H, m) - 2,22 (mc,t) - 1,90 (2H, t) - 1,65 (1H, m) - 1,51 (1H, m) - 1,47 (2H, m) -1,26 (2H, m). Следующие продукты получали аналогичным образом либо другими известными способами синтеза. Пример 9. Гидроксиамид 6-(8-метокси-5,5,11-триоксо-5,11-дигидро-56-дибензо[b,f][1,4]тиазепин 10-ил)гексановой кислоты.HPLC (A): 2,8 мин; MS[Ices+] MH+=403,0. 1 Н-ЯМР (DMSO-d6, 600 МГц) : 10,30 (1H, s) - 9,70 (mc, s) - 8,95 (mc, s) - 8,61 (1H, m) - 7,69 (2H, t) 7,62 (1H, d) - 7,55 (1H,tt) - 7,49 (1H, d) - 7,24 (1H, d) - 7,05 (1H, d), 4,57 (1H,dt), 3,78 (3H, s) - 3,67 (1H, m) 2,23 (mc, t) - 1,91 (2H, t) - 1,68-1,42 (4H, m) - 1,29 (2H, m). Пример 12. Гидроксиамид 6-(11-оксо-11H-дибензо[b,f][1,4]оксазепин-10-ил)гексановой кислоты. Стадии 1 и 2. Конденсированный дибензотрициклический промежуточный азоксипродукт, 2 нитробензо[b,f][1,4]оксазепин-11(10 Н)-он, получали в две стадии по методике, описанной в литературе для 7-Ме-замещенного аналога, приведенного в Klunder et al., J. Med. Chem., 1992, 35, 1887-1897. Первая стадия заключалась в конденсации 2-хлор-5-нитробензоилхлорида с 2-аминофенолом в THF в присутствии диизопропилэтиламина с перемешиванием при комнатной температуре в течение 48 ч. При этом получали промежуточный карбоксамид с выходом 92%. Анализ методом HPLC (A) t=3,58 мин; MS[Ices+] MH+=293,0. На следующей стадии промежуточный карбоксамид суспендировали в воде и обрабатывали 2NNaOH. После кипячения на протяжении 10 ч получали продукт с замкнутым кольцом с выходом 85% после фильтрования твердого материала и сушки под разрежением.HPLC=3,66 мин: MS[Ices+] MH+=257,2. Стадия 3. 2-Нитробензо[b,f][1,4]оксазепин-11(10 Н)-он (2,00 г, 7,81 ммоль) суспендировали в воде с абс. спиртом (25 мл+25 мл) и суспензию обрабатывали элементарным железом (0,36 г, 6,42 ммоль) и хлоридом железа (III) (65 мг, 0,4 ммоль). Суспензию кипятили на протяжении 2,5 ч. В кипящую смесь добавляли еще одну порцию железа (0,33 г) через 30 мин, а затем еще раз через 1 ч. После этого смесь выливали в большой объем этанола и фильтровали от частиц железа. Фильтрат избавляли от этанола при пониженном давлении, а остаток суспендировали в большом объеме воды. Продукт отфильтровывали и высушивали под разрежением. При этом получали 1,66 г (выход 94%) амина в виде вещества светлокирпичного цвета.HPLC (А)=2,19 мин; MS [Ices+] MH+=227,2. Стадия 4. Нагревали DMF (15 мл) на масляной бане до 50 С и туда же добавляли m-бутилнитрит(0,98 мл, 7,47 ммоль). В раствор m-бутилнитрита по каплям вносили амин (1 г, 3,90 ммоль) в DMF(10 мл) с такой скоростью, чтобы внутренняя температура не превышала 50 С. По завершении добавления субстрата смесь держали при той же температуре еще 40 мин. Смесь охлаждали до комнатной температуры и фильтровали через фильтр из пористого стекла. Фильтрат по каплям добавляли в смесь вода/конц. HCl (30 мл+30 мл), после чего продукт выпадал в осадок. Добавляли еще больше воды (140 мл) и оставляли смесь на 1 ч с перемешиванием. Продукт отфильтровывали под разрежением и высушивали. Дополнительный продукт получали при экстрагировании водного фильтрата этилацетатом (250 мл). Органическую фракцию осушали над сульфатом натрия и удаляли растворитель при пониженном давлении, получая твердый остаток, который обрабатывали петролейным эфиром (40-60), отфильтровывали твердое вещество под разрежением и объединяли его с первой партией продукта. После дополнительной промывки объединенной партии продукта петролейным эфиром и сушки под разрежением получали 0,68 г (выход 73%) дибензооксазепинона в виде темно-желтого вещества.HPLC (А)=3,45 мин; MS[Ices+] MH+=212,2. Стадия 5. Трициклическое соединение превращали в конечный продукт по методикам, уже описанным в предыдущих примерах.(mc, t) - 1,89 (2H, t) - 1,56 (2H, m) - 1,46 (2H, m) - 1,25 (2H, m). Следующие продукты получали аналогичным образом. Пример 13. Гидроксиамид 6-(8-метокси-11-оксо-11H-дибензо[b,f][1,4]оксазепин-10-ил)гексановой кислоты.- 7,56-7,52 (2H, m) - 7,38 (1H, dd) - 7,33 (1H, dd) - 7,28 (2H, qd) - 7,22 (1H, td) -4,10 (2H, bs) - 2,21 (mc, t) 1,89 (1H, t) - 1,55 (2H, m) - 1,41 (2H, m) - 1,26 (2H, m) - 1,20 (2H, m). Пример 16 (схема 2 А-С). Гидроксиамид 6-(5-оксо-5,11-дигидробензо[b]пиридо[2,3-е][1,4]диазепин 6-ил)гексановой кислоты. Стадия 1. Суспензию из 108 мг (1 экв., 1 ммоль) о-фенилендиамина и 157 мг (1 экв., 1 ммоль) 2 хлорникотиновой кислоты в монометиловом эфире диэтиленгликоля нагревали при 150 С в течение 6 ч. Суспензии давали остыть до комнатной температуры, а затем е всю выливали в воду, охлажденную до 0 С. Перемешивали в течение 20 мин, а затем образовавшийся коричневатый осадок отфильтровывали через пористую мембрану и оставляли сушиться на воздухе на фильтровальной бумаге. При этом получали 115 г твердого вещества (выход 54%).HPLC (В)=7,1 мин; MS[Ices+] MH+=212,2. Полученное трициклическое соединение затем превращали в конечный продукт по уже описанной методике.(2H, m) - 1,41 (2H, m) - 1,22 (2H, m). Следующие соединения получали точно таким же образом. Пример 17. Гидроксиамид 6-(6,7-дихлор-10-оксо-4 Н,10 Н-2-тиа-4,9-диазабензо[f]азулен-9 ил)гексановой кислоты.(2H, t) - 1,43 (4H, m) - 1,22 (2H, m). Пример 20 (В) (С). Гидроксиамид 6-(8-диметиламино-10,10-диоксо-5,10-дигидро-106-тиа-5,11 диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты. Стадия 1. Вносили 1-хлор-4-нитробензол (6,93 г, 44 ммоль) в колбу, содержащую хлорсульфоновую кислоту (20 мл), и нагревали при 120 С в течение 16 ч. После разложения порции реакционной смеси и экстрагирования дихлорметаном выполняли анализ методом GC-масс-спектрометрии, который показал 74% продукта и 14% непрореагировавшего исходного вещества. Реакцию останавливали, выливая смесь на лед, затем экстрагировали дихлорметаном, промывали насыщенным раствором NaCl, сушили на фазоразделителе и упаривали досуха. Получали 9,17 г полутвердого продукта и в таком виде использовали для дальнейшего синтеза. Стадия 2. Синтез 3-нитро-6,11-дигидродибензо[с,f][1,2]тиазепин-5,5-диоксида. Суспендировали ортофенилендиамин (44,4 ммоль, 4,8 г) в пиридине (20 мл), затем в эту суспензию медленно добавляли 2 хлор-5-нитробензолсульфонилхлоридхлорид, под конец ресуспендируя в пиридине, чтобы извлечь его из колбы. Поскольку реакция является экзотермической, то е охлаждали на водяной бане. По завершении добавления суспензию кипятили в течение 1,5 ч. Анализ методом HPLC показал исчезание хлорида серы-8 013015 и образование продукта. Реакционную смесь упаривали досуха, а остаток обрабатывали 1N HCl до рН 1,экстрагировали этилацетатом, промывали насыщенным раствором NaCl и осушали над MgSO4. При испарении растворителя получали остаток, затвердевающий при обработке этиловым эфиром, который затем отфильтровывали и промывали эфиром. Получали 4,35 г 3-нитро-6,11-дигидродибензо[с,f][1,2]тиазепин-5,5-диоксида в виде желтого вещества.HPLC (А)=3,4 мин; MS[Ices+] MH+=291,4. Стадия 3. Полученное перед этим вещество (6 ммоль, 1,746 г) растворяли в метаноле (50 мл) и обрабатывали метанольным раствором метоксида натрия (6 ммоль, 36 мл раствора, содержащего 385 мг натрия в 100 мл метанола). Затем полученный раствор сушили и упаривали досуха с помощью механического насоса, получая соответствующую натриевую соль сульфонамида в твердом виде. Это соединение растворяли в DMF (30 мл), добавляли метил-6-бромгексаноат (6 ммоль, 1,45 г) в DMF (10 мл) и нагревали смесь при 100 С в течение 3 ч до завершения реакции по данным HPLC. Реакционную смесь упаривали под вакуумом с помощью механического насоса, остаток обрабатывали насыщенным раствором NaCl и экстрагировали этилацетатом, осушали и упаривали досуха, получая продукт с количественным выходом.HPLC (A)=4,45 мин; MS[Ices+] MH+=419,8. Стадия 4. Алкилированное промежуточное соединение (4,5 ммоль, 1,9 г) растворяли в горячей ледяной уксусной кислоте (80 мл) и вносили первую порцию железа, восстановленного водородом (2,5 г,45 ммоль, разделено на 4 порции). Смесь кипятили с обратным холодильником в течение 1,5 ч; за первый час вносили остальные 3 порции железа. После кипячения около 1 ч реакционная смесь приобретала вид молочной суспензии бежевого цвета. По окончании реакции смесь охлаждали до 60 С и фильтровали через мембрану, промывая осадок уксусной кислотой. Фильтрат упаривали досуха, а остаток обрабатывали водой, экстрагировали DCM, промывали 5% NaHCO3 и осушали. После испарения растворителя получали метиловый эфир 6-(8-ацетиламино-10,10-диоксо-5,10-дигидро-106-тиа-5,11-диазадибензо[а,d]циклопентен-11-ил)гексановой кислоты в твердом виде (1,57 г). Твердый эфир суспендировали в метаноле (30 мл), обрабатывали 1N NaOH (8 ммоль, 8 мл) и кипятили в течение 1 ч, отмечая исчезание эфира и образование кислоты методом HPLC. Из реакционной смеси испаряли метанол под вакуумом, смесь разбавляли водой и экстрагировали примеси этилацетатом(50 мл), а оставшийся водный раствор подкисляли 1N HCl. Отделившееся вещество экстрагировали этилацетатом, осушали и упаривали, получая при этом 1,29 г твердого вещества с выходом 85,8%.HPLC (A)=3,19 мин; MS[Ices+] MH+=418,0. Полученную перед этим 6-(8-ацетиламино-10,10-диоксо-5,10-дигидро-106-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановую кислоту (387 мг, 0,93 ммоль) обрабатывали 95 этанолом (10 мл) и конц. HCl (2 мл) и кипятили в течение 1 ч, отмечая методом HPLC исчезание реагента и образование 30% кислоты и 70% этилового эфира. Реакционную смесь концентрировали на роторном испарителе, а остаток обрабатывали насыщенным раствором NaCl. Смесь экстрагировали этилацетатом и после осушивания и упаривания досуха получали 290 мг твердой массы, которую использовали в неочищенном виде для следующей реакции. Полученную перед этим неочищенную смесь (290 мг) растворяли в метаноле (8 мл) и добавляли туда параформальдегид (105 мг, 3,5 ммоль), уксусную кислоту (0,15 мл, 2,5 ммоль) и NaCNBH3 (126 мг,2 ммоль). Смесь перемешивали 48 ч при комнатной температуре до полного превращения в диметилированные производные. Реакционную смесь подкисляли 1N HCl, а через 1/2 ч подщелачивали 1N NaOH(8 мл) и кипятили в течение 1/2 ч, получая одно лишь кислотное производное. После охлаждения продукт подкисляли 1N HCl и экстрагировали этилацетатом, а затем, после промывки насыщенным раствором NaCl и сушки, упаривали, получая 6-(8-диметиламино-10,10-диоксо-5,10 дигидро-106-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановую кислоту в твердом виде, 232 мг с выходом 62%.(1,1 ммоль, 0,16 мл) при -10 С. По каплям добавляли этилхлорформиат (1 ммоль, 0,1 мл) и выдерживали смесь между -10 и 0 С в течение 1 ч. По окончании этого срока данную суспензию вносили полностью в смесь из NH2OH-HCl (2,8 ммоль, 200 мг) в DMF (3 мл), в которую был добавлен Et3N (2,9 ммоль, 0,4 мл). Полученную реакционную смесь выдерживали 2 ч с перемешиванием. Образование гидроксамата отслеживали методом HPLC. Реакционную смесь высушивали с помощью механического насоса, разбавляли насыщенным раствором NaCl и экстрагировали этилацетатом (дважды). Экстракт осушали и после испарения растворителя получали неочищенное масло, которое подвергали очистке методом HPLC на препаративной установке Schimatzu (3 прохода) на колонке Symmetry Prep C18, 19300 мм, элюируя смесью из 80% воды и 20% ацетонитрила (содержащих по 0,1% TFA), образующих линейный градиент CH3CN с возрастанием на 0,5% за 1 мин. Очищенные хроматографические фракции собирали и лиофилизировали. Получали 150 мг белого лиофилизованного вещества с выходом 48,5%.(1 Н, m) - 7,14 (3H, m) - 6,91 (1H, t) - 2,98 (2H, bs) - 2,93 (3H, m) - 2,20 (mc, t) - 1,89 (2H, t) - 1,40 (4H, m) 1,25 (2H, m). Следующие продукты получали аналогичным образом. Пример 21. Гидроксиамид 6-(3-метокси-10,10-диоксо-5,10-дигидро-106-тиа-5,11-диазадибензо[а,d]циклогептен-11-ил)гексановой кислоты.(1H, d) - 7,43 (2H, m) - 6,89 (1H, m) - 6,86 (1H, d) - 6,83 (1H, dd) - 6,61 (1H, d) -6,02 (3H, bs) - 3,11 (2H, bs) 2,21 (mc, t) - 1,89 (2H, t) - 1,42 (4H, m) - 1,27 (2H, bs). Пример 33. Гидроксиамид 6-(10-оксо-4 Н,10 Н-2-тиа-4,9-диазабензо[f]азулен-9-ил)гексановой кислоты. Стадия 1. Вносили 1,1 г металлического натрия, предварительно нарезанного на тонкие стружки, в 11 мл метанола при сильном перемешивании. Полученный раствор нагревали до кипения и медленно(около 10 мин) добавляли 3,0 г метил-3-[(2-метокси-2-оксоэтил)тио]пропаноата. Раствор опять доводили до кипения на 30 мин, а затем давали остыть до комнатной температуры. Все это выливали на лед и воду(около 100 мл) при перемешивании, потом перемешивали 30-40 мин и подкисляли до рН 2 с помощью конц. HCl. Воды экстрагировали 5 раз дихлорметаном, органические экстракты объединяли и осушали, а затем концентрировали на роторном испарителе, получая 1,7 г масла. Анализ методом GC-масс-спектрометрии показал присутствие другого изомера (метилтетрагидро 3-окса-2-тиофенкарбоксилата) на уровне около 3% (HPLC (А)=2,53 мин). Неочищенный продукт подвергали очистке на установке Flash Master Personal на заполненной силикагелем (20 г) колонке STRATA фирмы Phenomenex. Неочищенный продукт растворяли в смеси дихлорметан:гексан =1:1, затем наносили на колонку и элюировали смесью дихлорметан:гексан =1:1. Получали 1,12 г белого вещества. Выход: 54%.HPLC (А)=2,61 мин. Стадия 2. 1,3,4,9-Тетрагидро-10 Н-тиено[3,4-b][1,5]бензодиазепин-10-он. Раствор, полученный при растворении 1,12 г метилтетрагидро-4-окса-3-тиофенкарбоксилата и 0,76 г о-фенилендиамина в 27 мл безводного толуола, нагревали до кипения на 2,5 ч с использованием водоотделителя Dean-Stark для удаления воды. Раствору давали остыть до комнатной температуры. Образовался оранжевый осадок, который отфильтровывали через пористую мембрану и оставляли сушиться на воздухе. При этом получали 1,14 г чистого 1,3,4,9-тетрагидро-10 Н-тиено[3,4-b][1,5]бензодиазепин-10-она. Выход: 75%.HPLC (А)=2,43 мин; MS[Ices+] MH+=219,2. Стадия 3. Порциями вносили 698 мг N-хлорсукцинимида в смесь из 1,14 г полученного перед этим продукта в 11 мл безводного пиридина в атмосфере азота с перемешиванием так, чтобы внутренняя температура реакции оставалась между 10 и 15 С с помощью водоледяной бани. По окончании внесения вс это доводили до 60 С на 30 мин, а затем доводили до комнатной температуры. Реакционную смесь выливали на 100 мл воды со льдом и оставляли на 20 мин с перемешиванием. Образовавшийся осадок затем отфильтровывали через пористую мембрану и оставляли на несколько часов сушиться на фильтровальной бумаге. Получали 1,01 г 4,9-дигидро-10 Н-тиено[3,4-b][1,5]бензодиазепин-10-она с чистотой 95%. Выход: 90%.HPLC (A)=2,77 мин; MS[Ices+] MH+=217,2. Трициклическое соединение превращали в конечный продукт аналогично описанному способу.(4H, m) - 1,21 (2H, m). Следующие соединения получали точно таким же образом. Пример 34. Гидроксиамид 6-(6,7-дихлор-10-оксо-4 Н,10 Н-2-тиа-4,9-диазабензо[f]азулен-9-ил)гексановой кислоты.mc=второстепенный конформер,bs=широкий сигнал,m=мультиплет или наложение мультиплетов. Показания для терапии. Ингибиторы гистондеацетилазы представляют собой класс потенциальных средств для терапии или профилактики патологических состояний, вызванных нарушением экспрессии генов, как то воспалительных заболеваний, диабета, осложнений диабета, гомозиготной талассемии, фиброза, цирроза, острой промиелоцитарной лейкемии (APL), отторжения трансплантатов, аутоиммунных заболеваний, протозойных инфекций, опухолей и др. В частности, они возникают как новый класс лекарств с противоопухолевым действием. Описана связь между некоторыми опухолевыми патологиями, такими как рак молочной железы, толстой кишки и легких, и степенью ацетилирования хроматина в ядре. Препараты, способные модулировать перестройку хроматина, способны ингибировать пролиферацию опухолей и могли бы стать новыми инструментами для лечения раковых патологий в не столь отдаленном будущем. Многие экспериментальные данные ведут к предположению о том, что главной областью применения этих препаратов могла бы стать комбинированная терапия. Значительная переносимость, как следует из первых клинических испытаний,вызывает уверенность в том, что этот класс молекул подходит для комбинированной терапии вместе с традиционными лекарствами типа цитотоксических препаратов или вместе с радиотерапевтическим лечением или с противораковыми средствами нового поколения. В частности, настоящим изобретением также предусмотрено комбинирование обладающих активностью ингибиторов гистондеацетилазы соединений общей формулы (I) с одним или несколькими химиотерапевтическими соединениями из числа обычных цитотоксических средств, деметилирующих средств, ингибиторов циклин-зависимых киназ,веществ, способствующих дифференцировке, модуляторов передачи сигналов, антагонистов HSP-90,ингибиторов протеасом. Предпочтительными соединениями являются соединения, выбранные из следующих групп: из обычных цитотоксических средств: флударабин, гемцитабин, децитабин, паклитаксель, карбоплатин и ингибиторы топоизомеразы I/II, в том числе этопозид, иринотекан, топотекан, Т-128, и такие антрациклины, как доксорубицин, сабарубицин, даунорубицин; из деметилирующих средств (вызывающих деметилирование ДНК): 5-аза-2'-дезоксицитидин (5-азаdC), 5-азацитидин; из ингибиторов циклинзависимых киназ: флавопиридол, оломоуцин, росковитин, пурваланол В,GW9499, GW5181, CGP60474, CGP74514, AG12286, AG12275, стауроспорин, UCN-01; из веществ, способствующих дифференцировке: ретиноевая кислота и е производные (полностью транс-ретиноевая кислота (ATRA), 13-цис-ретиноевая кислота (CRA, РМА (форболмиристат-ацетат); из модуляторов передачи сигналов: TRAIL, иматиниб-мезилат, LY-294002, бортезомиб; из антагонистов HSP-90: гелданамицин и его аналоги (17-AAG); из ингибиторов протеасом: лактацистин, MG132, бортезомиб (Velcade). Биологическая активность. Активность соединений в качестве ингибиторов гистондеацетилазы (HDAC) измеряли методом ацетилирования in vitro. Затем соединения оценивали в качестве ингибиторов пролиферации раковых культур клеток человека. Сводка полученных данных представлена в таблице. Деацетилазная активность в экстрактах ядер клеток HeLa (раковых клеток шейки матки человека). Определение (набор Fluor de Lys, BioMol) состояло из двух стадий: на первой стадии субстрат,содержащий ацетилированный остаток лизина, реагировал с ядерным экстрактом (HeLa), содержащим энзиматическую активность, в присутствии и в отсутствие ингибиторов. На второй стадии добавляли флуорогенный реагент, который окрашивает деацетилированные остатки. При ингибировании деацетилазной активности происходит снижение флуоресценции. Результат выражали в процентах ингибирования относительно контроля, не содержащего ингибитора в концентрации 1 мкМ.- 12013015 Оценка цитотоксической активности на культуре клеток карциномы толстой кишки человека НСТ-116. Клетки карциномы толстой кишки человека НСТ-116 высевали на 96-луночные планшеты в культуральной среде RPMI1640 с добавлением 10% FBS и 2 мМ глутамина. Через 24 ч после посева добавляли соединения в различных концентрациях. Все соединения разводили DMSO таким образом, чтобы конечная концентрация в культурах не превышала 0,5%. Через 72 ч после добавления соединений измеряли жизнеспособность клеток при помощи красителя Alamar Blue. Результаты выражали в процентах жизнеспособных клеток среди обработанных относительно контроля, получавшего только носитель. В тех же опытах суберанилогидроксамовая кислота (SAHA), включенная в качестве эталона, проявляла ингибиторный эффект в 55% при 0,1 мкМ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) где X выбран из группы СО, SO2;Y выбран из группы О, S, SO, SO2, C=O, N-R6; А и В выбраны независимо из 5- или 6-членных колец, ароматических групп типа фенила или гетероароматических групп, выбранных из группы: тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксатиазол, 1,2,3-триазол, пиридин;R1, R2, R3, R4 выбраны независимо из группы: Н, галоген, CF3, NO2, NR9R10, CN, C1-6-алкил, ОН, ОС 1-6-алкил, O-(CH2)2-NR9R10, CH2-Z-R8, COR9, CR9R13R14, SR9, SOR15, SO2R15, Q-(CH2)nCONHOH;R5 и R6 могут независимо означать группу, выбранную из Н, C1-6-алкила, Q1-(CH2)nCONHOH;R8 означает группу (CH2)p-R11, где R11 может означать метил или гидроксил;Z выбран из группы О, NR12, S;Q может означать химическую связь или может быть выбран из группы -О-, -S-, -NR12-, -NR9CO-,-CONR9-, -COW-, где W означает группу, выбранную из пиперидина или пирролидина;Q1 может означать химическую связь или -СО-;R9 и R10 могут независимо означать Н или C1-6-алкил;R13 и R14 могут либо одновременно означать атом фтора, либо означать атомы кислорода, соединенные алкильной цепочкой, состоящей из 2 или 3 СН 2;n означает целое число между 2 и 6; р означает целое число между 0 и 5; с теми ограничениями, что в молекуле всегда должна быть только одна группа, содержащая гидроксамат (CH2)nCONHOH; и если X=СО, а А и В одновременно означают группу бензола, то R3 и R4 не могут означать Q(CH2)nCONHOH.N-гидрокси-4-[1-(11-оксо-10,11-дигидро-5 Н-дибензо[b,е][1,4]диазепин-6-карбонил)пиперидин-4 ил]бутирамид. 3. Применение соединений по п.1 для получения фармацевтических композиций, применимых в ка- 14013015 честве ингибиторов гистондеацетилазы. 4. Применение по п.3 для получения фармацевтических композиций, применимых для лечения воспалительных заболеваний, диабета, осложнений диабета, гомозиготной талассемии, фиброза, цирроза,острой промиелоцитарной лейкемии (APL), отторжения трансплантатов, аутоиммунных заболеваний,протозойных инфекций и опухолевых патологий. 5. Применение по п.4 для получения фармацевтических композиций, применимых для лечения опухолевых патологий. 6. Применение соединений по п.1 в комбинации с одним или несколькими активными началами,выбранными из химиотерапевтических средств, для получения фармацевтических композиций, применимых для лечения опухолевых патологий. 7. Применение соединений по п.1 для получения фармацевтических композиций, применимых в комбинации с радиотерапевтическим лечением для лечения опухолевых патологий. 8. Применение по п.6 в комбинации с одним или несколькими соединениями, выбранными из группы обычных цитотоксических средств, деметилирующих средств, ингибиторов циклинзависимых киназ,веществ, способствующих дифференцировке, модуляторов передачи сигналов, антагонистов HSP-90,ингибиторов протеасом. 9. Применение по п.8 для получения комбинации с одним или несколькими соединениями, выбранными из обычных цитотоксических средств: флударабина, гемцитабина, децитабина, паклитакселя, карбоплатина и ингибиторов топоизомеразы I/II, в том числе этопозида, иринотекана, топотекана, Т-128, и таких антрациклинов, как доксорубицин, сабарубицин, даунорубицин; из деметилирующих средств: 5 аза-2'-дезоксицитидина (5-аза-dC), 5-азацитидина; из ингибиторов циклинзависимых киназ: флавопиридола, оломоуцина, росковитина, пурваланола В, GW9499, GW5181, CGP60474, CGP74514, AG12286,AG12275, стауроспорина, UCN-01; из веществ, способствующих дифференцировке: ретиноевой кислоты и е производных (полностью транс-ретиноевой кислоты (ATRA), 13-цис-ретиноевой кислоты (CRA,РМА (форболмиристат-ацетата); из модуляторов передачи сигналов: TRAIL, иматиниб-мезилата, LY294002, бортезомиба; из антагонистов HSP-90: гелданамицина и его аналогов (17-AAG); из ингибиторов протеасом: лактацистина, MG132, бортезомиба (Velcade). 10. Фармацевтические композиции, содержащие в качестве активного начала соединение общей формулы (I) по пп.1-4, для лечения воспалительных заболеваний, диабета, осложнений диабета, гомозиготной талассемии, фиброза, цирроза, острой промиелоцитарной лейкемии (APL), отторжения трансплантатов, аутоиммунных заболеваний, протозойных инфекций и опухолевых патологий.
МПК / Метки
МПК: C07D 267/20, A61K 31/551, C07D 281/16, C07D 471/04, C07D 243/38, A61K 31/55, C07D 285/36
Метки: замещенные, формах, n-гидроксиамиды, получение, ингибиторы, группами, трициклическими, гистондеацетилазы, применение, фармацевтических
Код ссылки
<a href="https://eas.patents.su/16-13015-n-gidroksiamidy-w-zameshhennye-triciklicheskimi-gruppami-kak-ingibitory-gistondeacetilazy-ih-poluchenie-i-primenenie-v-farmacevticheskih-formah.html" rel="bookmark" title="База патентов Евразийского Союза">N-гидроксиамиды, w- замещенные трициклическими группами, как ингибиторы гистондеацетилазы, их получение и применение в фармацевтических формах</a>
Предыдущий патент: Жидкое комплексное удобрение с хелатными формами микроэлементов и способ его получения
Следующий патент: Способы и средства диагностики, профилактики и лечения инфекций mycobacterium и заболевания туберкулёзом
Случайный патент: Синергетическая травяная композиция, применяемая при глаукоме, и способ ее получения




















