Производные 2,3-диарил-пиразоло[1,5-b]пиридазинов, их получение и их применение в качестве ингибиторов циклооксигеназы 2 (цог-2)
Номер патента: 2775
Опубликовано: 29.08.2002
Авторы: Бесуик Пол Джон, Нейлор Алан, Кемпбелл Айан, Мэтьюз Нил
Формула / Реферат
1. Соединения формулы (I)
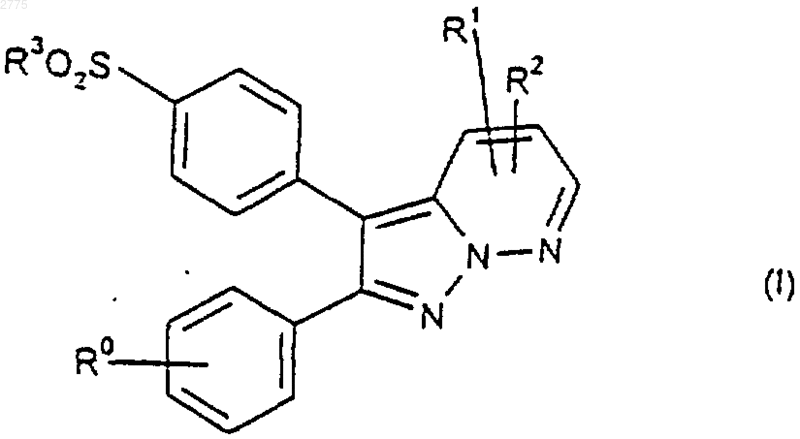
и их фармацевтически приемлемые производные, в которых
R0 представляет собой галоген, C1-6алкил, С1-6алкоксигруппу, C1-6алкоксигруппу, замещенную одним или более чем одним атомом фтора, или O(CH2)nNR4R5;
R1 и R2 независимо выбраны из Н, С1-6алкила, C1-6алкила, замещенного одним или более чем одним атомом фтора, C1-6алкоксигруппы, C1-6гидроксиалкила, SC1-6алкила, С(O)Н, С(O)С1-6алкила, C1-6алкилсульфонила, C1-6алкоксигруппы, замещенной одним или более чем одним атомом фтора, O(СН2)nСO2С1-6алкила, О(СН2)nSС1-6алкила, (CH2)nNR4R5, (СН2)nSС1-6алкила или C(O)NR4R5; при условии, что когда R0 находится в положении 4 и представляет собой галоген, по меньшей мере, один из R1 и R2 представляет собой C1-6алкилсульфонил, C1-6алкоксигруппу, замещенную одним или более чем одним атомом фтора, O(СН2)nСO2С1-6алкил, O(СН2)nSС1-6алкил, (CH2)nNR4R5 или (СН2)nSС1-6алкил, C(O)NR4R5;
R3 представляет собой C1-6алкил или NH2;
R4 и R5 независимо выбраны из Н или C1-6алкила или вместе с атомом азота, к которому они присоединены, образуют 4-8 членное насыщенное кольцо; и
n равно числу от 1 до 4.
2. Соединения по п.1, где R0 представляет собой F, C1-3алкил, C1-3алкоксигруппу, C1-3алкоксигруппу, замещенную одним или более чем одним атомом фтора, или O(CH2)nNR4R5; R1 представляет собой С1-4алкилсульфонил, С1-4алкоксигруппу, замещенную одним или более чем одним атомом фтора, O(СН2)nСO2С1-4алкил, O(CН2)nSС1-4алкил, (CH2)nNR4R5, (СН2)nSС1-4алкил или C(O)NR4R5, или, когда R0 является C1-3алкилом, C1-3алкоксигруппой, C1-3алкоксигруппой, замещенной одним или более чем одним атомом фтора, или O(CH2)nNR4R5 может представлять собой также Н; R2 представляет собой Н; R3 представляет собой метил или NН2; R4 и R5 независимо представляют собой C1-3алкил или вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное кольцо; и n равно числу от 1 до 3.
3. Соединения по п.1 или 2, где R0 представляет собой F, метил, С1-2алкоксигруппу, OCHF2 или O(CH2)nNR4R5; R1 представляет собой метилсульфонил, OCHF2, O(CН2)nСО2С1-4алкил, O(СН2)nSСН3, (CH2)nNR4R5, (СН2)nSСН3 или C(O)NR4R5, или, когда R0 представляет собой метил, С1-2алкокси, OCHF2 или O(СН2)nN(СН3)2, может представлять собой также Н; R2 представляет собой Н; R3 представляет собой метил или NH2; R4 и R5 оба представляют собой метил или вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное кольцо; и n равно числу от 1 до 2.
4. Соединения по любому из пп.1-3, где R0 представляет собой F, C1-3алкоксигруппу или C1-3алкоксигруппу, замещенную одним или более чем одним атомом фтора; R1 представляет собой С1-4алкилсульфонил, С1-4алкоксигруппу, замещенную одним или более чем одним атомом фтора, или, когда R0 представляет собой C1-3алкоксигруппу или C1-3алкоксигруппу, замещенную одним или более чем одним атомом фтора, может представлять собой также Н; R2 представляет собой Н; и R3 представляет собой метил или NН2.
5. Соединения по любому из пп.1-4, где R0 находится в положении 3 или 4 фенильного кольца.
6. Соединения по любому из пп.1-5, где R1 находится в положении 6 пиридазинового кольца.
7. 2-(4-Этоксифенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b]пиридазин; 6-дифторметокси-2-(3-фторфенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b]пиридазин; и их фармацевтически приемлемые производные.
8. Способ получения соединений формулы (I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором соединение формулы (II)

или его защищенное производное подвергают взаимодействию с соединением формулы (III)
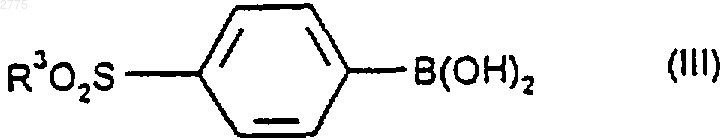
или его защищенным производным с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I), полученные способом, описанным выше, в их фармацевтически приемлемые производные.
9. Способ получения соединений формулы (I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором, если R3 представляет собой С1-4алкил, соединение формулы (IV)
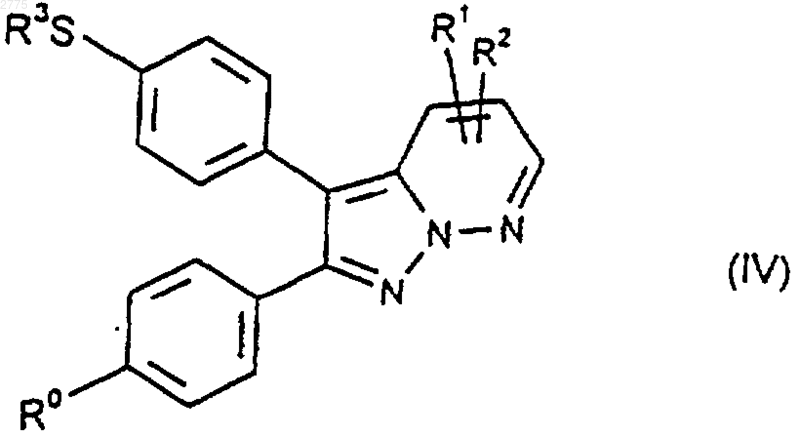
или его защищенное производное подвергают взаимодействию с окисляющим агентом с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I), полученные способом, описанным выше, в их фармацевтически приемлемые производные.
10. Способ получения соединений формулы (I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором, если R1 представляет собой C1-6алкилсульфонил, соединение формулы (V)
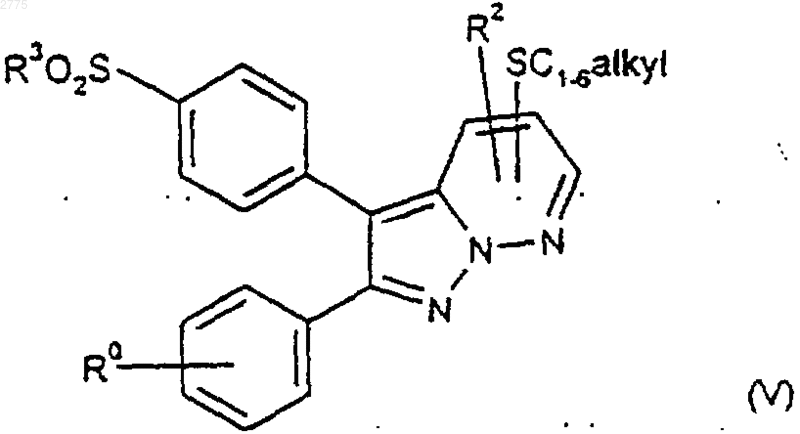
или защищенное производное подвергают окислению с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I), полученные способом, описанным выше, в их фармацевтически приемлемые производные.
11. Способ получения соединений формулы (I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором, если R1 представляет собой С1-6алкоксигруппу, замещенную одним или более чем одним атомом фтора, спирт формулы (VI)
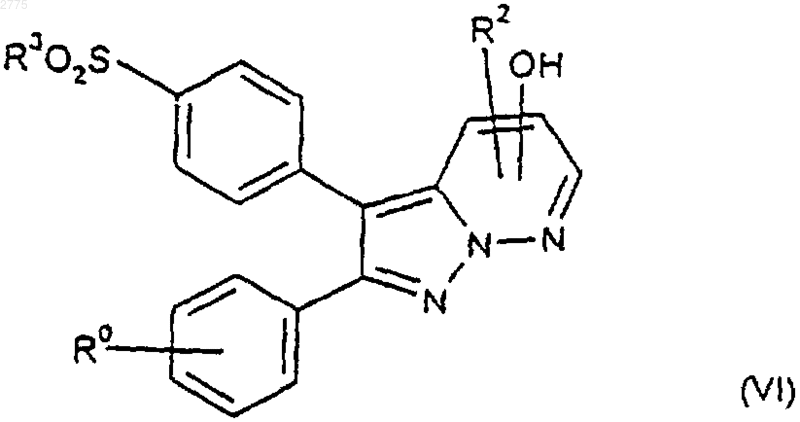
или его защищенное производное подвергают взаимодействию с галогенфторалканом с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I), полученные способом, описанным выше, в их фармацевтически приемлемые производные.
12. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемое производное по любому из пп.1-7 в смеси с одним или более чем одним физиологически приемлемым носителем или эксципиентом.
13. Соединение формулы (I) или его фармацевтически приемлемое производное по любому из пп.1-7 для применения в медицине или ветеринарии.
14. Соединение формулы (I) или его фармацевтически приемлемое производное по любому из пп.1-7 для применения при лечении состояния, которое опосредуется селективным ингибированием ЦОГ-2.
15. Способ лечения человека или животного, страдающего заболеванием, опосредованным селективным ингибированием ЦОГ-2, введением эффективного количесттр соединения формулы (I) или фармацевтически приемлемого производного по любому из пп.1-7.
16. Применение соединения формулы (I) или его фармацевтически приемлемого производного по любому из пп.1-7 для производства терапевтического агента для лечении состояния, которое опосредуется селективным ингибированием ЦОГ-2, такого как воспалительное расстройство.
Текст
1 Настоящее изобретение относится к производным пиразоло[1,5-b]пиридазина, к способам их получения, к содержащим их фармацевтическим композициям, и к их применению в медицине. Недавно было открыто, что фермент циклооксигеназа (ЦОГ) существует в двух изоформах, ЦОГ-1 и ЦОГ-2. ЦОГ-1 соответствует первоначально идентифицированному конститутивному ферменту, а ЦОГ-2 быстро и легко индуцируется рядом агентов, включая митогены,эндотоксин, гормоны, цитокины и факторы роста. Простагландины, которые вырабатываются под действием ЦОГ, играют как физиологическую, так и патологическую роль. Вообще считается, что ЦОГ-1 ответствен за важные физиологические функции, такие как поддержание желудочно-кишечной целостности и почечного кровотока. Напротив, индуцибельная форма,ЦОГ-2, как полагают, ответственна за патологические эффекты простагландинов, когда быстрое индуцирование фермента происходит в ответ на такие агенты, как агенты воспаления,гормоны, факторы роста и цитокины. Селективный ингибитор ЦОГ-2, следовательно, должен иметь противовоспалительные, жаропонижающие и анальгезирующие свойства без возможных побочных эффектов, связанных с ингибированием ЦОГ-1. В WO 96/06840 (Merck Frosst Canada Inc.) описан ряд 6,5-конденсированных бициклических гетероциклов, моно- и дизамещенных арилом, содержащих до четырех несмежных гетероатомов. В WO 96/31509 (Glaxo Group Limited) раскрыт ряд производных имидазол[1,2 а]пиридина, дизамещенных арилом. Все эти соединения описаны как полезные при лечении заболеваний, опосредованных ЦОГ-2. Нами обнаружена новая группа соединений, которые являются одновременно сильными и селективными ингибиторами ЦОГ-2. Так, согласно данному изобретению предложены соединения формулы (I) их фармацевтически приемлемые производные,гдеR0 представляет собой галоген, C1-6 алкил,C1-6 алкоксигруппу, C1-6 алкоксигруппу, замещенную одним или более чем одним атомом фтора, или O(СН 2)nNR4R5;R1 и R2 независимо выбраны из Н, C1-6 алкила, C1-6 алкила, замещенного одним или более чем одним атомом фтора,C1-6 алкоксигруппы,C1-6 гидроксиалкила,SC1-6 алкила,С(O)Н,С(O)С 1-6 алкила,C1-6 алкилсульфонила, C1-6 алкоксигруппы, замещенной одним или более чем одним атомом фтора, 002775O(СН 2)nСO2 С 1-6 алкила, O(CH2)nSС 1-6 алкила,(CH2)nNR4R5, (CH2)nSС 1-6 алкила или C(O)NR4R5; при условии, что когда R0 находится в положении 4 и представляет собой галоген, по меньшей мере, один из R1 и R2 представляет собой C1-6 алкилсульфонил,С 1-6 алкоксигруппу, замещенную одним или более чем одним атомом фтора, O(СН 2)nСO2 С 14 5 или 6 алкил, O(СH2)nSС 1-6 алкил, (CH2)nNR R 4 5R4 и R5 независимо выбраны из Н, или C1-6 алкила, или, вместе с атомом азота, к которому они присоединены, образуют 4-8-членное насыщенное кольцо; иn равно числу от 1 до 4. Под фармацевтически приемлемым производным следует понимать любую фармацевтически приемлемую соль, сольват или эфир, или соль или сольват такого эфира соединения формулы (I), или любое другое соединение, которое при введении реципиенту способно обеспечить получение (прямо или косвенно) соединения формулы (I) или его активного метаболита или остатка. Должно быть понятно, что для фармацевтического использования вышеуказанные соли должны быть физиологически приемлемыми солями; однако другие соли могут находить применение, например при получении соединений формулы (I) и их физиологически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений формулы (I) включают в себя соли, полученные присоединением кислоты, образованные с неорганическими или органическими кислотами, предпочтительно с неорганическими кислотами, например гидрохлориды, гидробромиды и сульфаты. Термин галоген использован для обозначения фтора, хлора, брома или йода. Термин алкил как группа или часть группы означает алкильную группу с прямой или разветвленной цепью, например метильную,этильную,н-пропильную,изопропильную, н-бутильную, втор-бутильную или трет-бутильную группу. Предпочтительно, R0 находится в положении 3 или 4 фенильного кольца, как определено в формуле (I). Предпочтительно, R1 находится в положении 6 пиридазинового кольца, как определено в формуле (I). Предпочтительно, R0 представляет собойF, C1-3 алкил, C1-3 алкоксигруппу, C1-3 алкоксигруппу, замещенную одним или более чем одним атомом фтора, или O(СН 2)1-3NR4R5. Более предпочтительно, R0 представляет собой F, C1-3 алкоксигруппу или C1-3 алкоксигруппу, замещенную одним или более чем одним атомом фтора. 3 Предпочтительно, R1 представляет собой С 14 алкилсульфонил, С 1-4 алкоксигруппу, замещенную одним или более чем одним атомом фтора, O(СН 2)14 5 3 СO2 С 1-4 алкил, O(СН 2)1-3SС 1-4 алкил, (CH2)1-3NR R ,4 5C1-6 алкилом,C1-6 алкоксигруппой,O(CH2)nNR4R5, может представлять собой также Н. Более предпочтительно, R1 представляет собой С 1-4 алкилсульфонил, С 1-4 алкоксигруппу, замещенную одним или более чем одним атомом фтора, или,когда R0 представляет собой C1-6 алкил, C1-6 алкоксигруппу, C1-6 алкоксигруппу, замещенную одним или более чем одним атомом фтора, илиO(CH2)nNR4R5, может представлять собой также Н. Предпочтительно, R2 представляет собой Н. Предпочтительно, R3 представляет собой метил или NH2. Предпочтительно R4 и R5 независимо представляют собой C1-3 алкил или, вместе с атомом азота, к которому они присоединены,образуют 5-6-членное насыщенное кольцо. Предпочтительно, n равно числу от 1 до 3,более предпочтительно 1 или 2. В объеме изобретения предложена одна группа соединений формулы (I) (группа А), где R0 представляет собой F, C1-3 алкил, С 1-3 алкоксигруппу, C13 алкоксигруппу, замещенную одним или более чем одним атомом фтора, или O(CH2)nNR4R5; R1 представляет собой С 1-4 алкил-сульфонил,С 14 алкоксигруппу, замещенную одним или более чем одним атомом фтора, О(СН 2)nСО 2 С 1-4 алкил,O(СН 2)nSС 1-4 алкил, (CH2)nNR4R5, (CH2)nSС 1-4 алкил или C(O)NR4R5, или, когда R0 представляет собойC1-3 алкил, C1-3 алкоксигруппу, C1-3 алкоксигруппу,замещенную одним или более чем одним атомом фтора, или O(CH2)nNR4R5 может представлять собой также Н; R2 представляет собой Н; R3 представляет собой метил или NH2; R4 и R5 независимо представляют собой C1-3 алкил или, вместе с атомом азота, к которому они присоединены, образуют 5-6 членное насыщенное кольцо; и n равно числу от 1 до 3. В пределах группы А предложена другая группа соединений (группа А 1), где R0 представляет собой F, метил, С 1-2 алкоксигруппу, OCHF2 илиO(CH2)nNR4R5; R1 представляет собой метилсульфонил, OCHF2, O(CH2)nCO2C1-4 алкил, O(СН 2)nSСН 2,(CH2)nNR4R5, (СН 2)nSСН 3 или C(O)NR4R5, или, когда R0 представляет собой метил, С 1-2 алкоксигруппу, OCHF2 или O(СН 2)nN(СН 3)2, может представлять собой также Н; R2 представляет собой Н; R3 представляет собой метил или NH2;R4 и R5 оба представляют собой метил или, вместе с атомом азота, к которому они присоединены, образуют 5-6 членное насыщенное кольцо; иn равно числу от 1 до 2. В пределах группы А, предложена еще одна группа соединений (группа А 2), где R0 представляет собой F, C1-3 алкоксигруппу или C1-3 алкоксигруппу, замещенную одним или более чем одним атомом фтора; R1 представляет собой С 1-4 4 алкилсульфонил, С 1-4 алкоксигруппу, замещенную одним или более чем одним атомом фтора,или, когда R0 представляет собой C1-3 алкоксигруппу или C1-3 алкоксигруппу, замещенную одним или более чем одним атомом фтора, может представлять собой также Н; R2 представляет собой Н; и R3 представляет собой метил или NH2. В пределах групп А, А 1 и А 2 R0 предпочтительно находится в положении 3 или 4 фенильного кольца, a R2 предпочтительно находится в положении 6 пиридазинового кольца. Должно быть понятно, что настоящее изобретение охватывает все изомеры соединений формулы (I) и их фармацевтически приемлемые производные, включая все геометрические, таутомерные и оптические формы и их смеси (например рацемические смеси). В частности, предпочтительными соединениями по настоящему изобретению являются 3-(4-метансульфонилфенил)-2-(4 метоксифенил)-пиразоло[1,5-b]пиридазин; 6-дифторметокси-2-(4-фторфенил)-3-(4 метансульфонилфенил)-пиразоло[1,5-b]пиридазин; 2-(4-этоксифенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b]пиридазин; 2-(4-фторфенил)-6-метансульфонил-3-(4 метансульфонилфенил)-пиразоло[1,5-b]пиридазин; 2-(4-дифторметоксифенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b]пиридазин; 4-[2-(4-этоксифенил)-пиразоло[1,5-b]пиридазин-3-ил]-бензолсульфонамид; 6-дифторметокси-2-(3-фторфенил)-3-(4 метансульфонилфенил)-пиразоло[1,5-b]пири-дазин; и их фармацевтически приемлемые производные. Соединения по изобретению являются сильными и селективными ингибиторами ЦОГ 2. Эта активность продемонстрирована их способностью селективно ингибировать ЦОГ-2 по сравнению с ЦОГ-1. С точки зрения их селективной в отношении ЦОГ-2 ингибирующей активности, соединения по настоящему изобретению представляют интерес для применения в медицине и ветеринарии, в частности при лечении боли (как хронической, так и острой), лихорадки и воспаления при различных состояниях и заболеваниях. Такие состояния и заболевания хорошо известны специалистам и включают в себя ревматическую лихорадку; симптомы, связанные с гриппом или другими вирусными инфекциями,такими как простуда, боль в нижней части спины и шее, головная боль, зубная боль, растяжение связок и сухожилий, миозит, невралгия,синовит, артрит, в том числе ревматоидный артрит, дегенеративные заболевания суставов, в том числе остеоартрит; подагра и анкилози 5 рующий спондилит, тендинит, бурсит; кожные заболевания, такие как псориаз, экзема, ожоги и дерматит; травмы, такие как спортивные травмы и травмы, полученные от хирургических и стоматологических процедур. Соединения по настоящему изобретению могут быть полезны также для лечения других состояний, опосредуемых селективным ингибированием ЦОГ-2. Например, соединения по настоящему изобретению могут ингибировать клеточную и неопластическую трансформацию и рост метастатической опухоли и, следовательно, могут быть полезны при лечении определенных раковых заболеваний, таких как рак толстой кишки. Соединения по изобретению могут также предупреждать нейрональное повреждение посредством ингибирования образования нейрональных свободных радикалов (и, следовательно, окислительного стресса) и, таким образом,могут быть полезны при лечении удара, эпилепсии и эпилептических припадков (включая большой эпилептический припадок, малый эпилептический припадок, миоклоническую эпилепсию и парциальные припадки). Соединения по изобретению также ингибируют индуцированное простаноидами сокращение гладкой мускулатуры и, следовательно,могут быть полезны при лечении дисменореи и преждевременных родов. Соединения по изобретению ингибируют воспалительные процессы и, таким образом,могут быть полезны при лечении астмы, аллергического ринита и респираторного дистресссиндрома; желудочно-кишечных состояний,таких как воспалительное заболевание кишечника, болезнь Крона, гастрит, синдром раздраженного кишечника и язвенный колит; и воспаления при таких заболеваниях, как сосудистое заболевание, мигрень, узелковый периартериит,тиреоидит, апластическая анемия, болезнь Ходжкина, склеродема, диабет типа I, тяжелая псевдопаралитическая миастения, рассеянный склероз, саркоидоз, нефротический синдром, синдром Бечета, полимиозит, гингивит, коньюнктивит и миокардиальная ишемия. Соединения по настоящему изобретению могут быть полезны также при лечении офтальмологических заболеваний, таких как ретинит,ретинопатии, увеит и острое повреждение глазной ткани. Соединения по изобретению могут быть полезны также для лечения когнитивных расстройств, таких как деменция, в частности дегенеративная деменция (включая сенильную деменцию, болезнь Aльцгеймера, болезнь Пика,хорею Хантингтона, болезнь Паркинсона и заболевание Крейтцфельда-Якоба), и сосудистая деменция (включая мультиинфарктную деменцию), а также деменция, связанная с обширным внутричерепным повреждением, травмой, инфекцией и родственными состояниями (включая 6 ВИЧ-инфекцию), метаболизмом, токсинами,аноксией и витаминной недостаточностью, и умеренное ослабление познавательной способности, связанной с возрастом, в частности связанное с возрастом ослабление памяти. Согласно следующему аспекту изобретения мы предлагаем соединение формулы (I) или его фармацевтически приемлемое производное для применения в медицине или ветеринарии. В соответствии с другим аспектом изобретения мы предлагаем соединение формулы (I) или его фармацевтически приемлемое производное для применения при лечении состояния,которое опосредуется селективным ингибированием ЦОГ-2. В соответствии со следующим аспектом изобретения мы предлагаем способ лечения субъекта человека или животного, страдающего состоянием, которое опосредуется селективным ингибированием ЦОГ-2, при котором указанному субъекту вводят эффективное количество формулы (I) или фармацевтически приемлемого производного. Согласно другому аспекту изобретения мы предлагаем применение соединения формулы (I) или его фармацевтически приемлемого производного для производства терапевтического агента для лечения состояния, которое опосредуется селективным ингибированием ЦОГ-2,такого как воспалительное расстройство. В соответствии со следующим аспектом изобретения мы предлагаем способ лечения субъекта человека или животного, страдающего воспалительным заболеванием, при котором указанному субъекту вводят эффективное количество соединения формулы (I) или его фармацевтически приемлемого производного. Должно быть ясно, что ссылка на лечение включает в себя как лечение установленных симптомов, так и профилактическое лечение,если точно не указано иначе. Должно быть ясно, что соединения по изобретению могут быть благоприятно использованы в комбинации с одним или более чем одним другим терапевтическим агентом. Примеры подходящих агентов для дополнительной терапии включают в себя болеутоляющие средства,такие как антагонист глицина, ингибитор натриевого канала (например ламотриджин), антагонист вещества Р (например антагонист NK1),ацетаминофен или фенацетин; ингибитор матриксной металлопротеиназы; ингибитор синтазы оксида азота (NOS) (например ингибиторiNOS или nNOS); ингибитор высвобождения или действия фактора некроза опухоли ; терапию антителами (например терапию моноклональными антителами); стимулятор, содержащий кофеин; Н 2-антагонист, такой как ранитидин; ингибитор протонного насоса, такой как омепразол; антацид, такой как гидроксид алюминия или магния; ветрогонное средство, такое как симетикон; противоотечное средство, такое 7 как фенилэфрин, фенилпропаноламин, псевдоэфедрин, оксиметазолин, эпинефрин, нафазолин, ксилометанзолин, пропилгекседрин или лево-дезоксиэфедрин; противокашлевое средство, такое как кодеин, гидрокодон, кармифен,карбетапентан или декстраметорфан; диуретик; или седативный или не седативный антигистамин. Должно быть ясно, что настоящее изобретение охватывает применение соединения формулы (I) или его фармацевтически приемлемого производного в комбинации с одним или более чем одним терапевтическим агентом. Соединения формулы (I) и их фармацевтически приемлемые производные обычно вводят в форме фармацевтических композиций. Таким образом, в другом аспекте изобретения мы предлагаем фармацевтическую композицию,содержащую соединение формулы (I) или его фармацевтически приемлемое производное,адаптированное для применения в медицине и ветеринарии. Такие композиции традиционным образом удобно могут быть представлены для применения в смеси с одним или более чем одним физиологически приемлемым носителем или эксципиентом. Соединения формулы (I) и их фармацевтически приемлемые производные могут быть приготовлены в форме препарата для введения любым подходящим способом. Например, они могут быть приготовлены в форме препарата для местного введения или введения ингаляцией или, более предпочтительно, для перорального, трансдермального или парентерального введения. Фармацевтическая композиция может быть в такой форме, которая позволяет осуществлять контролируемое высвобождение соединений формулы (I) и их фармацевтически приемлемых производных. Для перорального введения фармацевтическая композиция может быть в форме например таблеток (включая подъязычные таблетки), капсул, порошков, растворов, сиропов или суспензий,приготовленных стандартными способами с использованием эксципиентов. Для трансдермального введения фармацевтическая композиция может быть в форме трансдермального пластыря, такого как трансдермальный ионтофоретический пластырь. Для парентерального введения фармацевтическая композиция может быть представлена в виде инъекции или непрерывной инфузии (например внутривенно, внутрисосудисто или подкожно). Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать используемые в приготовлении лекарств агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Для введения путем инъекции они могут быть представлены в форме одной стандартной дозы или множества доз, предпочтительно с добавлением консерванта. 8 Альтернативно, для парентерального введения активный ингредиент может быть в форме порошка для разведения подходящим носителем. Соединения по изобретению могут быть приготовлены также в виде депо-препарата. Такие препараты длительного действия могут быть введены путем имплантации (например подкожно или внутримышечно) или путем внутримышечной инъекции. Так, соединения по изобретению могут быть приготовлены в виде препарата с использованием подходящих полимерных или гидрофобных веществ (например в виде эмульсии в приемлемом масле), или ионообменных смол, или в виде медленно растворимых производных, например в виде медленно растворимой соли. Как изложено выше, соединения по изобретению могут быть использованы также в комбинации с другими терапевтическими агентами. Таким образом, согласно изобретению в еще одном его аспекте предложена комбинация,включающая в себя соединение формулы (I) или его фармацевтически приемлемое производное вместе с дополнительным терапевтическим агентом. Комбинации, указанные выше, могут быть удобно представлены для использования в форме фармацевтического препарата и, таким образом, фармацевтические препараты, содержащие комбинацию, как она определена выше, вместе с фармацевтически приемлемым носителем или эксципиентом, составляют еще один аспект изобретения. Индивидуальные компоненты таких комбинаций можно вводить либо последовательно, либо одновременно в отдельных или объединенных фармацевтических препаратах. Когда соединение формулы (I) или его фармацевтически приемлемое производное используют в комбинации со вторым терапевтическим агентом, активным против того же болезненного состояния, доза каждого соединения может отличаться от дозы, когда данное соединение используют одно. Специалисты в данной области легко определят подходящие дозы. Предлагаемая суточная дозировка соединения формулы (I) для лечения человека составляет от 0,01 до 500 мг/кг, такая как от 0,05 до 100 мг/кг, например от 0,1 до 50 мг/кг, которая может быть удобно введена в виде 1-4 доз. Точная используемая доза будет зависеть от возраста и состояния пациента и от пути введения. Например, суточная доза от 0,25 до 10 мг/кг может быть подходящей для системного введения. Соединения формулы (I) и их фармацевтически приемлемые производные могут быть получены любым способом, известным специалистам для получения соединений аналогичной структуры. Подходящие способы получения соединений формулы (I) и их фармацевтически прием 9 лемых производных описаны ниже. В следующих формулах R0-R5 и n являются такими, как определено в формуле (I) выше, если не указано иначе; Hal представляет собой галоген, такой как Вr или I; X-представляет собой противоион,такой как I-; и алкил является таким, как определено ранее. Так, согласно первому способу (А) соединения формулы (I) могут быть получены путем взаимодействия соединения формулы (II) или его защищенного производного с бороновой кислотой формулы (III) или ее подходящим производным в присутствии подходящего катализатора на основе переходного металла. Подходящие производные формулы (III) включают в себя эфиры бороновой кислоты, такие как эфиры, которые описаны в R. Miyaura et al.,J.Org.Chem., 1995, 60, 7508-7510. Удобно проводить реакцию в растворителе, таком как простой эфир(например 1,2-диметоксиэтан), в присутствии основания, такого как неорганическое основание (например карбонат натрия), и с использованием палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0). Согласно другому способу (Б) соединения формулы (I), где R3 представляет собой C1-6 алкил, могут быть получены окислением соединений формулы (IV) или его защищенного производного в стандартных условиях. Удобно осуществлять окисление с использованием моноперсульфатного соединения, такого как пероксимоносульфат (известный как Охоnе) и проводить реакцию в растворителе, таком как водный спирт (например водный метанол), и при температуре между -78 С и температурой окружающей среды. Согласно другому способу (В) соединения формулы (I), где R1 представляет собой C1-6 алкилсульфонил, могут быть получены окислением соединения формулы (V) или его защищенного производного в стандартных условиях. Окисление удобно проводить способом, который описан непосредственно выше касательно способа (Б). 10 Согласно другому способу (Г) соединения формулы (I), где R1 представляет собой C1-6 алкоксигруппу, замещенную одним или более чем одним атомом фтора, могут быть получены путем взаимодействия спирта формулы (VI) или его защищенного производного с галогенфторалканом в стандартных условиях. Реакцию удобно проводить в растворителе, таком как полярный растворительN,Nдиметилформамид), в присутствии сильного основания, такого как неорганический гидрид(например гидрид натрия), при температуре примерно окружающей среды и с использованием соответствующего бромфторалкана с получением желаемого соединения формулы (I). Согласно другому способу (Д) соединения формулы (I) могут быть получены путем взаимного превращения с использованием других соединений формулы (I) в качестве предшественников. Следующие процедуры являются иллюстрацией подходящих взаимных превращений. Соединения формулы (I), где R1 или R2 представляют собой C1-6 алкил, замещенный одним или более чем одним атомом фтора, могут быть получены из соответствующего соединения формулы (I), где R1 или R2 представляет собой C1-6 гидроксиалкил, С(O)Н или С(O)С 1-6 алкил, путем обработки подходящим источником фтора. Подходящие источники фтора включают в себя, например, диэтиламиносеры трифторид. Реакцию удобно проводить в присутствии растворителя, такого как галогенированный углеводород (например дихлорметан), и при пониженной температуре, такой как -78 С. Соединения формулы (I), где R1 или R2 представляют собой С(O)Н, могут быть получены из соответствующего соединения формулы(I), где R1 или R2 представляет собой СН 2OН,путем окисления. Подходящие окислители включают в себя например оксид марганца (IV). Окисление удобно проводить в присутствии растворителя, такого как галогенированный углеводород (например хлороформ), и при повышенной температуре (например температуре дефлегмации). Соединения формулы (I), где R1 или R2 представляют собой C1-6 гидроксиалкил, и где гидроксигруппа присоединена к атому углерода,связанному с пиридазиновым кольцом, могут быть получены путем восстановления соединения формулы (I), где R1 или R2 представляет собой соответствующий альдегид или кетон. Подходящие восстановители включают в себя гидридные восстановители, такие как диизобутилалюминия гидрид. 11 Восстановление удобно проводить в присутствии растворителя, такого как галогенированный углеводород (например дихлорметан), и при пониженной температуре, такой как -78 С. Как должно быть понятно специалистам,на любой стадии синтеза соединений формулы(I) может быть необходимо или желательно защитить одну или более чем одну чувствительную группу в молекуле так, чтобы предотвратить нежелательные побочные реакции. Таким образом, другой способ (Е) получения соединений формулы (I), включает в себя удаление защиты с защищенных производных соединений формулы (I). Защитные группы, используемые при получении соединений формулы (I), могут быть использованы традиционным образом (см., например, способы, описанные в ProtectiveWiley and Sons, 1991), где описаны также способы удаления таких групп). Соединения формулы (II) могут быть получены галогенированием соединений формулы стандартными способами. Так, эфиры формулы (VI) сначала гидролизуют до их соответствующих кислот, например обработкой сильным основанием (например гидроксидом натрия) в присутствии растворителя (например этанола) и при повышенной температуре. Соответствующую кислоту затем обрабатывают галогенирующим агентом, удобно при температуре окружающей среды и в растворителе (например хлорированном углеводороде), в условиях, при которых кислота подвергается одновременно галогенированию и декарбоксилированию. Удобно, когда галогенирующий агент является броминирующим агентом,таким как бром в присутствии сильной кислоты(например бромоводородной кислоты в уксусной кислоте) или N-бромсукцинимид, с получением соответствующего соединения формулы(II), где Наl является бромом. Эфиры формулы (VII) могут быть получены путем взаимодействия соединения формулы в стандартных условиях. Реакцию удобно проводить в присутствии основания, такого как карбонат калия, растворителя, такого как N,Nдиметилформамид, и при температуре окружающей среды. Бороновые кислоты формулы (III) представляют собой либо известные соединения,либо могут быть получены способами, известными из литературы, такими как способы, которые описаны например в публикации ЕРА 533268. Соединения формул (IV), (V) и (VI) могут быть получены способами, аналогичными способам, описанным для получения соединения формулы (I) из соединений формулы (II). Соединения формулы (VIII) представляют собой либо известные соединения, либо могут быть получены способами, известными из литературы, такими как способы, описанные, например, в D.H.Wadsworth et al., J.Org.Chem,(1987), 52(16), 3662-8 и J.Morris and D.G.Wishka,Synthesis (1994), (1), 43-6. Соединения формулы (IX) являются либо известными соединениями, либо могут быть получены способами, известными из литературы, такими как способы, описанные, например,в Y.Kobayashi et al., Chem.Pharm.Bull., (1971),19(10), 2106-15; T.Tsuchiya, J.Kurita andSoedin., 1970, 2, 57-62. Некоторые промежуточные соединения,описанные выше, являются новыми соединениями, и должно быть понятно, что все новые промежуточные соединения образуют здесь дополнительные аспекты изобретения. Соединения формулы (II) являются ключевыми промежуточными соединениями и представляют собой конкретный аспект изобретения. Соединения по изобретению удобно выделять в форме свободного основания. Фармацевтически приемлемые соли присоединения кислот соединений по изобретению могут быть получены с использованием стандартных способов. Сольваты (например гидраты) соединения по изобретению могут образовываться в ходе обработки на одной из ранее упомянутых стадий способа. Следующие примеры иллюстрируют изобретение, но никоим образом не ограничивают данное изобретение. Все температуры даны в С. Колоночную флэш-хроматографию проводили, используя диоксид кремния Merck 9385. Тонкослойную хроматографию (ТСХ) проводили на пластинках из диоксида кремния. ЯМР 13 проводили на спектрометре Brucker 250 МГц. Химические сдвиги даны по отношению к тетраметилсилану как внутреннему стандарту химического сдвига, вмлн-1. Использовали следующие сокращения: Me - метил, s - синглет, d дублет, t - триплет и m - мультиплет. Пример 1. 6-Дифторметокси-2-(4-фторфенил)-3-(4-метансульфонилфенил)пиразоло[1,5-b]пиридазин.(3.39 мл) добавляли к смеси метилового эфира 3-(4 фторфенил)-проп-2-ионовой кислоты (3,36 г) и 1-амино-3-метоксипиридазин-1-ия мезитиленсульфоната(1980 (6,1419 г) в ацетонитриле (125 мл), и смесь перемешивали при температуре окружающей среды в течение 48 ч. В течение первых 2 ч через реакционную смесь пропускали поток воздуха. Смесь концентрировали в вакууме,растворяли в этилацетате (150 мл), промывали водой (3 х 25 мл), сушили (МgSO4), фильтровали и упаривали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества (4,77 г). 1(II) 6-Метокси-2-(4-фторфенилпиразоло[1,5-b]пиридазин-3-карбоновая кислота. Смесь метилового эфира 6-метокси-2-(4 фторфенилпиразоло[1,5-b]пиридазин-3-карбоновой кислоты (4,469 г), 2 н. гидроксида натрия (50 мл) и метанола (90 мл) нагревали при температуре дефлегмации в течение 2 ч. Охлажденный раствор добавляли к 2 н. соляной кислоте (200 мл), и указанное в заголовке соединение выделяли фильтрованием в виде бежевого твердого вещества (3,639 г). 1 Н ЯМР (ДМСО-d6): 12,8 (br.s, 1H) 8,4 (d,1H, J=10 Гц) 7,8-7,9 (m, 2H) 7,21-7,32 (m, 2H) 7,15-7,2 (d, 1H, J=10 Гц) 4,0 (s, 3H).(III) 2-(4-Фторфенил)-3-(4-метансульфонилфенил)-6-метоксипиразоло[1,5-b]пиридазин. Смесь 6-метокси-2-(4-фторфенилпиразоло[1,5-b]пиридазин-3-карбоновой кислоты (869 мг) и бикарбоната натрия (756 мг) в диметилформамиде (10 мл) обрабатывали Nбромсукцинимидом (587 мг) и перемешивали при температуре окружающей среды в течение 1 ч, затем добавляли к воде (50 мл) и экстрагировали этилацетатом (3 х 50 мл), сушили (MgSO4) и упаривали в вакууме. Полученное коричневое твердое вещество (1,612 г) растворяли в 1,2 диметоксиэтане (20 мл). Добавляли 2 н. водный раствор карбоната натрия (10 мл) вместе с 4 002775(660 мг) и тетракис(трифенилфосфин)палладием(0) (100 мг) и смесь нагревали при температуре дефлегмации в течение 20 ч. Реакционную смесь выливали в воду (50 мл), экстрагировали дихлорметаном (3 х 100 мл). Объединенные органические экстракты сушили (MgSO4) и упаривали в вакууме с получением коричневого твердого вещества (1,116 г), которое очищали колоночной флэшхроматографией на силикагеле, элюируя смесью циклогексан/этилацетат (4:1, затем 2:1), с получением указанного в заголовке соединения в виде желтого твердого вещества (390 мг). ТСХ, SiO2, Rf0,3 (1:1 циклогексан/этилацетат), детектирование УФ.(1,4 г) нагревали до 200 С и выдерживали при 200 С в запаянном реакционном сосуде (Reactivial) в течение 3 ч. Охлажденную реакционную смесь вливали в воду (20 мл) и экстрагировали этилацетатом (3 х 30 мл). Объединенные органические экстракты сушили (МgSO4),фильтровали и упаривали в вакууме с получением твердого вещества, которое растирали с диэтиловым эфиром с получением указанного в заголовке соединения в виде бежевого твердого вещества (119 мг). ТСХ, SiO2, Rf (1:2 смесь циклогексан/этилацетат), детектирование УФ. МH+ 384(0,046 г, 60% дисперсия в минеральном масле),после прекращения выделения пузырьков газа,вызванного потоком газообразного бромдифторметана, пропущенного через смесь при температуре окружающей среды в течение 30 мин. Реакционную смесь затем вливали в воду (50 мл) и экстрагировали этилацетатом (50 мл), органический экстракт промывали водой (3 х 50 мл), сушили и концентрировали в вакууме. Остаток очищали хроматографией с получением указанного в заголовке соединения в виде белого твердого вещества (0,17 г). МН+ = 434 1 Н ЯМР (CDCl3):8,05-8,0 (d, J=10 Гц, 2 Н) 8,0-7,95 (d, J=10 Гц, 1 Н) 7,6-7,5 (m, 4 Н) 7,8-7,2(I) Метиловый эфир 2-(4-метоксифенил)пиразоло[1,5-b]пиридазин-3-карбоновой кислоты. Диазабицикло[5.4.0]ундец-7-ен (22,76 мл,2 экв.) добавляли по каплям к раствору метилового эфира 3-(4-метоксифенил)-проп-2-ионовой кислоты (J.Morris and D.G.Wishka, Synthesis 91994), (1), 43-6) (14.46 г, 76 мМ) и 1 аминопиридазиния иодида (Kobayashi et alChem.Pharm.Bull. (1971), 19(10), 2106-15) (2 экв.) в ацетонитриле в атмосфере азота и перемешивали в течение 6 ч. Очисткой хроматографией на силикагеле, элюируя толуолом, затем смесью толуол:этилацетат (9:1), получали указанное в заголовке соединение (2,76 г) в виде коричневого твердого вещества.(III) 3-(4-Метансульфонилфенил)-2-(4 метоксифенил)-пиразоло[1,5-b]пиридазин. Смесь метилового эфира 2-(4-метоксифенил)-пиразоло[1,5-b]пиридазин-3-карбоновой кислоты (2,76 г) и водн. гидроксида натрия (2 н,30 мл) в этаноле (30 мл) кипятили с обратным холодильником в атмосфере азота в течение 2 ч. Охлажденную смесь подкисляли соляной кислотой (2 н.), и полученное белое твердое вещество (2,53 г) выделяли фильтрованием. Это твердое вещество растворяли в ДМФ и добавляли бикарбонат натрия (2,67 г, 3,3 экв.), а затемN-бромсукцинимид (1,88 г, 1,1 экв.) порциями. После перемешивания в течение 1 ч в атмосфере азота, добавляли воду и экстрагировали этилацетатом (2 х 25 мл). Высушенную органическую фазу концентрировали и остаток переносили в ДМЭ (60 мл). Добавляли водный карбонат натрия (2 н., 15 мл), а затем 4 метансульфонилфенилбороновую кислоту(3,12 г) и тетракис(трифенилфосфин)палладий(0) (250 мг). Смесь нагревали при температуре дефлегмации в атмосфере азота в течение 18 ч, охлаждали,вливали в воду и экстрагировали этилацетатом(2 х 25 мл). Объединенные органические фазы сушили и концентрировали на силикагеле. Хроматографией на силикагеле, элюируя смесью толуол:этилацетат (8:1), получали после концентрирования указанное в заголовке соединение (3,58 г) в виде кремового твердого вещества.(3,58 г) в CH2Cl2 при -70. Смесь перемешивали в течение 10 мин, затем нагревали до 0 и перемешивали при 0 в течение ночи. Реакционную смесь подщелачивали карбонатом калия, затем подкисляли соляной кислотой (2 М), вливали в воду и экстрагировали CH2Cl2. Органическую фазу сушили, фильтровали и концентрировали с получением указанного в заголовке соединения(1,87 г) в виде желтого твердого вещества.(II) 2-(4-Этоксифенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b]пиридазин. 4-[3-(4-Метансульфонилфенил)пиразоло[1,5-b]пиридазин-2-ил]-фенол (663 мг,1,82), иодэтан (1 экв.) и карбонат калия (2 экв.) в ацетонитриле (30 мл) нагревали при температуре дефлегмации в атмосфере азота в течение 18 ч. Охлажденную реакционную смесь распределяли между водой (30 мл) и этилацетатом (30 мл). Органическую фазу собирали, сушили и очищали хроматографией с получением указанного в заголовке соединения (547 мг) в виде кремовой пены. МH+ 394 1(I) Метиловый эфир 2-(4-фторфенил)-6 метилсульфонилпиразоло[1,5-b]пиридазин-3-карбоновой кислоты. Твердый трет-бутоксикарбонил-Oмезитиленсульфонилгидроксиламин (К. Novitskii et al., Khim. Geterotskil. Soedin., 1970, 2, 5762) (7,8 г) добавляли порциями при перемешивании к ТФУ (трифторуксусной кислоте) (25 мл) в течение 10 мин, затем перемешивали еще 20 мин. Раствор выливали на лед (200 мл) и оставляли до полного таяния льда. Полученное белое твердое вещество отфильтровывали, промывали водой и растворяли в ДМЕ (диметило 17 вый эфир) (100 мл). Раствор сушили над молекулярными ситами 4 А в течение 1,5 ч, фильтровали, затем добавляли к раствору 3 метилтиопиридазина (Barlin G.B., Brown, W.V.,J.Chem.Soc. (1968), (12), 1435-45) (2,6 г) в дихлорметане (35 мл), и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Промежуточную соль выделяли фильтрованием в виде светло-коричневых кристаллов(3,87 г), суспендировали в ацетонитриле (100 мл) и добавляли метил 3-(4-фтор-фенил)проп-2 ионовую кислоту (2,02 г). По каплям добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (2,1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Полученный кристаллический осадок отфильтровывали,промывали и сушили (770 мг). Концентрирование фильтрата давало второй выход (430 мг). Остатки распределяли между водой и метилацетатом (по 100 мл каждого) и водный слой экстрагировали этилацетатом (20 мл). Объединенные органические вещества промывали водой, рассолом и сушили. Удаление растворителя приводило к получению коричневого масла, которое очищали флэшхроматографией на силикагеле (300 г), элюируя смесью циклогексан/этилацетат (3:1), с получением дополнительного количества продукта(247 мг). Три выхода объединяли с получением указанного в заголовке соединения (1,45 г) в виде светло-коричневого твердого вещества. МН+ 318 1 Н ЯМР (CDCl3):2,70 (3 Н, s), 3,88 (3 Н, s),7,08-7,18 (3 Н, m), 7,84 (2 Н, m), 8,31 (1 Н, d,J=10 Гц).(II) 2-(4-Фторфенил)-3-(4-метансульфонилфенил)-6-метилсульфонилпиразоло[1,5-b]пиридазин. Смесь метилового эфира 2-(4-фтор-фенил)6-(метилтио)-пиразоло[1,5-b]пиридазин-3-карбоновой кислоты (1,45 г), карбоната калия (690 мг) в метаноле (40 мл) и воде(14 мл) перемешивали и нагревали при температуре дефлегмации в течение 20 ч в атмосфере азота. Растворители удаляли и полученное твердое вещество распределяли между этилацетатом(50 мл) и водой (250 мл). Водный слой подкисляли до рН 1 (2 М HCl), и твердое вещество отфильтровывали (1,0 г, МH+ 304). Смесь этого твердого вещества (1,0 г), бикарбоната натрия(557 мг) и NBS (N-бромсукцинимида) (594 мг) перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь вливали в воду(150 мл) и экстрагировали этилацетатом (3 х 50 мл). Объединенные экстракты промывали водой(50 мл), рассолом (20 мл), сушили и концентрировали. Полученное твердое вещество (1,015 г,МН+ 338,340), 4-(метансульфонил)фенилбороновую кислоту (902 мг), карбонат натрия (740 мг) и тетракис(трифенилфосфин)палладий (0) (175 мг) перемешивали и нагревали в атмосфере азота при температуре 18 дефлегмации в DME (30 мл) и воде (15 мл) в течение 48 ч. Реакционную смесь вливали в воду и экстрагировали этилацетатом (3 х 50 мл). Объединенные экстракты сушили и растворитель удаляли с получением коричневого твердого вещества. Его очищали на диоксиде кремния,элюируя смесью циклогексана и этилацетата(1:1) с получением указанного в заголовке соединения (0,713 г) в виде желтого твердого вещества.(196 мг, 0,32) в течение 20 ч. Полученный раствор вливали в воду (50 мл) и экстрагировали хлороформом (3 х 20 мл). Объединенные экстракты сушили и растворитель удаляли. Кристаллизация остатка из метанола приводила к получению указанного в заголовке соединения(60 мг) в виде белого твердого вещества. МH+ 446 1 Н ЯМР (ДМСО-d6):3,34 (3 Н, s) 3,53 (3 Н,s) 7,33 (2 Н, t, J=9 Гц) 7,62 (2 Н, m) 7,68 (1 Н, d,J=8,5 Гц) 8,04 (1 Н, d, J=10 Гц) 8,52 (1 Н, d, J=9 Гц).TCX SiO2 гексан:этилацетат (1:1), Rf 0,24,УФ. Пример 5. 2-(4-Дифторметоксифенил)-3-(4 метансульфонилфенил)-пиразоло[1,5-b]пиридазин. Гидрид натрия (48 мг, 60% дисперсия в масле, 1,2 ммоль) добавляли к раствору 4-[3-(4 метансульфонилфенил)пиразоло[1,5-b]пиридазин-2-ил]-фенола (200 мг, 0,55 ммоль) в безводном диметилформамиде (5 мл). Газообразный бромдифторметан осторожно пропускали через раствор в течение 20 мин, затем разбавляли CH2Cl2 (30 мл). Водная обработка с последующей хроматографией на силикагеле с использованием смеси СН 2 Сl2:этилацетат (3:1) в качестве элюента, а затем хроматографией с использованием смеси СН 2 Сl2:этилацетат (10:1) в качестве элюента, приводила к получению указанного в заголовке соединения в виде белого твердого вещества. МН+ 416 1(I) Метиловый эфир 2-(4-этоксифенил)пиразоло[1,5-b]пиридазин-3-карбоновой кислоты. Диазабицикло[5.4.0]ундец-7-ен (1,47 мл, 2 экв.) добавляли по каплям к раствору метилового эфира 3-(4-этоксифенил)-проп-2-ионовой кислоты (1,0 г) и 1-аминопиридазиния иодида(К. Novitskii et al, Khim Geterotskil Soedin, 1970,2, 57-62) (2,19 г) в ацетонитриле (10 мл) в атмосфере азота и перемешивали в течение 5 ч. Концентрирование и водная обработка приводили к получению указанного в заголовке соединения(1,2 г) в виде клейкого коричневого вещества. МH+ 298(II) 2-(4-Этоксифенил)-пиразоло-[1,5b]пиридазин-2-карбоновая кислота. Смесь метилового эфира 2-(4-этоксифенил)-пиразоло[1,5-b]пиридазин-3-карбоновой кислоты (1,2 г), этанола (10 мл) и 2 н. гидроксида натрия (10 мл) нагревали до 80 в течение 1,5 ч. Смесь оставляли охлаждаться и подкисляли 2 н. соляной кислотой до рН 1. Указанное в заголовке соединение выделяли фильтрованием в виде коричневого твердого вещества (716 мг,63%).(717 мг) в ДМФ (8 мл) перемешивали в течение 4 ч. Добавляли дополнительное количество Nйодосукцинимида (100 мг) и перемешивание продолжали в течение 2 ч. Водная обработка привела к получению темно-коричневого вещества, которое очищали SPE с использованием дихлорметана в качестве элюента. Это привело к получению указанного в заголовке вещества в виде оранжево-коричневого твердого веществаal.,J.Org.Chem., 1995, 60, 7508-7510) (0,279 г), ацетата калия (486 мг) и комплекса [1,1'бис(дифенилфосфино)-ферроцен]палла-дия(II) хлорида с дихлорметаном (1:1) (0,45 г) в диметилформамиде (8 мл) нагревали в атмосфере азота при 80 в течение 2 ч. Охлажденную реакционную смесь концентрировали в вакууме,остаток суспендировали в 1,2 диметоксиэтане(10 мл), добавляли 2-(4-этоксифенил)-3-иодпиразоло[1,5-b]пиридазин (0,4 г) вместе с 2 н. карбонатом натрия (4 мл) и тетракис(трифенилфосфин)палладием(0) (20 мг), и смесь нагревали при температуре дефлегмации в атмосфере азота в течение 18 ч. Охлажденную реакционную смесь вливали в воду (60 мл), и 20 суспензию экстрагировали этилацетатом (3 х 60 мл). Органические экстракты объединяли, сушили (NaSO4) и концентрировали. Остаток очищали хроматографией, элюируя смесью дихлорметан/этилацетат (3:1) с получением указанного в заголовке соединения в виде желтого твердого вещества (0,116 г, 27%).(77,1 г), поддерживая температуру ниже 10. Полученную оранжевую суспензию перемешивали при 0 в течение 1 ч перед добавлением к ней 3-фторбензальдегида (7,8 мл). После окончания добавления суспензию перемешивали при 0 в течение 1 ч, затем реакцию останавливали добавлением воды (75 мл). Органическую фазу отделяли и промывали рассолом (75 мл), сушили (NaSO4) и упаривали до сухого состояния. Оставшуюся смолу вливали в циклогексан (1 л) и перемешивали в течение 30 мин. Органическую фазу декантировали и остаток переносили в СН 2 Сl2 и вливали в циклогексан (1 л). Эту процедуру повторяли еще дважды,и объединенные органические фазы концентрировали до 100 мл и пропускали через силикагель. Фильтрат концентрировали с получением указанного в заголовке соединения в виде подвижного желтого масла (24 г, 100%). МН+ 280, MH+ 279 1 Н ЯМР (СDСl3):7,05 (1 Н, tm, J=9 Гц),7,3 (3 Н, m), 7,45 (1 Н, s).(II) Метиловый эфир (3-фторфенил)пропионовой кислоты. К перемешиваемому раствору 1-(2,2 дибромвинил)-3-фторбензола (23,8 г) в безводном ТГФ (350 мл), охлажденном до -78, добавляли по каплям в течение 30 мин н-бутиллитий(2,2 экв., 1,6 М в гексанах). Смесь перемешивали еще 30 мин при -78 перед добавлением метилхлороформиата (11,6 г, 9,5 мл), и полученную смесь оставляли нагреваться до 0 в течение 1 ч перед разбавлением ее смесью 1:1 насыщенный водный бикарбонат натрия:хлорид аммония(100 мл) и экстрагированием эфиром (2 х 100 мл). Объединенный органический экстракт промывали рассолом (25 мл), сушили (Nа 2SO4) и упаривали до сухого состояния с получением указанного в заголовке соединения в виде коричневого масла (16,7 г, 100%).(III) Метиловый эфир 2-(3-фторфенил)-6 метоксипиразоло[1,5-b]пиридазин-3-карбоновой кислоты. 1,8-Диазабицикло[5.4.0]ундец-7-ен (5 мл) добавляли к перемешиваемой, охлажденной смеси метилового эфира (4-фторфенил)пропионовой кислоты (2,67 г) и 1-амино-3 метоксипиридазин-1-ия мезитиленсульфоната(4,89 г) в ацетонитриле (80 мл), и смесь перемешивали при 0 в течение 1 ч, а затем при температуре окружающей среды в течение 18 ч. Смесь концентрировали в вакууме и распределяли между этилацетатом (150 мл) и водой (150 мл). Водную фазу отделяли и дополнительно экстрагировали этилацетатом (2 х 100 мл). Объединенные органические экстракты промывали водой (2 х 50 мл), рассолом (25 мл), сушили(MgSO4), фильтровали и упаривали в вакууме с получением твердого вещества, которое растирали со смесью безводный эфир:петролейный эфир (1:0,5) с получением указанного в заголовке соединения в виде коричневого твердого вещества (2,4 г, 53%). МH+ 302 1(IV) 2-(3-Фторфенил)-6-метоксипиразоло[1,5-b]пиридазин-3-карбоновая кислота. 2 н. гидроксид натрия (50 мл) добавляли к раствору метилового эфира 2-(3-фторфенил)-6 метоксипиразоло[1,5-b]пиридазин-3-карбоновой кислоты (2,3 г) в абсолютном этаноле (50 мл) и полученную смесь нагревали до температуры дефлегмации в течение трех часов. Охлажденную реакционную смесь медленно вливали в перемешиваемый раствор 2 н. соляной кислоты (300 мл). Полученную суспензию перемешивали при температуре окружающей среды в течение 1 ч, затем фильтровали и остаток на фильтре промывали водой и сушили в вакууме при 60 с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (2,0 г, 91%). МН+ 288 1(1,78 г) и полученный раствор перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь разбавляли этилацетатом(800 мл) и промывали последовательно водой 1(VI) 6-Дифторметокси-2-(3-фторфе-нил)пиразоло[1,5-b]пиридазин. Порции 3-бром-2-(3-фторфенил)-6 метоксипиразоло[1,5-b]пиридазина (400 мг, 2,1 г всего) помещали в отдельные реакционные сосуды Reactivials, снабженные магнитными мешалками. В каждый сосуд добавляли пиридина гидрохлорид (10 экв.), сосуды запаивали и нагревали до 200 С в течение 3 ч. Сосуды оставляли охлаждаться до 140 С перед тем, как открыть, и содержимое вливали в смесь лед/вода. Полученную смесь экстрагировали этилацетатом (3 х 100 мл) и объединенные органические экстракты промывали водой (7 х 75 мл), сушили(Na2SO4) и упаривали с получением дезбромфенола в виде коричневого твердого вещества (1,0 г, MH+ 230). Это твердое вещество растворяли в безводном ДМФ (диметилформамиде)(10 мл) и порциями добавляли гидрид натрия(60% дисперсия в минеральном масле, 200 мг). После перемешивания в течение 20 мин при температуре окружающей среды раствор переносили в небольшой охлаждаемый автоклав и добавляли бромдифторметан (5 мл, избыток,конденсированный при -30). Автоклав затем герметически закрывали, оставляли нагреваться до температуры окружающей среды и перемешивали в течение 36 ч. Полученный раствор разбавляли этилацетатом (200 мл), промывали водой (10 х 20 мл), сушили (Na2SO4), концентрировали и оставшуюся смолу очищали колоночной флэш-хроматографией с использованием смеси циклогексан/этилацетат (4:1) в качестве элюента. Это приводило к получению указанного в заголовке соединения в виде (652 мг,60%).(10 мл) и перемешивали в течение 18 ч. Реакционную смесь разбавляли этилацетатом (300 мл) и промывали водой (10 х 20 мл), рассолом (20 мл), сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения в виде твердого вещества (293 мг, 91%).(VIII) 6-Дифторметокси-2-(3-фторфенил)-3-(4 метансульфонилфенил)-пиразоло[1,5-b]пиридазин. К перемешиваемому раствору 3-бром-6 дифторметокси-2-(3-фторфенил)-пиразоло[1,5b]пиридазина (286 мг) в ДМФ (20 мл) добавляли 2 н. водн. карбонат натрия (10 мл). К этой смеси добавляли 4-метансульфонилфенилбороновую кислоту (180 мг) и тетракистрифенилфосфинпалладий(0) (34 мг). Полученную смесь перемешивали и нагревали до температуры дефлегмации в течение 18 ч. Охлажденную реакционную смесь разбавляли этилацетатом (300 мл) и органический раствор промывали водой (10 х 30 мл) и рассолом (30 мл), сушили (Na2SO4) и упаривали с получением смолы, которую очищали колоночной флэш-хроматографией, используя смесь хлороформ:этилацетат (от 50:1 до 5:1) в качестве элюента. Объединение подходящих фракций и концентрирование дало в результате указанное в заголовке соединение в виде не совсем белого твердого вещества (132 мг, 37%).MH+ 434 1 Н ЯМР (CDCl3):8,02 (1 Н, d, J=9 Гц),7,95 (2 Н, d, J=10 Гц), 7,58 (1 Н, d, 9 Гц), 7,52 (1 Н,t, J=70 Гц), 7,32 (3 Н, m), 7,08 (1 Н, m), 6,9 (1 Н, d,J=9 Гц), 3,15 (3 Н, s). Биологические данные Ингибирующую активность против ЦОГ-1 и ЦОГ-2 человека оценивали на клетках COS,которые были стабильно трансфецированы кДНК ЦОГ-1 человека и ЦОГ-2 человека. За 24 ч до эксперимента, клетки COS переносили из сосудов 175 см 2, где они росли, на 24-луночные планшеты для культивирования клеток, используя следующую процедуру. Среду для инкубирования (среду Игла, модифицированную по способу Дюльбекко (DMEM с добавлением инактивированной нагреванием фетальной сыворотки крупного рогатого скота (10% об./об.),пенициллина (100 МЕ/мл), стрептомицина (100 мкг/мл) и генетицина (600 мкг/мл) удаляли из сосуда с конфлуентными клетками (1 сосуд при конфлуентности содержит приблизительно 1 х 107 клеток). В сосуд добавляли 10 мл фосфатного солевого буфера (ФСБ) для промывания клеток. Отбросив ФСБ, клетки затем промывали в 10 мл трипсина в течение 20 с, после чего трипсин удаляли и сосуд помещали в инкубатор(37) на 1-2 мин до тех пор, пока клетки не открепятся от стенок сосуда. Сосуд затем вынимали из инкубатора и клетки ресуспендировали в 10 мл свежей среды для инкубирования. Содержимое сосуда переносили в стерильный контейнер емкостью 250 мл и объем среды для ин 1 24 кубирования затем доводили до 100 мл. 1 мл суспензии клеток вносили пипеткой в каждую лунку 4 х 24-луночных планшетов для культивирования клеток. Планшеты затем помещали в инкубатор (37 С, 95% воздух/5% СО 2) на ночь. Если требовалось больше одного сосуда клеток,клетки из отдельных сосудов объединяли, а затем распределяли в 24-луночные планшеты. После инкубирования в течение ночи среду для инкубирования полностью удаляли из 24 луночных планшетов для культивирования клеток и заменяли 250 мкл свежей DMEM (37 С). Исследуемые соединения доводили до 250-х требуемой исследуемой концентрации в ДМСО и добавляли в лунки в объеме 1 мкл. Планшеты затем осторожно перемешивали путем вращения, а затем помещали в инкубатор на 1 ч (37 С,95% воздух/5% СО 2). После окончания периода инкубирования в каждую лунку добавляли 10 мкл арахидоновой кислоты (750 мкМ) с получением конечной концентрации арахидоновой кислоты 30 мкМ. Планшеты затем инкубировали еще 15 мин, после чего среду для инкубирования удаляли из каждой лунки планшета и хранили при -20 С до определения уровня простагландина Е 2 (ПГE2) с использованием иммуноферментного анализа. Ингибиторную способность исследуемого соединения выражали в значениях ИК 50, которые определяли как концентрацию соединения, требуемую для ингибирования высвобождения ПГЕ 2 из клеток на 50%. Отношение селективности ингибирования ЦОГ 1 против ЦОГ-2 вычисляли, сравнивая соответственные значения ИК 50. Для соединений по настоящему изобретению были получены следующие значения ИK50 для ингибирования ЦОГ-1 и ЦОГ-2: Пример 1(V) 2(II) 3(II) 4(III) 5 6(IV) 7(VIII) и их фармацевтически приемлемые производные, в которыхR0 представляет собой галоген, C1-6 алкил, С 16 алкоксигруппу, C1-6 алкоксигруппу, замещенную одним или более чем одним атомом фтора, илиR1 и R2 независимо выбраны из Н, С 1-6 алкила,C1-6 алкила, замещенного одним или более чем од 25 ним атомом фтора, C1-6 алкоксигруппы, C1-6 гидроксиалкила, SC1-6 алкила, С(O)Н, С(O)С 1-6 алкила, C1-6 алкилсульфонила, C1-6 алкоксигруппы,замещенной одним или более чем одним атомом фтора, O(СН 2)nСO2 С 1-6 алкила, О(СН 2)nSС 1-6 алкила,(CH2)nNR4R5,(СН 2)nSС 1-6 алкила илиC(O)NR 4 R5 ; при условии, что когда R 0 находится в положении 4 и представляет собой галоген, по меньшей мере, один из R 1 и R 2 представляет собой C 1-6 ал-килсульфонил, C 16 алкоксигруппу, замещенную одним или более чем одним атомом фтора, O(СН 2 ) n СO 2 С 14 5 6 алкил, O(СН 2 ) n SС 1-6 алкил, (CH 2 ) n NR R или 4 5R4 и R5 независимо выбраны из Н или C1-6 алкила или вместе с атомом азота, к которому они присоединены, образуют 4-8 членное насыщенное кольцо; иn равно числу от 1 до 4. 2. Соединения по п.1, где R0 представляет собой F, C1-3 алкил, C1-3 алкоксигруппу, C13 алкоксигруппу, замещенную одним или более чем одним атомом фтора, или O(CH2)nNR4R5; R1 представляет собой С 1-4 алкилсульфонил, С 1-4 алкоксигруппу, замещенную одним или более чем одним атомом фтора, O(СН 2)nСO2 С 1-4 алкил,O(CН 2)nSС 1-4 алкил, (CH2)nNR4R5, (СН 2)nSС 14 5 0 4 алкил или C(O)NR R , или, когда R являетсяC1-3 алкилом, C1-3 алкоксигруппой, C1-3 алкоксигруппой, замещенной одним или более чем одним атомом фтора, или O(CH2)nNR4R5 может представлять собой также Н; R2 представляет собой Н; R3 представляет собой метил или NН 2;R4 и R5 независимо представляют собой C1-3 алкил или вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное кольцо; и n равно числу от 1 до 3. 3. Соединения по п.1 или 2, где R0 представляет собой F, метил, С 1-2 алкоксигруппу,OCHF2 или O(CH2)nNR4R5; R1 представляет собой метилсульфонил, OCHF2, O(CН 2)nСО 2 С 1-4 алкил, O(СН 2)nSСН 3, (CH2)nNR4R5, (СН 2)nSСН 3 или C(O)NR4R5, или, когда R0 представляет собой метил, С 1-2 алкокси, OCHF2 илиO(СН 2)nN(СН 3)2, может представлять собой также Н; R2 представляет собой Н; R3 представляет собой метил или NH2; R4 и R5 оба представляют собой метил или вместе с атомом азота, к которому они присоединены, образуют 5-6 членное насыщенное кольцо; и n равно числу от 1 до 2. 4. Соединения по любому из пп.1-3, где R0 представляет собой F, C1-3 алкоксигруппу или C1-3 алкоксигруппу, замещенную одним или более чем одним атомом фтора; R1 представляет собой С 1-4 алкилсульфонил, С 1-4 алкоксигруппу, замещенную одним или более чем одним атомом фтора, или,когда R0 представляет собой C1-3 алкоксигруппу илиC1-3 алкоксигруппу, замещенную одним или более чем одним атомом фтора, может представлять со 002775 26 бой также Н; R2 представляет собой Н; и R3 представляет собой метил или NН 2. 5. Соединения по любому из пп.1-4, где R0 находится в положении 3 или 4 фенильного кольца. 6. Соединения по любому из пп.1-5, где R1 находится в положении 6 пиридазинового кольца. 7. 2-(4-Этоксифенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b]пиридазин; 6-дифторметокси-2-(3-фторфенил)-3-(4 метансульфонилфенил)-пиразоло[1,5b]пиридазин; и их фармацевтически приемлемые производные. 8. Способ получения соединений формулы(I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором соединение формулы (II) или его защищенное производное подвергают взаимодействию с соединением формулы (III) или его защищенным производным с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I),полученные способом, описанным выше, в их фармацевтически приемлемые производные. 9. Способ получения соединений формулы(I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором, если или его защищенное производное подвергают взаимодействию с окисляющим агентом с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I), полученные способом, описанным выше, в их фармацевтически приемлемые производные. 10. Способ получения соединений формулы (I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором, если R1 представляет собой C16 алкилсульфонил, соединение формулы (V) или защищенное производное подвергают окислению с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I), полученные способом, описанным выше, в их фармацевтически приемлемые производные. 11. Способ получения соединений формулы (I) и их фармацевтически приемлемых производных по любому из пп.1-7, при котором, если R1 представляет собой С 16 алкоксигруппу, замещенную одним или более чем одним атомом фтора, спирт формулы или его защищенное производное подвергают взаимодействию с галогенфторалканом с последующим удалением любой из защитных групп и возможно превращают соединения формулы (I),полученные способом, описанным выше, в их фармацевтически приемлемые производные. 12. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемое производное по любому 28 из пп.1-7 в смеси с одним или более чем одним физиологически приемлемым носителем или эксципиентом. 13. Соединение формулы (I) или его фармацевтически приемлемое производное по любому из пп.1-7 для применения в медицине или ветеринарии. 14. Соединение формулы (I) или его фармацевтически приемлемое производное по любому из пп.1-7 для применения при лечении состояния, которое опосредуется селективным ингибированием ЦОГ-2. 15. Способ лечения человека или животного, страдающего заболеванием, опосредованным селективным ингибированием ЦОГ-2, введением эффективного количества соединения формулы (I) или фармацевтически приемлемого производного по любому из пп.1-7. 16. Применение соединения формулы (I) или его фармацевтически приемлемого производного по любому из пп.1-7 для производства терапевтического агента для лечении состояния,которое опосредуется селективным ингибированием ЦОГ-2, такого как воспалительное расстройство.
МПК / Метки
МПК: A61P 29/00, A61K 31/5025, C07D 487/04
Метки: ингибиторов, применение, получение, цог-2, производные, циклооксигеназы-2, качестве, 2,3-диарил-пиразоло[1,5-b]пиридазинов
Код ссылки
<a href="https://eas.patents.su/15-2775-proizvodnye-23-diaril-pirazolo15-bpiridazinov-ih-poluchenie-i-ih-primenenie-v-kachestve-ingibitorov-ciklooksigenazy-2-cog-2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2,3-диарил-пиразоло[1,5-b]пиридазинов, их получение и их применение в качестве ингибиторов циклооксигеназы 2 (цог-2)</a>
Следующий патент: Фармацевтические композиции, содержащие циклодекстрины и таксоиды
Случайный патент: Способ и устройство для обработки таблицы



















