Фармацевтические комбинации, содержащий их набор, применение этих комбинаций и способ лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом
Номер патента: 21757
Опубликовано: 31.08.2015
Авторы: Золка Флавио, Ван Мел Якобус С.А., Штефаник Мартин Фридрих, Хильберг Франк, Баум Анке, Мунцерт Герд
Формула / Реферат
1. Фармацевтическая комбинация, содержащая эффективное количество
(I) (Z)-3-(1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и
(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел, в форме комбинированного препарата для одновременного, отдельного или последовательного применения при лечении болезней, в которые вовлечены клеточная пролиферация, миграция или апоптоз миеломных клеток или ангиогенез.
2. Фармацевтическая комбинация по п.1, где (I) представляет собой моноэтансульфонат 3-Z-[1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон.
3. Фармацевтическая комбинация по п.1, где (II) выбран из группы, включающей дексаметазон или преднизолон.
4. Фармацевтическая комбинация по п.1, где (II) выбран из соединения платины карбоплатина.
5. Фармацевтическая комбинация по п.1, где (II) выбран из противоракового средства растительного происхождения паклитаксела или доцетаксела.
6. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении онкологических заболеваний.
7. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении злокачественных неоплазий.
8. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении плотных опухолей.
9. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении форм рака мочеполовой системы, рака легкого, форм рака желудочно-кишечного тракта, рака головы и шеи, злокачественных мезотелиом, рака молочной железы, злокачественной миеломы или сарком костной и мягкой тканей.
10. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении гематологических неоплазий.
11. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении резистентной или находящейся на стадии рецидива множественной миеломы, острого или хронического миелогенного лейкоза, миелодиспластического синдрома или острого лимфобластного лейкоза.
12. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении неонкологических заболеваний, таких как диабетическая ретинопатия, ревматоидный артрит или псориаз.
13. Набор фармацевтического комбинированного препарата для лечения болезней, в которые вовлечены клеточная пролиферация, миграция или апоптоз миеломных клеток или ангиогенез, включающий терапевтически эффективное количество:
(I) (Z)-3-(1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и
(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел, отличающийся тем, что (I) находится в первом отсеке и (II) находится во втором отсеке таким образом, что их введение нуждающемуся пациенту можно осуществлять независимо, отдельно или последовательно.
14. Набор фармацевтического комбинированного препарата по п.13, где (I) представляет собой моноэтансульфонат 3-Z-[1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон.
15. Набор фармацевтического комбинированного препарата по п.13 или 14, где состав (I) предназначен для перорального введения.
16. Применение фармацевтической комбинации по любому из пп.1-12 или набора фармацевтического комбинированного препарата по любому из пп.13-15 для приготовления лекарственного средства для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, у человека или млекопитающего кроме человека.
17. Применение эффективного количества:
(I) (Z)-3-(1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и
(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел,
для приготовления фармацевтического комбинированного препарата для одновременного, раздельного или последовательного применения для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, у человека или млекопитающего кроме человека.
18. Применение по п.17, где (I) представляет собой моноэтансульфонат 3-Z-[1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон.
19. Способ лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, заключающийся в том, что одновременно, раздельно или последовательно вводят эффективное количество
(I) (Z)-3-(1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и
(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел, в форме комбинированного препарата пациенту, нуждающемуся в таком лечении.
20. Способ по п.19, отличающийся тем, что (Z)-3-(1-(4-(N-((4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен)-6-метоксикарбонил-2-индолинон, или его полиморф, или фармацевтически приемлемую соль вводят в такой суточной дозе, чтобы уровень в плазме действующего вещества составлял 10-500 нг/мл по меньшей мере в течение 12 ч при 24-часовых интервалах между введением доз.
Текст
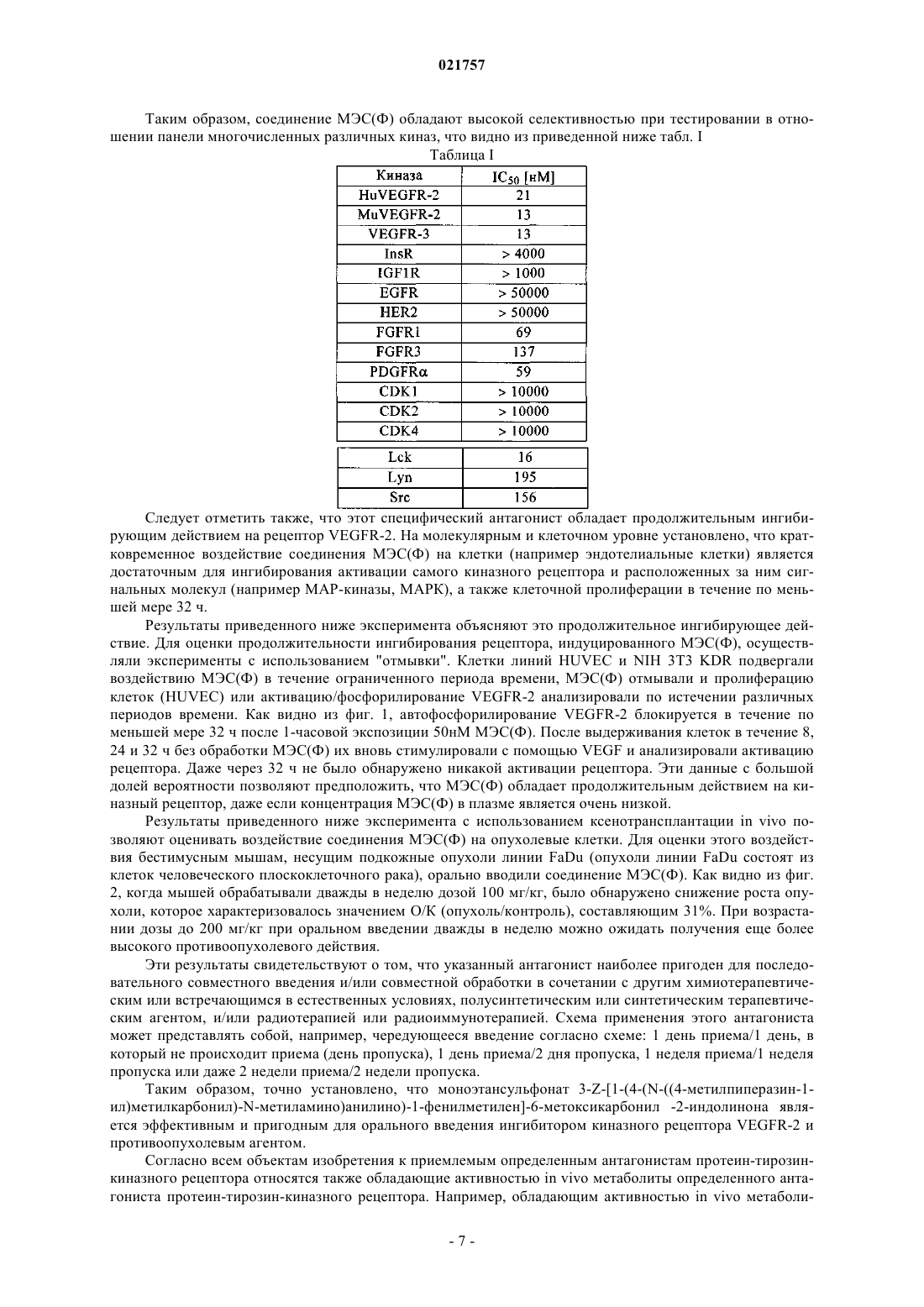
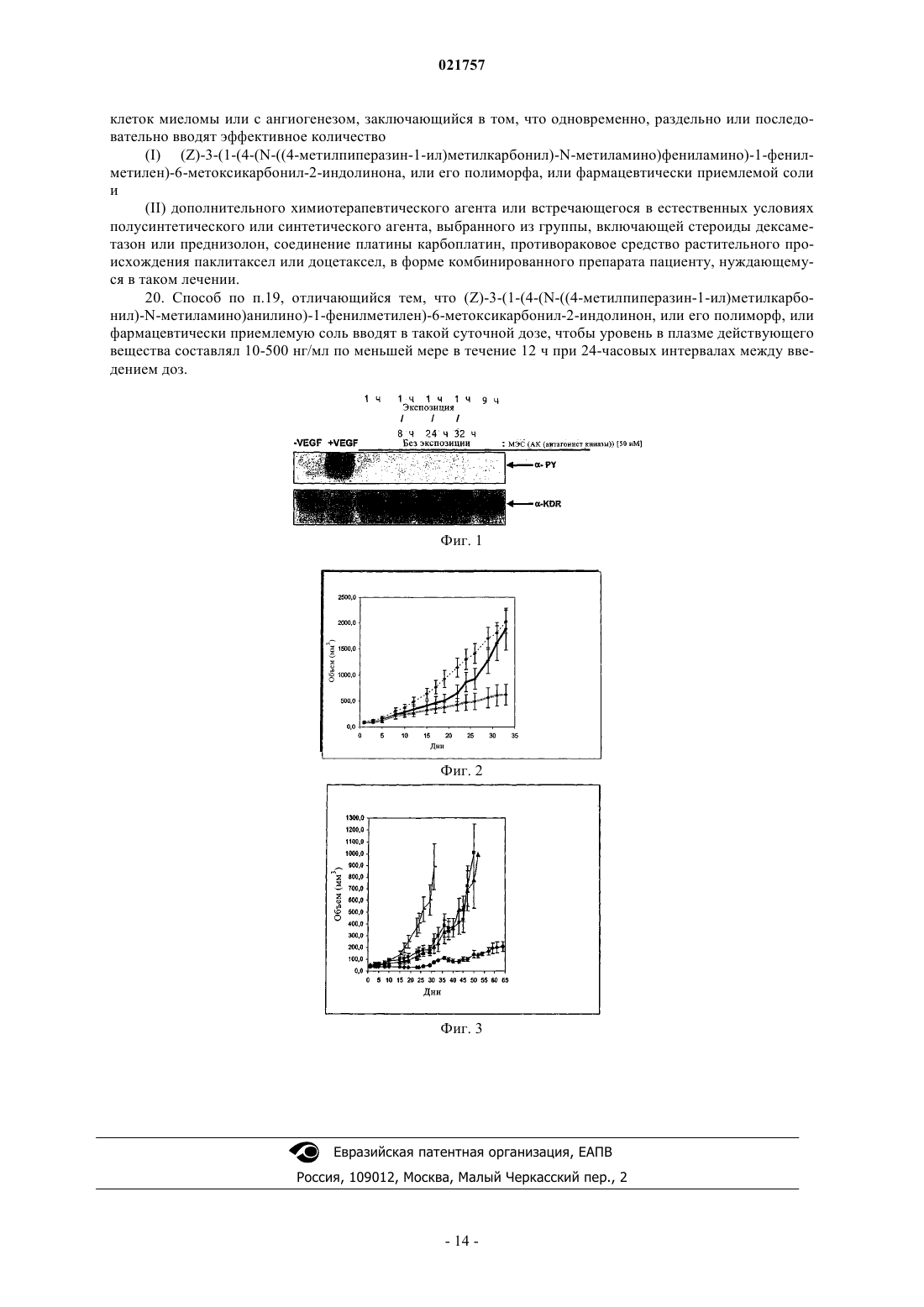
ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЙ ИХ НАБОР,ПРИМЕНЕНИЕ ЭТИХ КОМБИНАЦИЙ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ,СВЯЗАННЫХ С КЛЕТОЧНОЙ ПРОЛИФЕРАЦИЕЙ, МИГРАЦИЕЙ ИЛИ АПОПТОЗОМ КЛЕТОК МИЕЛОМЫ ИЛИ С АНГИОГЕНЕЗОМ В патенте описана фармацевтическая комбинация, предназначенная для лечения заболеваний,связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом. Также описан способ лечения указанных заболеваний, заключающийся в совместном введении эффективных количеств специфических действующих веществ и/или совместном лечении с использованием радиотерапии, в соотношении, которое обеспечивает аддитивное или синергетическое действие, а также в совместном применении указанных специфических соединений и/или радиотерапии, и способ приготовления соответствующих фармацевтических комбинированных препаратов.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Область техники, к которой относится изобретение Изобретение относится к лечению заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, заключающемуся в том, что индивидууму, который нуждается в таком лечении, совместно вводят эффективные количества и/или индивидуума, который нуждается в таком лечении, подвергают комбинированной терапии, применяя эффективные количества:(II) по меньшей мере дополнительного химиотерапевтического или встречающегося в естественных условиях, полусинтетического или синтетического терапевтического агента; и/или(III) радиотерапевтического или радиоиммунотерапевтического агента. Настоящее изобретение относится также к приемлемым фармацевтическим композициям, которые содержат эффективные количества:(II) по меньшей мере дополнительного химиотерапевтического или встречающегося в естественных условиях, полусинтетического или синтетического терапевтического агента,и необязательно адаптированы для комбинированной терапии с использованием радиотерапии или радиоиммунотерапии, представляющим собой комбинированную композицию, которая предназначена для одновременного, раздельного или последовательного применения с целью лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, и прежде всего для ингибирования роста, выживания и метастазирования опухолей. Настоящее изобретение относится также к совместному применению эффективных количеств:(II) по меньшей мере дополнительного химиотерапевтического или встречающегося в естественных условиях, полусинтетического или синтетического терапевтического агента,для приготовления фармацевтической комбинированной композиции, предназначенной для одновременного, раздельного или последовательного применения с целью лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, и прежде всего для ингибирования роста, выживания и метастазирования опухолей, необязательно в сочетании с совместным лечением с помощью радиотерапии или радиоиммунотерапии. Настоящее изобретение относится также к применению эффективного количества селективного антагониста протеин-тирозин-киназного рецептора для приготовления фармацевтической композиции,адаптированной для одновременного, раздельного или последовательного совместного лечения в сочетании с радиотерапией или радиоиммунотерапией заболеваний, связанных с клеточной пролиферацией,миграцией или апоптозом клеток миеломы или с ангиогенезом, и прежде всего для ингибирования роста,выживания и метастазирования опухолей. Предпосылки создания изобретения В последнее десятилетие была охарактеризована биологическая активность некоторых типов и подтипов семейства протеин-тирозин-киназных рецепторов, таких, например, как рецептор эпидермального фактора роста EGFR и его подтипов ErbB-2 и ErbB-4 (Brignola и др., Journal of Biological Chemistry, т. 277,2, 2002, cc. 1576-1585) или рецепторов сосудистого эндотелиального фактора роста VEGFR 1-3, а также лиганда VEGF и его четырех подтипов, известных к настоящему времени (Jung и др., EuropeanJournal of Cancer, т. 38, 2002, cc. 1133-1140). В аналогичных ранее проведенных исследованиях установлено, что сверхэкспрессия некоторых указанных рецепторов происходит при многих формах рака. Например, экспериментально доказано, что эпидермальный фактор роста EGF действует в качестве фактора роста в опухолях, а сосудистый эндотелиальный фактор роста VEGF является одним из наиболее широко распространенных медиаторов ангиогенеза опухолей, играющим важную роль для роста и метастазирования плотных опухолей. Поэтому изучались ингибиторы этих рецепторов, и все еще продолжается их исследование с целью применения для лечения рака (Cerrington и др., Advances in Cancer Research, Academic Press 2000, cc. 1-38). В современных исследованиях предложено также объединять несколько антагонистов рецепторов или дополнительно применять их в сочетании с химиотерапевтическим агентом или радиацией. Например, в WO 02/070008 предложено объединять антагонист, специфический для VEGF-рецептора, с антагонистом, специфическим для EGF-рецептора, необязательно в сочетании с радиацией или химиотерапевтическим агентом для ингибирования роста опухолей. В качестве примера приемлемых специфических антагонистов в WO 02/070008 предложены моноклональные антитела к VEGF-рецептору и моноклональные антитела к EGF-рецептору.WO 03/011837 также описывает композиции, включающие ингибиторы тирозинкиназы и второе терапевтическое соединение, a WO 03/022815 раскрывает производные индолинона в качестве ингибиторов тирозинкиназы, которые действуют на рецептор, а также на нерецепторные тирозинкиназы и могут быть скомбинированы с дополнительными химиотерапевтическими агентами и с терапией с помощью радиации. Таким образом, целый ряд антагонистов протеин-тирозин-киназного рецептора в настоящее время прошли клинические испытания с целью лечения рака (см., например, Expert Opinion Review of LaidCherrington in Expert Opin. Invest. Drugs, т. 12,1, 2003, cc. 51-64). Однако требуемая эффективность этих субстанций при их применении индивидуально или в сочетании с другими формами терапии рака при лечении онкологических заболеваний пока не достигнута либо из-за отсутствия дополнительного действия по сравнению со стандартной терапией, либо из-за обнаружения неприемлемых побочных действий. Например, недавно опубликованы данные о том, что ингибитор ангиогенеза, который уже прошел клинические испытания, в том числе в сочетании с химиотерапией, а именно ингибитор SU5416, разработанный фирмой Pharmacia для лечения рака, обладает серьезным побочным действием, таким как случаи тромбоэмболии (Ken Garber и Ann Arbor, Nature Biotechnology, т. 20, ноябрь 2002, cc. 1067-1068). Для лечения заболеваний онкологической природы уже предложен целый ряд химиотерапевтических агентов, которые можно применять для монотерапии (лечение с помощью одного агента) или комбинированной терапии (одновременная, раздельная или последовательная обработка с использованием нескольких агентов) и/или которые можно объединять с радиотерапией или радиоиммунотерапией. В этом контексте химиотерапевтический агент представляет собой встречающееся в естественных условиях, полусинтетическое или синтетическое химическое соединение, которое само по себе или посредством дополнительной активации, например с помощью радиации в случае радиоиммунотерапии, ингибирует или уничтожает растущие клетки, и которое можно применять или которое может быть показано для применения при лечении заболеваний онкологической природы, также называемых различными формами рака. В литературе эти агенты, как правило, классифицируют на основе их механизма действия. В этом плане в качестве ссылки можно использовать, например, классификацию, предложенную в "Cancer Chemotherapeutic Agents", American Chemical Society, 1995, под ред. W. О. Foye. Так, в контексте настоящего изобретения наибольший интерес представляют следующие классы химиотерапевтических агентов (но, не ограничиваясь ими): синтетические низкомолекулярные антагонисты VEGF-рецептора; низкомолекулярные антагонисты рецептора фактора роста (GF); ингибиторы EGF-рецептора и/или VEGF-рецептора и/или рецепторов интегрина или любых других протеин-тирозин-киназных рецепторов, которые не классифицируют как синтетические низкомолекулярные соединения; ингибиторы EGF-рецептора и/или VEGF-рецептора и/или рецепторов интегрина или любых других протеин-тирозин-киназных рецепторов, которые представляют собой слитые белки; соединения, которые взаимодействуют с нуклеиновыми кислотами и которые классифицируют как алкилирующие агенты или производные платины; соединения, которые взаимодействуют с нуклеиновыми кислотами и которые классифицируют как антрациклины, интеркаляторы ДНК или перекрестносшивающие ДНК агенты; антиметаболиты; встречающиеся в естественных условиях, полусинтетические или синтетические антибиотики типа блеомицина (БЛМ-группа антибиотиков); ингибиторы ферментов, участвующих в транскрипции ДНК, прежде всего ингибиторы топоизомеразы I или топоизомеразы II; агенты, модифицирующие хроматин; ингибиторы митоза, антимитотические агенты или ингибиторы клеточного цикла; ингибиторы протеосомы; ферменты; гормоны, антагонисты гормонов или ингибиторы гормонов или ингибиторы биосинтеза стероидов; стероиды; цитокины, специфические для гипоксии цитотоксины, ингибиторы цитокинов, лимфокины, антитела к цитокинам или агенты, применяемые в оральных или парентеральных стратегиях индукции толерантности; поддерживающие агенты; химические агенты, сенсибилизирующие действие радиации и защищающие от нее; фотохимически активируемые лекарственные средства; синтетические поли- или олигонуклеотиды; другие химиотерапевтические или встречающиеся в естественных условиях, полусинтетические или синтетические терапевтические агенты, такие как цитотоксические антибиотики, антитела к поверхностным молекулам раковых клеток, ингибиторы металлопротеиназ, ингибиторы онкогенов, ингибиторы транскрипции генов или трансляции РНК, или экспрессии белков, или комплексы редкоземельных элементов. Для комбинированной терапии представляют интерес также другие классы соединений, которые пока еще не классифицируются в качестве химиотерапевтических агентов, представляющие собой встречающиеся в естественных условиях, полусинтетические или синтетические терапевтические агенты, такие как нестероидные противовоспалительные лекарственные средства, прежде всего ингибиторы циклооксигеназы (СОХ) и более конкретно ингибиторы СОХ-2. Даже с учетом того, что концепция совместного применения нескольких терапевтических агентов уже является известной, и различные типы комбинированной терапии уже находятся на стадии изучения и клинических опытов, до сих пор сохраняется необходимость в разработке новых и эффективных терапевтических агентов для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, и все еще сохраняется необходимость в разработке дополнительных комбинаций, которые могут повышать эффективность и снижать побочные действия. Эти заболевания могут иметь онкологическую природу и включать все типы злокачественных неоплазий или разных форм рака или иметь не онкологическую природу, например, представлять собой диабетическую ретинопатию, ревматоидный артрит или псориаз. Краткое изложение сущности изобретения При создании изобретения было установлено, что совместное введение индивидууму, который нуждается в таком лечении, эффективных количеств и/или использование комбинированной терапии для индивидуума, который нуждается в таком лечении, с использованием эффективных количеств:(II) по меньшей мере дополнительного химиотерапевтического или встречающегося в естественных условиях, полусинтетического или синтетического терапевтического агента; и/или в сочетании с(III) радиотерапией или радиоиммунотерапией,для индивидуума, который нуждается в лечении указанных опухолей, неожиданно обладает преимуществами при лечении с точки зрения высокой эффективности по сравнению с введением любой из этих субстанций индивидуально и/или с лечением с помощью радиотерапии или радиоиммунотерапии. При создании изобретения было установлено также, что совместное лечение, предлагаемое в настоящем изобретении, является особенно эффективным для ингибирования роста, выживания и метастазирования опухолей. Антагонист протеин-тирозин-киназного рецептора выбирают из обладающих специфичностью соединений. Из химиотерапевтических или встречающихся в естественных условиях, полусинтетических или синтетических терапевтических агентов предпочтительными являются обладающие специфичностью соединения. Заболевание, подлежащее лечению, предлагаемого в настоящем изобретении, предпочтительно представляет собой онкологическое заболевание. В предпочтительном варианте осуществления изобретения заболевание выбирают из плотных опухолей, таких как формы рака мочеполовой системы (например, рак предстательной железы, формы рака почки, рака мочевого пузыря), формы рака гинекологических органов (например, формы рака яичников, рака шейки матки, рака эндометрия), рак легкого, формы рака желудочно-кишечного тракта (например, колоректальные формы рака, рак поджелудочной железы,рак желудка, формы рака пищевода, печеночно-клеточный рак, холангиоцеллюлярные формы рака), рак головы и шеи, злокачественная мезотелиома, рак молочной железы, злокачественная меланома или саркомы костной и мягких тканей. В предпочтительном варианте осуществления изобретения болезнь представляет собой чувствительный к гормонам или резистентный к гормонам рак предстательной железы,карциному яичника или мелкоклеточный рак легкого. Таким образом, более высокая эффективность способов, предлагаемых в изобретении, прежде всего основана на аддитивном и синергетическом действии совместного лечения или на повышенной переносимости лечения пациентом, например из-за введения более низких доз применяемых терапевтических агентов. Неожиданные указанные выше преимущества могут являться также результатом более эффективной индукции апоптоза химиотерапевтическим агентом, поскольку опосредуемый опухолью конститутивно активный сигнал выживания протеин-тирозин-киназного рецептора ингибируется определенным антагонистом протеин-тирозин-киназного рецептора. В случае применения антагониста протеин-тирозин-киназных рецепторов или ингибитора других медиаторов, участвующих в ангиогенезе, таких как сосудистый эндотелиальный фактор роста (VEGF),факторы сосудистой проницаемости, основной фактор роста фибробластов (bFGF), интерлейкин (IL-6) или интерлейкин-8 (IL-8), эпидермальный фактор роста (EGF) или фактор роста, полученный из тромбоцитов (PDGF), преимущества способа и композиции, предлагаемых в настоящем изобретении, обусловлены целенаправленным лечением или только связанной с опухолью сосудистой сети органа, а не самой опухоли, или сочетанием такого лечения с лечением самой опухоли, для того, чтобы препятствовать обеспечению энергией опухолевых клеток. Другим преимуществом является индукция или восстановление чувствительности к химиотерапевтическому агенту, что ожидается у пациентов при лечении комбинацией, содержащей химиотерапевтические агенты, чувствительность к которым снижена в процессе лечения, и антагониста VEGFR. Это прежде всего касается пациентов, страдающих резистентной множественной миеломой, и лечения с использованием стероидов в качестве химиотерапевтического агента. Ожидается, что совместное лечение стероидами и антагонистом VEGFR должно восстанавливать чувствительность пациента, страдающего резистентной множественной миеломой к стероидам. Согласно настоящему изобретению подразумевается, что обладающий синергетическим действием комбинированный препарат содержит количество определенного антагониста протеин-тирозинкиназного рецептора или его полиморфа, метаболита или фармацевтически приемлемой соли этого действующего вещества и количество дополнительного химиотерапевтического или встречающегося в естественных условиях, полусинтетического или синтетического терапевтического агента, и/или применяется в сочетании с радиотерапией или радиоиммунотерапией, где количество самих индивидуальных терапевтических агентов недостаточно для достижения терапевтического действия, которое достигается при введения комбинации указанных терапевтических агентов, и где совместные действия указанных количеств терапевтических агентов превосходят сумму терапевтических действий, которые могут достигаться при использовании таких количеств индивидуальных терапевтических агентов. Другим объектом настоящего изобретения является также фармацевтическая комбинация для лечения указанных опухолей, которая содержит определенный антагонист протеин-тирозин-киназного рецептора и другой химиотерапевтический или встречающийся в естественных условиях, полусинтетический или синтетический терапевтический агент, и/или применяемая в сочетании с радиотерапией или радиоиммунотерапией, представляющая собой комбинированный препарат для одновременного, раздельного или последовательного применения для лечения заболеваний необязательно в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями и/или носителями. Еще одном объектом настоящего изобретения является также набор, представляющий собой фармацевтический комбинированный препарат для лечения указанных опухолей, который включает терапевтически эффективное количество определенного антагониста протеин-тирозин-киназного рецептора или его полиморфа, метаболита или фармацевтически приемлемой соли и терапевтически эффективное количество дополнительного химиотерапевтического или встречающегося в естественных условиях, полусинтетического или синтетического терапевтического агента, отличающийся тем, что антагонист протеин-тирозин-киназного рецептора находится в первом отсеке, а дополнительный химиотерапевтический или встречающийся в естественных условиях, полусинтетический или синтетический терапевтический агент находится во втором отсеке, так, чтобы было можно осуществлять одновременное, раздельное или последовательное введение пациенту, который нуждается в этом указанный набор, представляющий собой фармацевтический комбинированный препарат, необязательно адаптирован для совместного применения с радиотерапией или радиоиммунотерапией. Согласно одному из вариантов осуществления настоящего изобретения в каждом отсеке набора,представляющего собой фармацевтический комбинированный препарат, каждое действующее вещество находится в виде композиции, предназначенной для орального применения. Таким образом, еще одним объектом настоящего изобретения является применение селективного антагониста протеин-тирозин-киназного рецептора в сочетании с дополнительным химиотерапевтическим или встречающимся в естественных условиях, полусинтетическим или синтетическим терапевтическим агентом и/или адаптированного для совместного применения с радиотерапией или радиоиммунотерапией, для приготовления фармацевтического комбинированного препарата, который предназначен для лечения указанных выше заболеваний или показаний. В контексте настоящего изобретения эффективные количества терапевтических агентов и/или терапевтического лечения с применением радиотерапии или радиоиммунотерапии обозначают количества агентов и/или лечения с применением радиотерапии или радиоиммунотерапии, которые являются эффективными для достижения терапевтического действия при их совместном применении. Подробное описание изобретения Заболевания Как уже отмечалось выше, к заболеваниям, которые можно лечить с помощью комбинации, предлагаемой в настоящем изобретении, относятся все типы плотных опухолей, такие как формы рака мочеполовой системы (например рак предстательной железы, формы рака почки, рака мочевого пузыря), формы рака гинекологических органов (например, формы рака яичников, рака шейки матки, рака эндометрия),рак легкого, формы рака желудочно-кишечного тракта (например, формы колоректального рака, рак поджелудочной железы, рак желудка, формы рака пищевода, печеночно-клеточный рак, холангиоцеллюлярные формы рака), рак головы и шеи, злокачественная мезотелиома, рак молочной железы, злокачественная меланома или саркомы костной и мягких тканей. Согласно настоящему изобретению совместное лечение является особенно эффективным для ингибирования роста, выживания и метастазирования опухолей. Важным аспектом комбинированной терапии является лечение чувствительного к гормонам или резистентного к гормонам рака предстательной железы, рака яичника, немелкоклеточного рака легкого,мелкоклеточного рака легкого или множественной миеломы. Определенный антагонист протеин-тирозин-киназного рецептора Согласно настоящему изобретению селективный антагонист протеин-тирозин-киназного рецептора предпочтительно представляет собой антагонист по меньшей мере одного рецептора, выбранного изVEGFR1-3, PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR, c-Kit, и который кроме того представляет собой антагонист одного из представителей src-семейства тирозин-киназ и прежде всего src, lck,-4 021757lyn или fyn, или его полиморф, метаболит или фармацевтически приемлемую соль. Определенный антагонист протеин-тирозин-киназного рецептора может представлять собой также антагонист по меньшей мере одного комплекса зависящей от циклина киназы и специфического для нее циклина или вирусного циклина, такого как CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9 и специфические для них циклины А, В 1, В 2, С, D1, D2, D3, Е, F, G1, G2, Н, I и K, и/или также ингибитор паракриновой секреции IL-6. Согласно еще одному варианту осуществления настоящего изобретения комбинация активных субстанций предназначена для лечения онкологических заболеваний, включающих ангиогенез. Ангиогенез опухоли играет важную роль в развитии злокачественных заболеваний человека. Ингибирование этого процесса, по-видимому, является идеальной мишенью для терапевтического вмешательства при лечении рака. Было установлено, что трансдукция сигнала через рецептор 2 сосудистого эндотелиального фактора роста (VEGFR-2) играет основную роль в пролиферации, выживании и миграции эндотелиальных клеток при ангиогенезе опухоли. Для этой цели созданы эффективные низкомолекулярные антагонисты VEGFR-2, которые можно вводить оральным путем, представляющие собой новые соединения, которые можно применять для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, и прежде всего в качестве новых агентов для лечения рака. Эти антагонисты являются ингибиторами активности рецептора. Некоторые из этих антагонистов являются также антагонистами других рецепторов факторов роста, таких как VEGFR-3, PDGFR и , FGFR1, 2 и 3, EGFR, HER2,IGF1R, HGFR, c-Kit, и, кроме того, антагонистами представителей src-семейства тирозинкиназ, таких какsrc, Ick, lyn или fyn. Эти соединения описаны в WO 02/36564, WO 99/52869, WO 00/18734, WO 00/73297, WO 01/27080,WO 01/27081 и WO 01/32651. Приведенное ниже репрезентативное соединение является комбинированными ингибитором VEGR2 и Ick, которое применяется согласно настоящему изобретению в качестве определенного антагониста протеин-тирозин-киназного рецептора.(Z)-3-(1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинон; а также его фармацевтически приемлемые соли. Это соединение описано в WO 01/27081. Наиболее репрезентативным соединением является эффективное низкомолекулярное соединение,которое можно вводить оральным путем, и является антагонистом VEGFR1-3, PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR, c-Kit, и, кроме того, антагонистом представителей src-семейства тирозинкиназ и прежде всего src, lck, lyn или fyn, а также антагонистом комплекса зависящих от циклина киназ и специфических для них циклинов или вирусного циклина, а также ингибитором паракриновой секрецииIL-6, описанное, например в WO 01/27081, в качестве соединения 473, а также его фармацевтически приемлемые соли. Это соединение, обозначенное как (Ф) в приведенном выше перечне, представляет собой 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]6-метоксикарбонил-2-индолинон. При сравнении с другими приведенными соединениями указанное соединение является еще особенно предпочтительным из-за его высокой эффективности в качестве ингибитора и его более благоприятного токсикологического профиля. Особенно предпочтительной является соль моноэтансульфоновой кислоты этого соединения, т.е. моноэтансульфонат 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1 фенилметилен]-6-метоксикарбонил -2-индолинона, которая описана, например, в неопубликованной немецкой заявке DE 10233500.1, неопубликованной заявке РСТ/03/07822 и неопубликованной заявке на патент США 10/623971. Согласно данным, представленным в заявке DE 10233500.1, неопубликованной заявке РСТ/03/07822 и неопубликованной заявке на патент США 10/623971 моноэтансульфонат 3-Z-[1-(4-(N4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинона имеет следующее химическое строение: Соединение МЭС(Ф) (Моноэтансульфонат соединения (Ф Это соединение можно получать специально путем соответствующего выбора условий получения,предпочтительно в форме кристаллического полугидрата. Это соединение характеризуется температурой плавления t пл =3055C (при определении с помощью ДСК (дифференциальная сканирующая калориметрия) с использованием устройства типа MettlerToledo DSC82; скорость нагревания: 10 K/мин). Для получения моноэтансульфоната 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-Nметиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинона можно использовать следующий процесс. В качестве исходного продукта для получения моноэтансульфоната 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинона можно применять 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон в виде свободного основания, который можно получать с помощью метода, известного из прототипов, и описанного, например в WO 01/27081. При этом на первой стадии и согласно описанному в WO 01/27081 методу получают 3-Z-[1-(4-(N4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон следующим образом. 10,5 г (30,0 ммоль) 1-ацетил-3-(1-этокси-1-фенилметилен)-6-метоксикарбонил-2-индолинона (полученного согласно методу, описанному в WO 01/27081) и 8,60 г (33,0 ммоль) N-[(4-метилпиперазин-1 ил)метилкарбонил]-N-метил-пара-фенилендиамина (полученного согласно методу, описанному в WO 01/27081) растворяют в 80 мл диметилформамида и перемешивают в течение 1 ч при 80 С. После охлаждения добавляют 6,50 мл пиперидина и полученный продукт перемешивают в течение еще 2 ч при комнатной температуре. Добавляют воду, жидкость над образовавшимся остатком отсасывают и остаток промывают вновь небольшим количеством воды. Остаток суспендируют в 200 мл метанола, жидкость отсасывают и образовавшийся остаток промывают холодной водой и диэтиловым эфиром. Образовавшийся продукт сушат в вакууме при 110 С. Элементный анализ: На второй стадии согласно методу, описанному в DE 10233500.1, получают моноэтансульфонат 3Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинона с помощью следующего процесса. 605 г (1,12 ммоль) 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)1-фенилметилен]-6-метоксикарбонил-2-индолинона суспендируют в 9 л метанола и нагревают до 50 С. Добавляют 183,7 г (1,121 моля) 70%-ного водного раствора этансульфоната. Образовавшийся раствор охлаждают до 40 С и смешивают с 4,5 л метил-трет-бутилового эфира. Через несколько минут происходит кристаллизация. Для достижения полного осаждения продукт перемешивают в течение 16 ч при комнатной температуре. После охлаждения до 10 С жидкость отсасывают, осадок промывают 2 л метилтрет-бутилового эфира и сушат в вакууме при 40 С. Моноэтансульфонат 3-2-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино) анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинона очень легко можно растворять в физиологически приемлемых солюбилизаторах. Кроме того, соединение МЭС(Ф) обладает биологической доступностью при оральном введении мышам. Моноэтансульфонат 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил -2-индолинона ингибирует человеческий киназный рецепторVEGFR-2 (huVEGFR-2), при этом значение IC50 составляет 21 нМ, мышиный киназный рецепторVEGFR-2 (muVEGFR-2), значение IC50 составляет 13 нМ и пролиферацию стимулированных VEGF эндотелиальных клеток (клетки линии HUVEC (эндотелиальные клетки пупочной вены человека), IC50 = 9 нМ, клетки линии HSMEC, IC50 = 12 нМ). Кроме того, это соединение ингибирует также FGFR-1 и PDGFR, т.е. двух представителей семейства рецепторов с различными киназными доменами, которые играют важную роль в трансдукции сигналов ангиогенеза, при этом значение IC50 составляет 69 и 59 нМ соответственно. Таким образом, соединение МЭС(Ф) обладают высокой селективностью при тестировании в отношении панели многочисленных различных киназ, что видно из приведенной ниже табл. I Таблица I Следует отметить также, что этот специфический антагонист обладает продолжительным ингибирующим действием на рецептор VEGFR-2. На молекулярным и клеточном уровне установлено, что кратковременное воздействие соединения МЭС(Ф) на клетки (например эндотелиальные клетки) является достаточным для ингибирования активации самого киназного рецептора и расположенных за ним сигнальных молекул (например МАР-киназы, МАРК), а также клеточной пролиферации в течение по меньшей мере 32 ч. Результаты приведенного ниже эксперимента объясняют это продолжительное ингибирующее действие. Для оценки продолжительности ингибирования рецептора, индуцированного МЭС(Ф), осуществляли эксперименты с использованием "отмывки". Клетки линий HUVEC и NIH 3 Т 3 KDR подвергали воздействию МЭС(Ф) в течение ограниченного периода времени, МЭС(Ф) отмывали и пролиферацию клеток (HUVEC) или активацию/фосфорилирование VEGFR-2 анализировали по истечении различных периодов времени. Как видно из фиг. 1, автофосфорилирование VEGFR-2 блокируется в течение по меньшей мере 32 ч после 1-часовой экспозиции 50 нМ МЭС(Ф). После выдерживания клеток в течение 8,24 и 32 ч без обработки МЭС(Ф) их вновь стимулировали с помощью VEGF и анализировали активацию рецептора. Даже через 32 ч не было обнаружено никакой активации рецептора. Эти данные с большой долей вероятности позволяют предположить, что МЭС(Ф) обладает продолжительным действием на киназный рецептор, даже если концентрация МЭС(Ф) в плазме является очень низкой. Результаты приведенного ниже эксперимента с использованием ксенотрансплантации in vivo позволяют оценивать воздействие соединения МЭС(Ф) на опухолевые клетки. Для оценки этого воздействия бестимусным мышам, несущим подкожные опухоли линии FaDu (опухоли линии FaDu состоят из клеток человеческого плоскоклеточного рака), орально вводили соединение МЭС(Ф). Как видно из фиг. 2, когда мышей обрабатывали дважды в неделю дозой 100 мг/кг, было обнаружено снижение роста опухоли, которое характеризовалось значением О/К (опухоль/контроль), составляющим 31%. При возрастании дозы до 200 мг/кг при оральном введении дважды в неделю можно ожидать получения еще более высокого противоопухолевого действия. Эти результаты свидетельствуют о том, что указанный антагонист наиболее пригоден для последовательного совместного введения и/или совместной обработки в сочетании с другим химиотерапевтическим или встречающимся в естественных условиях, полусинтетическим или синтетическим терапевтическим агентом, и/или радиотерапией или радиоиммунотерапией. Схема применения этого антагониста может представлять собой, например, чередующееся введение согласно схеме: 1 день приема/1 день, в который не происходит приема (день пропуска), 1 день приема/2 дня пропуска, 1 неделя приема/1 неделя пропуска или даже 2 недели приема/2 недели пропуска. Таким образом, точно установлено, что моноэтансульфонат 3-Z-[1-(4-(N-4-метилпиперазин-1 ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил -2-индолинона является эффективным и пригодным для орального введения ингибитором киназного рецептора VEGFR-2 и противоопухолевым агентом. Согласно всем объектам изобретения к приемлемым определенным антагонистам протеин-тирозинкиназного рецептора относятся также обладающие активностью in vivo метаболиты определенного антагониста протеин-тирозин-киназного рецептора. Например, обладающим активностью in vivo метаболи-7 021757 том антагониста 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1 фенилметилен]-6-метоксикарбонил-2-индолинона может являться не превращенное в сложный эфир соединение 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-карбонил-2-индолинон. Дополнительный химиотерапевтический или встречающийся в естественных условиях, полусинтетический или синтетический терапевтический агент Эти соединения предпочтительно можно выбирать из следующих классов и примеров соединений. Низкомолекулярные антагонисты рецептора фактора роста (GF) Предпочтительным соединением из этого класса является производное хиназолина, описанное вWO 02/50043 в качестве репрезентативного соединения из примера 1(10), а именно 4-[(3-хлор-4 фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3 илокси]хиназолин, или его таутомеры, стереоизомеры и соли, прежде всего его физиологически приемлемые соли с неорганическими или органическими кислотами или основаниями. Наиболее предпочтительной является соль дималеиновой кислоты этого соединения, которую можно легко получать согласно следующему методу: 6,0 кг (12,35 моля) 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1 оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина нагревают до 70 С в 84 л этанола. Добавляют раствор, содержащий 2,94 кг (25,31 моля) малеиновой кислоты в 36 л этанола. После начала кристаллизации реакционную смесь охлаждают до 20 С и перемешивают в течение 2 ч. Реакционную смесь охлаждают до 0 С и перемешивают в течение 3 ч. Осадок подвергают вакуумной фильтрации. Осадок на фильтре промывают 19 л этанола и сушат под вакуумом при 40 С. Соединения, которые взаимодействуют с нуклеиновыми кислотами и которые классифицируют как алкилирующие агенты или производные платины Соединения, которые взаимодействуют с нуклеиновыми кислотами и которые классифицируют как алкилирующие агенты или производные платины, являются известными и описано их применение для лечения заболеваний онкологической природы. Репрезентативным примером является карбоплатин. Ингибиторы митоза, антимитотические агенты или ингибиторы клеточного цикла Представляющими интерес репрезентативными классами и соединениями являются противораковые лекарственные средства растительного происхождения, такие как таксаны (паклитаксел или таксол,доцетаксел или таксотер). Согласно другому предпочтительному варианту осуществления настоящего изобретения дополнительный химиотерапевтический или встречающийся в естественных условиях, полусинтетический или синтетический терапевтический агент выбирают из ряда, включающего противораковое лекарственное средство растительного происхождения, такое как паклитаксел (таксол), доцетаксел или таксотер, производное платины карбоплатин, производное хиназолина 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,Nдиметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран -3-илокси]хиназолин или его фармацевтически приемлемая соль. В следующем предпочтительном варианте осуществления настоящего изобретения еще один химиотерапевтический или встречающийся в естественных условиях полусинтетический или синтетический терапевтический агент выбирают из указанного выше производного хиназолина, описанного в WO 02/50043 в качестве репрезентативного соединения из примера 1(10), а именно 4-[(3-хлор-4-фторфенил) амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси]хиназолина, или его таутомеров, стереоизомеров и солей, прежде всего его физиологически и фармацевтически приемлемых солей с неорганическими или органическими кислотами или основаниями. Еще в одном предпочтительном варианте осуществления настоящего изобретения еще один химиотерапевтический или встречающийся в естественных условиях полусинтетический или синтетический терапевтический агент выбирают из дималеиновой соли 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,Nдиметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран -3-илокси]хиназолина или его таутомеров или стереоизомеров. Радиотерапия, радиоиммунотерапия или предварительная направленная радиоиммунотерапия Для лечения заболеваний онкологического происхождения применяют радиотерапию, радиоиммунотерапию или предварительную направленную радиоиммунотерапию. "Радиотерапия" или лучевая терапия обозначает лечение рака и других заболеваний с помощью ионизирующего излучения. Ионизирующее излучение приносит энергию, которая повреждает или разрушает клетки в обрабатываемой области (ткань-мишень) путем нарушения их генетического материала, что приводит к невозможности дальнейшего роста этих клеток. Радиотерапию можно применять для лечения локализованных плотных опухолей, таких как различные формы рака кожи, языка, гортани, головного мозга, молочной железы,легкого или шейки матки. Ее можно применять также для лечения лейкоза и лимфомы, т.е. рака кровообразующих клеток и лимфатической системы соответственно. Один из обычно применяемых типов радиотерапии основан на использовании фотонов, например рентгеновских лучей. В зависимости от количества энергии, которую они несут, лучи можно применять для разрушения раковых клеток, расположенных на поверхности или более глубоко в организме. Чем больше энергия пучка рентгеновских лучей,тем более глубоко рентгеновские лучи могут проникать в ткань-мишень. Линейные ускорители и бета-8 021757 троны представляют собой установки, которые создают рентгеновские лучи существенно большей энергии. Применение установок для фокусирования излучения (такого как рентгеновские лучи) в области опухоли называется радиотерапией с использованием внешнего пучка. Гамма-лучи представляют собой другую форму фотонов, которую применяют в радиотерапии. Гамма-лучи образуются спонтанно, когда определенные элементы (такие как радий, уран и кобальт 60) испускают излучение при своем разложении или распаде. Другой метод, позволяющий подвергать раковые клетки излучению, заключается в том,что радиоактивные имплантаты помещают непосредственно в полость опухоли или тела. Этот метод называется внутренней радиотерапией. Брахитерапия (близкофокусная рентгенотерапия), интерстициальное облучение и внутриполостное облучение представляют собой различные типы внутренней радиотерапии. При таком лечении доза облучения концентрируется в небольшой области и пациент находится в клинике в течение нескольких дней. Внутреннюю радиотерапию часто применяют при лечении рака языка, матки и шейки матки. Еще одним методом является интраоперационное облучение, при котором большую дозу излучения от внешнего источника направляют на опухоль и окружающую ткань в ходе хирургической операции. Следующий подход представляет собой радиотерапию с использованием пучка частиц. Этот тип терапии отличается от фотонной радиотерапии тем, что в нем для лечения локализованных типов рака используются быстро движущиеся субатомные частицы. Некоторые частицы (нейтроны, пионы и тяжелые ионы) приносят на своем пути при прохождении через ткань больше энергии,чем рентгеновские лучи или гамма-лучи, что вызывает большее повреждение тех клеток, которые они поражают. Этот тип излучения часто называют излучением с большим линейным переносом энергии(большой ЛПЭ). Использование радиочувствительных агентов позволяет с большей вероятностью осуществлять повреждение раковых клеток, а использование радиозащитных агентов позволяет защищать здоровые ткани от воздействий излучения. Для повышения чувствительности ткани к излучению можно применять также гипертермию, т.е. использование нагрева. В другом методе для доставки доз излучения непосредственно в пораженную раком область используют радиоактивномеченные антитела (радиоиммуннотерапия). Для связывания радиоизотопа с антителом существуют многочисленные методы, известные в данной области. Например, для введения радиоактивного йода можно применять метод, описанный в WO 93/05804. Другой метод заключается в использовании линкерной молекулы для связывания антитела и радиоизотопа, например MAG-3 (US 5082930, ЕР 0247866), MAG-2 GABA (US 5681927; ЕР 0284071) и N2S2 (фентиоат, US 4897255; US 5242679; ЕР 0188256). Еще одним методом является предварительная направленная радиоиммунотерапия, которую можно применять для минимизации токсичного действия излучения с помощью разделения антитела с продолжительным временем нахождения в кровотоке и радионуклида с быстрым клиренсом (Drugs of the future, 28 (2), 2003, cc. 167-173). Специалист в данной области легко может найти подробное описание протоколов для радиотерапии (Cancer Radiotherapy: Methods and Protocols (Methods in Molecular Medicine), под ред. Huddart R. А., изд-во Human Press,2002). Специалисту в данной области известно как определять соответствующие дозы и схему введения лекарственного средства в зависимости от природы заболевания и конституции пациента. В частности,специалисту в данной области известно как оценивать ограничивающую дозу токсичность (ОДТ) и как определять максимальную переносимую дозу (МПД) соответственно. Совместное введение и/или комбинированная терапия Подразумевается, что совместное введение селективного антагониста протеин-тирозин-киназного рецептора и дополнительного химиотерапевтического или встречающегося в естественных условиях полусинтетического или синтетического терапевтического агента; и/или совместное лечение с помощью радиотерапии или радиоиммунотерапии включает введение и/или последовательное по времени лечение или одновременное введение и/или лечение. Для последовательного введения и/или обработки определенный антагонист протеин-тирозин-киназного рецептора можно вводить до или после введения дополнительного химиотерапевтического или встречающегося в естественных условиях полусинтетического или синтетического терапевтического агента и/или до или после лечения с помощью радиотерапии или радиоиммунотерапии. Действующие вещества можно вводить орально, буккально, парентерально, с помощью спрея для ингаляции, ректально или местно, причем предпочтительным является оральное введение. Парентеральное введение может представлять собой подкожные, внутривенные, внутримышечные или интрастернальные инъекции и введения путем инфузии. Действующие вещества можно вводить орально с использованием широкого разнообразия различных форм лекарственного средства, т.е. их можно включать в сочетании с различными фармацевтически приемлемыми инертными носителями в состав лекарственных средств в виде таблеток, капсул, пастилок,лепешек, твердых конфет, порошков, спреев, водных суспензий, эликсиров, сиропов и т.п. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители. Кроме того, такие оральные фармацевтические композиции можно соответствующим образом подслащивать и/или придавать им приятный вкус с помощью различных агентов, которые обычно применяют для этих целей. В целом соединения, предлагаемые в настоящем изобретении, присутствуют в таких оральных формах лекарственного средства в концентрациях от примерно 0,5 до примерно 90 мас.% в пересчете на массу всей композиции, в количествах, достаточных для по-9 021757 лучения требуемых стандартных доз. Другими пригодными формами лекарственного средства для соединений, предлагаемых в настоящем изобретении, являются композиции и устройства с контролируемым высвобождением, хорошо известные специалистам, практикующим в данной области. Для орального введения можно применять таблетки, содержащие различные эксципиенты, такие как цитрат натрия, карбонат кальция и фосфат кальция, наряду с различными разрыхлителями, такими как крахмал, предпочтительно картофельный или маниоковый крахмал, альгиновая кислота и определенный силикатный комплекс, связующими агентами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, в качестве наполнителей в мягких и твердых желатиновых капсулах можно применять также замасливатели, такие как стеарат магния, лаурилсульфат натрия и тальк,или составы аналогичного типа; в том числе лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Если для орального введения требуются водные суспензии и/или эликсиры, то входящее в них основное действующее вещество можно объединять с различными подслащивающими веществами или корригентами, окрашивающими веществами или красителями и при необходимости с эмульгаторами и/или водой, этанолом, пропиленгликолем, глицерином и различными их комбинациями указанного типа. Для орального введения наиболее пригодной фармацевтической формой лекарственного средства,содержащей определенный антагонист протеинкиназного рецептора, предлагаемый в настоящем изобретении, являются мягкие желатиновые капсулы. Мягкие желатиновые капсулы, пригодные для капсулирования фармацевтических соединений, и метод их изготовления описаны, например, в патентах GB 395546, US 2720463, US 2870062, US 4829057 и в следующих публикациях: ANON, изд-во VerpackRundsch., том 21,1, январь 1970, cc. 136-138; Lachman и др., The Theory and Practice of Industrial Pharmacy,глава 13, изд-во LeaFebiger, 1970, Ebert, Soft Gelatine Capsules: An Unique Dosage Form, репринт изand Industrial Pharmacy, том 12 (8 и 9), 1986, cc. 1133-1144). Для целей парентерального введения можно применять растворы соединений в кунжутном или арахисовом масле или в водном пропиленгликоле, а также стерильные водные растворы соответствующих фармацевтически приемлемых солей. Такие водные растворы при необходимости удобно забуферивать и придавать изотоничность жидкому разбавителю с помощью достаточного количества физиологического раствора или глюкозы. Указанные водные растворы особенно пригодны для целей внутривенной, внутримышечной и подкожной инъекции. В этой связи следует отметить, что применяемые стерильные водные среды легко могут быть получены с помощью стандартных методов, хорошо известных специалистам в данной области. Например, в качестве жидкого разбавителя, как правило, применяют дистиллированную воду и конечный препарат пропускают через пригодный бактериальный фильтр, такой как фильтр из спекшегося стекла или диатомовая земля, или неглазированный фарфоровый фильтр. Предпочтительными фильтрами этого типа являются фильтр Беркефельда, Чамберленда и дисковый асбестметаллический фильтр Зейтца, через которые жидкость всасывают в стерильный контейнер с помощью вакуумного насоса. При приготовлении таких пригодных для инъекции растворов требуется осуществлять необходимые стадии для гарантии того, что конечные продукты получают в стерильных условиях. Для целей трансдермального введения форма лекарственного средства конкретного соединения или соединений может представлять собой, например растворы, лосьоны, мази, кремы, гели, суппозитории,композиции с пролонгированным высвобождением с ограниченной скоростью и устройства для них. Такие формы лекарственного средства содержат конкретное соединение или соединения и могут включать этанол, воду, усилитель проникновения и инертные носители, такие как желирующие агенты, минеральное масло, эмульгаторы, бензиловый спирт и т.п. Согласно одному из вариантов осуществления изобретения определенный антагонист протеинтирозин-киназного рецептора или его фармацевтически приемлемую соль можно вводить в такой суточной дозе, чтобы уровень действующего вещества в плазме составлял от 10 до 500 нг/мл в течение по меньшей мере 12 ч при 24-часовых интервалах между приемами лекарственного средства. Согласно одному из вариантов осуществления изобретения определенный антагонист протеинтирозин-киназного рецептора или его полиморф или фармацевтически приемлемую соль можно вводить в суточной дозе, составляющей от 2 до 20 мг/кг веса тела. Дополнительный химиотерапевтический или встречающийся в естественных условиях полусинтетический или синтетический терапевтический агент можно вводить, применяя пригодные формы лекарственного средства, уровни доз и устройства, хорошо известные специалистам в данной области. Как уже указано выше, специалист в данной области легко может найти подробные протоколы радиотерапии. Специалисту в данной области известно как определять соответствующие дозы и схему применения в зависимости от природы заболевания и конституции пациента. В частности, специалисту в данной области известно, как оценивать ограничивающую дозу токсичность (ОДТ) и как определять максимальную переносимую дозу (МПД) соответственно. Изучение комбинации in vitro и in vivo, демонстрирующее способность ингибировать пролиферацию и/или индуцировать апоптоз опухолевых клеток Приведенные ниже примеры комбинаций, экспериментов in vitro с использованием репрезентатив- 10021757 ных клеточных линий или экспериментов in vivo с использованием бестимусных мышей, несущих определенные опухоли демонстрируют способность комбинации, которая содержит определенный антагонист протеин-тирозин-киназного рецептора в сочетании с дополнительным химиотерапевтическим агентом, и/или применяется совместно с радиотерапией, ингибировать пролиферацию эндотелиальных или опухолевых клеток и/или индуцировать апоптоз опухолевых клеток. Таким образом, эти примеры служат для иллюстрации настоящего изобретения. Примеры комбинаций 1. Комбинация антагониста по меньшей мере одного из рецепторов, выбранных из VEGFR1-3,PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR или c-Kit, который является также антагонистом представителя src-семейства тирозинкиназ, или фармацевтически приемлемой соли, и бифункционального антагониста рецептора эпидермального фактора роста (EGF) и рецептора человеческого эпидермального фактора роста типа 2 (НЕ типа 2) для лечения рака предстательной железы, немелкоклеточного рака легкого или колоректального рака. Для оценки воздействия на снижение роста опухоли комбинированной терапии, основанной на применении субоптимальных доз антагониста по меньшей мере одного из рецепторов, выбранных изVEGFR1-3, PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR или c-Kit, который является также антагонистом представителя src-семейства тирозинкиназ, такого как дихлорид Z-3-[1-(4-(N-4 метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон (соединение обозначено как C12 (Ф, которое представляет собой дихлорид приведенного выше в качестве примера соединения (Ф), и бифункционального антагониста рецептора эпидермального фактора роста (EGF) и рецептора человеческого эпидермального фактора роста типа 2 (НЕ типа 2), такого как соединение 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен 1-ил]амино-7-S)-тетрагидрофуран-3-илокси]хиназолин (соединение обозначено как "ингибиторEGFR/HER2", и описано в WO 02/50043 в качестве репрезентативного соединения в примере 1 (10, в сравнении с монотерапией, основанной на применении таких же доз, проводили следующий эксперимент. Для этой цели бестимусным мышам (линия NMRI nu/nu) инъецировали подкожно клетки линииSKOV-3 (человеческая карцинома яичников). Мышей, несущих выявленные опухоли, случайным образом разделяли на контрольную и обрабатываемые группы (N = 10). Мышам в контрольной группе вводили только раствор носителя (0,5%-ный Natrosol), мышам второй группы ежедневно вводили оральным путем 15 мг/кг "ингибитора EGFR/HER2", третьей группе мышей ежедневно один раз в день вводили 50 мг/кг C12 (Ф), а четвертой группе мышей вводили комбинацию, содержащую 15 мг/кг "ингибитораEGFR/HER2" и 50 мг/кг C12 (Ф). Результаты этого эксперимента представлены на фиг. 3. Первоначально осуществляли ежедневное оральное введение в течение 31 дня. К этому моменту некоторые мыши из контрольной группы имели опухоли, размер которых превышал 2000 мм 3, и поэтому их умерщвляли. Рассчитанные значения (Т/С), обозначающие соотношение размеров опухолей в обрабатываемой и контрольной группе в этот момент времени составили 35% для группы, которую обрабатывали 15 мг/кг "ингибитора EGFR/HER2", 32% для группы, которую обрабатывали 50 мг/кг С 12 (Ф), и 13% для группы, которую обрабатывали комбинацией. Эти результаты ясно демонстрируют противоопухолевой действие комбинации ингибиторов VEGFR-2 и EGFR/HER2 in vivo. Кроме того, продолжение лечения до 64 дней выявило очень незначительный рост опухолей в группе, которую обрабатывали комбинацией, по сравнению с группой, которую обрабатывали одним из компонентов комбинации, в этой группе опухоли в конце концов выросли до размеров, сопоставимых с размерами опухолей в контрольной группе. На основе результатов этого эксперимента можно заключить, что комбинация соединений, действие которых направлено на различные механизмы, участвующие и важные для роста опухоли, таких как ингибитор VEGFR-2 C12 (Ф), который ингибирует ангиогенез опухоли, и бифункциональный ингибиторEGFR/HER-2, такой как "ингибитор EGFR/HER2", который ингибирует прохождение сигналов пролиферации через тирозинкиназный рецептор класса I, обладает синергетической противоопухолевой эффективностью. 2. Комбинация антагониста по меньшей мере одного из рецепторов, выбранных из VEGFR1-3,PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR или c-Kit, который является также антагонистом представителя src-семейства тирозинкиназ, или фармацевтически приемлемой соли (например соединения МЭС(Ф, и противоракового лекарственного средства растительного происхождения (например паклитаксела или таксола), предназначенная для лечения карциномы яичников, мелкоклеточного рака легкого или рака предстательной железы. 3. Комбинация антагониста по меньшей мере одного из рецепторов, выбранных из VEGFR1-3,PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR или c-Kit, который является также антагонистом представителя src-семейства тирозинкиназ, или фармацевтически приемлемой соли (например соединения МЭС(Ф, и противоракового лекарственного средства растительного происхождения (например таксотера), предназначенная для лечения рака предстательной железы. 4. Комбинация антагониста по меньшей мере одного из рецепторов, выбранных из VEGFR1-3,PDGFR и , FGFR1, 2 и 3, EGFR, HER2, IGF1R, HGFR или c-Kit, который является также антагонистом представителя src-семейства тирозинкиназ, или его полиморфа, метаболита, или фармацевтически приемлемой соли (соединения МЭС(Ф, и соединения платины (карбоплатина или цисплатина, предпочтительно карбоплатина) для лечения карциономы яичников или немелкоклеточного рака легкого. Важно отметить, что для лечения онкологических заболеваний рациональный подход с использованием совместной обработки, предлагаемой в настоящем изобретении, основан на том, что достигают терапевтическое преимущество при лечении больного раком пациента путем объединения обладающих специфическим и механическим действием молекул, которые обладают более широким спектром терапевтического действия в результате того, что благодаря применению комбинации клетки-мишени имеют меньше шансов выжить с помощью их возможных защитных механизмов; требуемые соответствующие дозы лекарственных средств могут быть уменьшены по сравнению с дозами, применяемыми в монотерапии, из-за аддитивного или синергетического действия комбинации; введение соответствующих лекарственных средств в виде комбинации снижает вероятность развития у опухолевых клеток резистентности к лекарственным средствам, приводит к более эффективной доставке определенных лекарственных средств к опухоли (снижение давления внутри опухоли) и может активировать другие пути гибели опухолевых клеток. Таким образом, можно ожидать, что, обеспечивая направленное действие на различные клеточные структуры и компартменты, комбинированная терапия, предлагаемая в настоящем изобретении, приводит к улучшению показателей выживаемости или времени до прогрессирующего развития опухолей у большего числа пациентов по сравнению с соответствующими вариантами монотерапии. В результате специфической антиангиогенной терапии, например с использованием соединения МЭС(Ф), опухоли,вероятно, должны обладать меньшей способностью к восстановлению от поражения, вызываемого общепринятой химиотерапией. Кроме того, в результате блокирования действий VEGF на проницаемость сосудов, по-видимому, должно происходить снижение интерстициального давления в опухолях, что обеспечивает более высокий уровень проникновения цитотоксических лекарственных средств. Поддерживающая терапия с использованием специфического антиангиогенного агента, такого, например, как соединение МЭС(Ф), после стандартной циторедукции, вероятно, также должна приводить к консолидации реакции, получаемой при цитотоксической терапии. Такой подход подтверждается доклиническими данными о том, что комбинации антиангиогенных соединений с цитотоксической терапией приводят к синергетической противоопухолевой активности. Описание чертежей На чертежах показано на фиг. 1 - ингибирование фосфорилирования VEGFR-2 после различных вариантов обработки соединением МЭС(Ф) клеток линии NIH3T3 KDR. На верхней панели показаны результаты анализа методом Вестерн-блоттинга при использовании в качестве зонда антитела, специфического для фосфорилированных остатков тирозина (-PY). На нижней панели показаны результаты анализа методом Вестернблоттинга при использовании в качестве зонда антитела, специфического для VEGFR-2 (-KDR); на фиг. 2 - данные о развитии объема опухолей у бестимусных мышей, несущих подкожные опухоли FaDu, без обработки (пунктирная линия), при оральном введении дважды в неделю дозы 50 мг/кг соединения МЭС(Ф) (черная линия) или при оральном введении дважды в неделю дозы 100 мг/кг соединения МЭС(Ф) (серая линия); на фиг. 3 - данные о развитии опухолей у бестимусных мышей, несущих подкожные опухоли рака яичника линии SKOV-3, без обработки (пунктирная линия), при оральном введении каждый день по 15 мг/кг "ингибитора EGFR/HER2" (треугольники), при оральном введении ежедневно по 50 мг/кг C12 (Ф)(квадраты) или при введении комбинации, содержащей 15 мг/кг "ингибитора EGFR/HER2" и 50 мг/кг(I) (Z)-3-(1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел, в форме комбинированного препарата для одновременного,отдельного или последовательного применения при лечении болезней, в которые вовлечены клеточная пролиферация, миграция или апоптоз миеломных клеток или ангиогенез. 2. Фармацевтическая комбинация по п.1, где (I) представляет собой моноэтансульфонат 3-Z-[1-(4(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбо- 12021757 нил-2-индолинон. 3. Фармацевтическая комбинация по п.1, где (II) выбран из группы, включающей дексаметазон или преднизолон. 4. Фармацевтическая комбинация по п.1, где (II) выбран из соединения платины карбоплатина. 5. Фармацевтическая комбинация по п.1, где (II) выбран из противоракового средства растительного происхождения паклитаксела или доцетаксела. 6. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении онкологических заболеваний. 7. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении злокачественных неоплазий. 8. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении плотных опухолей. 9. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении форм рака мочеполовой системы, рака легкого, форм рака желудочнокишечного тракта, рака головы и шеи, злокачественных мезотелиом, рака молочной железы, злокачественной миеломы или сарком костной и мягкой тканей. 10. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении гематологических неоплазий. 11. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении резистентной или находящейся на стадии рецидива множественной миеломы, острого или хронического миелогенного лейкоза, миелодиспластического синдрома или острого лимфобластного лейкоза. 12. Фармацевтическая комбинация по любому из пп.1-5, где комбинированный препарат предназначен для применения при лечении неонкологических заболеваний, таких как диабетическая ретинопатия, ревматоидный артрит или псориаз. 13. Набор фармацевтического комбинированного препарата для лечения болезней, в которые вовлечены клеточная пролиферация, миграция или апоптоз миеломных клеток или ангиогенез, включающий терапевтически эффективное количество:(I) (Z)-3-(1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел, отличающийся тем, что (I) находится в первом отсеке и (II) находится во втором отсеке таким образом, что их введение нуждающемуся пациенту можно осуществлять независимо, отдельно или последовательно. 14. Набор фармацевтического комбинированного препарата по п.13, где (I) представляет собой моноэтансульфонат 3-Z-[1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон. 15. Набор фармацевтического комбинированного препарата по п.13 или 14, где состав (I) предназначен для перорального введения. 16. Применение фармацевтической комбинации по любому из пп.1-12 или набора фармацевтического комбинированного препарата по любому из пп.13-15 для приготовления лекарственного средства для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, у человека или млекопитающего кроме человека. 17. Применение эффективного количества:(I) (Z)-3-(1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел,для приготовления фармацевтического комбинированного препарата для одновременного, раздельного или последовательного применения для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, у человека или млекопитающего кроме человека. 18. Применение по п.17, где (I) представляет собой моноэтансульфонат 3-Z-[1-(4-(N-4 метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2 индолинон. 19. Способ лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом, заключающийся в том, что одновременно, раздельно или последовательно вводят эффективное количество(I) (Z)-3-(1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)фениламино)-1-фенилметилен)-6-метоксикарбонил-2-индолинона, или его полиморфа, или фармацевтически приемлемой соли и(II) дополнительного химиотерапевтического агента или встречающегося в естественных условиях полусинтетического или синтетического агента, выбранного из группы, включающей стероиды дексаметазон или преднизолон, соединение платины карбоплатин, противораковое средство растительного происхождения паклитаксел или доцетаксел, в форме комбинированного препарата пациенту, нуждающемуся в таком лечении. 20. Способ по п.19, отличающийся тем, что (Z)-3-(1-(4-(N-4-метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен)-6-метоксикарбонил-2-индолинон, или его полиморф, или фармацевтически приемлемую соль вводят в такой суточной дозе, чтобы уровень в плазме действующего вещества составлял 10-500 нг/мл по меньшей мере в течение 12 ч при 24-часовых интервалах между введением доз.
МПК / Метки
МПК: A61K 31/337, A61P 35/00, A61K 31/496, A61K 31/282, A61K 31/573
Метки: способ, связанных, комбинации, апоптозом, лечения, содержащий, этих, клеточной, комбинаций, клеток, набор, ангиогенезом, миеломы, пролиферацией, миграцией, применение, фармацевтические, заболеваний
Код ссылки
<a href="https://eas.patents.su/15-21757-farmacevticheskie-kombinacii-soderzhashhijj-ih-nabor-primenenie-etih-kombinacijj-i-sposob-lecheniya-zabolevanijj-svyazannyh-s-kletochnojj-proliferaciejj-migraciejj-ili-apoptozom-kl.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические комбинации, содержащий их набор, применение этих комбинаций и способ лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом</a>
Предыдущий патент: Способ транспортирования, передачи и выгрузки порошкового химического состава
Следующий патент: Способ лечения болезни альцгеймера
Случайный патент: Строительный элемент для изготовления облицовок полов или стен