Новые циклобутаиндолкарбоксамидные производные, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4738
Опубликовано: 26.08.2004
Авторы: Гумен Бертран, Пеглион Жан-Луи, Куссак Дидье, Мийан Марк, Лежён Франсуа
Формула / Реферат
1. Соединения формулы (I)
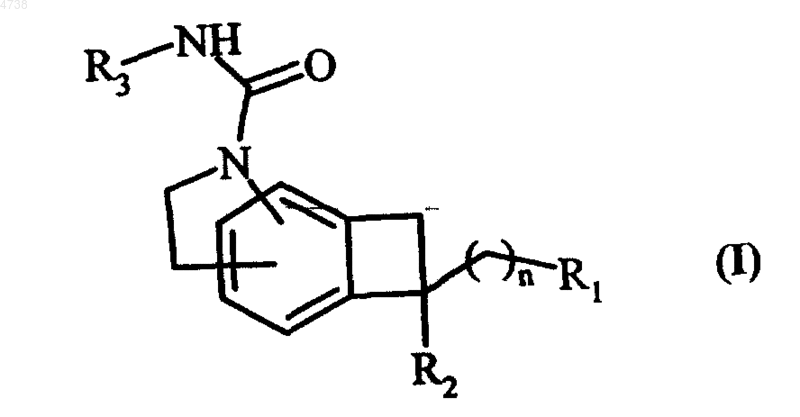
где n обозначает целое число от 0 до 6,
R1 обозначает группу, выбранную из ряда, включающего водород, гидрокси, циано и NR4R5, где R4 и R5, которые могут быть одинаковыми или различными, обозначают линейный или разветвленный C1-C6алкил,
R2 обозначает группу, выбранную из ряда, включающего водород или группу формулы
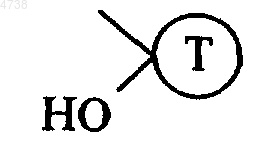
и
-U-V-W,
где T обозначает моноциклическую C3-C12циклоалкильную группу,
U обозначает связь,
V обозначает связь или группу S(O)q, где q равно 0, и
W обозначает группу, выбранную из ряда, включающего фенил и циклоалкил, и
R3 обозначает пиридил, необязательно замещенный одной или несколькими одинаковыми или различными группами, выбранными из ряда, включающего C1-C6алкил и пиридилокси, необязательно замещенный C1-C6алкилом,
их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием,
где циклоалкильная группа обозначает моноциклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем эти ненасыщенные группы не оказывают влияние на ароматическое строение указанной кольцевой системы.
2. Соединения формулы (I) по п.1, отличающиеся тем, что R2 обозначает атом водорода, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, отличающиеся тем, что R2 обозначает
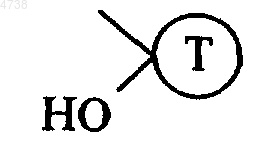
где T имеет значения, указанные для формулы (I), n равно 1 и R1 обозначает цианогруппу или аминогруппу, замещенную одним или двумя одинаковыми или различными, линейными или разветвленными C1-C6алкильными группами, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 0, R1 обозначает атом водорода или цианогруппу и R2 обозначает атом водорода, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 0, R1 обозначает атом водорода или цианогруппу и R2 обозначает группу формулы -U-V-W, где U обозначает простую связь, V обозначает группу формулы S(O)q, где q имеет значения, указанные для формулы (I), и W обозначает фенильную группу, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, представляющие собой
N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
5-циан-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
6-циан-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
6-(гидроксиметил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
5-(гидроксиметил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
7-циан-N-(3-пиридил)-1,2,6,7-тетрагидро-3H-циклобута[e]индол-3-карбоксамид,
7-(гидроксиметил)-N-(3-пиридил)-2,3,6,7-тетрагидро-1H-циклобута[g]индол-1-карбоксамид,
6-[(диметиламино)метил]-6-(1-гидроксициклогексил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
6-циан-(6-фенилсульфанил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
6-циан-6-циклогексил-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
6-циклогексил-N-(3-пиридил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
6-циан-N-{6-[(2-метил-3-пиридил)окси]-3-пиридил}-6-(фенилсульфанил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-1-карбоксамид,
их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Фармацевтическая композиция, предназначенная для лечения состояния тревоги, нарушений импульсивного контроля, нарушений познавательных способностей, психозов, депрессии и состояний, связанных с изменением поведения, включающая в качестве действующего вещества по меньшей мере одно соединение формулы (I) по любому из пп.1-6, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными экспициентами или носителями.
Текст
1 Настоящее изобретение относится к новым циклобутаиндолкарбоксамидным производным,способу их получения и содержащим их фармацевтическим композициям. Соединения по настоящему изобретению могут применяться для лечения нарушений центральной нервной системы, таких как состояние тревоги,приступы паники,обсессивнокомпульсивные состояния, фобии, нарушения импульсивного контроля, злоупотребление лекарственными средствами, нарушения познавательных способностей, психозы, депрессия и состояния, связанные с изменением настроения. Многочисленные полициклические и гетероциклические соединения, содержащие мочевинную функцию, описаны в литературе в качестве различных антагонистов серотонинергических рецепторов, что обусловливает возможность их применения для лечения заболеваний центральной нервной системы. Более конкретно следует упомянуть заявки на патент WO 95/29177, WO 96/23783 и WO 98/47868, а в заявке на патент US 5514690 описаны аминокарбонилхинолиновые и индолиновые производные и заявлена их способность активировать калиевые насосы. Помимо того, что они являются новыми,соединения по настоящему изобретению проявляют очень высокую активность при лечении нарушений центральной нервной системы, и более конкретно у них обнаружена очень высокая активность в конфликтном тесте Вогеля(Vogel), проведенном на крысах, и в тесте по закапыванию шариков, проведенном на мышах. Результаты, полученные в первом тесте, позволяют рекомендовать применение соединений по изобретению для лечения клинического нарушения, связанного с состоянием тревоги, а результаты, полученные во втором тесте, демонстрируют выраженный терапевтический потенциал соединений по изобретению в отношении лечения болезней, связанных с изменением поведения. Более конкретно, предметом настоящего изобретения являются соединения формулы (I) где n обозначает целое число от 0 до 6,R1 обозначает группу, выбранную из ряда,включающего водород, гидрокси, циано иNR4R5, где R4 и R5, которые могут быть одинаковыми или различными, обозначают линейный или разветвленный С 1-С 6 алкил,R2 обозначает группу, выбранную из ряда,включающего водород или группу формулы-U-V-W,где Т обозначает моноциклическую С 3-С 12 циклоалкильную группу,U обозначает связь,V обозначает связь или группу S(O)q, где q равно 0, иR3 обозначает пиридил, необязательно замещенный одной или несколькими одинаковыми или различными группами, выбранными из ряда, включающего С 1-C6 алкил и пиридилокси,необязательно замещенный C1-С 6 алкилом,их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием,где циклоалкильная группа обозначает моноциклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем эти ненасыщенные группы не оказывают влияние на ароматическое строение указанной кольцевой системы. Кроме того, были исследованы и другие соединения формулы (I), гдеn обозначает целое число от 0 до 6,R1 обозначает группу, выбранную из ряда,включающего водород, гидрокси, циано, линейный или разветвленный С 1-С 6 алкокси, линейный или разветвленный С 1-С 6 алкоксикарбонил,карбокси, аминокарбонил (аминогруппа необязательно замещена одной или двумя одинаковыми или различными группами, выбранными из ряда, включающего линейный или разветвленный С 1-С 6 алкил, арил и арилС 1-С 6 алкил, в котором алкильный фрагмент может быть линейным или разветвленным) и NR4R5, где R4 иR5, которые могут быть одинаковыми или различными, обозначают группу, выбранную из ряда, включающего линейный или разветвленный C1-С 6 алкил, арил, арилС 1-С 6 алкил, в котором алкильный фрагмент может быть линейным или разветвленным, гетероарил, гетероарилС 1 С 6 алкил, в котором алкильный фрагмент может быть линейным или разветвленным, циклоалкил, циклоалкилС 1-С 6 алкил, в котором алкильный фрагмент может быть линейным или разветвленным, линейный или разветвленный С 2 С 6 алкенил и линейный или разветвленный С 2 С 6 алкинил,R2 обозначает группу, выбранную из ряда,включающего водород, линейный или разветвленный C1-С 6 алкил, гидроксиметил, группу формулы и -U-V-W,где Т обозначает моноциклическую или полициклическую С 3-С 12 циклоалкильную группу, причем один из атомов углерода циклоалкила необязательно может быть замещен группой, 3 выбранной из ряда, включающего кислород,селен, группу формулы S(O)p, где р обозначает целое число от 0 до 2 включительно, группу формулы SiR6R7, где R6 и R7, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную С 1 С 6 алкильную группу,U обозначает связь или метиленовую группу,V обозначает связь, атом кислорода илиS(O)q, где q обозначает целое число от 0 до 2 включительно, иW обозначает группу, выбранную из ряда,включающего арил, арилC1-С 6 алкил, в котором алкильный фрагмент может быть линейным или разветвленным, пиклоалкил, циклоалкилС 1 С 6 алкил, в котором алкильный фрагмент может быть линейным или разветвленным, иR3 обозначает группу, выбранную из ряда,включающего водород, линейный или разветвленный С 1-С 6 алкил, арил и гетероарил,их изомерам, а также к аддитивным солям с фармацевтически приемлемой кислотой или основанием. Под понятием "арильная группа" подразумевают группу, выбранную из ряда, включающего фенил, бифенил, нафтил, дигидронафтил,тетрагидронафтил, инданил, инденил и бензоциклобутил, каждая из этих групп необязательно замещена одним или несколькими одинаковыми или различными группами, выбранными из ряда, включающего атомы галогена, линейный или разветвленный С 1-С 6 алкил, гидрокси,линейный или разветвленный C1-С 6 алкокси,нитро, циано, линейный или разветвленный С 1 С 6 тригалоалкил, амино, моноалкиламино, диС 1 С 6 алкиламино, в котором алкильные фрагменты могут быть линейными или разветвленными, С 1 С 6 тригалоалкокси, в котором алкоксигруппа может быть линейной или разветвленной,aминoC1-С 6 алкиламинокарбонил (где атомы азота каждой из аминогрупп необязательно могут быть замещены одинаковыми или различными линейными или разветвленными С 1 С 6 алкилильными группами), пиридил, пиридилокси и пиридилоксиметил, три последние группы необязательно могут быть замещены линейной или разветвленной С 1-С 6 алкильной группой. Под понятием "гетероарильная группа" подразумевают ароматическую моноциклическую систему или бициклическую систему, в которой одно из колец является ароматическим,а другое кольцо является ароматическим или частично гидрированным и включает от 5 до 12 кольцевых членов и содержит один, два или три одинаковых или различных гетероатом(ов), выбранных из кислорода, азота и серы, каждая из групп необязательно может быть замещена одной или несколькими одинаковыми или различными группами, выбранными из заместителей,указанных выше для арильной группы. 4 Под понятием "циклоалкильная группа" подразумевают моно- или полициклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем, эти ненасыщенные группы не оказывают влияние на ароматическое строение указанной кольцевой системы. Под изомерами подразумевают оптические изомеры (энантиомеры и диастереоизомеры). Из фармацевтически приемлемых кислот следует упомянуть (не ограничиваясь ими) соляную, бромисто-водородную, серную, фосфоновую, уксусную, трифторуксусную, молочную,пировиноградную, малоновую, янтарную, глутаровую, фумаровую, винную, малеиновую,лимонную, аскорбиновую, щавелевую, метансульфоновую, камфорную кислоту и т.д. Из фармацевтически приемлемых оснований следует упомянуть (не ограничиваясь ими) гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Согласно предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I), в которых R2 обозначает атом водорода. Согласно другому предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I), в которых R2 обозначает группу формулы(I), n равно 1 и R1 обозначает цианогруппу или аминогруппу, необязательно замещенную одним или двумя одинаковыми или различными группами, выбранными из ряда, включающего линейный или разветвленный С 1-С 6 алкил и арилС 1-С 6 алкил, где алкильный фрагмент может быть линейным или разветвленным. Согласно еще одному предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I), в которых n равно 0, R1 обозначает атом водорода или цианогруппу и R2 обозначает группу формулы -U-V-W, где U обозначает простую связь, V обозначает группу формулы S(O)p, где р имеет значения, указанные для формулы (I), и W обозначает арильную группу. Особенно предпочтительными соединениями по изобретению являются соединения формулы (I), в которых n равно 0, R1 обозначает атом водорода или цианогруппу и R2 обозначает атом водорода. Согласно изобретению заместитель R3 обозначает гетероарильную группу и более предпочтительно пиридильную группу. 5 Ниже указаны предпочтительные соединения по изобретениюN-(3-пиридил)-2,3,5,6-тетрагидро-1 Нциклобута[f]индол-1-карбоксамид,5-циан-N-(3-пиридил)-2,3,5,6-тетрагидро 1 Н-циклобута[f]индол-1-карбоксамид,6-циан-N-(3-пиридил)-2,3,5,6-тетрагидро 1 Н-циклобута[f]индол-1-карбоксамид,6-(гидроксиметил)-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,5-(гидроксиметил)-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,7-циан-N-(3-пиридил)-1,2,6,7-тетрагидро 3 Н-циклобута[е]индол-3-карбоксамид,7-(гидроксиметил)-N-(3-пиридил)-2,3,6,7 тетрагидро-1 Н-циклобута[g]индол-1-карбоксамид,6-[(диметиламино)метил]-6-(1-гидроксициклогексил)-N-(3-пиридил)-2,3,5,6-тетрагидро 1 Н-циклобута[f]индол-1-карбоксамид,6-циан-(6-фенилсульфанил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол 1-карбоксамид,6-циан-6-циклогексил-N-(3-пиридил)2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1 карбоксамид,6-циклогексил-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,6-циан-N-6-[(2-метил-3-пиридил)окси]-3 пиридил-6-(фенилсульфанил)-2,3,5,6-тетрагидро-1 Н- циклобута[f]индол-1-карбоксамид. Составной частью изобретения также являются изомеры предпочтительных соединений,а также аддитивные соли предпочтительных соединений с фармацевтически приемлемой кислотой или основанием. Изобретение также относится к способу получения соединений формулы (I), отличающемуся тем, что в нем в качестве исходного продукта применяют соединение формулы (II)C1-С 6 алкоксикарбонил,это соединение формулы (II) подвергают взаимодействию в условиях восстановительного аминирования с соединением формулы (III)(III) где А обозначает линейную или разветвленнуюC1-С 6 алкильную группу, с получением соединений формулы (IV) где А и R'1 имеют указанные выше значения,эти соединения формулы (IV) обрабатывают соединением формулы (V)(V) где Е обозначает линейную или разветвленную С 1-С 4 алкильную группу, фенил или паратолуил,с получением соединений формулы (VI) где А, Е и R'1 имеют указанные выше значения,эти соединения формулы (VI) циклизуют в кислотных условиях, с получением соединений формулы (VII) где Е и R'1 имеют указанные выше значения,эти соединения формулы (VII) обрабатывают либо гидроксидом щелочного металла в спиртовом растворителе, либо натрием в жидком аммиаке с получением соединений формулы (VIII) где R' 1 имеет указанные выше значения,эти соединения формулы (VIII) затем восстанавливают согласно общепринятым условиям органического синтеза с получением соединений формулы (IX) где R'1 имеет указанные выше значения,эти соединения формулы (IX) обрабатывают изоцианатом формулы (X)(I),с получением соединений формулы (I/а),которые являются частным случаем соединений формулы (I) где R' 1 и R3 имеют указанные выше значения,или те соединения формулы (IX), в которых R'1 обозначает цианогруппу, обрабатывают либо кетоном формулы (XI) 8 где R4 и R5 имеют значения, указанные для формулы (I), и Т и P1 имеют указанные выше значения, эти соединения формулы (XIV) после удаления защитной группы атома азота индолинового ядра обрабатывают соединением формулы (X) согласно описанному выше процессу с получением соединений формулы (I/с), которые являются частным случаем соединений формулы (I)(I), с получением соединений формулы (XII) где Т имеет указанные выше значения, эти соединения формулы (XII) затем либо обрабатывают изоцианатом формулы(X) согласно описанному выше процессу с получением соединений формулы (I/b), которые являются частным случаем соединений формулы (I) где Т и R3 имеют указанные выше значения,либо после защиты амина индолиновой группы восстанавливают согласно общепринятым методам органического синтеза с получением соединений формулы (XIII) где Т имеет указанные выше значения и Р 1 обозначает обычную защитную группу,затем первичную аминную функцию этих соединений формулы (XIII) замещают и превращают во вторичную, а затем в третичную аминную функцию, используя общепринятые методы органической химии, с получением соединений формулы (XIV) где Т, R4, R5 и R3 имеют указанные выше значения,либо сильным основанием или алкоголятом щелочного металла в присутствии соединения формулы (XV)(XV) где W1 обозначает линейную или разветвленную С 1-С 6 алкильную группу, арилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу или циклоалкилС 1 С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, и X обозначает уходящую группу, такую как атом галогена или трифтометилсульфонат, мезилат или тозилат, с получением соединений формулы (XVI) где W1 имеет указанные выше значения, эти соединения формулы (XVI) либо обрабатывают соединением формулы(X) согласно описанному выше процессу с получением соединений формулы (I/d), которые являются частным случаем соединений формулы (I) где W1 и R3 имеют указанные выше значения,либо после защиты атома азота индолинового ядра превращают аналогично соединениям формулы (XII) в первичный, вторичный, а затем в третичный амин с получением после удаления защитной группы и обработки в присутствии соединения формулы (X) согласно описанному ранее процессу соединений формулы (I/е), которые являются частным случаем соединений формулы (I) 10 получением после удаления защитной группы и обработки соединением формулы (X) согласно описанному ранее процессу соединений формулы (I/h), которые являются частным случаем соединений формулы (I) где W1, R3, R4 и R5 имеют указанные выше значения,либо бромом в хлорсодержащем органическом растворителе с получением соединений формулы (XVII) эти соединения формулы (XVII) подвергают взаимодействию с соединением формулы(I), и V1 обозначает атом кислорода или серы, с получением соединений формулы (XIX) где V1 и W имеют указанные выше значения,эти соединения формулы (XIX) либо обрабатывают соединением формулы(X) согласно описанному ранее процессу, с получением соединений формулы (I/f), которые являются частным случаем соединений формулы (I) где R3, V1 и W имеют указанные выше значения,эти соединения формулы (I/f) в случае, если V1 обозначает атом серы, могут быть подвергнуты окислению в общепринятых условиях органического синтеза с получением соединений формулы (I/g), которые являются частным случаем соединений формулы (I) где R3 и W имеют значения, указанные для формулы (I), и q1 обозначает целое число от 1 до 2 включительно,либо защищают и затем превращают, используя такую же последовательность реакций,что и в случае соединений формулы (XII), в первичный, вторичный и третичный амин, с где V1, W, R3, R4 и R5 имеют указанные выше значения, эти соединения формулы (I/h) в случае, если V1 обозначает атом серы, могут быть подвергнуты окислению в общепринятых условиях органического синтеза с получением соединений формулы (I/i), которые являются частным случаем соединений формулы (I) где W, R3, R4, R5 и q1 имеют указанные выше значения,либо с гидридом щелочного металла в диметилформамиде в присутствии формальдегида с получением соединений формулы (XX) эти соединения формулы (XX) либо обрабатывают соединением формулы(X) согласно описанному ранее способу, с получением соединений формулы (I/j), которые являются частным случаем соединений формулы(I),либо защищают на атоме азота индолинового ядра, затем обрабатывают в условиях реакции Митсунобу соединением формулы (XXI)(I),с получением после удаления защитной группы атома азота индолинового ядра соединений формулы (XXII) где W имеет указанные выше значения,эти соединения формулы (XXII) либо обрабатывают соединением формулы(X) согласно описанному ранее способу, с получением соединений формулы (I/k), которые являются частным случаем соединений формулы где R3 и W имеют указанные выше значения,либо защищают и затем превращают, используя такую же последовательность реакций,что и в случает соединений формулы (XII), в первичный, вторичный и третичный амин с получением после удаления защитной группы и обработки соединением формулы (X) согласно описанному ранее процессу соединений формулы (I/l), которые являются частным случаем соединений формулы (I) где R3, R4, R5 и W имеют указанные выше значения, эти соединения формул (I/а)-(I/l) представляют собой всю совокупность соединений по изобретению, и они могут быть очищены при необходимости с помощью общепринятого метода очистки, могут быть разделены при необходимости на различные изомеры с помощью общепринятого метода разделения и при необходимости превращены в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формул (II), (III), (V), (X),(XI), (XV), (XVIII) и (XXI) либо являются известными продуктами, либо представляют собой продукты, которые могут быть получены из известных соединений с помощью обычных методов органической химии. С точки зрения их фармакологических свойств соединения по настоящему изобретению могут применяться в качестве лекарственных средств для лечения состояния тревоги,приступов паники, обсессивно-компульсивных состояний, фобий, нарушений импульсивного контроля, злоупотребления лекарственными 12 средствами, нарушений познавательных способностей, психозов, депрессии и состояний,связанных с изменением поведения. Настоящее изобретение относится также к фармацевтическим композициям, включающим в качестве действующего вещества по меньшей мере одно соединение формулы (I), его оптический изомер или его аддитивную соль с фармацевтически приемлемой кислотой или основанием индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными, нетоксичными эксципиентами или носителями. Из фармацевтических композиций по изобретению, которые следует упомянуть, прежде всего следует отметить композиции, пригодные для перорального, парентерального (внутривенного, внутримышечного или подкожного), перили транскожного, назального, ректального,внутриязычного, глазного или респираторного введения, и прежде всего таблетки или драже,таблетки для сублингвального применения, желатиновые капсулы с мягким покрытием, желатиновые капсулы с твердым покрытием, суппозитории, кремы, мази, кожные гели, композиции для инъекций или для питья, аэрозоли, капли глазные или для носа и т.д. Приемлемая доза варьируется в зависимости от возраста и веса пациента, пути введения,природы и серьезности нарушения и применения возможных сопутствующих лечений и находится в диапазоне от 0,5 до 25 мг, и она может вводиться в виде одной или нескольких доз в день. Приведенные ниже примеры служат для иллюстрации изобретения и никоим образом не направлены на ограничение его объема. Применяемые исходные продукты являются известными или могут быть получены с использованием известных методов. Синтез промежуточных продуктов, предназначенных для получения соединений по изобретению, может быть осуществлен с помощью различных примеров получения. Строение описанных в примерах соединений определяли с помощью обычных спектрофотометрических методов (инфракрасная спектроскопия, ядерный магнитный резонанс, массспектрометрия и т.д.). Температуры плавления определяли с помощью нагревательной плиты Кофлера (К.) или с помощью нагревательной плиты, которую обследовали под микроскопом (М.К.). Когда соединение существует в форме соли, температура плавления соответствует температуре плавления соли. Только с информационной целью ниже приведена нумерация для трициклических систем. Пример получения 1. 2,3,5,6-Тетрагидро 1H-циклобута[f]индол-6-карбонитрил. Стадия 1. 5-[(2,2-Диметоксиэтил)амино] бензоциклобутан-1-карбонитрил. К суспензии, содержащей 13,5 г 5 аминобензоциклобутан-1-карбонитрила в 400 мл 1,2-дихлорэтана, быстро добавляют по каплям 26,5 мл 45%-ного раствора 2,2 диметоксиацетальдегида в метил-трет-бутиловом эфире, а затем 16 мл уксусной кислоты и после этого порциями 39,7 г триацетоксиборогидрида натрия. После повышения температуры до 29 С температуру реакционной смесь доводят до температуры окружающей среды, перемешивают в течение 1 ч 15 мин и затем подвергают гидролизу, сливая смесь на 500 мл насыщенного водного раствора NaHCO3. Органическую фазу удаляют, промывают водой и концентрируют при пониженном давлении, получая требуемый продукт. Стадия 2. 5-[N-(2,2-Диметоксиэтил)-N(метилсульфонил)амино]бензоциклобутан-1 карбонитрил. 10,8 мл мезилхлорида добавляют в течение 20 мин к охлажденному до 0 С раствору, содержащему 21,6 г продукта, полученного на стадии 1, 58 мл пиридина и 225 мл дихлорметана. После перемешивания в течение 40 мин при 0 С, а затем 20 ч при температуре окружающей среды реакционную смесь сливают на 150 мл насыщенного водного раствора NaHCO3. После сливания и двукратной экстракции, для которой каждый раз используют по 150 мл дихлорметана, объединенные органические фазы промывают 1 н. соляной кислотой, сушат, а затем концентрируют при пониженном давлении, получая ожидаемый продукт. Стадия 3. 1-(Метилсульфонил)-5,6 дигидро-1 Н-циклобута[f]индол-6-карбонитрил. В течение 1 ч 15 мин раствор, содержащий 10,9 мл хлорида титана в 450 мл толуола, и раствор, содержащий 27,9 мл продукта, полученного на стадии 2, в 450 мл толуола, одновременно сливают на 2 л толуола при температуре дефлегмации. После заверешения добавления температуре дают понизиться до 40 С и всю реакционную смесь сливают на 1,8 л насыщенного водного раствора NaHCO3. После сливания водную фазу экстрагируют толуолом и органические фазы объединяют, промывают, сушат и концентрируют. Остаток очищают хроматогра 004738 14 фией на силикагеле (дихлорметан/циклогексан: 75/25), выделяя ожидаемый продукт и его региоизомер.tпл: 142-144 С (М.К.) Стадия 4. 5,6-Дигидро-1 Н-циклобута[f]индол-6-карбонитрил. 2,6 г продукта, полученного на стадии 3,вносят в раствор, содержащий 7,7 г гидроксида калия в 190 мл метанола. После выдерживания в течение 12 ч при температуре дефлегмации метанол выпаривают и остаток растворяют в простом эфире. После промывки органическую фазу сушат и концентрируют, получая ожидаемый продукт.tпл: 126-128C (М.К.). Стадия 5. 2,3,5,6-Тетрагидро-1H-циклобута[f]индол-6-карбонитрил. 3,43 г продукта, полученного на стадии 4,растворяют в 55 мл уксусной кислоты. К реакционной смеси в течение 5 мин добавляют порциями 3,84 г цианборогидрида натрия, предварительно охлажденного до 13 С. После доведения до температуры окружающей среды реакционную смесь перемешивают в течение 2 ч, а затем охлаждают до 0 С и доводят значение рН до 11, добавляя раствор гидроксида натрия (45 г в 250 мл воды). Полученный мутный раствор экстрагируют простым эфиром. Органические фазы промывают, сушат и концентрируют, получая ожидаемый продукт.tпл: 85-87 С (М.К.). Пример получения 2. 2,3,6,7-Тетрагидро 1H-циклобута[е]индол-7-карбонитрил. Стадия 1. 6,7-Дигидро-3 Н-циклобута[е] индол-7-карбонитрил. Продукт получают согласно процессу,описанному на стадии 4 примера получения 1,используя в качестве субстрата региоизомер,полученный на стадии 3 примера получения 1. Стадия 2. 2,3,6,7-Тетрагидро-1 Н-циклобута[е]индол-7-карбонитрил. Используя в качестве исходного продукта соединение, полученное на стадии 1, продукт получают согласно процессу, описанному на стадии 5 примера получения 1. Пример получения 3. 2,3,5,6-Тетрагидро 1 Н-циклобута[f]индол. Стадия 1. 4-[(2,2-Диметоксиэтил)амино] бензоциклобутан. Раствор, содержащий 1 г продукта, полученного на стадии 1 примера получения 1, в 20 мл тетрагидрофурана и 0,22 мл безводного этанола, добавляют при -70 С к 40 мл жидкого аммиака. Затем добавляют порциями 322 мг натрия и перемешивают в течение 20 мин приNH4Cl и весь аммиак выпаривают. Реакционную смесь растворяют в насыщенном раствореNH4Cl и затем экстрагируют простым эфиром. Затем органическую фазу сушат и концентрируют, получая ожидаемый продукт.[f]индол. Продукт получают согласно процессу,описанному на стадиях 2-5 примера получения 1.tпл: 68-70C. Пример получения 4. 2,3,5,6-Тетрагидро 1H-циклобута[f]индол-6-илметанол. Стадия 1. Метил-5-амино-1-бензоциклобутанкарбоксилат. 9,74 г метил-5-нитро-1-бензоциклобутанкарбоксилата гидрируют в течение 6 ч 30 мин при температуре окружающей среды и атмосферном давлении в присутствии 10%-ногоPd/C. После фильтрации и концентрирования при пониженном давлении выделяют ожидаемый продукт. Стадия 2. Метил-5-[(2,2-диметоксиэтил) амино]-1-бензоциклобутанкарбоксилат. Используя в качестве исходного продукта соединение, полученное на предыдущей стадии,продукт получают согласно процессу, описанному на стадии 1 примера получения 1. Стадия 3. Метил-5-[N-(2,2-диметоксиэтил)-N-(метилсульфонил)амино]-1-бензоциклобутанкарбоксилат. Используя в качестве исходного продукта соединение, полученное на предыдущей стадии,продукт получают согласно процессу, описанному на стадии 2 примера получения 1. Стадия 4. Метил-1-(метилсульфонил)-5,6 дигидро-1 Н-циклобута[f]индол-6-карбоксилат. Используя в качестве исходного продукта соединение, полученное на предыдущей стадии,продукт получают согласно процессу, описанному на стадии 3 примера получения 1. Стадия 5.[1-(Метилсульфонил)-5,6 дигидро-1 Н-циклобута[f]индол-6-ил]метанол. Раствор, содержащий 1,6 г продукта, полученного на стадии 4, в 20 мл тетрагидрофурана,добавляют по каплям к суспензии, содержащей 0,42 г алюмогидрида лития в 7 мл тетрагидрофурана, поддерживая температуру смеси на уровне 0 С. Через 20 мин реакционную смесь гидролизуют, добавляя 0,3 мл воды, 0,23 мл 20%-ного раствора гидроксида натрия, а затем 1,05 мл воды. После удаления солей фильтрацией фильтрат концентрируют при пониженном давлении, получая ожидаемый продукт. Стадия 6. 5,6-Дигидро-1 Н-циклобута[f] индол-6-илметанол. Используя в качестве исходного продукта соединение, полученное на предыдущей стадии,продукт получают согласно процессу, описанному на стадии 4 примера получения 1. Стадия 7. 2,3,5,6-Тетрагидро-1 Н-циклобута[f]индол-6-илметанол. Используя в качестве исходного продукта соединение, полученное на предыдущей стадии,продукт получают согласно процессу, описанному на стадии 5 примера получения 1. Соеди 004738 16 нение выделяют хроматографией на силикагеле(дихлорметан/этанол: 97/3). Пример получения 5. 2,3,6,7-Тетрагидро 1 Н-циклобута[g]индол-7-илметанол. Стадия 1. 6-Ацетил-1-бензоциклобутанкарбонитрил. Раствор, содержащий 55,94 г 6-трифторацетил-1-бензоциклобутанкарбонитрила в 600 мл пиридина, продувают азотом в течение 15 мин, добавляют 30,5 мл триэтиламина, 117,44 мл простого бутилвинилового эфира, 2,25 г 1,3 бис(дифенилфосфин)пропана и 1,02 г ацетата палладия и реакционную смесь выдерживают при температуре дефлегмации в течение 2 ч. Затем по каплям в течение 1 ч добавляют 400 мл 1 н. соляной кислоты и после перемешивания в течение 3 ч при температуре окружающей среды реакционную смесь экстрагируют простым эфиром. Органические фазы промывают, сушат и концентрируют, получая остаток, который очищают хроматографией на силикагеле (дихлорметан: 100%), выделяя ожидаемый продукт.tпл: 55-59 С. Стадия 2. 6-Гидроксииминоэтил-1-бензоциклобутанкарбонитрил. 10,07 г продукта, полученного на стадии 1,и 6,13 г гидрохлорида гидроксиламина в 200 мл пиридина перемешивают при температуре окружающей среды в течение 19 ч. После удаления пиридина выпариванием полученное масло желтого цвета растворяют в дихлорметане и воде. Органическую фазу удаляют, сушат и концентрируют, выделяя ожидаемый продукт.tпл: 108-110 С. Стадия 3. N-(1-Цианбензоциклобутан-6 ил)ацетамид. 9,96 г РСl5 добавляют в виде четырех порцией к охлажденному до 0 С раствору, содержащему 8,9 г продукта, полученного на стадии 2, в 160 мл простого эфира. После перемешивания в течение 2 ч при 0 С температуру реакционной смеси доводят до температуры окружающей среды в течение 12 ч и затем сливают на смесь лед/вода и перемешивают в течение 20 мин. После сливания и экстрагирования простым эфиром объединенные органические фазы сушат и затем концентрируют при пониженном давлении, получая ожидаемый продукт.tпл: 50 С. Стадия 4. Этил-6-амино-1-бензоциклобутанкарбоксилат. При 0 С пропускают струю газообразного НСl до насыщения раствора, содержащего 5,04 г продукта, полученного на стадии 3, в 400 мл безводного этанола. Затем реакционную смесь выдерживают при температуре дефлегмации в течение 18 ч. После концентрирования растворителя остаток растворяют в ледяной воде,подщелачивают с помощью раствора карбоната натрия и экстрагируют дихлорметаном. Органичскую фазу удаляют, сушат и концентрируют, получая ожидаемый продукт.[g]индол-7-илметанол. Используя в качестве исходного продукта соединение, полученное на предыдущей стадии,продукт получают согласно процессу, описанному на стадиях 2 и 7 примера получения 4. Пример получения 6. 2,3,5,6-Тетрагидро 1H-циклобута[f]индол-5-карбонитрил. Продукт получают согласно процессу,описанному на стадиях 1-5 примера получения 1, используя в качестве субстрата полученный на стадии 1 4-амино-1-бензоциклобутанкарбонитрил.tпл: 103-107 С. Пример получения 7. 2,3,5,6-Тетрагидро 1H-циклобута[f]индол-5-илметанол. Продукт получают согласно процессу,описанному на стадиях 1-7 примера получения 4, используя в качестве субстрата полученный на стадии 1 этил-4-нитро-1-бензоциклобутанкарбоксилат. Пример получения 8. Никотиноилазид. К суспензии, содержащей 12,3 г никотиновой кислоты в 100 мл диметилформамида, добавляют 4,2 мл триэтиламина, а затем после охлаждения до 0 С 22 мл дифенилфосфорилазида в 50 мл диметилформамида. После перемешивания в течение 2 ч реакционную смесь сливают на лед. После экстракции простым эфиром органическую фазу промывают раствором NaHCO3, сушат и затем концентрируют,получая 9,68 г ожидаемого продукта. Пример получения 8. Фенил-6-[(2-метил-3 пиридил)окси]-3-пиридилкарбамат. Стадия 1. 6-[(2-Метил-3-пиридил)окси]-3 пиридиламин. Раствор, содержащий 14,35 г хлорида олова в 30 мл концентрированной соляной кислоты,добавляют к 5 г 2-(2-метилпирид-3-илокси)-5 нитропиридина и выдерживают при температуре дефлегмации в течение 1 ч. Реакционную смесь охлаждают и доводят рН до щелочного значения, добавляя концентрированный раствор гидроксида натрия. После удаления осадка фильтрацией водную фазу экстрагируют этилацетатом. После проведения обычной обработки выделяют ожидаемый продукт в виде порошка фиолетового цвета.tпл: 95-100 С (М.К.). Стадия 2. Фенил-6-[(2-метил-3-пиридил) окси]-3-пиридилкарбамат. 3 мл метилхлорформиата добавляют, поддерживая температуру на уровне -20 С, по каплям к раствору, содержащему 4,5 г продукта,полученного на стадии 1, 3,3 мл триэтиламина и 180 мл дихлорметана. После доведения температуры реакционной смеси до температуры окружающей среды ее промывают раствором бикарбоната натрия, сушат и концентрируют при пониженном давлении. Хроматографией остатка на силикагеле (дихлорметан/этанол/NH4 ОН: 98/2/0,29) выделяют ожидаемый продукт. 18 Пример 1. N-(3-Пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид. 7,4 г соединения, полученного в примере получения 8, в 40 мл толуола выдерживают при температуре дефлегмации в течение 2 ч 30 мин,затем охлаждают до температуры окружающей среды. Затем добавляют по каплям 0,99 г продукта, полученного в примере получения 3, растворенного в 50 мл дихлорметана. После перемешивания в течение 18 ч реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Хроматографией на силикагеле (дихлорметан/этанол: 95/5) выделяют ожидаемый продукт, который затем перекристаллизовывают из этанола.tпл: 178-180C (М.К.). Пример 2. 6-(Гидроксиметил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол 1-карбоксамид. Продукт согласно процессу, описанному в примере 1, используя в качестве субстрата соединение из примера получения 4.tпл: 195-200 С (М.К.). Пример 3. 6-Циан-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид. Продукт согласно процессу, описанному в примере 1, используя в качестве субстрата соединение из примера получения 1.tпл: 203-207 С (М.К.). Пример 4. 5-Циан-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид. Продукт согласно процессу, описанному в примере 1, используя в качестве субстрата соединение из примера получения 6.tпл: 209-211 С (М.К.). Пример 5. 5-(Гидроксиметил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол 1-карбоксамид. Продукт согласно процессу, описанному в примере 1, используя в качестве субстрата соединение из примера получения 7.tпл: 167-173C (М.К.). Пример 6. 7-Циан-N-(3-пиридил)-1,2,6,7 тетрагидро-3 Н-циклобута[е]индол-3-карбоксамид. Продукт согласно процессу, описанному в примере 1, используя в качестве субстрата соединение из примера получения 2.tпл: 203-205 С (М.К.). Пример 7. 7-(Гидроксиметил)-N-(3-пиридил)-2,3,6,7-тетрагидро-1 Н-циклобута[g]индол 1-карбоксамид. Продукт согласно процессу, описанному в примере 1, используя в качестве субстрата соединение из примера получения 5. 19 Стадия 1. 6-(1-Гидроксициклогексил)2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6 карбонитрил. 4,1 г продукта, полученного в примере получения 1, растворяют в 215 мл тетрагидрофурана. Реакционную смесь охлаждают до -80 С и добавляют с помощью шприца под давлением 19,25 мл 2,5 М раствора н-бутиллития в гексане. После завершения добавления смесь перемешивают в течение 20 мин, а затем на нее сливают 6,2 мл циклогексанона в течение 3 мин. После выдерживания в течение 2 ч при -80 С смеси дают нагреться до температуры окружающей среды и добавляют 23 мл насыщенного водного раствора хлорида аммония, а также 135 мл воды. После сливания органическую фазу промывают насыщенным раствором хлорида натрия,сушат и концентрируют. Полученный остаток отверждают с помощью простого изопропилового эфира и фильтруют, получая требуемый продукт, затем фильтрат очищают хроматографией на силикагеле (CH2Cl2/AcOEt: 90/10) с целью выделения дополнительного количества ожидаемого продукта.tпл: 168-170 С. Стадия 2. 6-(1-Гидроксициклогексил)-1(метилсульфонил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-6-карбонитрил. 4 г продукта, полученного на стадии 1,подвергают взаимодействию в условиях, описанных для стадии 2 примера получения 1. Стадия 3. 1-[6-(Аминометил)-1-(метилсульфонил)-2,3,5,6-тетрагидро-1H-циклобута[f] индол-6-ил]циклогексанол. 5,5 г продукта, полученного на стадии 2,растворяют в 250 мл 3,6 н. раствора аммиака в метаноле, содержащем 2 мг никеля Ренея. Реакционную смесь гидрируют в течение 24 ч при 60 С при давлении 30 бар. После фильтрации и удаления растворителя выпариванием остаток растворяют в дихлорметане, промывают водой до получения нейтрального значения рН, сушат и концентрируют, выделяя ожидаемый продукт. Стадия 4. 1-[6-[(Диметиламино)метил]-1(метилсульфонил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-ил]циклогексанол. 5,37 г амина, полученного на стадии 3,растворяют в 130 мл ацетонитрила. Смесь вносят в охлажденный до 0 С раствор, содержащий 2,9 г цианборогидрида натрия в 6,9 мл 37%-ного раствора формальдегида в воде, поддерживаяя температуру на уровне 0 С. После выдерживания реакционной смеси в течение 20 ч при температуре окружающей среды смесь гидролизуют с помощью 210 мл 1 н. соляной кислоты и затем перемешивают в течение 3 ч. Реакционную смесь промывают 30 мл простого эфира и затем подщелачивают, используя 20%-ный раствор гидроксида натрия. Водную фазу экстрагируют дихлорметаном. После сушки и упаривания остаток очищают хроматографией на сили 004738tпл: 156-158C (M.K.). Стадия 5. 1-6-[(Диметиламино)метил]2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-ил циклогексанол. 3,75 г продукта, полученного на стадии 4,в 100 мл тетрагидрофурана добавляют по каплям к 400 мл жидкого аммиака, охлажденного до -50 С. Порциями добавляют 0,56 г натрия и перемешивают в течение 15 мин. Реакцию прекращают, добавляя 2,65 г хлорида аммония. Смеси дают нагреться до температуры окружающей среды для выпаривания аммиака и затем растворяют в воде и экстрагируют простым эфиром. После сушки, упаривания и перекристаллизации из ацетонитрила получают ожидаемый продукт.tпл: 159-161 С (М.К.). Стадия 6. 6-[(Диметиламино)метил]-6-(1 гидроксициклогексил)-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид. Продукт получают согласно процессу,описанному в примере 1, используя в качестве субстрата продукт, полученный на стадии 5.tпл: 207-209 С (М.К.). Пример 9. 6-Циан-(6-фенилсульфанил)-N(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f] индол-1-карбоксамид. Стадия 1. 6-(Фенилсульфанил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбонитрил. 15 мл 1,6 н. раствора н-бутиллития в гексане добавляют в течение 30 мин к охлажденному до -70 С раствору, содержащему 2 г продукта,полученного в примере получения 1, растворенного в 40 мл тетрагидрофурана, а затем на него сливают 2,82 г дифенилсульфида, растворенного в 8 мл тетрагидрофурана. Температуру реакционной смеси медленно доводят до температуры окружающей среды. После проведения реакции в течение 2 ч смесь сливают на 1,2 л насыщенного раствора хлорида аммония и затем экстрагируют простым эфиром. Объединенные органические фазы очищают кислотно-щелочным обменом, выделяя ожидаемый продукт. Стадия 2. 6-Циан-(6-фенилсульфанил)-N(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f] индол-1-карбоксамид. 0,43 г продукта, полученного на стадии 1,обрабатывают 0,297 г соединения, полученного в примере получения 8, согласно процессу, описанному в примере 1, получая ожидаемый продукт. 21 15 мл 1,6 н. раствора н-бутиллития в гексане добавляют в течение 30 мин к охлажденному до -70 С раствору, содержащему 2 г продукта,полученного в примере получения 1, растворенного в 20 мл тетрагидрофурана. После проведения реакции в течение 30 мин в нее в течение 25 мин сливают 2,17 мл бромциклогексана и температуру реакционной смеси постепенно повышают до -20 С, а затем сливают на насыщенный раствор хлорида натрия и, наконец, экстрагируют простым эфиром. После очистки на силикагеле (дихлорметан/этилацетат: 95/5) получают ожидаемый продукт в виде масла. Стадия 2. 6-Циан-6-циклогексил-N-(3 пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f] индол-1-карбоксамид. 0,33 г продукта, полученного на стадии 1,обрабатывают 0,25 г соединения, полученного в примере получения 8, согласно процессу, описанному в примере 1, получая ожидаемый продукт.tпл: 224-227 С. Пример 11. 6-Циклогексил-N-(3-пиридил)2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1 карбоксамид. Стадия 1. 6-Циклогексил-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол. Раствор, содержащий 0,5 г продукта, полученного на стадии 1 примера 10, в 10 мл безводного тетрагидрофурана и 0,11 мл абсолютного этанола, сливают на 20 мл жидкого аммиака при температуре -78 С, а затем добавляют порциями 0,15 г натрия. После проведения реакции в течение 30 мин при указанной температуре реакционную смесь обрабатывают 0,83 г хлорида аммония. После удаления аммиака выпариванием остаток растворяют в насыщенном растворе хлорида аммония и экстрагируют простым эфиром, после чего эфирные фазы промывают, сушат и концентрируют, получая ожидаемый продукт. Стадия 2. 6-Циклогексил-N-(3-пиридил)2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1 карбоксамид. 0,43 г продукта, полученного на стадии 1,обрабатывают 0,36 г соединения, полученного в примере получения 8, согласно процессу, описанному в примере 1, получая ожидаемый продукт.tпл: 187-190 С (М.К.). Пример 12. 6-Циан-N-6-[(2-метил-3 пиридил)окси]-3-пиридил-6-(фенилсульфанил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол 1-карбоксамид. Смесь, содержащую 0,5 г продукта, полученного в примере 9, 0,6 г продукта, полученного в примере получения 9, 0,16 мл триэтиламина и 16 мл диметилформамида, выдерживают при 100 С в течение 1 ч. После удаления диметилформамида выпариванием остаток растворяют в 100 мл дихлорметана, промывают 10%-ным раствором гидроксида натрия и водой, а затем су 004738 22 шат и концентрируют при пониженном давлении, получая требуемый продукт после очистки на силикагеле (дихлорметан/этанол/NH4 ОН: 98/2/0,4) и перекристаллизации из ацетонитрила. Фармакологическое изучение соединений по изобретению Пример 13. Конфликтный тест Вогеля. Тест осуществляют с использованием самцов крыс линии Wistar (фирма IFFA-CREDO) весом 230-250 г, которых разделяют на группы по 4 особи в группе и содержат на подстилке из опилок в клетках в помещении для животных со свободным доступом к корму и воде для питья в течение 5 дней до начала эксперимента в следующих условиях: температура (211 С), влажность (605%) и 12-часовой дневной цикл (с 07:00 до 19:00 ч). В понедельник после доставки животных переносят в экспериментальную комнату, где они остаются до пятницы, т.е. до дня проведения теста. В течение 4 дней с понедельника по четверг включительно животные имеют доступ к воде для питья только в течение 1 ч в день (с 09:00 до 10:00 ч). За 1 день до теста в 15:00 ч животных изолируют в клетках с помощью решетки, где они не получают ни корма, ни воды для питья. Тест осуществляют в закрытой звуконепроницаемой и вентилируемой прозрачной пластиковой клетке. Дно клетки изготовлено из хромистой стали. Металлический кончик бутылки с водой для питья расположен на высоте 6 см над металлическим дном клетки. Дно клетки и кончик сосуда соединяют электрическим проводом с устройством, которое регистрирует количество лизаний животными кончика бутылки и контролирует подачу электрических разрядов. Устройство регулируют таким образом,чтобы животные получали электрический разряд (между кончиком бутылки и металлическим дном) через каждые 20 лизаний кончика бутылки. В день опыта животным делают инъекцию(контроль) или тестируемого продукта за 30 мин до помещения в опытную клетку. Эксперимент начинают сразу после того, как животные 20 раз полижут кончик бутылки, и они получают первый электрический разряд (продолжительность 0,5 с, интенсивность 0,300 мА). В течение 30 мин животные получают электрический разряд каждый раз после того, как они 20 раз полижут кончик бутылки. Результаты выражены в виде количества лизаний и разрядов, полученных животными в течение теста продолжительностью 3 мин. Сравнивают количество лизаний и разрядов обработанных животных и контрольных животных с помощью дисперсионного анализа с использованием критерия Дуннетта при р 0,05. Продукт, обладающий анксиолитическим дей 23 ствием, повышает количество лизаний и разрядов, полученных животными, по сравнению с контролем. Для информации, среднее количество лизаний испытывающими жажду животными при отсутствии"наказания" составляет 674,944,5 (N = 7) в течение 3 мин. Эффективность продукта выражают в виде минимальной эффективной дозы (МЭД), которая представляет собой наименьшую дозу, при которой обнаружено достоверное различие по сравнению с контролем. Эта доза для продукта из примера 1 составляет 2,5 мг/кг s.c. Результаты для продукта из примера 1 где n обозначает целое число от 0 до 6,R1 обозначает группу, выбранную из ряда,включающего водород, гидрокси, циано иNR4R5, где R4 и R5, которые могут быть одинаковыми или различными, обозначают линейный или разветвленный C1-С 6 алкил,R2 обозначает группу, выбранную из ряда,включающего водород или группу формулы Пример 14. Тест по закапыванию шариков мышами. Этот тест позволяет оценить способность фармакологических агентов ингибировать спонтанное поведение мышей по закапыванию шариков, ингибирование может быть предсказано,исходя из антидепрессантного и/или антиимпульсивного действия. Самцов мышей линииNMRI (фирма Iffa-Credo, l'Arbresle, Франция) весом 20-25 г в день эксперимента помещают по отдельности в садки из Макролона (30x18x19 см), содержащие подстилку из опилок толщиной 5 см и покрытые перфорированной пластиной из плексигласа. Двадцать четыре стеклянных шарика, раскрашенных под "тигровый глаз", равномерно распределяют на опилках в периферической части садка. После 30 минутного свободного эксперимента животных удаляют из садка и подсчитывают количество закопанных шариков. Для информации: значение МЭД (минимальная эффективная доза) продукта из примера 1 составляет 2,5 мг/кг s.c. Пример 15. Фармацевтическая композиция: таблетки. Состав для приготовления 1000 таблеток,каждая из которых содержит по 5 мг в качестве действующего вещества: Соединение из примера 1 5 г Гидроксипропилметилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 2 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)-U-V-W,где Т обозначает моноциклическую С 3 С 12 циклоалкильную группу,U обозначает связь,V обозначает связь или группу S(O)q, где q равно 0, иR3 обозначает пиридил, необязательно замещенный одной или несколькими одинаковыми или различными группами, выбранными из ряда, включающего С 1-С 6 алкил и пиридилокси,необязательно замещенный C1-С 6 алкилом,их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием,где циклоалкильная группа обозначает моноциклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем эти ненасыщенные группы не оказывают влияние на ароматическое строение указанной кольцевой системы. 2. Соединения формулы (I) по п.1, отличающиеся тем, что R2 обозначает атом водорода, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, отличающиеся тем, что R2 обозначает(I), n равно 1 и R1 обозначает цианогруппу или аминогруппу, замещенную одним или двумя одинаковыми или различными, линейными или разветвленными C1-С 6 алкильными группами, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 0, R1 обозначает атом водорода или цианогруппу и R2 обозначает атом водорода, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 0, R1 обозначает атом водорода или цианогруппу и R2 обозначает группу формулы -U-V-W, где U обозначает простую связь, V обозначает группу формулыS(O)q, где q имеет значения, указанные для формулы (I), и W обозначает фенильную группу, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, представляющие собойN-(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,5-циан-N-(3-пиридил)-2,3,5,6-тетрагидро 1 Н-циклобута[f]индол-1-карбоксамид,6-циан-N-(3-пиридил)-2,3,5,6-тетрагидро 1H-циклобута[f]индол-1-карбоксамид,6-(гидроксиметил)-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,5-(гидроксиметил)-N-(3-пиридил)-2,3,5,6 тетрагидро-1H-циклобута[f]индол-1-карбоксамид,7-циан-N-(3-пиридил)-1,2,6,7-тетрагидро 3 Н-циклобута[е]индол-3-карбоксамид,7-(гидроксиметил)-N-(3-пиридил)-2,3,6,7 тетрагидро-1 Н-циклобута[g]индол-1 карбоксамид, 26 6-[(диметиламино)метил]-6-(1-гидроксициклогексил)-N-(3-пиридил)-2,3,5,6-тетрагидро 1 Н-циклобута[f]индол-1-карбоксамид,6-циан-(6-фенилсульфанил)-N-(3-пиридил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол 1-карбоксамид,6-циан-6-циклогексил-N-(3-пиридил)2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1 карбоксамид,6-циклогексил-N-(3-пиридил)-2,3,5,6 тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,6-циан-N-6-[(2-метил-3-пиридил)окси]-3 пиридил-6-(фенилсульфанил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-1-карбоксамид,их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Фармацевтическая композиция, предназначенная для лечения состояния тревоги, нарушений импульсивного контроля, нарушений познавательных способностей, психозов, депрессии и состояний, связанных с изменением поведения, включающая в качестве действующего вещества по меньшей мере одно соединение формулы (I) по любому из пп.1-6, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными экспициентами или носителями.
МПК / Метки
МПК: A61P 25/24, C07D 401/04, A61K 31/404, C07D 209/70
Метки: фармацевтические, композиции, способ, содержащие, получения, производные, новые, циклобутаиндолкарбоксамидные
Код ссылки
<a href="https://eas.patents.su/14-4738-novye-ciklobutaindolkarboksamidnye-proizvodnye-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые циклобутаиндолкарбоксамидные производные, способ их получения и содержащие их фармацевтические композиции</a>


















