Способ получения ибодутанта (меn15596) и родственных промежуточных соединений
Номер патента: 19777
Опубликовано: 30.06.2014
Авторы: Джаннотти Данило, Бонаккорси Фабрицио, Феди Валентина
Формула / Реферат
1. Способ получения ибодутанта
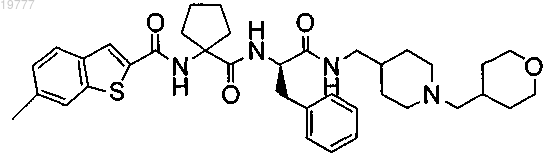
включающий:
а) получение промежуточного соединения (12)
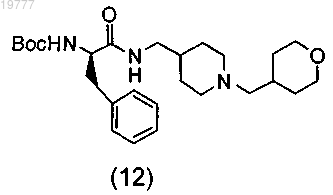
путем проведения следующих стадий:
а') защита первичного амина 4-аминометилпиперидина (2)
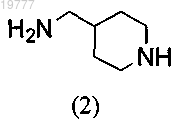
с использованием этилтрифторацетата с последующим восстановительным аминированием защищенного 4-аминометилпиперидина 4-формилтетрагидропираном и бораном и снятием защиты в щелочной среде с получением промежуточного диамина (11)
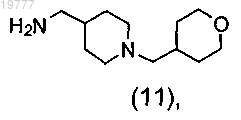
b') взаимодействие диамина (11) с Boc-D-Phe с получением промежуточного соединения (12);
или, альтернативно, путем проведения следующих стадий:
а") взаимодействие между 4-аминометилпиперидином (2)

и Boc-D-Phe(OSu) с получением промежуточного соединения (17)
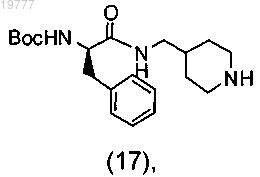
b") восстановительное аминирование соединения (17) 4-формилтетрагидропираном и бораном с получением промежуточного соединения (12);
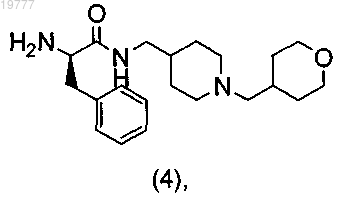
b) снятие защиты с промежуточного соединения (12) с получением соединения (4)
с) взаимодействие между соединением (4) и соединением (3)
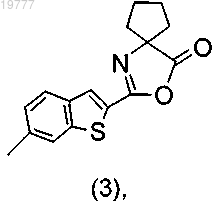
с получением конечного продукта.
2. Способ по п.1, где взаимодействие между соединениями (3) и (4) на стадии (с) проводят в этилацетате в качестве растворителя в течение периода времени от 10 до 30 ч.
3. Способ по п.1, где в реакциях восстановительного аминирования на стадиях (а') и (b") используют Na(OAc)3BH.
4. Способ по п.1, дополнительно включающий кристаллизацию ибодутанта в этаноле.
5. Способ по п.1, дополнительно включающий следующие стадии получения соединения (3):
а) активацию 6-метил-2-бензо[b]тиофенкарбоновой кислоты формулы (1)
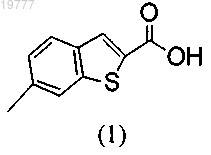
до соответствующего хлорангидрида;
b) взаимодействие между соединением (1) и 1-амин-альфа,альфа-циклопентанкарбоновой кислотой с получением промежуточного соединения (16)
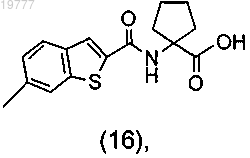
с) циклизацию соединения (16) в соответствующий оксазолон формулы (3).
6. Способ по п.5, дополнительно включающий получение 6-метил-2-бензо[b]тиофенкарбоновой кислоты (1) посредством каталитического гидродегалогенирования 3-хлор-6-метил-2-бензо[b]-тиофенкарбоновой кислоты (18)
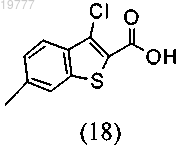
на Pd/C.
7. Способ по пп.1 и 5, где оксазолон формулы (3) получают из соединения (16) и сразу же, без выделения и очистки, подвергают взаимодействию с промежуточным соединением (4) с получением конечного продукта ибодутанта.
Текст
СПОСОБ ПОЛУЧЕНИЯ ИБОДУТАНТА (МЕN15596) И РОДСТВЕННЫХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ Изобретение относится к новому способу синтеза ибодутанта, состоящему из небольшого числа стадий с высоким выходом, включающему реагенты и растворители с низким воздействием на окружающую среду, характеризующемуся сочетанием двух составных частей, соединений(3) и (4), одно из которых, соединение (3), синтезируют путем сочетания 6-метил-2 бензо[b]тиофенкарбоновой кислоты (1) с 1-амино-альфа-альфа-циклопентанкарбоновой кислотой и последующей циклизации с оксазолоном, тогда как другое, соединение (4), получают из подходящего 4-аминометилпиперидина (2), функционализированного с высокой степенью селективности.(71)(73) Заявитель и патентовладелец: МАЛЕШИ ИСТИТУТО ФАРМАКОБИОЛОДЖИКО С.П.А Область изобретения Это изобретение относится к новому способу синтеза ибодутанта (MEN15596), представляющего собой продукт, который обладает антагонистической активностью в отношении тахикининовых рецепторов NK2. Указанный способ основан на высокоэффективном синтезе двух предшественников (3) и (4), проводимом с использованием способов и реагентов, подходящих для производства в промышленном масштабе. В частности, способ включает применение 4-аминометилпиперидина, который функционализирован с высокой степенью селективности только по первичному амину посредством ацилирования или только по вторичному амину посредством временного ацилирования и последующего алкилирования в условиях восстановительного аминирования. Такие подходы позволяют сократить общее число стадий при получении промежуточных соединений лучшего качества по сравнению с уже описанными. Кроме того, описанные здесь методики приводят к получению ключевых промежуточных соединений с гораздо более высокими выходами и, следовательно, обеспечивают способ синтеза, который в целом является гораздо более экономичным по сравнению с описанными ранее. Изобретение также включает альтернативный способ синтеза соединения (1) путем гидродегалогенирования соответствующего 3-хлор-производного в условиях Pd-катализируемого каталитического гидрирования. Предшествующий уровень техники[1-(2-Фенил-1(R)-[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоилэтилкарбамоил)циклопентил]амид 6-метилбензо[b]тиофен-2-карбоновой кислоты, известный как "ибодутант" (MEN 15596), представляет собой соединение с сильной антагонистической активностью в отношении тахикининовых рецепторов NK2 и может, таким образом, быть использован для изготовления фармацевтических композиций для лечения расстройств, в которые вовлечены тахикинины и, в частности, нейрокинин А. Указанное соединение и некоторые его промежуточные соединения раскрыты в публикации международной заявки WO 03037916. В частности, в примере 139 раскрыт синтез продукта согласно описанию, данному в примере 117 указанной публикации (схема 1). В указанном документе конечный продукт получают способами, известными специалисту в данной области техники, сначала путем последовательного присоединения Вос-циклолейцина (Boc означает трет-бутоксикарбонил) к промежуточному соединению (4), затем путем снятия Вос-защиты обычными способами и, наконец, путем ацилирования полученного таким образом промежуточного соединения(15) хлорангидридом промежуточного соединения (1). В указанной публикации промежуточное соединение 2-(R)-амино-3-фенил-N-[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]пропионамид (4) получают по следующей методике. Метиловый эфир 4-тетрагидропиранкарбоновой кислоты (5) гидролизуют до соединения (6) в щелочных условиях, затем превращают в соответствующий хлорангидрид (7) и подвергают взаимодействию с 4-карбэтоксипиперидином (8). Схема 1 Продукт присоединения (9) затем обрабатывают аммиаком с получением соответствующего первичного амида (10). Указанное диамидное промежуточное соединение проявляет заметное сродство к воде, и поэтому его трудно выделить экстракцией в органическом растворителе (см. WO 03037916, абзац 30, с. 45, где сообщается о 25 экстракциях хлороформом, и J. Med. Chem., 2007, 50, 4793-4807, с. 4806(синтез соединения 45), где сообщается о 18 экстракциях ДХМ (дихлорметаном) с получением выхода 70%). Две его амидные функциональные группы (первичную и третичную) одновременно восстанавливают путем обработки бораном (реагент, не подходящий для промышленного применения) в ТГФ (тетрагидрофуране) с получением соответствующего диамина. Диамин (11), полученный таким образом, подвергают взаимодействию с Boc-D-Phe-OSu и затем с продукта присоединения (12) снимают защиту стандартными способами с получением соединения (4). Таким образом, требуется не менее 7 стадий, чтобы получить ключевое промежуточное соединение (4) с помощью этой методики. Кроме того, в той же публикации описаны, в общей форме и конкретно в отношении отличных от ибодутанта соединений, способы, включающие применение оксазолоновых структур (WO 03037916, с. 14-15), подобных промежуточному соединению (3) по настоящему изобретению (чертеж). Дополнительный синтез рассматриваемого продукта описан в исследовании J. Med. Chem., 2007, 50,4793-4807 (схема 1), в котором в качестве существенного отличия от синтеза, описанного в вышеупомянутой публикации, указано, что амин (11) получают путем взаимодействия хлорангидрида (7) 4 тетрагидропиранкарбоновой кислоты непосредственно с изонипекотамидом (13) в присутствии триэтиламина в смешанном растворителе ДХМ/ДМФА и затем путем восстановления диамида (10) с использованием LiAlH4 в ТГФ. Указанная модификация снижает число стадий, необходимых для получения соединения (4), с 7 до 6, но все еще включает слишком много стадий синтеза, некоторые из которых проводят в растворителях, таких как ДМФА (диметилформамид), которые влекут за собой проблемы с токсичностью и утилизацией отходов, недопустимые при крупномасштабном производстве, и присутствие чрезвычайно опасных реагентов, таких как LiAlH4. Как известно специалисту в данной области техники,восстановление с использованием LiAlH4 также приводит в качестве побочного эффекта к образованию,которого невозможно избежать, продукта деалкилирования на уровне частичного восстановления третичного амида, который загрязняет промежуточное соединение (11) вследствие присутствия 4 аминометилпиперидина. Что касается способов получения 6-метил-2-бензо[b]тиофенкарбоновой кислоты (1), в исследовании J. Med. Chem., 2007, 50, 4793-4807 указан в качестве общей методики один из возможных способов синтеза, начинающийся с 2-фтор-4-метилбензальдегида, посредством обработки метилтиогликолятом в условиях реакции ароматического нуклеофильного замещения в щелочных условиях (CS2CO3, ДМСО(диметилсульфоксид, немного отличающихся от тех, о которых сообщается в литературе (J.R. Beck etal., J. Org. Chem., 1972, 37, 3224-3226, A.J. Bridges, Tetrahedron Lett., 1992, 33, 7499-7502). В первом из двух вышеупомянутых исследований описан синтез сложных эфиров 2-бензо[b]тиофенкарбоновой кислоты из 2-нитробензонитрилов или 2-нитробензальдегидов путем обработки метилтиогликолятом, KOH в ДМФА и метилтиогликолятом, K2CO3 и ДМФА соответственно с очень непостоянными выходами в зависимости от используемых субстратов. Во втором исследовании описан синтез сложных эфиров 2 бензо[b]тиофенкарбоновой кислоты из 2-фторбензальдегидов путем обработки метилтиогликолятом,триэтиламином или NaH в ДМСО, со столь же непостоянными температурами и выходами, в зависимости от используемых субстратов. Хотя промежуточное соединение (1) получают этим способом с высоким выходом и хорошего качества, способ не является надежным в случае незначительных сдвигов во времени и температуре или изменений в порядке, в котором добавляют реагенты, и эти факторы препятствуют его применению в крупном масштабе. Кроме того, что касается синтеза 6-метил-2-бензо[b]тиофенкарбоновой кислоты в литературе также описаны другие способы синтеза в качестве общих способов получения 2-бензо[b]тиофенкарбоновых кислот: a) J. Heterocyclic Chem., 1975, 12, 889-891 и J. Heterocyclic Chem., 1983, 20, 55-59, согласно которым соответствующим образом функционализированные бензальдегиды подвергают взаимодействию с роданином и гидролизуют в щелочных условиях с получением соответствующих меркаптокоричных кислот, которые подвергают циклизации до соответствующих бензо[b]тиофенов путем горячего окисления иодом в подходящем растворителе; б)WO 03106462 и Org. Proc. Res. Dev, 2006, 10, 296-303, согласно которым различным образом функционализированные 2-бензо[b]тиофенкарбоновые кислоты получают(путем карбоксилирования) из соответствующих бензотиофенов, которые получают из тиофенолов(функционализированных в мета- и пара-положении) путем алкилирования диэтилацеталем бромацетальдегида и последующей циклизации, например, полифосфорной кислотой в толуоле; эти способы синтеза также являются неудовлетворительными для промышленного применения. Гидрохлоридные соединения 2-карбоксибензо[b]тиофена в положении 3 известны в литературе, их получают, начиная с соответствующих коричных кислот, путем окисления тионилхлоридом в присутствии каталитических количеств основания, такого как пиридин (J. Org. Chem., 1975, 40, 3037-3045) илиDMAP (4-диметиламинопиридин) (WO 95/15323). Никаких исследований относительно возможности гидродегалогенирования этих карбоновых кислот (как таковых или в форме солей) для удаления хлора не было найдено; однако известны способы восстановления эфиров или амидов, которые часто включа-2 019777 ют особо жесткие условия (неприменимые в крупном масштабе), такие как применение Ni Ренея (для амидов, WO 9534551), палладиевой (Pd) черни в качестве катализатора или высокое давление водорода. Например, восстановление сложных эфиров 3-хлор-2-бензотиофенкарбоновой кислоты путем гидрирования с использованием Pd/C в присутствии оснований, таких как триэтиламин или AcONa, с очень низкими выходами описано в Helv. Chim. Acta, 1994, 77, 100-110. Исходя из анализа литературы, доступной на настоящий момент, синтез соединения ибодутанта,таким образом, все еще обнаруживает многочисленные проблемы. Следовательно, существует остро ощущаемая потребность в разработке нового способа синтеза, подходящего для промышленного применения. Краткое изложение сущности изобретения Заявитель на данный момент неожиданно обнаружил новый и более эффективный способ синтеза ибодутанта, который обобщен на схеме 2. В указанном способе устранены недостатки, уже описанные для ранее известных путей синтеза, а именно: 1) снижено большое количество стадий синтеза: промежуточное соединение (4) получают всего за 3 стадии (вместо 7 или 6), проводимые с высокими выходами, и, следовательно, достигнуто явное преимущество в экономичности всего процесса, который приводит к получению ибодутанта. Промежуточное соединение (12) получают с выходами от 95 до 80%, по сравнению с ранее описанным выходом 45%(см. J. Med. Chem., 2007, 50, 4793-4807). Полученный таким образом продукт также является лучшим с точки зрения качества; 2) ограничено применение растворителей, не оптимальных для промышленного синтеза, таких как ДМФА, который является тератогенным, высококипящим и смешивающимся с водой (дефлегмация), в пользу растворителей, которые являются безвредными, такие как изопропанол, низкокипящими, такие как ТГФ, и/или не смешивающимися с водой, такие как ДХМ или AcOEt (этилацетат); 3) исключена необходимость в применении чрезвычайно опасных гидридных восстановителей, таких как BH3 в ТГФ или LiAlH4, с заменой их, с целью получения соединения (12), на более удобныйNa(AcO)3BH в реакциях восстановительного аминирования; 4) исключен путь через диамидное промежуточное соединение (схема 1, соединение (10, которое является высокорастворимым в воде, и поэтому его трудно экстрагировать, выделять и анализировать; 5) в случае ацилирования диамина (11) также исключено применение Boc-D-Phe-OSu путем замены на соответствующую неактивированную аминокислоту и активирования in situ с использованием способов, хорошо известных специалисту в данной области техники, таких как изобутилхлорформиат или карбонилдиимидазол, что вызывает значительное снижение себестоимости, которое оказывает влияние на общую стоимость всего процесса производства данного активного ингредиента; Схема 2 6) неожиданно обнаружено, что 6-метил-2-бензо[b]тиофенкарбоновую кислоту (1) можно получить путем каталитического гидрирования непосредственно из соответствующей 3-хлорзамещенной кислоты(18) с высокими выходами и с использованием методик и реагентов, подходящих для производства в промышленном масштабе (схема 3); 7) и наконец, в результате проведенного таким образом конвергентного синтеза получают ибодутант с выходами, значительно превышающими выходы, полученные описанными ранее методиками (выход промежуточного соединения (12): способ согласно J. Med. Chem., 2007, 50, 4793-4807: 60%; способ,описанный по аналогии в WO 03037916: менее 55%; способ, к которому относится это изобретение: от 85 до 90%). Схема 3 Таким образом, настоящее изобретение относится к способу получения соединения ибодутанта,подходящему для промышленного применения, характеризующемуся сочетанием двух промежуточных соединений (3) и (4), где промежуточное соединение (3) получают из 6-метилбензотиофенкарбоновой кислоты и далее возможно выделяют и промежуточное соединение (4) получают путем снятия защиты с соединения (12), соответствующим образом получаемого из 4-аминометилпиперидина (2). Диамин (11) получают из 4-аминометилпиперидина (2) с использованием одностадийной методики путем избирательной защиты первичной аминной функциональной группы, восстановительного аминирования 4-тетрагидропиранальдегидом и гидролиза в щелочных условиях. Полученный таким образом диамин подвергают взаимодействию с соответствующим образом активированным Boc-D-Phe-OH с получением промежуточного соединения (12), с которого снимают защиту с получением промежуточного соединения (4). Альтернативно, соединение (4) может быть получено опять же из 4-аминометилпиперидина (2) путем избирательного ацилирования с использованием Boc-D-Phe-OSu с последующим восстановительным аминированием 4-тетрагидропиранальдегидом с получением промежуточного соединения (12), с которого снимают защиту с получением промежуточного соединения (4). Другим объектом настоящего изобретения является синтез соединения (1), начиная с 3-хлорбензотиофен-2-карбоновой кислоты (18), путем простого гидродегалогенирования, катализируемогоPd/C. Подробное описание изобретения Согласно настоящему изобретению соединение ибодутант получают способом, описанным на схеме 2, начиная с промежуточных соединений (3) и (4). Промежуточное соединение (4) получают из 4-аминометилпиперидина (2) предпочтительно согласно следующей методике: диамин (2) растворяют в растворителе, выбранном из ДХМ, EtOH, iPrOH (изопропанол), CH3CN, DME (диметоксиэтан) и диоксана, из которых предпочтительным является iPrOH,полученный раствор выдерживают при температуре от -20 до 20 С, предпочтительно от -10 до 5 С и даже более предпочтительно при 0 С и добавляют этилтрифторацетат (1-1,2 экв., предпочтительно 1,1 экв.). После завершения защиты добавляют 4-формилтетрагидропиран (1-1,7 экв., предпочтительно 1-1,2 экв.) и раствор разбавляют и затем нагревают с обратным холодильником для выпаривания этанола и части воды, присутствующих в качестве побочных продуктов ацилирования и конденсации между амином и альдегидом соответственно. Это предназначено для того, чтобы последующие операции по добавлению восстановителя и сокращению избытка восстановителя, необходимые для осуществления полного превращения, были более легко осуществимы. Затем к этому раствору порциями добавляют триацетоксиборгидрид натрия (NaBH(AcO)3, 1-2 экв., предпочтительно 1-1,2 экв.) при температуре от -20 до 60 С. Раствор затем доводят до температуры окружающей среды и по окончании алкилирования добавляют водный NaOH для нейтрализации восстановителя и гидролиза трифторацетамида до промежуточного соединения (11). Смесь нагревают с обратным холодильником и затем концентрируют. Промежуточное соединение (11) затем экстрагируют в ДХМ, и его можно выделить путем упаривания или предпочтительно использовать непосредственно на следующей стадии, возможно с одной стадией концентрации или обработкой с заменой растворителя. Для получения промежуточного соединения (12) достаточно провести взаимодействие активированной формы аминокислоты Boc-D-Phe-OH способами, известными специалисту в данной области техники, с промежуточным соединением (11), описанным выше. Методика, раскрытая в качестве примера,но без ограничения, включает суспендирование Boc-D-Phe-OSu в апротонном органическом растворителе, предпочтительно выбранном из ДХМ и ТГФ, и добавление его порциями при температуре от -10 до 30 С, предпочтительно от 10 до 20 С, в раствор промежуточного соединения (11), также растворенного в подходящем растворителе, предпочтительно выбранном из ДХМ и ТГФ. Альтернативно, Boc-D-Phe-OH может быть активирован опять же согласно способам, известным специалисту в данной области техники, с использованием изобутилхлорформиата (IBCF) в присутствии органического основания, выбранного из N-метилморфолина (NMM), диизопропилэтиламина (DIPEA) иNEt3 (триэтиламина), предпочтительно NMM, при температуре от 30 до 10 С, предпочтительно от -10 до 5 С и даже более предпочтительно от -5 до 0 С, в апротонном органическом растворителе, предпочти-4 019777 тельно выбранном из ДХМ и ТГФ, или с карбонилдиимидазолом (CDI) в тех же растворителях при температуре от -10 до 5 С, предпочтительно при 0 С. Промежуточное соединение (11), растворенное в ДХМ, добавляют к Вос-фенилаланину, активированному таким образом и растворенному предпочтительно в ДХМ; альтернативно, раствор активированной аминокислоты может быть добавлен к охлажденному раствору соединения (11). Согласно настоящему изобретению промежуточное соединение (12) может быть альтернативно получено путем взаимодействия 4-аминометилпиперидина (2), растворенного в ТГФ, с активированной аминокислотой, Boc-D-Phe-OSu, также суспендированной в ТГФ, при температуре от -20 до 10 С, предпочтительно от -5 до 0 С. В этих условиях неожиданно стало возможным ацилирование первичной аминной функциональной группы с высокой селективностью с получением главным образом промежуточного соединения (17), которое может быть выделено путем осаждения из смеси подходящих растворителей, в частности из смеси толуол/циклогексан, и превращено в производное (12) в условиях реакции восстановительного аминирования,как уже описано,путем взаимодействия с 4 формилтетрагидропираном и подходящим гидридным восстановителем, предпочтительно NaBH(OAc)3, в растворителе, предпочтительно выбранном из ДХМ (дихлорметана), ТГФ и CH3CN и даже более предпочтительно в ДХМ. Промежуточное соединение (12), полученное в соответствии со способами, описанными в настоящем изобретении, может быть кристаллизовано из метилэтилкетона, AcOR, iPrOH, MeOH, MeOH/H2O, 2 метилтетрагидрофурана, 1,2-диметоксиэтана и толуола; где R означает R1-R4-алкил с прямой или разветвленной цепью и предпочтительно выбранный из метила, этила, пропила, изопропила, бутила, вторбутила, трет-бутила; предпочтительно из AcOEt. Промежуточное соединение (4) предпочтительно получают путем снятия Вос-защиты в двухфазной смеси (Н 2 О/ДХМ) путем обработки HCl и последующей экстракции водной фазы, которую подщелачивают добавлением органического или неорганического основания и предпочтительно добавлением NaOH(32%), несмешивающимися органическими растворителями, предпочтительно ДХМ. Соединение (4) может быть кристаллизовано из растворителей, таких как метил-трет-бутиловый эфир, циклогексан, этилацетат и их смеси, из смесей гептан/AcOEt и предпочтительно из смесей циклогексан/этилацетат, предпочтительно в соотношении 6/1. Промежуточное соединение (3) получают из 6-метилбензотиофенкарбоновой кислоты (1). Карбоксильную функциональную группу активируют образованием соответствующего хлорангидрида с использованием способов, хорошо известных специалисту в данной области техники, включая в качестве примера, но без ограничения, обработку оксалилхлоридом и каталитическим количеством ДМФА в подходящем растворителе, предпочтительно толуоле. Указанный раствор активированного соединения добавляют к возможно охлажденному раствору циклолейцина, активированного посредством силилирования с использованием известных способов, таких как обработка бис-триметилсилил-ацетамидом (BSA). Продукт присоединения затем гидролизуют и выделяют путем экстракционной обработки. Карбоновую кислоту (16) конденсируют в соответствующий оксазолон (3) известными способами, включая, например,обработку гидрохлоридом этилдиметиламинопропилкарбодиимида (EDAC) и DIPEA в смеси ТГФ/CH3CN или обработку IBCF и NEt3, предпочтительно в ДХМ или EtOH. Соединение (3) может быть выделено или использовано без выделения непосредственно для взаимодействия с соединением (4). Два промежуточных соединения (3) и (4), полученных, как описано выше, подвергают взаимодействию в подходящем растворителе, выбранном из ДМФА и AcOR, где R означает R1-R5-алкил с прямой или разветвленной цепью, предпочтительно выбранный из метила, этила, пропила, изопропила, бутила,втор-бутила и трет-бутила; и даже более предпочтительно в AcOEt при температуре от 20 до 100 С и предпочтительно при температуре 76-78 С в течение периода времени от 10 до 30 ч. Соединение ибодутант получают таким способом с выходами от 70 до 90% на последней стадии. При необходимости соединение может быть перекристаллизовано из EtOH, EtOAc и их смесей или смесей EtOH и MEK (метилэтилкетон), предпочтительно EtOH. Настоящее изобретение также относится к способу получения промежуточного соединения (1) путем каталитического гидрирования 3-хлор-6-метилбензотиофенкарбоновой кислоты (18). Способ включает применение Pd/C катализатора, предпочтительно 5%, предпочтительно влажного, в смеси подходящих растворителей, которая обеспечивает, что реагент и продукт останутся в растворе, предпочтительно в смесях МеОН/Н 2 О, возможно при добавлении апротонного полярного растворителя, такого как ДМФА или ТГФ, и в присутствии органического или неорганического основания, предпочтительно гидроксида щелочного металла и даже более предпочтительно NaOH. Водород может быть вытеснен реагентом, известным специалисту как переносчик водорода, и предпочтительно формиатом аммония. Указанный способ позволяет получить промежуточное соединение (1) с превосходным выходом и чистотой за одну стадию из дешевого, имеющегося в продаже продукта с использованием реагентов, подходящих для промышленного производства. Примеры Пример 1. С-(1-(тетрагидропиран-4-илметил)пиперидин-4-ил)метиламин (11). 4-(Аминометил)пиперидин (2) (11,5 г) растворяют в изопропаноле и охлаждают до температуры от-10 до -5 С, затем порциями добавляют 15,5 г этилтрифторацетата, поддерживая внутреннюю температуру ниже 0 С. По окончании добавления реакционную смесь оставляют при перемешивании при 0 С в течение 1 ч. Затем быстро добавляют 11,6 г 4-формилтетрагидропирана и дополнительное количество изопропанола, все еще при 0-5 С. Реакционную смесь нагревают с обратным холодильником и затем часть растворителя отгоняют. После охлаждения до 10 С порциями добавляют 23,4 г триацетоксиборгидрида натрия, поддерживая температуру ниже 20 С. Реакционную смесь выдерживают при перемешивании при температуре окружающей среды в течение 2 ч, затем добавляют 52,2 г 32% раствора NaOH и 14 г воды. Реакционную смесь нагревают с обратным холодильником в течение 2 ч и упаривают при пониженном давлении, удаляя часть дистиллята. Смесь охлаждают до температуры окружающей среды и добавляют еще воду и метиленхлорид. После экстракции метиленхлоридом объединенные органические фазы промывают 2 М NaOH и частично упаривают при пониженном давлении. Раствор соединения (11), полученного таким образом (содержание соединения (11), эквивалентное теоретическому значению 21,4 г), обычно используют "в том виде как есть" при последующем получении соединения (12). Образец продукта (11), полученного упариванием досуха, охарактеризован, как изложено ниже.(m, 2 Н), 2.73-2.93 (m, 2 Н), 3.22-3.45 (m, 2 Н), 3.83-4.01 (m, 2 Н). Пример 2. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4-илметил)карбамоил)этил)карбаминовой кислоты (12) (способ А). 36,5 г Boc-D-Phe-OSu суспендируют в метиленхлориде (125 мл); суспензию перемешивают при температуре приблизительно 15 С и порциями добавляют дихлорметановый раствор продукта (11) (21,4 г), полученный, как описано в примере 1, поддерживая температуру ниже 20 С. После 2 ч перемешивания при температуре окружающей среды в реакционную смесь добавляют 8%-ный раствор NaOH. После 30 мин перемешивания и разделения фаз органическую фазу промывают водой (2) с получением дихлорметанового раствора, содержащего 43,4 г продукта (12). Чистота по ВЭЖХ (высокоэффективная жидкостная хроматография): 94,1%. Кристаллизация соединения (12). В неочищенном дихлорметановом растворе соединения (12) при атмосферном давлении проводят замену растворителя на этилацетат и продукт кристаллизуют из горячего этилацетата введением затравки. Суспензию, полученную охлаждением до температуры окружающей среды, охлаждают далее до 0 С в течение приблизительно 2 ч и фильтруют. Твердое вещество на фильтре промывают смесью растворителей этилацетат/МТВЕ (метил-трет-бутиловый эфир) 1:1 (об./об.). Твердое вещество затем сушат под вакуумом с получением 39,4 г соединения (12). Выход составляет 85,1% (исходя из 4 аминометилпиперидина). Чистота (ВЭЖХ): 100%. ВЭЖХ: колонка Zorbax Eclipse XDB-CN, 3,5 мкм, 1504,6 мм, подвижная фаза: предварительно полученный KH2PO4 20 мМ при рН 7/CH3CN: 62/38. Скорость потока: 1 мл/мин, детектор: УФ, =214 нм,объем вводимой пробы: 20 мкл, температура: 25 С; RT (время удерживания) соединения (12) составляет 13,8 мин. 1 Н-ЯМР (ДМСО-d6, 300 МГц):(млн-1) 1.02-1.79 (m, 12H), 1.31 (s, 9H), 2.07 (d, 2 Н), 2.74-2.78 (m,2 Н), 2.88-2.96 (m, 3 Н), 3.22-3.33 (m, 3 Н), 3.80-3.83 (m, 2 Н), 4.01-4.20 (m, 1 Н), 6.88 (dd, 1 Н), 7.18-7.26 (m,5 Н), 7.82 (уширенный синглет, 1 Н). Пример 3. (R)-трет-Бутил-1-оксо-3-фенил-1-(пиперидин-4-илметиламин)пропан-2-илкарбамат (17). 4-Аминометилпиперидин (2) (6,365 г) растворяют в тетрагидрофуране. Полученный раствор охлаждают до температуры от -5 до 0 С и порциями при перемешивании добавляют раствор, содержащий 10 гBoc-D-Phe-OSu в течение приблизительно 2,5 ч. Через 30 мин после завершения добавления, когда израсходование Boc-D-Phe-OSu подтверждено, температуре дают повыситься до температуры окружающей среды и добавляют толуол, промывая 10% водн. Na2CO3 (2). Затем проводят замену растворителя: при пониженном давлении часть толуола выпаривают, добавляют циклогексан (до соотношения толуол:циклогексан 2:3) и эту смесь охлаждают до 0 С в течение 2 ч. Полученную суспензию фильтруют и промывают циклогексаном и твердое вещество сушат в печи под вакуумом при 45 С с получением 9,18 г соединения (17). Выход 92,0%. Чистота по ВЭЖХ: 95,2%.MS:m/z: 191 (М+Н)+. Пример 4. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4-илметил)карбамоил)этил)карбаминовой кислоты (12) (способ В). Соединение (17) (8,50 г) растворяют в дихлорметане в слабом потоке азота и к полученному раствору при перемешивании при температуре окружающей среды добавляют 3,10 г 4-формилтетрагидропирана. Спустя приблизительно 15 мин порциями добавляют 6,21 г триацетоксиборгидрида натрия. Смесь выдерживают при перемешивании при температуре окружающей среды в течение ночи, затем к этой реакционной смеси при температуре окружающей среды добавляют раствор 4 М NaOH. После приблизительно 20 мин перемешивания органическую фазу отделяют и промывают водой (2). Затем при атмосферном давлении осуществляют замену растворителя на этилацетат, в этот раствор вводят затравку кристаллического соединения (12) и постепенно охлаждают в течение ночи. После охлаждения при 0 С в течение 2 ч суспензию фильтруют и промывают циклогексаном. Твердое вещество сушат с получением 9,55 г соединения (12). Выход 88,4%. Чистота по ВЭЖХ: 99,1%. 1 Н-ЯМР (ДМСО-d6, 300 МГц):(млн-1) 1.02-1.79 (m, 12 Н), 1.31 (s, 9H), 2.07 (d, 2 Н), 2.74-2.78 (m,2 Н), 2.88-2.96 (m, 3 Н), 3.22-3.33 (m, 3 Н), 3.80-3.83 (m, 2 Н), 4.01-4.20 (m, 1 Н), 6.88 (dd, 1 Н), 7.18-7.26 (m,5 Н), 7.82 (уширенный синглет, 1 Н). Пример 5. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4 илметил)карбамоил)этил)карбаминовой кислоты) (12) (способ С). Раствор 10 г Boc-D-Phe-OH, 4,6 мл N-метилморфолина и 80 мл дихлорметана охлаждают до температуры от -5 до 0 С и в него по каплям вводят раствор 5,4 мл изобутилхлорформиата в 20 мл ДХМ с такой скоростью, чтобы внутренняя температура не превышала 5 С. Реакционную смесь выдерживают при перемешивании при 0 С в течение 1,5 ч. Затем добавляют раствор 8,7 г соединения (11) в 20 мл дихлорметана с такой скоростью, чтобы внутренняя температура не превышала 5 С. Полученный раствор оставляют при перемешивании в течение приблизительно 1 ч при 0 С и приблизительно 2 ч при температуре окружающей среды. К этой реакционной смеси добавляют 100 мл 1 М NaOH и две фазы разделяют после перемешивания. Органическую фазу промывают Н 2 О (2) и после замены растворителя на этилацетат при пониженном давлении соединение (12) выделяют и очищают кристаллизацией из этилацетата с получением 14,44 г белого твердого вещества. Выход 84%. Чистота по ВЭЖХ: 98%. Пример 6. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4 илметил)карбамоил)этил)карбаминовой кислоты (12) (способ D). Раствор, состоящий из 10 г Boc-D-Phe-OH, 40 мл дихлорметана и 4,6 мл N-метилморфолина, медленно по каплям вводят в раствор 5,4 мл изобутилхлорформиата в 60 мл дихлорметана, охлажденного до 0 С, с такой скоростью, чтобы внутренняя температура не превышала 5 С. Полученную смесь выдерживают при перемешивании при 0 С в течение 1 ч. Раствор, состоящий из 8,0 г соединения (11) в 20 мл дихлорметана, вводят по каплям в реакционную смесь с такой скоростью, чтобы температура не превышала 5 С. Раствор выдерживают при перемешивании при 0 С в течение 1 ч и при температуре окружающей среды в течение 5 ч. После проверки процесса к этой смеси добавляют 100 мл 1 М NaOH, две фазы разделяют, органическую фазу промывают водой (2) и после замены растворителя на этилацетат при пониженном давлении соединение (12) кристаллизуют из этилацетата с получением 14,29 г белого твердого вещества. Выход 83%. Чистота по ВЭЖХ: 98%. Пример 7. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4 илметил)карбамоил)этил)карбаминовой кислоты (12) (способ Е). Раствор, состоящий из 10 г Boc-D-Phe-OH, 40 мл тетрагидрофурана и 4,6 мл N-метилморфолина,медленно вводят по каплям в раствор 5,4 мл изобутилхлорформиата в 60 мл тетрагидрофурана, охлажденного до 0 С, с такой скоростью, чтобы внутренняя температура не превышала 5 С. Полученную смесь выдерживают при перемешивании при 0 С в течение 0,5 ч. Раствор, состоящий из 8,0 г соединения(11) в 20 мл тетрагидрофурана, затем вводят по каплям в реакционную смесь с такой скоростью, чтобы температура не превышала 5 С. Раствор выдерживают при перемешивании при 0 С в течение 1 ч и при температуре окружающей среды в течение 5 ч. К этой смеси добавляют 100 мл 1 М NaOH и тетрагидрофуран выпаривают при пониженном давлении. В остаток добавляют дихлорметан и воду; органическую фазу промывают водой (2) и после замены растворителя на этилацетат при пониженном давлении соединение (12) кристаллизуют из этилацетата с получением 15 г белого твердого вещества. Выход 87%. Чистота по ВЭЖХ: 97%. Пример 8. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4 илметил)карбамоил)этил)карбаминовой кислоты (12) (способ F). 6,7 г карбонилдиимидазола добавляют в раствор 10 г Boc-D-Phe-OH в 80 мл дихлорметана, охлажденного до 0 С. Полученный раствор выдерживают при перемешивании при 0 С в течение 1 ч. Раствор,состоящий из 8,0 г соединения (11) в 20 мл дихлорметана, затем вводят по каплям в реакционную смесь с такой скоростью, чтобы температура не превышала 5 С. Раствор выдерживают при перемешивании при 0 С в течение 1 ч и при температуре окружающей среды в течение 2 ч. К этой смеси добавляют 100 мл 1 М NaOH, две фазы разделяют, органическую фазу промывают водой (2) и после замены растворителя на этилацетат при пониженном давлении соединение (12) кристаллизуют из этилацетата с получением 14,64 г белого твердого вещества. Выход 85%. Чистота по ВЭЖХ: 98%. Пример 9. трет-Бутиловый эфир (2-фенил-1-(R)-1-(тетрагидропиран-4-илметил)пиперидин-4 илметил)карбамоил)этил)карбаминовой кислоты (12) (способ G). 6,7 г карбонилдиимидазола добавляют в раствор 10 г Boc-D-Phe-OH в 80 мл тетрагидрофурана, охлажденного до 0 С. Полученный раствор выдерживают при перемешивании при 0 С в течение 1 ч. Раствор, состоящий из 8,0 г соединения (11) в 20 мл тетрагидрофурана, вводят по каплям в реакционную смесь с такой скоростью, чтобы температура не превышала 5 С. Раствор выдерживают при перемешивании при 0 С в течение 1 ч и при температуре окружающей среды в течение 1 ч. К этой смеси добавляют 100 мл 1 М NaOH и тетрагидрофуран выпаривают при пониженном давлении. К остатку добавляют дихлорметан и воду; две фазы разделяют, органическую фазу промывают водой (2) и после замены растворителя на этилацетат при пониженном давлении соединение (12) кристаллизуют из этилацетата с получением 14,73 г белого твердого вещества. Выход 85%. Чистота по ВЭЖХ: 96%. Пример 10. 2-(R)-Амино-3-фенил-N-(1-(тетрагидропиран-4-илметил)пиперидин-4-илметил)пропионамид (4). 35 г продукта (12) добавляют в 110 мл метиленхлорида и в полученную суспензию порциями добавляют 155 мл предварительно охлажденной 3 М HCl. Двухфазную смесь выдерживают при перемешивании в течение ночи. Водную фазу собирают и дополнительно промывают метиленхлоридом. Затем в водную фазу добавляют метиленхлорид (65 мл) и после охлаждения до приблизительно 0 С порциями добавляют 65 г 32% NaOH, при этом поддерживают температуру ниже 20 С. Отделенную водную фазу дополнительно экстрагируют метиленхлоридом (2) и объединенные органические фазы промывают водой (2). Органическую фазу затем подвергают замене растворителя на циклогексан при атмосферном давлении до объема приблизительно 250 мл. Затем в циклогексановый раствор добавляют 35 мл горячего этилацетата и после введения затравки температуру постепенно снижают до значений температуры окружающей среды. Суспензию затем выдерживают при перемешивании при 0 С в течение 2 ч и фильтруют. Твердое вещество промывают предварительно охлажденной смесью растворителей этилацетат/циклогексан 1:6(об./об.) и сушат с получением 26 г кристаллического соединения (4). Выход составляет 94,7%. Чистота по ВЭЖХ составляет 100%. ВЭЖХ: колонка: Zorbax Eclipse XDB-CN, 3,5 мкм, 1504,6 мм, подвижная фаза: предварительно полученный KH2PO4 20 мМ при рН 7/CH3CN: 62/38. Скорость потока: 0,8 мл/мин, детектор: УФ, =214 нм, объем вводимой пробы: 20 мкл, температура: 25 С; RT соединения (12) составляет 8 мин. 1 Н-ЯМР (ДМСО-d6, 400 МГц):(млн-1) 0.92-1.78 (m, 14H), 2.06 (d, 2H), 2.56-3.01 (m, 6 Н), 3.20-3.39(m, 3 Н), 3.77-3.84 (m, 2 Н), 7.13-7.29 (m, 5 Н), 7.78 (bt, 1 Н). ТСХ (тонкослойная хроматография): пластина с силикагелем, элюент: метиленхлорид/2 М NH3 в МеОН, 9:1 (об./об.), проявление пятен парами йода. Rf соединения (12) составляет 0,4.[]D равен + 31 (С равен 1%, ацетон). Точка плавления: 98-100 С (Кофлер). Пример 11. 1-[(6-Метилбензо[b]тиофен-2-карбонил)амино]циклопентанкарбоновая кислота (16). 100 г предшественника (1) растворяют горячим в безводном толуоле и добавляют 0,4 мл N,Nдиметилформамида в атмосфере инертного газа. Полученную смесь затем охлаждают до температуры окружающей среды и 72,6 г оксалилхлорида вводят по каплям с такой скоростью, чтобы температура не превышала 30 С. Реакционную смесь затем перемешивают при температуре окружающей среды в течение по меньшей мере 2 ч и концентрируют снова, разбавляют свежим толуолом и концентрируют еще раз с получением толуольного раствора хлорангидрида соединения (1). Во второй колбе суспендируют 73,4 г циклолейцина в безводном толуоле и медленно добавляют 219 г бис-триметилсилилацетамида (BSA) с такой скоростью, чтобы температура не превышала 30 С. После 30 мин при температуре окружающей среды реакционную смесь охлаждают до 0 С и добавляют толуольный раствор хлорангидрида соединения (1). Реакционную смесь затем выдерживают при перемешивании при температуре окружающей среды в течение по меньшей мере 5 ч, затем охлаждают до 0 С и медленно добавляют 1,6 л разбавленного раствора NaOH (содержащего 121 г NaOH) с такой скоростью, чтобы внутренняя температура не превышала 30 С. Двухфазную смесь перемешивают при температуре окружающей среды в течение 30 мин. Обогащенную водную фазу промывают толуолом (3) и охлаждают до 0 С и 0,46 л 6 н. HCl медленно добавляют с такой скоростью, чтобы температура не превышала 20 С. Образованную суспензию перемешивают при температуре окружающей среды в течение по меньшей мере 15 ч и при 0 С в течение 1 ч, затем центрифугируют и промывают водой (3) и изопропиловым спиртом. После сушки получают 146 г соединения (16) в форме белого твердого вещества. Выход: 93%. Чистота по ВЭЖХ: 95,2%. 1 Н-ЯМР (CDCl3, 200 МГц):(млн-1) 1.65-1.80 (m, 4 Н), 2.0-2.2 (m, 4 Н), 2.42 (s, 3 Н), 7.25 (d, 1 Н), 7.757.85 (m, 2 Н), 8.12 (s, 1H), 8.70 (s, 1H), 12-13.5 (уширенный синглет, 1 Н).MS (ESI, положительные ионы), m/z: 326 [M+Na]+, 304 [М+Н], 258, 175. Точка плавления: 214-217 С (Кофлер). Пример 12. 2-(6-Метилбензо[b]тиофен-2-ил)-3-окса-1-азаспиро[4,4]нон-1-ен-4-он (3) (способ А). Соединение (16) (58 г) растворяют в тетрагидрофуране (575 мл) и добавляют гидрохлорид N-(3 диметиламинопропил)-N'-этилкарбодиимида (EDAC) (39,8 г), ацетонитрил (575 мл) и N,Nдиизопропилэтиламин (DIPEA) (26,8 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 20 ч и проводят замену растворителя на ацетонитрил до конечного объема приблизительно 330-380 мл. Полученную суспензию перемешивают при 0 С в течение 3 ч и центрифугируют,твердое вещество промывают 100 мл ацетонитрила с получением 51 г соединения (3) в форме белого твердого вещества. Выход 94,4%. Кристаллизация соединения (3). Полученное таким образом соединение (3) (51 г) суспендируют в этилацетате и эту смесь нагревают до 55 С; растворитель затем частично выпаривают при пониженном давлении до остаточного объема приблизительно 160 мл. Суспензию охлаждают до 0 С в течение 1 ч и центрифугируют. Суспензию затем промывают этилацетатом и сушат под вакуумом при 40 С с получением соединения (3) в форме белого твердого вещества. Выход: 87%. Чистота по ВЭЖХ составляет 99,96%. ВЭЖХ: колонка Symmetry, C18, 3,5 мкм, 1004,6 мм, подвижная фаза А: CH3CN, подвижная фаза В: 10 мМ K2HPO4, рН равен 6. Затем проводят градиентное элюирование согласно следующему протоколу: Скорость потока: 1 мл/мин, детектор: УФ, =280 нм, объем вводимой пробы: 20 мкл, температура: 30 С, RT соединения (3) составляет 19 мин. Точка плавления: 161-163 С (Кофлер). Пример 13. 2-(6-Метилбензо[b]тиофен-2-ил)-3-окса-1-азаспиро[4,4]нон-1-ен-4-он (3) (способ В). 9,0 г соединения (16) суспендируют в колбе в 117 мл дихлорметана и добавляют 4,95 мл триэтиламина; полученный таким образом раствор охлаждают до приблизительно 0 С и медленно добавляют 5,81 мл изобутилхлорформиата. После 30 мин перемешивания при 0 С реакционную смесь затем доводят обратно до температуры окружающей среды и промывают 25 мл 0,5 М HCl, 25 мл насыщенного NaHCO3 и 25 мл воды. Органический раствор упаривают при пониженном давлении досуха с получением 8,07 г соединения (3) в форме белого твердого вещества. Выход 95,4%. Чистота по ВЭЖХ: 99,4%. Пример 14. 2-(6-Метилбензо[b]тиофен-2-ил)-3-окса-1-азаспиро[4,4]нон-1-ен-4-он (3) (способ С). 10,0 г соединения (16) суспендируют в 100 мл абсолютного этанола; полученную суспензию охлаждают до 0 С и добавляют 6,0 мл триэтиламина и 5,2 мл изобутилхлорформиата с такой скоростью, чтобы внутренняя температура не превышала 5 С. Через 1,5 ч суспензию фильтруют и твердое вещество промывают абсолютным этанолом (2) и сушат с получением 8,36 г соединения (3) в форме белого кристаллического твердого вещества. Выход: 88,9%. Чистота по ВЭЖХ: 98,9%. Пример 15. 6-Метилбензо(b)тиофен-2-карбоновая кислота (1) (способ А). 8,5 г палладия на 5% влажном угле (50% воды) добавляют в атмосфере инертного газа в смесь 11,33 г 3-хлор-6-метилбензо(b)тиофен-2-карбоновой кислоты (18), 135 мл N,N-диметилформамида, 15 мл 3,3 М NaOH и 40 мл смеси метанол/вода 9/1. После повторных циклов вакуум-водород суспензию выдерживают при перемешивании в атмосфере водорода при температуре окружающей среды в течение 20-24 ч. Эту смесь затем приводят в инертное состояние и фильтруют через набивку из целита и катализатор промывают 150 мл метанола. Фильтрат упаривают досуха, добавляют 500 мл воды и 40 мл 1 н. HCl и этот раствор выдерживают при перемешивании в течение 1 ч. Суспензию фильтруют и твердое вещество промывают 200 мл воды и сушат. После сушки получают 8,71 г соединения (1) в форме белого твердого вещества; выход составляет 90,6%. Чистота по ВЭЖХ составляет 99,3%.MS m/z: 191 (M-H)-. 1 Н-ЯМР (ДМСО-d6, 600 МГц):(млн-1) 13.35 (уширенный синглет, 1 Н), 8.04 (s, 1 Н), 7.88 (d, 1 Н,J=8,2), 7.84 (s, 1 Н), 7.30 (dd, 1 Н, J=1,0 Гц, J=8,2 Гц). Пример 16. 6-Метилбензо(b)тиофен-2-карбоновая кислота (1) (способ В). Суспензию 0,745 г палладия на 5% влажном угле (50% воды) в 5 мл метанола добавляют в атмосфере инертного газа в смесь 1,133 г 3-хлор-6-метилбензо(b)тиофен-2-карбоновой кислоты (18) в 17,5 мл тетрагидрофурана, 5 мл 1 н. NaOH и 17,5 мл метанола. Суспензию затем выдерживают при перемешивании в атмосфере водорода при температуре окружающей среды в течение 18-20 ч. Смесь приводят в инертное состояние и фильтруют через набивку из целита и катализатор промывают 30 мл метанола. Фильтрат затем упаривают досуха при пониженном давлении и к остатку добавляют 30 мл 1 н. HCl и 150 мл этилацетата. Органическую фазу промывают рассолом (2) и упаривают досуха. Получают 0,927 г соединения (1) в форме белого твердого вещества; чистота по ВЭЖХ составляет 97%, выход составляет 96,4%. Пример 17. 6-Метилбензо(b)тиофен-2-карбоновая кислота (1) (способ С) (МеОН/вода и формиат аммония). Суспензию палладия на 5% влажном угле (50% воды) (1,065 г) и формиата аммония (2,52 г) в метаноле (30 мл) перемешивают в течение 20 мин в атмосфере инертного газа, затем добавляют раствор 2,52 г формиата аммония в 5 мл воды и раствор, состоящий из 2,26 г 3-хлор-6-метилбензо(b)тиофен-2 карбоновой кислоты (18), 70 мл метанола и 10 мл 1 н. NaOH. Эту смесь выдерживают при перемешивании при температуре дефлегмации в атмосфере инертного газа в течение 15 ч. Затем добавляют 0,425 гPd/C (5% влажный) и реакционную смесь снова выдерживают при температуре дефлегмации в течение 24 ч. Смесь затем охлаждают, разбавляют метанолом, фильтруют через набивку из целита и катализатор промывают дополнительным количеством метанола. Фильтрат затем упаривают досуха при пониженном давлении и остаток обрабатывают 70 мл 1 н. HCl и 250 мл этилацетата. Органическую фазу промывают рассолом (3) и упаривают досуха с получением 1,82 г соединения (1) в форме белого твердого вещества; чистота по ВЭЖХ составляет 98,2%, выход составляет 94,7%. Пример 18. Ибодутант (способ А). 4,43 г соединения (3), 5,64 г соединения (4) и 60 мл этилацетата вводят в колбу объемом 250 мл в атмосфере инертного газа; полученную суспензию затем нагревают и выдерживают при температуре дефлегмации в течение 15 ч. Суспензию затем фильтруют и твердое вещество промывают этилацетатом(2), сушат с получением 9,81 г ибодутанта в форме белого твердого вещества. Скорректированный выход: 98%. Чистота по ВЭЖХ: 99,7%. 1 Н-ЯМР (ДМСО-d6, 300 МГц):(млн-1) 0.99-1.15 (m, 4H), 1.30-1.44 (m,1 Н), 1.44-1.84 (m, 13 Н), 1.851.95 (m, 1 Н), 1.85-1.95 (m, 1 Н), 1.97-2.08 (d, 2H, J=7,2 Гц), 2.24 (dt, 1H, J=13,2 е 8 Гц), 2.46 (s, 3 Н), 2.652.77 (d, 2H, J=10,8 Гц), 2.85 (dd, 1 Н, J=14,0 е 10,8 Гц), 2.91-3.01 (m, 2 Н), 3.19 (dd, 1H, J=14,0 e 4,0 Гц),3.22-3.31 (m, 2 Н), 3.81 (d, 2 Н, J=10,8 Гц), 4.41-4.51 (m, 1 Н), 7.08-7.25 (m, 5 Н), 7.29 (d, 1H, J=8,4 Гц), 7.48(t, 1 Н, J=5,6 Гц), 7.82 (s, 1 Н), 7.84-7.90 (m, 2 Н), 8.24 (s, 1H), 8.82 (s, 1H). ВЭЖХ: колонка Symmetry, C18, 3,5 мкм, 1004,6 мм, подвижная фаза А: CH3CN, подвижная фаза В: K2HPO4 20 мМ, рН равен 2,2/CH3CN 65/35. Проводят градиентное элюирование согласно следующему протоколу:MS (m/z): 645 (МН+, 100%), 360 (20%), 286 (10%). Дифракция рентгеновских лучей на монокристалле: см. Altamura et al., Acta Crystallographica SectionB, 2006, 62, 889-896. Пример 19. Ибодутант (способ В). 14,3 г соединения (16), 57 мл N,N-диметилформамида, 4,45 мл DIPEA и 9,9 г EDAC вводят в колбу объемом 100 мл. Эту смесь выдерживают при перемешивании при температуре окружающей среды в течение 18 ч; затем в эту колбу добавляют 16,8 г соединения (4) и 4,05 мл DIPEA и полученную смесь перемешивают при температуре окружающей среды в течение 21 ч. Реакционную смесь вводят по каплям в раствор 0,5 М NaOH, охлажденного до приблизительно 10 С. Полученную суспензию выдерживают при перемешивании при приблизительно 10 С в течение 3 ч,затем фильтруют и твердое вещество промывают водой. Твердое вещество затем разрушают водой и снова фильтруют, промывают водой и сушат. Получают 27,1 г неочищенного ибодутанта в форме белого твердого вещества; выход составляет 90,1%, чистота по ВЭЖХ составляет 98%. Кристаллизация ибодутанта. 27 г ибодутанта растворяют в абсолютном этаноле при приблизительно 70 С и этот раствор затем концентрируют. Суспензию перемешивают при температуре окружающей среды в течение приблизительно 3 ч и при 0 С в течение приблизительно 15 ч и фильтруют; твердое вещество промывают смесью этанол/метил-трет-бутиловый эфир, 1/3. Твердое вещество затем сушат под вакуумом при 40 С до постоянной массы и получают 25,1 г ибодутанта. Выход при кристаллизации: 93%. Продукт, который соответствует характеристикам, описанным в примере 18, имеет чистоту по ВЭЖХ 99,85%. Пример 20. Ибодутант (способ С). 3,0 г соединения (16) суспендируют в колбе объемом 100 мл в 39 мл дихлорметана и добавляют 1,50 мл триэтиламина; полученный таким образом раствор охлаждают до приблизительно 0 С и добавляют 1,45 мл изобутилхлорформиата. После 30 мин перемешивания при 0 С наблюдается образование соединения (3) с чистотой по ВЭЖХ, превышающей 99%. Реакционную смесь затем доводят обратно до температуры окружающей среды и промывают 0,5 М HCl (2) и водой (2). Затем проводят замену растворителя на этилацетат при атмосферном давлении до остаточного объема приблизительно 40 мл; добавляют 3,56 г соединения (4) и эту смесь нагревают с обратным холодильником в течение 9 ч и в течение ночи при 55 С. Суспензию затем охлаждают до температуры окружающей среды и фильтруют; полученное твердое вещество промывают этилацетатом (2) и сушат в печи под вакуумом при 40 С с получением 4,60 г ибодутанта, выход 72%. Продукт, который соответствует характеристикам, описанным в примере 18, имеет чистоту по ВЭЖХ 99,9%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения ибодутанта включающий: а) получение промежуточного соединения (12) путем проведения следующих стадий: а') защита первичного амина 4-аминометилпиперидина (2) с использованием этилтрифторацетата с последующим восстановительным аминированием защищенного 4-аминометилпиперидина 4-формилтетрагидропираном и бораном и снятием защиты в щелочной среде с получением промежуточного диамина (11)b') взаимодействие диамина (11) с Boc-D-Phe с получением промежуточного соединения (12); или, альтернативно, путем проведения следующих стадий: а") взаимодействие между 4-аминометилпиперидином (2) и Boc-D-Phe(OSu) с получением промежуточного соединения (17)b") восстановительное аминирование соединения (17) 4-формилтетрагидропираном и бораном с получением промежуточного соединения (12); с) взаимодействие между соединением (4) и соединением (3) с получением конечного продукта. 2. Способ по п.1, где взаимодействие между соединениями (3) и (4) на стадии (с) проводят в этилацетате в качестве растворителя в течение периода времени от 10 до 30 ч. 3. Способ по п.1, где в реакциях восстановительного аминирования на стадиях (а') и (b") используют Na(OAc)3BH. 4. Способ по п.1, дополнительно включающий кристаллизацию ибодутанта в этаноле. 5. Способ по п.1, дополнительно включающий следующие стадии получения соединения (3): а) активацию 6-метил-2-бензо[b]тиофенкарбоновой кислоты формулы (1)b) взаимодействие между соединением (1) и 1-амин-альфа,альфа-циклопентанкарбоновой кислотой с получением промежуточного соединения (16) с) циклизацию соединения (16) в соответствующий оксазолон формулы (3). 6. Способ по п.5, дополнительно включающий получение 6-метил-2-бензо[b]тиофенкарбоновой кислоты (1) посредством каталитического гидродегалогенирования 3-хлор-6-метил-2-бензо[b]тиофенкарбоновой кислоты (18) 7. Способ по пп.1 и 5, где оксазолон формулы (3) получают из соединения (16) и сразу же, без выделения и очистки, подвергают взаимодействию с промежуточным соединением (4) с получением конечного продукта ибодутанта.
МПК / Метки
МПК: A61K 38/05, C07D 409/12, A61P 25/00
Метки: меn15596, соединений, способ, ибодутанта, родственных, промежуточных, получения
Код ссылки
<a href="https://eas.patents.su/14-19777-sposob-polucheniya-ibodutanta-men15596-i-rodstvennyh-promezhutochnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения ибодутанта (меn15596) и родственных промежуточных соединений</a>
Предыдущий патент: Установка для преобразования тепловой энергии окружающей среды в полезную энергию
Следующий патент: Комплекс средств видеонаблюдения и связи мобильного пункта управления
Случайный патент: Пиримидиновые производные для лечения аномального клеточного роста












