Лекарственное средство на основе дииндолилметана (dim) с повышенной биодоступностью и его использование в лечении гиперпластических и воспалительных заболеваний человека
Формула / Реферат
1. Лекарственное средство для лечения гиперпластических и воспалительных заболеваний человека, содержащее 3,3'-дииндолилметан в качестве активного начала и носитель, отличающееся тем, что оно представляет собой раствор, содержащий в качестве носителя смесь рыбьего жира и по меньшей мере одного полисорбата при следующем содержании компонентов, мас.%:
3,3'-дииндолилметан - 1-20;
рыбий жир - 10-20;
полисорбат - остальное.
2. Лекарственное средство по п.1, отличающееся тем, что оно расфасовано во флаконы из темного стекла.
3. Лекарственное средство по п.1, отличающееся тем, что оно расфасовано в твердые желатиновые капсулы, покрытые гидроксипропилметилцеллюлозой или ее фталатом.
4. Применение лекарственного средства по любому из пп.1-3 для лечения гиперпластических и воспалительных заболеваний человека.
5. Применение по п.4, где средство вводят из расчета 0,5-2 мг 3,3'-дииндолилметана на кг веса пациента.
6. Применение по п.4, где указанное заболевание представляет собой заболевание, выбранное из группы: миома, аденомиоз, гиперплазия щитовидной железы, атопический дерматит, болезнь Крона, папилломатоз гортани и хламидийные цервициты.
Текст
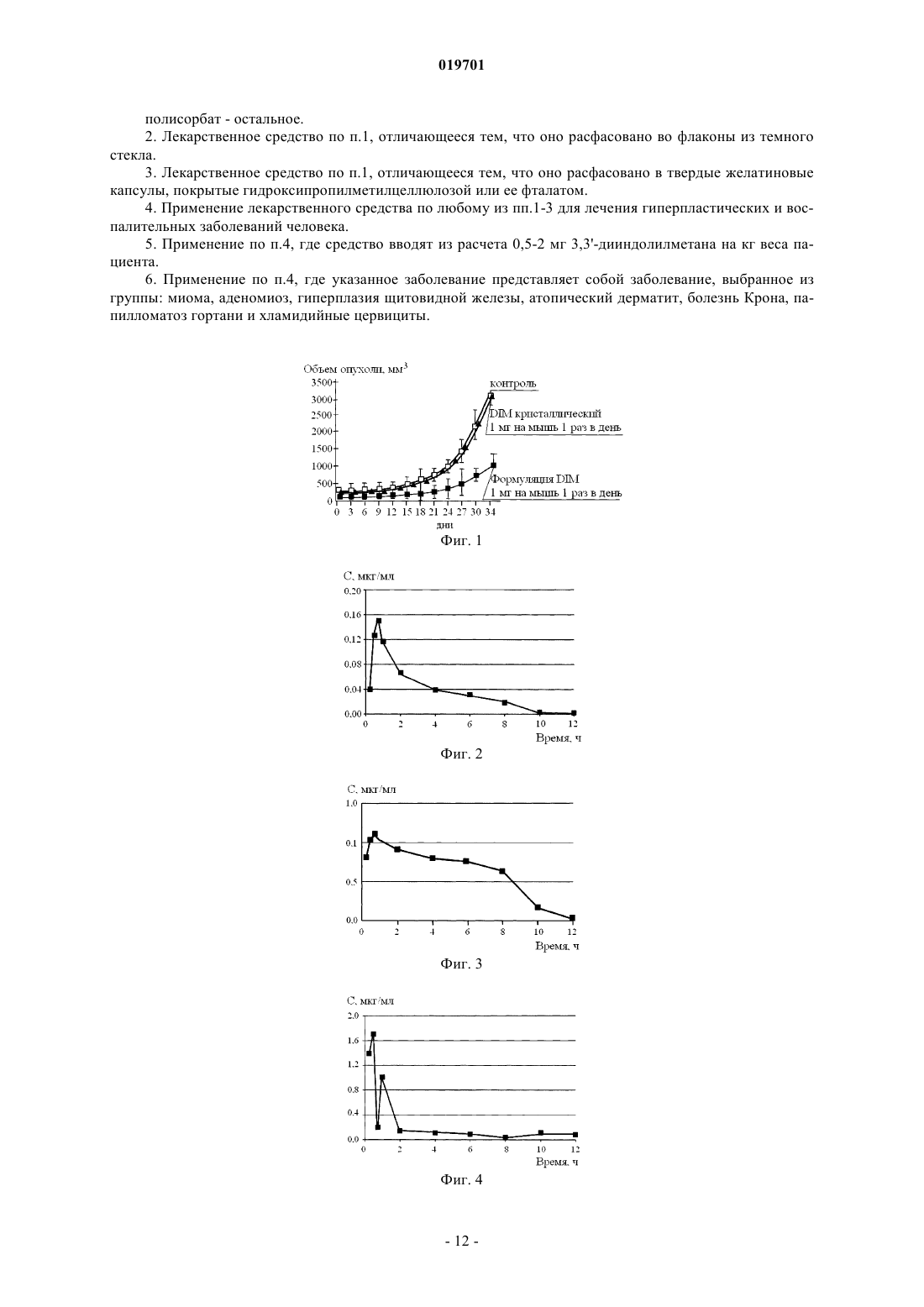
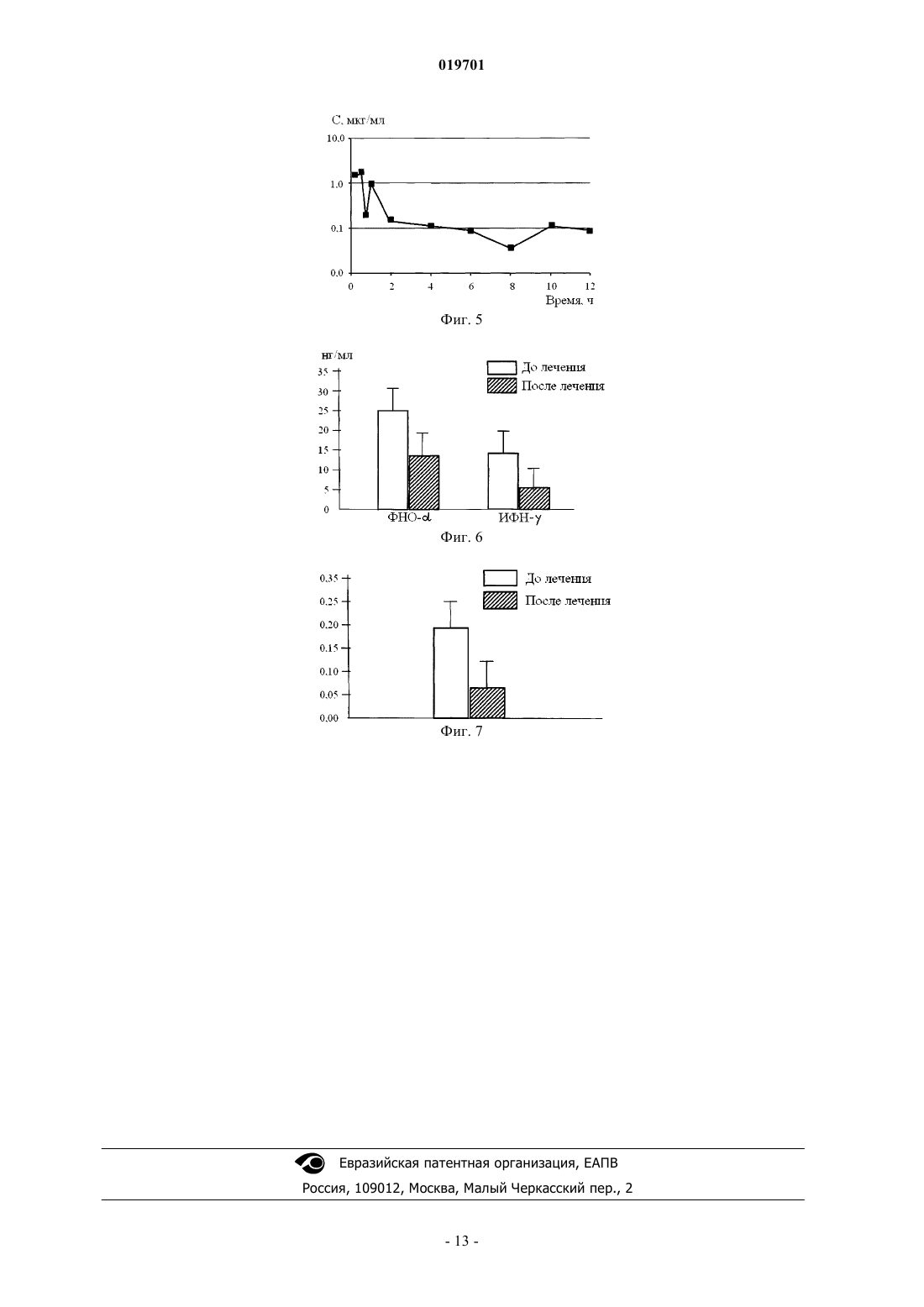
ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ДИИНДОЛИЛМЕТАНА (DIM) С ПОВЫШЕННОЙ БИОДОСТУПНОСТЬЮ И ЕГО ИСПОЛЬЗОВАНИЕ В ЛЕЧЕНИИ ГИПЕРПЛАСТИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА Изобретение относится к области медицины и химико-фармацевтической промышленности. Лекарственное средство для лечения гиперпластических и воспалительных заболеваний человека,содержащее в качестве активного начала 3,3'-дииндолилметан и носитель, содержащий смесь рыбьего жира и по меньшей мере одного полисорбата при следующем содержании компонентов,мас.%: 3,3'-дииндолилметан 1-20; рыбий жир 10-20; полисорбат - остальное. Область техники Изобретение относится к области медицины и химико-фармацевтической промышленности. Уровень техники В настоящее время в медицинской практике широкое распространение получили средства на основе индольных соединений, выделенных из семейства крестоцветных (Cruciferous), к которому относятся все виды кочанной капусты, брюссельская, цветная капуста и брокколи, а также их синтетические аналоги. Интерес к соединениям данной группы вызван, в частности, их антиканцерогенными и антиэстрогенными свойствами, в связи с чем они могут быть использованы при лечении заболеваний органов женской репродуктивной системы и некоторых гормональных патологий, сопровождающихся гиперпластическими процессами. К числу наиболее распространенных заболеваний данной категории относятся мастопатии, миомы матки, эндометриоз, аденомиоз, дисплазии шейки матки различной этиологии, а также гиперплазии щитовидной железы. В структуре онкологической заболеваемости у женщин опухоли репродуктивных органов занимают первое место, и в среднем заболеваемость увеличивается на 1% в год. В структуре смертности они стоят на втором месте, при этом "темп прироста" по показателям смертности остается самым высоким (28%). По данным экспертов ВОЗ в настоящее время каждый год во всем мире регистрируется около миллиона новых случаев рака молочной железы (РМЖ), одна треть из которых заканчивается смертельным исходом. По оценкам ряда исследователей, в следующем десятилетии 5 млн женщин во всем мире будет страдать от данной злокачественной опухоли. Известно, что ткани репродуктивных органов подвергаются непрерывному воздействию множества различных факторов, стимулирующих их к активному делению (пролиферации) и индуцирующих запуск специфических сигнальных каскадов. Среди них можно выделить три основных внутриклеточных механизма, приводящих к активации клеточной пролиферации: 1) гормональный (или эстрогензависимый); 2) индуцируемый ростовыми факторами и 3) активируемый провоспалительными цитокинами. Участие эстрогенов в развитии неопластических процессов в гормонзависимых тканях (эпителий молочных желез, эндометрий и шейка матки) в настоящее время считается общепризнанным и рассматривается как один из ведущих этиологических факторов их возникновения. В настоящее время достаточно хорошо изучены патогенетические механизмы развития гиперпластических процессов в молочной железе. Очевидно, что, блокируя основные каналы проведения сигналов, стимулирующих пролиферацию клеток молочной железы, мы можем рассчитывать на успех в профилактике и лечении возникающих на этой основе патологических состояний. Другими словами, фармакологическая коррекция гиперпролиферативных заболеваний органов репродуктивной системы должна осуществляться на всех этапах и по отношению ко всем сигнальным каскадам, опосредующим ключевые патофизиологические функции. Многолетние поиски природных соединений, блокирующих развитие гиперпластических процессов в гормонзависимых тканях, наконец, увенчались успехом. Одно из таких соединений - содержащийся в овощах семейства крестоцветных (различных видах капусты) фитонутриент индол-3-карбинол (I3C). Противоопухолевая защита, оказываемая I3C, обусловлена широким спектром его биологических активностей. В то же время известно, что клинический эффект, оказываемый I3C при тех или иных патологиях, существенно зависит от индивидуальных особенностей метаболизма принимающих данный препарат пациентов, в частности, от способности конвертировать I3 С в различные его производные, между которыми, в свою очередь, возможны синергетические и/или антагонистические взаимодействия (DalessandriKM, Firestone GL et al (2004) Pilot study: effect of 3-Diindolylmethane supplements on urinary hormone metabolites in postmenopausal women with a history of early-stage breast cancer. Nutrition and cancer, 50(2), 161167). Одним из производных индол-3-карбинола, образующимся при его олигомеризации, является дииндолилметан (DIM). Это соединение обладает практическими всеми биологическими эффектами, присущими индол-3-карбинолу, в том числе и способностью позитивно влиять на изменения в соотношении метаболитов эстрогенов. При этом DIM не подвергается метаболическим превращениям в организме человека и является стабильным химическим соединением. Эти отличия индол-3-карбинола от дииндолилметана делают использование DIMa более предпочтительным в фармацевтических композициях с другими фармакологически активными субстанциями при лечении гиперпластических и пролиферативных заболеваний. Дииндолилметан может использоваться при различных воспалительных заболеваниях (WO 2006105196, опубл. 05.10.2006). Установлено, что дииндолилметан способен индуцировать проапоптотическую гибель клеток с нарушенным метаболизмом. В частности, DIM активирует один из ключевых ферментов апоптоза, каспазу 8, вызывая гибель трансформированных клеток рака кишечника (Kim EJ, Park SY et all (2007) Activationof caspase-8 contributes to Diindolylmethane-induced apoptosis in colon cancer cells, J of Nutrition, 137, 3136). Мы предположили, что способность DIM активировать механизмы апоптоза может распространяться и на клетки, инфицированные внутриклеточными микроорганизмами. В частности, Clamydia Trachomatis. Хламидийная инфекция имеет весьма широкое распространение и по мнению многих авторов является одной из основных причин женского бесплодия. Традиционным методом лечения хламидийных цервицитов является терапия антибиотиками. Однако почти в 30-40% после завершения курса лечения не удается добиться полной иррадикации возбудителя, что приводит к рецидивированиию заболевания. Дело в том, что жизненный цикл Clamydia Trachomatis состоит из различных стадий, одна из которых"тельца включения" обладает устойчивостью к антибиотикам. Этот факт объясняет недостаточную эффективность терапии антибиотиками. Исследователями предпринимались попытки создания форм с повышенной абсорбцией дииндолилметана. В частности, известна фармацевтическая композиция для лечения мастопатии и эндометриоза (патент США 6689387, опубликованный 10.02.2004), представляющее собой микрочастицы ВС или 3,3'дииндолилметана в крахмальной матрице, в том числе, в виде твердых лекарственных форм для орального введения. Данные формы содержат 30-70% крахмала, что, повышая растворимость активного вещества, не обеспечивает достаточной стабильности в процессе хранения. Известны формуляции DIM на основе пегилированного витамина Е (патент США 6416793, опубликованный 09.07.2002). Однако использование композиций на основе TPGS позволило добиться только очень небольшого (не более чем в 1,5-2 раза) увеличения биологической доступности DIM, его аналогов и производных, что не позволяет в полной мере использовать терапевтический потенциал этих соединений. Кроме того, технология изготовления препарата предполагает использование распылительной сушки, что является весьма энергоемким процессом и удорожает его производство. Наиболее близким к данному изобретению является решение, описанное в международной заявкеWO2009032699 (опубликовано 12.03.2009), касающееся фармацевтических композиций на основе антипролиферативной комбинации дииндолилметана (DIM), полиненасыщенных жирных кислот (ПНЖК) и фолиевой кислоты. Недостатком данных композиций является недостаточная стабильность, так как при хранении наблюдается выпадение основного вещества в виде мелких кристаллов. Кроме того, в условиях дефицита омега-3 жирных кислот у большинства населения, эффекты от использования выделенных ПНЖК могут проявиться как чрезмерные. Включение фолиевой кислоты по последним данным нежелательно для детей с воспалительными заболеваниями аутоиммунного типа. Следует отметить, что индольные производные доказали свою эффективность в педиатрической практике. В частности, индол-3-карбинол и дииндолилметан широко используются при лечении детского респираторного папилломатоза гортани (Auborn KJ (2002) Therapy for recurrent respiratory papillomatosis,Antiviral therapy, 7(1), 1-9). При использовании твердых лекарственных форм возникают трудности с дозированием препарата. Клиническая практика нуждается в жидких лекарственных формах, которые позволят точно дозировать препарат из расчета 1 мг на 1 кг веса. Сущность изобретения Задачей изобретения является следующее: 1) разработать лекарственные формы на основе дииндолилметана, эффективные при лечении хронических воспалительных и гиперпластических процессов, и обладающие максимальной биодоступностью и обеспечивающих достижение концентрации активного вещества в крови пациентов, существенно превышающей 200 нг в мл крови; 2) разработать жидкую лекарственную форму дииндолилметана, удобную для дозирования препарата в педиатрической практике; Задача решается новой лекарственной формой 3,3'-дииндолилметана. Новая форма представляет собой раствор, содержащий активное начало-3,3'-дииндолилметан, и носитель из рыбьего жира и по меньшей мере один полисорбат при следующем содержании компонентов в мас.%: 3,3'-дииндолилметан 1-20; рыбий жир 10-20; полисорбат - остальное. Максимальная биодоступность и стабильность при хранении достигается за счет подобранного носителя из рыбьего жира и полисорбатов, взятых в определенных количествах. Полисорбаты - это поверхносто-активные вещества (ПАВ), которые являются эмульгаторами и солюбилизаторами (растворителями) жиров, как правило, для средств на водной основе. Номера полисорбатов (20, 40, 60, 80) связаны с типом жирных кислот, соединенных с частью молекул (кислот из кокосового масла - полисорбат 20, пальмового - полисорбаты 40 и 60, оливкового - полисорбат 80). Согласно изобретению могут использоваться любые полисорбаты или их смеси. Предпочтительно использование полисорбата 80 или полисорбата 20. В рыбьем жире полиненасыщенные жирные кислоты, имеющие способность к конкурентному с арахидоновой кислотой биосинтезу преимущественно вазодилатирующих простагландинов и лейкотриенов, обладающих меньшей тромбогенной активностью (ЭПК и ДГК), находятся в недостаточной концентрации для проявления собственно терапевтического эффекта, поэтому использование их в качестве носителя приводит к повышению биодоступности ДИМ, но не приводит к нежелательным эффектам. Раствор может быть расфасован во флаконы темного стекла. Также раствор может быть помещен в капсулы. Традиционно лекарственные формы на основе масел фасуют в мягкие желатиновые капсулы. Однако такие капсулы пропускают воздух, ДИМ постепенно окисляется, что может сопровождаться снижением концентрации основного вещества. Именно поэтому предпочтительно использование твердых желатиновых капсул, покрытых гидроксипропилметилцеллюлозой или ее фталатом. Например, могут быть использованы капсулы Licaps, разработанные компанией Capsulgel. В эти капсулы можно фасовать растворы под аргоном с последующей запайкой капсул с помощью лазера. Предлагается также применение лекарственного средства для лечения гиперпастических и воспалительных заболеваний человека. Примерами заболеваний, при которых полезно назначение данного средства являются: миома, аденомиоз, гиперплазия щитовидной железы, атопический дерматит, болезнь Крона и другие воспалительные заболевания кишечника, папилломатоз гортани, хламидийные цервициты. Предпочтительно средство вводят из расчета 0,5-2 мг 3,3'-дииндолилметана на кг веса пациента. Однако в зависимости от тяжести заболевания, возраста, пола, сопутствующих патологий дозы могут быть увеличены или уменьшены. Перечень чертежей Изобретение поясняется следующими рисунками: фиг. 1 - динамика роста привитой опухоли MCF-7 у бестимусных (nu/nu) мышей С 57 Вlаск/6 в контроле и после внутрижелудочного введения животным предлагаемого средства; ратов на основе кристаллического DIM фиг. 2 - усредненная динамика концентрации дииндолилметана в плазме крови экспериментальных животных при внутрижелудочном введении субстанции дииндолилметана 200,0 мг/кг (в линейных координатах); фиг. 3 - усредненная динамика концентрации дииндолилметана в плазме крови экспериментальных животных при внутрижелудочном введении субстанции дииндолилметана 200,0 мг/кг (в логарифмических координатах); фиг. 4 - усредненная динамика концентрации дииндолилметана в плазме крови экспериментальных животных при внутрижелудочном введении капсул дииндолилметана с повышенной биодоступностью 0,10 мг/кг (в линейных координатах); фиг. 5 - усредненная динамика концентрации Дииндолилметана в плазме крови экспериментальных животных при внутрижелудочном введении капсул Дииндолилметана с повышенной биодоступностью 0,10 мг/кг (в логарифмических координатах); фиг. 6 - продукция цитокинов лимфоцитами периферической крови больных атопическим дерматитом до и после лечения; фиг. 7 - влияние лечения больных атопическим дерматитом на уровень общего IgE в сыворотке. Примеры педпочтительного выполнения изобретения Изобретение может быть проиллюстрировано следующими примерами конкретного выполнения. Пример 1. Способ получения растворимой лекарственной формы дииндолилметана, обладающего повышенной биодоступностью (DIM-High Bioavailability (DIM-HB. К полисорбату (или смеси полисорбатов) добавляют рыбий жир в количестве 10-20% от общей массы композиции и полученную смесь тщательно перемешивают до получения однородной жидкости. В полученный раствор вносят субстанцию дииндолилметана 1-20% (10-200 мг вещества на 1 г композиции) и перемешивают до ее полного растворения. Полученный раствор фасуют по специальным капсулам или флаконам из темного стекла. Пример 2. Лекарственные формы на основе дииндолилметана. А. Капсулы, содержащие 100 мг дииндолилметана. Рыбий жир 100 мг, полисорбат 80 - 400 мг. Б. Капсулы, содержащие 50 мг дииндолилметана. Рыбий жир 50 мг, полисорбат 80 - 400 мг. С. Капсулы, содержащие 20 мг дииндолилметана. Рыбий жир 80 мг, полисорбат 80 - 450 мг. Д. Флаконы из темного стекла, объемом 10 мл, содержащие раствор, с концентрацией ДИМ 10 мг га 1 г раствора, 10% рыбьего жира и полисорбат 20 в смеси с полисорбатом 40 - остальное. Е. Флаконы из темного стекла, объемом 50 мл, содержащие раствор с концентрацией ДИМ 100 мг на 1 г раствора, 15% рыбьего жира и полисорбат 80 - остальное. Пример 3. Экспериментальное изучение специфической фармакологической активности предлагаемого средства в условиях in vivo. За 1 неделю до прививки опухолевых клеток самкам бестимусных (nu/nu) линейных мышей С 57 Вlаск/6 имплантировали в подлопаточную область пилюлю, содержащую 0,72 мг эстрадиола, из которой гормон высвобождается в течение 60 дней. Для индукции солидных опухолей опухолевые клетки аденокарциномы молочной железы человека линии MCF-7 собирали с помощью 0,05% раствора Трипсин-ЭДТА ("Sigma", США), трижды промывали стерильным фосфатно-солевым буфером (PBS) и затем в количестве 3 млн клеток в 0,1 мл физиологического раствора вводили подкожно каждому экспериментальному животному в боковую область (число живых клеток подсчитывали с помощью красителя трипанового синего (0,1%) и светового микроскопа). Через 24 ч после инокуляции ксеногенных опухолевых клеток молочной железы животным из опытной группы (10 животных в группе) начинали вводить внутрижелудочно (с помощью зонда) предлагаемое средство по примеру 2 пункт Д в количестве, эквивалентном 1 мг на одну мышь ежедневно. Контрольным животным вводили физиологический раствор. Размер солидных опухолей измеряли 1 раз в 2-3 дня после ее появления. Количественное определение уровня DIM в плазме крови у мышей линии С 57 Вlаск/6 осуществляли методом HPLC (ВЭЖХ) на жидкостном хроматографе "System Gold" (Beckman, США) с УФ-детектором с переменной длиной волны. Для получения образцов крови животным из опытной группы вводили внутрижелудочно (с помощью зонда) предлагаемое средство в количестве, эквивалентном 250 мг DIM/кг (всего 36 животных в группе) и индивидуальное вещество I3C в количестве 250 мг DIM/кг (30 животных в группе). Контрольным животным вводили физиологический раствор. Через 0,25; 0,5; 0,75; 1,0; 1,5; 2,0; 4,0; 6,0; 12,0; 18,0; 24,0 и 36,0 ч после введения предлагаемого средства и через 0,25; 0,5; 0,75; 1,0; 1,5; 2,0; 4,0; 6,0; 12,0 и 24,0 ч после введения индивидуального вещества DIM у экспериментальных животных (по 3 животных для каждой временной точки) из хвостовой вены гепаринизированным шприцем осуществляли забор периферической крови. Каждый образец крови помещали в пробирку, содержащую гепарин. Пробы крови центрифугировали (10000g, 5 мин), после чего отбирали по 1,5-2,0 мл плазмы, замораживали и хранили при -20 С. Непосредственно перед проведением HPLC-анализа в опытные образцы плазмы крови объемом 250 мкл добавляли внутренний стандарт - 4-метокси-индол (IS) (2,5 мкл раствора концентрации 0,4 мг/мл),перемешивали с помощью Vortex и оставляли при комнатной температуре на 30 мин, после чего образцы дважды экстрагировали с помощью третбутилметилового эфира (750 мкл). В каждом образце органическую фазу отделяли от водной центрифугированием (2800g, 10 мин) и переносили ее в новую 4 мл-пробирку. Органические слои образцов для каждой экспериментальной точки объединяли, эфир упаривали в токе азота, к осадку добавляли 150 мкл элюента (ацетонитрил/50 мMHepes-буфер (объемное соотношение 40:60; рН 7,4 и 50 мкл полученного образца вводили в хроматограф. Аналогичные процедуры проводили с контрольными образцами плазмы крови, в которые затем были внесены заданные количества дииндолилметана в диапазоне концентраций: 0,05-10,0 мкг/мл. Количественное определение дииндолилметана в плазме крови проводили на жидкостном хроматографе "System Gold" (Beckman, США) с УФ-детектором при длине волны 280 нм. Жидкостная хроматография производилась при комнатной температуре (22-24 С) на колонке Nucleosil, С 18,5 мкм (4,650 мм). Элюент (подвижная фаза) состоял из воды и ацетонитрила (АЦ). Перед хроматографированием подвижную фазу дегазировали и фильтровали. Элюция осуществлялась градиентом концентрации АЦ по следующей схеме: 1) от 15 до 60% АЦ в течение первых 20 мин; 2) линейный градиент АЦ от 60 до 65% с 20 по 40 мин; 3) линейный градиент АЦ от 65 до 85% с 40 по 65 мин; 4) повторное уравновешивание колонки 15% АЦ в течение 5 мин. Суммарная продолжительность элюции составляла 70 мин, скорость элюирования - 1 мл/мин. Концентрацию DIM в экспериментальных образцах определяли по калибровочным графикам, отражающим зависимость между концентрациями данных веществ в пробе и площадями хроматографических пиков. Минимальная чувствительность метода HPLC-анализа составила 0,05 мкг/мл. Противоопухолевую эффективность данных соединений оценивали, определяя объем солидной опухоли в опытной и контрольной группах животных. Как видно из фиг. 1, начиная приблизительно с 12 дня от начала эксперимента у животных контрольной группы, не получавших предлагаемого средства, отмечался интенсивный рост солидных опухолей. В течение последующих 20 дней (с 14 по 34 день эксперимента) средний размер опухоли, индуцированной клетками аденокарциномы человека линии MCF-7, увеличилсяв 10 раз. В то же время средний объем опухоли у животных, получавших предлагаемое средство, за тот же промежуток времени увеличился всего в 5 раз. Таким образом, ведение бестимусным (nu/nu) мышам С 57 Вlаск/6 предлагаемого средства в дозе 1 мг существенно тормозило рост солидных опухолей, индуцированных инокуляцией животным опухолевых клеток молочной железы человека линии MCF-7. При этом предлагаемое средство в применявшихся дозах не вызывал каких-либо изменений клеточной морфологии печени, почек и др. функционально важных органов, а также не влиял на вес экспериментальных животных. Отсюда можно заключить, что предлагаемое средство обладает выраженным противоопухолевым действием в отношении рака молочной железы in vivo на животной ксенотрансплантационной модели. Гистологическое исследование тканей животных, получавших предлагаемое средство (умерщвленных под эфирным наркозом в конце эксперимента), показало, что данный препарат в применявшихся дозах не вызывает каких-либо изменений клеточной морфологии печени, почек и др. функционально важных органов, а также не влияет на вес экспериментальных животных. Пример 4. Концентрации дииндолилметана в плазме крови экспериментальных животных (мкг/мл) при внутрижелудочном введении субстанции дииндолилметана 200,0 мг/кг. Результаты измерения концентрации субстанции Дииндолилметана в плазме крови крыс при внутрижелудочном введении представлены в табл. 1. Усредненные фармакокинетические кривые отображены на фиг. 2-3. Таблица 1 После введения дииндолилметан начинал определяться в системном кровотоке через 15 мин, максимум концентрации наблюдался около 1 ч (0,13-0,17 мкг/мл). Далее концентрация дииндолилметана начинала плавно снижаться, и через 12 ч после введения дииндолилметан определялся в крови в минимальных количествах (менее 0,03 мкг/мл). Разброс индивидуальных значений умеренный: коэффициент вариации CV составил 8-22%. Пример 5. Концентрации дииндолилметана в плазме крови экспериментальных животных (мкг/мл) при внутрижелудочном введении дииндолилметана с повышенной биодоступностью 0,10 мг/кг. Результаты измерения концентрации субстанции дииндолилметана в плазме крови крыс при внутрижелудочном введении представлены в табл. 2. Усредненные фармакокинетические кривые отображены на фиг. 4, 5. Таблица 2 После введения дииндолилметан начинал определяться в системном кровотоке через 15 мин, максимум концентрации наблюдался около 30 мин (1,6-1,8 мкг/мл), далее концентрация снижалась в 8 раз и через 2 ч после введения наблюдался повторный максимум концентрации (0,9-1,1 мкг/мл). Далее концентрация дииндолилметана начинала плавно снижаться, и через 12 ч после введения дииндолилметан определялся в крови в минимальных количествах (около 0,03 мкг/мл). Разброс индивидуальных значений умеренный: коэффициент вариации CV составил 5-20%. Обращает на себя внимание тот факт, что дозировка разработанной формуляции DIM на 1 животное в 2000 раз меньше, чем в случае кристаллического DIMa. Несмотря на такие различия в дозировках, концентрация DIM в плазме экспериментальных животных имеет сопоставимые значения для двух препаратов. Пример 6. Эффективность предлагаемого средства при лечении атопического дерматита. Под нашим наблюдением находилось 43 больных атопическим дерматитом в возрасте от 18 до 25 лет, из них 35 мужчин (81,4%) и 8 женщин (18,6%). Кожные проявления заболевания соответствовали клинике атопического дерматита с типичной для данного дерматоза морфологией и локализацией высыпаний. У больных выявлены следующие клинические формы АД: эритематозно-сквамозная со слабой или умеренной лихенификацией - у 34 пациентов (78,3%), лихеноидная - у 1 (2,3%), пруригоподобная - у 2 (4,6%), экзематозная - у 6 больных (13,8%). Тяжесть заболевания оценивалась по индексу SCORAD,колебалась в пределах от 12,4 до 61,2. Из них с легкой степенью было 27 больных (62,8%), средней - 15 больных (34,9%), тяжелой - 1 больной (2,3%). Белый разлитой стойкий дермографизм определялся у 44%. Всех больных беспокоил зуд различной степени интенсивности: от незначительного до биопсирующего. Среди больных 35 человек (81,4%) характеризовали зуд как умеренный, терпимый, 8 больных как нетерпимый. Большинство - 37 больных (86%) - отмечали раздражительность, плохое настроение,быструю утомляемость, нарушение сна. У большинства больных (90,7%) отмечали колебания в течении заболевания. Наиболее часто обострения АД наблюдались в холодное время года. Среди факторов, провоцирующих очередное обострение, 27 (62,8%) пациентов отмечают нарушение гипоаллергенной диеты,8 (18,6%) - стрессовые ситуации, 5 (11,6%) - инфекционные заболевания, 4 больных АД (9,3%) - прием лекарственных средств. Для лечения больных был применен новый препарат. Активной субстанцией препарата является дииндолилметан в жидкой лекарственной форме, обладающей повышенной биодоступностью. Препарат использовали в виде капсул, содержащих 10, 20, 50 и 100 мг активного вещества. Все пациенты получали препарат в дозировке 1 мг на 1 кг веса в сутки. Оценку результатов терапии проводили на основании изменения клинической картины на 7 и 14 день лечения и через 1 месяц от начала лечения. Объективными критериями служили динамика кожной симптоматики заболевания, оцениваемая с помощью шкалы SCORAD. Среди 43 пациентов, получавших препарат, клиническое выздоровление, характеризующееся исчезновением зуда и воспалительных изменений кожи, было достигнуто у 10 больных (23,3%) с легкой степенью и у 9 больных (20,9%) со средней степенью тяжести заболевания в среднем через 2 недели от момента начала терапии. Значительное улучшение отмечалось у 8 пациентов (18,6%) с легкой и у 5(11,6%) со средней степенью тяжести заболевания. Положительная динамика на фоне проводимой терапии в виде улучшения была отмечена у 7 больных (16,3%) с легкой степенью, у 1 (2,3%) - с тяжелой степенью тяжести заболевания. Отсутствие эффекта от проводимой терапии в данной группе наблюдали у 2 больных (4,6%) с легкой степенью и у 1 больного (2,3%) со среднетяжелой степенью тяжести заболевания. Клиническая эффективность препарата составила 74,4%. Продукция цитокинов Методом проточной цитометрии на бусах, покрытых антителами к цитокинам, определяли уровень продукции фактора некроза опухолей альфа (ФНО-) и интерферона g (ИФН-g) у больных атопическим дерматитом до и после лечения. После лечения наблюдали достоверное (t-test, p0,05) снижение продукции ФНО-. ИФН-g (фиг. 6). Продукция IgE Лечение препаратом приводило к достоверному снижению уровня IgE, что наблюдается достаточно редко при этом заболевании. Повторный забор крови у больных после лечения осуществляли через 1,5-2 месяца. Время жизни иммуноглобулинов в сыворотке крови составляет около 1 месяца. Соответственно,снижение уровня IgE в сыворотке крови больных АД после лечения означает прямое действие препарата на продукцию IgE. Снижение IgE наблюдали в 100% случаев, даже если исходный уровень был низким(фиг. 7). Пример 7. Клиническая эффективность новой формуляции DIM для профилактики рецидивов при болезни Крона. Цель Определить эффективность новой формуляции DIM для поддержания ремиссии при болезни Крона. Структура исследования Рандомизированное двойное слепое плацебо-контролируемое исследование; длительность - 1 год. Больные 58 больных (от 18 до 67 лет, 50% мужчины) с болезнью Крона в стадии клинической ремиссии, но с высоким риском рецидивирования. Лабораторные показатели отражали наличие хронического воспалительного процесса. Критерии исключения: возраст 18 или 75 лет; прием мезаламина, сульфасалазина или кортикостероидов в течение предшествующих 3 месяцев, а иммуносупрессивных препаратов - в течение предшествующих 6 месяцев. Лечение Больные получали 2-3 раза/сут DIM в капсулах по 50 мг (пример 2, пункт Б) или плацебо. Критерии оценки Частота рецидивов и длительность ремиссии. Рецидив определялся по повышению индекса активности болезни Крона по сравнению с базисным уровнем на 100 пунктов и его удержанию на уровне 150 баллов в течение 2 недель. Основные результаты Лечение DIM в капсулах по 50 мг снизило частоту рецидивов по сравнению с плацебо (28 и 69% соотв.; р 0,001). Вывод Лечение DIM в капсулах по 50 мг снижает частоту рецидивов и поддерживает ремиссию при болезни Крона в тех случаях, когда клинические проявления заболевания отсутствуют, но содержание в крови маркеров воспаления повышено. Пример 8. Исследование концентрации DIM в плазме крови пациентов. Во всех клинических исследованиях проводилось сравнение эффективности DIM-HB и кристаллического DIM в равных дозировках. Во всех исследуемых группах пациентов установлена выраженная положительная динамика при приеме DIM-HB и отсутствие таковой при приеме кристаллического DIM. Вероятно, эти отличия обусловлены достижением эффективных терапевтических концентрацийDIM в периферической крови и тканях мишенях при лечении DIM-HB. Результаты измерений этих параметров представлены в табл.3. Таблица 3 Как следует из наших наблюдений, устойчивые клинические эффекты достигнуты при леченииDIM-HB в дозировке 100 мг в день. При этом концентрация DIM в плазме при приеме 100 мг DIM-HB составила более 300 нг/мл. Пример 9. Применение DIM-HB у женщин с гиперпластическими процессами в эндометрии. В исследовании принимали участие 32 пациентки, средний возраст которых 47,31,53 лет, отказавшиеся от гормональной терапии и у которых отсутствовали показания к хирургическому лечению. Больные получали DIM-HB по 50 мг 2 раза в сутки в течение 6 месяцев. Оценка эффективности проводилась через 3 месяца и 6 месяцев по клиническим данным, определению уровня гормонов, УЗИ, РДВ и пайпель-биопсия эндометрия. Результаты представлены в табл.4. Пример 10. Результаты клинических исследований эффективности DIM-HB при лечении больных с сочетанной патологией аденомиоз + миома матки. В исследовании участвовало 72 пациентки с длительностью заболевания 10 лет, средний возраст которых составил 38,5 2,7 лет. Отбор пациенток осуществлялся по следующим критериям: 1. Больные с начальными проявлениями заболеваний, отказавшиеся от приема гормональных препаратов. 2. Больные с неэффективной ранее проведенной терапией. 3. Больные с отсутствием показаний для оперативного лечения. Лечение проводилось DIM-HB по 50 мг 2 раза в день в течение 6 месяцев. Динамика клинических симптомов у пациенток с сочетанной патологией аденомиоз и миома матки после шести месяцев лечения представлены в табл. 5. Таблица 5 Пример 11. Изменение уровня молекулярных маркеров в узлах миомы матки после применения DIM-HB по сравнению с контролем. В исследовании принимали участие 24 пациентки с показаниями к оперативному лечению, но операция по различным причинам отсрочена. Длительность приема DIM-HB по 50 мг 2 раза в день составила 3,5 месяца. Результаты иммуногистохимических исследований (оценка в баллах полуколичественным методом по проценту окрашенных клеток (Colvin R et al, 1995) (р 0,05 представлены в табл.6. подсчет процента окрашенных ядер на 3000 клетокподсчет процента выявленных апоптозных телец на 3000 клеток Пример 12. Изучение результативности лечения лиц с патологией щитовидной железы препаратом на основеDIM-HB. Для этого проведен клинико-биохимический анализ эффективности лечения 138 больных. В I группу вошли больные, получавшие терапию препаратом на основе DIM-HB в дозировках 10-100 мг в день. Во вторую группу вошли больные, получавшие лечение в соответствии с принятыми стандартами. Эффективность лечения больных в группе I препаратом на основе DIM-HB отображена в табл. 7. Таблица 7 Анализ эффективности лечения в 1-й группе продемонстрировал улучшение всех показателей. В тех случаях гипотиреоза, где больные (до момента обращения к врачу) принимали стандартную терапию,лечение препаратом DIM-HB позволило постепенно отменить или значительно снизить дозу L-тироксина(его аналогов). Эффективность лечения больных в группе II (стандартная терапия) отображена в табл.8. Выводы Прием препаратов на основе DIM-HB как самостоятельный метод лечения патологии щитовидной железы позволяет достичь положительных клинических результатов; эффективность их подтверждается лабораторными и инструментальными методами исследования. Преимущество лечения этими препаратами патологии щитовидной железы заключается в достижении стойкого клинического результата, без ухудшения со стороны других органов (отсутствие побочного действия). С помощью этих препаратов можно достичь положительной динамики в лечении гипотиреоза(при постепенной отмене или снижении доз заместительной терапии); во многих случаях избежать оперативного вмешательства, нормализуя структуру и функцию щитовидной железы в случаях диффузного токсического зоба и узловатого зоба. Пример 13. Противорецидивирующая терапия респираторного папилломатоза гортани препаратом на основе DIM-HB. Раствор по примеру 2, п.Д на основе DIM-HB назначали в дозировке 1 мг на 1 кг веса ребенка. Препарат вводили в 1-3 приема, во время еды. Длительность лечения составляла не менее 12 недель. Терапию начинали после очередного удаления папиллом. Анализировали длительность межрецидивного периода до и после назначения препарата. Эффективность лечения оценивали по критериям: длительная ремиссия (прекращение роста папиллом в течение 2 лет и более); увеличение межрецидивного периода (увеличение временного интервала между операциями по удалению папиллом в 1,5 раза и более от исходного); отсутствие эффекта (временной интервал между операциями не изменялся или увеличивался менее чем в 1,5 раза от исходного). Критериями исключения из исследования явились самостоятельное прекращение приема препарата на основе DIM-HB (2 больных) и недостаточный срок наблюдения (у 7 больных длительность наблюдения от начала приема препарата до проведения анализа результатов лечения была меньше длительности исходного межрецидивного периода). Таким образом, анализу подвергнуты результаты противорецидивной терапии РРП при помощи препарата у 46 больных. Первые симптомы заболевания у этих 46 пациентов возникли в возрасте от 1 до 156 мес. (в среднем - 44,729,38 мес). Возраст первой операции по удалению папиллом составлял от 2 до 162 мес. (в среднем - 56,729,26 мес). До начала терапии препаратом детям было проведено от 2 до 64 операций по удалению папиллом (в среднем - 13,49,01). Длительность межрецидивного периода до лечения препаратом составляла от 2 нед. до 12 мес. (в среднем - 5,62,26 мес). Возраст на момент начала терапии составлял от 2 до 14 лет (в среднем - 8,93,49 лет). Результаты Выраженный положительный эффект противорецидивной терапии препаратом получен у 41(89,1%) больных, в том числе у 21 (45,6%) - достигнута длительная (от 2 лет до 3 лет 10 мес. наблюдения) ремиссия, а у 20 (43,4%) - увеличение длительности межрецидивного периода в 1,5-6 раз. Ни в одном случае не наблюдали каких-либо побочных эффектов от проводимой терапии. Пример 14. Активность в отношении хламидийного цервицита. Для проверки были отобраны 30 женщин с диагнозом "хламидийный цервицит". Одной группе (15 человек) проводили стандартную терапию антибиотиками (Сумамед по 250 мг, 2 раза в день). Другой группе (15 человек) дополнительно назначали DIM по 50 мг (пример 2, пункт Б), 3 раза в день. После 30 дней лечения пробы из цервикального канала исследовали методом ПЦР на наличие Clamydia Trachomatis. В первой группе отрицательный результат лабораторного тестирования был получен у 9 женщин,тогда как во второй группе у 14 женщин не выявлялась Clamydia Trachomatis. Вывод: введение в схему лечения хламидийных цервицитов препаратов на основе DIM с повышенной биодоступностью позволит индуцировать апоптотическую гибель инфицированных клеток, что приведет к увеличению эффективности проводимой терапии. Пример 15. Исследование стабильности лекарственных форм DIM полученных по технологии, описанной в примере 1. Для получения лекарственных форм использовали мягкие желатиновые капсулы и твердые желатиновые капсулы "Licaps". Капсулы хранили при комнатной температуре и через определенные интервалы времени определяли количество активного вещества DIM методом хроматографии высокого давления. Результаты проведенного исследования представлены в табл.9. Таблица 9 Как следует из полученных данных, в твердых желатиновых кансулах "Licaps" содержание активного вещества DIM остается без изменений, тогда как в мягких желатиновых капсулах наблюдается снижение концентрации вещества DIM вследствие его окисления. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лекарственное средство для лечения гиперпластических и воспалительных заболеваний человека, содержащее 3,3'-дииндолилметан в качестве активного начала и носитель, отличающееся тем, что оно представляет собой раствор, содержащий в качестве носителя смесь рыбьего жира и по меньшей мере одного полисорбата при следующем содержании компонентов, мас.%: 3,3'-дииндолилметан - 1-20; рыбий жир - 10-20; полисорбат - остальное. 2. Лекарственное средство по п.1, отличающееся тем, что оно расфасовано во флаконы из темного стекла. 3. Лекарственное средство по п.1, отличающееся тем, что оно расфасовано в твердые желатиновые капсулы, покрытые гидроксипропилметилцеллюлозой или ее фталатом. 4. Применение лекарственного средства по любому из пп.1-3 для лечения гиперпластических и воспалительных заболеваний человека. 5. Применение по п.4, где средство вводят из расчета 0,5-2 мг 3,3'-дииндолилметана на кг веса пациента. 6. Применение по п.4, где указанное заболевание представляет собой заболевание, выбранное из группы: миома, аденомиоз, гиперплазия щитовидной железы, атопический дерматит, болезнь Крона, папилломатоз гортани и хламидийные цервициты.
МПК / Метки
МПК: A61P 35/00, A61K 9/14, A61P 37/00, A61K 9/20, A61K 31/404, A61K 9/48, A61K 9/107, A61K 47/30
Метки: основе, биодоступностью, повышенной, воспалительных, лекарственное, использование, человека, лечении, заболеваний, dim, гиперпластических, дииндолилметана, средство
Код ссылки
<a href="https://eas.patents.su/14-19701-lekarstvennoe-sredstvo-na-osnove-diindolilmetana-dim-s-povyshennojj-biodostupnostyu-i-ego-ispolzovanie-v-lechenii-giperplasticheskih-i-vospalitelnyh-zabolevanijj-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственное средство на основе дииндолилметана (dim) с повышенной биодоступностью и его использование в лечении гиперпластических и воспалительных заболеваний человека</a>