Производные индолинона и способ их получения
Формула / Реферат
1. Соединение формулы
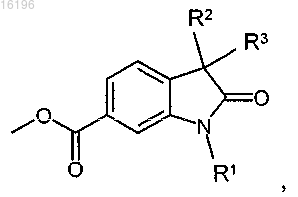 в которой R1 обозначает атом водорода или Cl-СН2-СО-группу, а R2 и R3, каждый, обозначают атом водорода или R2 и R3 вместе представляют собой
в которой R1 обозначает атом водорода или Cl-СН2-СО-группу, а R2 и R3, каждый, обозначают атом водорода или R2 и R3 вместе представляют собой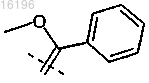 -группу, при условии, что, если R1 обозначает атом водорода, то R2 и R3 вместе представляют собой
-группу, при условии, что, если R1 обозначает атом водорода, то R2 и R3 вместе представляют собой
-группу.
2. Соединение формулы
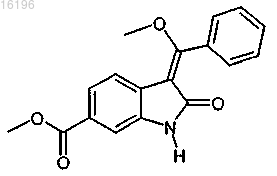
3. Соединение формулы
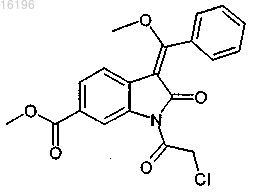
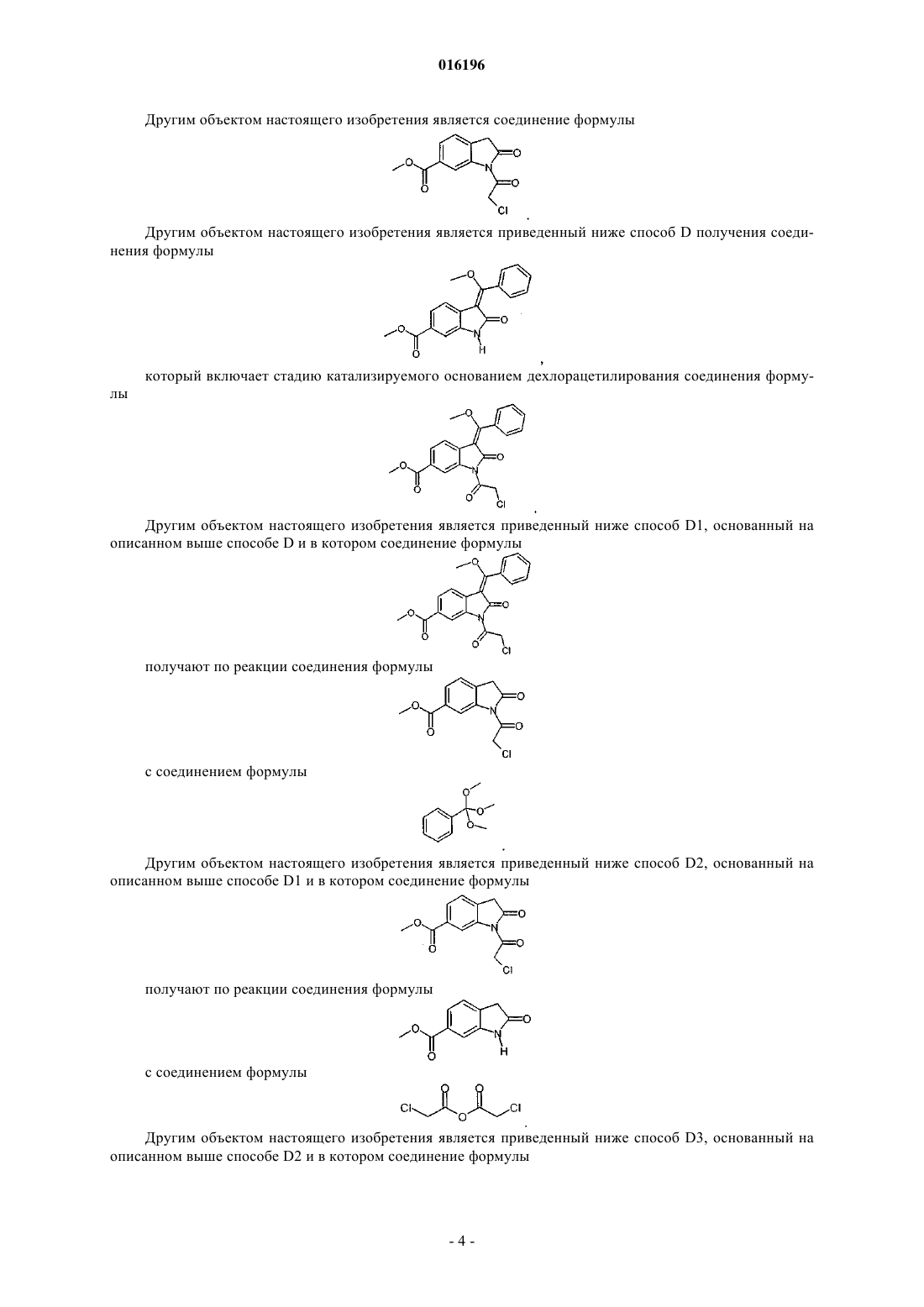
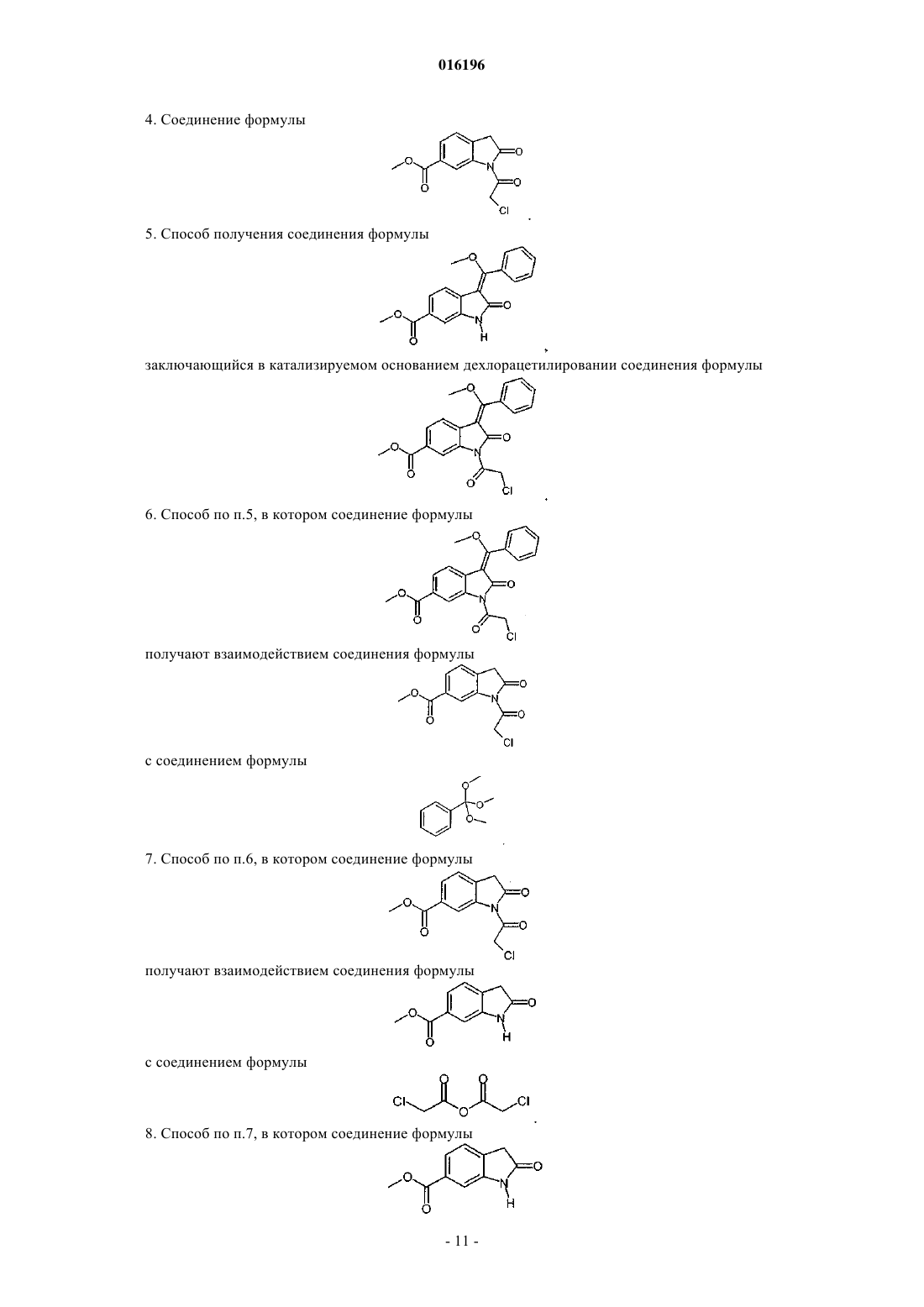
4. Соединение формулы
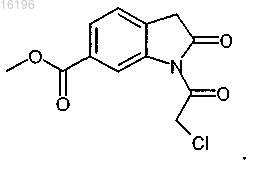
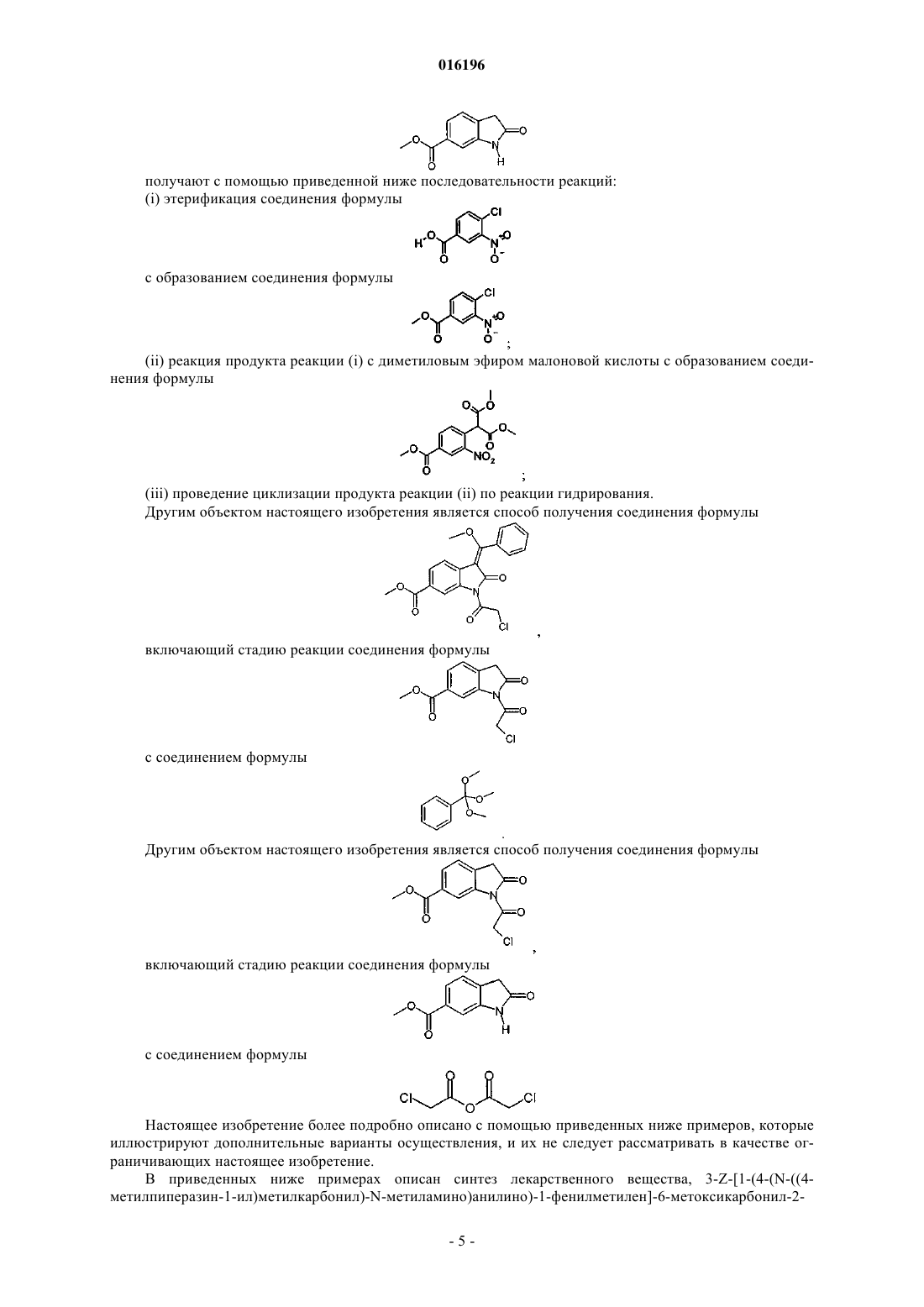
5. Способ получения соединения формулы
заключающийся в катализируемом основанием дехлорацетилировании соединения формулы
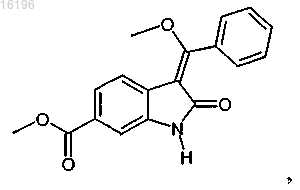
6. Способ по п.5, в котором соединение формулы
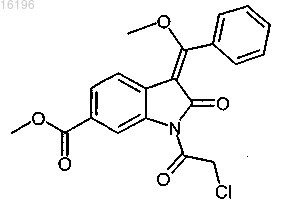
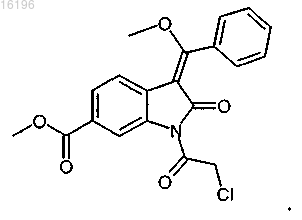
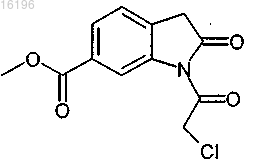
получают взаимодействием соединения формулы
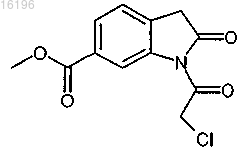
с соединением формулы
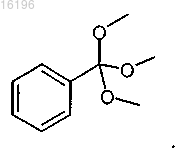
7. Способ по п.6, в котором соединение формулы
получают взаимодействием соединения формулы
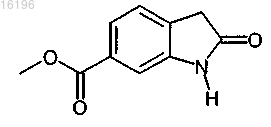
с соединением формулы

8. Способ по п.7, в котором соединение формулы
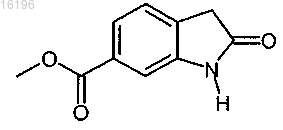
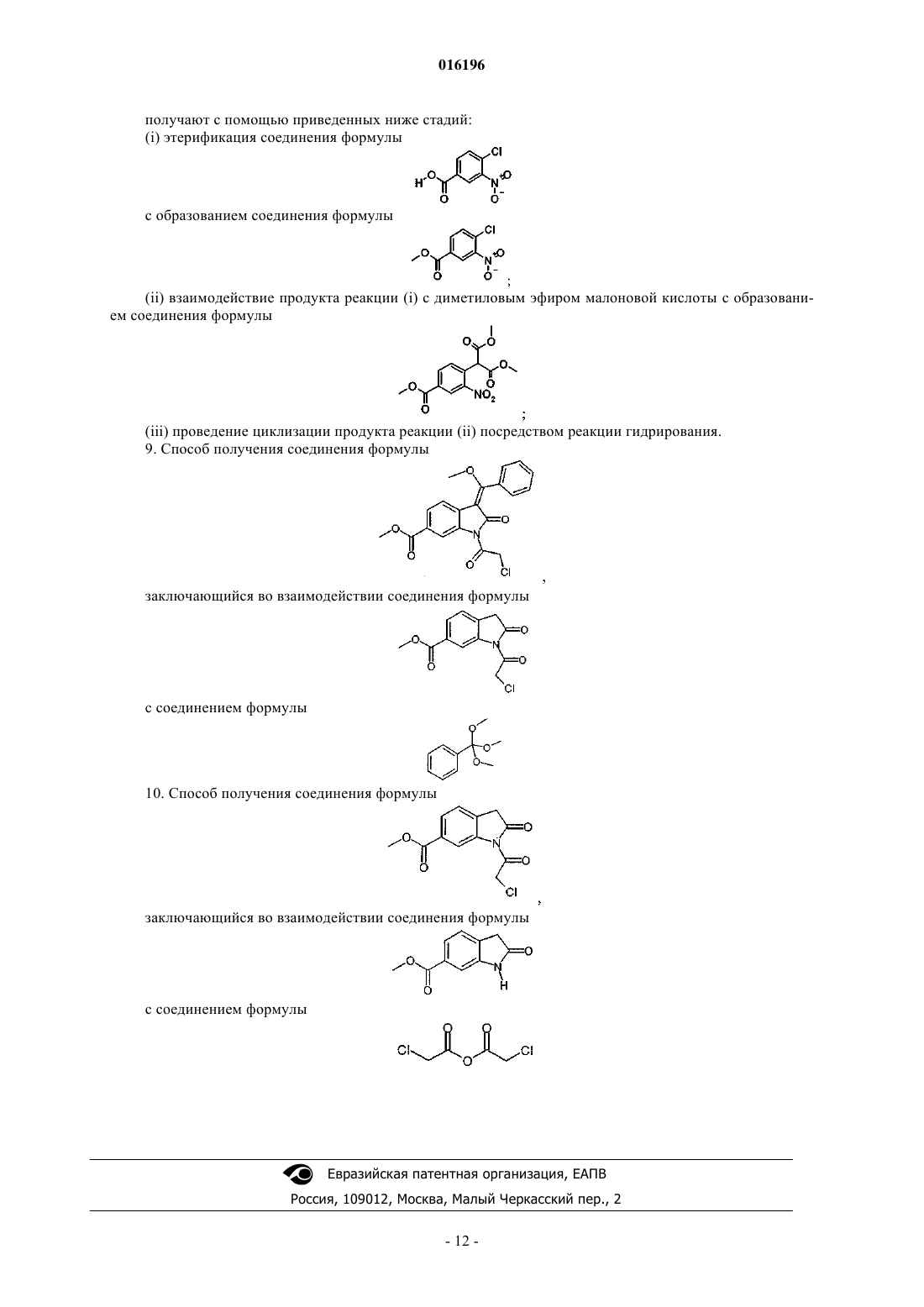
получают с помощью приведенных ниже стадий:
(i) этерификация соединения формулы
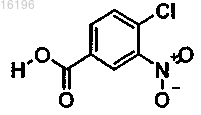
с образованием соединения формулы
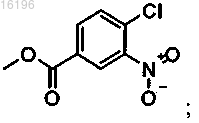
(ii) взаимодействие продукта реакции (i) с диметиловым эфиром малоновой кислоты с образованием соединения формулы
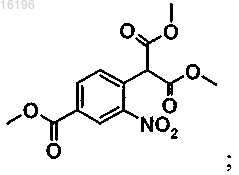
(iii) проведение циклизации продукта реакции (ii) посредством реакции гидрирования.
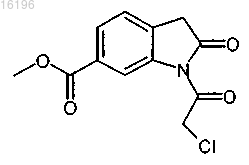
9. Способ получения соединения формулы
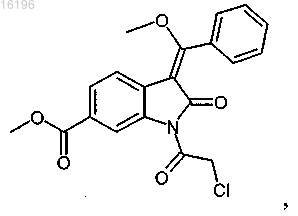
заключающийся во взаимодействии соединения формулы
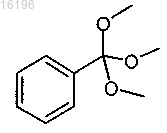
с соединением формулы
10. Способ получения соединения формулы
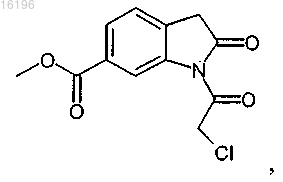
заключающийся во взаимодействии соединения формулы
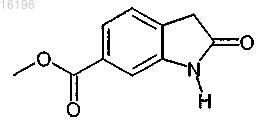
с соединением формулы
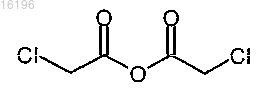
Текст
В изобретении описаны особые производные индолинона, а именно соединения формулы в которой R1 обозначает атом водорода или Сl-СН 2-СО-группу, а R2 и R3, каждый, обозначают атом водорода или R2 и R3 вместе представляют собой(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) обозначает атом водорода, то R2 и R3 вместе представляют собой их получения. 016196 Настоящее изобретение относится к особым производным индолинона, а именно к соединениям формулы в которой R1 обозначает атом водорода или Cl-СН 2-СО-группу, а R2 и R3, каждый, обозначают атом водорода или R2 и R3 вместе представляют собой-группу, и к способу их получения. Указанные выше производные индолинона являются промежуточными продуктами, пригодными для синтеза лекарственных веществ, таких как раскрыты, например, в следующих заявках: WO 01/027081, WO 04/013099, WO 04/017948, WO 04/096224 и WO 06/067165. В этих заявках раскрыты лекарственные вещества и использование этих лекарственных веществ или их фармацевтически приемлемых солей в фармацевтической композиции, предназначенной для лечения онкологических или неонкологических заболеваний путем подавления пролиферации клеток-мишеней, по отдельности или в комбинации с другими терапевтическими средствами. Механизм действия, по которому происходит пролиферация клеток-мишеней, по существу, представляет собой механизм ингибирования различных рецепторов тирозинкиназы и, в частности, ингибирование рецептора сосудистого эндотелиального фактора роста(РСЭФР). Хотя в указанных выше заявках уже описан способ получения лекарственных веществ, объектом настоящего изобретения является новый и улучшенный способ получения промежуточных продуктов,пригодных для синтеза указанных лекарственных веществ. Таким образом, по сравнению со способами,уже описанными в предшествующем уровне техники, способ, предлагаемый в настоящем изобретении,наряду с другими обладает указанными ниже примечательными преимуществами. Первым преимуществом является более высокий общий выход, который можно обеспечить с помощью нового и улучшенного способа. Этот более высокий общий выход означает повышение общей эффективности способа. Это также влечет за собой экономическое преимущество. Вторым преимуществом является то, что новый и улучшенный способ, предлагаемый в настоящем изобретении, является менее вредным для окружающей среды, чем способы, известные из предыдущего уровня техники. Это преимущество основано на том факте, что стадии способа проводят при более высоких концентрациях. Третьим преимуществом, которое можно отметить, является применимость нового и улучшенного способа, предлагаемого в настоящем изобретении, для крупномасштабного производства. Эта применимость характеризуется наличием надежных стадий реакций, т.е. стадий реакций, менее чувствительных к количествам исходных веществ. Эти преимущества обеспечивают необходимую высокую чистоту активного фармацевтического ингредиента. Способ, предлагаемый в настоящем изобретении, представлен на приведенной ниже общей схеме синтеза 1. Общая схема синтеза 1-1 016196 В настоящем изобретении используют приведенную ниже номенклатуру. Таким образом, способ, предлагаемый в настоящем изобретении, включает приведенные ниже стадии реакций.I. Синтез 6-метоксикарбонил-2-оксиндола. 6-Метоксикарбонил-2-оксиндол можно синтезировать способами, описанными на приведенных ниже схемах синтеза А или В. Эти способы описаны в предшествующем уровне техники. Схема синтеза А Таким образом, 6-метоксикарбонил-2-оксиндол можно получить по трехстадийной методике,включающей этерификацию 3-нитробензойной кислоты с последующим электрофильным замещением с использованием метилового эфира хлоруксусной кислоты, что приводит к образованию метилового эфира 4-метоксикарбонилметил-3-нитробензойной кислоты, и конечную последовательность реакций гидрирования-внутримолекулярного амидирования. Схема синтеза В 6-Метоксикарбонил-2-оксиндол также можно получить по описанной выше четырехстадийной методике. Сначала проводят удлинение цепи 4-метил-3-нитробензонитрила и восстановительную циклизацию полученной (4-циано-2-нитрофенил)уксусной кислоты с образованием оксиндольного ядра, синтез заканчивают омылением нитрильной группы и последующей этерификацией карбоксильной функциональной группы. Альтернативно, 6-метоксикарбонил-2-оксиндол также можно синтезировать способом синтеза 2 оксиндолов, описанным в патенте US 6469181. Альтернативно, 6-метоксикарбонил-2-оксиндол можно синтезировать способом, описанным на приведенной ниже схеме синтеза С. Схема синтеза С Стадии реакций схемы синтеза С, которые также являются объектом настоящего изобретения, дополнительно описаны в приведенном ниже экспериментальном примере 1, который не следует рассматривать в качестве ограничивающего настоящее изобретение.IIa. Реакция 6-метоксикарбонил-2-оксиндола с ангидридом хлоруксусной кислоты с образованием"хлоримида" (метил-1-(хлорацетил)-2-оксоиндолин-6-карбоксилата). Реакцию 6-метоксикарбонил-2-оксиндол с ангидридом хлоруксусной кислоты или другим соответствующим образом активированным производным хлоруксусной кислоты, например хлорацетилхлоридом, предпочтительно проводят в высококипящем апротонном растворителе, например толуоле, ксилоле или бутилацетате, при температуре в диапазоне от примерно 80 до примерно 130 С. Кристаллизацию инициируют путем добавления неполярного растворителя, например циклогексана или метилциклогексана, при температуре в диапазоне от примерно 80 до примерно 100 С и заканчивают при температуре в диапазоне от примерно -5 С до комнатной температуры. Твердое вещество собирают, промывают предпочтительно полярными растворителями, такими как спирты, наиболее предпочтительно метанолом, и сушат и получают "хлоримид".-2 016196 Алкилирующие реагенты, такие как хлорацетилхлорид или ангидрид хлоруксусной кислоты, можно приобрести у различных фирм-поставщиков. Фирмой-поставщиком больших количеств ангидрида хлоруксусной кислоты является, например, SF-Chem (Switzerland). Описанная выше стадия реакции IIa и продукт этой реакции, т.е. "хлоримид" (метил-1(хлорацетил)-2-оксоиндолин-6-карбоксилат), также являются объектом настоящего изобретения.IIb. Реакция "хлоримида" с триметилортобензоатом с образованием "хлоренола" (метил-1(хлорацетил)-3-[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата). Реакцию метил-1-(хлорацетил)-2-оксоиндолин-6-карбоксилата с триметилортобензоатом проводят в высококипящем апротонном растворителе, таком как бутилацетат, N,N-диметилформамид, ксилол или предпочтительно толуол, при температуре в диапазоне от примерно 100 до примерно 140 С. Реакции содействуют связывающие метанол реагенты, такие как уксусный ангидрид. В ходе реакции летучие вещества можно отгонять с заменой удаленных веществ на используемый в реакции растворитель или без такой замены. Кристаллизацию заканчивают при температуре в диапазоне от температуры окружающей среды примерно до -10 С. Твердое вещество собирают и промывают, предпочтительно растворителями,такими как толуол, ксилол и/или этилацетат. После сушки получают "хлоренол". Уксусный ангидрид можно приобрести у различных фирм-поставщиков. Триметилортобензоат можно приобрести у фирмы AMI DrugsSpeciality Chemicals India Inc. Описанная выше стадия реакции IIb и продукт этой реакции, т.е. "хлоренол" (метил-1-(хлорацетил)3-[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилат), также являются объектом настоящего изобретения.IIc. Реакция "хлоренола" с основаниями с образованием "енолидола" (метил-3[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата). Катализируемое основанием дехлорацетилирование метил-1-(хлорацетил)-3[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата проводят в протонных растворителях, таких как спирты, например изопропанол или предпочтительно метанол, при температуре в диапазоне примерно от 70 С до температуры окружающей среды. В качестве катализаторов можно использовать неорганические основания, такие как гидроксиды щелочных металлов, или органические основания, такие как метоксид натрия. Кристаллизацию заканчивают при температуре в диапазоне от температуры окружающей среды примерно до -10 С. Твердое вещество собирают и промывают предпочтительно спиртами,наиболее предпочтительно метанолом. После сушки получают "енолидол". Описанная выше стадия реакции IIc и продукт этой реакции, т.е. "енолидол" (метил-3[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилат), также являются объектом настоящего изобретения. Таким образом, первым объектом настоящего изобретения является соединение формулы в которой R1 обозначает атом водорода или Cl-СН 2-СО-группу и R2 и R3 все обозначают атом водорода или R2 и R3 вместе обозначают-группу. да, то R2 и R3 вместе обозначают Другим объектом настоящего изобретения является соединение формулы Другим объектом настоящего изобретения является соединение формулы-3 016196 Другим объектом настоящего изобретения является соединение формулы Другим объектом настоящего изобретения является приведенный ниже способ D получения соединения формулы который включает стадию катализируемого основанием дехлорацетилирования соединения формулы Другим объектом настоящего изобретения является приведенный ниже способ D1, основанный на описанном выше способе D и в котором соединение формулы получают по реакции соединения формулы Другим объектом настоящего изобретения является приведенный ниже способ D2, основанный на описанном выше способе D1 и в котором соединение формулы получают по реакции соединения формулы Другим объектом настоящего изобретения является приведенный ниже способ D3, основанный на описанном выше способе D2 и в котором соединение формулы получают с помощью приведенной ниже последовательности реакций:(ii) реакция продукта реакции (i) с диметиловым эфиром малоновой кислоты с образованием соединения формулы(iii) проведение циклизации продукта реакции (ii) по реакции гидрирования. Другим объектом настоящего изобретения является способ получения соединения формулы включающий стадию реакции соединения формулы Другим объектом настоящего изобретения является способ получения соединения формулы включающий стадию реакции соединения формулы Настоящее изобретение более подробно описано с помощью приведенных ниже примеров, которые иллюстрируют дополнительные варианты осуществления, и их не следует рассматривать в качестве ограничивающих настоящее изобретение. В приведенных ниже примерах описан синтез лекарственного вещества, 3-Z-[1-(4-(N-4 метилпиперазин-1-ил)метилкарбонил)-N-метиламино)анилино)-1-фенилметилен]-6-метоксикарбонил-2-5 016196 индолинона, раскрытого в WO 01/027081, WO 04/013099, WO 04/017948, WO 04/096224 и WO 06/067165. Этот синтез осуществляют в соответствии с приведенной ниже общей схемой синтеза 2. Общая схема синтеза 2 На приведенной выше общей схеме синтеза 2 и в приведенных ниже примерах используют приведенную ниже номенклатуру. Пример 1. Синтез 6-метоксикарбонил-2-оксиндола способом, описанным на схеме синтеза С. Синтез метилового эфира 4-хлор-3-нитробензойной кислоты. 20 кг 4-хлор-3-нитробензойной кислоты (99,22 моль) суспендируют в 76 л метанола. В течение 15 мин добавляют 5,9 кг тионилхлорида (49,62 моль) и смесь кипятят с обратным холодильником в течение примерно 3 ч. После охлаждения примерно до 5 С продукт выделяют центрифугированием и сушат при 45 С. Выход: 19,0 кг (88,8% от теоретического). Чистота (ВЭЖХ (высокоэффективная жидкостная хроматография: 99,8%. Синтез диметилового эфира [4-(метоксикарбонил)-2-нитрофенил]пропандикарбоновой кислоты. 12,87 кг диметилового эфира малоновой кислоты (97,41 моль) добавляют к горячему (75 С) раствору 10,73 кг трет-амилата натрия (97,41 моль) в 35 л 1-метил-2-пирролидинона (NMP). При 75 С добавляют раствор 10 кг метилового эфира 4-хлор-3-нитробензойной кислоты (46,38 моль) в 25 л 1-метил-2 пирролидинона. После перемешивания при температуре, равной примерно 75 С, в течение 1,5 ч и охлаждения до 20 С смесь подкисляют до рН 1 с помощью 100 л разбавленной хлористо-водородной кислоты. После перемешивания при температуре, равной примерно 5 С, в течение 1,5 ч продукт выделяют центрифугированием и сушат при 40 С. Выход: 13,78 кг (95,4% от теоретического).-6 016196 Чистота (ВЭЖХ): 99,9%. Синтез 6-метоксикарбонил-2-оксиндола. Раствор 13 кг диметилового эфира [4-(метоксикарбонил)-2-нитрофенил]пропандикарбоновой кислоты (41,77 моль) в 88 л уксусной кислоты гидрируют в присутствии 1,3 кг 10% Pd/C при 45 С и давлении, равном 40-50 фунт-сила/дюйм. После остановки гидрирования реакционную смесь нагревают при 115 С в течение 2 ч. Катализатор отфильтровывают и при температуре, равной примерно 50 С, добавляют 180 л воды. Продукт выделяют после охлаждения до 5 С, центрифугирования и сушки при 50 С. Выход: 6,96 кг (87,2% от теоретического). Чистота (ВЭЖХ): 99,8%. Пример 2. Синтез "хлоримида" (метил-1-(хлорацетил)-2-оксоиндолин-6-карбоксилата) Методика 1. 6-Метоксикарбонил-2-оксиндол (400 г; 2,071 моль) при комнатной температуре суспендируют в толуоле (1200 мл). К этой суспензии добавляют ангидрид хлоруксусной кислоты (540 г; 3,095 моль). Смесь кипятят с обратным холодильником в течение 3 ч, затем охлаждают до 80 С и в течение 30 мин добавляют метилциклогексан (600 мл). Затем полученную суспензию в течение 60 мин охлаждают до комнатной температуры. Маточный раствор отделяют и твердое вещество промывают охлажденным льдом метанолом (400 мл). Кристаллы сушат и получают 515,5 г (93,5%) "хлоримида" в виде белого твердого вещества. 1 Н-ЯМР (ядерный магнитный резонанс) (500 МГц, ДМСО-d6) : 8,66 (s, 1 Н, 6-Н); 7,86 (d, J=8,3 Гц, 1 Н, 8-Н); 7,52 (d, J=8,3 Гц, 1 Н, 9-Н); 4,98 (s, 2 Н, 15-Н 2); 3,95 (s, 3 Н, 18-Н 3); 3,88 (s, 2 Н, 3-Н 2). 13 СЯМР (126 МГц, ДМСО-d6) : 174,7 (С-2); 36,0 (С-3); 131,0 (С-4); 140,8 (С-5); 115,7 (С-6); 128,9 (С-7); 126,1 (С-8); 124,6 (С-9); 166,6 (С-10); 165,8 (С-13); 46,1 (С-15); 52,3 (С-18). МС (масс-спектроскопия): m/z 268 (М+Н)+. Анализ: рассчитано для C12H10ClNO4: С, 53,85; Н, 3,77; Cl, 13,25; N, 5,23. Найдено: С, 52,18; Н, 3,64; Cl, 12,89; N, 5,00. Методика 2. 6-Метоксикарбонил-2-оксиндол (10 г; 0,052 моль) при комнатной температуре суспендируют в нбутилацетате (25 мл). К этой суспензии в течение 3 мин добавляют раствор ангидрида хлоруксусной кислоты (12,8 г; 0,037 моль) в н-бутилацетате (25 мл). Смесь кипятят с обратным холодильником в течение 2 ч, затем охлаждают до 85 С и добавляют метилциклогексан (20 мл). Затем полученную суспензию охлаждают до комнатной температуры и перемешивают в течение еще 2 ч. Маточный раствор отделяют и твердое вещество при температуре окружающей среды промывают метанолом (400 мл). Кристаллы сушат и получают 12,7 г (91,5%) "хлоримида" в виде желтоватого твердого вещества. Пример 3. Синтез "хлоренола" (метил-1-(хлорацетил)-3-[метокси(фенил)метилен]-2-оксоиндолин-6 карбоксилата) Методика 1. Метил-1-(хлорацетил)-2-оксоиндолин-6-карбоксилат (12,0 г; 0,045 моль) при температуре окружающей среды суспендируют в толуоле (60 мл). К этой суспензии добавляют уксусный ангидрид (16,2 г; 0,157 моль). Смесь нагревают до температуры, равной не ниже 104 С, и в течение 60 мин добавляют триметилортобензоат (20,0 г; 0,108 моль). В ходе добавления и последующего перемешивания при такой же температуре в течение 3 ч содержащиеся в реакционной смеси летучие вещества отгоняют. Концентрацию реакционной смеси поддерживают постоянной путем замены отогнанных веществ толуолом (40 мл). Смесь охлаждают до 5 С, перемешивают в течение еще 1 ч и фильтруют. Твердое вещество последовательно промывают толуолом (14 мл) и смесью толуола (8 мл) и этилацетата (8 мл). После сушки выделяют 16,3 г (91,7%) "хлоренола" в виде желтоватых кристаллов. 1 Н-ЯМР (500 МГц, ДМСО-d6) : 8,73(С-6); 126,1 (С-8); 122,5 (С-9); 166,7 (С-10); 173,4 (С-13); 58,4 (С-15); 46,4 (С-18); 128,6 (С-21 + С-22 + С-7 016196 24 + С-25); 130,5 (С-23); 52,2 (С-27). МС: m/z 386 (М+Н)+. Анализ: рассчитано для C20H16ClNO5: С, 62,27; Н, 4,18; Cl, 9,19; N, 3,63. Найдено: С, 62,21; Н, 4,03; Cl, 8,99; N, 3,52. Методика 2. Метил-1-(хлорацетил)-2-оксоиндолин-6-карбоксилат при температуре окружающей среды (12,0 г; 0,045 моль) суспендируют в ксилоле (60 мл). К этой суспензии добавляют уксусный ангидрид (16,2 г; 0,157 моль). Смесь кипятят с обратным холодильником, в течение 40 мин добавляют триметилортобензоат (20,0 г; 0,108 моль) и нагревание продолжают в течение еще 4 ч. Смесь охлаждают до 0 С и маточный раствор отделяют. Твердое вещество последовательно промывают ксилолом (14 мл) и смесью ксилола (8 мл) и этилацетата (8 мл). После сушки выделяют 14,3 г (81,0%) "хлоренола" в виде желтых кристаллов. Методика 3. Метил-1-(хлорацетил)-2-оксоиндолин-6-карбоксилат (12,0 г; 0,045 моль) при температуре окружающей среды суспендируют в толуоле (60 мл). К этой суспензии добавляют уксусный ангидрид (16,2 г; 0,157 моль). Смесь кипятят с обратным холодильником, в течение 40 мин добавляют триметилортобензоат (20,0 г; 0,108 моль) и нагревание продолжают в течение еще 3 ч. Смесь охлаждают до 0 С и маточный раствор отделяют. Твердое вещество последовательно промывают толуолом (14 мл) и смесью толуола (8 мл) и этилацетата (8 мл). После сушки выделяют 15,3 г (87,3%) "хлоренола" в виде бежевых кристаллов. Пример 4. Синтез "енолидола" (метил-3-[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата) Методика 1. Раствор гидроксида калия (0,41 г, 0,006 моль) в метаноле (4 мл) при 63 С добавляют к суспензии метил-1-(хлорацетил)-3-[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата (8,0 г; 0,020 моль) в метаноле (32 мл). Затем смесь перемешивают в течение 30 мин, охлаждают до 0 С и перемешивание продолжают в течение 2 ч. После фильтрования твердое вещество промывают метанолом (24 мл), сушат и получают 6,0 г (94,6%) "енолидола" в виде желтых кристаллов. 1 Н-ЯМР (500 МГц, CDCl3) : 8,08 (s, 1 Н, 1-Н); 7,88 (d, J=7,8 Гц, 1 Н, 9-Н); 7,75 (m, 1 Н, 8-Н); 7,52-7,56 (т, 3 Н, 18-Н, 19-Н, 20-Н); 7,40-7,45 (m, 3 Н, 6-Н, 17-Н, 211-Н); 3,92 (s, 3 Н, 23-Н 3); 3,74 (s, 3 Н, 13-Н 3). 13 С-ЯМР (126 МГц, CDCl3) : 168,8 (С-2); 107,4 (С-3); 130,8 (С-4); 138,2 (С-5); 109,4 (С-6); 128,2 и 128,3 (С-7, С-16); 123,5 (С-8); 123,1 (С-9); 170,1(m/z): 310 (М + Н)+. Анализ: рассчитано для C18H15NO4: С, 69,89; Н, 4,89; N, 4,53. Найдено: С, 69,34; Н,4,92; N, 4,56. Методика 2. Суспензию метил-1-(хлорацетил)-3-[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата (7,0 г; 0,018 моль) в метаноле (28 мл) кипятят с обратным холодильником. К этой суспензии в течение 3 мин добавляют раствор метоксида натрия в метаноле (0,24 г, 30% (мас./мас.), 0,001 моль). Затем смесь перемешивают в течение 30 мин, охлаждают до 5 С и перемешивание продолжают в течение 2 ч. После фильтрования твердое вещество промывают метанолом (9 мл), сушат и получают 5,4 г (89,7%) "енолидола" в виде желтых кристаллов. Методика 3. Суспензию метил-1-(хлорацетил)-3-[метокси(фенил)метилен]-2-оксоиндолин-6-карбоксилата (8,0 г; 0,021 моль) в метаноле (32 мл) кипятят с обратным холодильником. К этой суспензии по каплям добавляют раствор метоксида натрия в метаноле (0,74 г, 30% (мас./мас.), 0,004 моль), дополнительно разбавленный метанолом (4 мл). Затем смесь перемешивают в течение 90 мин, охлаждают до 0 С и перемешивание продолжают в течение 2 ч. После фильтрования твердое вещество промывают метанолом (24 мл),сушат и получают 5,9 г (91,2%) "енолидола" в виде желтых кристаллов. Пример 5. Синтез "хлорацетила" (N-(4-нитроанилино)-N-метил-2-хлорацетамида) Методика 1. Суспензию N-метил-4-нитроанилина (140 г; 0,920 моль) в этилацетате (400 мл) нагревают до 70 С. К этой суспензии в течение 90 мин добавляют хлорацетилхлорид (114 г; 1,009 моль). Затем полученный-8 016196 раствор кипятят с обратным холодильником в течение 1 ч, охлаждают до 60 С и добавляют метилциклогексан (245 мл). Затем суспензию охлаждают до 0 С и перемешивают в течение еще 1 ч. Реакционную смесь фильтруют, промывают метилциклогексаном (285 мл) и осадившееся вещество сушат и получают 210,4 г (92,7%) "хлорацетила" в виде белых кристаллов. 1 Н-ЯМР (500 МГц, ДМСО-d6) : 8,29 (d, J=8,5 Гц, 2 Н, 1-Н + 3-Н); 7,69 (d, J=8,5 Гц, 2 Н, 4-Н + 6-Н); 4,35 (s, 2 Н, 9-Н 2); 3,33 (s, 3 Н, 12-Н 3). 13 С-ЯМР (126 МГц, ДМСО-d6) : 124,6 (С-1 + С-3); 145,6 (С-2); 127,4 (С-4 + С-6); 148,6 (С-5); 165,6 (С-8); 42,7 (С-9); 37,2 (С-12). МС (m/z): 229 (М + Н)+. Анализ: рассчитано для C9H9ClN2O3: С, 47,28; Н, 3,97; N, 12,25. Найдено: С, 47,26; Н, 3,99; Cl, 15,73; N, 12,29. Методика 2. Суспензию N-метил-4-нитроанилина (20,0 г; 0,131 моль) в этилацетате (20 мл) нагревают до 60 С. К этой суспензии в течение 15 мин добавляют раствор ангидрида хлоруксусной кислоты (26,0 г; 0,151 моль) в этилацетате (60 мл). Затем полученный раствор кипятят с обратным холодильником в течение 1 ч, охлаждают до 75 С и добавляют метилциклогексан (80 мл). После внесения затравки при 60 С суспензию охлаждают до 0 С и перемешивают в течение еще 1 ч. Реакционную смесь фильтруют, промывают метилциклогексаном (40 мл) и осадившееся вещество сушат и получают 25,9 г (83,3%) "хлорацетила" в виде серых кристаллов. Пример 6. Синтез Методика 1. Суспензию N-(4-нитроанилино)-N-метил-2-хлорацетамида (20,0 г; 0,087 моль) в толуоле (110 мл) нагревают до 40 С. В течение 30 мин по каплям добавляют 1-метилпиперазин (21,9 г; 0,216 моль). После промывки капельной воронки толуолом (5 мл) реакционную смесь перемешивают при 55 С в течение 2 ч, охлаждают до температуры окружающей среды и промывают водой (15 мл). Органический слой разбавляют изопропанолом (100 мл) и добавляют Pd/C (10%; 1,0 г). После последующего гидрирования (Н 2,4 бар) при 20 С катализатор удаляют. Примерно 4/5 объема полученного раствора выпаривают при 50 С. Полученный остаток растворяют в этилацетате (20 мл) и толуоле (147 мл), нагретых до 80 С, затем охлаждают до 55 С и вносят затравку. Затем реакционную смесь охлаждают до 0 С и перемешивают при такой же температуре в течение 3 ч. После фильтрования твердое вещество промывают охлажденным льдом толуолом (40 мл) и сушат и получают 20,2 г (88,0%) "анилина" в виде белых кристаллов. 1 Н-ЯМР(М + Н)+. Анализ: рассчитано для C14H22N4O: С, 64,09; Н, 8,45; N, 21,36. Найдено: С, 64,05; Н, 8,43; N,21,39. Методика 2. Суспензию N-(4-нитроанилино)-N-метил-2-хлорацетамида (14,5 г; 0,063 моль) в этилацетате (65 мл) нагревают до 40 С. В течение 30 мин по каплям добавляют 1-метилпиперазин (15,8 г; 0,156 моль). После промывки капельной воронки этилацетатом (7 мл) реакционную смесь перемешивают при 50 С в течение 90 мин, охлаждают до температуры окружающей среды и промывают водой (7 мл). Органический слой разбавляют изопропанолом (75 мл) и сушат над сульфатом натрия. После отделения твердого вещества добавляют Pd/C (10%; 2,0 г) и раствор гидрируют (Н 2, 5 бар) при температуре окружающей среды без охлаждения. Затем катализатор удаляют фильтрованием и растворитель выпаривают при 60 С. Полученный остаток растворяют в этилацетате (250 мл) и перекристаллизовывают. После фильтрования и сушки выделяют 10,4 г (60,4%) "анилина" в виде белых кристаллов.N-(4-аминофенил)-N-метил-2-(4-метилпиперазин-1-ил)ацетамида (8,6 г; 0,032 моль) в смеси метанола (72 мл) и N,N-диметилформамида (18 мл) кипятят с обратным холодильником. После кипячения с обратным холодильником в течение 7 ч суспензию охлаждают до 0 С и перемешивание продолжают в течение еще 2 ч. Твердое вещество отфильтровывают, промывают метанолом (40 мл) и сушат и получают 15,4 гN-(4-аминофенил)-N-метил-2-(4-метилпиперазин-1-ил)ацетамида (17,1 г; 0,065 моль) в метаноле (180 мл) кипятят с обратным холодильником в течение 7,5 ч. Полученную суспензию в течение 1 ч охлаждают до 10 С и перемешивание продолжают в течение еще 1 ч. После фильтрования твердое вещество промывают охлажденным льдом метанолом (80 мл), сушат и получают 31,0 г (89,0%) "анилино" в виде желтых кристаллов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы в которой R1 обозначает атом водорода или Cl-СН 2-СО-группу, а R2 и R3, каждый, обозначают атом водорода или R2 и R3 вместе представляют собой атом водорода, то R2 и R3 вместе представляют собой 2. Соединение формулы 5. Способ получения соединения формулы заключающийся в катализируемом основанием дехлорацетилировании соединения формулы получают взаимодействием соединения формулы получают взаимодействием соединения формулы- 11016196 получают с помощью приведенных ниже стадий:(ii) взаимодействие продукта реакции (i) с диметиловым эфиром малоновой кислоты с образованием соединения формулы(iii) проведение циклизации продукта реакции (ii) посредством реакции гидрирования. 9. Способ получения соединения формулы заключающийся во взаимодействии соединения формулы 10. Способ получения соединения формулы заключающийся во взаимодействии соединения формулы
МПК / Метки
МПК: C07D 209/34
Метки: получения, производные, способ, индолинона
Код ссылки
<a href="https://eas.patents.su/13-16196-proizvodnye-indolinona-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индолинона и способ их получения</a>
Предыдущий патент: Ингибиторы действия akt
Следующий патент: Рекуперативное теплопередающее устройство
Случайный патент: Устройство, система и способ перемещения в трубном канале