Мутантные белки (мутеины) фактора роста фибробластов 21
Номер патента: 11390
Опубликовано: 27.02.2009
Авторы: Хуан Лихуа, Фрай Кристофер Карл, Миканович Радмила
Формула / Реферат
1. Мутеин человеческого FGF-21, где нумерация аминокислот основана на SEQ ID NO:1, где указанный мутеин представляет собой DHisProIlePro/Leu118Cys/Ala134Cys/Ser167Ala.
2. Способ получения мутеина по п.1, включающий:
(a) трансформирование клетки-хозяина с помощью вектора, содержащего ДНК, кодирующую указанный мутеин;
(b) культивирование указанной клетки-хозяина в среде, подходящей для экспрессии указанного мутеина; и
(c) выделение указанного мутеина из среды культивирования.
3. Фармацевтическая композиция, пригодная для лечения пациента, имеющего одно или несколько из следующих состояний: ожирение, диабет II типа, инсулинорезистентность, гиперинсулинемию, непереносимость глюкозы, гипергликемию или метаболический синдром, содержащая следующее:
(a) терапевтически эффективное количество мутеина FGF-21 по п.1 и
(b) приемлемый фармацевтический носитель.
4. Мутеин человеческого FGF-21 или его биологически активный пептид по п.1 для применения в качестве лекарственного средства.
5. Применение мутеина FGF-21 по п.1 для производства лекарственного средства для лечения пациента, имеющего одно или несколько из следующих состояний: ожирение, диабет II типа, инсулинорезистентность, гиперинсулинемию, непереносимость глюкозы, гипергликемию или метаболический синдром.
Текст
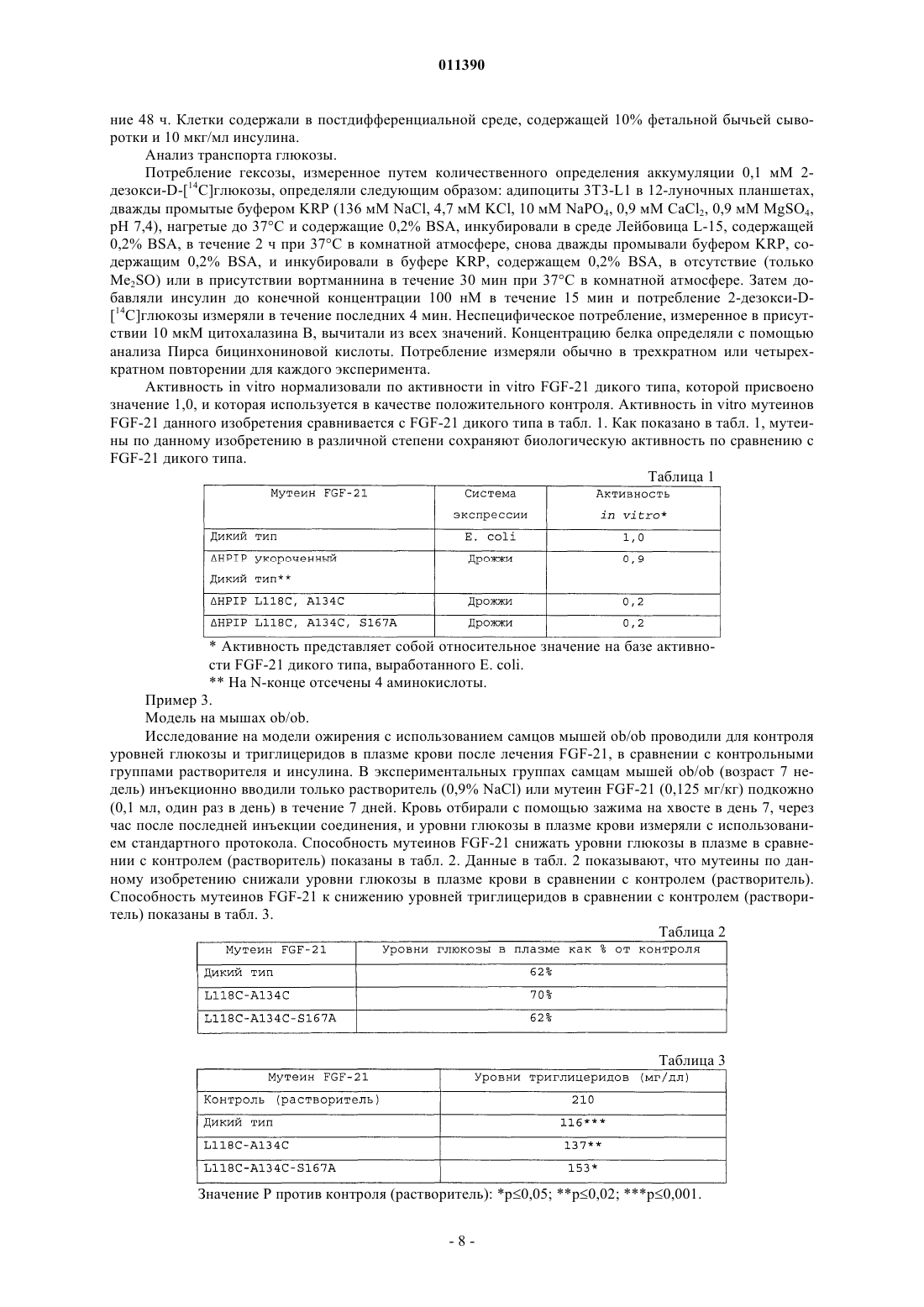
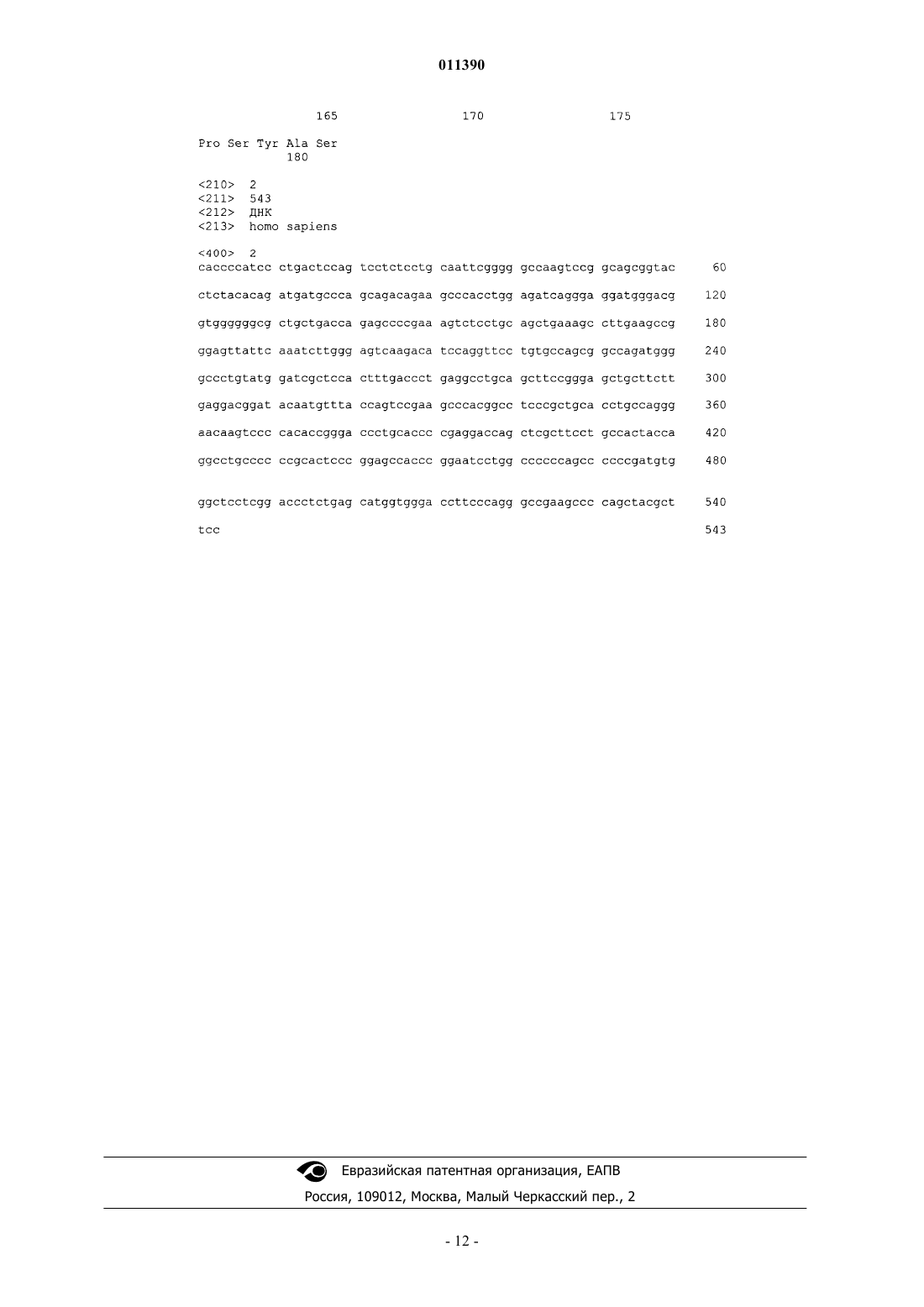
011390 Предпосылки изобретения Область изобретения Данное изобретение относится к идентификации новых мутантных белков (мутеинов) фактора роста фибробластов 21, которые обладают сниженным О-связанным гликозилированием при экспрессии в дрожжах. Уровень техники Факторы роста фибробластов представляют собой полипептиды большого размера, которые широко экспрессируются в растущих и взрослых тканях (Baird et al., Cancer Cells, 3: 239-243, 1991) и играют критическую роль в многочисленных физиологических функциях, включая ангиогенез, митогенез, образование шаблонов, дифференциацию клеток, метаболическое регулирование и восстановление повреждения ткани (McKeehan et al., Prog. Nucleic Acid Res. Mol. Biol. 59: 135-176, 1998). В соответствии с опубликованными данными, семейство FGF в настоящее время состоит по меньшей мере из двадцати трех членов, от FGF-1 до FGF-23 (Reuss et al., Cell Tissue Res. 313: 139-157 (2003. Сообщалось, что факторы роста фибробластов 21 (FGF-21) предпочтительно экспрессируются в печени (Nishimura et al., Biochimica et Biophysica Acta, 1492: 203-206, 2000; WO 01/36640 и WO 01/18172) и описаны в качестве средства для лечения ишемического заболевания сосудов, заживления ран и заболеваний, связанных со снижением клеточной функции легких, бронхов или альвеол и множеством других нарушений. Позже было показано, что FGF-21 стимулирует захват глюкозы адипоцитами мыши 3T3-L1 после длительной обработки (72 ч) в присутствии и в отсутствие инсулина, а также уменьшает уровень глюкозы, триглицеридов и глюкагона в крови натощак и после приема пищи у мышей ob/ob и db/db и у крыс ZDF в возрасте 8 недель зависимым от дозы образом, таким образом, обеспечивая основу для применения FGF-21 в качестве терапии для лечения диабета и ожирения (WO 03/011213). Развитие технологии рекомбинантной ДНК делает возможным получение чужеродных продуктов,таких как мутеины FGF-21 в клетках-хозяевах, в которые введены экзогенные последовательности ДНК,кодирующие такие продукты. Преимущество такой технологии состоит в том, что продукты могут быть получены с высокими выходами, в высокоочищенной форме, с низким риском загрязнения, такого как вирусное загрязнение. Такие рекомбинантные технологии широко применяются для получения рекомбинатных белков в прокариотных, а также эукариотических клетках-хозяевах. Однако получение рекомбинантных продуктов в больших масштабах с помощью таких технологий по-прежнему ограничено из-за проблем с эффективностью экспрессии таких экзогенных последовательностей ДНК, а также из-за нестабильности вектора и внутриклеточного разложения рекомбинантных продуктов клетками-хозяевами, в которых они вырабатываются. Кроме того, рекомбинантные продукты часто отличаются от своих природных аналогов. Например, рекомбинантные продукты, продуцируемые в гетерологичных эукариотических хозяевах, обычно отличаются от их природного аналога по степени гликозилирования. Это может происходить за счет присутствия (по сравнению с отсутствием) любой углеводной структуры, расположения указанной углеводной структуры в продукте, а также природы углевода. Более конкретно, было показано, что рекомбинантные продукты, полученные в дрожжах, часто несут дополнительные неприродные O-гликаны в сравнении с их природным аналогом (Van den Steen, etal., Crit. Reviews in Biochem. and Mole. Biol. 33(3): 151-208, 1998). Данное изобретение решает задачу аномального O-гликозилирования, связанного с полученными в дрожжах рекомбинантными белками, путем обеспечения FGF-21 мутеинов, которые обладают сниженной степенью О-гликозилирования в сравнении с FGF-21 дикого типа при экспрессии в дрожжах. Авторами было обнаружено, что мутеины FGF-21 со сниженным O-гликозилированием могут быть получены в условиях промышленного ферментирования и могут сохранять биологическую активность, необходимую для того, чтобы быть пригодными для лечения пациентов с нарушениями, включающими, но не ограничиваясь ими, диабет II типа, ожирение и метаболический синдром. Сущность изобретения В первом варианте осуществления данное изобретение предлагает мутеины человеческого FGF-21 или его биологически активный пептид, который включает замену любой аминокислотой, за исключением Ser или Thr для Ser 167, где нумерация аминокислот основана на SEQ ID NO:1 и где указанный мутеин обладает сниженной способностью к О-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа. Второй вариант осуществления данного изобретения предлагает мутеины человеческого FGF-21 или его биологически активный пептид, который включает замену любой аминокислотой, за исключением Ser или Thr для Ser 167, в сочетании с заменой цистеином для двух или более из следующего: аргинин 19, тирозин 20, лейцин 21, тирозин 22, треонин 23, аспартат 24, аспартат 25, аланин 26, глутамин 27, глутамин 28, аланин 31, лейцин 33, изолейцин 35, лейцин 37, валин 41, глицин 42, глицин 43, глутамат 50,глутамин 54, лейцин 58, валин 62, лейцин 66, глицин 67, лизин 69, аргинин 72, фенилаланин 73, глутамин 76, аргинин 77, аспартат 79, глицин 80, аланин 81, лейцин 82, глицин 84, серин 85, пролин 90, аланин 92,серин 94, фенилаланин 95, лейцин 100, аспартат 102, тирозин 104, тирозин 107, серин 10 9, глутамат 110,пролин 115, гистидин 117, лейцин 118, пролин 119, аспарагин 121, лизин 122, серин 123, пролин 124,гистидин 125, аргинин 126, аспартат 127, аланин 129, пролин 130, глицин 132, аланин 134, аргинин 135,-1 011390 лейцин 137, пролин 138 или лейцин 139, где нумерация аминокислот основана на SEQ ID NO:1 и где указанный мутеин обладает сниженной способностью к О-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа. Третий вариант осуществления данного изобретения предлагает мутеины человеческого FGF-21 или его биологически активный пептид, который включает замену любой аминокислотой, за исключением Ser или Thr для Ser 167 в сочетании с заменой заряженной и/или полярной, но незаряженной аминокислотой для одной или нескольких аминокислот в положениях: глицин 42, глутамин 54, аргинин 77,аланин 81, лейцин 86, фенилаланин 88, лизин 122, гистидин 125, аргинин 126, пролин 130, аргинин 131,лейцин 139, аланин 145, лейцин 146, изолейцин 152; аланин 154; глутамин 156, глицин 161, серин 163,глицин 170 или серин 172, где нумерация аминокислот основана на SEQ ID NO:1 и где указанный мутеин обладает сниженной способностью к O-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа. Другие варианты осуществления представляют собой полинуклеотиды, кодирующие мутеины по первому, второму и третьему вариантам осуществления, вектор, содержащий указанные полинуклеотиды и клетку-хозяин, несущую указанный вектор. Другой вариант осуществления представляет собой способы получения полипептида, с получением клеток, способных продуцировать указанный полипептид, с получением вектора, содержащего ДНК, кодирующую указанный полипептид. Еще один вариант осуществления представляет собой способы лечения пациента, имеющего одно или несколько из следующих состояний: ожирение, диабет II типа, инсулинорезистентность, гиперинсулинемию, непереносимость глюкозы, гипергликемию или метаболический синдром, включающие введение указанному пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества мутеина человеческого FGF-21 по первому, второму или третьему варианту осуществления изобретения. Подробное описание изобретения Для целей данного изобретения, как раскрыто и заявлено в данном описании, следующие термины используются в таком значении, как определено ниже. Человеческий FGF-21 представляет собой полипептид из 208 аминокислот, содержащий лидерную последовательность, которая состоит из 27 аминокислот. Человеческий FGF-21 имеет 79% идентичность аминокислот с мышиным FGF-21 и 80% идентичность аминокислот с крысиным FGF-21. Человеческий FGF-21 представляет собой предпочтительный шаблон полипептида для мутеинов по данному изобретению, но признано, что специалист в данной области может легко получить мутеины на основе альтернативной последовательности полипептида млекопитающих FGF-21. Положения аминокислот в мутеинах по данному изобретению определены на основе зрелого человеческого полипептида FGF-21, состоящего из 181 аминокислот, как показано ниже (SEQ ID NO:1): Соответствующая последовательность ДНК, кодирующая зрелый человеческий полипептид FGF21, состоящий из 181 аминокислоты, представляет собой (SEQ ID NO:2): Аминокислоты идентифицируют с использованием трехбуквенного кода или альтернативно обо-2 011390 значают с использованием стандартного однобуквенного кода. Мутации обозначают трехбуквенным кодом для исходной аминокислоты, с последующим номером аминокислоты, с последующим трехбуквенным кодом заменяющей аминокислоты. Численные обозначения каждого мутеина основаны на последовательности из 181 аминокислоты зрелого человеческого FGF-21 дикого типа. Например, замена серина в положении 167 (т.е. Ser167) неполярной/гидрофобной аминокислотой, аланином (Ala), обозначается как Ser167Ala или S167A. Подобным образом, двойная замена лейцина в положении 118 и аланина в положении 134 (Leu118, Ala134) серосодержащей аминокислотой, цистеином (Cys) обозначается какLeu118Cys/Ala134Cys или L118C/A134C. Термин аминокислота в данном описании используется в самом широком смысле и включает природные аминокислоты, а также неприродные аминокислоты, включая аналоги и производные аминокислот. Последние включают молекулы, содержащие аминокислотный фрагмент. Специалист в данной области будет понимать, с точки зрения данного широкого определения, что ссылка на аминокислоту в данном описании включает, например, природные протеогенные L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как аналоги и производные аминокислот; природные непротеогенные аминокислоты, такие как норлейцин, -аланин, орнитин и т.д.; а также химически синтезированные соединения, обладающие свойствами, которые известны из уровня техники как характерные для аминокислот. Мутеин человеческого FGF-21 определяется как содержащий человеческий FGF-21, в котором по меньшей мере одна аминокислота в зрелом белке дикого типа замещена другой аминокислотой. Примеры мутеинов FGF-21 описаны в патентной заявке США 60/528582, которая включена в качестве ссылки. В целом, мутеин обладает некоторым модифицированным свойством, структурным или функциональным, белка дикого типа. Например, мутеин может обладать усиленной или улучшенной физической стабильностью в концентрированных растворах (например, меньшей степенью гидрофобно опосредованной агрегации) при сохранении благоприятного профиля биологической активности. Мутеин может обладать повышенной совместимостью с фармацевтическими консервантами (например, м-крезол, фенол, бензиловый спирт), таким образом, делая возможным приготовление фармацевтического препарата с консервантами, который сохраняет физико-химические свойства и биологическую активность белка в процессе хранения. Мутеин может обладать сниженной степенью О-гликозилирования при экспрессии в дрожжах. Такое О-гликозилирование может вводить новые иммунологические детерминанты в белок и может, таким образом, быть антигенным при введении людям; может изменять фармакокинетические свойства белка и/или влиять на биологическую активность белка. Соответственно, дрожжи продуцируют мутеины со сниженной степенью О-гликозилирования в сравнении с диким типом FGF-21, которые являются менее иммуногенными и обладают благоприятным фармакокинетическим профилем, при сохранении биологической активности. В данном описании указанные термины не являются ограничивающими и вполне возможно, что данный мутеин обладает одним или несколькими модифицированными свойствами белка дикого типа. Терапевтически эффективное количество представляет собой минимальное количество активного агента, необходимое для достижения терапевтического эффекта у пациента. Например, терапевтически эффективное количество для пациента, который страдает или склонен к возникновению, а также для предупреждения диабета II типа, ожирения или метаболического синдрома представляет собой такое количество, которое вызывает, облегчает или другим способом вызывает улучшение патологических симптомов, прогрессирования заболевания, физиологических состояний, связанных с ними, или устойчивость к упомянутым выше расстройствам. Для целей данного изобретения субъект или пациент предпочтительно является человеком. Диабет II типа характеризуется избыточным содержанием глюкозы в крови, несмотря на доступность инсулина, причем уровни глюкозы в кровотоке остаются чрезмерно высокими в результате неадекватного клиренса глюкозы. Непереносимость глюкозы может быть определена как избыточная чувствительность к глюкозе. Гипергликемия определяется как избыточный уровень сахара (глюкозы) в крови. Гипогликемия, которую также называют низким уровнем сахара в крови, возникает, когда уровень глюкозы в крови падает слишком низко для того, чтобы обеспечить достаточно энергии для функционирования организма. Гиперинсулинемия определяется как уровень инсулина в крови выше нормы. Инсулинорезистентность определяется как состояние, при котором нормальное количество инсулина приводит к субнормальной (ниже нормы) биологической реакции. Ожирение, применительно к человеку, может быть определено как масса тела, которая на 20% и больше превышает идеальную массу тела для данной популяции (R.H. Williams, Textbook of Endocrinology, 1974, p. 904-916). Метаболический синдром может быть определен как совокупность по меньшей мере трех из следующих признаков: жировые отложения в области живота - у большинства мужчин, объем талии 40 дюймов или больше; высокий уровень сахара в крови - по меньшей мере 110 миллиграммов на децилитр(мг/дл) натощак; высокий уровень триглицеридов - по меньшей мере 150 мг/дл в кровотоке; низкий уро-3 011390 вень липопротеидов высокой плотности (HDL) - менее 40 мг/дл; а также артериальное давление 130/85 или выше. Данное изобретение обеспечивает гликозилированные мутеины, в которых количество и/или вид сайтов гликозилирования изменены в сравнении с природным FGF-21. Один такой вариант включает мутеины FGF-21, которые включают меньшее количество О-связанных сайтов гликозилирования. Не существует консенсусной последовательности аминокислот для идентификации сайтов O-связанного гликозилирования, что делает такую идентификацию трудной задачей. В норме О-связанное гликозилирование происходит в боковой цепи остатка серина или треонина. Как только идентифицирован сайт Освязанного гликозилирования, замены аминокислот для удаления данной последовательности могут удалять существующую О-связанную углеводную цепь. Сайты O-связанного гликозилирования, идентифицированные в данном изобретении, включают Ser163, Ser164, Ser167, Ser172 и Ser176. Основным сайтом О-гликозилирования является Ser167. Авторами было обнаружено, что удаление сайта Ser167 ведет к значительному уменьшению О-гликозилирования экспрессированного дрожжами мутеина. Хотя Ser167 представляет собой предпочтительный сайт мутации для устранения O-гликозилирования, мутации в других сайтах О-гликозилирования человеческого FGF-21 (Ser163, Ser164, Ser172 и Ser176) находятся в рамках данного изобретения. Следовательно, в первом предпочтительном варианте осуществления данное изобретение предлагает мутеины человеческого FGF-21 или его биологически активный пептид, который включает замену любой аминокислотой, за исключением Ser или Thr для Ser 167, где нумерация аминокислот основана наSEQ ID NO:1 и где указанный мутеин обладает сниженной способностью к О-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа. Предпочтительные мутеины по первому варианту представляют собой Ser167Ala, Ser167Glu, Ser167Asp, Ser167Asn, Ser167Gln,Ser167Gly, Ser167Val, Ser167His, Ser167Lys и Ser167Tyr. Второй вариант осуществления данного изобретения предлагает мутеины человеческого FGF-21 или его биологически активный пептид, который включает замену любой аминокислотой, за исключением Ser или Thr для Ser167, в сочетании с заменой цистеином для двух или более из следующего: аргинин 19, тирозин 20, лейцин 21, тирозин 22, треонин 23, аспартат 24, аспартат 25, аланин 26, глутамин 27, глутамин 28, аланин 31, лейцин 33, изолейцин 35, лейцин 37, валин 41, глицин 42, глицин 43, глутамат 50,глутамин 54, лейцин 58, валин 62, лейцин 66, глицин 67, лизин 69, аргинин 72, фенилаланин 73, глутамин 76, аргинин 77, аспартат 79, глицин 80, аланин 81, лейцин 82, глицин 84, серин 85, пролин 90, аланин 92,серин 94, фенилаланин 95, лейцин 100, аспартат 102, тирозин 104, тирозин 107, серин 109, глутамат 110,пролин 115, гистидин 117, лейцин 118, пролин 119, аспарагин 121, лизин 122, серин 123, пролин 124,гистидин 125, аргинин 126, аспартат 127, аланин 129, пролин 130, глицин 132, аланин 134, аргинин 135,лейцин 137, пролин 138 или лейцин 139, где нумерация аминокислот основана на SEQ ID NO:1 и где указанный мутеин обладает сниженной способностью к О-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа. Предпочтительно, фраза два или более означает замещение цистеином для 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 остатков аминокислот в указанных выше положениях. Более предпочтительно, она означает замещение цистеином для 2 или 4 остатков аминокислот в указанных выше положениях. Специалист в данной области также будет понимать, что природные цистеины, цистеин 75 и цистеин 93, также могут быть использованы как локусы (местоположения) для введения новой дисульфидной связи, которая может обеспечивать улучшенные свойства. Конкретно, предусматривается введение замены цистеином серина 85 или фенилаланина 73, в сочетании с одновременной заменой в положении цистеина 93 или цистеина 75, соответственно, где последние сайты заменены любой другой аминокислотой. Мутеины FGF-21 с введенными дисульфидными связями, кроме природной связи в положенииCys75-Cys93, описаны в патентной заявке США 60/528582. Наиболее предпочтительные мутеины по второму варианту осуществления представляют собой Leu118Cys-Ala134Cys-Ser167Ala; Leu21CysLeu33Cys-Ser167Ala; Ala26Cys-Lys122Cys-Ser167Ala или Leu21Cys-Leu33Cys/Leu118Cys-Ala134CysSer167Ala. Третий вариант осуществления данного изобретения предлагает мутеины человеческого FGF-21 или его биологически активный пептид, который включает замену любой аминокислоты, за исключением Ser или Thr для Ser 167 в сочетании с заменой заряженной и/или полярной, но незаряженной аминокислотой для одной или более аминокислот в положениях: глицин 42, глутамин 54, аргинин 77, аланин 81, лейцин 86, фенилаланин 88, лизин 122, гистидин 125, аргинин 126, пролин 130, аргинин 131, лейцин 139, аланин 145, лейцин 146, изолейцин 152, аланин 154, глутамин 156, глицин 161, серин 163, глицин 170 или серин 172, где нумерация аминокислот основана на SEQ ID NO:1 и где указанный мутеин обладает сниженной способностью к O-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа. Заряженная аминокислота определяется как положительно или отрицательно заряженная аминокислота. Определение положительно заряженной аминокислоты включает гистидин, лизин, аргинин, а также их не встречающиеся в природе аналоги (например, гамма-аминомасляная кислота, орнитин и т.д.). Определение отрицательно заряженной аминокислоты включает аспартат, глутамат, а также их не-4 011390 встречающиеся в природе аналоги (например, аминоадипиновая кислота). Определение полярной, но не заряженной аминокислоты включает серин, треонин, аспарагин, глутамин, а также их не встречающиеся в природе аналоги. Предпочтительные мутеины по третьему варианту осуществления представляют собой Последующие варианты осуществления данного изобретения предлагают мутеины человеческогоFGF-21 или его биологически активный пептид, которые включают комбинацию первого варианта осуществления по данному изобретению, второго варианта осуществления по данному изобретению и третьего варианта осуществления по данному изобретению, где указанные мутеины обладают сниженной способностью к O-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF21 дикого типа. Хотя варианты осуществления по данному изобретению касаются мутеинов FGF-21 со сниженной способностью к O-гликозилированию при экспрессии в дрожжах в сравнении с человеческим FGF-21 дикого типа, сохранение биологической активности мутеинов в сравнении с FGF-21 дикого типа также представляет собой важный фактор для рассмотрения. Биологическая активность мутеинов по данному изобретению определяется по способности мутеинов влиять на потребление глюкозы, что демонстрируется анализом in vitro на клетках 3 Т 3-L1 (пример 2), и/или снижать уровни глюкозы в плазме, а также уровни триглицеридов в плазме, что демонстрируется анализом in vivo на мышах ob/ob (пример 3). Мутеины FGF-21, вводимые в соответствии с данным изобретением, могут быть созданы и/или выделены любыми средствами, известными из уровня техники. Наиболее предпочтительным способом получения мутеина является получение с помощью методологий рекомбинантных ДНК, которые хорошо известны специалистам в данной области. Такие способы описаны в Current Protocols in Molecular Biology (John WileySons, Inc.), которая включена в данное описание путем ссылки. Кроме того, предпочтительные варианты осуществления включают биологически активный пептид,происходящий из мутеина, раскрытого в данном описании, причем такой пептид будет содержать по меньшей мере одну из описанных замен, будет проявлять сниженную способность к Огликозилированию в сравнении с соответствующим немутантным пептидом, и также будет обладать биологической активностью. Такая биологическая активность определяется по способности пептида влиять на потребление глюкозы, что демонстрируется анализом in vitro на клетках 3T3-L1 (пример 2),и/или снижать уровни глюкозы в плазме, а также уровни триглицеридов в плазме, что демонстрируется анализом in vivo на мышах ob/ob (пример 3). Пептид может быть получен любыми средствами, известными специалисту в данной области, примеры которых включают, не ограничиваясь ими, ферментативное расщепление, химический синтез или методики рекомбинантной ДНК. Из уровня техники известно, что фрагменты пептидов некоторых факторов роста фибробластов являются биологически активными. См., например, Baird et al., Proc. Natl. Acad. Sci. (USA) 85: 2324-2328(1988), и J. Cell. Phys. Suppl. 5: 101-106 (1987). Например, известно, что дипептидилпептидаза IV (DPPIV) представляет собой протеазу серинового типа, которая принимает участие в инактивации нейропептидов, эндокринных пептидов и цитокинов (Damme et al. Chem. Immunol. 72: 42-56, (1999. N-конецFGF-21 (HisProIlePro) содержит два дипептида, которые потенциально могут быть субстратами для DPPIV, что приводит к образованию фрагмента FGF-21, укороченного на N-конце (отсечен фрагмент до 4 аминокислот). Неожиданно данный фрагмент дикого типа FGF-21 продемонстрировал способность сохранять биологическую активность (табл. 1), и таким образом, мутеины по данному изобретению укорочены на N-конце (отсечен фрагмент до 4 аминокислот) в сочетании с заменами аминокислот по любому из вариантов осуществления данного изобретения. Кроме того, авторами было обнаружено, что отсечение 5 или более аминокислот на N-конце отрицательно влияет на биологическую активность. Данное изобретение также охватывает полинуклеотиды, кодирующие описанные выше мутеины,которые могут быть в форме РНК или в форме ДНК, причем ДНК включает кДНК, геномную ДНК и синтетическую ДНК. ДНК может быть двухцепочечной или одноцепочечной. Кодирующие последовательности, которые кодируют мутеины по данному изобретению, могут варьировать в результате избыточности или вырожденности генетического кода. Полинуклеотиды, которые кодируют мутеины по данному изобретению, могут включать следующее: только кодирующая последовательность для мутеина, кодирующая последовательность для мутеина и дополнительная кодирующая последовательность, например, для функционального полипептида, или лидерная или секреторная последовательность или последовательность пробелка; кодирующая последовательность для мутеина и не кодирующая последовательность, например, интроны или не кодирующая последовательность 5' и/или 3' кодирующей последовательности для мутеина. Таким образом, термин полинуклеотид, кодирующий мутеин охватывает полинуклеотид, который может включать не только-5 011390 кодирующую последовательность для мутеина, но также полинуклеотид, который включает дополнительную кодирующую и/или не кодирующую последовательность. Данное изобретение дополнительно относится к вариантам описанных полинуклеотидов, которые кодируют фрагменты, аналоги и производные полипептида, содержащие указанные замены. Вариант полинуклеотида может представлять собой встречающийся в природе аллельный вариант человеческой последовательности FGF-21, не встречающийся в природе вариант или укороченный вариант, как описано выше. Таким образом, данное изобретение также включает полинуклеотиды, кодирующие описанные выше мутеины, а также варианты таких полинуклеотидов, причем варианты кодируют фрагмент, производное или аналог раскрытого мутеина, которые демонстрирует сниженную способность к Огликозилированию в сравнении с соответствующим немутантным фрагментом, производным или аналогом. Такие нуклеотидные варианты включают варианты делеции, варианты замены, укороченные варианты, а также варианты добавления или вставки, до тех пор, пока присутствует по меньшей мере одна из указанных замен аминокислот по первому, второму или третьему варианту осуществления. Полинуклеотиды по данному изобретению будут экспрессироваться в клетке-хозяине после того,как последовательности будут функционально присоединены к последовательности, контролирующей экспрессию. Такие вектора экспрессии обычно способны к репликации в организмах-хозяевах в виде эписом или в виде интегральной части хромосомной ДНК хозяина. Обычно векторы экспрессии будут содержать маркеры селекции, например, тетрациклин, неомицин и дигидрофолатредуктазу для выявления клеток, трансформированных с помощью желаемых последовательностей ДНК. Предпочтительно,клетка-хозяин представляет собой грибковую или дрожжевую клетку. Дрожжевые клетки, которые используются для экспрессии мутеинов по данному изобретению,включают Pichia pastoris, Saccharomyces cerevisiae, Schizosaccharomyces pombe и Pichia august. Дрожжевые клетки-хозяева содержат подходящие векторы с контролирующими экспрессию последовательностями, такими как промоторы, включая 3-фосфоглицераткиназу или другие гликолитические ферменты и начало репликации, последовательности терминации и т.п., по желанию. Предпочтительный дрожжевой хозяин по данному изобретению представляет собой Pichia pastoris,в котором вектор экспрессии интегрирован в хромосомную ДНК хозяина. Aspergillus niger, Trichodermareesei и Schizophyllum commune представляют собой примеры грибковых хозяев, хотя другие также могут использоваться, по выбору. Векторы, содержащие желаемые полинуклеотидные последовательности (например, мутеины FGF21 и контролирующие экспрессию последовательности), могут быть перенесены в клетку-хозяин с помощью хорошо известных способов, которые варьируют в зависимости от вида клетки-хозяина. Например, трансфекция с хлоридом кальция обычно используется в случае прокариотных клеток, тогда как обработка кальция фосфатом или электропорация могут использоваться в случае других клеток-хозяев. Могут применяться различные способы очистки белка, и такие способы известны из уровня техники и описаны, например, в Deutscher, Methods in Enzymology 182: 83-9 (1990) и Scopes, ProteinPurification: Principles and Practice, Springer-Verlag, NY (1982). Выбранная(ые) стадия(и) очистки будут зависеть, например, от характера способа получения, который используется для мутеинов FGF-21. Композиции, содержащие мутеин FGF-21, должны разрабатываться и вводиться способом, который согласуется с надлежащей медицинской практикой, принимая во внимание клиническое состояние пациента, место доставки композиции мутеина FGF-21, способ введения, схему введения, а также другие факторы, известные практикующим специалистам. Терапевтически эффективное количество мутеинаFGF-21 для целей данного описания, таким образом, определяется указанными соображениями. Фармацевтические композиции мутеинов FGF-21 по данному изобретению могут вводиться любым известным из уровня техники способом, который достигает общей поставленной цели в лечении диабетаII типа, ожирения или метаболического синдрома. Предпочтительным способом введения является парентеральный, который в данном описании определяется как включающий внутривенную, внутримышечную, внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекцию и инфузию. Вводимые дозы будут зависеть от возраста, состояния здоровья и массы тела реципиента, вида сопутствующего лечения, если оно проводится, частоты введения препарата, а также природы желаемого эффекта. Композиции в рамках изобретения включают все композиции, где присутствует мутеин FGF-21 в количестве, эффективном для достижения желаемого медицинского эффекта для лечения диабета II типа,ожирения или метаболического синдрома. Поскольку индивидуальные потребности могут варьировать от одного пациента к другому, определение оптимальных интервалов эффективных количеств всех компонентов находится в рамках навыков среднего клинициста. Мутеины FGF-21 по данному изобретению могут быть введены в препарат в соответствии с известными способами приготовления полезных с фармацевтической точки зрения композиций. Желаемым препаратом будет такой, который представляет собой стабильный лиофилизированный продукт, который разбавляют соответствующим разбавителем, или водный раствор высокой чистоты, необязательно с фармацевтически приемлемыми носителями, консервантами, вспомогательными веществами или стабилизаторами [Remington's Pharmaceutical Sciences 16th edition (1980)]. Мутеины по данному изобретению могут сочетаться с фармацевтически приемлемым буфером, и pH может корректироваться для обеспече-6 011390 ния приемлемой стабильности и значения pH, приемлемого для введения. Более того, мутеины по данному изобретению могут быть помещены в контейнер, выбранный из группы, которая состоит из флакона, картриджа, шприц-ручки, шприца, капельницы для внутривенного введения и бутыли для внутривенного введения, где контейнер представляет собой однодозовый контейнер. Для парентерального введения мутеины FGF-21 вводят в препараты, обычно путем смешивания одного или более мутеинов с желательной степенью чистоты, в однодозовой инъекционной форме (раствор, суспензия или эмульсия) с фармацевтически приемлемым носителем, т.е. нетоксичным для реципиента, в дозах и концентрациях, которые совместимы с другими ингредиентами препарата. Предпочтительно, может добавляться один или более фармацевтически приемлемых антимикробных агентов. Фенол, м-крезол и бензиловый спирт являются предпочтительными фармацевтически приемлемыми антимикробными агентами. Необязательно, одна или более фармацевтически приемлемых солей могут добавляться для коррекции ионной силы или тоничности. Одно или более вспомогательных веществ могут добавляться для дальнейшей коррекции изотоничности препарата. Глицерин, хлорид натрия и маннит представляют собой примеры вспомогательных веществ для коррекции изотоничности. Специалисты в данной области могут легко оптимизировать фармацевтически эффективные дозы и схемы введения лечебных композиций, которые включают мутеин FGF-21, что определяется в соответствии с надлежащей медицинской практикой и клиническим состоянием отдельного пациента. Надлежащая доза мутеина FGF-21 для введения будет приводить к снижению уровней глюкозы и повышению расхода энергии путем более быстрой и более эффективной утилизации глюкозы, и, таким образом, будет полезной для лечения диабета II типа, ожирения и метаболического синдрома. Кроме того, FGF-21 не вызывает гипогликемии у тощих крыс ZDF по сравнению с крысами, которым вводили инсулин (WO 03/011213). Эти данные показывают, что FGF-21 оказывает влияние на уровни глюкозы в плазме инсулинзависимым образом, указывая на то, что мутеины FGF-21 по данному изобретению также могут быть полезными в лечении диабета I типа. В другом аспекте данного изобретения мутеины человеческого FGF-21, описанные в данном описании, или его биологически активный пептид применяются в качестве лекарственного средства. Еще в одном аспекте данного изобретения эффективное количество мутеинов FGF-21, описанных в данном описании, или его биологически активного пептида применяются в производстве лекарственного средства для лечения или профилактики одного или нескольких состояний, выбранных из диабета II типа, ожирения или метаболического синдрома. После подробного описания данного изобретения его объект будет дополнительно проиллюстрирован путем ссылки на следующие примеры, которые включены в данное описание исключительно для целей иллюстрации и не предназначены для ограничения изобретения. Все патенты и публикации, ссылки на которые сделаны в данном описании, таким образом, включены путем ссылки. Пример 1. Экспрессия и очистка мутеинов FGF-21 в дрожжах. Мутеины FGF-21 экспрессируются в дрожжах, таких как Pichia pastoris, Pichia methanolica или Saccharomyces cerevisiae. Для продуцирования в Pichia pastoris в коммерчески доступной системе (Invitrogen,Carlsbad, CA) используют векторы с сильными промоторами AOX1 (алкогольоксидаза) для осуществления высокого уровня экспрессии рекомбинантных белков. Альтернативно, для высоких уровней конститутивной экспрессии доступны векторы, в которых используется промотор из гена GAP (глицеральдегид-3-фосфатдегидрогеназа). Мультикопийные векторы экспрессии Pichia позволяют получить штаммы с множественными копиями желаемого гена, интегрированными в геном. Увеличение количества копий желаемого гена в рекомбинантном штамме Pichia может увеличить уровни экспрессии белка. Еще одной системой экспрессии в дрожжах является Saccharomycescerevisiae. Векторы экспрессии содержат последовательности промотора и энхансера из гена GAL1. Промотор GAL1 представляет собой один из наиболее широко используемых дрожжевых промоторов благодаря его выраженной транскрипциональной активности при индукции галактозой. Аналитическое описание (анализ масс-спектра) показывает, что экспрессируемый в Pichia pastorisFGF-21 укорочен (отсечение четырех аминокислот на N-конце дикого типа). При проведении анализа в пробе адипоцитов мышей 3T3-L1 (см. пример 2) этот укороченный вариант FGF-21 стимулирует потребление глюкозы при применении таких же концентраций, как и FGF-21 дикого типа (табл. 1). Пример 2. Потребление глюкозы адипоцитами мышей 3T3-L1. Клетки 3T3-L1 получены от Американской Коллекции Культур Видов (American Type Culture Collection, ATCC, Rockville, MD). Клетки культивировали в среде культивирования (GM), содержащей 10% обогащенной железом фетальной бычьей сыворотки в модифицированной Дульбекко среде Игла. Для стандартной дифференциации адипоцитов через два дня после достижения слияния клеток (обозначается день 0) клетки подвергали действию дифференцирующей среды (DM), содержащей 10% фетальной бычьей сыворотки, 10 мкг/мл инсулина, 1 мкМ дексаметазона и 0,5 мкМ изобутилметилксантина, в тече-7 011390 ние 48 ч. Клетки содержали в постдифференциальной среде, содержащей 10% фетальной бычьей сыворотки и 10 мкг/мл инсулина. Анализ транспорта глюкозы. Потребление гексозы, измеренное путем количественного определения аккумуляции 0,1 мМ 2 дезокси-D-[14C]глюкозы, определяли следующим образом: адипоциты 3T3-L1 в 12-луночных планшетах,дважды промытые буфером KRP (136 мМ NaCl, 4,7 мМ KCl, 10 мМ NaPO4, 0,9 мМ CaCl2, 0,9 мМ MgSO4,pH 7,4), нагретые до 37C и содержащие 0,2% BSA, инкубировали в среде Лейбовица L-15, содержащей 0,2% BSA, в течение 2 ч при 37 С в комнатной атмосфере, снова дважды промывали буфером KRP, содержащим 0,2% BSA, и инкубировали в буфере KRP, содержащем 0,2% BSA, в отсутствие (толькоMe2SO) или в присутствии вортманнина в течение 30 мин при 37C в комнатной атмосфере. Затем добавляли инсулин до конечной концентрации 100 нМ в течение 15 мин и потребление 2-дезокси-D[14C]глюкозы измеряли в течение последних 4 мин. Неспецифическое потребление, измеренное в присутствии 10 мкМ цитохалазина В, вычитали из всех значений. Концентрацию белка определяли с помощью анализа Пирса бицинхониновой кислоты. Потребление измеряли обычно в трехкратном или четырехкратном повторении для каждого эксперимента. Активность in vitro нормализовали по активности in vitro FGF-21 дикого типа, которой присвоено значение 1,0, и которая используется в качестве положительного контроля. Активность in vitro мутеиновFGF-21 данного изобретения сравнивается с FGF-21 дикого типа в табл. 1. Как показано в табл. 1, мутеины по данному изобретению в различной степени сохраняют биологическую активность по сравнению с Активность представляет собой относительное значение на базе активности FGF-21 дикого типа, выработанного E. coli.На N-конце отсечены 4 аминокислоты. Пример 3. Модель на мышах ob/ob. Исследование на модели ожирения с использованием самцов мышей ob/ob проводили для контроля уровней глюкозы и триглицеридов в плазме крови после лечения FGF-21, в сравнении с контрольными группами растворителя и инсулина. В экспериментальных группах самцам мышей ob/ob (возраст 7 недель) инъекционно вводили только растворитель (0,9% NaCl) или мутеин FGF-21 (0,125 мг/кг) подкожно(0,1 мл, один раз в день) в течение 7 дней. Кровь отбирали с помощью зажима на хвосте в день 7, через час после последней инъекции соединения, и уровни глюкозы в плазме крови измеряли с использованием стандартного протокола. Способность мутеинов FGF-21 снижать уровни глюкозы в плазме в сравнении с контролем (растворитель) показаны в табл. 2. Данные в табл. 2 показывают, что мутеины по данному изобретению снижали уровни глюкозы в плазме крови в сравнении с контролем (растворитель). Способность мутеинов FGF-21 к снижению уровней триглицеридов в сравнении с контролем (растворитель) показаны в табл. 3. Таблица 2-8 011390 Пример 4. Фармацевтическая стабильность мутеинов FGF-21. Стабильность мутеинов FGF-21 по данному изобретению анализировали путем имитации физиологических условий и условий фармацевтического препарата. Для имитации физиологических условий анализировали стабильность мутеина в фосфатном буферном растворе (PBS) при комнатной температуре(RT) при концентрации целевого белка 10 мг/мл, pH 7,4. Растворимость/физическая стабильность мутеинов в PBS считалась удовлетворительной, если выход белка после приготовления составлял 90% при комнатной температуре, что определяли с помощью хроматографии с разделением по размеру (sizeexclusion chromatography) и/или обращенно-фазовой хроматографии. Как показано в табл. 4 и 5, мутеины по данному изобретению удовлетворяют данным критериям. Было предположено, что фармацевтический препарат мутеина по данному изобретению, вероятно,будет представлять собой препарат для универсального применения с консервантами, поэтому была проанализирована совместимость с широко используемым консервантом. Для исследования совместимости препарата консервант м-крезол (конечная концентрация 3 мг/мл, обычно достаточная для удовлетворения критериям Европейской Фармакопеи В для эффективности консерванта в условиях нейтральных значений pH) добавляли при комнатной температуре к раствору, содержащему мутеин в концентрации приблизительно 10 мг/мл в PBS, pH 7,4. Физическую стабильность в присутствии консерванта первоначально оценивали путем определения выхода белка по основному пику на хроматограмме после обращенно-фазовой хроматографии и хроматографии с разделением по размеру при комнатной температуре. Кроме того, степень агрегации, измеренная с помощью DLS (динамического рассеивания света) при 37C, показана как средний диаметр частиц в присутствии м-крезола по прохождении 2 ч, в сравнении сFGF-21 дикого типа. Больший размер среднего диаметра соответствует повышенной степени ассоциации и/или агрегации белка. Совместимость с консервантом (как функция среднего диаметра частиц) мутеинов по первому и второму вариантам данного изобретения в сравнении с FGF-21 дикого типа показана в табл. 4. Белок дикого типа экспрессировали в E. coli, тогда как мутеины экспрессировали в дрожжах(Pichia pastoris). Мутеины по данному изобретению, которые являются стабильными в PBS и совместимыми с консервантом, сконструированы таким образом, чтобы обладать усиленными или улучшенными фармацевтическими свойствами в сравнении с FGF-21 дикого типа. Как показано в табл. 4, предпочтительные мутеины по данному изобретению, которые обладают усиленными фармацевтическими свойствами по сравнению с FGF-21 дикого типа, представляют собой L118C-A134C и L118C-A134C-S167A. Таблица 4 Средний диаметр частиц представляет раствор белка с целевой концентрацией 10 мг/мл м-крезола с концентрацией 3 мг/мл, после 2 ч инкубирования при 37 С. Пример 5. Анализ О-гликозилирования. Мутеины FGF-21 экспрессировали в Pichia pastoris и очищали из среды культивирования с помощью ВЭЖХ (Waters 2695) с использованием колонки Zorbax, 330-SB C8, 4,650 мм, частицы 3,5 мкм при 40C (подвижная фаза С: 0,1% TFA в 10% ацетонитрила и 90% H2O, D: 0,1% TFA в ацетонитриле). Уровни О-гликозилирования очищенных мутеинов FGF-21 измеряли с помощью стандартного анализа ЖХ/МС (жидкостная хроматография, масс-спектроскопия. LC/MS). Процент O-гликозилирования для типичных представителей мутеинов показан в табл. 5 по сравнению с человеческим FGF-21 дикого типа. Уровни О-гликозилирования предпочтительных мутеинов L118C-A134C-S167A составляют только 3% по сравнению со значениями 60% для FGF-21 дикого типа или мутеина L118C-A134C, что четко демонстрирует, что мутеин S167A значительно снижает уровень O-гликозилирования. Таблица 5-9 011390 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Мутеин человеческого FGF-21, где нумерация аминокислот основана на SEQ ID NO:1, где указанный мутеин представляет собой HisProIlePro/Leu118Cys/Ala134Cys/Ser167Ala. 2. Способ получения мутеина по п.1, включающий:(b) культивирование указанной клетки-хозяина в среде, подходящей для экспрессии указанного мутеина; и(c) выделение указанного мутеина из среды культивирования. 3. Фармацевтическая композиция, пригодная для лечения пациента, имеющего одно или несколько из следующих состояний: ожирение, диабет II типа, инсулинорезистентность, гиперинсулинемию, непереносимость глюкозы, гипергликемию или метаболический синдром, содержащая следующее:(a) терапевтически эффективное количество мутеина FGF-21 по п.1 и(b) приемлемый фармацевтический носитель. 4. Мутеин человеческого FGF-21 или его биологически активный пептид по п.1 для применения в качестве лекарственного средства. 5. Применение мутеина FGF-21 по п.1 для производства лекарственного средства для лечения пациента, имеющего одно или несколько из следующих состояний: ожирение, диабет II типа, инсулинорезистентность, гиперинсулинемию, непереносимость глюкозы, гипергликемию или метаболический синдром.
МПК / Метки
МПК: A61K 38/18, C07K 14/50, C12P 21/00
Метки: фибробластов, роста, белки, фактора, мутеины, мутантные
Код ссылки
<a href="https://eas.patents.su/13-11390-mutantnye-belki-muteiny-faktora-rosta-fibroblastov-21.html" rel="bookmark" title="База патентов Евразийского Союза">Мутантные белки (мутеины) фактора роста фибробластов 21</a>
Предыдущий патент: Лекарственное средство
Следующий патент: Липосомная композиция, содержащая активное вещество для релаксации гладкой мускулатуры, получение этой композиции и ее терапевтическое применение
Случайный патент: Усовершенствования порошков или связанные с порошками