Способ получения кислотных солей тровафлоксацина
Номер патента: 2340
Опубликовано: 25.04.2002
Авторы: Норрис Тимоти, Ди Вриз Кит Майкл, Роуз Питер Роберт
Формула / Реферат
1. Способ получения кислотной соли тровафлоксацина, имеющей формулу (IV)
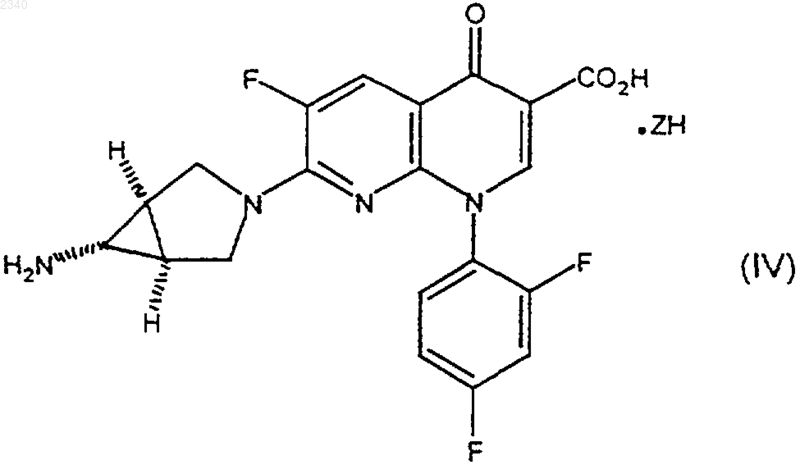
где ZH представляет собой минеральную кислоту, включающий в себя стадию, на которой соединение формулы (I)
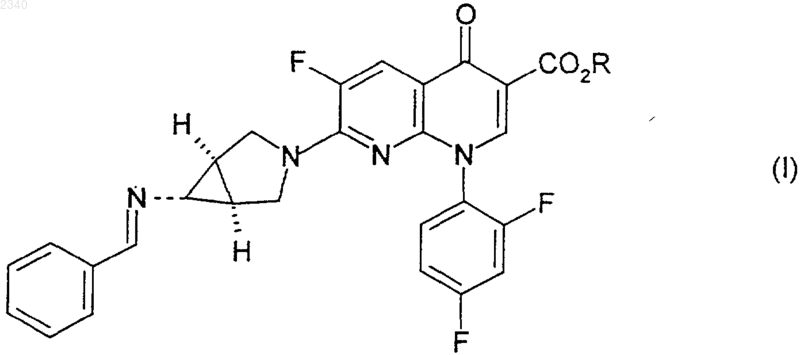
где R представляет собой C1-С6алкильную группу и где бензилиденовое кольцо соединения формулы (I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1-С6алкильной или C1-С6алкоксигруппой,
приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду.
2. Способ по п.1, где R представляет собой этил.
3. Способ по п.1, где минеральная кислота выбрана из группы, в которую входят метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, азотная кислота, серная кислота, фосфорная кислота, соляная кислота, бромоводородная кислота, винная кислота, лимонная кислота, уксусная кислота и малеиновая кислота.
4. Способ по п.1, где данный способ выполняют в присутствии инертного органического растворителя.
5. Способ получения кислотной соли тровафлоксацина, имеющей формулу (IV)
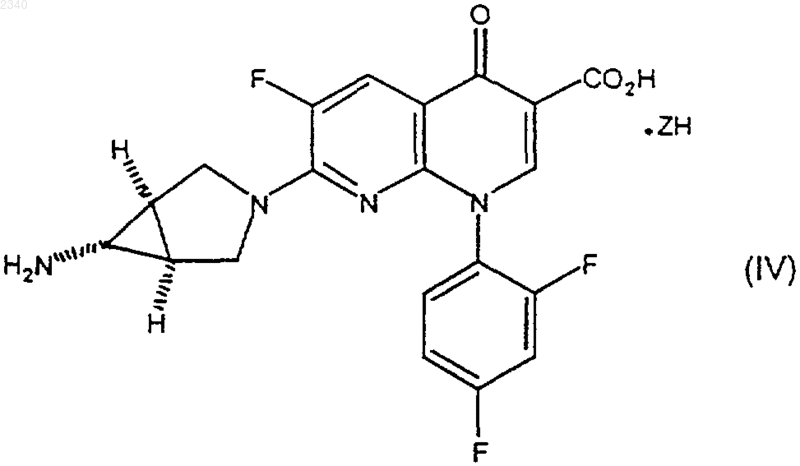
где ZH представляет собой минеральную кислоту, включающий в себя стадии, на которых:
(а) соединение формулы (V)
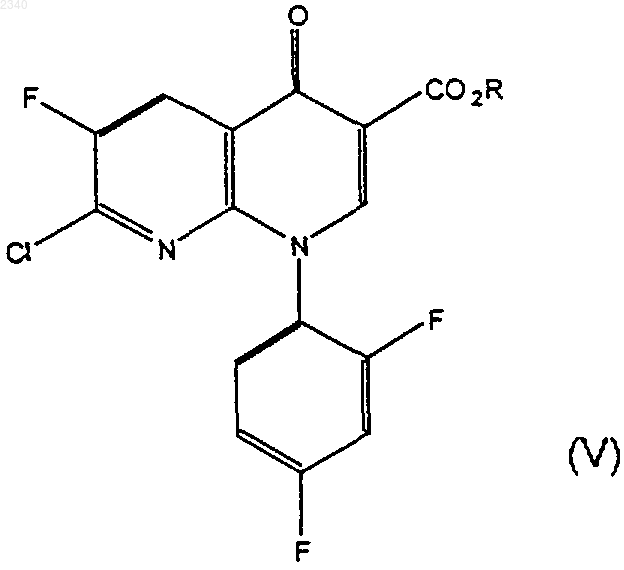
где R представляет собой C1-С6алкильную группу, приводят в контакт в присутствии третичного аминного основания с соединением формулы (II)
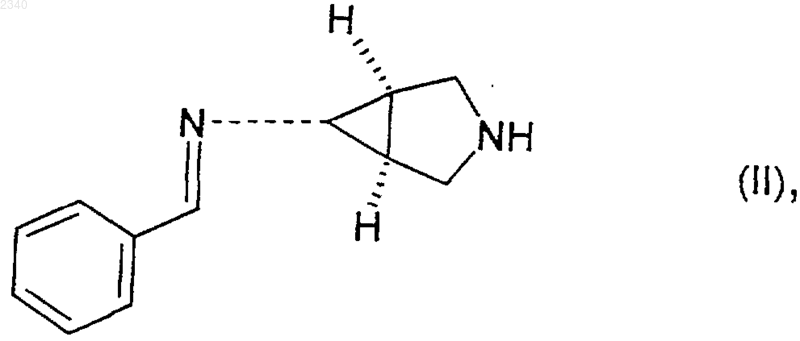
где бензилиденовое кольцо соединения формулы (II) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1-С6алкильной или C1-С6алкоксигруппой,
с получением соединения формулы (I)

и
(б) соединение формулы (I) приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду.
6. Способ по п.5, где R представляет собой этил.
7. Способ по п.5, где минеральная кислота выбрана из группы, в которую входят метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, азотная кислота, серная кислота, фосфорная кислота, соляная кислота, бромоводородная кислота, винная кислота, лимонная кислота, уксусная кислота и малеиновая кислота.
8. Способ по п.5, где третичное аминное основание выбрано из группы, в которую входят триэтиламин, N,N-диизопропилэтиламин, диметилизопропиламин, метилдибутиламин, трифениламин, пиридин, 4-диметиламинопиридин, 2,6-лутидин, 2,4,6-коллидин и N,N,N',N'-тетраметил-1,8-нафталиндиамин.
9. Способ по п.6, где стадию (а) данного способа выполняют в присутствии инертного органического растворителя.
10. Способ по п.6, где стадию (б) данного способа выполняют в присутствии водорастворимого органического растворителя.
11. Способ получения кислотной соли тровафлоксацина, имеющей формулу (IV)
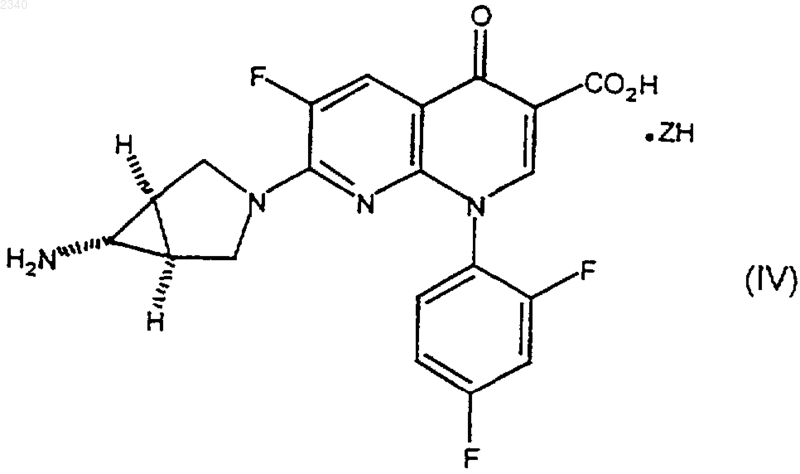
где ZH представляет собой минеральную кислоту, включающий в себя стадии, на которых:
(а) соединение формулы (I)
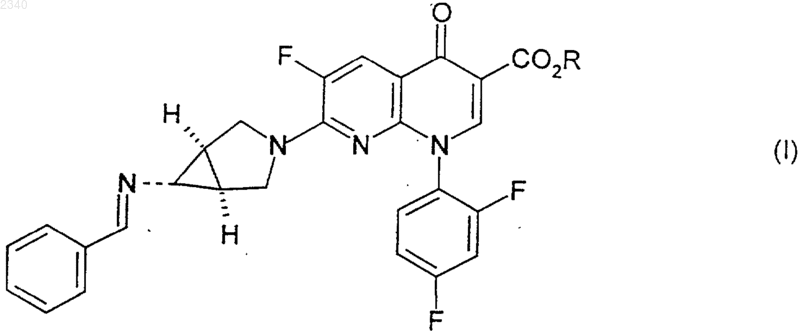
где R представляет собой С1-С6алкильную группу;
и бензилиденовое кольцо соединения формулы (I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1-С6алкильной или С1-С6алкоксигруппой, приводят в контакт по существу в безводных условиях с минеральной кислотой с получением соединения формулы (III)
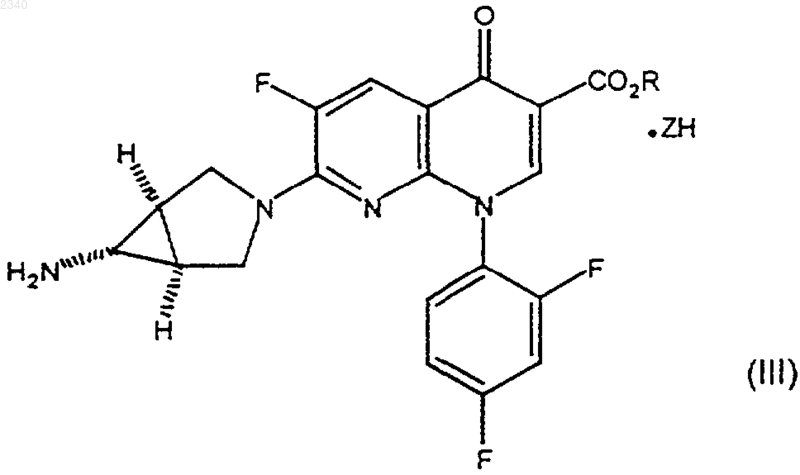
и
(б) соединение формулы (III) приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду.
12. Способ по п.11, где R представляет собой этил.
13. Способ по п.11, где минеральная кислота выбрана из группы, в которую входят метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, азотная кислота, серная кислота, фосфорная кислота, соляная кислота, бромоводородная кислота, винная кислота, лимонная кислота, уксусная кислота и малеиновая кислота.
14. Способ по п.11, где стадию (а) выполняют в присутствии инертного органического растворителя.
15. Способ по п.11, где стадию (б) выполняют в присутствии водорастворимого органического растворителя.
16. Соединение формулы (I)
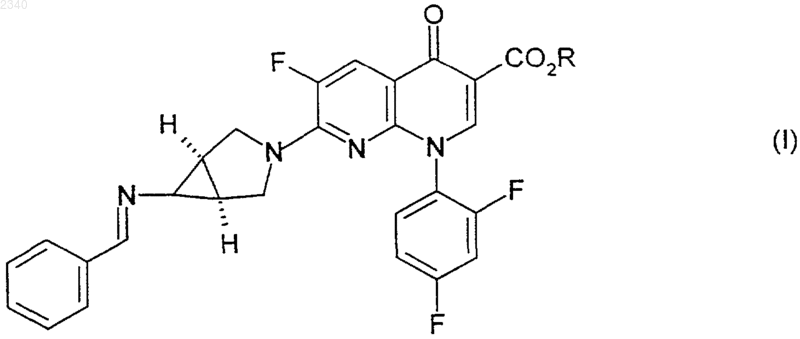
где R представляет собой C1-С6алкильную группу;
и бензилиденовое кольцо соединения формулы (I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1-С6алкильной или C1-С6алкоксигруппой.
17. Соединение по п.16, где R представляет собой этил.
18. Соединение по п.16, где данное соединение представляет собой этиловый эфир (1a,5a,6a)-7-(6-бензилидениламино-3-азабицикло[3.1.0]гекс-3-ил)-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты.
19. Соединение формулы (II)
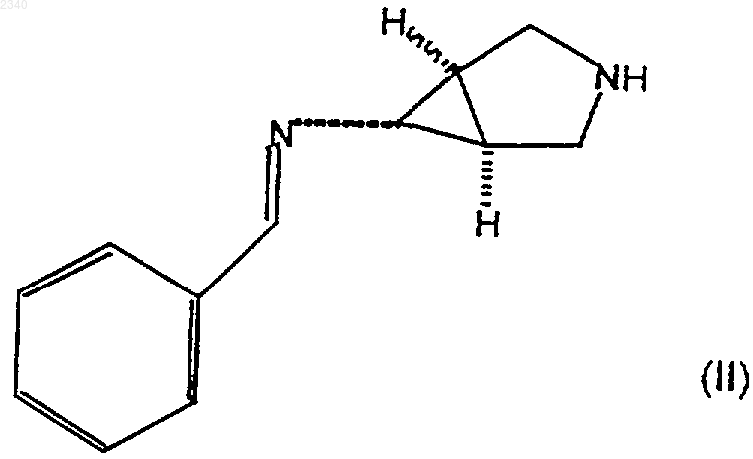
где бензилиденовое кольцо соединения формулы (II) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1-С6алкильной или C1-С6алкоксигруппой.
20. Соединение по п.19, которое представляет собой (1a,5a,6a)-6-бензилидениламино-3-азабицикло[3.1.0]гексан.
21. Соединение формулы (III)
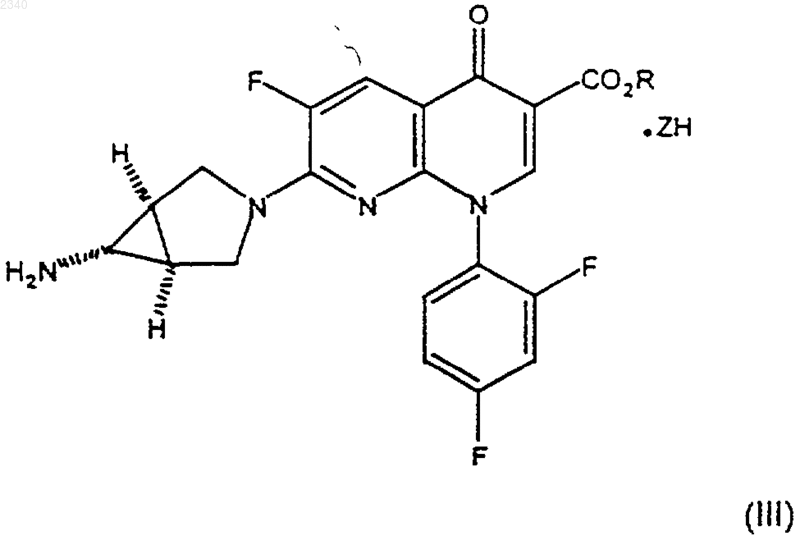
где R представляет собой C1-С6алкильную группу, a ZH представляет собой минеральную кислоту.
Текст
1 1. Область изобретения Данное изобретение относится к способу получения кислотных солей тровафлоксацина. Кислотные соли тровафлоксацина могут быть получены в результате гидролиза иминного промежуточного соединения с использованием мягких условий. 2. Предпосылки изобретения Хинолон- и нафтиридонкарбоновые кислоты, их цвиттер-ионные соли и их фармацевтически приемлемые соли полезны в качестве антибактериальных агентов, и они были получены согласно способам, описанным, например, в патенте США 4738968, Matsumoto et al.; в патенте США 4382937, Matsumoto et al.; в патенте США 4382892, Hayakawa et al.; в патенте США 4571396, Hutt et al.; в патенте США 4416884, Ishikawa et al.; в патенте США 4775668, Jefson et al.; в патенте США 5164402, Brighty; и в патенте Великобритании 2191776, Toyama Chemical Co. Ltd.(1,5,6)-(7-Амино-3-азабицикло[3.1.0.] гекс-3-ил)-1-(2,4-дифторфенил)-6-фтор-1,4 дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, также известная как тровафлоксацин,является одной из нафтиридонкарбоновых кислот, имеющих предпочтительные антибактериальные свойства Как и тровафлоксацин, кислотные соли тровафлоксацина обладают антибактериальными свойствами. Кислотные соли тровафлоксацина представляют собой водорастворимые пролекарственные формы тровафлоксацина. Тровафлоксацина гидрохлорид ранее был получен сочетанием этилового эфира 7-хлор-1-(2,4 дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8 нафтиридин-3-карбоновой кислоты и гидролизом полученного продукта с использованием водной соляной кислоты (патент США 5164402, Brighty, пример 12 А). Позднее, тровафлоксацина метансульфонат был получен сочетанием этилового эфира 7 хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро 4-оксо-1,8-нафтиридин-3-карбоновой кислоты с[1,5,6]-6-трет-бутоксикарбониламино-3 азабицикло[3.1.0.]гексаном и гидролизом полученного продукта с использованием метансульфоновой кислоты (патент США 5763454,Handanyan et al.). Несмотря на то, что вышеупомянутые способы надежно обеспечивают пригодные для использования количества кислотных солей тровафлоксацина, при осуществлении этих способов продуцируются молярные эквиваленты газа изобутилена как побочного продукта гидролиза трет-бутоксикарбонильных защитных групп. Изобутилен представляет собой легко воспламеняющееся вещество, и, как полагают,оказывает вредное воздействие на озоновый слой атмосферы. Соответственно, способ получения кислотных солей тровафлоксацина, в результате которого не продуцируется опасный газ изобутилен, является крайне желательным и выгодным. Цитирование или идентификация любой ссылки в разделе 2 этой заявки не должны истолковываться как признание того, что такая ссылка пригодна в качестве уровня техники для настоящей заявки. 3. Сущность изобретения Согласно данному изобретению предложен способ получения кислотной соли тровафлоксацина, имеющей формулу (IV) где ZH представляет собой минеральную кислоту, включающий в себя стадию, на которой соединение формулы (I) 3 бензилиденовое кольцо соединения формулы (I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1-С 6 алкильной или С 1-С 6 алкоксигруппой,приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду. Согласно изобретению далее предложены новые соединения формулы (I). Соединения формулы (I) пригодны в качестве промежуточных продуктов для синтеза кислотных солей тровафлоксацина. В предпочтительном воплощении изобретения соединение формулы (I) представляет собой этиловый эфир (1,5,6)7-(6-бензилидениламино-3-азабицикло[3.1.0] гекс-3-ил)-1-(2,4-дифторфенил)-6-фтор-1,4 дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты Кроме того, согласно изобретению предложен способ получения кислотной соли тровафлоксацина, имеющей формулу (IV), включающий в себя стадии, на которых: Далее, согласно изобретению предложен способ получения кислотных солей тровафлоксацина, включающий в себя стадии, на которых:(а) соединение формулы (I) приводят в контакт, по существу, в безводных условиях с минеральной кислотой ZH с получением соединения формулы (III)(б) соединение формулы (III) приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду. Далее, согласно изобретению предложены новые соединения формулы (III), которые пригодны в качестве промежуточных соединений для синтеза кислотных солей тровафлоксацина. В предпочтительном воплощении изобретения соединение формулы (III) представляет собой метансульфонатную соль этилового эфира тровафлоксацина где R является таким, как определено выше,приводят в контакт в присутствии третичного аминного основания с соединением формулы(II) метансульфонатная соль этилового эфира тровафлоксацина где бензилиденовое кольцо соединения формулы (II) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или C1-С 6 алкоксигруппой с получением соединения формулы (I); и(б) соединение формулы (I) приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду. Согласно изобретению, кроме того, предложены новые соединения формулы (II), пригодные в качестве промежуточных соединений для синтеза соединений формулы (I) и кислотных солей тровафлоксацина. В предпочтительном воплощении изобретения соединение формулы (II) представляет собой (1,5,6)-6 бензилидениламино-3-азабицикло[3.1.0]гексан Поскольку соединения формул (I) и (II) представляют собой имины, то они существуют либо в син, либо в анти-конфигурации. Понятно, что изобретение в том виде, как оно заявлено, включает в себя каждую из этих конфигураций или и их смесь. 4. Подробное описание изобретения 4.1. Определения Термин "алкил", как он используется в данной заявке, включает в себя углеводородную группу с прямой или разветвленной цепью, такую как метил, этил, пропил, изопропил, нбутил, изобутил, втop-бутил, трет-бутил и т.д. Термин "арил", как он используется в данной заявке, включает в себя ароматическую углеводородную группу, такую как фенил или нафтил, возможно замещенную заместителями в количестве от одного до трех, независимо выбранными из группы, в которую входят фторо,хлоро, циано, нитро, трифторметильная, (С 1 С 6)алкокси, (С 6-С 10)арилокси, трифторметокси,дифторметокси и (С 1-С 6)алкильная группы. 5 Термин "реакция сочетания", как он используется в данной заявке, означает реакцию,результатом которой является образование соединения формулы (I) через взаимодействие соединения формулы (II) с соединением формулы (V) в присутствии третичного аминного основания. Термин "реакция гидролиза", как он используется в данной заявке, означает реакцию между соединением формулы (I) и композицией, содержащей минеральную кислоту и воду. Термин "иминобразующая реакция", как он используется в данной заявке, означает реакцию(1,5,6)-6-амино-3-азабицикло[3.1.0] гексана с возможно замещенным альдегидом 5 как показано на схеме 1. Термин "третичное аминное основание",как он используется в данной заявке, означает органическое соединение, имеющее атом азота,образующий три связи, каждая из которых является sp2 связью или sp3 связью, исключительно с атомами углерода. Термин "кислотная соль тровафлоксацина", как он используется в данной заявке, означает соль тровафлоксацина с минеральной кислотой. Термин "по существу в безводных условиях", как он используется в данной заявке, означает условия реакции, при которых вода присутствует в количестве не выше приблизительно 1% от массы реакционной смеси. 4.2. Соединения формулы (II) Соединения формулы (II) могут быть получены согласно схеме 1. Нитроциклопропанирование(1,5,6)-3-N-бензил-6-нитро-2,4-диоксо-3 азабицикло[3.1.0]гексана (2). Восстановление иминокарбонильной группы соединения 2 с использованием NaBH4 в присутствии ВF3-ТГФ обеспечивает получение (1,5,6)-3-N-бензил 6-нитро-3-азабицикло[3.1.0]гексана (3). Восстановление нитрогруппы соединения 3 до аминогруппы с сопутствующим гидрогенолизом егоN-бензильной группы доводят до конца гидрированием в присутствии 10% палладия на угле с получением (1,5,6)-6-амино-3-азабицикло[3.1.0]гексана (4). Затем (1,5,6)-6-амино-3 азабицикло[3.1.0]гексан подвергают взаимодействию с возможно замещнным альдегидом 5 в иминобразующей реакции с получением соединения формулы (II), которое несет защитную группу имино на 6-аминогруппе соединения(1,5,6)-6-амино-3-азабицикло[3.1.0]гексана. Соединения 1-4 могут быть получены с использованием способов, описанных ниже в разделе 5 или способами, известными специалистам в данной области. Соединение 3 может быть получено согласно способам, описанным Braish et 6 Альдегид 5 возможно замещен одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или C1-С 6 алкоксигруппой. Альдегиды 5 коммерчески доступны или легко могут быть синтезированы способами, известными специалистам. Подходящие альдегиды 5 включают в себя бензальдегид, 2-хлорбензальдегид,3-хлорбензальдегид, 4-хлорбензальдегид, 2 бромбензальдегид,3-бромбензальдегид,4 бромбензальдегид,4-этилбензальдегид,отолуальдегид, м-толуальдегид, п-толуальдегид и т.п., но не ограничены ими. Предпочтительным альдегидом 5 является бензальдегид. Схема 1 Реакцию, результатом которой является образование соединения формулы (II) (иминобразующая реакция), проводят приведением в контакт (1,5,6)-6-амино-3-азабицикло[3.1.0] гексана (4) с альдегидом (5). Обычно молярное отношение[3.1.0]гексана к альдегиду 5 находится в интервале от приблизительно 3:1 до приблизительно 1:3, предпочтительно от приблизительно 1,5:1 до приблизительно 1:1,5 и наиболее предпочтительно от приблизительно от 1,1:1 до приблизительно 1:1,1. Иминобразующая реакция может быть проведена, возможно, в присутствии инертного органического растворителя. Подходящие органические растворители включают в себя диэтиловый эфир, тетрагидрофуран, метиленхлорид,хлороформ, четыреххлористый углерод, толуол,ксилолы и простые спирты, например метанол и изопропанол, но не ограничены ими. Когда иминобразующую реакцию проводят в присутствии инертного органического растворителя,реакционная смесь представляет собой от приблизительно 1 до приблизительно 95% об./об. раствор в инертном органическом растворителе; предпочтительно от приблизительно 5 до приблизительно 40% об./об. раствор в инертном органическом растворителе. Предпочтительно иминобразующую реакцию проводят в отсутствии инертного органического растворителя. Иминобразующую реакцию предпочтительно проводят в присутствии третичного 7 аминного основания независимо от того, используют или нет инертный органический растворитель. Без всякой связи с конкретной теорией, считается, что функции третичного аминного основания заключаются в удалении любых следовых количеств кислоты, присутствующей в реакционной среде, которые могут инициировать разложение, например гидролиз, соединения формулы (II). Подходящие третичные аминные основания включают в себя триэтиламин, N,N-диизопропилэтиламин, диметилизопропиламин, метилдибутиламин, трифениламин, пиридин, 4-диметиламинопиридин, 2,6 лутидин, 2,4,6-коллидин, N,N,N',N'-тетраметил 1,8-нафталиндиамин и т.п., но не ограничены ими. В случае, когда используют третичное аминное основание, предпочтительным третичным аминным основанием является триэтиламин. Если используют третичное аминное основание, то оно предпочтительно присутствует в избытке по отношению к (1,5,6)-6-амино-3 азабицикло[3.1.0]гексану или к альдегиду 5,какой бы из них ни присутствовал в большем количестве. Более предпочтительно молярное отношение третичного аминного основания к(1,5,6)-6-амино-3-азабицикло[3.1.0]гексану или к альдегиду 5, какой бы из них ни присутствовал в большем количестве, составляет от приблизительно 10:1 до приблизительно 2:1, наиболее предпочтительно от приблизительно 5:1 до приблизительно 2:1. Иминобразующую реакцию проводят при температуре от примерно комнатной до примерно температуры дефлегмации любого из используемых инертного органического растворителя или третичного аминного основания,предпочтительно при температуре от примерно комнатной до примерно 120 С, более предпочтительно при температуре от примерно 45 до примерно 110 С и наиболее предпочтительно при температуре от примерно 70 до примерно 100 С. Когда иминобразующую реакцию проводят в отсутствии инертного органического растворителя, но в присутствии третичного аминного основания триэтиламина, данную иминобразующую реакцию проводят при примерно температуре дефлегмации триэтиламина. Соединения формулы (II), полученные в результате иминообразующей реакции, могут быть очищены от их реакционной смеси с использованием стандартных методов перекристаллизации, известных специалистам в данной области, или могут быть получены простым концентрированием иминобразующей реакционной смеси, возможно в вакууме, для удаления инертного органического растворителя или третичного аминного основания. Альтернативно,соединения формулы (II) могут образовыватьсяin situ, и могут быть использованы без очистки в качестве промежуточных соединений для полу 002340 8 чения соединений формулы (I) и кислотных солей тровафлоксацина. В предпочтительном воплощении изобретения альдегид 5 представляет собой бензальдегид, а соединение формулы (II) представляет собой (1,5,6)-6-бензилидениламино-3-азабицикло[3.1.0]гексан. 4.3. Соединения формулы (I) В общем случае соединения формулы (I) получают объединением в произвольном порядке соединения формулы (II), соединения формулы (V) и третичного аминного основания. Соединения формулы (II) могут быть получены согласно способам, описанным выше в разделе 4.3. Соединения формулы (V) могут быть получены согласно способам, описанным в патенте Великобритании 2191776. Третичное аминное основание является таким, как описано выше в отношении иминобразующей реакции. Предпочтительно третичное аминное основание имеет формулу(R2)(R2)(R2)N, где каждый из R2 независимо представляет собой C1-С 6 алкильную или (С 6 С 10)арильную группу; или третичное аминное основание представляет собой ароматическое соединение, имеющее эндоциклический атом азота. Подходящие третичные аминные основания включают в себя триэтиламин, N,Nдиизопропилэтиламин, диметилизопропиламин,метилдибутиламин, трифениламин, пиридин, 4 диметиламинопиридин,2,6-лутидин,2,4,6 коллидин, N,N,N',N'-тетраметил-1,8-нафталиндиамин и т.п., но не ограничиваются ими. Предпочтительно третичное аминное основание представляет собой триэтиламин. Молярное отношение соединения формулы (II) к соединению формулы (V) находится в интервале от примерно 1,5:1 до примерно 1:1,5 и предпочтительно от примерно 1,3:1 до примерно 1:1,3. Молярное отношение третичного аминного основания к соединению формулы (II) или к соединению формулы (V), какое бы из них не использовалось в большем количестве, в общем случае находится в интервале от примерно 10:1 до примерно 1:1, предпочтительно от примерно 6:1 до примерно 1:1. Без всякой связи с конкретной теорией,считается, что использование третичного аминного основания по существу исключает образование нежелательных побочных продуктов, образующихся в результате гидролиза имина и последующего взаимодействия первичной экзоциклической аминогруппы соединения формулы (II) с хлорогруппой по атому углерода в положении 7 соединения формулы (V). Кроме того, третичное аминное основание способствует процессу образования связей между атомом углерода в положении 7 соединения формулы(V) и кольцевым атомом азота соединения формулы (II). Если третичное аминное основание достаточно хорошо солюбилизирует соединение 9 формулы (II) и соединение формулы (V), то нет необходимости проводить реакцию сочетания в присутствии дополнительного растворителя. Тем не менее, при некоторых обстоятельствах может быть желательным, чтобы реакция сочетания протекала в присутствии растворителя для реакции сочетания, например, для лучшей солюбилизации реагентов или для регулирования экзотермичности реакции. Подходящие растворители для реакции сочетания включают в себя (С 1-С 6)спирты, такие как метанол, этанол и изопропанол; эфиры, такие как тетрагидрофуран(ТГФ) и диэтиловый эфир; полярные апротонные растворители, такие как диметилсульфоксид, ацетонитрил, диметилформамид и Nметилпирролидинон; и их смеси. Соединение формулы (II) и соединение формулы (V) должны быть, по меньшей мере, частично растворимы в выбранном для реакции сочетания растворителе; соответственно, это полностью в компетенции специалиста выбрать, при необходимости, подходящий растворитель или смесь растворителей. Реакцию сочетания удобно проводить при температуре примерно 60 С или выше и в течение периода времени в интервале от примерно 1 до примерно 48 ч, предпочтительно в течение периода времени от примерно 2 до примерно 24 ч. Более предпочтительным является проводить реакцию сочетания при температуре дефлегмации третичного аминного основания или конкретного используемого растворителя и в течение периода времени от примерно 6 до примерно 20 ч. Продукт реакции сочетания, т.е. соединение формулы (I), может быть очищен перекристаллизацией из традиционно используемых в лабораторной практике растворителей или другими известными специалистам способами. В тех случаях, когда соединение формулы (I) нерастворимо в третичном аминном основании или в растворителе для реакции сочетания, соединение формулы (I) может быть выделено фильтрацией и возможно перекристаллизацией соединения формулы (I) из традиционно используемых в лабораторной практике растворителей или их смесей, или очисткой соединения формулы (I) с использованием любого другого известного специалистам способа(ов). Соединение формулы (II), используемое в реакции сочетания может быть выделено и очищено из иминобразующей реакционной смеси, описанной выше в разделе 4.2, или предпочтительно может быть образовано и приведено в контакт с соединением формулы (V) и третичным аминным основанием in situ. В этом случае соединение формулы (II) образуется согласно иминобразующей реакции,описанной выше, и в иминобразующую реакционную смесь добавляют соединение формулы(V). Если третичное аминное основание используют в иминобразующей реакционной смеси, то 10 добавление дополнительного количества третичного аминного основания в реакционную смесь при проведении реакции сочетания является необязательным. Если третичное аминное основание не присутствует в растворе соединения формулы (V), то третичное аминное основание добавляют в реакционную смесь при проведении реакции сочетания либо совместно с добавлением соединения формулы (V), либо до добавления соединения формулы (V), либо после добавления соединения формулы (V). 4.4. Кислотные соли тровафлоксацина Кислотные соли тровафлоксацина получают приведением в контакт соединения формулы(I) с композицией, содержащей минеральную кислоту и воду (реакция гидролиза). Без всякой связи с конкретной теорией, считается, что минеральная кислота удаляет защитную группу имино из соединения формулы (I) и что композиция, содержащая минеральную кислоту и воду, гидролизует эфирную группу на атоме углерода в положении 3 соединения формулы (I) с образованием тровафлоксацина, который образует стабильную кислотную соль с 1 эквивалентом минеральной кислоты, используемой в реакции гидролиза. Подходящие минеральные кислоты включают в себя метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, азотную кислоту, серную кислоту, фосфорную кислоту, соляную кислоту, бромоводородную кислоту, винную кислоту, лимонную кислоту, уксусную кислоту и малеиновую кислоту, и т.п., но не ограничены ими. Понятно,что кислотная соль тровафлоксацина, полученная в результате реакции гидролиза, представляет собой соль тровафлоксацина конкретной минеральной кислоты, которую используют в данной реакции. В общем случае, молярное отношение минеральной кислоты к соединению формулы (I) находится в интервале от примерно 10:1 до примерно 1:1, предпочтительно от примерно 5:1 до примерно 2:1. Массовое отношение воды к общей массе соединения формулы (I) и минеральной кислоты составляет от примерно 10:1 до примерно 2:1. Возможно, что в реакционную смесь при проведении реакции гидролиза может быть добавлен водорастворимый органический растворитель для того, чтобы способствовать солюбилизации соединения формулы (I). Такой водорастворимый органический растворитель предпочтительно представляет собой не нуклеофильный растворитель, и он не образует производное карбоновой кислоты с эфирной группой соединения формулы (I), или с карбоксильной группой кислотной группы тровафлоксацина по атому углерода в положении 3. Полезные в этом отношении водорастворимые органические растворители включают в себя тетрагидрофуран,диметилформамид, диметилсульфоксид, N 11 метилпирролидинон и т.п., но не ограничены ими. Если в реакции гидролиза используют водорастворимый органический растворитель, то предпочтительным водорастворимым органическим растворителем является тетрагидрофуран. Реакцию гидролиза проводят при температуре в интервале от примерно комнатной температуры до примерно температуры дефлегмации воды или водорастворимого органического растворителя в течение периода времени от приблизительно 1 до приблизительно 48 ч. Предпочтительно реакцию гидролиза проводят при температуре дефлегмации воды или водорастворимого органического растворителя в течение периода времени от приблизительно 12 до приблизительно 36 ч. Кислотная соль тровафлоксацина может быть выделена из реакционной смеси гидролиза концентрированием реакционной смеси гидролиза до меньшего объема, возможно охлаждением полученного концентрата и фильтрованием полученного осадка кислотной соли тровафлоксацина. Реакционная смесь стадии гидролиза может быть предварительно обработана обесцвечивающим углем, подвергнута фильтрованию перед концентрированием. Кроме того,перед фильтрованием может быть желательным вручную или механически гранулировать продукт - кислотную соль тровафлоксацина. После фильтрования продукт - кислотная соль тровафлоксацина возможно может быть перекресталлизован с использованием традиционных в лабораторной практике растворителей или очищен с использованием других средств, известных специалистам. Необходимо указать на то, что кислотные соли тровафлоксацина могут быть получены также из соединения формулы (I) через двухстадийный способ: на первой стадии защитную группу имино удаляют из соединения формулы(I) без гидролиза эфирной группы по атому углерода в положении 3 с образованием соединения формулы (III); а на второй стадии эфирную группу по атому углерода в положении 3 соединения формулы (III) гидролизуют с получением кислотной соли тровафлоксацина. Соответственно, соединения формулы (III) пригодны в качестве промежуточных продуктов для синтеза кислотных солей тровафлоксацина, а также для синтеза пролекарств. Соединения формулы (III) получают приведением в контакт соединения формулы (I) с минеральной кислотой, возможно в присутствии инертного органического растворителя. В общем случае, молярное отношение минеральной кислоты к соединению формулы (I) находится в интервале от примерно 10:1 до примерно 1:1,предпочтительно от примерно 5:1 до примерно 2:1. Чтобы способствовать солюбилизации соединения формулы (I) можно добавлять инертный органический растворитель. Если инертный органический растворитель добавляют, то пред 002340 12 почтительным инертным органическим растворителем является тетрагидрофуран. Понятно, что поскольку в соединении формулы (III) остается эфирная группа по атому углерода в положении 3, реакцию, используемую для образования соединения формулы (III),проводят по существу в безводных условиях таким образом, чтобы исключить воду, которая может гидролизовать эфирную группу. Реакцию, используемую для получения соединения формулы (III), проводят при температуре в интервале от примерно комнатной температуры до температуры примерно 80 С в течение периода времени от примерно 1 до примерно 24 ч. Предпочтительно эту реакцию проводят при температуре от примерно 40 до температуры примерно 60 С в течение времени от приблизительно 5 до приблизительно 20 ч. Полученное соединение формулы (III) может быть выделено охлаждением реакционной смеси до комнатной температуры или ниже и фильтрованием продукта - соединения формулы(III). Если требуется, чтобы соединение формулы (III) было выделено в форме порошка, перед фильтрованием соединение формулы (III) может быть подвергнуто гранулированию, вручную или механически. Сразу после фильтрования соединение формулы (III) может быть перекристаллизовано или очищено другими известными специалистам способами. Сразу после выделения соединения формулы (III) полученное соединение формулы (III) может быть превращено в кислотную соль тровафлоксацина приведением в контакт соединения формулы (III) с композицией, содержащей минеральную кислоту и воду. В общем случае,молярное отношение минеральной кислоты к соединению формулы (III) находится в интервале от примерно 5:1 до примерно 1:1, предпочтительно от примерно 3:1 до примерно 1:1. Массовое отношение воды к общей массе соединения формулы (I) и минеральной кислоты составляет от примерно 10:1 до примерно 2:1. Возможно, что для облегчения солюбилизации соединения формулы (III) может быть добавлен водорастворимый органический растворитель, описанный выше. Если используют водорастворимый органический растворитель,то этим водорастворимым органическим растворителем предпочтительно является тетрагидрофуран. Превращение соединений формулы (III) в кислотные соли тровафлоксацина происходит при температуре в интервале от примерно комнатной температуры до примерно температуры дефлегмации воды или водорастворимого органического растворителя в течение периода времени от примерно 1 до примерно 12 ч. Предпочтительно эту реакцию проводят при температуре от примерно 50 до примерно 100 С в течение периода времени от примерно 4 ч до 8 ч. 13 Полученная таким образом кислотная соль тровафлоксацина может быть выделена из реакционной смеси согласно способам осуществления реакции гидролиза, описанным выше. 4.5. Цвиттер-ион тровафлоксацина Несмотря на то, что кислотные соли тровафлоксацина пригодны в качестве антибактериальных агентов, может быть желательным приготовить их в форме, имеющей более высокое процентное содержание активного соединения, т.е. в отсутствии кислотной соли. В таком случае кислотные соли тровафлоксацина, полученные согласно описанным в данной заявке способам, могут быть обработаны насыщенным водным раствором бикарбоната натрия (см. Международную публикацию WO 97/07800,пример 1 А) с образованием цвиттер-иона тровафлоксацина, имеющего приведенную ниже структуру цвиттер-ион тровафлоксацина 4.6. Способы применения кислотных солей тровафлоксацина Кислотные соли тровафлоксацина пригодны для лечения бактериальных инфекций широкого спектра, в частности для лечения инфекционных заболеваний,вызванных граммположительными бактериальными штаммами. Кислотные соли тровафлоксацина можно вводить сами по себе, но, как правило, их будут вводить в смеси с фармацевтическим носителем, выбранным с учетом предполагаемого пути введения и стандартной фармацевтической практики. Их можно вводить, например, перорально, либо в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза,либо в капсулах, сами по себе или вместе с эксципиентами, либо в форме эликсиров или суспензий, содержащих корригенты или красящие агенты. В случае животных их преимущественно добавляют в корм или в питьевую воду в концентрации 5-5000 млн-1, предпочтительно 25-500 млн-1. Их можно инъецировать парентерально, например внутримышечно, внутривенно или подкожно. Для парентерального введения их лучше использовать в форме стерильного водного раствора, который может содержать другие растворенные вещества, например соль или глюкозу, в количестве, достаточном для того, чтобы сделать раствор изотоничным. В случае животных кислотные соли тровафлоксацина можно вводить внутримышечно или подкожно при уровнях дозировки приблизительно 0,1-50 мг/кг/сутки, преимущественно 0,2-10 14 мг/кг/сутки, которые назначают в однократной суточной дозе или в до 3 разделенных дозах. Кислотные соли тровафлоксацина можно вводить людям для лечения бактериальных болезней либо пероральным, либо парентеральным путем, и перорально можно вводить при уровнях дозировки от приблизительно 0,1 до 500 мг/кг/сутки, преимущественно 0,5-50 мг/кг/сутки, в однократной дозе или в до 3 разделенных дозах. Для внутримышечного или внутривенного введения уровни дозировки составляют приблизительно 0,1-200 мг/кг/сутки,преимущественно 0,5-50 мг/кг/сутки. В то время как при внутримышечном введении можно применять однократную дозу или до 3 разделенных доз, внутривенное введение может включать в себя непрерывное капельное введение. В зависимости от веса и состояния субъекта, которого лечат, и выбранного конкретного пути введения обязательно будут иметь место отклонения, как это известно специалистам в данной области. Антибактериальная активность кислотных солей тровафлоксацина продемонстрирована тестированием по репликаторной методике Стирса, которая является стандартным in vitro методом бактериального тестирования, описанным Е. Steers et al. в Antibiotics and Chemotherapy, 9, 307 (1959). Приведенные ниже примеры изложены для более полного понимания данного изобретения и не должны расцениваться как ограничение изобретения, описанного и заявленного в этом документе. Варианты изобретений, которые могут быть в компетенции специалистов, включая замену всех эквивалентов, известных на данный момент, или которые будут разработаны впоследствии, должны рассматриваться как находящиеся в объеме изобретения, включенного в данную заявку. Пример 1. (1,5,6)-3-N-бензил-6-нитро 2,4-диоксо-3-азабицикло[3.1.0]гексан (2).N-Бензилмалеимид (1) (500 г, 2,67 моль),90% бромнитрометан (831 г, 5,34 моль), порошкообразные молекулярные сита, 200 меш (2020 г), и толуол (12 дм 3) перемешивали под азотом при температуре -10 С. 1,2-Диметил-1,4,5,6 тетрагидропиримидин (616 г, 5,49 моль) медленно добавляли в течение приблизительно 3 ч,поддерживая температуру реакции ниже -8 С на протяжении всего процесса добавления. После завершения добавления реакционную смесь перемешивали в течение 1,5 ч при температуре 25 С, фильтровали в атмосфере азота в герметичном напорном фильтре, чтобы удалить сита и образовавшуюся смолу, и сита промывали толуолом (2 л). Объединенные фильтраты промывали 2 н. соляной кислотой (3750 см 3), обрабатывали углеродом (50 г) при 70 С, фильтровали в течение 1 ч, концентрировали и растирали с 2-пропанолом (примерно 4 дм 3) с полу 15 чением кристаллов вышеназванного соединенияm/z 246 (M+), 200 (М+ -NO2, 100%);Н (300 МГц; CDCl3) 7,3 (m, 5H, Ph), 4,54 (s, 2 Н, бензильный, 4,45 (s, 1 Н, 6b), 3,35 (s, 2 Н, 3-цикл). Пример 2. (1,5,6)-3-N-бензил-6-нитро 3-азабицикло[3.1.0]гексан (3). Тетрагидрофуран (350 см 3), боргидрид натрия (14,1 г) и (1,5,6)-3-N-бензил-6-нитро 2,4-диоксо-3-азабицикло[3.1.0]гексан (2) (35,0 г,ммоль), полученный выше, перемешивали в атмосфере азота в течение 0,25 ч, а затем обрабатывали по каплям комплексом трифторид бора/ТГФ, содержащим 21,5% BF3 (44,9 см 3), так,чтобы температура реакционной смеси не превышала 40 С. После завершения добавления реакционную смесь перемешивали в течение 3 ч при 40 С, осторожно гасили смесью вода/TГФ в соотношении 1:1 (70 см 3), чтобы избежать чрезмерного вспенивания, и перемешивали в течение 0,5 ч при 50 С для гарантии того, что гашение не прореагировавшего диборана, образовавшегося in situ закончено. В результате гашения образовывалась солевая взвесь, которую фильтровали и промывали ТГФ (140 см 3); объединенный фильтрат частично концентрировали,разбавляли водой (350 см 3) и концентрировали далее для удаления большей части ТГФ, и экстрагировали этилацетатом (140 см 3). Полученный этилацетатный раствор концентрировали с получением вышеназванного соединения в виде прозрачного масла (30,6 г, 97%). Элементный анализ, произведенный для его мезилатной соли, которая была получена смешиванием эквивалента (1,5,6)-3-N-бензил-6-нитро-3-азабицикло[3.1.0]гексана с эквивалентом метансульфоновой кислоты в спиртовом растворителе и концентрированием полученной смеси. Обнаружено: С, 49,8: Н, 6,0; N, 9,1; S, 10,2.CDCl3) 7,3 (m, 5H, Ph), 4,63 (s, 1H, 6b), 3,6 (S,2H, бензильный), 3,14 (d, 2H, 5-цикл), 2,51 (m,2H, 3-цикл). Пример 3. (1,5,6)-6-амино-3-азабицикло[3.1.0]гексан(4). Смесь (1,5,6)-3-N-бензил-6-нитро-3 азабицикло[3.1.0]гексана (3) (25,2 г, 115,5 ммоль), 10% палладия на угле (содержание воды 55%) (10,0 г), воды (125 см 3) и 2-пропанола(250 см 3) гидрировали в аппарате Парра при 50 С и давлении 3,5 атм в течение 24 ч. Катализатор отфильтровывали, а полученный фильтрат концентрировали в вакууме с получением вышеназванного соединения в виде масла (10,4 г,91,7%), чистота GC (газовая хроматография) 83%. Полученное таким образом вещество использовали без дальнейшей очистки. Очистка колоночной хроматографией на силикагеле с 16 использованием СНСl3, 55%; СН 3 ОН, 35%; и концентрированного NH4OH, 10%, дала вышеназванное соединение в виде прозрачного масла: m/z 96 (M+ -2);(300 МГц, CD3OD) 4,86 (s,NНы и МеОН), 2,97 (2H, d, J=11,4 Гц), 2,77 (2H,dt, J=1,4 и 11,4 Гц), 2,06 (1H, t, J=2,2 Гц), 1,42 (2(30 см 3) и 10% палладия на угле (содержание воды 50%) (12,3 г) гидрировали при давлении 50 фунт./кв.дюйм (-350 кПа) и температуре 50 С в течение 18-24 ч в шейкере Парра. Палладиевый катализатор отфильтровывали, а полученный бледно-желтый фильтрат подвергали азеотропной дистилляции при постоянном объеме для удаления воды. Полученный раствор обрабатывали триэтиламином (46 г, 456 ммоль) и нагревали до образования флегмы. Бензальдегид (15,0 г, 141 ммоль) добавляли по каплям в течение 15 мин. Реакционную смесь нагревали при температуре дефлегмации в течение 4 ч до образования (1,5,6)-6-бензилидениламино-3-азабицикло[3.1.0]гексана in situ. Полученный оранжевый раствор охлаждали до 40-50 С, добавляли этиловый эфир 7-хлор-1-(2,4-дифторфенил)6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3 карбоновую кислоту (42,45 г, 111 ммоль; см. публикацию патента Великобритании 2191776) и триэтиламин (13,1 г, 130 ммоль). Полученную взвесь нагревали при температуре дефлегмации в течение 6-18 ч, охлаждали до 20 С и перемешивали в течение 5 ч. Взвесь фильтровали и выделяли вышеназванное соединение в виде белого твердого вещества (выход 75,5% в расчете на (1,5,6)-3-N-бензил-6 нитро-2,4-диоксо-3-азабицикло[3.1.0]гексан; 96,6% в расчете на этиловый эфир 7-хлор-1-(2,4 дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8 нафтиридин-3-карбоновой кислоты). Вышеназванное соединение перекристаллизовывали из ацетонитрила, т.пл. 148-155 С, разл.F, 10,35; N, 10,2%); m/z 533 (M+ +1); Н (300 МГц, CDCl3) 8,33 (s, 1H), 8,29 (s, 1H), 7,97 (d,J=7,1 Гц, 1 Н), 7,58 -7,61 (m, 2H), 7,46 (td, J=5,77,8,6 Гц, 1H), 7,31-7,35 (m, 3H), 6,97-7,08 (m, 2H),4,31 (q, J=7,1 Гц, 2H), 3,80 (br. S, 2H), 3,64 (br. S,2H), 2,75 (t, J=1,8 Гц, 1 Н), 2,13 (s, 2H), 1,32 (t,J=7,1 Гц, 3H), vmax (KBr) см-1 1730, 1697, 1632. Пример 5. Метансульфонатная соль тровафлоксацина (метод А). Тетрагидрофуран (250 см 3), этиловый эфир(1,5,6)-7-(6-бензилидениламино-3-азабицик 17 ло[3.1.0]гекс-3-ил)-1-(2,4-дифторфенил)-6-фтор 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты (25,05 г, 47 ммоль), полученный выше, и воду (250 см 3) обрабатывали 97% метансульфоновой кислотой (13,3 г, 138 ммоль) и нагревали до образования флегмы в течение 24 ч. Полученный раствор охлаждали до 45 С, обрабатывали активированным углем (2,5 г) в течение 1 ч и фильтровали. Полученный фильтрат концентрировали под вакуумом до приблизительно 25% от его первоначального объема с получением взвеси белых кристаллов, охлаждали до 15-25 С, гранулировали в течение 4 ч и фильтровали с получением вышеназванного соединения (16,86 г, 70,0%). т.пл. 253-256 С,разл.;(Обнаружено: С, 49,3; Н, 3,75; F, 11,2; N,11,0; S, 6,3. С 20 Н 15F3N4OзСН 4O3S требует С,49,2; Н, 3,7; F, 11,1; N, 10, 9; S, 6,3%); Н (300 МГц; d6-DMSO) 8,85 (s, 1H), 8,17(br, m, 2H),8,11 (d, 1 Н), 7,83 (m, 2 Н), 7,62 (m, 2 Н), 7,37 (m,2 Н), 3,67 (br. S, 3 Н), 2,45 (s, 1H), 2,37 (s, 3 Н),2,08 (s, 2H). Вышеназванное соединение может быть выделено также в виде моногидрата. Пример 6. Цвиттер-ион тровафлоксацина. Тетрагидрофуран (250 см 3), этиловый эфир(1,5,6)-7-(6-бензилидениламино-3-азабицикло[3.1.0]гекс-3-ил)-1-(2,4-дифторфенил)-6-фтор 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты (25,05 г, 47 ммоль), полученный выше, и воду (250 см 3) обрабатывали 97% метансульфоновой кислотой (13,3 г, 138 ммоль) и нагревали до образования флегмы в течение 24 ч. Полученный раствор, который содержал метансульфонатную соль тровафлоксацина, охлаждали до 45 С, обрабатывали активированным углем (2,5 г) в течение 1 ч и фильтровали. Обработка фильтрата насыщенным водным раствором бикарбаната натрия до рН 8 (см. публикацию РСТ WO 97/07800, пример 1 А) дает вышеназванное соединение. Пример 7. Метансульфонатная соль этилового эфира тровафлоксацина. Этиловый эфир (1,5,6)-7-(6-бензилидениламино-3-азабицикло[3.1.0]гекс-3-ил)-1-(2,4 дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8 нафтиридин-3-карбоновой кислоты (6,02 г, 11,3 ммоль), полученный выше, тетрагидрофуран (90 см 3) и метансульфоновую кислоту (1,11 г, 11,2 ммоль) смешивали вместе до образования взвеси. Взвесь нагревали до температуры 45-55 С и выдерживали в этом температурном диапазоне в течение 4 ч, на протяжении которых к реакционной смеси добавляли дополнительное количество метансульфоновой кислоты (2,2 г, 22,4 ммоль). После нагревания в течение дополнительных 12 ч при температуре в интервале 4555 С реакция завершалась. Реакционную смесь охлаждали до температуры 0-25 С, гранулировали в течение времени до 10 ч, фильтровали и 18 высушивали под вакуумом при температуре 4045 С с получением вышеназванного соединения в виде белого твердого вещества (выход 3,76 г,62%). Пример 8. Метансульфонатная соль тровафлоксацина (метод В). Метансульфонатную соль этилового эфира тровафлоксацина (50,0 г, 92,5 ммоль), полученную выше, обрабатывали тетрагидрофураном(450 см 3), водой (50 см 3) и метансульфоновой кислотой (13,4 г, 139 ммоль) до образования взвеси. Реакционную смесь в виде взвеси нагревали в течение 4 ч при температуре 70-80 С,затем дистилляцией удаляли 250 см 3 растворителя. Полученную концентрированную реакционную смесь разбавляли водой (250 см 3) до образования раствора, который нагревали при 7080 С в течение 2 ч, пока реакция не завершится. Полученный растворитель (200 см 3) удаляли под вакуумом при температуре 55-65 С. Полученный остаток гранулировали при 20-25 С в течение 16 ч, фильтровали и высушивали под вакуумом при температуре 30-50 С с получением вышеназванного соединения (выход: 43,8 г,92,4%). Вышеназванное соединение было идентично, по всем параметрам, мезилату тровафлоксацина, полученному выше в примере 5. Полное раскрытие цитируемых источников информации включено в данный документ ссылкой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения кислотной соли тровафлоксацина, имеющей формулу (IV) где ZH представляет собой минеральную кислоту, включающий в себя стадию, на которой соединение формулы (I) где R представляет собой C1-С 6 алкильную группу и где бензилиденовое кольцо соединения формулы (I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или C1-С 6 алкоксигруппой,приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду. 2. Способ по п.1, где R представляет собой этил. 19 3. Способ по п.1, где минеральная кислота выбрана из группы, в которую входят метансульфоновая кислота, этансульфоновая кислота,бензолсульфоновая кислота, азотная кислота,серная кислота, фосфорная кислота, соляная кислота, бромоводородная кислота, винная кислота, лимонная кислота, уксусная кислота и малеиновая кислота. 4. Способ по п.1, где данный способ выполняют в присутствии инертного органического растворителя. 5. Способ получения кислотной соли тровафлоксацина, имеющей формулу (IV) где ZH представляет собой минеральную кислоту, включающий в себя стадии, на которых: 20 сульфоновая кислота, этансульфоновая кислота,бензолсульфоновая кислота, азотная кислота,серная кислота, фосфорная кислота, соляная кислота, бромоводородная кислота, винная кислота, лимонная кислота, уксусная кислота и малеиновая кислота. 8. Способ по п.5, где третичное аминное основание выбрано из группы, в которую входят триэтиламин, N,N-диизопропилэтиламин, диметилизопропиламин, метилдибутиламин, трифениламин, пиридин, 4-диметиламинопиридин,2,6-лутидин, 2,4,6-коллидин и N,N,N',N'тетраметил-1,8-нафталиндиамин. 9. Способ по п.6, где стадию (а) данного способа выполняют в присутствии инертного органического растворителя. 10. Способ по п.6, где стадию (б) данного способа выполняют в присутствии водорастворимого органического растворителя. 11. Способ получения кислотной соли тровафлоксацина, имеющей формулу (IV) где ZH представляет собой минеральную кислоту, включающий в себя стадии, на которых:(а) соединение формулы (I) где R представляет собой C1-С 6 алкильную группу, приводят в контакт в присутствии третичного аминного основания с соединением формулы где бензилиденовое кольцо соединения формулы (II) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или C1-С 6 алкоксигруппой,с получением соединения формулы (I)(б) соединение формулы (I) приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду. 6. Способ по п.5, где R представляет собой этил. 7. Способ по п.5, где минеральная кислота выбрана из группы, в которую входят метан где R представляет собой С 1-С 6 алкильную группу; и бензилиденовое кольцо соединения формулы(I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или С 1-С 6 алкоксигруппой, приводят в контакт по существу в безводных условиях с минеральной кислотой с получением соединения формулы (III)(б) соединение формулы (III) приводят в контакт с композицией, содержащей минеральную кислоту ZH и воду. 12. Способ по п.11, где R представляет собой этил. 13. Способ по п.11, где минеральная кислота выбрана из группы, в которую входят ме 21 тансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, азотная кислота, серная кислота, фосфорная кислота, соляная кислота, бромоводородная кислота, винная кислота, лимонная кислота, уксусная кислота и малеиновая кислота. 14. Способ по п.11, где стадию (а) выполняют в присутствии инертного органического растворителя. 15. Способ по п.11, где стадию (б) выполняют в присутствии водорастворимого органического растворителя. 16. Соединение формулы (I) где R представляет собой C1-С 6 алкильную группу; и бензилиденовое кольцо соединения формулы(I) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или C1-С 6 алкоксигруппой. 17. Соединение по п.16, где R представляет собой этил. 18. Соединение по п.16, где данное соединение представляет собой этиловый эфир где бензилиденовое кольцо соединения формулы (II) возможно замещено одной или более чем одной фторо, хлоро, бромо, иодо, C1 С 6 алкильной или C1-С 6 алкоксигруппой. 20. Соединение по п.19, которое представляет собой (1,5,6)-6-бензилидениламино-3 азабицикло[3.1.0]гексан. 21. Соединение формулы (III) где R представляет собой C1-С 6 алкильную группу, a ZH представляет собой минеральную кислоту.
МПК / Метки
МПК: C07D 471/04
Метки: солей, способ, тровафлоксацина, получения, кислотных
Код ссылки
<a href="https://eas.patents.su/12-2340-sposob-polucheniya-kislotnyh-solejj-trovafloksacina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения кислотных солей тровафлоксацина</a>
Предыдущий патент: Производные тиола, обладающие (ace/nep) ингибирующим действием на металлопептидазу
Следующий патент: 1-арил-3-иминопиразолы, способы их получения и применение в качестве инсектицидов
Случайный патент: Система маркировки и идентификации изделий
















