Способ получения аммониевых солей 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида
Номер патента: 2236
Опубликовано: 28.02.2002
Авторы: Хансен Ханспетер, Меркле Ханс Руперт, Егер Карл-Фридрих, Дурайн Альфонс
Формула / Реферат
1. Способ получения аммониевых солей 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида (бентазона) общей формулы I
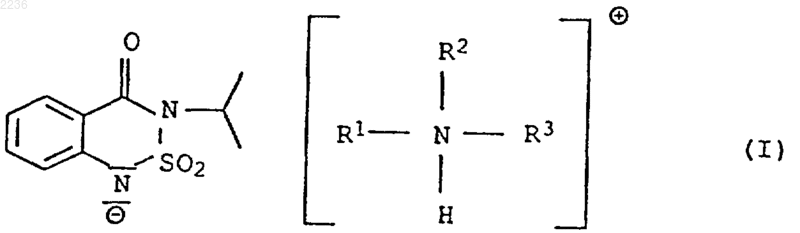
в которой R1, R2, R3 и R4 независимо друг от друга представляют собой водород, C1-C8 алкил или гидрокси C1-C8 алкил, отличающийся тем, что бентазон формулы IIа
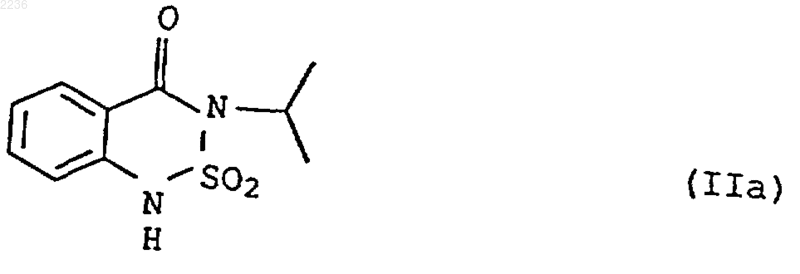
подвергают взаимодействию с амином общей формулы IIIa

или его солью формулы IIIb
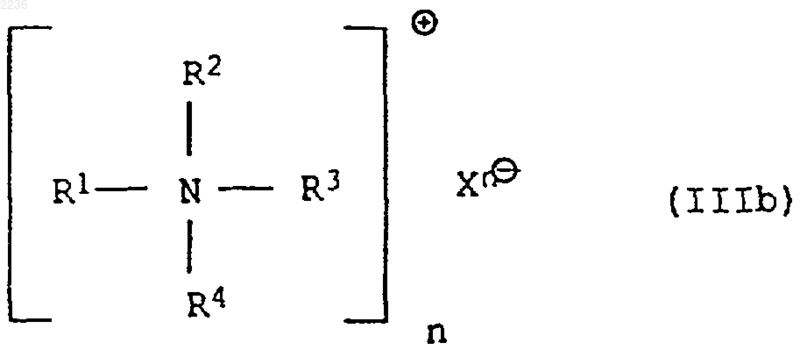
где Х представляет собой анион кислоты с рКs больше 4 или означает гидроксильный ион, а n равно числу отрицательных зарядов аниона X, в среде растворителя, при условии, что при взаимодействии с амином формулы IIIa в качестве растворителя берут органический растворитель или практически несмешиваемый с водой органический растворитель и при необходимости воду, а взаимодействие с аммониевой солью формулы IIIb, как и во втором случае для амина IIIa, ведут в несмешиваемом органическом растворителе с добавлением при необходимости воды или только в воде и выделение целевого продукта ведут без высокотемпературного упаривания растворителя.
2. Способ по п.1, отличающийся тем, что используют амин формулы IIIa, где радикалы R1, R2 и R3 обозначают водород.
3. Способ по п.1 или 2, отличающийся тем, что в качестве органического растворителя используют 1,2-дихлорэтан.
4. Способ по п.1 или 2, отличающийся тем, что используют амин формулы IIIa или аммониевую соль формулы IIIb, в которых радикалы R1-R4 обозначают водород.
5. Способ получения аммониевых солей 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида (бентазона) общей формулы I

в которой радикалы R1, R2, R3 и R4 независимо друг от друга представляют собой водород, C1-C8 алкил или гидрокси C1-C8 алкил, отличающийся тем, что натриевую соль 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида (IIb)
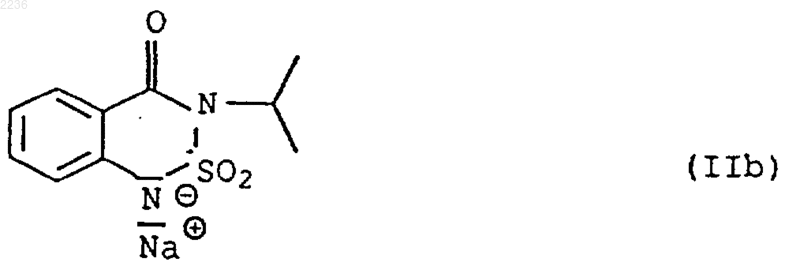
подвергают взаимодействию в воде с аммониевой солью общей формулы IIIс
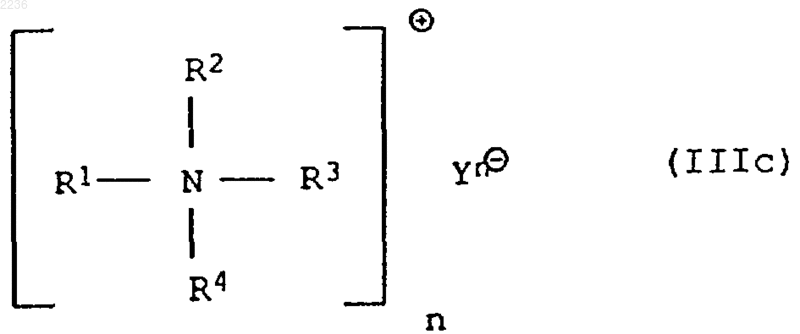
где Y обозначает анион кислоты, а n равно числу отрицательных зарядов аниона Y.
6. Способ по п.5, отличающийся тем, что аммониевая соль формулы IIIс содержит в качестве аниона Y карбонатный или гидрокарбонатный анион.
Евразийский патент действует на территории всех Договаривающихся государств, кроме AM и MD.
Текст
1 Настоящее изобретение относится к способам получения солей 3-изопропил-2,1,3 бензотиадиазин-4-он-2,2-диоксида общей формулы I в которой радикалы R1, R2, R3 и R4 независимо друг от друга представляют собой водород,низший алкил или низший гидроксиалкил. Обладающие гербицидным действием бензотиадиазин-4-он-2,2-диоксиды известны из заявок Германии DE-A 1542836, DE-A 2164459 и DE-A 2217722. В этих публикациях в качестве одной из форм применения указаны также аммониевые соли, причем особо выделены аммониевые, метиламмониевые, триметиламмониевые, этиламмониевые, диэтаноламмониевые и этаноламмониевые соли. Общеизвестно далее, что натриевая, кальциевая и калиевая соли 3-изопропил-2,1,3 бензотиадиазин-4-он-2,2-диоксида(международное наименование: бентазон) очень гигроскопичны. В случае применения композиций этих солей в твердом виде это приводит к комкованию продукта даже под воздействием влажности воздуха или, более того, к его расплыванию, вследствие чего существенно осложняется возможность его дозирования. Кроме того, при расфасовке этих солей в водорастворимые пакеты из пленки в результате взаимодействия гигроскопичных действующих веществ и пленки происходит дегидратация солей. Следствием этого является то, что пленка становится хрупкой, а это означает отсутствие надежной устойчивости при хранении. При синтезе бентазона действующее вещество получают обычно в нейтральной форме и,как правило, растворенным в органическом растворителе (ср. заявку Германии DE-A 2710382). Затем действующее вещество в большинстве случаев переводят в одну из его солей, так как последняя улучшает биоэффективность бентазона. Из патента США US-A 5266533 известна,например, методика приготовления композиций из аммониевых солей гербицидов, в том числе бентазона в виде сыпучих водорастворимых твердых веществ. С этой целью согласно предлагаемому в патенте техническому решению сначала получают водную смесь из аммониевой соли. Твердую композицию действующего вещества получают из этой смеси выпариванием всего растворителя и последующей обработкой продукта нейтрализующим основанием. Однако стадия выпаривания воды, используемой в качестве растворителя, требует значительных энергозатрат и действующее вещество при этом в течение длительного времени подвергается воздействию высокой температуры, необходимой для процесса выпаривания. 2 Исходя из вышеизложенного, в основу изобретения была положена задача разработать способы получения аммониевых солей бентазона, которые позволили бы полностью или частично устранить недостатки вышеописанного способа получения таких солей, в частности,путем исключения высокотемпературного упаривания растворителей при получении конечного продукта. При этом, как видно из описания к данному патенту, в нем отсутствуют конкретные примеры получения аммониевых солей бентазона, даны только два, описывающие получение только натриевой и калиевой соли бентазона, недостатки которых уже приведены выше. В соответствии с указанной задачей был создан способ получения солей 3-изопропил 2,1,3-бензотиадиазин-4-он-2,2-диоксида общей формулы I в которой радикалы R1, R2 и R3 независимо друг от друга представляют собой водород, низший алкил или низший гидроксиалкил, отличающийся тем, что 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксид (IIа) подвергают взаимодействию в органическом растворителе с амином общей формулы IIIa Далее был создан способ получения солей 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2 диоксида общей формулы I в которой радикалы R1, R2, R3 и R4 независимо друг от друга представляют собой водород,низший алкил или низший гидроксиалкил, отличающийся тем, что а) 3-изопропил-2,1,3-бензотиадиазин-4-он 2,2-диоксид (IIа) подвергают взаимодействию в практически несмешиваемом с водой органическом растворителе и при необходимости в присутствии воды с амином общей формулы IIIa или с аммониевой солью общей формулы IIIb где Х представляет собой анион кислоты с pKs больше 4 или означает гидроксильный ион, а n равно числу отрицательных зарядов аниона X, и б) соль формулы I растворяют в воде. Кроме вышеописанных, был создан способ получения солей 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида общей формулы I в которой радикалы R1, R2, R3 и R4 независимо друг от друга представляют собой водород,низший алкил или низший гидроксиалкил, отличающийся тем, что а) 3-изопропил-2,1,3-бензотиадиазин-4-он 2,2-диоксид (IIа) подвергают взаимодействию в воде с аммониевой солью общей формулы IIIb где Х представляет собой анион кислоты с рКs больше 4 или означает гидроксильный ион, а n равно числу отрицательных зарядов аниона X,или б) натриевую соль бентазона (IIb) подвергают взаимодействию в воде с аммониевой солью общей формулы IIIс где Y обозначает анион кислоты, а n равно числу отрицательных зарядов аниона Y. Под понятием низший алкил, соответственно низший гидроксиалкил, имеются в виду алкильные группы, соответственно гидроксиалкильные группы с числом С-атомов до 8, предпочтительно до 6, такие как метил, гидроксиметил, этил, 2-гидроксиэтил, пропил, 3 гидроксипропил и бутил. Предлагаемые способы обозначены в последующем как способы А, Б и В.IIIa общеизвестны. Как правило, амин IIIa применяют в эквимолярном количестве по отношению к бентазону (IIа). Для обеспечения более успешной обменной реакции может оказаться целесообразным применять амин IIIa в избытке. Однако для достижения полной обменной реакции этот избыток в принципе не должен превышать 10 мол.% по отношению к бентазону (IIа). В качестве органических растворителей приемлемы ароматические углеводороды, предпочтительно однократно-трехкратно метилированные бензолы, прежде всего толуол и ксилолы; кетоны, предпочтительно с 3-9 С-атомами,прежде всего ацетон; сложные эфиры, предпочтительно эфиры монокарбоновых кислот с 1-5 С-атомами с моноалканолами с 1-4 С-атомами,прежде всего этиловый эфир уксусной кислоты; простые эфиры, предпочтительно с 4-8 Сатомами, прежде всего тетрагидрофуран; галогеналканы, предпочтительно моно- либо дихлоралканы с 2-4 С-атомами, прежде всего 1,2 дихлорэтан, кроме того, алканолы, предпочтительно С 1-С 4 алканолы, прежде всего метанол или этанол, а также смеси из двух или более указанных растворителей. Особенно предпочтителен в качестве растворителя 1,2-дихлорэтан,используемый индивидуально. Схема 1R1-R3 обозначают независимо друг от друга водород, низший алкил или низший гидроксиалкил. В пересчете на один моль бентазона (IIа) растворитель используют обычно в количестве от 0,2 до 25 и прежде всего от 1 до 10 кг. Бентазон (IIа) может содержать при этом до 2 маc.% воды, что не оказывает негативного воздействия на проведение способа. Способ может осуществляться в диапазоне температур от 10 до 80 С. На ход реакции температура оказывает определенное влияние, прежде всего это касается растворимости бентазона(IIа), которая увеличивается с возрастанием температуры. Однако прежде всего в тех случаях, когда в реакции участвуют газообразные или низкокипящие амины IIIa, температура не должна превышать 60 С. Предпочтительно реакцию проводят при температурах в интервале от 20 до 60 С и прежде всего от 25 до 50 С. Реакцию осуществляют преимущественно при давлении от 0,5 до 10, предпочтительно от 1 до 3 бар и прежде всего при нормальном давлении (при атмосферном давлении). В качестве реакторов пригодны соответствующие устрой 5 ства, которые обычно используют для реакций подобного типа. Соль формулы I выпадает в осадок при температуре реакции и/или при охлаждении смеси и ее можно по известной методике, прежде всего путем фильтрации, отделять от жидкой фазы. Выход соли I составляет 95-100%. Способ А особенно пригоден для получения NH4+-соли бентазона (формула I; R1-R4 обозначают Н). При этом работают предпочтительно следующим образом: газообразный аммиак подают непосредственно в раствор бентазона(IIа) в органическом растворителе или же раствор бентазона (IIа) в органическом растворителе смешивают с жидким аммиаком. Способ Б. В этом способе бентазон (IIа) подвергают взаимодействию в практически несмешиваемом с водой органическом растворителе с амином формулы IIIa либо с аммониевой солью формулы IIIb, при необходимости в присутствии воды,после чего соль формулы I растворяют в водеR1-R4 обозначают независимо друг от друга водород, низший алкил или низший гидроксиалкил; Х обозначает анион кислоты с pKs4 или гидроксильный ион;n обозначает число отрицательных зарядов аниона X. Амины формулы IIIa общеизвестны. То же относится и к аммониевым солям формулы IIIbChemie, 4 издание, издательство Thieme Verlag,Штутгарт, том 11/2, стр. 591 и далее). В качестве аниона Х в общей формуле IIIb предпочтительны карбонатный ион и гидрокарбонатный ион, но наиболее предпочтительным является гидроксильный ион. Как правило, амин IIIa, соответственно аммониевую соль IIIb применяют в эквимолярном количестве по отношению к бентазону (IIа). Для обеспечения более успешной обменной реакции может оказаться целесообразным применять амин IIIa, соответственно аммониевую соль IIIb в избытке. Однако для достижения полной обменной реакции этот избыток в принципе не должен превышать 10 мол.% по отношению к бентазону (IIа). В качестве практически несмешиваемых с водой органических растворителей приемлемы алканы, предпочтительно с 5-8 С-атомами, прежде всего н-алканы, такие как н-пентан и нгексан, и галогенуглеводороды, предпочтительно галогеналканы, такие как моно- и дихлорал 002236 6 каны с 2-4 С-атомами, в частности 1,1 дихлорэтан, 1,3-дихлорпропан, 1,2-дихлорпропан и прежде всего 1,2-дихлорэтан. В тех же целях могут использоваться также смеси из двух или нескольких этих практически несмешиваемых с водой органических растворителей. Наиболее предпочтителен из вышеуказанных практически несмешиваемых с водой органических растворителей 1,2-дихлорэтан, применяемый индивидуально. В пересчете на один моль бентазона (IIа) растворитель используют обычно в количестве от 1 до 4 и прежде всего от 1,5 до 3 кг. Способ может осуществляться в диапазоне температур от 20 до 80 С. На ход реакции температура оказывает определенное влияние, прежде всего это касается растворимости бентазона(IIа), которая увеличивается с возрастанием температуры. Однако прежде всего в тех случаях, когда в реакции участвует газообразный или низкокипящий амин IIIa, температура не должна превышать 60 С. Предпочтительно взаимодействие бентазона (IIа) с аминами IIIa, соответственно аммониевыми солями IIIb осуществляют при температурах в интервале от 20 до 60 С и прежде всего от 25 до 50 С. Реакцию осуществляют преимущественно при давлении от 0,5 до 10, предпочтительно от 1 до 3 бар и прежде всего при нормальном давлении (при атмосферном давлении). В качестве реакторов пригодны соответствующие устройства, которые обычно используют для реакций подобного типа. Образующуюся соль формулы I растворяют в воде, причем воду можно добавлять уже во время реакции или же по ее завершении. Если при этом вместе с водной фазой отделяют некоторое количество органического растворителя,то последний до выделения соли I можно удалять при нормальном либо пониженном давлении по известной методике, например, выпариванием или при определенных условиях азеотропной перегонкой, в частности в случае рeaкционной среды 1,2-дихлорэтан/вода. Для полного растворения соли воду, в пересчете на 1 кг соли I, как правило, применяют в количестве 1-5, предпочтительно 2-4 и прежде всего 2,5-3,5 кг. В большинстве случаев соль I выпадает в осадок уже при температуре реакции. Для обеспечения лучшего осаждения раствор большей частью охлаждают. Кристаллизация происходит предпочтительно при температуре в интервале от 5 до 40 С и прежде всего при 15-25 С. Особое преимущество способа Б согласно изобретению состоит в том, что благодаря описанной выше методике органический растворитель после его отделения от водной фазы может непосредственно использоваться при проведении последующих реакций без необходимости для выделения продукта его выпаривания и/или его очистки путем перегонки. 7 Способ Б, помимо возврата маточного раствора в производственный цикл, обеспечивает получение соли формулы I, как правило, с выходом 98-100% и со степенью чистоты, по крайней мере, 98%. Способ Б особенно пригоден для получения NH4+-соли бентазона (формула I; R1R4 обозначают Н). Способ В. В способе В бентазон (IIа) подвергают взаимодействию в воде с аммониевой солью формулы IIIb или натриевую соль бентазона(IIb) подвергают взаимодействию в воде с аммониевой солью формулы IIIс (см. схему 3). Схема 3R1-R4 обозначают независимо друг от друга водород, низший алкил, низший гидроксиалкил;X обозначает анион кислоты с pKs4 или гидроксильный ион;n обозначает число отрицательных зарядов аниона X, соответственно Y. Способ В особенно пригоден для получения NH4+-соли бентазона (формула I; R1-R4 обозначают водород). Аммониевые соли формулы IIIb общеизвестны (ср. Houben-Weyl, Methoden der Organischen Chemie, 4 издание, изд-во Thieme Verlag,Штутгарт, том 11/2, стр. 591 и далее). В качестве анионов Y в общей формулеIIIс приемлемы сульфат, гидросульфат, фосфат,гидрофосфат или дигидрофосфат, предпочтительно галогенид или ацетат и прежде всего хлорид, нитрат, формиат, карбонат и гидрокарбонат. В качестве иона Y кислоты в общей формуле IIIс, соответственно в качестве аниона Х кислоты с pKs больше 4 предпочтительны карбонатный ион и гидрокарбонатный ион, а для Х особенно предпочтительным является гидроксильный ион. Как правило, аммониевую соль IIIb по отношению к бентазону (IIа), а аммониевую соль(IIb) применяют в эквимолярном количестве. Для обеспечения более успешной обменной реакции может оказаться целесообразным применять аммониевые соли в избытке. Однако для достижения полной обменной реакции этот избыток в принципе не должен превышать 10 мол.% по отношению к бентазону (IIа), соответственно к натриевой соли бентазона (IIb). В пересчете на один моль бентазона (IIа), соответственно его натриевой соли IIb воду используют 8 обычно в количестве от 0,2 до 4 и прежде всего от 0,2 до 2 кг. Натриевая соль NanY обычно более растворима в воде по сравнению с солью формулыI. Поэтому в случае частичной растворимости последней ее отделение можно осуществлять(фракционной) кристаллизацией. Такая методика известна специалисту в данной области техники и, следовательно, отпадает необходимость в дальнейших ее пояснениях. Для достижения хорошего выхода продукта при кристаллизации наиболее оптимальным,как было установлено, молярным соотношением между водой и солью I является от 50:1 до 30:1. Способ может осуществляться в диапазоне температур от 10 до 80 С. На ход реакции температура оказывает определенное влияние, это касается прежде всего растворимости бентазона(IIа) и его натриевой соли (IIb), которая увеличивается с возрастанием температуры. Предпочтительно реакцию проводят при температурах в интервале от 20 до 70 С и прежде всего от 40 до 60 С. Как правило, реакцию осуществляют при давлении от 0,5 до 10, предпочтительно от 1 до 3 бар и прежде всего при нормальном давлении(при атмосферном давлении). В качестве реакторов пригодны соответствующие устройства,которые обычно используют для реакций подобного типа. Способ В обеспечивает получение солей формулы I, как правило, с выходом более 80% и степенью чистоты, по крайней мере, 98%. Благодаря возврату маточного раствора в производственный цикл выход продукта можно повысить до более 98%. Полученную по одному из способов А-В соль формулы I можно выделять по известной методике. В тех случаях, когда продукт выпадает в виде кристаллов уже из реакционной смеси,это выделение можно осуществлять прежде всего путем фильтрации. Если же соль I получают в растворенном виде, то из всего раствора с помощью известных методов, в частности выпариванием, прежде всего при пониженном давлении, можно удалять растворитель. Содержание воды в получаемой по способу Б или В соли формулы I, которую кристаллизуют из водной фазы, составляет, как правило,уже менее 10 мас.%. Влажную (от органического растворителя либо воды) соль I, как правило,подвергают сушке при температуре в интервале от 20 до 80 С, предпочтительно от 40 до 60 С. Сушку можно проводить в обычных сушильных устройствах. При этом предпочтительно работают при пониженном давлении или при нагревании продукта I в потоке воздуха. Маточные растворы, остающиеся после выделения кристаллизованной соли I, содержат в некоторых случаях еще до 20% соли I в растворенном виде. При необходимости это растворенное действующее вещество можно выде 9 лять по известной методике, например, путем концентрирования раствора и повторной кристаллизации или же полным упариванием маточного раствора. Во многих случаях маточный раствор также может возвращаться в способ. Гранулят из растворов солей формулы I получают, исходя из образующихся в производственном цикле растворов или из используемых для кристаллизации продукта маточных растворов предпочтительно с помощью обычного из методов с применением псевдоожиженного слоя либо агломерированием с получением порошка солей I, который в свою очередь получают распылительной сушкой или сушкой под вакуумом. Полученный таким путем гранулят содержит обычно от 20 до 100 мас.% солей I. Размеры частиц такого гранулята составляют, как правило, от 200 до 3000 мкм. Количество пыли в грануляте незначительно. Так, в 30 граммовой пробе содержание пыли составляет менее 20 мг (согласно CIPAC МТ 171: "Dustiness of GranularFormulation"), что гарантирует пользователю высокую степень безопасности. Насыпная масса такого гранулята составляет, как правило, 400800 г/л. Соли формулы I отличаются очень высокой стабильностью при хранении в водорастворимых пакетах из пленки. Пленочные пакеты такого типа в принципе известны (см. европейские заявки ЕР-А 449773 и ЕР-А 493553), что исключает необходимость дальнейших пояснений. Действующее вещество I расфасовывают в пакеты из пленки обычно порциями от 0,1 до 10 кг, предпочтительно от 0,5 до 5 кг. Толщина пленки составляет 20-100 мкм, предпочтительно 30-60 мкм. Содержание воды в полимерных пленках может составлять до 20 мас.%. Получаемый описанным выше путем гранулят или заполненные пакеты из пленки, кроме солей формулы I, могут содержать также другие обычные добавки, например, поверхностноактивные вещества, наполнители, равно как и другие действующие вещества, предназначенные для защиты растений. Было установлено, что соли формулы I и прежде всего NH4+-соль бентазона обладают в соответствующих реакционных средах относительно малой растворимостью по сравнению с исходными веществами IIа, соответственно IIb. Этот эффект используется в способах согласно изобретению для выделения продукта I из реакционной среды простым путем в твердом виде. В отличие от применяемой в большинстве случаев натриевой соли аммониевые соли и прежде всего NH4+-соль значительно быстрее растворяются в воде, что позволяет тем самым снизить материально-технические затраты, требуемые для приготовления водных растворов действующих веществ. Примеры Пример 1. В раствор из 24 г бентазона (IIа) в 2376 г 1,2-дихлорэтана при перемешивании при темпе 002236 10 ратуре 20-50 С подавали 1,7-3 г газообразного аммиака и при этом образовывалась суспензия. Твердое вещество отделяли при 20 С путем фильтрации и при пониженном давлении из него удаляли остатки растворителя. В результате получили 25,4 г аммониевого бентазона (tпл 180 С). Пример 2. В раствор из 24 г бентазона (IIа) в 16 г ацетона при температуре 30-50 С при перемешивании подавали 1,7 г газообразного аммиака. Аммониевый бентазон выпадал в осадок и его отфильтровывали при комнатной температуре. Из полученного кристаллизата при пониженном давлении и при температуре 50 С удаляли растворитель. Таким путем получили 19,5 г аммониевого бентазона. Маточный раствор, оставшийся после фильтрации, упаривали при пониженном давлении и при температуре 50 С досуха, получив в результате дополнительно 6 г аммониевого бентазона. Пример 3. В суспензию из 24 г бентазона (IIа) и 300 г воды при перемешивании вводили 4,8 г карбоната аммония. Реакционную смесь продолжали перемешивать еще в течение 2 ч при температуре 50 С, после чего путем фильтрации удаляли твердые частицы. После упаривания раствора при пониженном давлении получили 25,5 г аммониевого бентазона. Пример 4. Работали аналогично примеру 3, с той, однако, разницей, что вместо карбоната аммония использовали 7,9 г гидрокарбоната аммония. В результате получили 25,5 г аммониевого бентазона. Пример 5. В раствор из 26,3 г натриевого бентазона в 21,7 г воды при температуре 50 С при перемешивании вводили 8 г нитрата аммония и реакционную смесь продолжали перемешивать еще в течение одного часа. После охлаждения до 20 С осадок отфильтровывали, дважды промывали порциями по 5 мл ледяной воды соответственно и при пониженном давлении и при температуре 50 С сушили. Таким путем получили 18,9 г аммониевого бентазона со степенью чистоты 99%. Пример 6. Работали аналогично тому, как это описано в примере 5, с той, однако, разницей, что вместо нитрата аммония использовали 6,3 г формиата аммония. Выход аммониевого бентазона составил 21 г. Продукт имел степень чистоты 98,4%. Пример 7. Раствор из 24 г бентазона (IIа) в 216 г 1,2 дихлорэтана при перемешивании при температуре 50-60 С смешивали с 34 г добавляемой аммиачной воды (5%-ный раствор аммиака в воде). После введения добавки водную фазу при температуре 50-60 С отделяли. При остывании 11 водной фазы аммониевый бентазон выпадал в виде кристаллов. Твердое вещество отделяли при температуре 20 С путем фильтрации и при пониженном давлении и при температуре 50 С из него удаляли остатки растворителя. В результате получили 11,8 г аммониевого бентазона (tпл 180 С). Из маточного раствора после выпаривания воды при пониженном давлении и при температуре 50-60 С получили дополнительно 13,7 г аммониевого бентазона. Пример 8. Раствор из 24 г бентазона (IIа) в 216 г 1,2 дихлорэтана при перемешивании при температуре 30-50 С смешивали с 22,5 г добавляемого 20%-ного водного раствора диметиламина. После введения добавки водную фазу отделяли при температуре 50-60 С при пониженном давлении и при температуре 50-60 С упаривали досуха. Таким путем получили 28 г диметиламмониевого бентазона (tпл 145-147 С; чистота более 99% согласно ЖХВД-анализу для бентазона и титрованию для диметиламмония). Пример 9. Смесь из 24 г бентазона (IIа), 4,8 г карбоната аммония, 220 г 1,2-дихлорэтана и 300 г воды перемешивали в течение 1 ч при температуре 50-60 С. Затем фазы разделяли и при пониженном давлении и температуре 50-60 С удаляли воду. Таким путем получили 25,5 г аммониевого бентазона. Пример 10. Работая аналогично примеру 9, но используя 7,9 г гидрокарбоната аммония, получили 25,5 г аммониевого бентазона. Пример 11. 20%-ный водный раствор аммониевого бентазона сушили в распылительном грануляторе с псевдоожиженным слоем при температуре сушильного воздуха 120 С. При этом одновременно впрыскивали раствор аммониевой соли и в результате агломерации и сушки получали гранулированные частицы. Полученный гранулят содержал в своем составе 99,6 мас.% аммониевого бентазона, а остаточное содержание воды в нем составляло 0,4 мас.%. Размер частиц гранулята составлял в среднем 0,3 мм(максимальный диаметр). Полученный гранулят не содержал пыли и быстро растворялся в воде. Кроме того, он был негигроскопичен, т.е. даже при длительном хранении в условиях высокой влажности воздуха он сохранял сыпучесть. Пример 12. В распылительный гранулятор с псевдоожиженном слоем загружали 75 г порошкообразного сульфата аммония. Затем в подготовленный таким путем гранулятор впрыскивали 375 г 20 мас.%-ного водного раствора аммониевого бентазона при температуре сушильного воздуха 120 С. В результате агломерации и сушки получали гранулированные частицы. Полученный гранулят содержал в своем составе 50 мас.% аммониевого бентазона, а остаточное 12 содержание воды в нем составляло 0,1-0,5 мас.%. Средний размер частиц гранулята составлял 1-2 мм (максимальный диаметр). Полученный гранулят не содержал пыли и быстро растворялся в воде. Кроме того, он был негигроскопичен, т.е. даже при длительном хранении в условиях высокой влажности воздуха он сохранял сыпучесть. Пример 13. Физические характеристики продукта. а) Исследования гигроскопичности солей Несколько 1-граммовых проб соответственно сушили в течение 48 ч при температуре 50 С под вакуумом. Затем высушенные пробы выдерживали при относительной влажности воздуха 55 и 65% и температуре 20 С, после чего по достижении состояния равновесия определяли увеличение веса каждой из проб. Далее оценивали реологические свойства проб и их внешний вид. Касательно гигроскопичности было установлено, что критические субстанции поглощали много воды из воздуха до достижения состояния равновесия. Это приводило к затвердеванию субстанций. Результаты представлены в нижеследующей таблице. Тип соли Натриевая соль Калиевая соль Калиевая соль Аммониевая соль Свойства после хранения комкование затвердение комкование затвердение комкование затвердение кристалличная сыпучая кристалличная сыпучая; б) Исследования свойств соли в пакетах из пленки Субстанцию в виде гранулята расфасовывали порциями по 10 г соответственно в пакеты из пленки и пакеты заваривали. Затем заполненные пакеты (пленка Monosol 8030, изготовитель фирма Chris Craft Inc., США) помещали в герметичную упаковку и выдерживали в течение 4 недель в различном температурном режиме. Устойчивость пленки проявлялась в ее эластичности при механических нагрузках. Если соль бентазона впитывала воду из пленки, последняя становилась хрупкой. Так, например, пленкаMonosol 8030 в присутствии натриевого бентазона в запечатанной упаковке утратила большую часть содержащейся в пленке остаточной влаги. При комнатной температуре ее количество снизилось от первоначальных 14 до 6% в состоянии равновесия. Следствием этого явилось то, что пленка стала хрупкой и пакеты при механических нагрузках во время транспортировки, при ударах и под воздействием тяжести лопались. Результаты экспериментальных исследований представлены в следующей таблице. Свойства пакетов из пленки ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения аммониевых солей 3 изопропил-2,1,3-бензотиадиазин-4-он-2,2 диоксида (бентазона) общей формулы I в которой R1, R2, R3 и R4 независимо друг от друга представляют собой водород, C1-C8 алкил или гидрокси C1-C8 алкил, отличающийся тем,что бентазон формулы IIа подвергают взаимодействию с амином общей формулы IIIa 14 воды или только в воде и выделение целевого продукта ведут без высокотемпературного упаривания растворителя. 2. Способ по п.1, отличающийся тем, что используют амин формулы IIIa, где радикалыR1, R2 и R3 обозначают водород. 3. Способ по п.1 или 2, отличающийся тем,что в качестве органического растворителя используют 1,2-дихлорэтан. 4. Способ по п.1 или 2, отличающийся тем,что используют амин формулы IIIa или аммониевую соль формулы IIIb, в которых радикалыR1-R4 обозначают водород. 5. Способ получения аммониевых солей 3 изопропил-2,1,3-бензотиадиазин-4-он-2,2 диоксида (бентазона) общей формулы I в которой радикалы R1, R2, R3 и R4 независимо друг от друга представляют собой водород, C1C8 алкил или гидрокси C1-C8 алкил, отличающийся тем, что натриевую соль 3-изопропил 2,1,3-бензотиадиазин-4-он-2,2-диоксида (IIb) или его солью формулы IIIb подвергают взаимодействию в воде с аммониевой солью общей формулы IIIс где Х представляет собой анион кислоты с рКs больше 4 или означает гидроксильный ион, а n равно числу отрицательных зарядов аниона X, в среде растворителя, при условии, что при взаимодействии с амином формулы IIIa в качестве растворителя берут органический растворитель или практически несмешиваемый с водой органический растворитель и при необходимости воду, а взаимодействие с аммониевой солью формулы IIIb, как и во втором случае для аминаIIIa, ведут в несмешиваемом органическом растворителе с добавлением при необходимости где Y обозначает анион кислоты, а n равно числу отрицательных зарядов аниона Y. 6. Способ по п.5, отличающийся тем, что аммониевая соль формулы IIIс содержит в качестве аниона Y карбонатный или гидрокарбонатный анион. Евразийский патент действует на территории всех Договаривающихся государств, кроме
МПК / Метки
МПК: C07D 285/16
Метки: получения, аммониевых, способ, 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида, солей
Код ссылки
<a href="https://eas.patents.su/8-2236-sposob-polucheniya-ammonievyh-solejj-3-izopropil-213-benzotiadiazin-4-on-22-dioksida.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения аммониевых солей 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида</a>
Предыдущий патент: Деформируемая обсадная труба
Следующий патент: Способы снижения содержания фибриногена
Случайный патент: Световозвращающее покрытие из стеклянных микросфер, в котором предусмотрено изображение, имеющее визуальную направленность












