Полиморфные формы производного 1-пиррола, промежуточного соединения для получения аторвастатина
Номер патента: 7104
Опубликовано: 30.06.2006
Авторы: Грефф Зольтан, Барта Ференц, Надь Калман, Баркоци Йожеф, Верецкейне Донат Дьёрди, Котаи Надь Петер, Сент Кирайи Жужа, Шимиг Дьюла
Формула / Реферат
1. Кристаллическая форма I трет-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]даоксан-4-ил-уксусной кислоты формулы
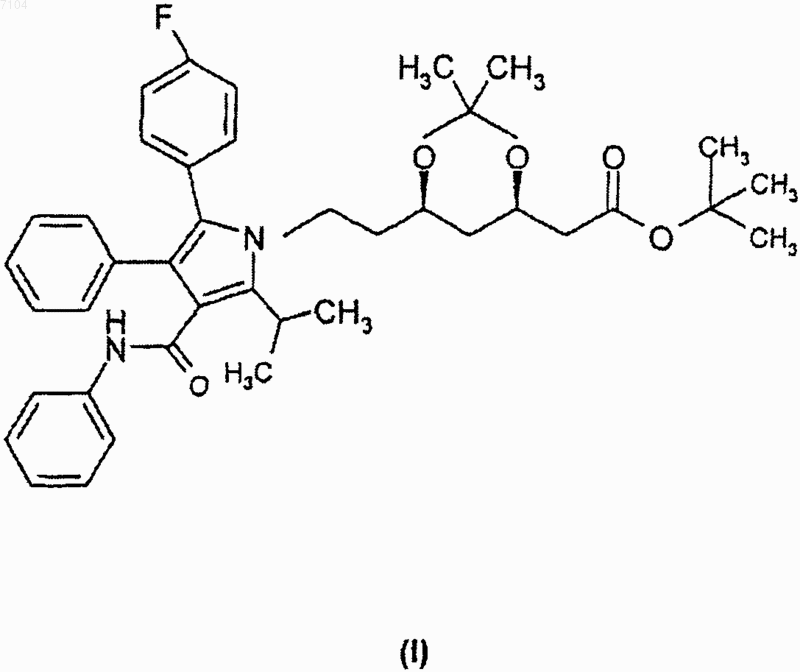
характеризующаяся тем, что имеет порошковую рентгенограмму, представленную в табл. 1 и на фиг. 1, полученную с помощью СuКa -излучения:
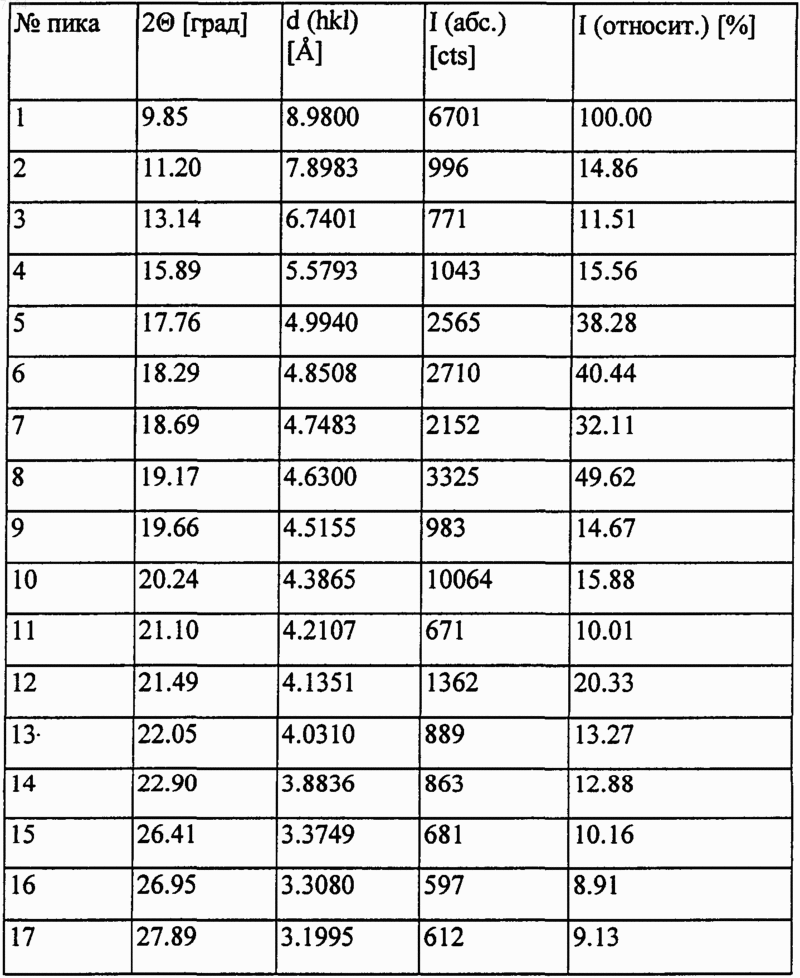
Таблица 1. Положение дифракционных полос и относительная интенсивность (> 10% полиморфной формы I)
2. Способ получения кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксус-ной кислоты, охарактеризованной в п.1, включающий растворение аморфного трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа при нагревании с последующей кристаллизацией и выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фтор-фенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты.
3. Способ получения кристаллической формы I тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксус-ной кислоты, охарактеризованной в п.1, включающий растворение кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа при нагревании с последующей кристаллизацией и выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенил-карбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты.
4. Способ получения кристаллической формы I трет-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксус-ной кислоты, охарактеризованной в п.1, включающий суспендирование аморфной или кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метил-этил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа в течение 1-120 ч с последующим выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамо-ил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты.
5. Способ по любому из пп.2-4, включающий использование в качестве протонного растворителя низшего спирта, или воды, или смеси указанных растворителей.
6. Способ по п.5, включающий использование метанола, этанола, пропанола-2, воды или смеси пропанола-2 и воды.
7. Способ по любому из пп.2-4, включающий использование в качестве биполярного апротонного растворителя ацетона, ацетонитрила, этилацетата, диметилформамида, диметилсульфоксида или триамида гексаметилфосфорной кислоты.
8. Способ по любому из пп.2-4, включающий использование в качестве растворителя эфирного типа диизопропилового эфира.
9. Кристаллическая форма II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метипэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, характеризующаяся тем, что имеет порошковую рентгенограмму, представленную в табл. 2 и на фиг. 2, полученную с помощью СuКa -излучения:
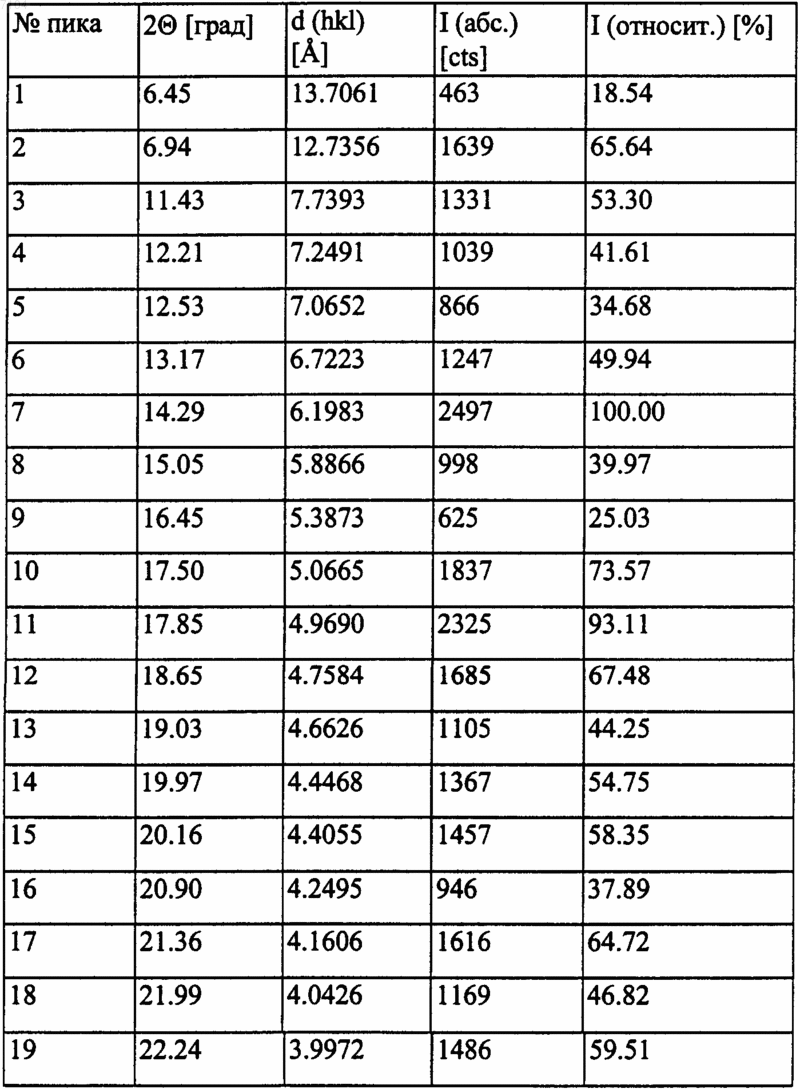
Таблица 2. Положение дифракционных полос и относительная интенсивность (> 10% полиморфной формы II)

10. Способ получения кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметип-[1,3]диоксан-4-ил-уксус-ной кислоты, охарактеризованной в п.9, включающий растворение аморфного трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в неполярном растворителе при нагревании с последующей кристаллизацией и выделением кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-ук-усной кислоты.
11. Способ получения кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксус-ной кислоты, охарактеризованной в п.9, включающий растворение кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в неполярном растворителе при нагревании с последующей кристаллизацией и выделением кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты.
12. Способ по п.10 или 11, включающий использование в качестве неполярного растворителя циклогексана, толуола, гексана, гептана или их смеси.
13. Способ получения кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксус-ной кислоты, охарактеризованной в п.9, включающий взаимодействие (4R-циc)-1,1-диметилэтил-6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-ацетата формулы
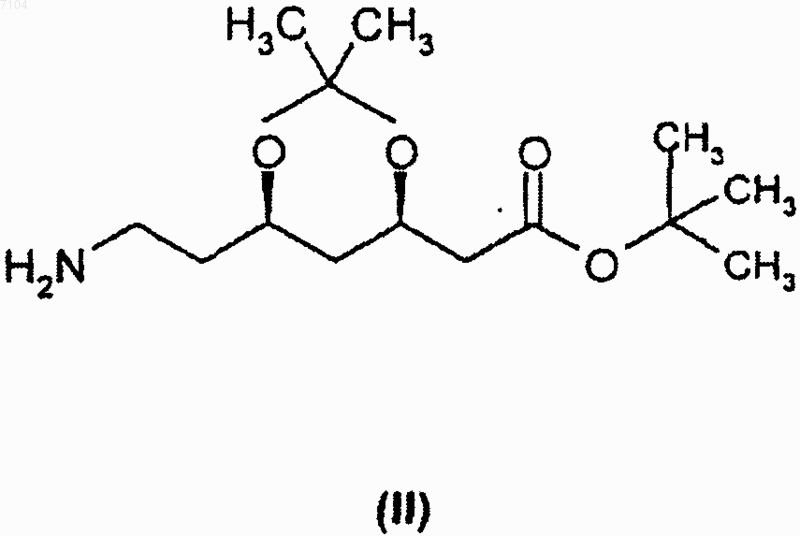
с 2-[1-фенил-2-(4-фторфенил)-2-оксоэтил]-4-метил-N-метил-N-фенил-3-оксопентанамидом формулы

в смеси толуола, гептана и тетрагидрофурана, 1:4:1, в присутствии пиваловой кислоты в качестве катализатора, добавление к реакционной массе в конце реакции диизопропилового эфира с последующим выделением кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты.
Текст
007104 Область изобретения Изобретение относится к новым полиморфным формам трет-бутилового эфира (4R-цис)-6-[2-[3 фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан 4-ил-уксусной кислоты и способу их получения. В частности, изобретение относится к новым кристаллическим формам I и II трет-бутилового эфира(4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2 диметил-[1,3]диоксан-4-ил-уксусной кислоты и способу их получения. Технические предпосылки изобретения трeт-Бутиловый эфир (4R-цис)-6-[2-[3-фенил-4-фенил-карбамоил-2-(4-фторфенил)-5-(1-метилэтил) пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты формулы является известным ценным фармацевтическим промежуточным соединением, используемым для получения ГМГ-КоА [ингибитора редуктазы гидроксиметилглютарилкоэнзима полукальциевой соли (3R,5R)3,5-дигидрокси-[3-фенил-4-(фениламино)карбонил]-2-(4-фторфенил)-5-(1-метилэтил)-1 Н-пиррол-1-илэтилгептановой кислоты), имеющего МНН (международное непатентованное название) аторвастатин. Технические предпосылки тpeт-Бутиловый эфир (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил) пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты формулы I описан в патенте ЕР-В 330172. Согласно данному патенту трет-бутиловый эфир (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4 фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты формулы I получают взаимодействием (4R-цис)-1,1-диметилэтил-6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4 ацетата формулы в смеси гептана и толуола 9:1, при кипении в течение 24 ч, охлаждением реакционной массы, добавлением пропанола-2 и отделением выпавшего продукта фильтрацией. В работе отсутствуют данные о точке плавления продукта, также не упоминается о его кристаллической форме. Согласно патенту US 5103024 реакцию проводят в условиях, описанных в патенте ЕР-В 330172, за исключением того, что используют смесь толуола и гептана 9:1; далее реакционную массу нагревают при кипении в течение 24 ч, охлаждают, добавляют пропанол-2 и отделяют выпавшее соединение формулы I фильтрацией. Данные о точке плавления и кристаллической форме продукта отсутствуют.-1 007104 В патенте US 5155251 раскрыт рабочий пример патента ЕР-В 330172. Данная ссылка не содержит сведений о точке плавления и кристаллической форме соединения формулы I. Согласно статье в журнале Tetrahedron Letters, Vol. 33, Np. 17, 2283-2284 (1992) реакцию между соединениями формулы II и III проводят в смеси толуола, гептана и тетрагидрофурана, 1:4:1, в присутствии пиваловой кислоты в качестве катализатора. Выделение продукта из реакционной массы не описано,также не раскрыто, образуется ли соединение формулы I в кристаллическом виде. В последнее время появилась настоятельная потребность в чистых и морфологически однородных продуктах. Для технологических процессов все более и более требуются продукты, проявляющие постоянные, стабильные и идентичные свойства при сушке и фильтрации. В силу экономических причин существует необходимость в морфологически однородных продуктах, которые могут быть получены способами, легко осуществимыми в промышленном масштабе, пригодными для масштабирования и позволяющими получить продукт устойчиво идентичной кристаллической формы. Известно, что при фильтрации и сушке аморфных веществ возникают трудности, при масштабировании процесса производства приходится сталкиваться со значительными сложностями, да и стабильность продукта также является недостаточной. Краткое описание изобретения Целью изобретения является создание новых кристаллических форм тpeт-бутилового эфира (4Rцис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил[1,3]диоксан-4-ил-уксусной кислоты, которые бы легко фильтровались и сушились, были стабильными в течение длительного времени и хорошо хранились. Данная цель решается посредством настоящего изобретения. Изобретение основано на том, что трет-бутиловый эфир (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил 2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты формулы I может быть получен в виде двух морфологически однородных полиморфных кристаллических форм, удовлетворяющих изложенным выше требованиям. Указанные новые морфологически однородные полиморфные формы обозначены в описании изобретения к патенту и в формуле изобретения как полиморфы I и II. Подробное описание изобретения Согласно одному аспекту настоящего изобретения получена кристаллическая форма I тpeт-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, характеризующаяся тем, что имеет порошковую рентгенограмму, представленную в табл. 1 и на фиг. 1, полученную с помощью СuК-излучения: Таблица 1. Положение дифракционных полос и относительная интенсивность (10% полиморфной формы I) Порошковая рентгенограмма новой кристаллической полиморфной формы I получена в следующих условиях. Оборудование: порошковый дифрактометр марки PHILIPS-XPERT PW3710.-2 007104 Излучение: СuК (: 1,54190). Монохроматор: графитовый. Напряжение возбуждения: 40 кВ. Анодный ток: 30 МА. Стандартное вещество сравнения: SRM 675. Слюдяной порошок (синтетический фторграфит), сер. : 981307. Измерение непрерывное: /2 пробег: 4,5-35,002. Величина шага: 0,04. Образец: поверхность ровная, ширина 0,5 мм, в кварцевом держателе образца, измерение и хранение осуществляли при комнатной температуре. Согласно еще одному аспекту изобретения представлен способ получения кристаллической формы I тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, включающий а) растворение аморфного тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4 фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа при нагревании с последующей кристаллизацией и выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2 диметил-[1,3]диоксан-4-ил-уксусной кислоты; илиb) растворение кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа при нагревании с последующей кристаллизацией и выделением кристаллической формы I тpeтбутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1 ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты; илиc) суспендирование аморфной или кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа в течение 1-120 ч с последующим выделением кристаллической формы I тpeтбутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1 ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В качестве полярного протонного растворителя может быть использован низший спирт (предпочтительны метанол, этанол, пропанол-2), вода или смесь указанных растворителей. Более предпочтительно в качестве полярного протонного растворителя использовать этанол, пропанол-2, воду или смесь пропанола-2 и воды. В качестве биполярного апротонного растворителя могут быть использованы ацетон, ацетонитрил,этилацетат, диметилформамид, диметилсульфоксид или триамид гексаметилфосфорной кислоты. Предпочтительно использовать ацетонитрил. В качестве растворителя эфирного типа предпочтительно может быть использован ацетонитрил. Точные реакционные условия для получения кристаллической формы I трет-бутилового эфира (4Rцис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил[1,3]диоксан-4-ил-уксусной кислоты могут быть установлены экспериментально. При выполнении способов а) и b) аморфную или кристаллическую форму II тpeт-бутилового эфира(4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты растворяют в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа при кипячении, раствор выдерживают при указанной температуре в течение нескольких минут, затем охлаждают до комнатной температуры и оставляют на кристаллизацию. Кристаллы отделяют фильтрованием либо центрифугированием. При выполнении способа с) аморфную или кристаллическую форму II тpeт-бутилового эфира (4Rцис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил[1,3]диоксан-4-ил-уксусной кислоты суспендируют в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа в течение 1-120 ч, после чего осадившуюся кристаллическую форму I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1 метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты отделяют фильтрацией либо центрифугированием. Продолжительность суспендирования зависит от использованного растворителя и может быть установлена экспериментально. Согласно еще одному аспекту изобретения получена кристаллическая форма II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2 диметил-[1,3]диоксан-4-ил-уксусной кислоты, характеризующаяся тем, что имеет порошковую рентгенограмму, представленную в табл. 2 и на фиг. 2, полученную с помощью СuК-излучения.-3 007104 Таблица 2. Положение дифракционных полос и относительная интенсивность (10% полиморфной формы II) Порошковая рентгенограмма новой кристаллической формы II получена в условиях, описанных для кристаллической формы I. Согласно еще одному аспекту изобретения представлен способ получения кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, включающийa) растворение аморфного тpeт-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4 фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в неполярном растворителе при нагревании с последующей кристаллизацией и выделением кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты; илиb) растворение кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной-4 007104 кислоты в неполярном растворителе при нагревании с последующей кристаллизацией и выделением кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты; илиc) взаимодействие (4R-цис)-1,1-диметилэтил-6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-ацетата формулы II с 2-[1-фенил-2-(4-фторфенил)-2-оксоэтил]-4-метил-N-метил-N-фенил-3-оксопентанамидом формулы III в смеси толуола, гептана и тетрагидрофурана, 1:4:1, в присутствии пиваловой кислоты в качестве катализатора, добавление к реакционной смеси в конце реакции диизопропилового эфира с последующим выделением кристаллической формы II трет-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. Способы а) и b) можно проводить в условиях, описанных для получения кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В качестве неполярного растворителя предпочтительно использовать циклогексан, гептан, гексан, толуол или их смесь. Для сохранения неполярности инертный растворитель дополнительно может содержать небольшое количество растворителя эфирного типа (например, диизопропилового эфира или тетрагидрофурана). Точные реакционные условия для получения кристаллической формы II трет-бутилового эфира(4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты определяют экспериментально. Согласно способу с) к реакционной смеси, полученной в результате взаимодействия соединений формул II и III, проводимого в смеси толуола, гептана и тетрагидрофурана, 1:4:1, в присутствии пиваловой кислоты в качестве катализатора, по завершении реакции прибавляют диизопропиловый эфир, после чего выделяют кристаллическую форму II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. Из вышеизложенного видно, что полиморфные формы I и II можно превращать друг в друга. Настоящее изобретение дает возможность получения трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4 ил-уксусной кислоты, имеющего однородную кристаллическую структуру с высокой степенью чистоты. Настоящее изобретение обладает следующими преимуществами: получен продукт, который легко фильтровать и сушить, и имеет технологически однородные характеристики сушки и фильтрации; процесс перекристаллизации и морфологически однородная кристаллическая структура обеспечивают получение высокочистого продукта; чистота, определенная методом ВЭЖХ, составляет 99,5%; морфологически однородный продукт изобретения стабилен при хранении в течение длительного времени; не требуется никаких особых условий хранения; способ изобретения может быть легко масштабирован и подходит для производства в промышленном масштабе. Дополнительные детали настоящего изобретения представлены в следующих примерах, которые не ограничивают объем охраны изобретения. Пример 1. Получение кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты из тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, содержащего кристаллическую форму I. В круглодонную колбу емкостью 10 мл, оборудованную обратным холодильником и термометром,загружают 2 г кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 5 мл циклогексана. Смесь кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 35-40 С до постоянного веса. Таким образом получают 1,87 г целевого продукта. Т.пл. 128-130 С. Пример 2. Получение кристаллической формы I тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты из тpeт-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, содержащего кристаллическую форму II. В круглодонную колбу емкостью 25 мл, оборудованную обратным холодильником и термометром,загружают 2 г кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 5 мл этанола. Смесь кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной-5 007104 температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 35-40 С до постоянного веса. Таким образом получают 1,81 г целевого продукта. Т.пл. 140-142 С. Пример 3. Получение кристаллической формы I тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В круглодонную колбу емкостью 10 мл, оборудованную обратным холодильником и термометром,загружают 2 г аморфного трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 5 мл ацетонитрила. Смесь кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 35-40 С до постоянного веса. Таким образом получают 1,84 г целевого продукта. Т.пл. 140-142 С. Пример 4. Получение кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В круглодонную колбу емкостью 10 мл, оборудованную обратным холодильником и термометром,загружают 2 г аморфного трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 3,5 мл пропанола-2. Смесь кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 35-40 С до постоянного веса. Таким образом получают 1,85 г целевого продукта. Т.пл. 140-142 С. Пример 5. Получение кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В круглодонную колбу емкостью 100 мл, оборудованную обратным холодильником и термометром,загружают 2 г аморфного тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 47 мл диизопропилового эфира. Смесь кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 3540 С до постоянного веса. Таким образом получают 1,74 г целевого продукта. Т.пл. 140-142 С. Пример 6. Получение кристаллической формы I тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В круглодонную колбу емкостью 250 мл, оборудованную обратным холодильником и термометром,загружают 2 г аморфного тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 130 мл смеси пропанола-2 и воды, 2:1. Реакционную массу кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 35-40 С до постоянного веса. Таким образом получают 1,80 г целевого продукта. Т.пл. 140-142 С. Пример 7. Получение кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. В круглодонную колбу емкостью 50 мл, оборудованную обратным холодильником и термометром,загружают 2 г аморфного трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты и 19 мл смеси пропанола-2 и воды, 4:1. Реакционную массу кипятят с обратным холодильником в течение 5 мин, охлаждают до комнатной температуры и оставляют на ночь. Суспензию фильтруют, продукт промывают и сушат при 35-40 С до постоянного веса. Таким образом получают 1,86 г целевого продукта. Т.пл. 140-142 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма I трет-бутилового эфира (4R-циc)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4 фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]даоксан-4-ил-уксусной кислоты формулы характеризующаяся тем, что имеет порошковую рентгенограмму, представленную в табл. 1 и на фиг. 1,полученную с помощью СuК-излучения: Таблица 1. Положение дифракционных полос и относительная интенсивность (10% полиморфной формы I) 2. Способ получения кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, охарактеризованной в п.1, включающий растворение аморфного трет-бутилового эфира(4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе,либо растворителе эфирного типа при нагревании с последующей кристаллизацией и выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. 3. Способ получения кристаллической формы I тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, охарактеризованной в п.1, включающий растворение кристаллической формы II третбутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1 ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа при нагревании с последующей кристаллизацией и выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. 4. Способ получения кристаллической формы I трет-бутилового эфира (4R-циc)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, охарактеризованной в п.1, включающий суспендирование аморфной или кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метил-7 007104 этил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в полярном протонном или биполярном апротонном растворителе, либо растворителе эфирного типа в течение 1-120 ч с последующим выделением кристаллической формы I трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты. 5. Способ по любому из пп.2-4, включающий использование в качестве протонного растворителя низшего спирта, или воды, или смеси указанных растворителей. 6. Способ по п.5, включающий использование метанола, этанола, пропанола-2, воды или смеси пропанола-2 и воды. 7. Способ по любому из пп.2-4, включающий использование в качестве биполярного апротонного растворителя ацетона, ацетонитрила, этилацетата, диметилформамида, диметилсульфоксида или триамида гексаметилфосфорной кислоты. 8. Способ по любому из пп.2-4, включающий использование в качестве растворителя эфирного типа диизопропилового эфира. 9. Кристаллическая форма II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2(4-фторфенил)-5-(1-метипэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, характеризующаяся тем, что имеет порошковую рентгенограмму, представленную в табл. 2 и на фиг. 2,полученную с помощью СuК-излучения: Таблица 2. Положение дифракционных полос и относительная интенсивность (10% полиморфной формы II) 10. Способ получения кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметип-[1,3]диоксан-4-ил-уксусной кислоты, охарактеризованной в п.9, включающий растворение аморфного трет-бутилового эфира(4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил[1,3]диоксан-4-ил-уксусной кислоты в неполярном растворителе при нагревании с последующей кристаллизацией и выделением кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-укусной кислоты. 11. Способ получения кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, охарактеризованной в п.9, включающий растворение кристаллической формы I третбутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1 ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты в неполярном растворителе при нагревании с последующей кристаллизацией и выделением кристаллической формы II трет-бутилового эфира (4Rцис)-6-[2-[3-фенил-4-фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил[1,3]диоксан-4-ил-уксусной кислоты. 12. Способ по п.10 или 11, включающий использование в качестве неполярного растворителя циклогексана, толуола, гексана, гептана или их смеси. 13. Способ получения кристаллической формы II тpeт-бутилового эфира (4R-цис)-6-[2-[3-фенил-4 фенилкарбамоил-2-(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты, охарактеризованной в п.9, включающий взаимодействие (4R-циc)-1,1-диметилэтил-6-(2 аминоэтил)-2,2-диметил-1,3-диоксан-4-ацетата формулы в смеси толуола, гептана и тетрагидрофурана, 1:4:1, в присутствии пиваловой кислоты в качестве катализатора, добавление к реакционной массе в конце реакции диизопропилового эфира с последующим выделением кристаллической формы II трет-бутилового эфира (4R-цис)-6-[2-[3-фенил-4-фенилкарбамоил-2(4-фторфенил)-5-(1-метилэтил)пиррол-1-ил]этил]-2,2-диметил-[1,3]диоксан-4-ил-уксусной кислоты.
МПК / Метки
МПК: C07D 405/06
Метки: полиморфные, производного, 1-пиррола, соединения, получения, формы, аторвастатина, промежуточного
Код ссылки
<a href="https://eas.patents.su/11-7104-polimorfnye-formy-proizvodnogo-1-pirrola-promezhutochnogo-soedineniya-dlya-polucheniya-atorvastatina.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфные формы производного 1-пиррола, промежуточного соединения для получения аторвастатина</a>
Предыдущий патент: Способ и система обеспечения доступа к информации в сети
Следующий патент: Сверхчувствительные неизотопные водорастворимые нанокристаллы
Случайный патент: Связанные с матрицей пептидомиметики β-шпилечной структуры с активностью антагонистов cxcr4












