Способ синтеза (2r,2-альфа-r, 3а)-2-[1-[3,5-бис (трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазина
Номер патента: 4743
Опубликовано: 26.08.2004
Авторы: Конрад Карен М., Брэндс Карел М.Ес, Зао Мэттью М., Цай Фух-Ронг
Формула / Реферат
1. Способ получения соединения формулы
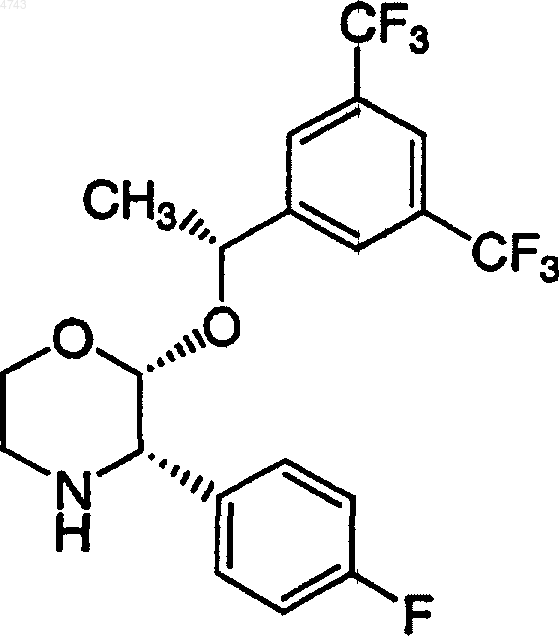
который включает контактирование соединения формулы
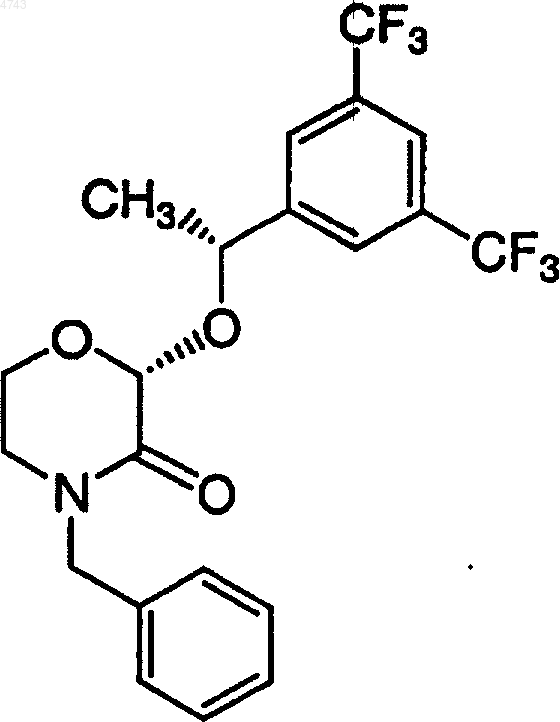
с соединением формулы
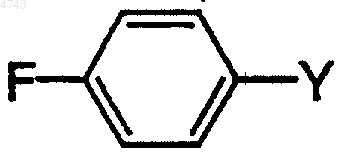
где Y выбирают из MgCl, MgBr, MgI и Li,
в первом растворителе с последующим гидрированием во втором растворителе.
2. Способ по п.1, где Y означает MgBr.
3. Способ по п.1, где первый растворитель выбирают из группы, включающей толуол, тетрагидрофуран, 1,2-диметоксиэтан (ДМЭ), диэтиловый эфир, диизопропиловый эфир, МТБЭ, 2-метоксиэтиловый эфир, 1,4-диоксан, 1,3-диоксолан и их смеси.
4. Способ по п.1, где первый растворитель выбирают из группы, включающей толуол, тетрагидрофуран и их смеси.
5. Способ по п.1, где первый растворитель представляет собой тетрагидрофуран.
6. Способ по п.1, где продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2-[1-[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4-фторфенильным реагентом, приводится в контакт со спиртом и сильной неорганической или органической кислотой перед проведением гидрирования.
7. Способ по п.1, где продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2-[1-[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4-фторфенильным реагентом приводится в контакт с метанолом и хлористо-водородной кислотой, бромисто-водородной кислотой или 4-толуолсульфоновой кислотой перед проведением гидрирования.
8. Способ по п.1, где гидрирование означает каталитическое гидрирование.
9. Способ по п.8, где катализатор гидрирования выбирают из группы, включающей палладий на угле, палладий на окиси алюминия, палладий на сульфате бария, палладий на карбонате кальция, палладий на карбонате бария, палладий на карбонате стронция, палладий на двуокиси кремния и гидроксид палладия на угле.
10. Способ по п.9, где катализатор гидрирования представляет собой палладий на угле.
11. Способ по п.1, где второй растворитель выбирают из группы, включающей C1-C4-первичные, вторичные, третичные спирты и воду.
12. Способ по п.1, где второй растворитель выбирают из группы, включающей метанол, этанол, изопропанол, н-пропанол, н-бутанол, воду и их смеси.
13. Способ по п.1, где второй растворитель выбирают из метанола и смесей метанола и воды.
14. Хлористо-водородная соль соединения
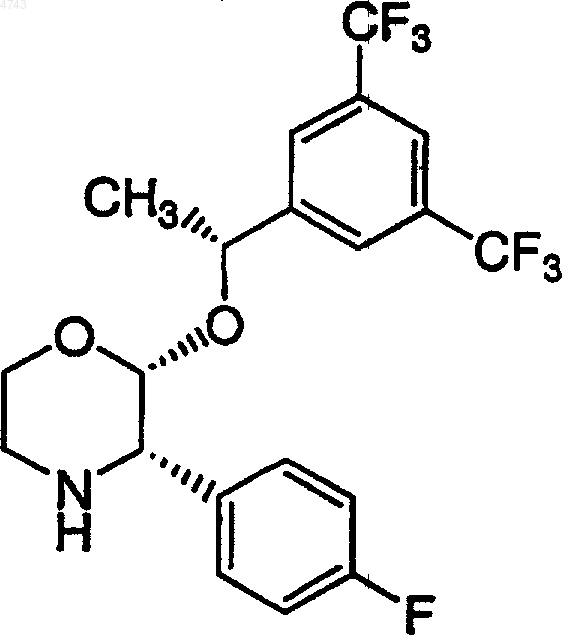
15. Полиморфная форма хлористо-водородной соли соединения
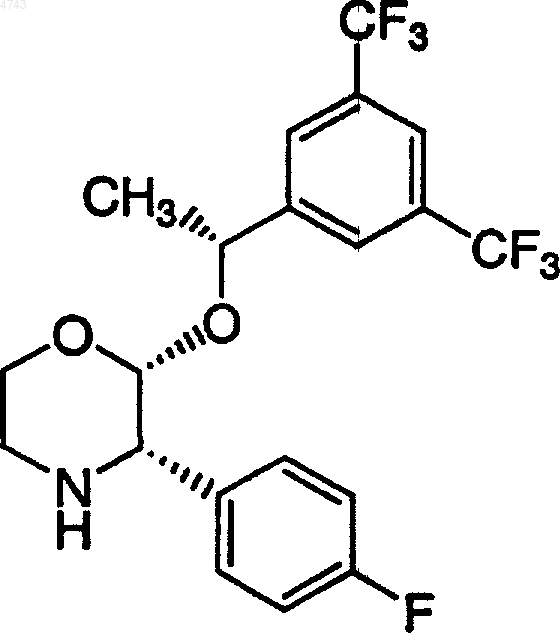
которая характеризуется рентгеновской порошковой дифрактограммой с характеристическими рефлексиями приблизительно при 13,71, 20,23, 22,70 и 23,26ш (2q ).
16. Полиморфная форма хлористо-водородной соли соединения
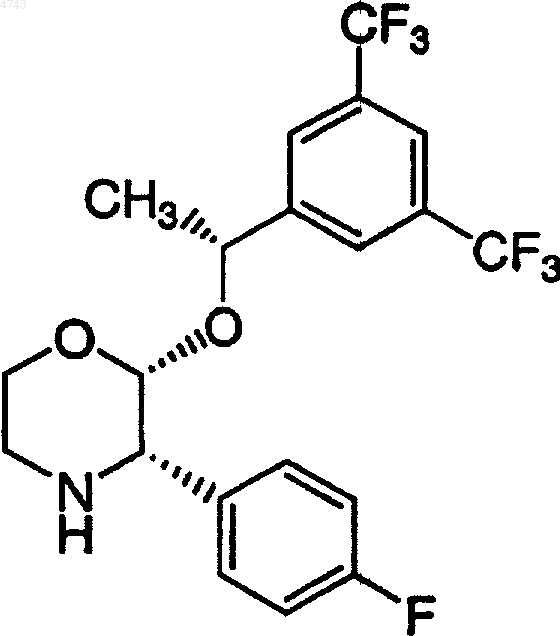
которая характеризуется рентгеновской порошковой дифрактограммой с характеристическими рефлексиями приблизительно при 20,24, 20,79, 21,88 и 24,03ш (2q ).
Текст
1 Обоснование изобретения Настоящее изобретение касается способа получения (2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4 оксазина, который полезен в качестве промежуточного соединения при получении некоторых терапевтических средств. В частности, данное изобретение представляет способ получения соединения (2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4 оксазина, являющегося промежуточным соединением в синтезе фармацевтических соединений, являющихся антагонистами рецептора субстанции Р (нейрокинин-1). Основной, известный из уровня техники,способ получения (2R,2-альфа-R)-4-бензил-2-[1[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она приводит к сравнительно низким и неустойчивым выходам требуемого продукта(см. патент США 5.719.147). В противоположность известному ранее способу настоящее изобретение представляет более практичный и экономичный способ получения (2R,2-альфаR,3 а)-2-[1-[3,5-бис(трифторметил)фенил] этокси]-3-(4-фторфенил)-1,4-оксазина со сравнительно высокими выходом и чистотой. Ценно, что (2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)1,4-оксазин является важным промежуточным соединением для чрезвычайно полезного класса терапевтических средств. По этой причине существует необходимость в дальнейшей разработке способа получения (2R,2-альфа-R,3 а)-2[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4 фторфенил)-1,4-оксазина, особенно подходящего для крупномасштабного производства, использующего рентабельные и легко доступные реагенты и поэтому пригодного для практического применения при производстве в крупных масштабах. Следовательно, объектом изобретения является способ получения (2R,2-альфа-R,3 а)-2-[1[3,5-бис(трифторметил)фенил]этокси]-3-(4 фторфенил)-1,4-оксазина путем очень простого,короткого, сравнительно недорогого и высокоэффективного синтеза. Краткое описание изобретения Новый способ по настоящему изобретению включает синтез (2R,2-альфа-R,3 а)-2-[1-[3,5 бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазина. В частности, настоящее изобретение касается нового способа получения соединения формулы 2 Настоящее соединение является промежуточным продуктом в синтезе соединений, обладающих фармацевтической активностью. В частности, такие соединения являются антагонистами рецептора субстанции Р (нейрокинин-1),которые полезны, например, для лечения психических нарушений, воспалительных заболеваний и против рвоты. Описание чертежей Фиг. 1 представляет рентгеновскую порошковую дифрактограмму формы I (2R,2 альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил] этокси]-3-(4-фторфенил)-1,4-оксазингидрохлорида; фиг. 2 представляет рентгеновскую порошковую дифрактограмму формы II (2R,2 альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил] этокси]-3-(4-фторфенил)-1,4-оксазингидрохлорида. Подробное описание изобретения Настоящее изобретение представляет способ получения (2R,2-альфа-R,3 а)-2-[1-[3,5-бис Воплощение основного способа получения включает контактирование соединения формулы в первом растворителе с последующим гидрированием во втором растворителе, с получением соединения формулы который схематически может быть представлен следующим образом: Согласно настоящему изобретению взаимодействие (2R,2-альфа-R)-4-бензил-2-[1-[3,5 бис(трифторметил)фенил]этокси]-1,4-оксазин-3 она с 4-фторфенилметаллоорганическим реагентом с последующим гидрированием дает (2R,2 альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил] этокси]-3-(4-фторфенил)-1,4-оксазин с высоким выходом и эффективным способом. Другой вариант выполнения настоящего изобретения касается способа получения соединения формулы Другой конкретный вариант выполнения настоящего изобретения касается способа получения (2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазина, который схематически может быть представлен следующим образом: который включает контактирование соединения формулы в первом растворителе с последующим гидрированием во втором растворителе, с получением соединения формулы Специфический вариант выполнения настоящего изобретения касается способа получения Предпочтительно 4-фторфенилметаллоорганический реагент по настоящему изобретению выбирают из группы, включающей 4 фторфенилмагнийбромид, 4-фторфенилмагнийхлорид, 4-фторфенилмагнийиодид и 4-фторфениллитий. 4-Фторфенилметаллоорганический реагент может быть получен из соответствующего 4 фторбромбензола, 4-фторхлорбензола или 4 фториодбензола способами, указанными здесь или известными из уровня техники. 4-Фторфенильный реактив Гриньяра можно получить из магния, который может быть в форме магниевых гранул, магниевых стружек,магниевой пыли, магниевого порошка, суспензии магния в масле и тому подобного. Для сведения риска к минимуму желательно использовать магний в гранулах. Предпочтительные растворители для получения 4-фторфенильного реактива Гриньяра включают органический растворитель, который выбирают из толуола, тетрагидрофурана (ТГФ), диэтилового эфира, диглима и метил-трет-бутилового эфира. Для получения 4-фторфенильного реактива Гриньяра более предпочтительными органическими растворителями являются тетрагидрофуран или диэтиловый эфир, и наиболее предпочтительным органическим растворителем является тет 5 рагидрофуран. Получение по реакции Гриньяра из 4-фторбромбензола в стандартных условиях с использованием магниевых стружек (4 экв.) с маркировкой "годный для реакций Гриньяра" в диэтиловом эфире или тетрагидрофуране и при медленном добавлении исходного бромида легко приводит к образованию реактива Гриньяра. По настоящему изобретению первый растворитель и второй растворитель могут быть одинаковыми или различными. По настоящему изобретению предпочтительно, чтобы первый растворитель в реакции(2R,2-альфа-R)-4-бензил-2-[1-[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4 фторфенильным реактивом Гриньяра состоял из растворителя, который выбирают из группы,включающей толуол, тетрагидрофуран, 1,2 диметоксиэтан (DME (ДМЭ, диэтиловый эфир,диизопропиловый эфир, МТВЕ (МТБЭ), 2 метоксиэтиловый эфир, 1,4-диоксан, 1,3 диоксолан и их смеси. По настоящему изобретению более предпочтительно, чтобы первый растворитель во взаимодействии (2R,2-альфа-R)-4-бензил-2-[1[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4-фторфенильным реактивом Гриньяра состоял из растворителя, который выбирают из группы, включающей толуол, тетрагидрофуран и их смеси. По настоящему изобретению еще более предпочтительно, чтобы первый растворитель в реакции (2R,2-альфа-R)-4 бензил-2-[1-[3,5-бис(трифторметил)фенил] этокси]-1,4-оксазин-3-она с 4-фторфенильным реактивом Гриньяра состоял из тетрагидрофурана. По настоящему изобретению предпочтительно, чтобы температура при взаимодействии(2R,2-альфа-R)-4-бензил-2-[1-[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4 фторфенильным реактивом Гриньяра находилась в пределах приблизительно от -70 до+70 С. По настоящему изобретению более предпочтительно, чтобы температура при взаимодействии(2R,2-альфа-R)-4-бензил-2-[1-[3,5 бис(трифторметил)фенил]этокси]-1,4-оксазин-3 она с 4-фторфенильным реактивом Гриньяра находилась в пределах приблизительно от 20 до 25 С. По настоящему изобретению предпочтительно осуществлять взаимодействие (2R,2 альфа-R)-4-бензил-2-[1-[3,5-бис(трифторметил) фенил]этокси]-1,4-оксазин-3-она с 4-фторфенильным реактивом Гриньяра при перемешивании. По настоящему изобретению предпочтительно, чтобы продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2-[1-[3,5 бис(трифторметил)фенил]этокси]-1,4-оксазин-3 она с 4-фторфенильным реактивом Гриньяра,контактировал со спиртом и сильной неорганической или органической кислотой перед прове 004743 6 дением гидрирования. Спирт может быть выбран из группы C1-С 4-первичных, вторичных и третичных спиртов, где наиболее предпочтительным спиртом является метанол. Кислоту выбирают из группы, в которую входят хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота,муравьиная кислота, уксусная кислота, трифторуксусная кислота, трихлоруксусная кислота,щавелевая кислота, винная кислота, лимонная кислота, яблочная кислота, бензойная кислота,4-нитробензойная кислота, метансульфоновая кислота, трифторметансульфоновая кислота,бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота и толуолсульфоновая кислота, где наиболее предпочтительными кислотами являются хлористо-водородная кислота,бромисто-водородная кислота или 4-толуолсульфоновая кислота. По настоящему изобретению более предпочтительно, чтобы продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2-[1[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4-фторфенильным реактивом Гриньяра, приводился в контакт с метанолом и хлористо-водородной кислотой,бромистоводородной кислотой или 4-толуолсульфоновой кислотой перед проведением гидрирования. По настоящему изобретению более предпочтительно, чтобы продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2-[1[3,5-бис(трифторметил)фенил]этокси]-1,4-оксазин-3-она с 4-фторфенильным реактивом Гриньяра, приводился в контакт с метанолом при температуре ниже приблизительно 25 С и желательно ниже приблизительно 10 С, перед проведением гидрирования. По настоящему изобретению предпочтительно, чтобы катализатором гидрирования являлся палладиевый катализатор, который выбирают из группы, включающей палладий на угле,палладий на окиси алюминия, палладий на сульфате бария, палладий на карбонате кальция,палладий на карбонате бария, палладий на карбонате стронция, палладий на двуокиси кремния и гидроксид палладия на угле (катализаторPearlman). По настоящему изобретению более предпочтительно, чтобы катализатором гидрирования являлся палладий на угле, в особенности, 5 или 10% палладий на угле. По настоящему изобретению предпочтительно, чтобы второй растворитель состоял из растворителя, который выбирают из группы,включающей С 1-С 4-первичные, вторичные и третичные спирты и воду. Предпочтительные растворители для гидрирования включают метанол, этанол, изопропанол, н-пропанол, нбутанол, воду и их смеси. Более предпочтительные растворители для гидрирования включают метанол и смеси метанола и воды. По настоящему изобретению более предпочтительно, чтобы температура реакционной смеси для гидрирования была приблизительно от 10 до 50 С, при этом наиболее предпочтительная температура равна приблизительно 2025 С. По настоящему изобретению предпочтительно, чтобы давление водорода во время гидрирования составляло приблизительно от 1 до 150 фунт/кв.дюйм, при этом наиболее предпочтительно давление приблизительно от 5 до 50 фунт/кв.дюйм. Настоящее изобретение, кроме того, касается солей соединения (2R,2-альфа-R,3 а)-2-[1[3,5-бис(трифторметил)фенил]этокси]-3-(4 фторфенил)-1,4-оксазина формулы(2R,2-альфа-R,3 а)-2-[1-[3,5 бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазин может быть в форме кислотноаддитивной соли, неорганических или органических кислот. Примерами таких кислот являются хлористо-водородная, азотная, серная,фосфорная, муравьиная, уксусная, трифторуксусная, пропионовая, малеиновая, янтарная,малоновая, метансульфоновая, бензолсульфоновая, паратолуолсульфоновая и тому подобные кислоты. Предпочтительной кислотно-аддитивной солью(2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4 оксазина является хлористо-водородная соль. Указанная соль имеет преимущества перед другими солями 8 мической стабильности, очистки и технологичности. Как использовано здесь, полиморфная форма химического соединения имеет ту же химическую структуру, но другую кристаллическую структуру. Предпочтительные полиморфные формы(2R,2-альфа-R,3 а)-2-[1-[3,5 бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазингидрохлорида описаны в данной заявке. Эти полиморфные формы имеют преимущества перед другими формами (2R,2 альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил] этокси]-3-(4-фторфенил)-1,4-оксазингидрохлорида в отношении термодинамической стабильности и технологичности.(2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазин, полученный согласно настоящему изобретению, может быть использован как исходный материал в дальнейших взаимодействиях непосредственно или после очистки. Исходные материалы и реагенты для рассматриваемого способа либо выпускаются промышленно, либо известны из литературы, либо могут быть получены по описанным в литературе способам, приведенным для аналогичных соединений. Технические приемы, требующиеся для проведения взаимодействия и очистки полученных реакционных продуктов, известны специалистам из уровня техники. Способы очистки включают кристаллизацию, перегонку,хроматографию с нормальной фазой или обращенной фазой. Следующие примеры приведены исключительно в целях дальнейшей иллюстрации, и не рассматриваются как ограничивающие обсуждаемое изобретение. Пример 1. 4-Бензил-2-гидрокси-1,4-оксазин-3-он. Раствор ТГФ (27,0 л) и 50% водной глиоксиловой кислоты (12,6 л; 16,9 кг) нагревают до температуры кипения с обратным холодильником и за период 45 мин добавляют Nбензилэтаноламин (7,8 кг). Полученную смесь нагревают до температуры кипения с обратным холодильником 21 ч. Затем отгоняют ТГФ при атмосферном давлении, поддерживая при этом постоянный объем путем одновременного добавления воды (27 л). По завершению перегонки(8 об.% ТГФ на порцию) смесь охлаждают приблизительно от 95-100 до 79-81 С и, необязательно, вносят в качестве затравки 4-бензил-2 гидрокси-1,4-оксазин-3-он (250 г). После допол 9 нительного охлаждения до комнатной температуры продукт кристаллизуется. Кристаллический 4-бензил-2-гидрокси-1,4-оксазин-3-он фильтруют, промывают водой и затем сушат в вакуумной печи приблизительно при 60 С в токе N2 (72-76% выход); т.пл. 134 С. 1 К энергично перемешиваемому раствору 1,3-бис(трифторметил)бензола (107 г) в смеси ледяной уксусной кислоты (22 мл) и концентрированной серной кислоты (142 мл) добавляют 1,3-дибром-5,5-диметилгидантоин (77,25 г) при 25 С. Экзотермическая реакция приводит к повышению температуры приблизительно до 40 С. После выдерживания при 45 С в течение 4,5 ч смесь охлаждают приблизительно до 0 С и выливают в ледяную воду (250 мл). После промывания 5 н. NaOH (75 мл) органический слой Материалы 3,5-Бис(трифторметил)бромбензол Магний-гранулы, 20 меш Уксусный ангидрид ТГФ (KF=60 мкг/мл) МТБЭ Вода 50% NaOH Раствор 3,5-бис(трифторметил)бромбензола (29,3 г) в 30 мл ТГФ добавляют к смеси магниевых гранул (5,10 г) в ТГФ (200 мл), нагретой до температуры кипения с обратным холодильником (реакцию инициируют приблизительно 5 мл бромидного раствора; остаток добавляют медленно в течение 1 ч). Смесь выдерживают 30 мин при температуре кипения флегмы, охлаждают до комнатной температуры и добавляют за 1 ч раствор уксусного ангидрида-15 С. Полученную темно-коричневую смесь нагревают до 10 С на водяной бане и добавляют воду (300 мл). рН энергично перемешиваемой двухфазной смеси доводят до 8,0, используя согласно анализу содержит 137 г требуемого 3,5-бис(трифторметил)-1-бромбензола(94% выход). Указанный продукт используют на следующей стадии без дополнительной очистки. Пример 3. 1-(3,5-Бис(трифторметил) фенил)этан-1-он. 50% NaOH. Добавляют МТБЭ (300 мл), слои разделяют и водный слой дополнительно экстрагируют МТБЭ (3150 мл). Органические слои объединяют и концентрируют в вакууме(баня при 30-35 С; 50-80 торр). Концентрат перегоняют затем при атмосферном давлении,получая чистый продукт (20,7 г; 82% выход) с температурой кипения 187-189 С. Пример 4. (R)-1-(3,5-Бис(трифторметил) фенил)этан-1-ол.(7 л) перемешивают в течение 30 мин и тщательно дегазируют в вакууме. Затем добавляют 5 М гидроксид натрия (9 мл) и смесь выдерживают в течение 3-4 ч до достижения полной конверсии исходного материала. Реакционную смесь выливают в 1 н. НСl (7 л) и экстрагируют гептаном (23,5 л). Объединенные органические слои промывают насыщенным раствором соли (5 л) и добавляют 1,4-диазабицикло[2.2.2] октан (240 г). Раствор концентрируют приблизительно до 4 мл/г спирта (KF 200 мкг/мл; 2 пропанол 5 об.%). В смесь вносят затравку при 40 С, дают охладиться до комнатной температуры для образования затравочного слоя и затем охлаждают до 0 С. Кристаллический продукт фильтруют, промывают охлажденным гептаном и сушат, получая ДАБЦО комплекс (70% выход; е.е. (исключая ошибки) 99%). Пример 5. (R)-1-(3,5-Бис(трифторметил) фенил)этан-1-ол. Раствор [RuCl2 (п-цимен)]2 (18,4 г),(1S,2R)-цис-1-амино-2-инданола (9,0 г) и 1-(3,5 бис(трифторметил)фенил)этан-1-она (3 кг) в 2 пропаноле (21 л) перемешивают в течение 30 мин и тщательно дегазируют в вакууме. Затем добавляют 5 М гидроксид натрия (28 мл) и смесь выдерживают 4-6 ч до достижения полной конверсии исходного материала. Реакционную смесь выливают в 1 н. НСl (21 л) и экстрагируют 12 гептаном (210,5 л). Объединенные органические слои промывают насыщенным раствором соли и добавляют 1,4-диазабицикло[2.2.2]октан(740 г). Раствор концентрируют приблизительно до 4 мл/г спирта (KF 200 мкг/мл; 2-пропанол 5 об.%). В смесь вносят затравку при 40 С,дают охладиться до комнатной температуры для образования затравочного слоя и затем охлаждают до 0 С. Кристаллический продукт фильтруют, промывают охлажденным гептаном и сушат, получая ДАБЦО комплекс (75-80% выход; е.е. (исключая ошибки) 99%). Пример 6. (2R,2-альфа-R)-4-Бензил-2-[1[3,5-бис(трифторметил)фенил]этокси]-1,4 оксазин-3-он (способ 1). Трифторуксусный ангидрид (2,16 кг) добавляют за 10 мин к сухой (KF 100 мкг/мл) суспензии лактамлактола (2,14 кг) в ацетонитриле (5 л), охлажденной до 5 С. Температура поднимается от 5 до 30 С и твердые вещества растворяются. Раствор выдерживают 1 ч при температуре между 17-25 С перед добавлением концентрированного раствора(0,65 л). Температура поднимается от 17 до 27 С, и смесь выдерживают в течение 4 ч перед медленным добавлением 5 М NaOH (7,6 л), при сохранении температуры ниже 27 С, с последующим добавлением 3,7-диметилоктан-3-ола(5,9 л). Полученную смесь перегоняют при атмосферном давлении, пока температура паров не достигнет 92 С и большая часть ацетонитрила будет отогнана. Добавляют воду (5 л) и гептан (8 л) и смесь нагревают до 45 С. Органический слой отделяют, промывают водой (13 л) при 45-50 С и затем разбавляют гептаном (16 л). Раствор сушат азеотропной перегонкой до KF 130 мкг/мл (собранно 6 л дистиллята; добавлено 3 л свежего гептана). Раствор охлаждают до комнатной температуры и вносят затравку из 13 затравочного слоя суспензию охлаждают до-10 С и добавляют трет-бутилат калия (752 г) за одну порцию. Смесь выдерживают между -12 и-7 С в течение 8,5 ч, в течение которых фактически весь нежелательный диастереомер превращается в требуемый (R,R) диастереомер согласно ВЭЖХ анализу. Добавляют уксусную кислоту (0,59 л) с последующим добавлением 5% NаНСО 3 в водном растворе (5 л). Двухфазную смесь нагревают до 45-50 С. Органический слой отделяют, промывают водой (5 л) при 4550 С и концентрируют перегонкой при атмосферном давлении до общего объема 24 л (собранно 12 л дистиллята). После охлаждения до 35 С образуется затравочный слой. Суспензию охлаждают до -10 С и затем фильтруют. Твердые продукты промывают охлажденным гептаном (4,5 л) и сушат в вакууме, получая чистый продукт (3,66 кг; 83% общий выход). Пример 7. (2R,2-альфа-R)-4-Бензил-2-[1[3,5-бис(трифторметил)фенил]этокси]-1,4 оксазин-3-он (способ 2). Трифторуксусный ангидрид (2,056 кг) добавляют за 10 мин к сухой (KF 140 мкг/мл) суспензии лактамлактола (2,03 кг) в ацетонитриле (4,8 л), охлажденной до 5 С. Температура поднимается от 5 до 30 С и твердые вещества растворяются. Раствор выдерживают 1 ч при температуре между 17-25 С перед добавлением концентрированного раствора(0,62 л). Температура поднимается от 17 до 28 С, и смесь выдерживают 2 ч перед медленным добавлением 5 М NaOH (8,1 л), при сохранении температуры ниже 27 С, с последующим добавлением 3,7-диметилоктан-3-ола (2,0 л). Полученную смесь перегоняют при атмосферном давлении, пока температура паров не достигнет 92 С и большая часть ацетонитрила будет отогнана (собранно 8,1 л дистиллята). До 004743 14 бавляют воду (4,1 л) и гептан (12,2 л) и смесь нагревают до 45 С. Органический слой отделяют, промывают водой (12,2 л) при 45-50 С и затем разбавляют гептаном (6 л). Раствор сушат азеотропной перегонкой до KF 130 мкг/мл (собранно 7,8 л дистиллята). Раствор охлаждают до комнатной температуры и вносят затравку из(R,R) диастереомера (50 мг). После образования затравочного слой суспензию охлаждают до -11 С и добавляют 3,7 диметилокт-3-оксид калия (1,09 кг; 48,7 мас.% раствора в гептане) за 10 мин. Смесь выдерживают между -12 и -7 С в течение 5 ч, в течение которых фактически весь нежелательный диастереомер превращается в требуемый (R,R) диастереомер согласно ВЭЖХ анализу. Добавляют уксусную кислоту (0,28 л) с последующим добавлением 5% NaHCO3 в водном растворе (4,1 л). Двухфазную смесь нагревают до 45-50 С. Органический слой отделяют, промывают водой(4,1 л) при 45-50 С и концентрируют перегонкой при атмосферном давлении до общего объема 16 л (собранно 4,1 л дистиллята). В раствор вносят затравку при 45 С и затем дают охладиться до комнатной температуры. Суспензию охлаждают до 5 С, выдерживают 1,5 ч и затем фильтруют. Твердые продукты промывают охлажденным гептаном (3,0 л) и сушат в вакууме,получая чистый продукт (3,51 кг; 84% общий выход). Пример 8.(2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4 оксазин (способ 1). Раствор (2R,2-альфа-R)-4-бензил-2-[1-[3,5 бис(трифторметил)фенил]этокси]-1,4-оксазин-3 она (4,80 г) в толуоле (27 мл) охлаждают до -6 С и медленно, так, что Т 0 С, добавляют раствор 4-фторфенилмагнийбромида в ТГФ (27 мл; 0,93 М). Полученный прозрачный раствор выдерживают 1 ч и затем реакцию гасят водной уксусной кислотой (10 мас.%; 27 мл). Добавляют толуол (27 мл) и органический слой отделяют и промывают 0,5 М раствором бикарбоната натрия и водой (по 25 мл каждого). Раствор частично концентрируют до общего объема порядка 20 мл и затем разбавляют метанолом до общего объема 90 мл. Добавляют моногидрат 4 толуолсульфоновой кислоты (1,95 г) и катализатор 10% Pd/C (950 мг) и смесь гидрируют под давлением 5 фунт/кв.дюйм водорода при комнатной температуре в течение 4 ч. Катализатор фильтруют и промывают дополнительным ко 15 личеством метанола (90 мл). Объединенные фильтраты концентрируют досуха. Остаток растворяют в 60 мл горячего толуола. При медленном охлаждении образуются кристаллы. После охлаждения до комнатной температуры добавляют гептан (60 мл). После фильтрования и высушивания получают (2R,2-альфа-R,3 а)-2-[1[3,5-бис(трифторметил)фенил]этокси]-3-(4 фторфенил)-1,4-оксазин в виде тозилатной соли с общим выходом 89%. Пример 9.(2R,2-альфа-R)-4-бензил-2-[1-[3,5 бис(трифторметил)фенил]этокси-1,4-оксазин-3 она (49,5 г) в ТГФ (50 мл) при температуре между 20 и 25 С. Полученный прозрачный раствор выдерживают 30 мин и затем медленно,так, что Т 20 С, добавляют в охлажденный метанол (100 мл). К суспензии добавляют раствор моногидрата 4-толуолсульфоновой кислоты (42,1 г) в метаноле (50 мл) с последующим добавлением катализатора, 10% Pd/C (16,5 г; влажность 55 мас.%). Полученную смесь гидрируют под давлением 5 фунт/кв.дюйм водорода при комнатной температуре в течение 3 ч. Катализатор фильтруют и промывают метанолом(100 мл). Объединенные фильтраты концентрируют перегонкой при атмосферном давлении до общего объема приблизительно 350 мл. Перегонку продолжают, поддерживая объем постоянным, равным 350 мл, путем медленного добавления 4-метил-2-пентанона (метилизобутилкетона; MIBK МИБК) 450 мл). После завершения перегонки полученной суспензии дают охладиться до 20-30 С и промывают 500 мл раствора дигидрата тринатрийцитрата (10 мас.%) и бикарбоната натрия (1,0 М) в воде. К органическому слою добавляют концентрированную хлористо-водородную кислоту (11,9 г; 37,3 мас.%) и прозрачный раствор концентрируют при атмосферном давлении до общего объема порядка 180 мл. Полученную суспензию продукта охлаждают от 118 до 5 С и фильтруют. Твердые продукты промывают метилизобутилкетоном (МИБК) и сушат в вакууме при 40 С,получая 46,4 г (2R,2-альфа-R,3 а)-2-[1-[3,5-бис 16 Две полиморфные формы (2R,2-альфаR,3 а)-2-[1-[3,5-бис(трифторметил)фенил] этокси]-3-(4-фторфенил)-1,4-оксазингидрохлорида (форма I и II) охарактеризованы ниже посредством рентгеновских порошковых (XRPD) дифрактограмм. XRPD рентгенограммы получены на Philips PW 3710 MPD автоматически контролируемом порошковом дифрактометре. Генератор рентгеновских лучей использует медную мишень, ускоряющий потенциал в 45 кВ и эмиссию нити 40 мА. Рентгеннограммы собирают при углах от 2 до 40. Форма I (2R,2-альфа-R,3 а)-2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)1,4-оксазингидрохлорида характеризуется порошковой рентгенограммой с характеристическими рефлексиями приблизительно при: 13,71,20,23, 22,70 и 23,26 (2). Дополнительные XRPD данные в отношении указанной полиморфной формы (формы I) представлены ниже в табл. 1 (установочные параметры генератора: 45 кВ, 40 мА; угл. при Сu альфа 1, 2 длинах волн 1,54060, 1,54439) и на фиг. 1.(трифторметил)фенил]этокси]-3-(4-фторфенил)1,4-оксазингидрохлорида характеризуется порошковой рентгенограммой с характеристическими рефлексиями приблизительно при 20,24,20,79, 21,88 и 24,03 (2). Дополнительные XRPD данные в отношении указанной полиморфной формы (формы II) представлены ниже (установочные параметры генератора: 45 кВ, 40 мА; угл. при Сu альфа 1, 2 длинах волн 1,54060, 1,54439) и на фиг. 2. 18 ходных материалов может изменяться в зависимости и в соответствии с конкретными присутствующими заместителями или условиями промышленного получения, и такие ожидаемые изменения или различия в результатах рассматриваются как соответствующие целям и практическим задачам изобретения. Поэтому подразумевается, что изобретение определяется рамками объема приложенных пунктов и что указанные пункты интерпретируются так широко, насколько это разумно. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы который включает контактирование соединения формулы Хотя изобретение описано и иллюстрируется некоторыми конкретными вариантами выполнения, для квалифицированного специалиста в данной области очевидно, что могут быть произведены различные адаптации, изменения,модификации, замены, исключения или дополнения, не выходящие за суть и рамки объема изобретения и приложенных пунктов. Например, могут быть применены другие реакционные условия, отличающиеся от вышеуказанных конкретных условий, такие как последовательность варьирования реагентов, или методики при получении соединений вышеуказанными способами по изобретению. Подобным образом,специфическая реакционная способность ис где Y выбирают из MgCl, MgBr, MgI и Li,в первом растворителе с последующим гидрированием во втором растворителе. 2. Способ по п.1, где Y означает MgBr. 3. Способ по п.1, где первый растворитель выбирают из группы, включающей толуол, тетрагидрофуран, 1,2-диметоксиэтан (ДМЭ), диэтиловый эфир, диизопропиловый эфир, МТБЭ,2-метоксиэтиловый эфир, 1,4-диоксан, 1,3 диоксолан и их смеси. 4. Способ по п.1, где первый растворитель выбирают из группы, включающей толуол, тетрагидрофуран и их смеси. 5. Способ по п.1, где первый растворитель представляет собой тетрагидрофуран. 6. Способ по п.1, где продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2[1-[3,5-бис(трифторметил)фенил]этокси]-1,4 оксазин-3-она с 4-фторфенильным реагентом,приводится в контакт со спиртом и сильной неорганической или органической кислотой перед проведением гидрирования. 7. Способ по п.1, где продукт, полученный при взаимодействии (2R,2-альфа-R)-4-бензил-2[1-[3,5-бис(трифторметил)фенил]этокси]-1,4 оксазин-3-она с 4-фторфенильным реагентом, 19 приводится в контакт с метанолом и хлористоводородной кислотой, бромисто-водородной кислотой или 4-толуолсульфоновой кислотой перед проведением гидрирования. 8. Способ по п.1, где гидрирование означает каталитическое гидрирование. 9. Способ по п.8, где катализатор гидрирования выбирают из группы, включающей палладий на угле, палладий на окиси алюминия,палладий на сульфате бария, палладий на карбонате кальция, палладий на карбонате бария,палладий на карбонате стронция, палладий на двуокиси кремния и гидроксид палладия на угле. 10. Способ по п.9, где катализатор гидрирования представляет собой палладий на угле. 11. Способ по п.1, где второй растворитель выбирают из группы, включающей С 1-С 4 первичные, вторичные, третичные спирты и воду. 12. Способ по п.1, где второй растворитель выбирают из группы, включающей метанол,этанол, изопропанол, н-пропанол, н-бутанол,воду и их смеси. 13. Способ по п.1, где второй растворитель выбирают из метанола и смесей метанола и воды. 14. Хлористо-водородная соль соединения 15. Полиморфная форма водородной соли соединения хлористо которая характеризуется рентгеновской порошковой дифрактограммой с характеристическими рефлексиями приблизительно при 13,71, 20,23,22,70 и 23,26 (2). 16. Полиморфная форма хлористоводородной соли соединения которая характеризуется рентгеновской порошковой дифрактограммой с характеристическими рефлексиями приблизительно при 20,24, 20,79,21,88 и 24,03 (2).
МПК / Метки
МПК: C07D 265/32
Метки: 2r,2-альфа-r, 3а)-2-[1-[3,5-бис, синтеза, способ, трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазина
Код ссылки
<a href="https://eas.patents.su/11-4743-sposob-sinteza-2r2-alfa-r-3a-2-1-35-bis-triftormetilfeniletoksi-3-4-ftorfenil-14-oksazina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза (2r,2-альфа-r, 3а)-2-[1-[3,5-бис (трифторметил)фенил]этокси]-3-(4-фторфенил)-1,4-оксазина</a>
Предыдущий патент: Способ получения циталопрама
Следующий патент: Комбинированные композиции адъювантов
Случайный патент: Способ подачи флюидизируемых материалов и устройство для его осуществления












