Четвертичные соединения аммония
Номер патента: 4292
Опубликовано: 26.02.2004
Авторы: Мадельмон Жан-Клод, Ренар Пьер, Кэньяр Даньель-Анри, Рапп Мариза, Жиро Изабелла, Никола Колетта, Моризи Жан-Клод, Оллье Моника
Формула / Реферат
1. Соединения формулы (Ia)
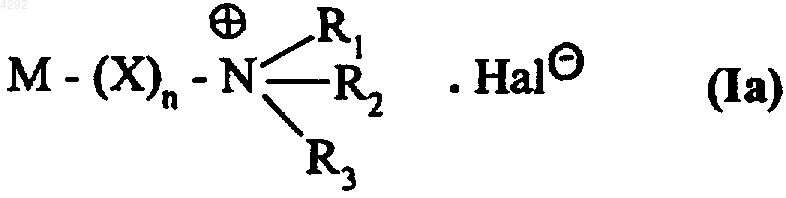
где M представляет собой остаток молекулы соединения, которое можно применять для лечения или диагностики паталогий, возникающих в результате поражения хряща,
R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (C1-C6)алкильную группу или
R1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо,
X обозначает линейную или разветвленную (C1-C6)алкиленовую группу, в которой одна или более групп -CH2- могут быть заменены атомом серы, атомом кислорода, группой -NR- (где R обозначает линейную или разветвленную (C1-C6)алкильную группу), группой -CO-, группой -CO-NH-, группой -CO2-, группой -SO- или группой -SO2-,
n принимает значения 0 или 1 и
Hal обозначает атом галогена,
или формулы (Ib)

где R4 обозначает линейную или разветвленную (C1-C6)алкильную группу,
Hal обозначает атом галогена и
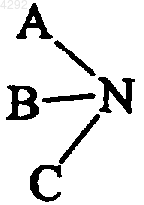
обозначает молекулу соединения, где атом азота может быть включен в насыщенную или ненасыщенную азотсодержащую гетероциклическую систему или включен в двойную связь, которое можно использовать для лечения или диагностики патологий, возникающих в результате поражения хрящей.
2. Соединение по п.1, отличающееся тем, что M представляет собой остаток молекулы соединения MP, где P означает атом водорода или гидроксильную группу, причем соединение MP или 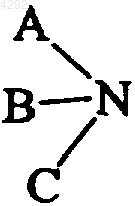 , которое может быть использовано для лечения патологий, обусловленных поражением хряща, является противовоспалительным, аналгезирующим, противоостеоартритным, противоартритным или специфическим противоопухолевым агентом.
, которое может быть использовано для лечения патологий, обусловленных поражением хряща, является противовоспалительным, аналгезирующим, противоостеоартритным, противоартритным или специфическим противоопухолевым агентом.
3. Соединение по п.1, которое описывается формулой (Ia1)
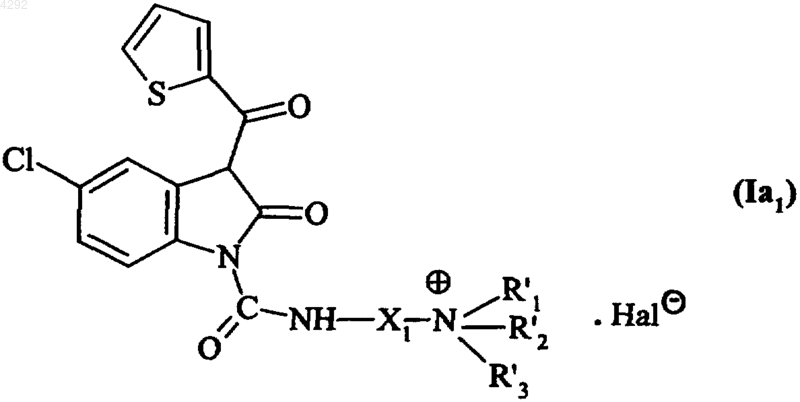
где X1 обозначает линейную или разветвленную (C1-C6)алкиленовую группу,
R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (C1-C6)алкильную группу и
Hal обозначает атом галогена.
4. Соединение по п.1, которое описывается формулой (Ia2)
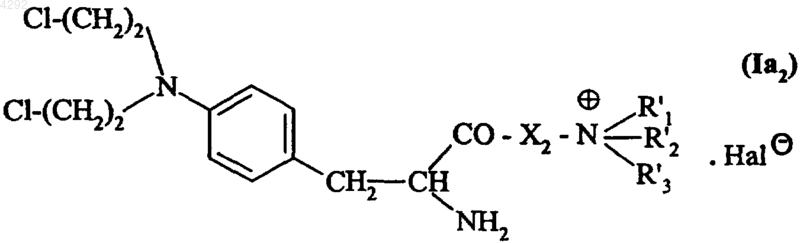
в которой X2 обозначает группу -NH-(CH2)m-, где m обозначает целое число от 1 до 5 включительно,
R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (C1-C6)алкильную группу и
Hal обозначает атом галогена.
5. Соединение по п.1, которое описывается формулой (Ia3)
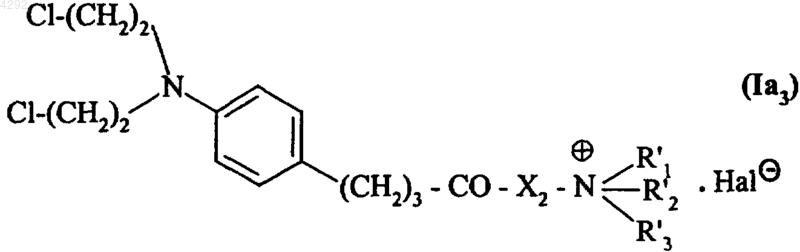
в которой X2 обозначает группу -NH-(CH2)m, где m представляет собой целое число от 1 до 5 включительно,
R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (C1-C6)алкильную группу и
Hal обозначает атом галогена.
6. Соединение по п.1, которое описывается формулой (Ia4)
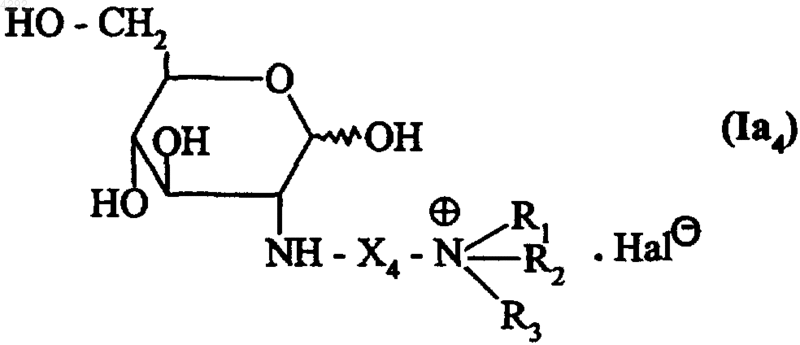
в которой X4 обозначает группу -CO-(CH2)m-, где m представляет собой целое число от 1 до 5 включительно,
R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (C1-C6)алкильную группу или
R1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо и
Hal обозначает атом галогена.
7. Соединение по п.1, которое описывается формулой (Ib1)
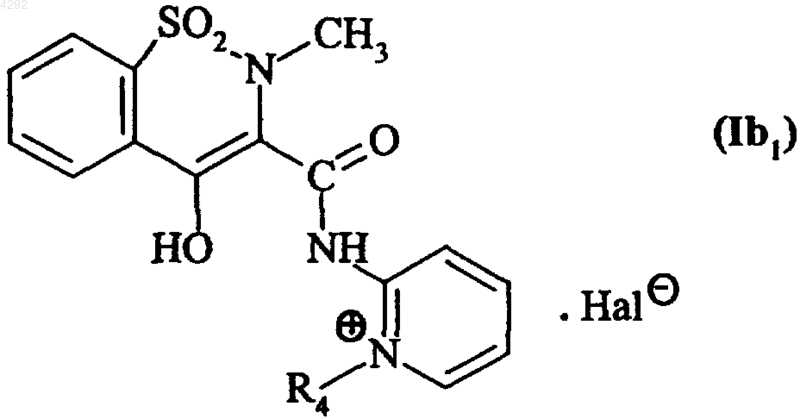
где R4 обозначает линейную или разветвленную (C1-C6)алкильную группу и
Hal обозначает атом галогена.
8. Соединение по п.1, которое описывается формулой (Ib2)
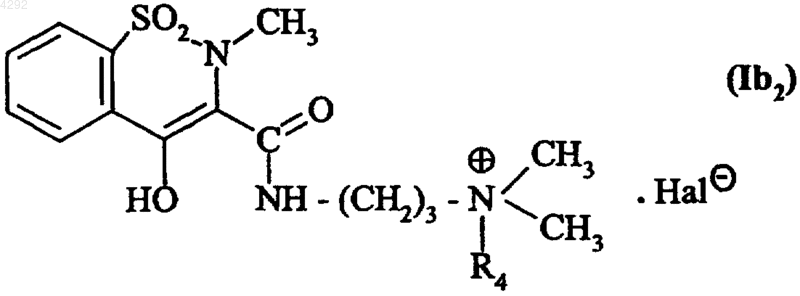
где R4 обозначает линейную или разветвленную (C1-C6)алкильную группу и
Hal обозначает атом галогена.
9. Соединение по п.1, которое описывается формулой (Ia5)
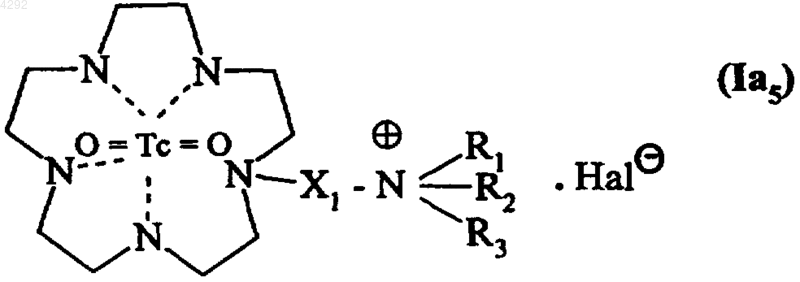
где X1 обозначает линейную или разветвленную (C1-C6)алкиленовую группу,
R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (C1-C6)алкильную группу или
R1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо и
Hal обозначает атом галогена.
10. Способ получения соединений формулы (Ia1) по п.3, отличающийся тем, что 4-нитрофенил-5-хлор-2,3-дигидро-2-оксо-1H-индол-1-карбоксилат подвергают взаимодействию с амином, который описывается формулой (II)
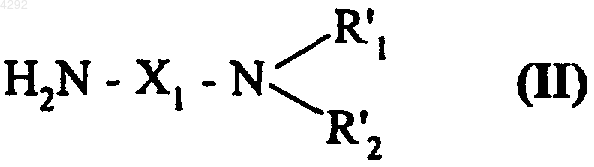
где X1, R'1 и R'2 соответствуют определениям, введенным в п.3, с получением соединения формулы (III)
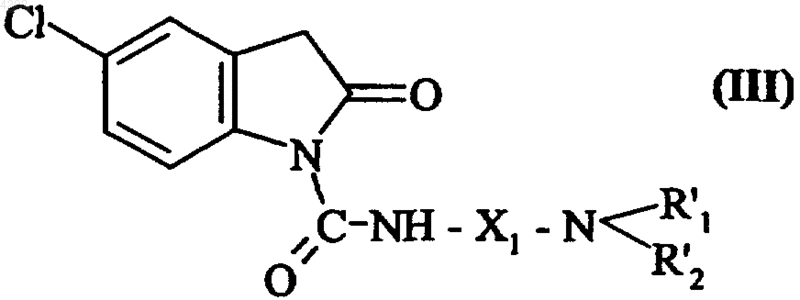
где X1, R'1 и R'2 соответствуют введенным выше определениям,
которое в инертной атмосфере подвергают воздействию 2-теноилхлорида в основной среде, а затем обрабатывают кислотой с получением соединения формулы (IV)
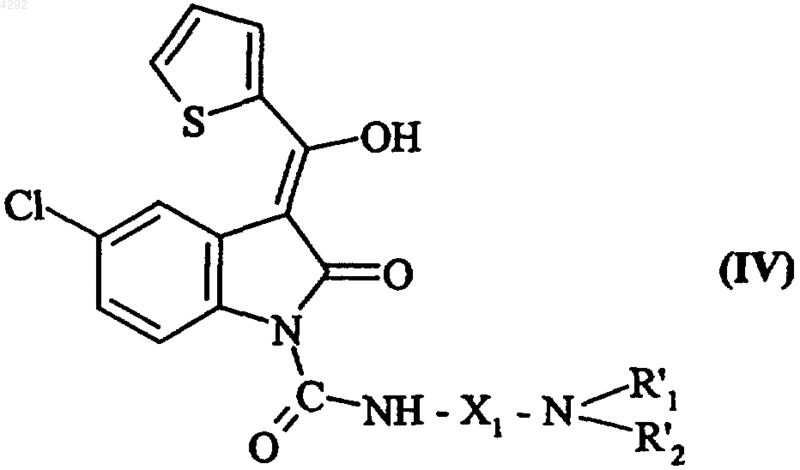
где X1, R'1 и R'2 соответствуют введенным выше определениям,
и полученное соединение преобразуют в соответствующую натриевую соль, которую далее подвергают воздействию линейного или разветвленного (C1-C6)алкилгалогенида формулы R'3Hal (где R'3 соответствует введенному выше определению и Hal обозначает атом галогена) с получением соединения формулы (V)
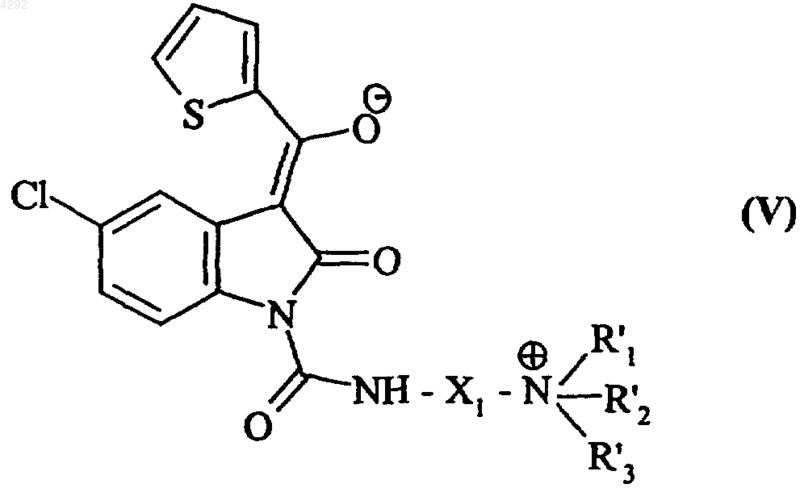
где X1, R'1, R'2 и R'3 соответствуют введенным выше определениям,
которое в хлористо-водородной среде преобразуют в соединение с формулой (Ia1) и, при необходимости, производят его очистку.
11. Способ получения соединений формулы (Ia2) по п.4, отличающийся тем, что мелфалан, аминную функцию которого предварительно защищают трет-бутоксикарбонильной группой (Boc), подвергают взаимодействию с амином формулы (VI) в присутствии реагента, связывающего пептиды

где R'1, R'2 и m соответствуют определениям, введенным в п.4, с получением соединения формулы (VII)
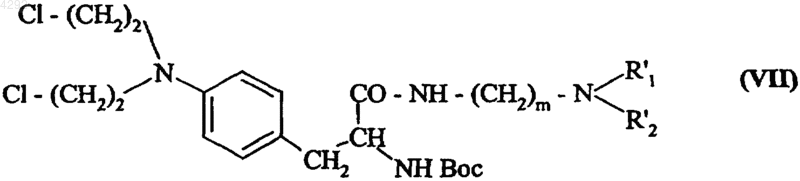
где m, R'1 и R'2 соответствуют введенным выше определениям,
которое подвергают воздействию линейного или разветвленного (C1-C6)алкилгалогенида с формулой R'3Hal (где R'3 определено выше, a Hal обозначает атом галогена), затем обрабатывают HCl с получением соединения формулы (Ia2), которое, яЁш необходимости, можно подвергнуть очистке.
12. Способ получения соединений формулы (Ia3) по п.5, отличающийся тем, что хлорамбуцил, кислотную функцию которого преобразуют в соответствующий хлорангидрид, подвергают взаимодействию с амином, который описывается формулой (VI), в присутствии или в отсутствие реагента, связывающего пептиды,
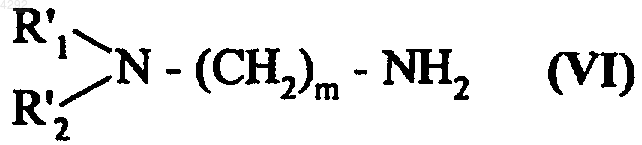
где R'1, R'2 и m соответствуют введенным в п.5 определениям, с получением соединения формулы (VIII)
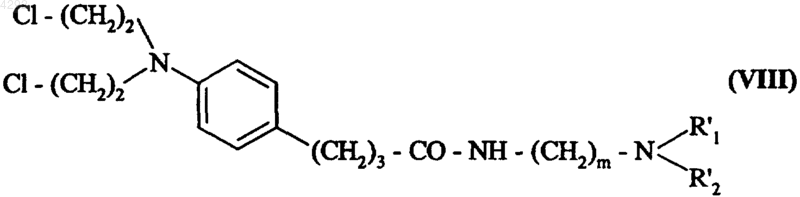
где R'1, R'2 и m соответствуют введенным выше определениям,
которое подвергают воздействию линейного или разветвленного (C1-C6)алкилгалогенида формулы R'3Hal (где R'3 соответствует введенному выше определению, a Hal обозначает атом галогена) с получением соединения с формулой (Ia2), которое, в случае необходимости, можно очистить.
13. Способ получения соединений формулы (Ia4) по п.6, отличающийся тем, что проводят реакцию глюкозамина с хлорангидридом, который описывается формулой (IX)
Cl-(CH2)m-CO-Cl (IX),
где m принимает значения, указанные в п.6, с получением соединения формулы (X)
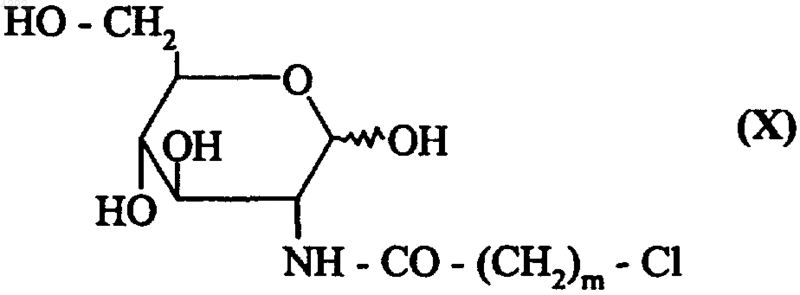
где m соответствует приведенному выше определению, которое конденсируют с амином, соответствующим формуле (XI)
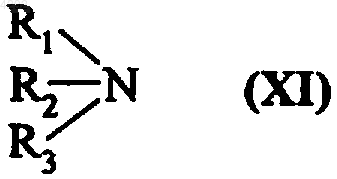
где R1, R2 и R3 соответствуют введенным в п.6 определениям,
с получением соединения формулы (Ia4), которое, при необходимости, очищают и которое может быть разделено на его изомеры с использованием стандартных методик.
14. Способ получения соединений формулы (Ia5) по п.9, отличающийся тем, что соединение формулы (XII)
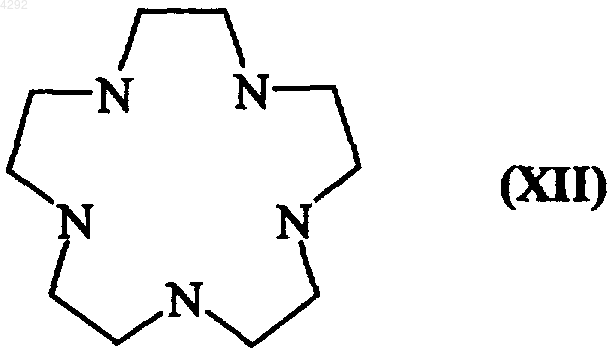
подвергают взаимодействию с галогенидом галоалкиламмония, который описывается формулой (XIII)
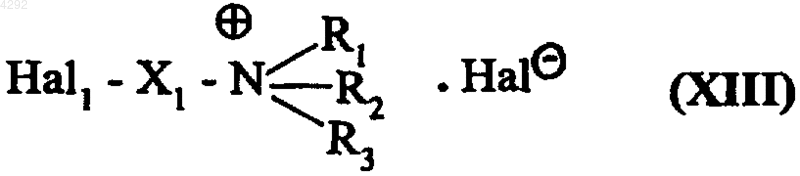
где X1, R1, R2 и R3 соответствуют приведенным в п.9 определениям, a Hal и Hal1, которые могут быть одинаковыми или различными, обозначают атомы галогена, с получением соединения формулы (XIV)
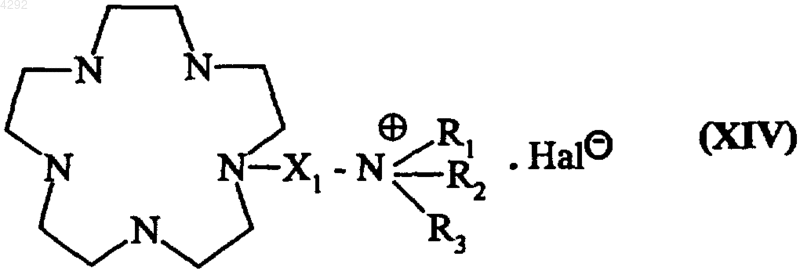
где X1, R1, R2, R3 и Hal соответствуют приведенным выше определениям,
и затем проводят взаимодействие полученного соединения формулы (XIV) с пертехнеатом натрия в присутствии хлорида олова с получением соединения формулы (Ia5), которое, при необходимости, подвергают очистке.
15. Способ получения соединений формулы (Ib1) по п.7, отличающийся тем, что пироксикам подвергают взаимодействию с линейным или разветвленным (C1-C6)алкилгалогенидом и полученный продукт, при необходимости, подвергают очистке.
16. Способ получения соединений формулы (Ib2) по п.8, отличающийся тем, что соответствующий амин подвергают взаимодействию с линейным или разветвленным (C1-C6)алкилгалогенидом и, при необходимости, производят последующую очистку.
17. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-9, как индивидуально, так и в комбинации с одним или более фармацевтически приемлемыми инертными, нетоксичными эксципиентами или носителями.
18. Фармацевтическая композиция по п.17, включающая соединение по любому из пп.1-9, для применения при лечении патологий, обусловленных поражениями хряща.
19. Фармацевтическая композиция по п.17, включающая соединение по любому из пп.1 или 9, для применения в качестве диагностического реагента, способного обнаруживать патологию хряща или нарушения обмена веществ.
Текст
1 Настоящее изобретение относится к новым четвертичным соединениям аммония, к способу их получения и к содержащим эти соединения фармацевтическим композициям. Новые четвертичные соединения аммония позволяют производить векторизацию активных ингредиентов в хрящевые ткани и, следовательно, лечить патологии, возникающие в результате поражения хрящей вследствие суставных или раковых заболеваний. Эти соединения можно применять также в качестве диагностических реагентов, при помощи которых можно, например, обнаруживать патологии хрящей или нарушения обмена веществ (радиоактивные метки, окрашенные маркеры, ). Терапевтические агенты, которые в настоящее время имеются в продаже и предназначены для лечения суставных заболеваний, таких как артрит или остеоартрит, в общем случае проявляют низкое сродство к тканям-мишеням,и для достижения желаемого терапевтического эффекта их требуется назначать в высоких дозах. Назначение препаратов с такой большой дозировкой активных ингредиентов приводит к учащению случаев проявления побочных эффектов. Например, известно, что назначение нестероидных противовоспалительных препаратов сопряжено со значительным дигестионным токсикозом. В области раковых заболеваний костей также известно, что терапевтические агенты,которые в настоящее время применяются для лечения, например хондросаркомы, вызывают нежелательные побочные эффекты, особенно токсикозы, в частности гематологические и негематологические токсикозы. Наконец, в сфере диагностики патологии хрящей, применяемые в настоящее время реактивы недостаточно специфичны по отношению к мишеням, для которых они используются, что является существенным недостатком. Следовательно, представляет значительный интерес функционализирование этих различных видов соединений с целью придания им специфичности по отношению к хрящевым тканям, что позволит ограничить или даже исключить нежелательные эффекты, которые наблюдаются при непосредственном назначении подобных соединений. Новые соединения, которые составляют предмет настоящего изобретения, позволяют,как в результате увеличения тропизма, так и за счет снижения назначаемых доз, значительно уменьшить проявление побочных эффектов при одновременном повышении степени терапевтического воздействия активных молекул. Более конкретно, настоящее изобретение относится к соединениям формулы (Iа) где М представляет собой остаток молекулы соединения, которое можно применять для лечения или диагностики патологий, возникающих в результате поражения хряща,R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу,или R1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо,Х обозначает линейную или разветвленную (С 1-С 6)алкиленовую группу, в которой одна или более групп -СН 2- могут быть заменены атомом серы, атомом кислорода, группой -NR(где R обозначает линейную или или разветвленную (С 1-С 6)алкильную группу), группой где R4 обозначает линейную или разветвленную(С 1-С 6)алкильную группу,Hal обозначает атом галогена и обозначает молекулу соединения, которое может быть использовано для лечения или диагностики патологий, возникающих в результате поражения хрящей, где атом азота может быть включен в насыщенную или ненасыщенную азотсодержащую гетероциклическую систему,или включен в двойную связь. Предпочтительно соединения с формулой(Ia) - это такие соединения,где n равно 1,X обозначает линейную или разветвленную (С 1-С 6)алкиленовую группу, группу -NR(CH2)m- (где R соответствует приведенному выше определению), группу -СО-(СН 2)m- или группу -CO-NH-(CH2)m, в которых m обозначает целое число от 1 до 5 включительно.R1, R2 и R3 в соединениях с формулой (Iа) представляют собой предпочтительно одинаковые или различные, линейные или разветвленные (С 1-С 6)алкильные группы или вместе с несущим их атомом азота образуют пиридиновое кольцо (в каждом случае одна из этих групп представляет собой линейную или разветвленную (С 1-С 6)алкильную группу). Обычно М представляет собой остаток молекулы соединения МР, где Р означает атом водорода или гидроксильную группу, причем соединения, которые могут применяться для лечения или диагностики патологий или для диагностики патологий, обусловленных поражением хрящей, представляют собой более конкретно противовоспалительные, противоартритные, противоостеоартритные, аналгезирующие или специфические противоопухолевые агенты. Из соединений с формулой (Iа) в качестве активных ингредиентов предпочтительно применять следующие:x соединения, выделенные из тенидапа с формулой (Ia1) где X1 обозначает линейную или разветвленную(С 1-С 6)алкиленовую группу,R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу иHal обозначает атом галогена,x соединения, выделенные из мелфалана с формулой (Ia2) в которой Х 2 обозначает группу -NH-(CH2)m-,где m принимает указанные выше значения,R'1, R'2 и R'3 соответствуют приведенным выше определениям, аHal обозначает атом галогена,x соединения, выделенные из хлорамбуцила с формулой (Iа 3) в которой X2, R'1, R'2 и R'3 соответствуют приведенным выше определениям иHal обозначает атом галогена,x соединения, выделенные из глюкозамина с формулой (Ia4) в которой Х 4 обозначает группу -СО-(СН 2)m-,где m принимает указанные выше значения,R1, R2 и R3 соответствуют приведенным выше определениям, аHal обозначает атом галогена. Из соединений с формулой (Ib) в качестве активных ингредиентов предпочтительно применять следующие:x соединения, выделенные из пироксикама с формулой (Ib1) где R4 и Hal соответствуют приведенным выше определениям,x соединения с формулой (Ib2) где R4 и Hal соответствуют приведенным выше определениям. Из соединений с формулой (Iа) в качестве диагностических реагентов предпочтительно применять соединения с формулой (Ia5) в которой X1, R1, R2, R3 и Hal соответствуют приведенным выше определениям. Изобретение относится также к способу получения соединений с формулами (Iа) или(Ib). Соединения с формулой (Iа) получают на основе традиционных методик органической химии путем функционализации, которую производят в один или несколько этапов в зависимости от природы требуемой группы X, соединения с формулой М-Р (где М соответствует определению, приведенному в описании формулы (Ia), a P обозначает атом водорода или гидроксильную группу) или предшественника соединения с формулой М-Р с последующим проведением реакций, необходимых для образования конечного соединения с формулой (Iа). Соединения с формулой (Ib) получают взаимодействием алкилгалогенида с соединением формулы, как определено выше. Соединения, выделенные из описанного выше тенидапа с формулой (Ia1), получают путем реакции 4-нитрофенил 5-хлор-2,3 дигидро-2-оксо-17H-индол-1-карбоксилата с амином формулы (II) 5 в которой X1, R'1 и R'2 соответствуют приведенным выше определениям; продуктом этой реакции является соединение с формулой (III) где X1, R'1 и R'2 соответствуют приведенным выше определениям,которое подвергают воздействию 2-теноилхлорида в основной среде и инертной атмосфера, а затем обрабатывают кислотой, чтобы получить соединение с формулой (IV) которое преобразуют в соответствующую натриевую соль. Эту соль далее подвергают воздействию линейного или разветвленного (С 1-С 6)алкилгалогенида (R'3 Наl), чтобы получить соединение с формулой (V) которое в солянокислой среде превращается в соединение с формулой (Ia1); при необходимости далее производят очистку полученного продукта. Соединения, выделенные из определенного выше мелфалана с формулой (Ia2), получают путем взаимодействия мелфалана, аминную функцию которого предварительно защищают трет-бутоксикарбонильной группой (Воc), с амином формулы (VI) в присутствии связывающего пептиды реагента где R'1, R'2 и m соответствуют приведенным выше определениям,чтобы получить соединение с формулой (VII) где R'1, R'2 и m соответствуют приведенным выше определениям,которое подвергают воздействию линейного или разветвленного (С 1-С 6)алкилгалогенида, а затем обработке НСl, чтобы получить соедине 004292 6 ние с формулой (Ia2), которое при необходимости подвергают очистке. Соединения, выделенные из определенного выше хлорамбуцила с формулой (Iа 3), получают взаимодействием хлорамбуцила, кислотная функция которого преобразована в соответствующий кислый хлорид, с амином, который описывается формулой (VI), необязательно в присутствии связывающего пептиды реагента,где R'1, R'2 и m соответствуют приведенным выше определениям,чтобы получить соединение с формулой (VIII) где R'1, R'2 и m соответствуют приведенным выше определениям,которое подвергают воздействию линейного или разветвленного (С 1-С 6)алкилгалогенида,чтобы получить соединение с формулой (Ia2),которое, при необходимости можно очистить. Соединения, выделенные из определенного выше глюкозамина с формулой (Ia4), получают реакцией глюкозамина с хлорангидридом,который описывается формулой (IX) Сl-(СН 2)m-СО-Сl(IX) В этой реакции получают соединение с формулой (X) где m соответствует приведенным выше определениям, которое конденсируют с амином с формулой (XI) где R1, R2 и R3 соответствуют приведенным выше определениям,и получают соединение с формулой (Ia4),которое при необходимости очищают и которое может быть разделено на его изомеры по обычным методикам. Определенные выше соединения формулы(Ia5) получают взаимодействием соединения формулы (ХII) где X1, R1, R2 и R3 соответствуют приведенным выше определениям, a Hal и Hal1, которые могут 7 быть одинаковыми или различными, обозначают атомы галогена; в этой реакции получают соединение с формулой (XIV) где X1, R1, R2, R3 и Hal соответствуют приведенным выше определениям; далее проводят реакцию этого соединения с пертехнеатом натрия в присутствии хлорида олова, чтобы получить соединение с формулой(Ia5), и, при необходимости, производят его очистку. Соединения, выделенные из определенного выше пироксикама формулы (Ib1) получают взаимодействием пироксикама с линейным или разветвленным (С 1-С 6)алкилгалогенидом и, при необходимости, производят очистку полученного соединения. Определенные выше соединения формулы(Ib2) получают, начиная от соответствующего амина, осуществляя его реакцию с линейным или разветвленным (С 1-С 6)алкилгалогенидом, и,при необходимости, производят очистку полученного соединения. В биологических исследованиях обнаружено, что соединения по данному изобретению проявляют повышенный тропизм по отношению к хрящевым тканям. Фармацевтические свойства этих молекул, функционализированных функцией четвертичных соединений аммония,резко отличаются от характеристик нефункционализированных молекул. Например, наблюдается более высокая их концентрация в хрящах уже к первому часу после приема препарата. Изобретение распространяется также на фармацевтические композиции, которые в качестве активного ингредиента содержат по крайней мере одно соединение с формулой (I) с одним или более подходящим инертным нетоксичным эксципиентом. Среди фармацевтических композиций по данному изобретению следует особо отметить те, которые пригодны для орального, парэнтерального (внутривенного либо подкожного) или ингаляционного назначения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, дермальные гели, инъекционные препараты, питьевые суспензии и т.д. Полезную дозировку можно подобрать в соответствии с природой расстройства и степенью его тяжести, в зависимости от назначенного курса, возраста и веса пациента, а также в соответствии со свойствами применяемого соединения. Следующие ниже примеры иллюстрируют данное изобретение, но никоим образом не ограничивают его. 8 Исходные материалы представляют собой известные вещества, либо реагенты, которые можно приготовить по известным методикам. Структуры описанных в примерах соединений были определены в рамках традиционных спектроскопических методов (инфракрасная спектроскопия, ЯМР, масс-спектрометрия). Пример 1. 3-([(Z)-5-Хлор-2,3-дигидро-3(гидрокси-2-тиенилметилен)-2-оксо-1 Н-индол 1-нл]карбониламино)пропилтриметиламмония хлорид. Этап А. [N-(Диметиламино)пропил]-5 хлор-2,3-дигидро-2-оксо-1H-индол-1-карбоксамид. При температуре окружающей среды 12,08 ммолей 3-(диметиламино)пропиламина добавляют к раствору 12,08 ммолей 4-нитрофенил 5 хлор-2,3-дигидро-2-оксо-1 Н-индол-1-карбоксилата в 70 мл дихлорметана. Реакция происходит немедленно. После экстрагирования полученного раствора при помощи 0,05N раствора гидроокиси натрия, которое производят до полного исчезновения водной фазы, желтую органическую фазу просушивают, фильтруют и выпаривают при пониженном давлении. Целевое соединение выделяют в виде твердой фазы коричневого цвета. Температура плавления: 84-85 С. Этап В. [(Z)-N-(Диметилaмино)пропил]-5 хлор-2,3-дигидро-3-(гидрокси-2-тиенилметилен)-2-оксо-1 Н-индол-1-карбоксамидгидрохлорид. В атмосфере аргона при 0 С 2,10 мл триэтиламина и 7,44 ммолей 2-теноилхлорида добавляют к 7,44 ммолей раствора полученного на предыдущем этапе соединения и 186 мг 4-N,Nдиметиламинопиридина в 5 мл диметилформамида. При температуре окружающей среды реакционную смесь перемешивают в течение 3 ч. Далее добавляют 4 мл метанола, затем 4 мл 37% соляной кислоты и перемешивают при температуре окружающей среды в течение еще 1 ч, затем фильтруют. Полученную желтую твердую фазу промывают ледяной водой и высушивают,в результате получается целевой продукт. Температура плавления: 197-198 С (разложение). Этап С. [(Z)-N-(Диметиламино)пропил]-5 хлор-2,3-дигидро-3-(гидрокси-2-тиенилметилен)-2-оксо-1H-индол-1-карбоксамида натриевая соль. Суспензию, которая содержит 2,49 ммолей полученного на предыдущем этапе продукта и 1,25 ммолей Na2CO3 в 70 мл метанола, перемешивают при температуре окружающей среды в течение 5 ч. Затем реакционную смесь концентрируют при пониженном давлении и фильтруют. Осадок промывают ледяной водой и высушивают. При температуре окружающей среды полученный продукт обрабатывают в течение еще 30 мин при помощи Na2CO3 в метаноловой среде. После выпаривания, промывки осадка 9 метанолом и высушивания получают целевой продукт. Точка плавления: 211-212 С (разложение). Этап D. (Z)-(5-Хлор-1,2-дигидро-2-оксо-1[3-(триметиламмонио)пропил]аминокарбонил-3H-индол-3-илиден)-2-тиенилметанолат. В атмосфере аргона к раствору 2,22 ммолей соединения, полученного на предыдущем этапе, в 30 мл метанола добавили 3,33 ммоля метилйодида. Смесь выдерживали в течение 3 ч при температуре окружающей среды. Целевой продукт в ходе реакции выделился в виде твердой фазы желтого цвета; этот осадок отфильтровали,промыли метанолом и эфиром, затем высушили. Точка плавления: 260-261 С (разложение). Этап Е. 3-[(Z)-5-Хлор-2,3-дигидро-3(гидрокси-2-тиенилметилен)-2-оксо-1H-индол 1-ил]карбониламинопропилтриметиламмония хлорид. К раствору 0,95 ммолей продукта, полученного на предыдущем этапе, в 7 мл диметилформамида добавили 2,5 мл 2N эфирного хлористого водорода. Реакционную смесь перемешивали в течение 10 мин при температуре окружающей среды. Далее полученный раствор влили в 100 мл эфира. Образовавшийся желтый осадок сразу отфильтровали, тщательно промыли эфиром и высушили. Точка плавления: 209-211 С. Пример 2. 3-(4-[бис(2-Хлорэтил)амино]L-фенилаланиламино)пропилтриметиламмония гидрохлорид. Этап А. 1-N-трет-бутоксикарбонил-4[бис(2-хлорэтил)амино]-L-фенилаланиламино-3-(диметиламнно)пропан. К раствору 1,32 ммоля гидрохлорида мелфалана в 7 мл метанола при температуре окружающей среды последовательно добавили 2,7 ммолей триэтиламина и 1,98 ммолей ди-третбутилдикарбоната. Затем смесь нагревали до 3040 С. Сразу после растворения раствор перемешивали в течение 30 мин при температуре окружающей среды, затем произвели выпаривание при пониженном давлении. Полученный осадок обрабатывали ледяным разбавленным раствором соляной кислоты (0,01 N), пока рН не достигло 2. Сразу после этого произвели экстрагирование раствора этилацетатом. Органическую фазу последовательно просушили, профильтровали и сконцентрировали при пониженном давлении. Далее полученный промежуточный продукт поместили в 10 мл дихлорметана. К образовавшемуся раствору последовательно добавили 1,33 ммоля 1-гидроксибензотриазола и 1,33 ммоля 3-(диметиламино)пропиламина. Затем в полученную смесь ввели раствор 1,33 ммоля дициклогексилкарбодиимида в 10 мл дихлорметана. Реакционную смесь перемешивали при температуре окружающей среды в течение 5 ч. Образовавшуюся мочевину выделили фильтрацией. Далее фильтрат экстрагировали 1N раствором NаНСО 3 и промыли водой. Органиче 004292 10 скую фазу высушили, профильтровали и выпарили при пониженном давлении. Затем осуществили очистку полученного остатка хроматографией на силикагеле (элюант: дихлорметан/ этанол, 1/1, затем дихлорметан/этанол/аммиак,50/49/1). Целевое соединение выделили в виде кристаллизующегося масла. Точка плавления: 80-82 С (разложение). Этап В. 3-N-трет-Бутоксикарбонил-4[бис(2-хлорэтил)амино]-L-фенилаланиламино пропилтриметиламмония йодид. В инертной атмосфере к раствору 0,61 ммоля соединения, полученного на этапе А, в 5 мл этанола добавили 0,92 ммоля метилйодида. Реакционную смесь выдерживали при температуре окружающей среды в течение трех часов,затем концентрировали при пониженном давлении. Полученный осадок поместили в минимальное количество метанола и далее влили в эфирный раствор. Целевой продукт в виде высокогигроскопичной твердой фазы выделили посредством фильтрации, промывки эфиром и высушивания. Точка плавления: 139-142 С. Этап С. 3-4-[бис(2-Хлорэтил)амино]-Lфенилаланиламинопропилтриметиламмония гидрохлорид. 0,148 ммолей продукта, полученного на этапе В, обрабатывали в течение 2 ч при температуре окружающей среды в 10 мл 2N хлористого этанола. Затем произвели выпаривание раствора при пониженном давлении. Полученный осадок растворили в 50 мл метанола и оставили на несколько минут для полимеризации. Далее метаноловую фракцию выпаривали при пониженном давлении. Полученный осадок поместили в минимальное количество метанола и влили в эфирный раствор. Целевой продукт в форме высокогигроскопичной светло-бежевой твердой фазы выделили путем фильтрации,промывки эфиром и высушивания. Точка плавления: 115-120 С. Угол поворота: []D25=+49,2 (с=1,04%, 1NHCl) Пример 3. 3-4-[4-[бис(2-Хлорэтил)амино] фенил]бутаноиламинопропилтриметиламмония йодид. Этап А. N-[3-(Диметиламино)пропил]-44-[бис(2-хлорэтил)амино]фенилбутирамид. В инертной атмосфере, при 0 С, 1,25 мл тионилхлорида добавили к раствору 1,61 ммоля хлорамбуцила в 5 мл дихлорметана. Реакционную смесь перемешивали при 4 С в течение 16 ч, затем избыток SOCl2 выпарили при пониженном давлении. Полученный осадок поместили в 10 мл дихлорметана. При 0 С, в инертной атмосфере, к полученному раствору добавили 1,61 ммоля 3-(диметиламино)пропиламина, растворенного в 10 мл дихлорметана. Далее эту смесь перемешивали при температуре окружающей среды в течение 1 ч. К концу этого периода ввели вторую добавку - 1,61 ммоля диамина. После 11 четырехчасового перемешивания произвели выпаривание реакционной смеси при пониженном давлении. После нейтрализации 1N раствором NaHCO3 водную фазу несколько раз экстрагировали дихлорметаном. Различные органические фазы объединили и промывали водой до нейтрализации, затем просушили, профильтровали и выпарили при пониженном давлении. Полученный осадок очистили хроматографией на силикагеле (элюант: градиент этанола в дихлорметане начиная от 0 и с возратанием до 50%, а затем, в конце, использовали элюант:(дихлорметан/этанол/аммиак 50/49/1). Целевой продукт получили в виде масла. Этап В. 3-4-[бис(2-Хлорэтил)амино]фенилбутаноиламинопропилтриметиламмония йодид. В инертной атмосфере 1,01 ммоля метилйодида добавили к раствору 1,34 ммоля соединения, полученного на предыдущем этапе, в 7 мл этанола. Смесь перемешивали при температуре окружающей среды в течение 3 ч, затем выпаривали при пониженном давлении. Полученное масло поместили в минимальное количество метанола. Далее образовавшийся раствор влили в 150 мл эфира и перемешивали при 0 С в течение 1 ч. Затем отфильтровали выпавший осадок. После промывки эфиром и высушивания был получен целевой продукт в виде высокогигроскопичной твердой фазы бежевого цвета. Точка плавления: 118-120 С (разложение). Этап 4. 2-(N,N,N-Триметиламмониоацетамидо)-2-деокси-,-D-глюкопиранозы хлорид. Этап А. 2-Хлорацетамидо-2-деокси-,-Dглюкопираноза. 46,4 ммоля хлорэтаноилхлорида капельно добавили к охлажденному до 0 С раствору 23,2 ммоля глюкозамингидрохлорида и 40 ммолейK2 СО 3 в 40 мл дистиллированной воды. Смесь перемешивали в течение 1 ч. После выпаривания водного раствора при пониженном давлении полученную твердую фазу несколько раз промыли этанолом. Затем этаноловую фазу концентрировали при пониженном давлении до выпадения твердого осадка белого цвета. После охлаждения до 0 С раствор фильтровали. Образовавшуюся белую твердую фазу растирали в порошок с ацетоном, сушили, и получили целевой продукт после рекристаллизации из этанола. Точка плавления: 183-185 С. Этап В. 2-(N,N,N-Триметиламмониоацетамидо)-2-деокси-,-D-глюкопиранозы хлорид. 9,8 ммолей полученного на предыдущем этапе соединения и 10 мл 4 М раствора триэтиламина в этаноле поместили в инертную атмосферу и выдерживали в течение 3 дней при 40 С. Выпавший осадок отфильтровали, промыли этанолом, затем эфиром и после просушки получили целевой продукт. Точка плавления: 240-242 С. 12 Пример 5. 2-(Пиридиниоацетамидо)-2-деокси-,-D-глюкопиранозы хлорид. 9,8 ммолей соединения, полученного на этапе А примера 4 в 50 мл пиридина, поместили в инертную атмосферу и выдерживали в течение 3 дней при температуре 40 С. Далее произвели выпаривание пиридина в вакууме и получили целевой продукт после промывки этанолом и эфиром с последующей просушкой. Точка плавления: 223-225 С. Пример 6. 3-[(4-Гидрокси-2-метил-1,1-диоксид-2 Н-1,2-бензотиазин-3-ил)карбоксамидо] пропилтриметиламмония йодид. 3,39 моля N-[3-(Диметиламино)пропил]-4 гидрокси-2-метил-1,1-диоксо-2 Н-1,2-бензотиазил-3-ил]карбоксамида выдерживали в течение 24 ч при 80 С в атмосфере аргона в присутствии 3 мл йодометана. После охлаждения образовавшийся осадок отфильтровали, промыли ацетоном и высушили; в результате, был получен целевой продукт. Точка плавления: 220-222 С (разложение). Пример 7. 2-[(4-Гидрокси-2-метил-1,1-диоксо-2 Н-1,2-бензотиазин-3-ил)карбоксамидо]N-метилпиридиния йодид. Целевой продукт получали взаимодействием пироксикама с йодметаном по методике,описанной в примере 6. Пример 8. Гидрохлорид [15]ан-N5-(N-3 пропил)триэтиламмонийбромида, меченый технецием. Этап А. Гидрохлорид [15]ан-N5-(N-3-пропил)триэтиламмонийбромида. 10 ммолей (3-бромпропил)триэтиламмонийбромида добавили к 10 ммолям [15an]-N5,растворенным в 50 мл деионизированной воды. В инертной атмосфере систему выдерживали при 90 С в течение 12 ч, и вода испарялась. Маслянистый остаток дважды промывали дихлорметаном, затем растворяли в 100 мл этанола. Произвели обработку 10N раствором НСl, 4 мл которой вводили капельно, в процессе охлаждения круглодонной колбы до 0 С, выпали в осадок белые хлопья; осадок отфильтровали,промыли сначала спиртом, затем эфиром, высушили и получили целевой продукт. Точка плавления: 200 С (разложение). 13 Этап В. Гидрохлорид [15]ан-N5-(N-3-пропил)триэтиламмонийбромида, меченый технецием. Маркировку технецием соединения, полученного на этапе А, производили в вакууме в стерильной колбе емкостью 15 мл, в которую вводили следующие ингредиенты: раствор 7,5 ммолей полученного на этапе А продукта в 1 мл физиологической сыворотки,натрия пертехнетат (99mТсО 4-, 25 mCi; 925MBq), растворенный в 1 мл физиологической сыворотки; колбу выдерживали при 85 С в течение 5 мин (металлический банник),обескислороженный водный растворSnCl2.2H2O (9 ммолей), приготовленный для немедленного использования. Маркирование производили посредством выдерживания системы при 85 С в течение 30 мин. Фармакологическое исследование соединений по изобретению Фармакокинетическое исследование: изучение распределения в тканях. Это исследование проводили с молекулами, мечеными 14 С. Изучение распределения в тканях производили посредством прямого измерения радиоактивности по сечению всего тела в соответствии со следующей методикой: самцам крыс Sprague-Dawley вводили дозу меченых молекул внутривенно или орально. Через различные периоды времени после приема препарата, в интервале от 5 мин до 24 ч, животных убивали либо ингаляционным способом, либо замораживанием в жидком азоте. Приготавливали срезы при помощи криомикротома и, после десикации, измеряли распределение радиоактивности с использованием анализатора изображений. Результаты, полученные для соединений по изобретению, свидетельствуют, что эти соединения проявляют повышенный тропизм по отношению к хрящевым тканям. В случае соединений, описанных в примерах 4 и 5, не считая почек, выделенные части тела, в которых обнаруживается значительная радиоактивность в первые минуты после инъекции - хрящи, в меньшей степени - кожа, которые оказываются единственными мишенями. При проведении аналогичного исследования с нефункционализированным глюкозамином, главной мишенью оказалась печень. По отношению к соединению из примера 6 хрящ проявляет значительно большее сродство,чем окружающие ткани. Максимум связывания достигается через 5 мин после инъекции. Аналогично, очень высокое сродство к хрящу наблюдается в исследованиях, произведенных после орального приема дозы меченых молекул. В случае соединения из примера 8, повышение его концентрации в хрящевых тканях наблюдается через 10 мин после инъекции. где М представляет собой остаток молекулы соединения, которое можно применять для лечения или диагностики патологий, возникающих в результате поражения хряща,R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу илиR1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо,Х обозначает линейную или разветвленную(С 1-С 6)алкиленовую группу, в которой одна или более групп -СН 2- могут быть заменены атомом серы, атомом кислорода, группой -NR- (где R обозначает линейную или разветвленную (С 1 С 6)алкильную группу), группой -СО-, группой где R4 обозначает линейную или разветвленную(С 1-С 6)алкильную группу,Hal обозначает атом галогена и обозначает молекулу соединения, где атом азота может быть включен в насыщенную или ненасыщенную азотсодержащую гетероциклическую систему или включен в двойную связь,которое можно использовать для лечения или диагностики патологий, возникающих в результате поражения хрящей. 2. Соединение по п.1, отличающееся тем,что М представляет собой остаток молекулы соединения МР, где Р означает атом водорода или гидроксильную группу, причем соединение МР или, которое может быть использовано для лечения патологий, обусловленных поражением хряща, является противовоспалительным,аналгезирующим, противоостеоартритным, противоартритным или специфическим противоопухолевым агентом. 3. Соединение по п.1, которое описывается формулой (Ia1) 15 где X1 обозначает линейную или разветвленную(С 1-С 6)алкиленовую группу,R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу иHal обозначает атом галогена. 4. Соединение по п.1, которое описывается формулой (Iа 2) в которой Х 2 обозначает группу -NH-(CH2)m-,где m обозначает целое число от 1 до 5 включительно,R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу иHal обозначает атом галогена. 5. Соединение по п.1, которое описывается формулой (Iа 3)m представляет собой целое число от 1 до 5 включительно,R'1, R'2 и R'3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу иHal обозначает атом галогена. 6. Соединение по п.1, которое описывается формулой (Ia4) 16 где R4 обозначает линейную или разветвленнуюHal обозначает атом галогена. 8. Соединение по п.1, которое описывается формулой (Ib2) где R4 обозначает линейную или разветвленнуюHal обозначает атом галогена. 9. Соединение по п.1, которое описывается формулой (Ia5) где X1 обозначает линейную или разветвленную(С 1-С 6)алкиленовую группу,R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу илиR1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо иHal обозначает атом галогена. 10. Способ получения соединений формулы (Ia1) по п.3, отличающийся тем, что 4 нитрофенил-5-хлор-2,3-дигидро-2-оксо-1Hиндол-1-карбоксилат подвергают взаимодействию с амином, который описывается формулой где X1, R'1 и R'2 соответствуют определениям,введенным в п.3, с получением соединения формулы (III) в которой Х 4 обозначает группу -СО-(СН 2)m-,где m представляет собой целое число от 1 до 5 включительно,R1, R2 и R3, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную (С 1-С 6)алкильную группу илиR1, R2 и R3 вместе с несущим их атомом азота образуют пиридиновое кольцо иHal обозначает атом галогена. 7. Соединение по п.1, которое описывается формулой (Ib1) где X1, R'1 и R'2 соответствуют введенным выше определениям,которое в инертной атмосфере подвергают воздействию 2-теноилхлорида в основной среде, а затем обрабатывают кислотой с получением соединения формулы (IV) где X1, R'1 и R'2 соответствуют введенным выше определениям,и полученное соединение преобразуют в соответствующую натриевую соль, которую далее подвергают воздействию линейного или раз 17 ветвленного (С 1-С 6)алкилгалогенида формулыR'3Hal (где R'3 соответствует введенному выше определению и Hal обозначает атом галогена) с получением соединения формулы (V) где X1, R'1, R'2 и R'3 соответствуют введенным выше определениям,которое в хлористо-водородной среде преобразуют в соединение с формулой (Ia1) и, при необходимости, производят его очистку. 11. Способ получения соединений формулы (Iа 2) по п.4, отличающийся тем, что мелфалан, аминную функцию которого предварительно защищают трет-бутоксикарбонильной группой (Воc), подвергают взаимодействию с амином формулы (VI) в присутствии реагента, связывающего пептиды где R'1, R'2 и m соответствуют определениям,введенным в п.4, с получением соединения формулы (VII) где m, R'1 и R'2 соответствуют введенным выше определениям,которое подвергают воздействию линейного или разветвленного (С 1-С 6)алкилгалогенида с формулой R'3 Наl (где R'3 определено выше, a(Ia2), которое, при необходимости, можно подвергнуть очистке. 12. Способ получения соединений формулы (Iа 3) по п.5, отличающийся тем, что хлорамбуцил, кислотную функцию которого преобразуют в соответствующий хлорангидрид, подвергают взаимодействию с амином, который описывается формулой (VI), в присутствии или в отсутствие реагента, связывающего пептиды,где R'1, R'2 и m соответствуют введенным в п.5 определениям, с получением соединения формулы (VIII) где R'1, R'2 и m соответствуют введенным выше определениям,которое подвергают воздействию линейного или разветвленного (С 1-С 6)алкилгалогенида формулы R'3 Наl (где R'3 соответствует введен 004292(Ia2), которое, в случае необходимости, можно очистить. 13. Способ получения соединений формулы (Ia4) по п.6, отличающийся тем, что проводят реакцию глюкозамина с хлорангидридом, который описывается формулой (IX) Сl-(СН 2)m-СО-Сl(IX),где m принимает значения, указанные в п.6, с получением соединения формулы (X) где m соответствует приведенному выше определению, которое конденсируют с амином, соответствующим формуле (XI) где R1, R2 и R3 соответствуют введенным в п.6 определениям,с получением соединения формулы (Ia4), которое, при необходимости, очищают и которое может быть разделено на его изомеры с использованием стандартных методик. 14. Способ получения соединений формулы (Ia5) по п.9, отличающийся тем, что соединение формулы (ХII) подвергают взаимодействию с галогенидом галоалкиламмония, который описывается формулой (ХIII) где X1, R1, R2 и R3 соответствуют приведенным в п.9 определениям, a Hal и Hal1, которые могут быть одинаковыми или различными, обозначают атомы галогена, с получением соединения формулы (XIV) где X1, R1, R2, R3 и Hal соответствуют приведенным выше определениям,и затем проводят взаимодействие полученного соединения формулы (XIV) с пертехнеатом натрия в присутствии хлорида олова с получением соединения формулы (Iа 5), которое, при необходимости, подвергают очистке. 15. Способ получения соединений формулы (Ib1) по п.7, отличающийся тем, что пироксикам подвергают взаимодействию с линейным или разветвленным (С 1-С 6)алкилгалогенидом и полученный продукт, при необходимости, подвергают очистке. 16. Способ получения соединений формулы (Ib2) по п.8, отличающийся тем, что соответствующий амин подвергают взаимодействию с линейным или разветвленным (C1-С 6)алкилгалогенидом и, при необходимости, производят последующую очистку. 17. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-9, как индивидуально,так и в комбинации с одним или более фармацевтически приемлемыми инертными, нетоксичными эксципиентами или носителями. 20 18. Фармацевтическая композиция по п.17,включающая соединение по любому из пп.1-9,для применения при лечении патологий, обусловленных поражениями хряща. 19. Фармацевтическая композиция по п.17,включающая соединение по любому из пп.1 или 9, для применения в качестве диагностического реагента, способного обнаруживать патологию хряща или нарушения обмена веществ.
МПК / Метки
МПК: A61K 49/00, A61P 19/00, C07D 409/06, C07C 237/20, C07H 15/26, C07F 13/00
Метки: аммония, соединения, четвертичные
Код ссылки
<a href="https://eas.patents.su/11-4292-chetvertichnye-soedineniya-ammoniya.html" rel="bookmark" title="База патентов Евразийского Союза">Четвертичные соединения аммония</a>
Предыдущий патент: Новые соединения 3-имино-1,2-дитиола, способ их получения и фармацевтические композиции, их содержащие
Следующий патент: Фунгицидная смесь
Случайный патент: Гербицидные средства, содержащие бензоилпиразолы и защитные вещества















