Новые кристаллические формы макролидного антибиотика
Номер патента: 3417
Опубликовано: 24.04.2003
Авторы: Аллен Даглас Джон Мелдрам, Рейган Коулман Брендан, Рафка Роберт Джон, Мортон Барри Джеймс
Формула / Реферат
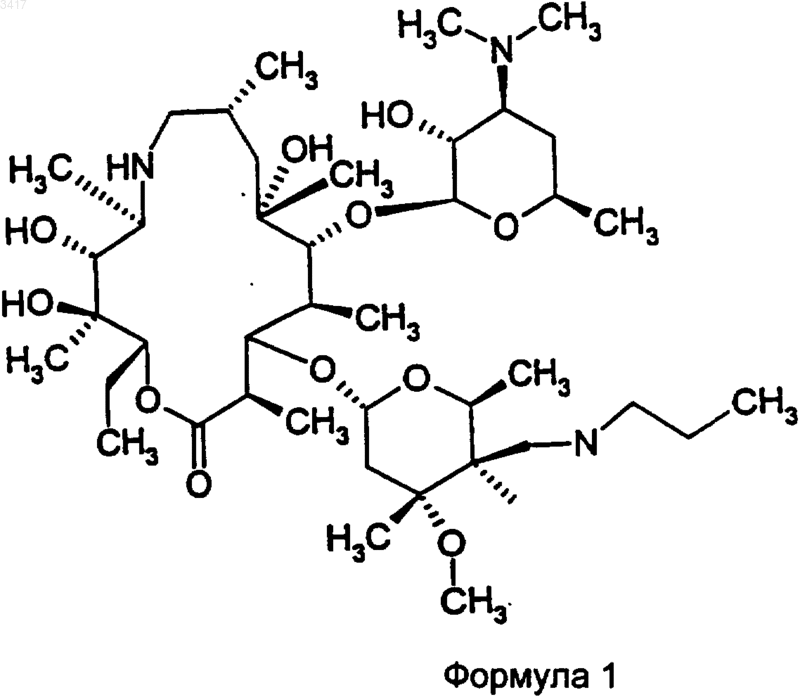
1. Кристаллическая форма соединения формулы 1
2. Кристаллическая форма по п.1, представляющая собой одну из форм: безводную форму, моногидрат и сесквигидрат.
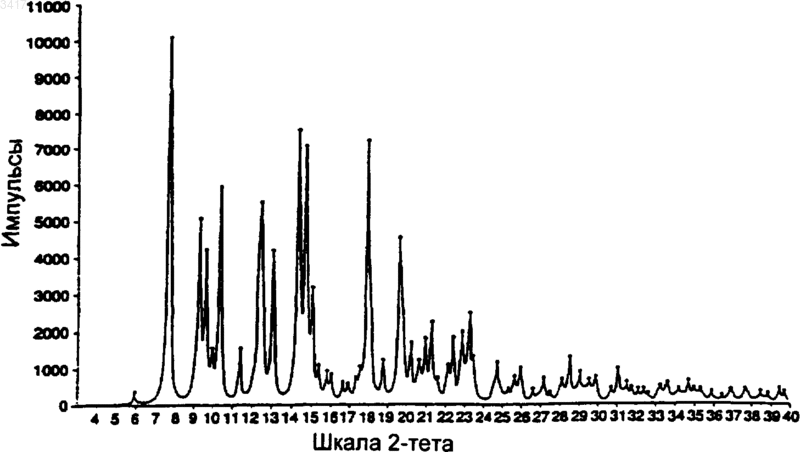
3. Кристаллическая форма по п.1, которая имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2q , при примерно 6,0: 8,6; 9,7; 15,4; 15,9; 17,5; 18,2; 18,7 и 21.
4. Кристаллическая форма по п.3, которая имеет картину дифракции рентгеновских лучей на порошке

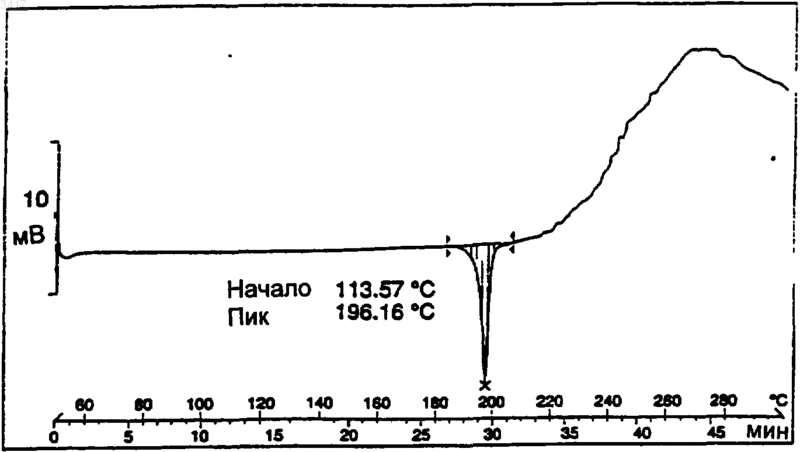
5. Кристаллическая форма по п.1, которая имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 75шC или при примерно 193шC.
6. Кристаллическая форма по п.5, которая имеет спектр дифференциальной сканирующей калориметрии
7. Кристаллическая форма по п.1, которая является негигроскопичной в течение примерно 72 ч или в течение периода до примерно 7 дней при хранении при относительной влажности примерно 87% и 25шC.
8. Кристаллическая форма по п.1, которая имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2q, при примерно 6,2; 7,6; 9,2; 9,5; 12,3; 12,9; 14,2; 14,6; 17,8 и 19,5.
9. Кристаллическая форма по п.8, которая имеет картину дифракции рентгеновских лучей на порошке
10. Кристаллическая форма по п.1, которая имеет параметры монокристалла, по существу, такие же, как параметры, представленные в табл. 1.
11. Кристаллическая форма по п.10, которая содержит атомы в атомных положениях относительно начала координат элементарной ячейки, как представлено в табл. 2, длины связей, как представлено в табл. 3, или углы связей, как представлено в табл. 4.
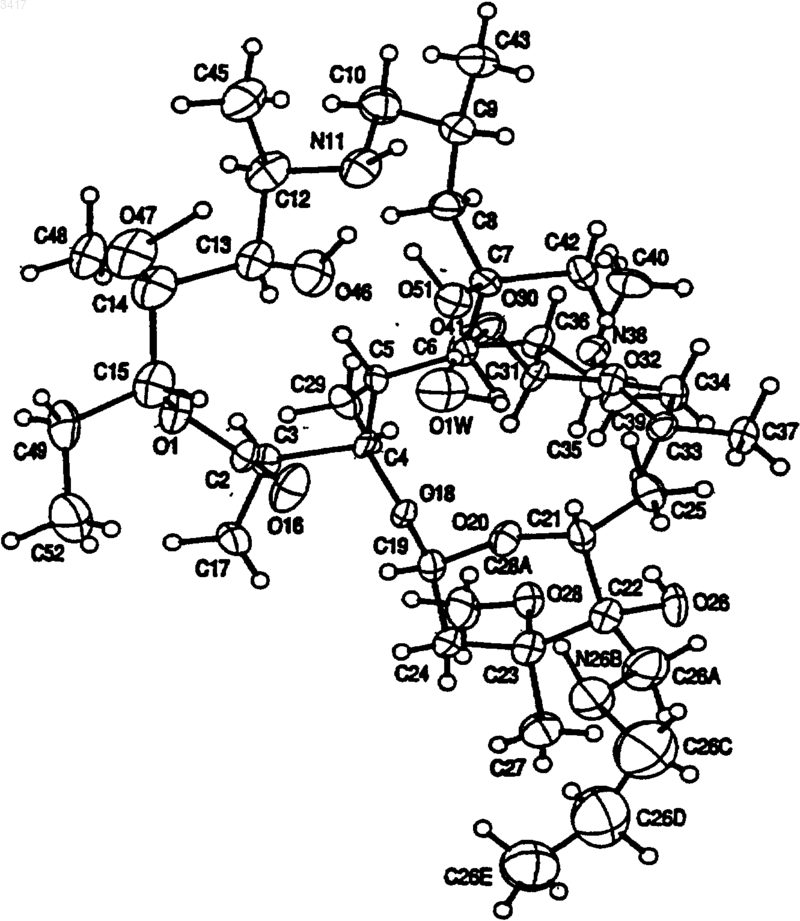
12. Кристаллическая форма по п.11, которая имеет структуру монокристалла
13. Кристаллическая форма по п.12, которая имеет спектр дифференциальной сканирующей калориметрии
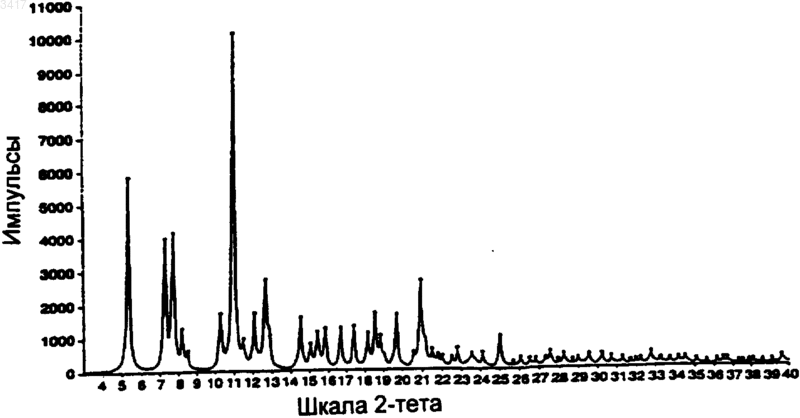
14. Кристаллическая форма по п.1, которая имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2q, при примерно 5,2; 7,4; 11,2; 11,7; 12,3; 12,9; 14,9; 15,4; 16,7 и 17,9.
15. Кристаллическая форма по п.14, которая имеет картину дифракции рентгеновских лучей на порошке
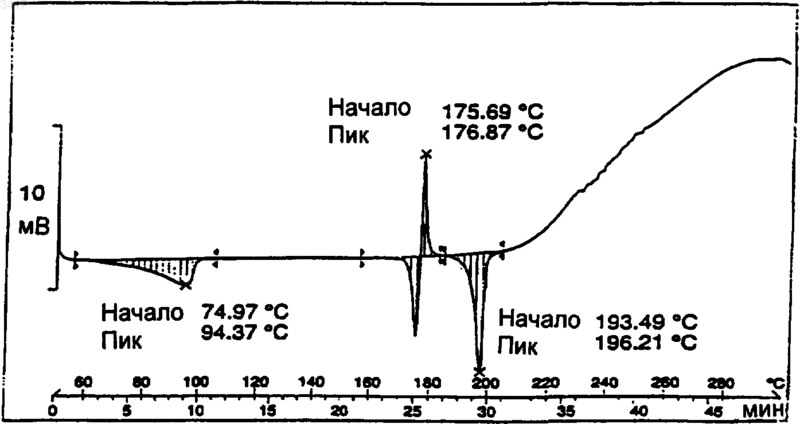
16. Кристаллическая форма по п.1, которая имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 101шC.
17. Кристаллическая форма по п.16, которая имеет спектр дифференциальной сканирующей калориметрии

18. Фармацевтическая композиция, содержащая кристаллическую форму соединения формулы 1 и фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п.18, где кристаллическая форма представляет собой одну из форм: безводную форму, моногидрат и сесквигидрат.
20. Фармацевтическая композиция по п.18, подходящая для перорального, ректального, парентерального (внутривенного, внутримышечного), чрескожного, трансбуккального, назального, подъязычного или подкожного введения.
21. Способ получения любой из кристаллических форм соединения формулы 1: безводной, моногидрата и сесквигидрата соответственно, при котором
растворяют некоторое количество соединения формулы 1 в одном из растворителей: безводном растворителе, неводном растворителе и этилацетате соответственно;
охлаждают этот раствор до температуры, при которой все количество соединения формулы 1 более не растворяется в этом растворе; и
выделяют любые образовавшиеся кристаллы фильтрованием.
22. Продукт способа по п.21.
23. Способ лечения бактериальной или протозойной инфекции у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят терапевтически эффективное количество кристаллической формы соединения формулы 1.
24. Способ по п.23, где кристаллическая форма представляет собой одну из форм: безводную форму, моногидрат и сесквигидрат.
Текст
Область изобретения Данное изобретение относится к новым кристаллическим формам макролидного антибиотика, к содержащим их композициями и способам их получения и применению. Предшествующий уровень техники Макролид, обозначенный здесь как СР 472295, имеет структуру, показанную формулой 1 СР-472295 обладает антибиотическими свойствами и является полезным при лечении,например, бактериальных и протозойных инфекций. Как и для всех лекарств, безопасное и эффективное применение СР-472295 зависит от возможности специалиста в данной области техники правильно вводить его в точных количествах. Правильной доставке точных количеств лекарства способствует приготовление лекарственных форм. Однако хорошо известно, что легкость приготовления этих лекарственных форм зависит от таких факторов, но не ограничиваясь ими, как растворимость, гомогенность,гигроскопичность и характеристики текучести лекарства. Часто эти свойства улучшаются, если можно получить кристаллические, а не аморфные, формы этого лекарства. Таким образом,существует потребность в кристаллических формах СР-472295 с хорошими характеристиками. Существует особая потребность в негигроскопичных формах СР-472295. Краткое изложение сущности изобретения Данное изобретение направлено на кристаллические формы СР-472295, фармацевтические композиции, содержащие эти кристаллические формы, и способы их получения и применение. Первое воплощение изобретения, таким образом, охватывает кристаллические формы соединения формулы 1. Предпочтительная кристаллическая форма соединения формулы 1 является безводной. Предпочтительная кристаллическая форма соединения формулы 1 имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2, при примерно 6,0; 8,6; 9,7; 15,4; 15,9; 17,5; 18,2; 18,7 и 21. Особенно предпочтительная кристаллическая форма соединения формулы 1 имеет картину дифракции рентгеновских лучей на порошке: График 1 представляет собой характеристическую картину дифракции рентгеновских лучей на порошке кристаллического безводного СР-472295. На вертикальной оси представлена интенсивность (имп/с); на горизонтальной оси представлены углы два тета (градусы). Предпочтительная кристаллическая форма соединения формулы 1 имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 193 С. Особенно предпочтительная кристаллическая форма соединения формулы 1 имеет спектр дифференциальной сканирующей калориметрии: График 2 представляет собой характеристическую термограмму дифференциальной сканирующей калориметрии кристаллического безводного СР-472295, сделанную в системеMettler Toledo Staro. На вертикальной оси представлены мВ; на горизонтальной оси представлена температура (С). Температуру повышали со скоростью примерно 5 С/мин. Предпочтительная кристаллическая форма соединения формулы 1 является негигроскопичной в течение примерно 72 ч при хранении при относительной влажности примерно 87% и 25 С. Предпочтительная кристаллическая форма соединения формулы 1 представляет собой моногидрат. Предпочтительная кристаллическая форма соединения формулы 1 имеет картину дифракции рентгеновских лучей на порошке, показывающая характеристические пики, выраженные в 2, при примерно 6,2; 7,6; 9,2; 9,5; 12,3; 12,9; 14,2; 14,6; 17,8 и 19,5. Особенно предпочтительная кристаллическая форма соединения форму 3 лы 1 имеет картину дифракции рентгеновских лучей на порошке: График 3 представляет собой характеристическую картину дифракции рентгеновских лучей на порошке кристаллического моногидрата СР-472295. На вертикальной оси представлена интенсивность (имп/сек); на горизонтальной оси представлены углы два тета (градусы). Предпочтительная кристаллическая форма соединения формулы 1 имеет параметры монокристалла по существу такие же, как параметры,представленные в табл. 1: Таблица 1 Параметры кристалла а =10,557(1)Параметры элементарнойP212121 Количество молекул в эле 4 ментарной ячейке Плотность (г/см) 1,151 Особенно предпочтительная кристаллическая форма соединения формулы 1 содержит атомы в атомных положениях относительно начала координат элементарной ячейки, как представлено ниже в табл. 2, длины связей, как представлено ниже в табл. 3, или углы связей,как представлено ниже в табл. 4. Наиболее предпочтительная кристаллическая форма соединения формулы 1 имеет структуру монокристалла: конфигурация кристаллического моногидрата СР-472295 Предпочтительная кристаллическая форма соединения формулы 1 имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 75 С. Особенно предпочтительная кристаллическая форма соединения формулы 1 имеет спектр дифференциальной сканирующей калориметрии: График 4 представляет собой характеристическую термограмму дифференциальной сканирующей калориметрии кристаллического моногидрата СР-472295, сделанную в системеMettler Toledo Star. На вертикальной оси представлены мВ; на горизонтальной оси представлена температура (С), причем температуру повышают со скоростью примерно 5 С/мин. Предпочтительная кристаллическая форма соединения формулы 1 является негигроскопичной в течение примерно 7 суток при хранении при относительной влажности примерно 87% и 25 С. Предпочтительная кристаллическая форма соединения формулы 1 представляет собой сесквигидрат. Предпочтительная кристаллическая форма соединения формулы 1 имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2, примерно при 5,2; 7,4; 11,2; 11,7; 12,3; 12,9; 14,9; 15,4; 16,7 и 17,9. Особенно предпочтительная кристаллическая форма соединения формулы 1 имеет картину дифракции рентгеновских лучей на порошке: График 5 представляет собой определенную характеристическую картину дифракции рентгеновских лучей на порошке кристалличе 5 ского сесквигидрата СР-472295. На вертикальной оси представлена интенсивность (имп/сек); на горизонтальной оси представлены углы два тета (градусы). Предпочтительная кристаллическая форма соединения формулы 1 имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 101 С. Особенно предпочтительная кристаллическая форма соединения формулы 1 имеет спектр дифференциальной сканирующей калориметрии: График 6 представляет собой характеристическую термограмму дифференциальной сканирующей калориметрии кристаллического сесквигидрата СР-472295, сделанную в системеMettler Toledo Star. На вертикальной оси представлены мB; на горизонтальной оси представлена температура (С). Температуру повышали со скоростью примерно 5 С/мин. Второе воплощение данного изобретения охватывает фармацевтические композиции, содержащие кристаллическую форму соединения формулы 1 и фармацевтически приемлемый носитель. Кристаллическая форма соединения формулы 1 может представлять собой безводную форму, моногидрат или сесквигидрат. Фармацевтические композиции по изобретению являются подходящими для перорального, ректального, парентерального (внутривенного,внутримышечного), чрескожного, трансбуккального, назального, подъязычного или подкожного введения. Третье воплощение данного изобретения охватывает способы получения кристаллических форм соединения формулы 1. Предпочтительным способом является способ получения кристаллической безводной формы соединения формулы 1, при котором: растворяют количество соединения формулы 1 в безводном малополярном растворителе; охлаждают этот раствор до температуры, при которой все количество соединения формулы 1 более не является растворимым в этом растворе; и выделяют любые образовавшиеся кристаллы с помощью фильтрования. Данное изобретение охватывает продукты этого способа. Предпочтительным способом является способ получения кристаллической формы моногидрата соединения формулы 1, при котором: 6 растворяют количество соединения формулы 1 в безводном растворителе, содержащем от примерно 0,05 и до примерно 15 объемных процентов воды; охлаждают этот раствор до температуры,при которой все количество соединения формулы 1 более не является растворимым в этом растворе; и выделяют любые образовавшиеся кристаллы с помощью фильтрования. Данное изобретение включает в себя продукты этого способа. Предпочтительным способом является способ получения кристаллической формы сесквигидрата соединения формулы 1, при котором: растворяют количество соединения формулы 1 в этилацетате, содержащем от примерно 1 и до примерно 10 объемных процентов воды; охлаждают этот раствор до температуры, при которой все количество соединения формулы 1 более не является растворимым в этом растворе; и выделяют любые образовавшиеся кристаллы с помощью фильтрования. Данное изобретение включает в себя продукты этого способа. Четвертое воплощение изобретения включает в себя способ лечения бактериальной или протозойной инфекции у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят терапевтически эффективное количество кристаллической формы соединения формулы 1. Кристаллическая форма соединения формулы 1 может представлять собой безводную форму, моногидрат или сесквигидрат. Определения Как его используют здесь, термин негигроскопичный при использовании для описания соединения означает, что это соединение поглощает влагу со скоростью менее чем примерно 0,4% за 24 ч при относительной влажности 90%. Как его используют здесь, термин млекопитающее охватывает человека, собаку и кошку. Как их используют здесь, термины бактериальная инфекция (инфекции) и протозойная инфекция (инфекции) включают в себя бактериальные инфекции и протозойные инфекции,которые встречаются у млекопитающих, рыб и птиц, а также расстройства, связанные с бактериальными инфекциями и протозойными инфекциями, которые можно лечить или предупреждать с помощью антибиотиков, таких как соединения по настоящему изобретению. Такие бактериальные инфекции и протозойные инфекции, а также расстройства, связанные с такими инфекциями, включают в себя следующее: пневмонию, средний отит, синусит, бронхит,тонзиллит и мастоидит, связанные с инфекциейChlamydia pneumoniae; неосложненные инфекции кожи и мягких тканей, абсцессы и остеомиелит, а также послеродовую лихорадку, связанные с инфекцией Staphylococcus aureus, коагулазоположительными стафилококками (то есть, S. epidermis, S. hemolyticus и так далее),Staphylococcus pyogenes, Streptococcus agalactiae, стрептококковыми группами C-F (мелкоколониевые стрептококки), зеленящими стрептококками, Corynebacterium minutissimum, Clostridium spp. или Bartonella henselae; неосложненные острые инфекции мочевых путей, связанные с инфекцией Staphylococcus saprophyticus или Enterococcus spp.; уретрит и цервицит; а также заболевания, передаваемые половым путем, связанные с инфекцией Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum,Ureaplasma urealyticum или Neiserria gonorrhea; токсинные заболевания, связанные с инфекциейS. aureus (пищевая интоксикация и токсический шок) или стрептококками групп А, В и С; язвы,связанные с инфекцией Helicobacter pylori; системные лихорадочные синдромы, связанные с инфекцией Borrelia recurrentis; болезнь Лайма,связанную с инфекцией Borrelia burgdorferi,конъюнктивит, кератит и дакриоцистит, связанные с инфекцией Chlamydia trachomatis, Neiserria gonorrhoeae, S. aureus, S. pneumoniae, S. pyogenes, H. influenzae или Listeria spp.; заболевание, вызванное диссеминированным Mycobacterium avium комплексом (MAC), связанное с инфекцией Mycobacterium avium или Mycobacterium intracellulare; гастроэнтерит, связанный с инфекцией Campylobacter jejuni, кишечных простейших, связанных с инфекцией Cryptosporidium spp.; одонтогенную инфекцию, связанную с инфекцией зеленящими стрептококками; персистентный кашель, связанный с инфекцией Bordetella pertussis; газовую гангрену, связанную с инфекцией Clostridium perfringens или Bacteroides spp.; и атеросклероз, связанный с инфекциейHelicobacter pylori или Chlamydia pneumoniae. Бактериальные инфекции и протозойные инфекции, а также расстройства, связанные с такими инфекциями, которые можно лечить или предупреждать у животных, включают в себя следующее: респираторное заболевание коров,связанное с инфекцией Р. haem., P. multocida,Mycoplasma bovis или Bordetella spp.; кишечное заболевание коров, связанное с инфекцией Е. соli или простейшими (то есть кокцидиями,криптоспоридиями и так далее); мастит молочных коров, связанный с инфекцией Staph.Fusobacterium necrophorum или Bacteroides nodosus; коровий инфекционный конъюнктивит,связанный с инфекцией Moraxella bovis; преждевременный выкидыш у коров, связанный с инфекцией простейшими (то есть неоспорами),инфекцию мочевых путей у собак и кошек, связанную с инфекцией Е. coli, инфекции кожи и мягких тканей у собак и кошек, связанные с инфекцией Staph. epidermidis, Staph. intermedius,коагулазоотр. Staph. или Р. multocida; и инфекционные болезни зубов или рта у собак и кошек,связанные с инфекцией Alcaligenes spp., Bacteroides spp., Clostridium spp., Enterobacter spp.,Eubacterium, Peptostreptococcus, Porphyromonas или Prevotella. Другие бактериальные инфекции и протозойные инфекции, а также расстройства,связанные с такими инфекциями, которые можно лечить или предупреждать в соответствии со способами по данному изобретению, приведены в Sanford, J.P. et al., The Sanford Guide to Antimicrobal Therapy, 27th Edition (AntimicrobalTherapy, Inc., 1996). Подробное описание изобретения Данное изобретение основано на открытии трех различных полиморфов (то есть кристаллических структур) СР-472295. Эти полиморфы обладают неожиданными физическими свойствами, которые облегчают производство лекарственных форм этого соединения. Предпочтительный полиморф этого соединения представляет собой кристаллическую безводную форму. Данная форма имеет игольчатый (в виде игл) габитус со средним двойным лучепреломлением. Параллельное двойникование может привести к тому, что кристаллы будут в виде пластинчатых вкраплений, и это препятствует выделению монокристаллов, подходящих для рентгенографического измерения монокристалла. На приведенном выше графике 1 показана характеристическая картина дифракции рентгеновских лучей на порошке кристаллической безводной формы. На приведенном выше графике 2 показана характеристическая термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллической безводной формы. Наблюдается только одно событие, которое имеет начало примерно при 193 С. Микроскопия плавления данной формы СР-472295 не выявляет других событий, кроме плавления. Особенным преимуществом, даваемым этой формой, является отсутствие у нее гигроскопичности. На следующем графике 7 показа 9 но характеристическое измерение гигроскопичности данной формы: График 7 представляет собой характеристическое измерение гигроскопичности кристаллического безводного СР-472295. Увеличение поглощения пара измеряли с помощью анализатора VTI. На основании этих и других данных определили, что кристаллический безводный СР 472295 является негигроскопичным при относительной влажности примерно 87% в течение 72 ч при температуре окружающей среды. Это неожиданное свойство позволяет осуществлять недорогую эффективную обработку и хранение этого лекарства, а также легкое включение точных количеств этого лекарства в ряд лекарственных форм. Подобно безводной форме, кристаллический моногидрат СР-472295 также неожиданно является негигроскопичным. Данная форма имеет пластинчатый или изометрический габитус, который может быть результатом пластинчатой упаковки и агломерации. На графике 3 показана характеристическая картина дифракции рентгеновских лучей на порошке данной формы. Можно получить кристаллы, подходящие для рентгенографического анализа монокристалла; данные, полученные с помощью такого анализа, дают отображение кристаллической структуры, показанное выше. На графике 4 представлена характеристическая термограмма ДСК кристаллического моногидрата СР-472295. ДСК и микроскопия плавления показывают, что данная форма начинает терять воду и превращается в псевдоморф при температуре от примерно 70 С до примерно 75 С. Этот псевдоморф можно также создать,помещая данный кристаллический моногидрат в вакуум при температуре окружающей среды. Если этот псевдоморф не находится в вакууме,он плавится примерно при 165 С, а затем быстро превращается в кристаллическую безводную форму, которая, как показано выше, плавится примерно при 193 С. Кристаллический моногидрат СР-472295,подобно кристаллической безводной форме,описанной выше, предпочтительно является негигроскопичным. На графике 4 показано ха 003417 10 рактеристическое измерение гигроскопичности этой формы. На основании этих и других данных определили, что кристаллический моногидрат СР-472295 является негигроскопичным при относительной влажности примерно 87% в течение примерно 7 суток при температуре окружающей среды. Это неожиданное свойство позволяет осуществлять недорогую эффективную обработку и хранение этого лекарства, а также легкое включение точных количеств этого лекарства в ряд лекарственных форм. В противоположность этому, псевдоморф,образующийся когда моногидрат теряет воду,является гигроскопичным и повторно поглощает гидратную воду в течение примерно 4 ч при хранении при относительной влажности примерно 87% и температуре окружающей среды. Кристаллическая форма сесквигидрат СР 472295 обладает физическими свойствами, отличными от двух форм, описанных выше. Данная форма имеет габитус пластинчатых вкраплений и среднее двойное лучепреломление. На графике 5 представлена характеристическая картина дифракции рентгеновских лучей на порошке данной формы. В отличие от моногидрата, данная форма СР-472295 легко теряет воду в обычных условиях обработки (например, при 25 С и относительной влажности 70%). На графике 6 представлена характеристическая термограмма ДСК кристаллического сесквигидрата СР-472295. ДСК и микроскопия плавленияпоказывают потерю воды примерно при 35 С с последующей кристаллизацией безводной формы, которая, как показано выше, плавится при 193 С. Каждое из трех обсуждаемых кристаллических соединений, описанных здесь, можно получить из аморфного (то есть не кристаллического) или неочищенного СР-472295. Синтез СР-472295 описан в WO 98/56802, которая включена сюда путем ссылки. В предпочтительном способе получения кристаллического безводного СР-472295 растворяют аморфное соединение в безводном растворителе или в смеси растворителей. Предпочтительные растворители включают в себя гептан, ацетон и ацетонитрил. Можно использовать другие растворители, такие как этанол, изопропанол и тетрагидрофуран, но они имеют свойство давать смеси безводного продукта, моногидрата и сесквигидрата. Предпочтительно растворитель нагревают, аморфное соединение растворяют в нем до точки, примерно эквивалентной насыщению, и полученный в результате раствор оставляют охлаждаться до температуры, при которой все количество растворенного соединения более не является растворимым в данном растворителе. Кристаллы выделяют фильтрованием и высушивают на воздухе. Кристаллическую безводную форму можно также получить с помощью диффузионной кристаллизации. Например, один или более чем 11 один из смешиваемых растворителей, в которых СР-472295 малорастворим, добавляют к раствору, в котором растворен аморфный СР-472295. В другом способе получения кристаллического безводного СР-472295 кристаллическую форму, представляющую собой моногидрат соединения, подвергают дегидратации. Это можно осуществить с помощью нагревания, возможно при пониженном давлении. Кристаллический моногидрат СР-472295 можно выделить из растворителя или из смеси растворителей, которые содержат некоторое количество воды, предпочтительно от примерно 0,05 до примерно 15 об.% воды, более предпочтительно от примерно 1 до примерно 10 об.% воды. За исключением этилацетата, полярность растворителя, по-видимому, не влияет на выделение данной формы. В предпочтительном способе выделения моногидрата нагревают смесь растворителей, такую как этанол/10% воды или диизопропиловый эфир/1% воды, растворяют аморфный СР-472295 в этой смеси так, чтобы достичь или почти достичь насыщения, а затем охлаждают смесь до температуры, при которой все количество растворенного соединения более не является растворимым в данной смеси растворителей. Кристаллы выделяют фильтрованием и высушивают на воздухе. Кристаллический сесквигидрат СР-472295 можно также выделить из влажных растворителей, используя обычные способы кристаллизации. Однако предпочтительно получать его путем растворения аморфного СР-472295 в нагретом этилацетате, содержащем от примерно 1 до примерно 10 объемных процентов воды, более предпочтительно от примерно 2 до примерно 6 объемных процентов воды, и охлаждения полученной в результате смеси до температуры, при которой все количество растворенного соединения более не является растворимым в данном растворителе. Кристаллы выделяют фильтрованием. Фармацевтические препараты и способы лечения Соединения по данному изобретению (то есть кристаллический безводный СР-472295,кристаллический моногидрат СР-472295 и кристаллический сесквигидрат СР-472295; в дальнейшем называемые активными соединениями) можно вводить пероральным, ректальным,парентеральным (то есть внутривенным, внутримышечным), чрескожным, трансбуккальным,назальным, подъязычным и подкожным путями. Как правило, активные соединения наиболее желательно вводить в дозировках, находящихся в диапазоне от примерно 0,2 мг на кг массы тела в сутки (мг/кг/сутки) до примерно 200 мг/кг/ сутки в однократной дозе или в разделенных дозах (то есть от 1 до 4 доз в сутки), хотя вариации будут неизбежно встречаться в зависимости от вида, массы и состояния субъекта, которого лечат, и конкретного выбранного пути введе 003417 12 ния. Уровень дозировки, который находится в диапазоне от примерно 1 мг/кг/сутки до примерно 100 мг/кг/сутки, является предпочтительным, и уровень дозировки макролидного антибиотика, который находится в диапазоне от примерно 2 мг/кг/сутки до примерно 50 мг/кг/ сутки, является наиболее предпочтительным. Тем не менее, могут происходить вариации в зависимости от вида, подлежащего лечению(например, человека, страдающего бактериальной или протозойной инфекцией), и его индивидуальной восприимчивости к макролидному антибиотику, а также от типа выбранного фармацевтического препарата и от периода времени и интервала, при которых осуществляют такое введение. В некоторых случаях уровни дозировки ниже нижнего предела вышеупомянутых диапазонов могут быть более адекватными, тогда как в других случаях можно применять гораздо большие дозы, не вызывая каких-либо вредных побочных эффектов, при условии, что такие большие дозы сначала разделяют на несколько небольших доз для введения в течение суток. Активные соединения можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями или разбавителями указанными ранее путями. Такое введение можно осуществлять однократными или многократными дозами. Активные соединения можно вводить в широком ряде различных лекарственных форм, то есть их можно комбинировать с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, твердых леденцов, порошков, спреев, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, инъекционных растворов, эликсиров,сиропов и тому подобного. Такие носители включают в себя твердые разбавители, или наполнители, стерильные водные среды и различные нетоксичные органические растворители. Кроме того, пероральные фармацевтические композиции можно подходящим образом подслащивать и/или корригировать их аромат и вкус. Как правило, активные соединения находятся в таких лекарственных формах в концентрации на уровне от примерно 5,0% до примерно 70% мас./мас. Для перорального введения можно применять таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, гидроортофосфат кальция и глицин вместе с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный или маниоковый крахмал), альгиновая кислота и некоторые сложные силикаты, вместе со связующими веществами для грануляции, подобно поливинилпирролидону, сахарозе, желатину и аравийской камеди. Смазывающие агенты, поверхносто-активные вещества и скользящие 13 агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, также являются полезными для таблетирования. Твердые композиции подобного типа можно также применять в качестве наполнителей желатиновых капсул. Предпочтительные наполнители включают в себя лактозу, или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или эликсиры, активное соединение можно комбинировать с различными подслащивающими или корригирующими агентами, красящим веществом или красителями и, если желательно, с эмульгирующими и/или суспендирующими агентами, а также вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и различные подобные их комбинации. В дополнение к обычным лекарственным формам, описанным выше, соединения по изобретению можно вводить с помощью средств с контролируемым высвобождением и/или способов доставки, способных высвобождать активное соединение с требуемой скоростью для поддержания постоянной фармакологической активности в течение желаемого периода времени. Такие лекарственные формы обеспечивают доставку лекарства в организм в течение заданного периода времени и, таким образом, поддерживают уровни лекарства в терапевтическом диапазоне в течение более длительных периодов,чем традиционные неконтролируемые препараты. Подходящие фармацевтические композиции с контролируемым высвобождением и способы доставки, которые можно приспособить для введения активных соединений по изобретению,описаны в патентах США 3847770; 3916899; 3536809; 3598123; 3630200; 4008719; 4687610; 4769027; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354566 и 5733566,описания изобретения которых включены сюда посредством этой ссылки. Например, активные соединения можно объединять с классом биоразрушаемых полимеров, полезных при достижении контролируемого высвобождения лекарства, например, с полимером молочной кислоты, полигликолевой кислотой, с сополимерами полимеров молочной кислоты и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами,полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно-сшитыми или амфифильными блок-сополимерами гидрогелей. Для парентерального введения можно применять растворы активного соединения либо в кунжутном, либо в арахисовом масле или в водном пропиленгликоле. Водные растворы должны быть подходящим образом забуферены,если необходимо, а жидкий разбавитель сначала доведен до изотоничности. Эти водные растворы являются пригодными для внутривенных инъекций. Масляные растворы являются при 003417 14 годными для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко осуществить с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Возможно также вводить активные соединения по изобретению местно. Это можно сделать с помощью кремов, желе, гелей, паст, пластырей, мазей и тому подобного в соответствии со стандартной фармацевтической практикой. Кроме того, активные соединения можно вводить в корме для животных или перорально в виде композиции для вливания в рот. Активные соединения можно также вводить в форме липосомальных систем доставки,таких как маленькие однослойные везикулы,большие однослойные везикулы и многослойные везикулы. Липосомы можно образовывать из множества фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Активные соединения можно также объединять с растворимыми полимерами в качестве носителей наводимого на цель лекарства. Такие полимеры могут включать в себя поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенил, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоил-остатками. Дополнительные новые и не ограничивающие аспекты обсуждаемых соединений по изобретению предложены в примерах. Примеры Пример 1. Получение кристаллического безводного СР-472295. Приблизительно 20 мг аморфного СР 472295, полученного согласно способу WO 98/56802, помещали во флаконы на 1 драхму с предварительно нанесенными рисками. Предпринимали попытки кристаллизации, используя диэтиловый эфир, ацетонитрил, ацетон, метилизобутилкетон (МИБК), метил-тpeт-бутиловый эфир (МТБЭ) и бензол. Аморфное соединение в каждом флаконе переводили в раствор путем добавления небольших нагретых количеств каждого растворителя. Флаконы оставляли для охлаждения до комнатной температуры, и образование кристаллов (белые иглы) наблюдали в системах с ацетоном, ацетонитрилом и МИБК. Кристаллы также получали, используя диффузионную кристаллизацию, где диффундирующий растворитель представлял собой диэтиловый эфир, а этилацетат, этанол, ацетонитрил, н-пропанол и МИБК использовали в качестве базовых растворителей. Рост кристалла наблюдали в системе этанол/диэтиловый эфир. Пример 2. Получение кристаллического моногидрата СР-472295 Насыщенный водой раствор диэтилового эфира (0,9% воды об./об.) приготовили путем встряхивания диэтилового эфира с водой. Вод 15 ный слой удалили, а органический слой фильтровали с получением прозрачного раствора, в который добавляли СР-472295, пока не достигали насыщения. При стоянии при комнатной температуре кристаллический моногидрат осаждался из раствора в течение примерно 1 мин. Кристаллическую форму, представляющую собой моногидрат, также получали путем растворения аморфного СР-472295 в 2 мл насыщенного водой МТБЭ до достижения насыщения с последующим декантированием раствора. Осаждение соединения происходило после того, как декантированный раствор стоял при комнатной температуре в течение примерно 15 мин. Пример 3. Структура монокристалла кристаллического моногидрата СР-472295. Исследовали образец кристалла, полученный с использованием способа примера 2 (диэтиловый эфир), и набор данных 1 А получали на дифрактометре Siemens R3RA/v. Атомные множители взяты из International Tables for Xray Crystallography, Vol. IV, pp. 55, 99, 149 (Birmingham: Kynoch Press, 1974). Все кристаллографические вычисления осуществляли с помощью системы SHELXTL. См. Sheldrick, G.M.,SHELXTL, User Manual, Nicolet Instrument Co.,1981. Все данные на дифрактометре получали при комнатной температуре. Опытную структуру, которую получили прямыми способами, уточняли рутинным образом. Отображение разностей показало воду кристаллизации. Положения атомов водорода рассчитывали, где возможно. Расположения метильных атомов водорода и атомы водорода на азоте и кислороде определяли с помощью методик разности Фурье. Параметры водорода добавляли к расчетам структурных факторов, но не уточняли. Все сдвиги, рассчитанные в конечном цикле уточнения по методу наименьших квадратов, составляли менее 0,1 от их соответствующих стандартных отклонений, и конечный индекс R составлял 6,29%. Конечная разность Фурье на выявила отсутствующей или неправильно расположенной электронной плотности. Детали кристалла приведены в табл. 1 выше. Отдельные атомные координаты и изотропные тепловые параметры, определенные на основании этих данных, представлены в табл. 2. Таблица 2 Атомные координаты (х 10) и изотропные тепловые параметры (Axi 03) моногидрата СР-472295 Атом х Некоторые длины связей, определенные на основании данных по монокристаллу, представлены в табл. 3. Таблица 3 Длины связей моногидрата СР-472295 Некоторые углы связей, определенные на основании данных по монокристаллу, представлены в табл. 4. Таблица 4 Углы связей моногидрата СР-472295 С(2)-O(1)-С(15) 119.1(4) Приведенная выше пространственная структура показывает диаграмму уточненной кристаллической структуры. Абсолютную конфигурацию не определили в данном анализе,поскольку в этой структуре не присутствует тяжелый атом. Пример 4. Получение кристаллического сесквигидрата СР-472295. СР-472295 (0,3 г) растворяли в 1 мл этилацетата при комнатной температуре. К этому 18 прозрачному раствору добавляли 0,4 мл воды. Этот раствор перемешивали в течение ночи,причем в течение этого времени происходило образование сесквигидрата в виде осадка. Этот осадок извлекали фильтрованием. Данное изобретение не ограничивается примерами и деталями, приведенными выше, и его объем определен прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма соединения формулы 1 2. Кристаллическая форма по п.1, представляющая собой одну из форм: безводную форму, моногидрат и сесквигидрат. 3. Кристаллическая форма по п.1, которая имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2, при примерно 6,0: 8,6; 9,7; 15,4; 15,9; 17,5; 18,2; 18,7 и 21. 4. Кристаллическая форма по п.3, которая имеет картину дифракции рентгеновских лучей на порошке 5. Кристаллическая форма по п.1, которая имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 75 С или при примерно 193 С. 6. Кристаллическая форма по п.5, которая имеет спектр дифференциальной сканирующей калориметрии 7. Кристаллическая форма по п.1, которая является негигроскопичной в течение примерно 72 ч или в течение периода до примерно 7 дней при хранении при относительной влажности примерно 87% и 25 С. 8. Кристаллическая форма по п.1, которая имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2, при примерно 6,2; 7,6; 9,2; 9,5; 12,3; 12,9; 14,2; 14,6; 17,8 и 19,5. 9. Кристаллическая форма по п.8, которая имеет картину дифракции рентгеновских лучей на порошке 10. Кристаллическая форма по п.1, которая имеет параметры монокристалла, по существу,такие же, как параметры, представленные в табл. 1. 11. Кристаллическая форма по п.10, которая содержит атомы в атомных положениях относительно начала координат элементарной ячейки, как представлено в табл. 2, длины связей, как представлено в табл. 3, или углы связей,как представлено в табл. 4. 12. Кристаллическая форма по п.11, которая имеет структуру монокристалла 13. Кристаллическая форма по п.12, которая имеет спектр дифференциальной сканирующей калориметрии 14. Кристаллическая форма по п.1, которая имеет картину дифракции рентгеновских лучей на порошке, показывающую характеристические пики, выраженные в 2, при примерно 5,2; 7,4; 11,2; 11,7; 12,3; 12,9; 14,9; 15,4; 16,7 и 17,9. 15. Кристаллическая форма по п.14, которая имеет картину дифракции рентгеновских лучей на порошке 16. Кристаллическая форма по п.1, которая имеет спектр дифференциальной сканирующей калориметрии, включающий в себя событие с началом при примерно 101 С. 17. Кристаллическая форма по п.16, которая имеет спектр дифференциальной сканирующей калориметрии 18. Фармацевтическая композиция, содержащая кристаллическую форму соединения формулы 1 и фармацевтически приемлемый носитель. 19. Фармацевтическая композиция по п.18,где кристаллическая форма представляет собой одну из форм: безводную форму, моногидрат и сесквигидрат. 20. Фармацевтическая композиция по п.18,подходящая для перорального, ректального,парентерального (внутривенного, внутримышечного), чрескожного, трансбуккального, назального, подъязычного или подкожного введения. 21. Способ получения любой из кристаллических форм соединения формулы 1: безводной, моногидрата и сесквигидрата соответственно, при котором растворяют некоторое количество соединения формулы 1 в одном из растворителей: безводном растворителе, неводном растворителе и этилацетате соответственно; охлаждают этот раствор до температуры, при которой все количество соединения формулы 1 более не растворяется в этом растворе; и выделяют любые образовавшиеся кристаллы фильтрованием. 22. Продукт способа по п.21. 23. Способ лечения бактериальной или протозойной инфекции у млекопитающего, при котором млекопитающему, нуждающемуся в таком лечении, вводят терапевтически эффективное количество кристаллической формы соединения формулы 1. 24. Способ по п.23, где кристаллическая форма представляет собой одну из форм: безводную форму, моногидрат и сесквигидрат.
МПК / Метки
МПК: C07H 17/08, A61K 31/70
Метки: макролидного, формы, антибиотика, новые, кристаллические
Код ссылки
<a href="https://eas.patents.su/11-3417-novye-kristallicheskie-formy-makrolidnogo-antibiotika.html" rel="bookmark" title="База патентов Евразийского Союза">Новые кристаллические формы макролидного антибиотика</a>
Предыдущий патент: Частицы термообработанного катализатора фишера-тропша
Следующий патент: Способ и система моделирования углеводородсодержащего пласта
Случайный патент: Телевизионный приемник с телефонным модулем












