Фенил- и пиридил-тетрагидропиридины, обладающие ингибирующей активностью в отношении фактора некроза опухоли (фно)
Номер патента: 4508
Опубликовано: 29.04.2004
Авторы: Кардамоне Розанна, Бурри Бернар, Барони Марко, Гуцци Умберто, Казелла Пьер
Формула / Реферат
1.Соединение формулы (I)
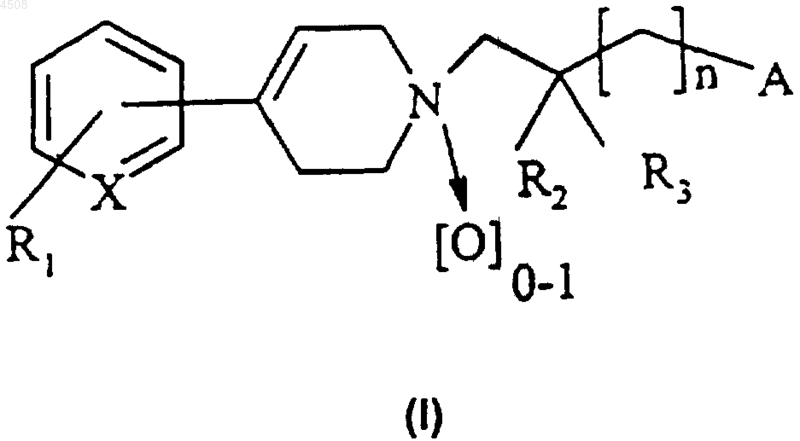
где X представляет собой N или CH;
R1 представляет собой атом водорода или галогена или группу CF3;
R2 и R3 независимо представляют собой атом водорода или метильную группу;
n равно 0 или 1;
A представляет собой группу формулы (a) или (b)

где R4 представляет собой атом водорода или галогена, (C1-C4)алкильную группу, группу CF3, аминогруппу, моно(C1-C4)алкиламиногруппу или ди(C1-C4)алкиламиногруппу;
R5 представляет собой атом водорода или галогена, (C1-C4)алкоксигруппу, (C1-C4)алкильную группу или группу CF3;
R6 представляет собой атом водорода, (C1-C4)алкильную группу или (C1-C4)алкоксигруппу;
а также его соли или сольваты.
2. Соединение по п.1, где n равно нулю.
3. Соединение по п.1 или 2, где R2 и R3 представляют собой водород.
4. Соединение по пп.1-3, где R1 представляет собой группу CF3.
5. Соединение по пп.1-3, где R1 представляет собой атом фтора.
6. Соединение по пп.1-3, где X представляет собой CH, а R1 находится в положении 3 бензола.
7. Соединение по пп.1-3, где X представляет собой CH, а R1 находится в положении 2 бензола.
8. Соединение по пп.1-3, где X представляет собой атом азота, а пиридин замещен в положениях 2 и 6.
9. Соединение по пп.1-8, выбранное из его моно-N-оксидных и бис-N-оксидных производных.
10. Соединение по п.1, выбранное из 7-(2-(4-(3-трифторметилфенил)-1,2,3,6-тетрагидро-1-пиридил)этил)изохинолина, его моно-N-оксидных и бис-N-оксидных производных и их солей и сольватов.
11. Способ получения соединения по п.1, отличающийся тем, что проводят реакцию сочетания/восстановления между соединением формулы (VI)
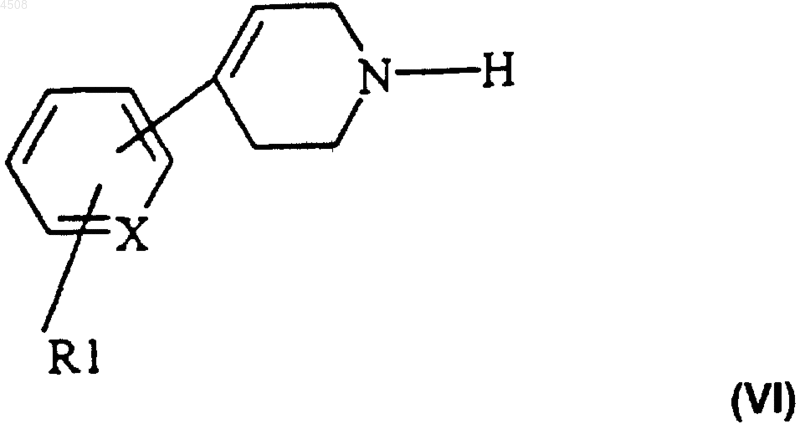
где X и R1 являются такими, как определено в п.1, и альдегидом формулы (VII)
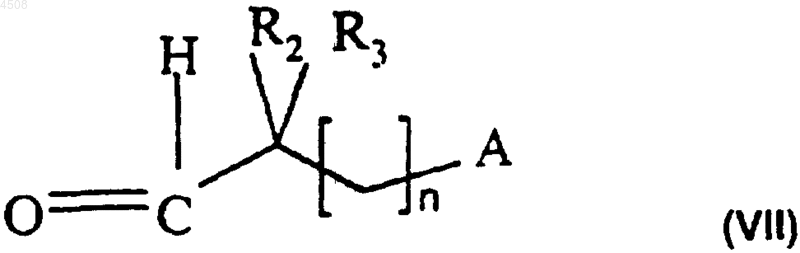
где R2, R3, n и A являются такими, как определено в п.1, и соединение формулы (I) выделяют и возможно превращают в его соль или сольват или его N-оксид.
12. Способ получения соединения по п.1, отличающийся тем, что
a) соединение формулы (II)
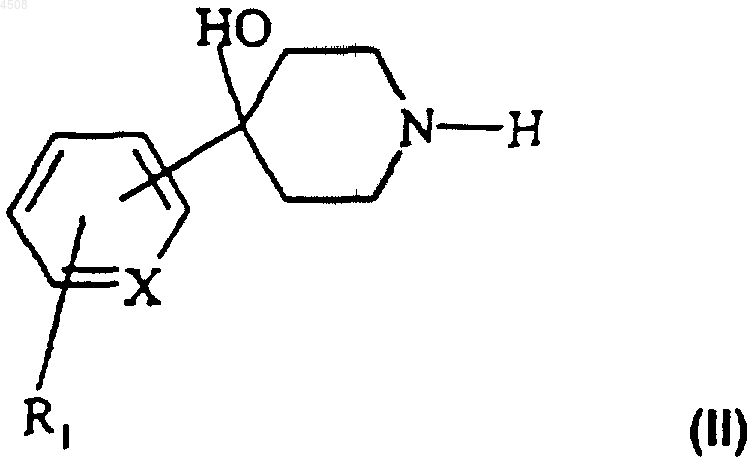
где X и R1 являются такими, как определено в п.1, подвергают взаимодействию с функциональным производным кислоты формулы (III)
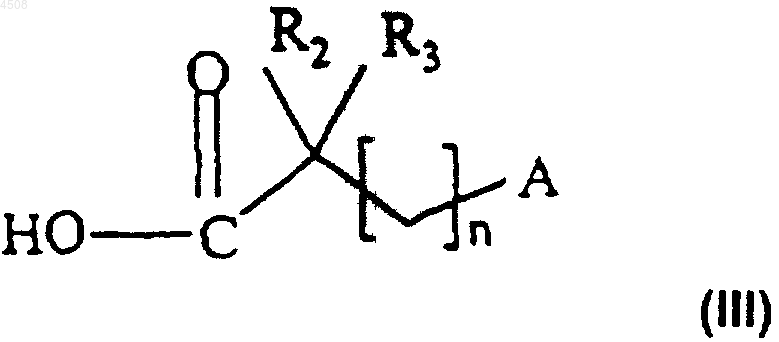
где R2, R3, n и A являются такими, как определено в п.1,
б) карбонильную группу полученного таким образом соединения формулы (IV)
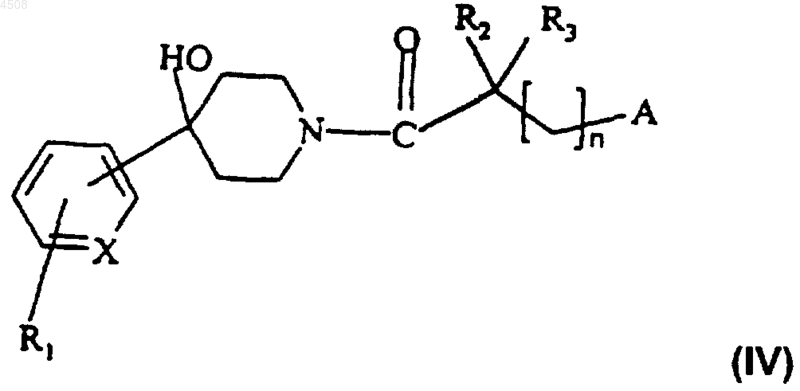
восстанавливают,
в) полученное таким образом промежуточное соединение пиперидинол формулы (V)
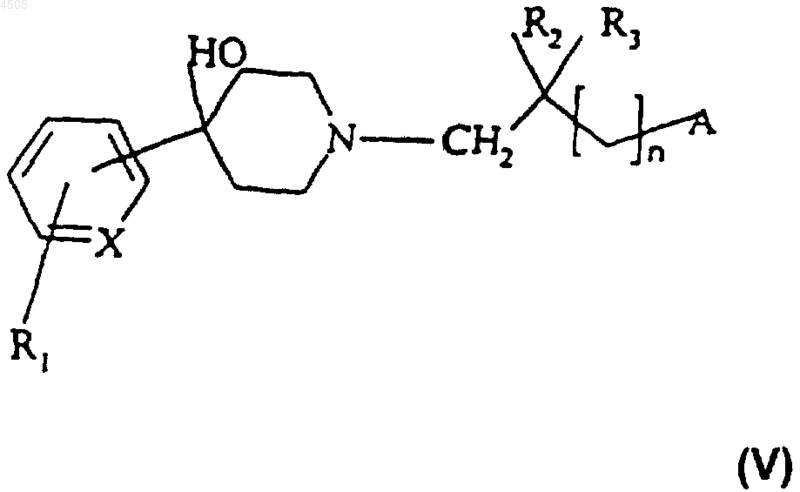
дегидратируют,
г) полученное таким образом соединение формулы (I) выделяют и возможно превращают в его соль или сольват или его N-оксидные производные.
13. Соединение формулы (V)
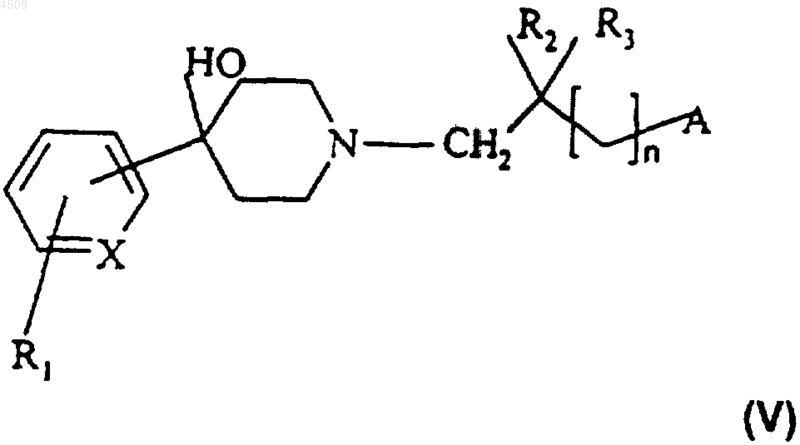
где X представляет собой N или CH;
R1 представляет собой атом водорода или галогена или группу CF3;
R2 и R3 независимо представляют собой атом водорода или метильную группу;
n равно 0 или 1;
A представляет собой группу формулы (a) или (b),
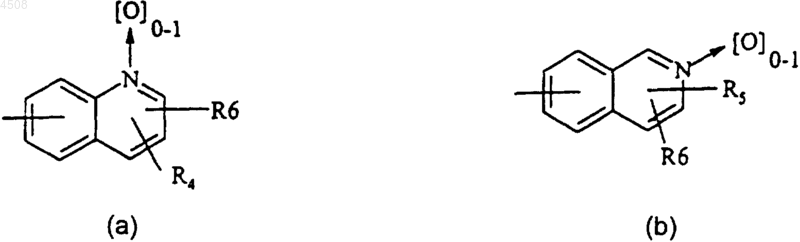
где R4 представляет собой атом водорода или галогена, (C1-C4)алкильную группу, группу CF3, аминогруппу, моно(C1-C4)алкиламиногруппу или ди(C1-C4)алкиламиногруппу;
R5 представляет собой атом водорода или галогена, (C1-C4)алкоксигруппу, (C1-C4)алкильную группу или группу CF3;
R6 представляет собой атом водорода, (C1-C4)алкильную группу или (C1-C4)алкоксигруппу;
а также его соли или сольваты.
14. Соединение формулы (IV)
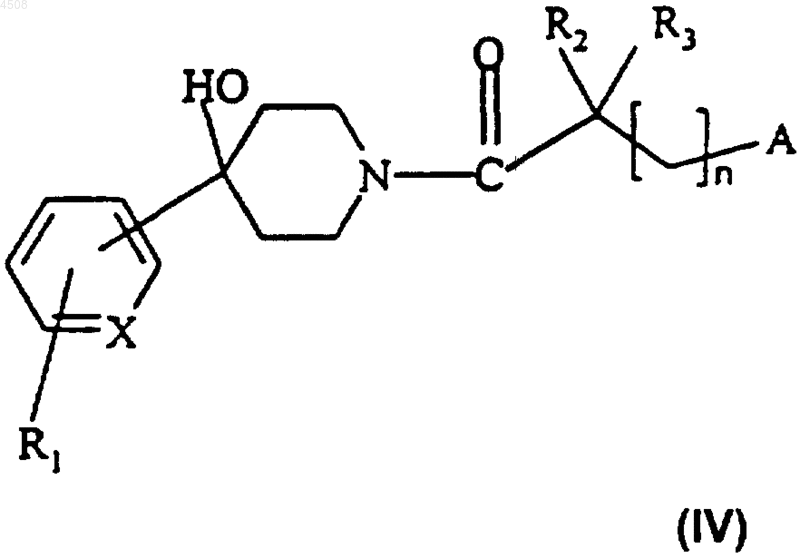
где X представляет собой N или CH;
R1 представляет собой атом водорода или галогена или группу CF3;
R2 и R3 независимо представляют собой атом водорода или метильную группу;
n равно 0 или 1;
A представляет собой группу формулы (a) или (b)
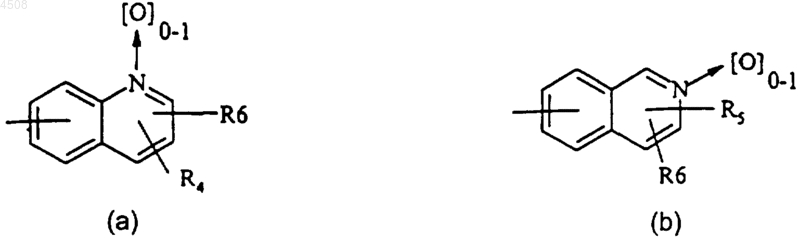
где R4 представляет собой атом водорода или галогена, (C1-C4)алкильную группу, группу CF3, аминогруппу, моно(C1-C4)алкиламиногруппу или ди(C1-C4)алкиламиногруппу;
R5 представляет собой атом водорода или галогена, (C1-C4)алкоксигруппу, (C1-C4)алкильную группу или группу CF3;
R6 представляет собой атом водорода, (C1-C4)алкильную группу или (C1-C4)алкоксигруппу;
а также его соли или сольваты.
15. Фармацевтическая композиция, содержащая в качестве активного начала соединение формулы (I) по пп.1-10 или его фармацевтически приемлемые соль или сольват.
16. Композиция по п.15, отличающаяся тем, что она содержит от 0,001 до 100 мг активного начала.
17. Применение соединения формулы (I) по пп.1-10 или его фармацевтически приемлемых соли или сольвата для приготовления аналгезирующих медицинских препаратов и/или медицинских препаратов, которые предназначены для лечения заболеваний, ассоциированных с иммунными и воспалительными расстройствами.
Текст
1 Настоящее изобретение относится к новым фенил- и пиридилтетрагидропиридинам, содержащим их фармацевтическим композициям,способу их получения и синтетическим промежуточным соединениям в этом способе. В US 5118691 и US 5620988 раскрыты тетрагидропиридины, замещенные 3-хинолилалкильным радикалом, которые демонстрируют дофаминергическую активность. В настоящее время обнаружено, что некоторые тетрагидропиридины, замещенные хинолинилалкильным или изохинолилалкильным радикалом, обладают значительной активностью в отношении модуляции ФНО-альфа (фактора некроза опухоли). ФНО-альфа является цитокином, который в последнее время вызывает интерес как медиатор иммунитета, воспаления, пролиферации клеток, фиброза и так далее. Этот медиатор присутствует в избытке в воспаленной синовиальной ткани и играет важную роль в патогенезе аутоиммунной реакции (Annu. Rep. Med. Chem.,1997.22:241-250). Таким образом, согласно одному из аспектов, настоящее изобретение относится к тетрагидропиридинам формулы (I)R1 представляет собой атом водорода или галогена или группу CF3;R2 и R3 независимо представляют собой атом водорода или метильную группу;n равно 0 или 1; А представляет собой группу формулы (а) или (b), где R4 представляет собой атом водорода или галогена, (С 1-С 4)алкильную группу, группу СF3,аминогруппу,моно(С 1-С 4)алкиламиногруппу или ди(С 1-С 4)алкиламиногруппу;R5 представляет собой атом водорода или галогена, (С 1-С 4)алкоксигруппу, (С 1-С 4)алкильную группу или группу СF3;R6 представляет собой атом водорода, (С 1 С 4)алкильную группу или (С 1-С 4)алкоксигруппу; а также их солям или сольватам. В настоящем описании термин "(С 1-С 4)алкил" обозначает одновалентный радикал насыщенного С 1-С 4 углеводорода с прямой или разветвленной цепью. 2 В настоящем описании термин "галоген" обозначает атом, выбранный из хлора, брома,иода и фтора. Предпочтительными являются соединения,в которых n равно нулю. Другими предпочтительными соединениями являются те, в которых R2 и R3 представляют собой водород. Другими предпочтительными соединениями являются те, в которых R1 представляет собой группу CF3. Другими предпочтительными соединениями являются те, в которых R1 представляет собой атом фтора. Другими предпочтительными соединениями являются те, в которых Х представляет собой CH, a R1 находится в положении 2 или 3 бензола. Другими предпочтительными соединениями являются те, в которых Х представляет собой СН, a R1 представляет собой группу CF3. Другими предпочтительными соединениями являются те, в которых Х представляет собой атом азота, а пиридин замещен в положениях 2 и 6. Согласно настоящему изобретению соединения формулы (I) могут существовать в виде(I) могут, в частности, нести N-оксидную группу на тетрагидропиридине или на хинолине или изохинолине группы А, или, альтернативно, двеN-окcидные группы могут присутствовать одновременно. Соли соединений формулы (I) по настоящему изобретению включают в себя как соли присоединения фармацевтически приемлемых неорганических или органических кислот, такие как гидрохлорид, гидробромид, сульфат, гидросульфат, дигидрофосфат, цитрат, малеат, тартрат, фумарат, глюконат, метансульфонат, 2 нафталинсульфонат и так далее, так и соли присоединения, которые позволяют удобно выделить или выкристаллизовать соединения формулы (I), такие как пикрат или оксалат, или соли присоединения оптически активных кислот,например, камфарсульфоновых кислот и миндальных кислот или замещенных миндальных кислот. Оптически чистые стереоизомеры и смеси изомеров соединений формулы (I) благодаря асимметрическому атому углерода, когда любойR2 или R3 является метилом, а другой является водородом, в любом соотношении, составляют часть настоящего изобретения. Соединения формулы (I) можно синтезировать с помощью способа, при котором где X и R1 являются такими, как определено выше, подвергают взаимодействию с функциональным производным кислоты формулы (III): где R2, R3, n и А являются такими, как определено выше,(б) восстанавливают карбонильную группу полученного таким образом соединения формулы (IV):(в) дегидратируют полученное таким образом промежуточное соединение пиперидинол формулы (V):(г) выделяют полученное таким образом соединение формулы (I) и возможно превращают в его соль или сольват или его N-оксидные производные. Взаимодействие на стадии (а) можно подходящим образом проводить в органическом растворителе при температуре в интервале от-10 С до температуры дефлегмации реакционной смеси. Может быть предпочтительно осуществлять взаимодействие без нагревания, если оно является экзотермическим, как, например, в случае использования хлорангидрида в качестве функционального производного кислоты формулы (III). Подходящие функциональные производные кислоты формулы (III), которые можно использовать, являются свободной кислотой, возможно активированной (например с помощью ВОР=трис(диметиламино)бензотриазол-1 илоксифосфонийгексафторфосфат),ангидридом, смешанным ангидридом, активным эфиром или галогенангидридом кислоты, предпочтительно бромангидридом. Одним особенно предпочтительным среди активных эфиров является 4 сложный п-нитрофениловый эфир, однако, также подходящими являются сложные метоксифениловый, тритиловый и бензгидриловый эфиры и тому подобные. Предпочтительно используемым растворителем для реакции является галогенированный растворитель, такой как метиленхлорид, дихлорэтан, 1,1,1-трихлорэтан, хлороформ и тому подобные, но также можно использовать другие органические растворители, которые совместимы с используемыми реагентами, например диоксан, тетрагидрофуран или углеводород, такой как гексан. Взаимодействие можно удобно проводить в присутствии акцептора протонов, например карбоната щелочного металла или третичного амина, такого как триэтиламин. Восстановление на стадии (б) можно удобно проводить, используя подходящие восстановители, такие как комплексы боранов, например диметилсульфид/боран ([СН 3]2S-ВН 3),гидриды алюминия или комплекс алюмогидрида лития в инертном органическом растворителе, при температуре в интервале от 0 С до температуры дефлегмации реакционной смеси, в соответствии с обычными способами. Выражение "инертный органический растворитель" означает растворитель, который не препятствует реакции. Такими растворителями являются, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), диоксан или 1,2-диметоксиэтан. Согласно одной предпочтительной процедуре, способ осуществляют с использованием диметилсульфида/борaна, используемого в избытке относительно исходного соединения (II) при температуре дефлегмации, возможно в инертной атмосфере. Восстановление обычно завершается через несколько часов. Дегидратацию на стадии (в) легко проводят, например, используя смесь уксусная кислота/серная кислота, при температуре в интервале от комнатной температуры до температуры дефлегмаций используемого растворителя. Согласно предпочтительному способу, реакцию на стадии (в) проводят в смеси уксусная кислота/серная кислота в соотношении 3/1 по объему путем нагревания до температуры примерно 100 С в течение 1-3 ч. Желаемое соединение выделяют в соответствии с обычными методиками в форме свободного основания или его соли. Свободное основание можно превратить в одну из его солей с помощью простого образования соли в органическом растворителе, таком как спирт,предпочтительно этанол или изопропанол, простой эфир, такой как 1,2-диметоксиэтан, этилацетат, ацетон или углеводород, такой как гексан. Полученное соединение формулы (I) выделяют в соответствии с обычными методиками 5 и возможно превращают в его соль или сольват или в его N-оксидные производные. Соединения формулы (I) также можно получить с помощью реакции сочетания/восстановления, используя в качестве исходного соединения соединение формулы (VI) где R2, R3, n и А являются такими, как определено выше, выделения соединения формулы (I) и возможного превращения в его соль или сольват или в его N-оксидные производные. Реакцию сочетания/восстановления проводят в соответствии с обычными способами путем смешивания исходных соединений (VI) и(VII) в органическом растворителе, таком как спирт, такой как, например, метанол, в кислой среде в присутствии восстановителя, такого как цианоборогидрид натрия. Исходные соединения формул (II), (III) и(VI) известны или же их можно получить аналогичным способом, как и для известных соединений. Такие продукты описаны, например, вWO 97/01536; J. Am. Chem. Soc., 1948, 70:28432847; J. Med. Chem., 1997, 40 (7): 1049. Соединения формул (IV), (V) и (VII) являются новыми соединениями и составляют другой аспект настоящего изобретения. Соединения формулы (VII) можно получить путем нагревания трифторметилсульфонильного производного (также известного как"трифлат") подходящего гидрокси(изо)хинолина с N,N-диалкилэтаноламиновиниловым эфиром в присутствии палладиевого катализатора и сильного основания, такого как, например, триэтиламин, и путем взаимодействия полученного таким образом промежуточного соединения с концентрированной серной кислотой, в соответствии с обычными процедурами. Примеры такого способа приведены в экспериментальной части. Альтернативно, соединения формулы (VII) можно получить путем восстановления соответствующих кислот формулы (III) в соответствии с хорошо известными способами. Соединения формулы (I), несущие Nоксидную группу на атоме азота хинолина или изохинолина, можно получить из N-оксидных производных соединений формулы (III) или(VII). Примеры таких синтезов приведены в экспериментальной части. Соединения формулы (I), несущие N-оксидную группу на атоме азота тетрагидропиридина, можно получить путем окисления соот 004508 6 ветствующих соединений формулы (I). В этом случае соединение формулы (I), полученное путем вышеуказанного синтеза, подвергают реакции окисления согласно обычным способам, например согласно реакции с метахлорпербензойной кислотой в подходящем растворителе, и выделяют в соответствии с обычными методиками, которые хорошо известны специалистам в данной области техники. Соединения по изобретению имеют предпочтительные свойства в отношении ингибирования ФНО-. Эти свойства демонстрировали с помощью теста, предназначенного для измерения воздействия молекул на синтез ФНО-, индуцируемый у мышей Balb/c липополисахаридом (ЛПС) изEscherichia Coli (055:B5, Sigma, St. Louis, Mo). Исследуемые продукты вводят перорально группам, состоящим из пяти самок мышейBalb/c в возрасте от 7 до 8 недель (Charles River,France). Через 1 ч внутривенно вводят ЛПС (10 мкг/мышь). Кровь каждого животного отбирают через 1,5 ч после введения ЛПС. Образцы центрифугируют, плазму выделяют и замораживают при -80 С. ФНО- измеряют, используя имеющиеся в продаже наборы (R and D, Abingdon, UK). В этом тесте было обнаружено, что показательные соединения по изобретению являются очень активными, ингибируя синтез ФНОдаже в очень низких дозах. Благодаря этой активности и низкой токсичности, соединения формулы (I) и их соли или сольваты можно применять в лечении заболеваний, ассоциированных с иммунным и воспалительным расстройствами, или в качестве аналгезирующих средств. В частности, соединения формулы (I) можно применять для лечения атеросклероза, аутоиммунных заболеваний,заболеваний, вызывающих демиелинизацию нейронов (таких как множественный склероз),астмы, ревматоидного артрита, фиброзных заболеваний, идиопатического фиброза легких,фиброзно-кистозной дегенерации, гломерулонефрита, ревматоидного спондилита, остеоартрита, подагры, резорбции кости и хряща, остеопороза, болезни Педжета, множественной миеломы, увеоретинита, септического шока, септицемии,эндотоксинового бактериальнотоксического шока, гомологичной болезни, отторжения трансплантата, респираторного дистресс-синдрома взрослых, силикоза, асбестоза,легочного саркоидоза, болезни Крона, неспецифического язвенного колита, бокового амиотрофического склероза, болезни Альцгеймера,болезни Паркинсона, диссеминированной красной волчанки, гемодинамического шока, ишемических патологий (инфаркта миокарда, миокардиальной ишемии, коронарного вазоспазма,грудной жабы, сердечной недостаточности, сердечного приступа), постишемических реинфу 7 зионных приступов, малярии, микобактериальных инфекций, менингита, проказы, вирусных инфекций (вируса иммунодефицита человека(ВИЧ), вируса цитомегалии, вируса герпеса),условно-патогенных инфекций, ассоциированных с синдромом приобретенного иммунодефицита (СПИДом), туберкулеза, псориаза, атопического дерматита и контактного дерматита,диабета, кахексии, рака и повреждения, опосредованного излучением. Соединения формулы (I) и их фармацевтически приемлемые соли и сольваты предпочтительно вводят перорально. В фармацевтических композициях по настоящему изобретению для перорального применения активное начало можно вводить в стандартных формах для введения, в виде смеси с обычными фармацевтическими носителями,животным и людям для лечения вышеупомянутых заболеваний. Подходящие стандартные формы для введения включают в себя, например, таблетки, которые можно разделить, гелевые капсулы, порошки, гранулы и растворы или суспензии для перорального применения. Когда готовят твердую композицию в форме таблеток, то главный активный ингредиент смешивают с фармацевтическим наполнителем, таким как желатин, крахмал, лактоза,стеарат магния, тальк, аравийская камедь или тому подобные. Таблетки могут быть покрыты сахарозой или другими подходящими веществами или, альтернативно, они могут быть обработаны так, что будут иметь длительную или замедленную активность и непрерывно будут высвобождать предопределенное количество активного начала. Препарат в форме гелевых капсул готовят путем смешивания активного ингредиента с разбавителем и заполнения полученной смесью мягких или твердых гелевых капсул. Препарат в форме сиропа или эликсира может содержать активный ингредиент вместе с подсластителем, предпочтительно подсластителем, не содержащим калорий, метилпарабеном и пропилпарабеном в качестве антисептических агентов, а также корригентом и подходящим красителем Диспергируемые в воде порошки или гранулы могут содержать активный ингредиент в виде смеси с диспергирующими агентами, или увлажняющими агентами, или суспендирующими агентами, такими как поливинилпирролидон, а также подсластителями или усилителями вкуса и запаха. Активное начало также может быть приготовлено в форме микрокапсул, возможно с одним или более чем одним носителем или добавкой. В фармацевтических композициях по настоящему изобретению активное начало также может быть в форме комплекса включения в 8 циклодекстрины или их простые или сложные эфиры. Вводимое количество активного начала зависит, как всегда, от степени течения заболевания, а также возраста и массы пациента. Однако стандартные дозы обычно содержат от 0,001 до 100 мг, еще лучше от 0,01 до 50 мг, а предпочтительно от 0,1 до 20 мг активного начала, преимущественно от 0,5 до 10 мг. Согласно другому аспекту настоящее изобретение относится к комбинации, содержащей соединение формулы (I) или его фармацевтически приемлемые соль или сольват и по меньшей мере одно соединение, выбранное из иммунодепрессантов, таких как интерферон бета-1b; адренокортикотропного гормона; глюкокортикоидов, таких как преднизон или метилпреднизолон; ингибиторов интерлейкина-1. Более подробно, изобретение относится к комбинации, содержащей соединение формулы(I) или его фармацевтически приемлемые соль или сольват и по меньшей мере одно соединение, выбранное из роквинимекса (roquinimex)(продукт от компании Autoimmune, содержащий бычий миелин), антегрена (моноклональное человеческое антитело от компаний Elan/AthenaNeurosciences) и рекомбинантного интерферона бета-1b. Другие возможные комбинации представляют собой комбинации, состоящие из соединения формулы (I) или его фармацевтически приемлемых соли или сольвата и блокатора калиевого канала, такого как, например, фампридин(fampridine) (4-аминопиридин). Согласно другому аспекту, настоящее изобретение относится к способу лечения заболеваний, ассоциированных с иммунными и воспалительными расстройствами, а также лечению бoли, в частности, атеросклероза, аутоиммунных заболеваний, заболеваний, вызывающих демиелинизацию нейронов (таких как множественный склероз), астмы, ревматоидного артрита, фиброзных заболеваний, идиопатического фиброза легких, фиброзно-кистозной дегенерации, гломерулонефрита, ревматоидного спондилита, остеоартрита, подагры, резорбции кости и хряща, остеопороза, болезни Педжета, множественной миеломы, увеоретинита, септического шока, септицемии, эндотоксинового бактериально-токсического шока, гомологичной болезни, отторжения трансплантата, респираторного дистресс-синдрома взрослых, силикоза, асбестоза, легочного саркоидоза, болезни Крона, неспецифического язвенного колита, бокового амиотрофического склероза, болезни Альцгеймера, болезни Паркинсона, диссеминированной красной волчанки, гемодинамического шока,ишемических патологий (инфаркта миокарда,миокардиальной ишемии, коронарного вазоспазма, грудной жабы, сердечной недостаточно 9 сти, сердечного приступа), постишемических реинфузионных приступов, малярии, микобактериальных инфекций, менингита, проказы, вирусных инфекций (ВИЧ, вируса цитомегалии,вируса герпеса), условно-патогенных инфекций,ассоциированных со СПИДом, туберкулеза,псориаза, атопического дерматита и контактного дерматита, диабета, кахексии, рака и повреждения, опосредованного излучением, при котором вводят соединение формулы (I) или его фармацевтически приемлемые соль или сольват отдельно или в комбинации с другими активными началами. Следующие примеры иллюстрируют изобретение. Получение 1. 7-Изохинолилацетальдегид. Охлаждают 1,5 г (0,0103 моль) 7-гидроксиизохинолина и 5,3 мл пиридина до 0 С. Добавляют по каплям 1,86 мл ангидрида трифторметансульфокислоты. Смесь перемешивают в течение 1 ч при 0 С и затем в течение 2 ч при комнатной температуре. Полученную смесь выливают в смесь воды и льда и экстрагируют этилацетатом, органическую фазу сушат и растворитель выпаривают при пониженном давлении. Сырой продукт очищают с помощью хроматографии на силикагелевой колонке, элюируя смесью циклогексан/этилацетат в соотношении 7/3. 7-Гидроксиизохинолинтрифторметансульфонат получают в форме масла. В атмосфере аргона 1,65 г этого продукта смешивают с 27,5 мл безводного диметилформамида, 41 мг ацетата палладия, 1,65 мл безводного триэтиламина и 1,38 г N,N-диэтилэтаноламиновинилового эфира. Эту смесь нагревают при 80 С в течение 36 ч. Полученную смесь выливают в смесь воды и этилацетата. Две фазы разделяют, органическую фазу промывают водой и сушат. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на силикагелевой колонке, элюируя смесью этилацетат/метанол в соотношении 9/1. Получают 2-[2(7-изохинолил(этенил)окси)]-N,N-диэтил-1-этанамин. 1,5 г этого продукта обрабатывают 130 мл воды и 13 мл 96% серной кислоты. Эту смесь нагревают в течение 4,5 ч при 60C и выливают в лед. Добавляют насыщенный водный растворNаНСО 3 и смесь экстрагируют этилацетатом. Органическую фазу сушат и растворитель выпаривают при пониженном давлении. Получают указанное в заголовке соединение. Получение 2. 6-Изохинолилацетальдегид. Осуществляя синтез, как описано в получении 1, но используя 6-гидроксиизохинолин,получают указанное в заголовке соединение. Получение 3. 7-ИзохинолилацетальдегидN-оксид. Смешивают вместе 14 мл воды, 3,5 мл 96% серной кислоты и 400 мг 2-[2-(7-изохинолил(этенил)окси)]-N,N-диэтил-1-этанамина, полученного в качестве промежуточного продукта в получении 1. Добавляют 24 мл метанола и эту 10 смесь нагревают в течение 5,5 ч при б 5 С. Полученную смесь выливают в лед, добавляют насыщенный водный раствор NаНСО 3 и смесь экстрагируют этилацетатом. Органическую фазу сушат и растворитель выпаривают при пониженном давлении. Продукт очищают с помощью хроматографии на силикагелевой колонке,элюируя смесью циклогексан/этилацетат в соотношении 1/1,с получением 7-(2,2 диметоксиэтил)изохинолина. Растворяют 100 мг этого продукта в 15 мл метиленхлорида и добавляют 135 мг мета-хлорпербензойной кислоты (МХПБК), затем перемешивают в течение 3 ч при комнатной температуре. Смесь разбавляют метиленхлоридом, добавляют водный раствор бикарбоната натрия до нейтрального значения рН, полученную смесь экстрагируют метиленхлоридом. Органические экстракты сушат над сульфатом натрия, фильтруют и растворитель выпаривают при пониженном давлении с получением 7-(2,2-диметоксиэтил)-изохинолинN-оксида. Растворяют 105 мг этого продукта в 0,2 мл метиленхлорида и при температуре 0 С добавляют 0,4 мл смеси трифторуксусная кислота/вода в соотношении 1/1. Смесь перемешивают при 0 С в течение 2 ч и затем при комнатной температуре в течение ночи. Добавляют метиленхлорид, смесь промывают раствором бикарбоната натрия до слабощелочного значения рН, органическую фазу сушат над сульфатом натрия, фильтруют и растворитель выпаривают при пониженном давлении. Получают указанный в заголовке продукт. Пример 1. 6-(2-(4-(3-Трифторметилфенил)1,2,3,6-тетрагидропирид-1-ил)этил)хинолин и его гидрохлорид. 1 а) 1-(4-Гидрокси-4-(3-трифторметилфенил)-1-пиперидил)-2-(6-хинолил)-1-этанон. Перемешивают в течение ночи смесь 2,8 г(0,0015 моль) 4-гидрокси-4-(3-трифторметилфенил)пиперидина, 6,63 г (0,015 моль) ВОР и 5,3 мл триэтиламина в 60 мл метиленхлорида. Добавляют 100 мл этилацетата, смесь промывают водой и 1 н раствором гидроксида натрия, сушат над сульфатом натрия и растворитель выпаривают. Получают 5,9 г указанного в заголовке соединения. 1 б) 6-(2-(4-Гидрокси-4-(3-трифторметилфенил)-1-пиперидил)этил)хинолин. Полученный в примере 1 а продукт растворяют в 70 мл безводного ТГФ, нагревают до температуры дефлегмации и добавляют 4,05 мл(0,0427 моль) смеси диметилсульфид/боран в 50 мл ТГФ. Эту смесь перемешивают в течение 15 мин при комнатной температуре, а затем в течение 30 мин при температуре дефлегмации. Растворитель выпаривают и остаток растворяют в смеси этилацетат/разбавленный NH4 ОH. Две фазы разделяют и органическую фазу промывают водой. Ее сушат над сульфатом натрия и растворитель выпаривают при пониженном дав 11 лении. Сырой продукт очищают с помощью хроматографии на силикагелевой олонке, элюируя смесью этилацетат/метанол в соотношении 9/1. Получают 1,95 г указанного в заголовке продукта. Температура плавления (Т.пл.)=140142 С. 1 в) 6-(2-(4-(3-Трифторметилфенил)-1,2,3,6 тетрагидропирид-1-ил)этил)хинолин и его гидрохлорид. Растворяют 1,1 г полученного на предыдущей стадии продукта в 12 мл уксусной кислоты, добавляют 3,0 мл концентрированной серной кислоты и смесь нагревают при 100 С в течение 2 ч. Полученную смесь выливают в лед,добавляют разбавленный NH4 ОH и эту смесь экстрагируют этилацетатом. Органические экстракты промывают водой, сушат и упаривают при пониженном давлении. Сырой продукт очищают с помощью хроматографии, элюируя этилацетатом. Получают указанное в заголовке соединение. Гидрохлорид получают, используя раствор изопропанола,насыщенный соляной кислотой. Т.пл. (гидрохлорид)=220-222 С. Пример 2. 7-(2-(4-(3-Трифторметилфенил)1,2,3,6-тетрагидропирид-1-ил)этил)хинолин и его дигидрат дигидрохлорида. Осуществляя синтез, как описано в примере 1, но используя 7-хинолилуксусную кислоту вместо 6-хинолилуксусной кислоты, получают указанные в заголовке соединения. Т.пл. (дигидрат дигидрохлорида)=216-218 С. Пример 3. 7-(2-(4-(3-Трифторметилфенил)1,2,3,6-тетрагидропирид-1-ил)этил)изохинолин и его дигидрат дигидрохлорида. Смешивают вместе 1,75 г (0,0077 моль) 4(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина, 30 мл метанола, 1,15 мл ледяной уксусной кислоты и 0,73 г безводного этилацетата. Смесь охлаждают до 0-5 С и добавляют 1,14 г 7 изохинолилацетальдегида (получение 1), затем осторожно добавляют 1,1 г (0,0175 моль) цианоборогидрида натрия. Смесь перемешивают в течение 1,5 ч при 0-5 С, а затем в течение ночи при комнатной температуре. Добавляют 7 мл концентрированной соляной кислоты, полученную смесь перемешивают в течение 10 мин,растворитель выпаривают при пониженном давлении и остаток растворяют в смеси этилацетат/разбавленный NH4OH. Органическую фазу сушат над сульфатом натрия, фильтруют и растворитель выпаривают. Остаток очищают на силикагелевой колонке, элюируя смесью этилацетат/метанол в соотношении 9/1. Получают указанное в заголовке соединение. Гидрохлорид получают, используя раствор изопропанола,насыщенный соляной кислотой. Получают 1,1 г продукта. Т.пл. (дигидрат дигидрохлорида)=230-233 С. Пример 4. 6-(2-(4-(3-Трифторметилфенил)1,2,3,6-тетрагидропирид-1-ил)этил)изохинолин и его дигидрат дигидрохлорида.(получение 2) вместо 7-изохинолилацетальдегида и 4-(3-фторфенил)-1,2,3,6-тетрагидропиридин вместо 4-(3-трифторметилфенил)-1,2,3,6 тетрагидропиридина, получают указанные в заголовке соединения. Т.пл. (дигидрохлорид)=242-244 С. Пример 6. 7-(2-(4-(3-Фторфенил)-1,2,3,6 тетрагидропирид-1-ил)этил)изохинолин и его дигидрохлорид. Осуществляя синтез, как описано в примере 3, но используя 4-(3-фторфенил)-1,2,3,6-тетрагидропиридин вместо 4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина,получают указанные в заголовке соединения. Т.пл. (дигидрохлорид)=227-229 С. Пример 7. 7-(2-(4-Фенил-1,2,3,6-тетрагидропирид-1-ил)этил)изохинолин и его дигидрохлорид. Осуществляя синтез, как описано в примере 3, но используя 4-фенил-1,2,3,6-тетрагидропиридин вместо 4-(3-трифторметилфенил)1,2,3,6-тетрагидропиридина, получают указанные в заголовке соединения. Т.пл. (дигидрохлорид)=259-261 С. Пример 8. 6-(2-(4-(3-Фторфенил)-1,2,3,6 тетрагидропирид-1-ил)этил)хинолин и его дигидрохлорид. Осуществляя синтез, как описано в примере 1, но используя 4-гидрокси-4-(3-фторфенил) пиперидин вместо 4-гидрокси-4-(3-трифторметилфенил)пиперидина, получают указанные в заголовке соединения. Т.пл. (дигидрохлорид)=216-218 С. Пример 9. 7-(2-(4-(3-Трифторметилфенил)1,2,3,6-тетрагидропирид-1-оксидо-1-ил)этил)хинолин и его гидрохлорид. К раствору 0,19 г (0,5 ммоль) 7-(2-(4-(3 трифторметилфенил)-1,2,3,6-тетрагидропирид 1-ил)этил)изохинолина в 25 мл метиленхлорида добавляют 0,086 г мета-хлорпербензойной кислоты при температуре 0-5 С. Смесь перемешивают при 0-5 С в течение 2 ч, промывают насыщенным водным раствором бикарбоната натрия и две фазы разделяют. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении. Продукт очищают с помощью флэш-хроматографии,элюируя смесью метанол/этилацетат в соотношении 1/1, с получением указанного в заголовке продукта. Гидрохлорид получают, используя 13 раствор изопропанола, насыщенный соляной кислотой. Т.пл. (гидрохлорид)=166-168 С. Пример 10. 7-(2-(4-(3-Трифторметилфенил)-1,2),3,6-тетрагидропирид-1-ил)этил)изохинолин-N-оксид и его гидрохлорид. Осуществляя синтез, как описанo в примере 3, но используя 7-изохинолилацетальдегидN-оксид (получение 3) вместо 7-изохинолилацетальдегида, получают указанные в заголовке соединения. Т.пл. (гидрохлорид)=198-201 С. Пример 11. 7-(2-(4-(6-Трифторметилпирид-2-ил)-1,2,3,6-тетрагидропирид-1-ил)этил) изохинолин и его дигидрат дигидрохлорида. Смешивают вместе 0,650 г (0,0028 моль) 4(6-трифторметил-2-пиридил)-1,2,3,6 тетрагидропиридина, 16 мл метанола, 0,693 г ацетата натрия, 1,6 мл уксусной кислоты и 1,05 г 7-изохинолилацетальдегида (получение 1) в 16 мл метанола. Эту смесь охлаждают до 0-5 С и через 10 мин осторожно добавляют 1,06 г цианоборогидрида натрия. Полученную смесь перемешивают в течение 30 мин при 0-5 С, а затем в течение ночи при комнатной температуре. Добавляют 7 мл концентрированной соляной кислоты, смесь перемешивают в течение 30 мин, растворитель выпаривают при пониженном давлении и остаток растворяют в смеси диэтиловый эфир/разбавленный NH4 ОH до щелочного значения рН. Органическую фазу сушат над сульфатом натрия, фильтруют и растворитель выпаривают. Остаток очищают с помощью флэш-хроматографии на силикагелевой колонке, элюируя смесью этилацетат/метанол в соотношении 9/1. Получают указанное в заголовке соединение (основание) в форме масла. Гидрохлорид получают, используя раствор изопропанола, насыщенный соляной кислотой. Указанное в заголовке соединение получают в форме его соли дигидрата дигидрохлорида. Т.пл. (дигидрат дигидрохлорида)=203-206C. Пример 12. 6-(2-(4-(6-Трифторметилпирид-2-ил)-1,2,3,6-тетрагидропирид-1-ил)этил) изохинолин и его дигидрохлорид. Осуществляя синтез, как описано в примере 11, но используя 6-изохинолилацетальдегид вместо 7-изохинолилацетальдегида, получают указанные в заголовке соединения. Т.пл. (дигидрохлорид)=190-195 С. Пример 13. 7-(2-(4-(6-Хлорпирид-2-ил)1,2,3,6-тетрагидропирид-1-ил)этил)изохинолин и его дигидрохлорид. Осуществляя синтез, как описано в примере 11, но используя 4-(6-хлор-2-пиридил)1,2,3,6-тетрагидропиридин вместо 4-(6-трифторметил-2-пиридил)-1,2,3,6-тетрагидропиридина,получают указанные в заголовке соединения. Т.пл. (дигидрохлорид)=110-112 С. Пример 14. 7-(2-(4-(3-Трифторметилфенил)-1,2,3,6-тетрагидропирид-1-ил)этил)-1,3 диметилизохинолин и его дигидрохлорид. Осуществляя синтез, как описано в примере 3, но используя 1,3-диметил-7-изохинолил 004508 16 8. Соединение по пп.1-3, где Х представляет собой атом азота, а пиридин замещен в положениях 2 и 6. 9. Соединение по пп.1-8, выбранное из его моно-N-оксидных и бис-N-оксидных производных. 10. Соединение по п.1, выбранное из 7-(2(4-(3-трифторметилфенил)-1,2,3,6-тетрагидро-1 пиридил)этил)изохинолина, его моно-N-оксидных и бис-N-оксидных производных и их солей и сольватов. 11. Способ получения соединения по п.1,отличающийся тем, что проводят реакцию сочетания/восстановления между соединением формулы (VI)R1 представляет собой атом водорода или галогена или группу СF3;R2 и R3 независимо представляют собой атом водорода или метильную группу;n равно 0 или 1; А представляет собой группу формулы (а) или (b) где R4 представляет собой атом водорода или галогена, (С 1-С 4)алкильную группу, группу СF3,аминогруппу,моно(С 1-С 4)алкиламиногруппу или ди(С 1-С 4)алкиламиногруппу;R5 представляет собой атом водорода или галогена, (С 1-С 4)алкоксигруппу, (С 1-С 4)алкильную группу или группу СF3;R6 представляет собой атом водорода, (С 1 С 4)алкильную группу или (С 1-С 4)алкоксигруппу; а также его соли или сольваты. 2. Соединение по п.1, где n равно нулю. 3. Соединение по п.1 или 2, где R2 и R3 представляют собой водород. 4. Соединение по пп.1-3, где R1 представляет собой группу СF3. 5. Соединение по пп.1-3, где R1 представляет собой атом фтора. 6. Соединение по пп.1-3, где Х представляет собой СН, а R1 находится в положении 3 бензола. 7. Соединение по пп.1-3, где Х представляет собой СН, а R1 находится в положении 2 бензола. где R2, R3, n и А являются такими, как определено в п.1, и соединение формулы (I) выделяют и возможно превращают в его соль или сольват или его N-оксид. 12. Способ получения соединения по п.1,отличающийся тем, что а) соединение формулы (II) где Х и R1 являются такими, как определено в п.1, подвергают взаимодействию с функциональным производным кислоты формулы (III) где R2, R3, n и А являются такими, как определено в п.1,б) карбонильную группу полученного таким образом соединения формулы (IV) восстанавливают,в) полученное таким образом промежуточное соединение пиперидинол формулы (V) дегидратируют,г) полученное таким образом соединение формулы (I) выделяют и возможно превращают в его соль или сольват или его N-оксидные производные. 13. Соединение формулы (V)R1 представляет собой атом водорода или галогена или группу СF3;R2 и R3 независимо представляют собой атом водорода или метильную группу;n равно 0 или 1; А представляет собой группу формулы (а) или (b), где R4 представляет собой атом водорода или галогена, (С 1-С 4)алкильную группу, группу СF3,аминогруппу,моно(С 1-С 4)алкиламиногруппу или ди(С 1-С 4)алкиламиногруппу;R5 представляет собой атом водорода или галогена, (С 1-С 4)алкоксигруппу, (С 1-С 4)алкильную группу или группу CF3;R6 представляет собой атом водорода, (С 1 С 4)алкильную группу или (С 1-С 4)алкоксигруппу; а также его соли или сольваты. 14. Соединение формулы (IV)R1 представляет собой атом водорода или галогена или группу CF3;R2 и R3 независимо представляют собой атом водорода или метильную группу;n равно 0 или 1; А представляет собой группу формулы (а) или (b) где R4 представляет собой атом водорода или галогена, (С 1-С 4)алкильную группу, группу СF3,аминогруппу,моно(С 1-С 4)алкиламиногруппу или ди(С 1-С 4)алкиламиногруппу;R5 представляет собой атом водорода или галогена, (С 1-С 4)алкоксигруппу, (С 1-С 4)алкильную группу или группу СF3;R6 представляет собой атом водорода, (С 1 С 4)алкильную группу или (С 1-С 4)алкоксигруппу; а также его соли или сольваты. 15. Фармацевтическая композиция, содержащая в качестве активного начала соединение формулы (I) по пп.1-10 или его фармацевтически приемлемые соль или сольват. 16. Композиция по п.15, отличающаяся тем, что она содержит от 0,001 до 100 мг активного начала. 17. Применение соединения формулы (I) по пп.1-10 или его фармацевтически приемлемых соли или сольвата для приготовления аналгезирующих медицинских препаратов и/или медицинских препаратов, которые предназначены для лечения заболеваний, ассоциированных с иммунными и воспалительными расстройствами.
МПК / Метки
МПК: A61P 9/00, C07D 401/06, A61K 31/4709
Метки: фенил, активностью, ингибирующей, отношении, некроза, фактора, обладающие, фно, опухоли, пиридил-тетрагидропиридины
Код ссылки
<a href="https://eas.patents.su/10-4508-fenil-i-piridil-tetragidropiridiny-obladayushhie-ingibiruyushhejj-aktivnostyu-v-otnoshenii-faktora-nekroza-opuholi-fno.html" rel="bookmark" title="База патентов Евразийского Союза">Фенил- и пиридил-тетрагидропиридины, обладающие ингибирующей активностью в отношении фактора некроза опухоли (фно)</a>
Предыдущий патент: Новые спиросоединения
Следующий патент: Днк, кодирующая белок-7 морфогенеза кости человека, содержащая промоторную область гена, кодирующего данный белок, и способ ее получения
Случайный патент: Твердые принимаемые внутрь лекарственные композиции на основе s-аденозилметионина (same) или никотинамидадениндинуклеотида (nadh) и способ их получения














