Соединения диосметина, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 15424
Опубликовано: 31.08.2011
Авторы: Лефулон Франсуа, Сансильвестри-Морель Патрисия, Вержбицкий Мишель, Пайзан Жером, Буссар Мари-Франсуа, Вербёрен Тони, Рюпэн Ален
Формула / Реферат
1. Соединение формулы (I)
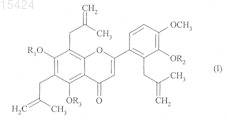
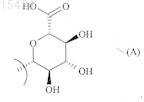
где R1, R2 и R3могут быть одинаковыми или различными и каждый представляет собой атом водорода или группу формулы (А)
2. Соединение формулы (I) по п.1, выбранное из
6,8,2'-трис-(изобут-2-ен-1-ил)диосметина,
(5-гидрокси-2-[3-гидрокси-4-метокси-2-(изобут-2-ен-1-ил)фенил]-6,8-бис-(изобут-2-ен-1-ил)-4-оксо-4H-хромен-7-ил)-бета-D-глюкуроновой кислоты и
3-[5,7-дигидрокси-6,8-бис-(изобут-2-ен-1-ил)-4-оксо-4H-хромен-2-ил]-6-метокси-2-(изобут-2-ен-1-ил)фенил-бета-D-глюкуроновой кислоты.
3. Способ получения соединений формулы (I) по п.1, включающий взаимодействие диосметина формулы (II)
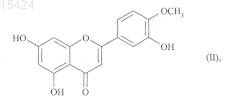
с металлилбромидом с получением соединения формулы (III)
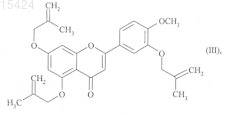
нагревание которого приводит к получению соединения формулы (Ia), частного случая соединений формулы (I), в которых R1, R2и R3, каждый, представляют собой атом водорода
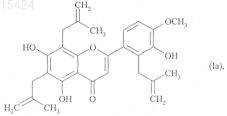
которое, если является желательным получение других соединений формулы (I), подвергают взаимодействию с соединением формулы (IV)
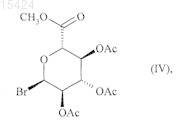
где Ас представляет собой ацетильную группу,
с последующим снятием защиты с функциональной кислотной группы и спиртовых функциональных групп с группы (А), как определено в п.1, с получением соединений формулы (I), в которых по меньшей мере один из R1, R2и R3 отличается от Н.
4. Фармацевтическая композиция, содержащая в качестве активного компонента соединение формулы (I) по п.1 или 2 в сочетании с одним или несколькими фармацевтически приемлемыми, нетоксичными, инертными носителями или разбавителями.
5. Применение соединения по п.1 или 2 для приготовления лекарственных средств для предотвращения или лечения заболеваний вен, для предотвращения или лечения посттромботического синдрома, сосудистых осложнений, связанных с диабетом, гипертонией, атеросклерозом, воспалением, метаболическим синдромом, связанным с ожирением, сосудистых осложнений, связанных с ожирением, стенокардией, артериитов нижних конечностей или острых сосудистых расстройств головного мозга, для заживления хронических ран, включая главным образом венозные или смешанные язвы голени и диабетическую стопу, для лечения или предотвращения геморроидальных приступов, для лечения или предотвращения пролежней и для лечения рассеянного склероза.
6. Применение соединения по п.1 или 2 для приготовления лекарственных средств для предотвращения или лечения хронического заболевания вен.
Текст
Дата публикации и выдачи патента Номер заявки СОЕДИНЕНИЯ ДИОСМЕТИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ ИХ СОДЕРЖАТ где R1, R2 и R3 могут быть одинаковыми или разными, каждый представляет собой атом водорода или группу формулы (А) и их применение для получения лекарственных средств для лечения заболеваний вен.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) 015424 Настоящее изобретение относится к новым соединениям диосметина, способу их получения и фармацевтическим композициям, которые их содержат. Соединения диосметина и их активность для лечения венозной недостаточности раскрыты в описании к патенту ЕР 0709383. Соединения по изобретению являются ингибиторами молекул адгезии, ингибиторами NADPH оксидазы и антиагрегантными средствами. Свойства ингибирования адгезии лейкоцитов и ингибирования NADPH оксидазы являются важными для лечения хронических заболеваний вен, принимая во внимание тот факт, что при этой патологии в воспалении микроциркуляторной сети нижних конечностей задействуется инфильтрация лейкоцитамиtreatment of chronic venous insufficiency, 2000, Microcirculation, 7, S41-S48). Свойство ингибировать агрегацию тромбоцитов свидетельствует об антитромботическом потенциале соединений согласно изобретению, не только для предотвращения и лечения венозных и артериальных тромбозов, но также и для лечения хронических заболеваний вен, при которых тромбоциты могут активироваться медиаторами воспаления, или у пациентов, имеющих посттромботический синдром. Установлено, что при хронических заболеваниях вен наблюдается наличие микроангиопатии капилляров/венул. Эта микроангиопатия является следствием венозной гипертонии и вызывает проблемы,связанные с фильтрацией капилляров/венул (повышенная проницаемость) и, следовательно, микроотеки(Barbier и др., Microcirculation and rheology, 1994, Presse med., 23, 213-224). В различных исследованиях было показано, что вовлечение активации клеток эндотелия в венозную гипертонию связано с повышением уровня молекул адгезии в циркулирующей крови (Saharay M., Shields D.A., Georgiannos S.N. и др.,Endothelial activation in patients with chronic venous disease, 1998, Eur. J. Vasc. Surg., 15, 342-349; Verbeurenvenous insufficiency, 2000, Microcirculation, 7, S41-S48). Соединения согласно настоящему изобретению обладают не только противовоспалительной активностью, но также и ингибирующей активностью на повышенную проницаемость. Кроме того, было показано, что при хронических заболеваниях вен повышается количество свободных радикалов и, следовательно, происходит активация NADPH оксидазы. Полагают, что этот окислительный стресс связан с активацией эндотелиальных клеток и инфильтрацией лейкоцитами (Glowinski J. и Glowinski S., Generation of reactive oxygen metabolites by the varicose vein wall, 2002, Eur. J. Vasc.Endovasc. Surg., 23, 5550-555). Показано, что при различных патологиях сосудов происходит инфильтрация эндотелиальных клеток и индукция молекул адгезии и NADPH оксидазы (Bedard K. и Krause K.H., The NOX family ofROS-generating oxidases: Physiology and pathophysiology, 2007, Physiol. Rev., 87, 245-313). Таким образом, соединения согласно настоящему изобретению могут применяться для предотвращения или лечения заболеваний вен, в особенности хронического заболевания вен на всех его стадиях(боли, телеангиэктазии, варикозного расширения вен, отеков, трофических нарушений, язв), а также для предотвращения или лечения посттромботического синдрома, сосудистых осложнений, связанных с диабетом, гипертонией, атеросклерозом, воспалением, метаболическим синдромом, связанным с ожирением,сосудистых осложнений, связанных с ожирением, стенокардией, артериитов нижних конечностей или острых сосудистых расстройств головного мозга, заживления хронических ран, включая главным образом венозные или смешанные язвы голени и диабетическую стопу, для лечения или предотвращения геморроидальных приступов, для лечения или предотвращения пролежней и для лечения рассеянного склероза. Более специфически, настоящее изобретение относится к соединениям формулы (I) где R1, R2 и R3 могут быть одинаковыми или разными, каждый представляет собой атом водорода или группу формулы (А)-1 015424 Соединения, в которых по меньшей мере один из R1, R2 и R3 представляет собой группу (А), являются метаболитами соединений формулы (Ia), где R1, R2 и R3, каждый, представляют собой атом водорода. Настоящее изобретение также относится к способу получения соединений формулы (I), используя в качестве исходного вещества диосметин формулы (II) который подвергают реакции с металлилбромидом, получая соединение формулы (III) которое нагревают, получая соединение формулы (Ia), частный случай соединений формулы (I), где R1,R2 и R3, каждый, представляют собой атом водорода которое, если является желательным получение других соединений формулы (I), подвергают реакции с соединением формулы (IV) где Ас представляет собой ацетильную группу,получая после снятия защиты с функциональной кислотной группы и спиртовых функциональных групп с группы (А) соединения формулы (I), в которых по меньшей мере один из R1, R2 и R3 отличается от Н. Если соединения формулы (I) получают в смеси, то они могут быть разделены, например, путем препаративной ВЭЖХ хроматографии. Соединение формулы (Ib), где R1 и R3, каждый, представляют собой атом водорода и R2 представляет собой группу формулы (А), также могут быть получены путем ацетилирования соединения формулы (Ia), получая соединение формулы (V) где Ас представляет собой ацетильную группу,которое подвергают реакции с соединением формулы (IV), получая соединение формулы (VI) где Ас представляет собой ацетильную группу,из кислотной функциональной группы и спиртовых и фенольных функциональных групп которого снимают защиту, получая соединение формулы (Ib). Соединения по изобретению являются ингибиторами молекул адгезии и NADPH оксидазы и антиагрегантными средствами. На основании вышеизложенного они являются пригодными для предотвращения или лечения заболеваний вен, в особенности хронического заболевания вен на всех его стадиях (боли, телеангиэктазии,варикозного расширения вен, отеков, трофических нарушений, язв), а также для предотвращения или лечения посттромботического синдрома, сосудистых осложнений, связанных с диабетом, гипертонией,атеросклерозом, воспалением, метаболическим синдромом, связанным с ожирением, сосудистых осложнений, связанных с ожирением, стенокардией, артериитов нижних конечностей или острых сосудистых расстройств головного мозга, заживления хронических ран, включая главным образом венозные или смешанные язвы голени и диабетическую стопу, для лечения или предотвращения геморроидальных приступов, для лечения или предотвращения пролежней и для лечения рассеянного склероза. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве активного компонента соединение формулы (I), в сочетании с одним или несколькими фармацевтически приемлемыми, нетоксичными, инертными носителями или наполнителями. Среди фармацевтических композиций в соответствии с изобретением особенно можно отметить те,которые пригодны для перорального, парентерального (внутривенного, внутримышечного или подкожного), чрес- или транскожного, назального, ректального, перлингвального, глазного введения или введения через дыхательные пути, и в особенности таблетки или драже, подъязычные таблетки, твердые желатиновые капсулы, капсулы, суппозитории, кремы, мази, кожные гели, составы для инъекций или питья,аэрозоли, глазные капли и носовые капли. Кроме соединения формулы (I), фармацевтические композиции в соответствии с изобретением содержат один или несколько наполнителей или носителей, таких как разбавители, смазывающие вещества, связующие, дезинтеграторы, абсорбенты, красители, подсластители. Примерами наполнителей или носителей, которые могут быть упомянуты, являются в качестве разбавителей: лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза, глицерин; в качестве смазывающих веществ: диоксид кремния, тальк, стеариновая кислота и ее магниевая и кальциевая соли, полиэтиленгликоль; в качестве связующих: силикат алюминия, силикат магния, крахмал, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия и поливинилпирролидон; в качестве дезинтегрантов: агар, альгиновая кислота и ее натриевая соль, шипучие смеси. Процентное содержание активного компонента формулы (I) в фармацевтической композиции составляет предпочтительно от 5 до 50 вес.%. Полезные дозировки изменяются в зависимости от возраста и веса тела пациента, пути введения,природы и тяжести расстройства и введения любых сопутствующих видов лечения и находятся в интервале от 0,5 до 1000 мг в сутки на одно или несколько введений. Последующие примеры иллюстрируют настоящее изобретение. Структуры соединений, описанных в примерах, определены в соответствии с традиционными спектрофотометрическими методиками (инфракрасный, ядерный магнитный резонанс, масс-спектрометрия). Сокращения. ДМСО: диметилсульфоксид,NADPH: восстановленная форма никотинамидадениндинуклеодтидфосфата,ВЭЖХ: высокоэффективная жидкостная хроматография. Стадия А. 2-4-Метокси-3-[(изобут-2-ен-1-ил)окси]фенил-5,7-бис-[(изобут-2-ен-1-ил)окси]-4 Нхромен-4-он. К 30 г диосметина добавляли 69,3 г карбоната калия и 450 мл ацетона. Смесь нагревали в колбе с обратным холодильником в течение 4 ч 30 мин и затем охлаждали до температуры окружающей среды; после этого добавляли 54 г металлилбромида. Затем реакционную смесь нагревали в колбе с обратным холодильником в течение ночи и после этого охлаждали до температуры окружающей среды и фильтровали. Осадок на фильтре промывали ацетоном и затем фильтрат упаривали, получая остаток, который перекристаллизовывали из толуола, получая указанное в заглавии соединение. Стадия В. 6,8,2'-трис-(Изобут-2-ен-1-ил)диосметин. К 10 г соединения, полученного на предыдущей стадии, добавляли 120 мл N,N-диметиланилина; затем смесь нагревали в колбе с обратным холодильником в течение 1 ч. После этого растворитель упаривали при пониженном давлении и полученный остаток перекристаллизовывали из изопропанола, получая указанное в заглавии соединение. Точка плавления: 141 С. Пример 2. (5-Гидрокси-2-[3-гидрокси-4-метокси-2-(изобут-2-ен-1-ил)фенил]-6,8-бис-(изобут-2-ен-1 ил)-4-оксо-4H-хромен-7-ил)-бета-D-глюкуроновая кислота Стадия А. Метил 5-гидрокси-2-[3-гидрокси-4-метокси-2-(изобут-2-ен-1-ил)фенил]-6,8-бис-(изобут 2-ен-1-ил)-4-оксо-4 Н-хромен-7-ил-2,3,4-трис-O-ацетил-бета-D-глюкуронат. Указанное в заглавии соединение получали путем взаимодействия соединения из примера 1(250 мг) с соединением формулы (IV) (429 мг), с помощью межфазного катализа, согласно методике,описанной в публикации Synth. Commun., 1999, 29(16), 2775-2781. Стадия В. (5-Гидрокси-2-[3-гидрокси-4-метокси-2-(изобут-2-ен-1-ил)фенил]-6,8-бис-(изобут-2-ен-1 ил)-4-оксо-4 Н-хромен-7-ил)-бета-D-глюкуроновая кислота. Соединение, полученное на стадии А, растворяли в метаноле и после этого добавляли гидроксид натрия. Смесь нагревали в колбе с обратным холодильником в течение 1 ч 30 мин и затем нейтрализовали с помощью 2 н. раствора соляной кислоты, после этого упаривали насухо, получая указанное в заглавии соединение. Пример 3. 3-[5,7-Дигидрокси-6,8-бис-(изобут-2-ен-1-ил)-4-оксо-4H-хромен-2-ил]-6-метокси-2(изобут-2-ен-1-ил)фенил-бета-D-глюкуроновая кислота Стадия А. 5-Гидрокси-2-[3-гидрокси-4-метокси-2-(изобут-2-ен-1-ил)фенил]-6,8-бис-(изобут-2-ен-1 ил)-4-оксо-4 Н-хромен-7-ил ацетат. Соединение из примера 1 (3 г) растворяли в пиридине и после этого добавляли уксусный ангидрид(0,61 мл) при температуре окружающей среды. Затем реакционную смесь перемешивали в течение 16 ч и после этого упаривали насухо. Остаток ресуспендировали в смеси воды со льдом и затем экстрагировали-4 015424 дихлорметаном, высушивали, фильтровали и упаривали. Таким образом, полученный неочищенный продукт очищали на силикагеле и затем путем препаративной ВЭЖХ с обращенной фазой, получая указанное в заглавии соединение. Стадия В. Метил 3-[7-(ацетилокси)-5-гидрокси-6,8-бис-(изобут-2-ен-1-ил)-4-оксо-4 Н-хромен-2-ил]6-метокси-2-(изобут-2-ен-1-ил)фенил-2,3,4-трис-О-ацетил-бета-D-глюкуронат. Используя в качестве исходного вещества соединение, полученное на вышеописанной стадии, указанное в заглавии соединение получали согласно методике стадии А примера 2. Стадия С. 3-[5,7-Дигидрокси-6,8-бис-(изобут-2-ен-1-ил)-4-оксо-4 Н-хромен-2-ил]-6-метокси-2(изобут-2-ен-1-ил)фенил-бета-D-глюкуроновая кислота. Используя в качестве исходного вещества соединение, полученное на вышеописанной стадии, указанное в заглавии соединение получали согласно методике стадии В примера 2. Фармакологическое исследование. В нижеприведенных примерах термин "сравнительное соединение" относится к примеру 69 заявки ЕР 0709383. Пример 4. Ингибирование агрегации тромбоцитов в условиях in vitro. У анестезированных новозеландских кроликов из сонной артерии отбирали образец крови над 0,109 М цитратом. Плазму, обогащенную тромбоцитами, получали путем центрифугирования. После этого тромбоциты промывали с помощью центрифугирования. Промытые тромбоциты ресуспендировали в буфере Tyrode. Тромбоцитарную суспензию помещали в камеру и затем в агрегометре при 37 С при перемешивании, в присутствии соединения из примера 1(30 мкМ) или сравнительного соединения (30 мкМ), каждое разводили в одном и том же растворителе(0,1% ДМСО). Через 2 мин агрегацию осуществляли с помощью коллагена (4 мкг/мл); затем записывали ответную реакцию в течение 6 мин. Агрегацию тромбоцитов количественно определяли с помощью нефелометрии, а именно путем определения процента света, который проходит через тромбоцитарную суспензию для камеры, содержащей Tyrode, и для камеры, содержащей растворитель (0,1% ДМСО). Антиагрегационную активность соединений диосметина в соответствии с изобретением, в особенности соединения из примера 1 и сравнительного соединения, определяли в виде функции процента ингибирования агрегации тромбоцитов, при этом больший процент ингибирования соответствовал большей активности. Соединение из примера 1 (30 мкМ) вызывает ингибирование 36,69,9%, тогда как сравнительное соединение не оказывает существенного влияния (4,11,8%); (р 0,01 соединение из примера 1 относительно сравнительного соединения, t-критерий Стьюдента, n=7). Этот тест свидетельствует об антиагрегационной активности по отношению к тромбоцитам и, следовательно, об антитромботической активности соединения из примера 1. Пример 5. Ингибирование адгезии лейкоцитов в условиях in vivo. В этом исследовании использовали три группы по 3 хомяка весом от 90 до 110 г. За 30 мин до анестезии хомякам перорально вводили однократную дозу плацебо (10% аравийская камедь), соединения из примера 1 (3 мг/кг) или сравнительного соединения (3 мг/кг). Животных анестезировали с помощью пентобарбитала 50 мг/кг путем внутрибрюшинного введения. Хомяков помещали под микроскоп и выделяли защечный мешок и погружали в перфузионный раствор (NaCl 110,0 мМ, KCl 4,7 мМ, CaCl2 2,0 мМ,MgSO4 1,2 мМ, NaHCO3 18,0 мМ, Hepes 15,39 мМ и Hepes Na+-соль 14,61 мМ), (Duling, The preparationmicrovasculature, 1978, Uppsala J. Med. Sci., 83: 71-79). Локальную ишемию осуществляли с помощью латексной трубки, прикрепленной к входу в защечный мешок. Внутритрубное давление в трубке повышали до 200-220 мм рт.ст. с помощью калиброванного шприца. Эту общую окклюзию осуществляли в течение 30 мин и затем проводили реперфузию в течение 45 мин. Адгезию лейкоцитов к эндотелиальным клеткам в посткапилярных венулах количественно определяли в поле зрения 6 мм 2 сразу после начала ишемии (принимаемую за 100%) и в различные промежутки времени после реперфузии (0, 15, 30 и 45 мин). Модель адгезии лейкоцитов, осуществляемой путем реперфузионной ишемии, в защечном мешке хомяка предоставляет возможность подтверждения эффективности соединений диосметина в соответствии с изобретением в качестве антиадгезионных агентов, в особенности соединения из примера 1 и сравнительного соединения. Активность соединения из примера 1 и сравнительного соединения оценивали в качестве функции количества лейкоцитов, прилипших к эндотелиальным клеткам в поле зрения 6 мм 2 после ишемии/реперфузии, при этом активность является большей, если снижается количество лейкоцитов и, следовательно, снижается процент прилипших лейкоцитов относительно количества прилипших лейкоцитов после ишемии.-5 015424 Таблица 1 Влияние перорального лечения хомяков соединением из примера 1 или сравнительным соединением на количество лейкоцитов, прилипших к эндотелиальным клеткам в посткапиллярных венулах защечного кармана, после ишемии (количество лейкоцитов принимается за 100%) и через 0, 15, 30 и 45 мин после реперфузии. : р 0,01; : р 0,001 относительно лечения с помощью плацебо, двухфакторный (время и лечение) ANOVA, с последующим тестом Bonferroni (n=3) Соединение из примера 1 предоставляет возможность очевидного и существенного уменьшения количества лейкоцитов, прилипших к эндотелиальным клеткам, после ишемии/реперфузии относительно плацебо. Активность соединения из примера 1 является более эффективной, чем активность сравнительного соединения. Этот эксперимент свидетельствует об ингибирующем действии на адгезию лейкоцитов, соединения из примера 1 и, следовательно, о потенциальных возможностях лечения заболевания вен, а также заболеваний артериальных сосудов, таких как атеросклероз или сосудистых осложнений, связанных с диабетом. Пример 6. Ингибирование в условиях in vivo экспрессии молекулы адгезии сосудистого эндотелия типа 1 (VCAM-1). В этом исследовании использовали четыре группы по 8 мышей, дефицитных по аполипопротеину Е(АроЕ-/-, развивающиеся самопроизвольно атеромные бляшки в их аортах). В возрасте 9 недель у мышей вызывали диабет с помощью 5 внутрибрюшинных инъекций 100 мг/кг стрептозотоцина в течение 5 дней. На десятую неделю животных разделяли на четыре группы: контрольная группа, для соединения из примера 1, леченная группа, получавшая соединение из примера 1 (130 мг/кг/стуки с пищей в течение 6 недель), контрольная группа для сравнительного соединения, леченная группа, получавшая сравнительное соединение (130 мг/кг/сутки с пищей в течение 6 недель). Мышей забивали на пятнадцатую неделю после анестезии с использованием изофлурана. Аорты удаляли, разрезали и замораживали в жидком азоте. Аорты измельчали при низкой температуре и экстрагировали общую РНК с помощью микронабораRNeasy (Qiagen). После этого осуществляли обратную транскрипцию на 1 мкг общей РНК, используя набор для синтеза одноцепочечной кДНК Superscript III (Invitrogen). Экспрессию VCAM-1 количественно определяли с помощью ПЛР в реальном времени и нормализовали относительно 3 сравнительных генов: -актин, гипоксантин-гуанин фосфорибозил трансфераза (HPRT) и глицеральдегид фосфаз дегидрогеназа (GAPDH). Использовали набор IQ SYBR Green supermix (Biorad), с 2 мкл кДНК и 150 нМ каждого праймера. Образцы денатурировали в течение 5 мин при 95 С и амплифицировали в течение 40 циклов согласно следующему протоколу: денатурация в течение 20 с при 95 С и гибридизация и элонгация в течение 1 мин при 54 С для VCAM-1, -актина и HPRT, при 56 С для GAPDH. Пороговый цикл (определяемый как цикл, для которого принимают, что флуоресценция существенно превышает фоновый шум) для VCAM-1 необработанных животных нормализовали относительно сравнительных генов (и принимали равной 100%) и затем ее сравнивали в таковой у леченых животных. Используемые специфические праймеры были следующими:VCAM-1: 5'-AGA GCA GAC ТТТ СТА ТТТ САС-3' (смысловой) и 5'-ССА ТСТ ТСА CAG GCA ТТТ С-3' (антисмысловой);GAPDH: 5'-GCC TTC CGT GTT CCT АСС С-3' (смысловой) и 5'-TGC CTG СТТ САС САС СТТ-3'(антисмысловой). Модель с диабетом у мышей, которые дефицитны по АроЕ, предоставляет возможность подтвердить эффективность соединений диосметина в соответствии с изобретением в качестве антиадгезионных средств. Активность соединения из примера 1 и сравнительного соединения оценивали в виде функции уровня экспрессии VCAM-1 в аорте, по сравнению с нелечеными животными, при этом активность является более высокой при снижении уровня экспрессии VCAM-1. У мышей, подвергнутых лечению соединением из примера 1, уровень экспрессии VCAM-1 составлял 65,910,1% относительно нелеченых мышей (р 0,01, t-критерий Стьюдента, n=8), тогда как у мышей, подвергнутых лечению сравнительным соединением, уровень экспрессии VCAM-1 составлял 83,06,6% (р 0,05, t-критерий Стьюдента, n=8).-6 015424 Соединение из примера 1 предоставляет возможность очевидного и существенного уменьшения экспрессии VCAM-1 в аорте диабетических мышей АроЕ-/- относительно нелеченой группы. Активность соединения из примера 1 является более эффективной, чем активность сравнительного соединения. Этот эксперимент свидетельствует об ингибирующих действиях на экспрессию молекул адгезии соединения из примера 1 и, следовательно, на потенциальную возможность лечения заболевания вен, а также патологий артерий, таких как сосудистые осложнения, связанные с диабетом, гипертонией, атеросклерозом, воспалением, метаболическим синдромом, связанным с ожирением, сосудистых осложнений,связанных с ожирением, стенокардией, артериитов нижних конечностей и острых сосудистых расстройств головного мозга. Пример 7. Ингибирование в условиях in vitro активности NADPH оксидазы. Исследование проводили на эндотелиальных клетках человека HUVEC (Human Umbilical VeinEndothelial Cells, Clonetics Co). Клетки культивировали в ЕВМ 2 среде (Endothelial Basal Medium,Clonetics Co), дополненной 2% FCS (Foetal Calf Serum) и EGM2 (Endothelial Growth Medium, Clonetics Co). Клетки инкубировали в присутствии растворителя (0,1% ДМСО, контроль для соединения из примера 1), ЕВМ 2 (контроль для соединения из примера 2 и контроль для соединения из примера 3), соединение из примера 1 (100 мкМ), соединение из примера 2 (100 мкМ) или соединение из примера 3(100 мкМ) в течение 15 мин и затем активировали с помощью ангиотензина II (1 мкМ) в течение 30 мин для активации NADPH оксидазы. Клетки промывали с помощью ЕВМ 2 и затем добавляли субстратNADPH оксидазы (NADPH, 200 мкМ) и люцигенин (25 мкМ). Восстановление в люцигенине с помощью супероксидных анионов, продуцируемых NADPH оксидазой, количественно определяли с помощью люминометра. Количество импульсов в секунду (имп./с) в контрольных группах сравнивали с соответствующими значениями в группах, подвергнутых лечению. Количество имп./с, полученное для контрольных групп, принимали за 100% активность NADPH оксидазы. Модель измерения эндотелиальной активности NADPH оксидазы с помощью антиотензина II предоставляет возможность подтвердить эффективность соединений диосметина в соответствии с изобретением в качестве средств, которые ингибируют активность NADPH оксидазы. Активность соединений из примеров 1, 2 и 3 оценивали в качестве функций полученных значений имп./с, при этом активность является более высокой при снижении количества имп./с. Таблица 2 Влияние лечения эндотелиальных клеток соединениями из примеров 1, 2 и 3 на активность NADPH оксидазы после индукции с помощью ангиотензина II (активность в контрольной группе [без соединения] принимали за 100%). : р 0,01 относительно контрольной группы для соединения из примера 1 или контрольной группы для соединения из примера 23, t-критерий Стьюдента (n=3) Соединения из примеров 1, 2 и 3 предоставляют возможность очевидного и существенного снижения активности NADPH оксидазы в эндотелиальных клетках человека. Этот тест свидетельствует об ингибирующих действиях на активность сосудистой NADPH оксидазы соединений из примеров 1, 2 и 3 и, следовательно, потенциальных возможностях для ингибирования свободных радикалов при заболевании вен, а также при артериальных патологиях, таких как атеросклероз, гипертония, сосудистых осложнениях, связанных с диабетом, и ишемических заболеваний. Пример 8. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая содержит 10 мг активного компонента: где R1, R2 и R3 могут быть одинаковыми или различными и каждый представляет собой атом водорода или группу формулы (А) 2. Соединение формулы (I) по п.1, выбранное из 6,8,2'-трис-(изобут-2-ен-1-ил)диосметина,(5-гидрокси-2-[3-гидрокси-4-метокси-2-(изобут-2-ен-1-ил)фенил]-6,8-бис-(изобут-2-ен-1-ил)-4 оксо-4H-хромен-7-ил)-бета-D-глюкуроновой кислоты и 3-[5,7-дигидрокси-6,8-бис-(изобут-2-ен-1-ил)-4-оксо-4H-хромен-2-ил]-6-метокси-2-(изобут-2-ен-1 ил)фенил-бета-D-глюкуроновой кислоты. 3. Способ получения соединений формулы (I) по п.1, включающий взаимодействие диосметина формулы (II) с металлилбромидом с получением соединения формулы (III) нагревание которого приводит к получению соединения формулы (Ia), частного случая соединений формулы (I), в которых R1, R2 и R3, каждый, представляют собой атом водорода которое, если является желательным получение других соединений формулы (I), подвергают взаимодействию с соединением формулы (IV) где Ас представляет собой ацетильную группу,с последующим снятием защиты с функциональной кислотной группы и спиртовых функциональных групп с группы (А), как определено в п.1, с получением соединений формулы (I), в которых по меньшей мере один из R1, R2 и R3 отличается от Н. 4. Фармацевтическая композиция, содержащая в качестве активного компонента соединение формулы (I) по п.1 или 2 в сочетании с одним или несколькими фармацевтически приемлемыми, нетоксичными, инертными носителями или разбавителями. 5. Применение соединения по п.1 или 2 для приготовления лекарственных средств для предотвращения или лечения заболеваний вен, для предотвращения или лечения посттромботического синдрома,сосудистых осложнений, связанных с диабетом, гипертонией, атеросклерозом, воспалением, метаболическим синдромом, связанным с ожирением, сосудистых осложнений, связанных с ожирением, стенокардией, артериитов нижних конечностей или острых сосудистых расстройств головного мозга, для заживления хронических ран, включая главным образом венозные или смешанные язвы голени и диабетическую стопу, для лечения или предотвращения геморроидальных приступов, для лечения или предотвращения пролежней и для лечения рассеянного склероза. 6. Применение соединения по п.1 или 2 для приготовления лекарственных средств для предотвращения или лечения хронического заболевания вен.
МПК / Метки
МПК: C07H 15/26, C07D 407/12, A61P 7/02, C07D 407/14, C07D 311/30, A61K 31/35
Метки: фармацевтические, которые, композиции, содержат, диосметина, получения, способ, соединения
Код ссылки
<a href="https://eas.patents.su/10-15424-soedineniya-diosmetina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения диосметина, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Применение определенных алкоксилатов спиртов в качестве адъюванта в области агротехники
Следующий патент: Бензоилпиразолы, их применение в качестве гербицидов и промежуточные вещества
Случайный патент: Способ производства витых проволочных изделий












