Способ получения производных класса таксоидов
Номер патента: 2622
Опубликовано: 27.06.2002
Авторы: Дидье Эрик, Поз Дени, Риге Дидье, Оддон Жилль, Леон Патрик
Формула / Реферат
1. Способ прямого одностадийного одновременного алкилирования двух гидроксильных функций в положениях 7 и 10 10-дезацетилбаккатина III или производных этого соединения, этерифицированных в положении 13, отвечающих формуле (V)
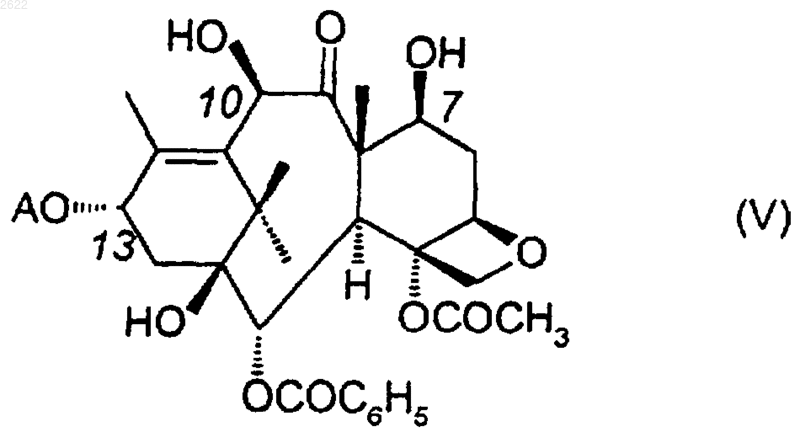
в которой А обозначает водород или боковую цепь формулы (Iс)
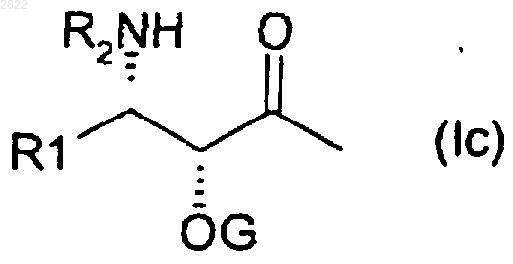
в которой G обозначает защитную группу для гидроксильной функции и
R1 обозначает
1) прямой или разветвленный С1-С8-алкил, прямой или разветвленный С2-С8-алкенил, прямой или разветвленный С2-С8-алкинил, С3-С6-циклоалкил, фенил или a- или b-нафтил, который может быть замещен одним или несколькими атомами или радикалами, выбранными из атомов галогена и радикалов алкил, алкенил, алкинил, арил, арилалкил, алкокси, алкилтио, арилокси, арилтио, гидрокси, гидроксиалкил, меркапто, формил, ацил, ациламино, ароиламино, алкоксикарбониламино, амино, алкиламино, диалкиламино, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил, диалкилкарбамоил, циано, нитро и трифторметил, или
2) пятичленный ароматический гетероцикл, содержащий один или несколько одинаковых или различных гетероатомов, выбранных из атомов азота, кислорода, серы, который может быть замещен одним или несколькими одинаковыми или различными заместителями, выбранными из атомов галогена и радикалов алкил, арил, амино, алкиламино, диалкиламино, алкоксикарбониламино, ацил, арилкарбонил, циано, карбокси, карбамоил, алкилкарбамоил, диалкилкарбамоил или алкоксикарбонил,
3) при условии, что в радикалах фенил, a- или b-нафтил и ароматических гетероциклах алкильные заместители или алкильные части других заместителей содержат 1-4 атома углерода, что радикалы алкенил и алкинил содержат 2-8 атомов углерода и что арильные радикалы представляют собой радикалы фенил или a- или b-нафтил;
R2 обозначает
1) радикал бензоил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из атомов галогена, радикалов С1-С4-алкил, C1-C4-алкокси, трифторметил, теноил или фуроил, или
2) радикал R'2-O-CO-, в котором R'2 обозначает:
C1-C8-алкил, С2-С8-алкенил, С3-С8-алкинил, С3-С6-циклоалкил, С4-С6-циклоалкенил или С7-С10-бициклоалкил, которые могут быть замещены одним или несколькими атомами или радикалами, выбранными из атомов галогена, радикалов гидрокси, С1-С4-алкокси, ди-С1-С4-алкиламино, пиперидино, морфолино, пиперазин-1-ил (который может быть замещен в положении 4 С1-С4-алкилом или фенил-С1-С4-алкилом), С3-С6-циклоалкил, С4-С6-циклоалкенил, фенил (возможно замещенный одним или несколькими атомами или радикалами, выбранными из атомов галогена и радикалов С1-С4-алкил или C1-C4-алкокси), циано, карбокси или С1-С4-алкоксикарбонил;
радикал фенил или a- или b-нафтил, который может быть замещен одним или несколькими атомами или радикалами, выбранными из атомов галогена и радикалов С1-С4-алкил, С1-С4-алкокси, или пятичленный ароматический гетероциклический радикал, выбранный преимущественно из фурила и тиенила; или
насыщенный гетероциклический радикал с 4-6 атомами углерода, который может быть замещен одним или несколькими С1-С4-алкилами,
или оксазолидиновую группу формулы (Id)
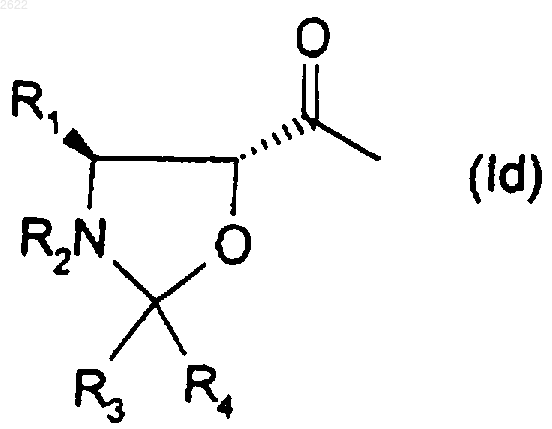
в которой R3 и R4 обозначают водород или радикалы алкил, арил, галоген, алкокси, арилалкил, алкоксиарил, галогеналкил, галогенарил, или могут вместе образовывать 4-7-членный цикл, заключающийся в том, что алкилирующий агент выбирают из
алкилгалогенидов и преимущественно из алкилйодидов (RI),
алкилсульфатов, таких как метилсульфат,
оксониевых солей, таких как триалкилоксониевые соли соединений бора, в частности тетрафторборат триметилоксония,
и используют в присутствии одного или нескольких агентов анионизации, таких как одно или несколько сильных оснований в безводной среде.
2. Способ по п.1, отличающийся тем, что алкилирующим агентом является метилсульфат или метилйодид, предпочтительно метилйодид.
3. Способ по п.1, отличающийся тем, что основания, пригодные для использования в безводной среде, выбирают из гидридов щелочных металлов, алкоголятов щелочных металлов, оксида серебра, 1,8-бис(диметиламино)нафталина, амидов щелочных металлов в смеси с трет-бутилатами щелочных металлов или алкиллитиевых соединений в смеси с трет-бутилатами щелочных металлов.
4. Способ по п.3, отличающийся тем, что гидриды щелочных металлов выбирают из гидридов натрия или калия, предпочитая гидрид калия.
5. Способ по п.3, отличающийся тем, что алкоголятом щелочного металла является трет-бутилат калия.
6. Способ по п.1, отличающийся тем, что алкилирующим агентом является метилйодид в присутствии гидрида калия.
7. Способ по любому из предыдущих пунктов, отличающийся тем, что реакцию проводят в органической среде, инертной в условиях реакции.
8. Способ по пп.4-6, отличающийся тем, что используемый растворитель выбирают из простых эфиров.
9. Способ по п.3, отличающийся тем, что, когда реакцию проводят в присутствии оксида серебра, используют растворитель, выбираемый из ароматических растворителей и апротонных полярных растворителей.
10. Способ по п.8, отличающийся тем, что в качестве растворителя используют тетрагидрофуран или диметоксиэтан.
11. Способ по пп.1 и 3, отличающийся тем, что используют смесь 1,8-бис(диметиламино)нафталин и тетрафторбората триметилоксония в этилацетате.
12. Способ по любому из предыдущих пунктов, отличающийся тем, что молярное отношение агента анионизации к субстрату превышает 2 и предпочтительно составляет от 2 до 20.
13. Способ по любому из предыдущих пунктов, отличающийся тем, что молярное отношение алкилирующего агента к субстрату превышает 2 и предпочтительно составляет от 2 до 40.
14. Способ по любому из предыдущих пунктов, отличающийся тем, что используемая температура реакции составляет от -30 до 80шС.
Текст
1 Настоящее изобретение относится к новому способу получения диалкоксильных производных класса таксоидов. Под диалкоксильными производными класса таксоидов подразумеваются производные, имеющие в положениях 7 и 10 баккатинового ядра алкоксигруппы и, возможно, в положении 13 фенилизосериновую цепь. Более конкретно, под диалкоксильными производными класса таксоидов подразумеваются производные, отвечающие следующей общей формуле в которой группы R обозначают один и тот же прямой или разветвленный C1-C6-алкил;Z обозначает водород или группу формулы в которой R1 обозначает 1) прямой или разветвленный C1-C8-алкил,прямой или разветвленный С 2-С 8-алкенил, прямой или разветвленный С 2-С 8-алкинил, С 3-С 6 циклоалкил, фенил или - или -нафтил, который может быть замещен одним или несколькими атомами или радикалами, выбранными из следующей группы: атомы галогена и радикалы алкил, алкенил, алкинил, арил, арилалкил, алкокси, алкилтио, арилокси, арилтио, гидрокси,гидроксиалкил, меркапто, формил, ацил, ациламино, ароиламино, алкоксикарбониламино,амино, алкиламино, диалкиламино, карбокси,алкоксикарбонил, карбамоил, алкилкарбамоил,диалкилкарбамоил, циано, нитро и трифторметил или 2) пятичленный ароматический гетероцикл, содержащий один или несколько одинаковых или различных гетероатомов (азот, кислород, серу), который может быть замещен одним или несколькими одинаковыми или различными заместителями, выбранными из следующей группы: атомы галогена и радикалы алкил, арил, амино, алкиламино, диалкиламино,алкоксикарбониламино, ацил, арилкарбонил,циано, карбокси, карбамоил, алкилкарбамоил,диалкилкарбамоил или алкоксикарбонил,3) при условии, что в радикалах фенил, или -нафтил и ароматических гетероциклах алкильные заместители или алкильные части других заместителей содержат 1-4 атома углерода, что радикалы алкенил и алкинил содержат 2-8 атомов углерода и что арильные радикалы представляют собой радикалы фенил или - или 2 1) радикал бензоил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбираемыми из следующей группы: атомы галогена и радикалы С 1-С 4-алкил, С 1-С 4-алкокси,трифторметил, теноил или фуроил или 2) радикал R'2-O-CO-, в котором R'2 обозначает С 1-С 8-алкил, С 2-С 8-алкенил, С 3-С 8-алкинил, С 3-С 6-циклоалкил, С 4-С 6-циклоалкенил или С 7-С 10-бициклоалкил, которые могут быть замещены одним или несколькими атомами или радикалами, выбранными из следующей группы: атомы галогена и радикалы гидрокси, С 1-С 4 алкокси, ди-С 1-С 4-алкиламино, пиперидино,морфолино, пиперазин-1-ил (который может быть замещен в положении 4 С 1-С 4-алкилом или фенил-С 1-С 4-алкилом), С 3-С 6-циклоалкил, С 4-С 6 циклоалкенил, фенил (возможно, замещенный одним или несколькими атомами или радикалами из следующей группы: атомы галогена и радикалы С 1-С 4-алкил или С 1-С 4-алкокси), циано,карбокси или С 1-С 4-алкоксикарбонил; радикал фенил или - или -нафтил, который может быть замещен одним или несколькими атомами или радикалами из следующей группы: атомы галогена и радикалы С 1-С 4 алкил, C1-C4-алкокси или пятичленный ароматический гетероцикл (преимущественно фурил или тиенил); или насыщенный гетероциклический радикал с 4-6 атомами углерода, который может быть замещен одним или несколькими C1-C4-алкилами. Из соединений формулы (Iа), получаемых способом согласно изобретению, предпочтительными являются те, у которыхZ является атомом водорода или радикалом формулы (Ib), в которойR1 обозначает радикал фенил иR2 обозначает радикал трет-бутоксикарбонил или бензоил. Особенно предпочтительны те соединения, у которыхR обозначает радикал метил. Из заявки WO 96/30355 известны два способа получения производных, описанных выше. Согласно первому способу, включающему несколько стадий и исходящему из 10 дезацетилбаккатина III приведенной ниже формулы это соединение селективно защищают в положениях 7 и 13, например, в форме силильного диэфира, с последующим действием соединением общей формулы 3 в котором R обозначает определенный выше радикал, и Х обозначает остаток реакционноспособного сложного эфира, например, остаток эфира серной или сульфоновой кислоты, или атом галогена, и получают соединение, имеющее в положении 10 группу -OR и силилсодержащие группы в положениях 7 и 13. После этого силил-содержащие защитные группы замещают атомами водорода с получением соединения, содержащего в положении 10 группу -OR и имеющего в положениях 7 и 13 группы ОН. Это полученное соединение селективно этерифицируют в положении 7 реакцией с производным формулы (III) с целью получения производного формулы (I), в которой Z обозначает водород. Последняя стадия состоит в этерификации известным способом в положении 13 производных формулы (Iа), в которой Z обозначает водород, в присутствии -лактама, например, согласно способу, описанному в патенте ЕР 617018, или в присутствии оксазолидина, например, согласно способу, описанному в упомянутой выше заявке WO 96/30355. Согласно второму способу, описанному в том же патенте WO 96/30355, соединения общей формулы (Iа) могут быть получены с использованием пятистадийного процесса, исходя из соединения формулы (II). На первой стадии осуществляют защиту положений 7 и 10, после чего следует этерификация в положении 13 в присутствии -лактама согласно, например, способу,описанному в патенте ЕР 617018, или в присутствии оксазолидина, например, согласно способу, описанному в упомянутой выше заявке WO 96/30355. После удаления защитных групп в положениях 7 и 10 получают сложный эфир формулы (Iа), в которой Z отличен от водорода,и R является водородом. Следующая стадия состоит в одновременном действии на положения 7 и 10 реагентом, образующимся in situ из сульфоксида формулы (IV) и уксусного ангидрида (реакция типа Pummerer),R-SO-R(IV) где R имеет значение, указанное выше, с получением промежуточного соединения, имеющего в положениях 7 и 10 алкилтиоалкилоксизаместители. На последней стадии, на которой образуется целевое соединение формулы (Iа), на полученное в предыдущей стадии промежуточное соединение действуют активированным никелем Ренея. Обычно воздействие реагента, образующегося in situ из сульфоксида общей формулы (IV),преимущественно диметилсульфоксида, и уксусного ангидрида протекает в присутствии уксусной кислоты, при температуре от 0 до 50 С. Обычно обработку активированным никелем Ренея в присутствии алифатического спирта 4 или простого эфира проводят при температуре от -10 до 60 С. Таким образом, ни один из описанных выше в уровне техники способов не позволял непосредственно в одну стадию получать производные 10-дезацетилбаккатина III, диалкоксилированного в положениях 7 и 10. Настоящее изобретение позволяет решить эту задачу. Оно позволяет осуществить в одну стадию одновременное прямое селективное алкилирование двух гидроксильных функций в положениях 7 и 10 соединения 10 дезацетилбаккатина III или его производных,этерифицированных в положении 13, отвечающих формуле (V) в которой А обозначает водород или боковую цепь формулы (Iс) в которой G обозначает защитную группу для гидроксильной функции, или оксазолидиновую группу формулы (Id) в которой R1 и R2 имеют значения, указанные выше, а R3 и R4 обозначают водород или радикалы: алкил, арил, галоген, алкокси, арилалкил,алкоксиарил, галогеналкил, галогенарил, или заместители, которые могут вместе образовывать 4-7-членный цикл. В качестве исходного соединения, предпочтительно, используют 10-дезацетилбаккатин, т.е. соединение формулы (II), что обеспечивает значительную экономичность способу, а с другой стороны, позволяет устранить промежуточные стадии ведения и удаления защитных групп, которые были необходимы в известных процессах. Защитные группы G для гидроксильной функции в формуле (Iс) обычно предпочитают выбирать из перечня защитных групп, описанных в таких работах, как Green and Wuts "Protective groups in organic synthesis" 1991, JohnOrganic Chemistry" 1975, Plenum Press, и которые удаляются в условиях, мало разрушающих или вообще не разрушающих остаток молекулы,как например, простые эфиры и, предпочтительно, такие эфиры, как метоксиметиловый эфир, 1-этоксиэтиловый эфир, бензилоксиметиловый эфир, п-метоксибензилоксиметиловый 5 эфир; бензиловые эфиры, которые могут быть замещены одной или несколькими группами,такими как метокси, хлор и нитро, 1-метил-1 метоксиэтиловый эфир, 2-(триметилсилил)этоксиметиловый эфир, тетрагидропираниловый эфир; силиловые эфиры, такие как триалкилсилиловые эфиры;- карбонаты, такие как трихлорэтилкарбонаты. Более предпочтительны радикалы R3 и R4 общей формулы (Id), которые выбирают из радикалов, описанных в заявке WO 94/07878, причем большее предпочтение отдают производным, в которых R3 является водородом, a R4 пметоксифенильным радикалом. Алкилирующий агент выбирают из алкилгалогенидов и, преимущественно, из алкилйодидов (RI); алкилсульфатов, таких как метилсульфат; оксониевых солей, таких как триалкилоксониевые соли соединений бора, в частности,тетрафторборат триметилоксония (Ме 3 ОВF4). Преимущественно используют метилйодид. Алкилирующий агент используют в присутствии агента анионизации, такого как одно или несколько сильных оснований в безводной среде. Из используемых в безводной среде оснований могут быть названы гидриды щелочных металлов, такие как гидрид натрия или калия; алкоголяты щелочных металлов, такие как трет-бутилат калия; оксид серебра Аg2 О; 1,8-бис(диметиламино)нафталин; моно- или биметаллические смеси оснований, такие, например, которые описаны в публикациях Р. Caubere, Chem. Rev. 1993, 93, 23172334, и М. Schlosser, Mod. Synth. Methods, 1992,6, 227-271, в частности, предпочтительны смеси алкиллития с трет-бутилатом щелочного металла или амидаты щелочных металлов с третбутилатом щелочного металла. Одно из двух оснований может образовываться in situ. Из всех возможных сочетаний алкилирующего агента и агента анионизации предпочитают использовать метилйодид в присутствии гидрида калия. Реакцию проводят преимущественно в органической среде, инертной в условиях реакции. Из растворителей предпочитают использовать простые эфиры, такие как тетрагидрофуран и диметоксиэтан,когда используется оксид серебра, предпочитают использовать полярные апротонные растворители, такие как диметилформамид или ароматические растворители, такие как толуол,когда используется 1,8-бис(диметиламино)нафталин,предпочитают использовать сложные эфиры, такие как этилацетат. 6 Для лучшего осуществления изобретения предпочтительно использовать молярное отношение агента анионизации к субстрату, превышающее 2 и, более предпочтительно, составляющее от 2 до 20. Предпочтительно также использование молярного отношения алкилирующего агента к субстрату, превышающего 2 и, более предпочтительно, составляющего от 2 до 40. Предпочтительно использование температуры реакции от -30 до 80 С. Предпочтительная длительность реакции варьирует в пределах от нескольких часов до 48 ч в зависимости от выбранных реагентов. После стадии алкилирования, если ее проводят с использованием 10-дезацетилбаккатина,последующую стадию этерификации проводят обычным способом, например, в соответствии со способами, описанными в ранее упомянутом патенте ЕР 617018 и в заявке WO 96/30355. Таким образом, согласно первому трехстадийному способу, исходят из 10-дезацетилбаккатина, который с использованием алкилирующего агента в присутствии сильного основания, затем на второй стадии диэтерифицированный в положениях 7 и 10 10-дезацетилбаккатин подвергают конденсации в положении 13 с защищенным -лактамом в присутствии активирующего агента, выбранного из третичных аминов и металлических оснований,в результате чего образуется алкоголят в положении 13. После этого удаляют защитную группу из боковой цепи действием минеральной или органической кислоты. В соответствии со вторым трехстадийным способом проводят алкилирование 10 дезацетилбаккатина с использованием алкилирующего агента в присутствии сильного основания, после чего во второй стадии диэтерифицированный в положениях 7 и 10 10 дезацетилбаккатин подвергают конденсации в положении 13 оксазолидином в присутствии агента сочетания, такого как диимиды, и в присутствии активирующего агента, такого как диалкиламинопиридины. Раскрытие оксазолидинового цикла обеспечивается действием минеральной или органической кислоты. В соответствии с третьим способом проводят этерификацию в положении 13 баккатина,соответствующим образом защищенного в положениях 7 и 10, -лактамом или оксазолидином в присутствии агента сочетания и/или активирующего агента, как это описано в двух предыдущих способах. После снятия защиты в положениях 7 и 10 по этим положениям осуществляют диэтерификацию алкилирующим агентом в присутствии сильного основания. После этого удаляют защитную группу из боковой цепи действием минеральной или органической кислоты. Более полно настоящее изобретение описывается с помощью приведенных ниже приме 7 ров, которые не должны рассматриваться как ограничение изобретения. Примеры Все испытания проводились под аргоном с использованием безводных растворителей. Пример 1. Оксид серебра/метилйодид/толуол/10-ДАБ. К суспензии 10-дезацетилбаккатина III(255 мг, 1,1 ммоль, 2,2 экв). Температуре дают постепенно подняться до комнатной. После протекания реакции в течение 5 ч реакционную смесь нагревают до 60 С. После перемешивания в течение 24 ч при 60 С добавляют избыток реагентов: оксид серебра (2 х 255 мг) и метилйодид(2 х 1 мл). После нагревания в течение дополнительных 36 ч реакционную смесь фильтруют через пористое стекло и полученный фильтрат упаривают. По данным жидкостной хроматографии высокого разрешения (ЖХВР), реакционная смесь содержит 11,5% (при внутренней стандартизации поверхностей) 7,10-диметокси 10-дезацетилбаккатина. Пример 2. Оксид серебра/метилйодид/пиридин/толуол/10-ДАБ. К суспензии 10-дезацетилбаккатина III(3/2; 2,5 мл) при комнатной температуре последовательно добавляют пиридин (8 мкл, 0,1 ммоль, 0,2 экв) и затем оксид серебра (255 мг,1,1 ммоль, 2,2 экв). После этого реакционную смесь нагревают до 50 С. После перемешивания в течение 24 ч при 60 С добавляют избыток реагентов: оксида серебра (255 мг, 1,1 ммоль, 2,2 экв), пиридина (80 мкл, 1 ммоль, 2 экв) и метилйодида (1 мл). После нагревания в течение дополнительных 24 ч реакционную смесь фильтруют через пористое стекло и фильтрат разбавляют этилацетатом (40 мл). Полученную фазу промывают рассолом (20 мл), отделяют,сушат над сульфатом натрия и упаривают (131 мг). По данным ЖХВР сырая реакционная смесь содержит 12,2% (при внутренней стандартизации поверхностей) 7,10-диметокси-10-дезацетилбаккатина. Пример 3. Оксид серебра/метилйодид/N,Nдиметилформамид/10-ДАБ. К раствору 10-дезацетилбаккатина III (272 мг, 0,5 ммоль) в смеси N,N-диметилформамид/метилйодид (3/2; 2,5 мл) при 0 С добавляют оксид серебра (255 мг, 1,1 ммоль, 2,2 экв). Температуре дают постепенно подняться до комнатной. После перемешивания в течение 24 ч реакционную смесь разбавляют диэтиловым эфиром (20 мл) и фильтруют через пористое стекло. Фильтрат промывают водой (20 мл). Органическую фазу отделяют, сушат над сульфатом натрия и упаривают (207 мг). По данным ЖХВР сырая реакционная смесь содержит 9,2% 8 Пример 4. Гидрид калия/метилйодид/тетрагидрофуран/10-ДАБ. Гидрид калия в виде 20%-ной суспензии в минеральном масле (6,0 г, 30 ммоль, 3 экв) предварительно промывают пентаном. К суспензии предварительно промытого пентаном гидрида калия в тетрагидрофуране (30 мл) при -30 С прибавляют по каплям суспензию 10-дезацетилбаккатина III (5,23 г, 8,5 ммоль,чистота 89%) в смеси тетрагидрофуран/метилйодид (3/2, 50 мл). Вслед за этим температуре дают постепенно подняться до комнатной. После перемешивания в течение 3,5 ч реакционную смесь вливают в воду (150 мл) и диизопропиловый эфир (250 мл). Смесь фильтруют через пористое стекло. Осадок собирают и промывают отдельно водой (14 мл). Полученную суспензию вновь фильтруют через пористое стекло, получая после высушивания в течение ночи в эксикаторе над P2O5 3,17 г 7,10 диметокси-10-дезацетилбаккатина (чистота по ЖХВР 93% с внутренней стандартизацией поверхностей). Выход выделенного продукта составляет 61%. Пример 5. Трет-бутилат калия/метилйодид/тетрагидрофуран/10-ДАБ. К суспензии трет-бутилата калия (336 мг, 3 ммоль, 3 экв) в тетрагидрофуране (4 мл) при -30 С прибавляют по каплям суспензию 10 дезацетилбаккатина III (544 мг, 1 ммоль) в смеси тетрагидрофуран/метилйодид (3/2, 5 мл). Вслед за этим температуре дают постепенно подняться до комнатной. После перемешивания в течение 3,5 ч реакционная смесь по данным ЖХВС содержит 10,0% (при внутренней стандартизации поверхностей) 7,10-диметокси-10-дезацетилбаккатина. Пример 6. Гидрид калия/метилсульфат/тетрагидрофуран/10-ДАБ. Гидрид калия в виде 20%-ной суспензии в минеральном масле (0,6 г, 3 ммоль, 3 экв) предварительно промывают пентаном. К суспензии предварительно промытого пентаном гидрида калия в тетрагидрофуране (3 мл) при -20 С одновременно прибавляют по каплям суспензию 10-дезацетилбаккатина III(544 мг, 1 ммоль) в тетрагидрофуране (6 мл) и раствор метилсульфата (2,0 г, 16 ммоль, 16 экв) в тетрагидрофуране (2 мл). Вслед за этим температуре дают постепенно подняться до комнатной. После протекания реакции в течение 8 ч реакционную смесь вливают в воду (20 мл) и выдерживают в течение ночи при -4 С. Затем добавляют диизопропиловый эфир (20 мл) и полученную смесь фильтруют через пористое стекло, получая 220 мг неочищенного продукта,содержащего по данным ЖХВР 98% (при внутренней стандартизации поверхностей) 7,10 диметокси-10-дезацетилбаккатина. Пример 7. Гидрид калия/тетрафторборат триметилоксония/тетрагидрофуран/10-ДАБ. 9 Гидрид калия в виде 20%-ной суспензии в минеральном масле (0,6 г, 3 ммоль, 3 экв) предварительно промывают пентаном. К суспензии предварительно промытого пентаном гидрида калия в тетрагидрофуране (3 мл) при -20 С добавляют суспензию 10 дезацетилбаккатина III (544 мг, 1 ммоль) в тетрагидрофуране (3 мл). Температуре дают постепенно подняться до -10 С. После протекания реакции в течение 2 ч добавляют суспензию гидрида калия (2 экв) в тетрагидрофуране (1 мл). Продолжают реакцию еще 2 ч и получают реакционную смесь, содержащую по данным ЖХВР 16,3% (при внутренней стандартизации поверхностей) 7,10-диметокси-10-дезацетилбаккатина. Пример 8. Гидрид калия/метилйодид/1,2 диметоксиэтан/10-ДАБ. Гидрид калия в виде 20%-ной суспензии в минеральном масле (0,6 г, 3 ммоль, 3 экв) предварительно промывают пентаном. К суспензии предварительно промытого пентаном гидрида калия в 1,2-диметоксиэтане (3 мл) при -20 С прибавляют по каплям раствор 10-дезацетилбаккатина III (544 мг, 1 ммоль) в смеси 1,2-диметоксиэтан/метилйодид (3/1, 8 мл). Температуре дают постепенно подняться до комнатной. После перемешивания в течение 6,5 ч данные ЖХВР свидетельствуют о том, что реакционная смесь содержит 28,1% (при внутренней стандартизации поверхностей) 7,10 диметокси-10-дезацетилбаккатина. Пример 9. Гидрид калия/метилйодид/тетрагидрофуран/соединение формулы (V), где А указано выше (R1 - фенил, R2 - водород, R3 трет-бутоксикарбонил, R4 - 4-метоксифенил). Гидрид калия в виде 20%-ной суспензии в минеральном масле (0,145 г, 2,4 экв) предварительно промывают пентаном. К суспензии предварительно промытого пентаном гидрида калия в тетрагидрофуране(0,7 мл) при -78 С прибавляют по каплям суспензию 4-ацетокси-2-бензоилокси-5, 20 эпокси-1, 7,10-тригидрокси-9-оксотакс-11-ен 13-илового эфира (2R,4S,5R)-3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-5 оксазолидин-карбоновой кислоты (284 мг, 0,3 ммоль) в смеси тетрагидрофуран/метилйодид(5/3,1,6 мл). Температуре дают постепенно подняться до -15 С. После перемешивания в течение 3,5 ч реакционную смесь вливают в воду (15 мл) и этилацетат (15 мл). Органическую фазу отделяют, промывают рассолом (15 мл), сушат над сульфатом натрия, фильтруют и упаривают(232 мг). По данным ЖХВР для неочищенного продукта, выход 4-ацетокси-2-бензоил-окси 5,20-эпокси-1-гидрокси-9-оксо-7,10-диметокситакс-11-ен-13-илового эфира (2R, 4S, 5R)3-трет-бутоксикарбонил-2-(4-метоксифенил)-4 фенил-5-оксазолидинкарбоновой кислоты составляет 39%. 10 Пример 10. Гидрид натрия/метилйодид/тетрагидрофуран/10-ДАБ. Гидрид калия в виде 55%-ной суспензии в минеральном масле (0,13 г, 3 ммоль, 3 экв) предварительно промывают пентаном. К суспензии предварительно промытого пентаном гидрида натрия в тетрагидрофуране (3 мл) при 0 С прибавляют по каплям суспензию 10-дезацетилбаккатина III (544 мг, 1 ммоль) в смеси тетрагидрофуран/метилйодид (3/2, 5 мл). Температуре дают постепенно подняться до комнатной. После перемешивания в течение 7,5 ч реакционную смесь вливают в воду (25 мл) и диизопропиловый эфир (25 мл). Появившийся осадок отфильтровывают на пористом стекле. Получают 57 мг продукта, содержащего 67%(при внутренней стандартизации поверхностей) 7,10-диметокси-10-дезацетилбаккатина. Пример 11. н-Бутиллитий/трет-бутилат калия/тетрагидрофуран/10-ДАБ. Раствор н-бутиллития в гексане (2 мл, 3 ммоль, 3 экв) упаривают в вакууме. Остаток поглощают предварительно охлажденным до -78 С тетрагидрофураном (3 мл). Вслед за этим добавляют трет-бутилат калия (336 мг, 3 ммоль, 3 экв) и затем суспензию 10-дезацетилбаккатина III (544 г, 1 ммоль) в смеси тет-рагидрофуран/метилйодид (3/2,5 мл). Температуре дают постепенно подняться до комнатной. После протекания реакции в течение 3 ч 45 мин смесь вливают в воду (10 мл) и диизопропиловый эфир (10 мл). После кристаллизации при температуре 4 С в течение ночи получают 75 мг кристаллов, содержащих 61% (при внутренней стандартизации поверхностей) 7,10-диметокси-10 дезацетилбаккатина. Пример 12. н-Бутиллитий/трет-бутилат калия/диизопропиламин/тетрагидрофуран/10 ДАБ. Раствор н-бутиллития в гексане (2 мл, 3 ммоль, 3 экв) упаривают в вакууме. Остаток поглощают раствором диизопропиламина (0,5 мл, 3 ммоль, 3 экв) в предварительно охлажденном до -78 С тетрагидрофуране (3 мл). После этого добавляют трет-бутилат калия (336 мг, 3 ммоль, 3 экв) и затем суспензию 10 дезацетилбаккатина III (544 мг, 1 ммоль) в смеси тетрагидрофуран/метилйодид (3/2, 5 мл). Температуре дают постепенно подняться до комнатной. После протекания реакции в течение 19 ч данные ЖХВР свидетельствуют о том, что реакционная смесь содержит 24% (при внутренней стандартизации поверхностей) 7,10 диметокси-10-дезацетилбаккатина. Пример 13. Амидат натрия/трет-бутиловый спирт/тетрагидрофуран/10-ДАБ. Суспензию амидата натрия (173 мг, 4 ммоль, 4 экв) и трет-бутилового спирта (0,13 мл,1,3 ммоль, 1,3 экв) в тетрагидрофуране (2 мл) нагревают в течение 2 ч при 45 С. После самопроизвольного охлаждения до комнатной температуры смесь охлаждают до -50 С и прибавляют по каплям суспензию 10-дезацетил 11 баккатина III (544 г, 1 ммоль) в смеси тетрагидрофуран/метилйодид (3/2, 5 мл). Температуре дают постепенно подняться до -20 С. После перемешивания в течение 2 ч 20 мин смесь вливают в воду (10 мл) и диизопропиловый эфир(10 мл). Осадок отфильтровывают на пористом стекле, получая 160 мг неочищенного продукта,содержащего 37% (при внутренней стандартизации поверхностей) 7,10-диметокси-10 дезацетилбаккатина. Пример 14. Тетрафторборат триметилоксония/1,8-бис(диметиламино)нафталин/сита 4/10-ДАБ. К суспензии 10-дезацетилбаккатина III(109 мг, 0,2 ммоль) в хлористом метилене (4 мл) при 25 С последовательно добавляют 1,8 бис(диметиламино)нафталин (514 мг, 2,4 ммоль,12 экв), молекулярные сита 4 (700 мг) и тетрафторборат триметилоксония (296 мг, 2 ммоль,10 экв). После перемешивания в течение 24 ч при комнатной температуре данные ЖХВР свидетельствуют о том, что реакционная смесь содержит 7,10-диметокси-10-дезацетилбаккатин в количестве, соответствующем выходу 17%. Пример 15. К суспензии 10-дезацетилбаккатина III(0,2876 г, 0,46 ммоль) в этилацетате (7,8 мл) при 20 С последовательно добавляют 1,8 бис(диметиламино)нафталин (1,2744 г, 5,95 ммоль, 12,8 экв) и тетрафторборат триметилоксония (0,7598 г, 14 ммоль, 11 экв). После перемешивания в течение 2 ч 20 мин при температуре от 45 до 50 С данные ЖХВР свидетельствуют о том, что реакционная смесь содержит 7,10 диметокси-10-дезацетилбаккатин в количестве,соответствующем выходу 62%. Анализы 7,10-диметокси-10-дезацетилбаккатина III ЯМР-анализ производили на спектрометре Bruker AM 360, работающем при 360 МГц для анализа по протону и при 90 МГц для анализа по углероду-13 и оборудованному двойным 5-мм зондом протон/углерод 13. Химические сдвиги выражены в мд (милионных долях). В качестве внешнего стандарта использован ДМСО (диметилсульфоксид: 2,44 мд по протону и 39,5 мд по углероду). Температуру контролировали при 300 К с помощью регулируемого температурного блока. Синглет Мультиплет Мультиплет Синглет Синглет Синглет Синглет Синглет ДуплетO-Н спиртовый (третичный) Углеводородный скелет С-Н групп O-СН 3 С=O групп ОАс и кетона С-O простого ароматического эфира С-O спиртов и простых циклических эфиров ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ прямого одностадийного одновременного алкилирования двух гидроксильных функций в положениях 7 и 10 10 дезацетилбаккатина III или производных этого соединения, этерифицированных в положении 13, отвечающих формуле (V) в которой А обозначает водород или боковую цепь формулы (Iс)G обозначает защитную группу для гидроксильной функции и 13 1) прямой или разветвленный С 1-С 8-алкил,прямой или разветвленный С 2-С 8-алкенил, прямой или разветвленный С 2-С 8-алкинил, С 3-С 6 циклоалкил, фенил или - или -нафтил, который может быть замещен одним или несколькими атомами или радикалами, выбранными из атомов галогена и радикалов алкил, алкенил,алкинил, арил, арилалкил, алкокси, алкилтио,арилокси, арилтио, гидрокси, гидроксиалкил,меркапто, формил, ацил, ациламино, ароиламино, алкоксикарбониламино, амино, алкиламино,диалкиламино, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил, диалкилкарбамоил,циано, нитро и трифторметил, или 2) пятичленный ароматический гетероцикл, содержащий один или несколько одинаковых или различных гетероатомов, выбранных из атомов азота, кислорода, серы, который может быть замещен одним или несколькими одинаковыми или различными заместителями, выбранными из атомов галогена и радикалов алкил, арил, амино, алкиламино, диалкиламино,алкоксикарбониламино, ацил, арилкарбонил,циано, карбокси, карбамоил, алкилкарбамоил,диалкилкарбамоил или алкоксикарбонил,3) при условии, что в радикалах фенил, или -нафтил и ароматических гетероциклах алкильные заместители или алкильные части других заместителей содержат 1-4 атома углерода, что радикалы алкенил и алкинил содержат 2-8 атомов углерода и что арильные радикалы представляют собой радикалы фенил или - илиR2 обозначает 1) радикал бензоил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из атомов галогена, радикалов С 1-С 4 алкил, C1-C4-алкокси, трифторметил, теноил или фуроил, или 2) радикал R'2-O-CO-, в котором R'2 обозначает:C1-C8-алкил,С 2-С 8-алкенил,С 3-С 8 алкинил, С 3-С 6-циклоалкил, С 4-С 6-циклоалкенил или С 7-С 10-бициклоалкил, которые могут быть замещены одним или несколькими атомами или радикалами, выбранными из атомов галогена,радикалов гидрокси, С 1-С 4-алкокси, ди-С 1-С 4 алкиламино, пиперидино, морфолино, пиперазин-1-ил (который может быть замещен в положении 4 С 1-С 4-алкилом или фенил-С 1-С 4 алкилом),С 3-С 6-циклоалкил,С 4-С 6-циклоалкенил, фенил (возможно, замещенный одним или несколькими атомами или радикалами, выбранными из атомов галогена и радикалов С 1 С 4-алкил или C1-C4-алкокси), циано, карбокси или С 1-С 4-алкоксикарбонил; радикал фенил или - или -нафтил, который может быть замещен одним или несколькими атомами или радикалами, выбранными из атомов галогена и радикалов С 1-С 4-алкил, С 1-С 4 002622 14 алкокси, или пятичленный ароматический гетероциклический радикал, выбранный преимущественно из фурила и тиенила; или насыщенный гетероциклический радикал с 4-6 атомами углерода, который может быть замещен одним или несколькими С 1-С 4-алкилами,или оксазолидиновую группу формулы (Id) в которой R3 и R4 обозначают водород или радикалы алкил, арил, галоген, алкокси, арилалкил, алкоксиарил, галогеналкил, галогенарил,или могут вместе образовывать 4-7-членный цикл, заключающийся в том, что алкилирующий агент выбирают из алкилгалогенидов и преимущественно из алкилйодидов (RI),алкилсульфатов, таких как метилсульфат,оксониевых солей, таких как триалкилоксониевые соли соединений бора, в частности тетрафторборат триметилоксония,и используют в присутствии одного или нескольких агентов анионизации, таких как одно или несколько сильных оснований в безводной среде. 2. Способ по п.1, отличающийся тем, что алкилирующим агентом является метилсульфат или метилйодид, предпочтительно метилйодид. 3. Способ по п.1, отличающийся тем, что основания, пригодные для использования в безводной среде, выбирают из гидридов щелочных металлов, алкоголятов щелочных металлов, оксида серебра, 1,8-бис(диметиламино)нафталина,амидов щелочных металлов в смеси с третбутилатами щелочных металлов или алкиллитиевых соединений в смеси с трет-бутилатами щелочных металлов. 4. Способ по п.3, отличающийся тем, что гидриды щелочных металлов выбирают из гидридов натрия или калия, предпочитая гидрид калия. 5. Способ по п.3, отличающийся тем, что алкоголятом щелочного металла является третбутилат калия. 6. Способ по п.1, отличающийся тем, что алкилирующим агентом является метилйодид в присутствии гидрида калия. 7. Способ по любому из предыдущих пунктов, отличающийся тем, что реакцию проводят в органической среде, инертной в условиях реакции. 8. Способ по пп.4-6, отличающийся тем,что используемый растворитель выбирают из простых эфиров. 9. Способ по п.3, отличающийся тем, что,когда реакцию проводят в присутствии оксида серебра, используют растворитель, выбираемый из ароматических растворителей и апротонных полярных растворителей. 10. Способ по п.8, отличающийся тем, что в качестве растворителя используют тетрагидрофуран или диметоксиэтан. 11. Способ по пп.1 и 3, отличающийся тем,что используют смесь 1,8-бис(диметиламино)нафталин и тетрафторбората триметилоксония в этилацетате. 12. Способ по любому из предыдущих пунктов, отличающийся тем, что молярное от 16 ношение агента анионизации к субстрату превышает 2 и предпочтительно составляет от 2 до 20. 13. Способ по любому из предыдущих пунктов, отличающийся тем, что молярное отношение алкилирующего агента к субстрату превышает 2 и предпочтительно составляет от 2 до 40. 14. Способ по любому из предыдущих пунктов, отличающийся тем, что используемая температура реакции составляет от -30 до 80 С.
МПК / Метки
МПК: C07D 305/14
Метки: таксоидов, класса, способ, получения, производных
Код ссылки
<a href="https://eas.patents.su/9-2622-sposob-polucheniya-proizvodnyh-klassa-taksoidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных класса таксоидов</a>
Предыдущий патент: Соединения пиперидиниламинометил трифторметил циклических эфиров в качестве антагонистов вещества р
Случайный патент: Cъёмное покрытие поверхностей













