Способ получения симвастатина и его производных
Формула / Реферат
1. Способ получения соединения формулы (I)
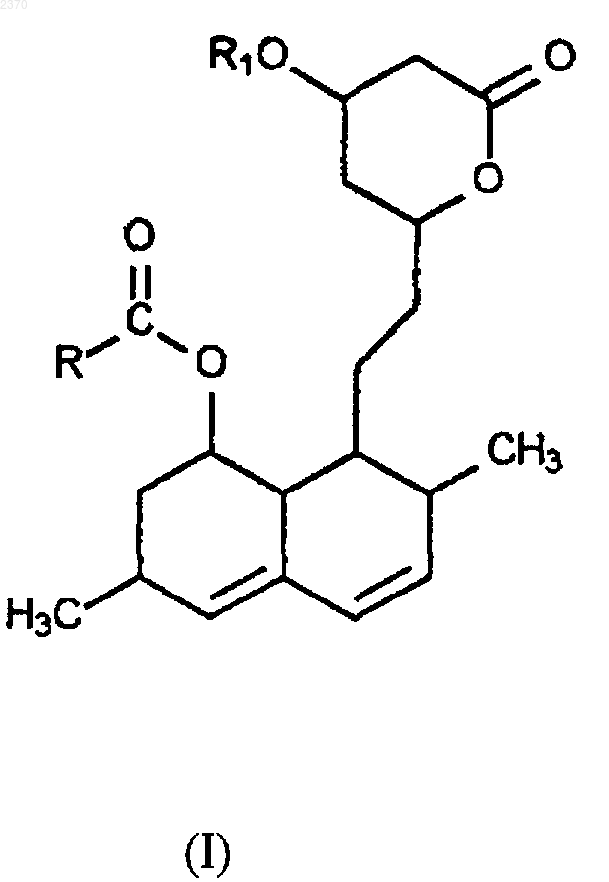
где R означает алкильную группу с 1-12 атомами углерода и R1 означает защитную группу или Н,
и этот способ включает
(а) превращение дигидроксилактона формулы (II)
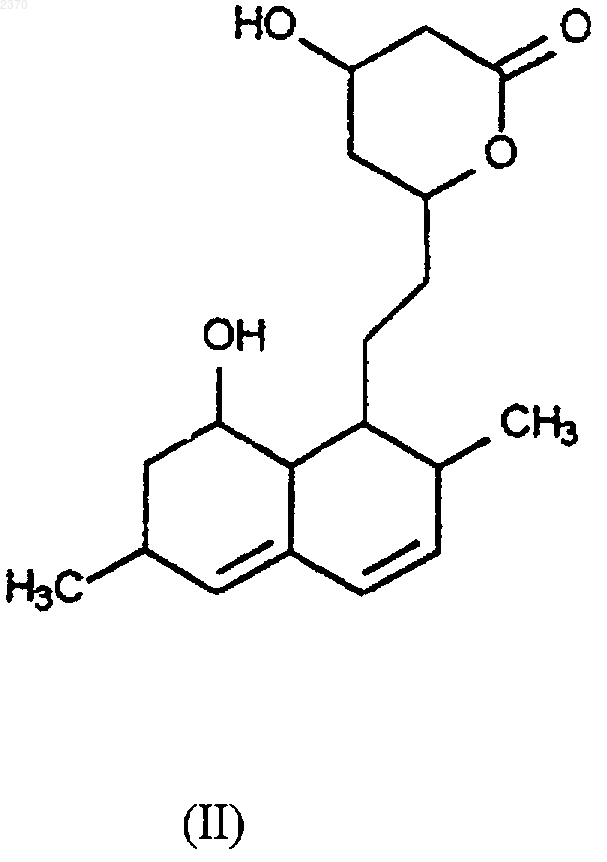
в защищенный дигидроксилактон формулы (IIа), где R1 означает защитную группу,
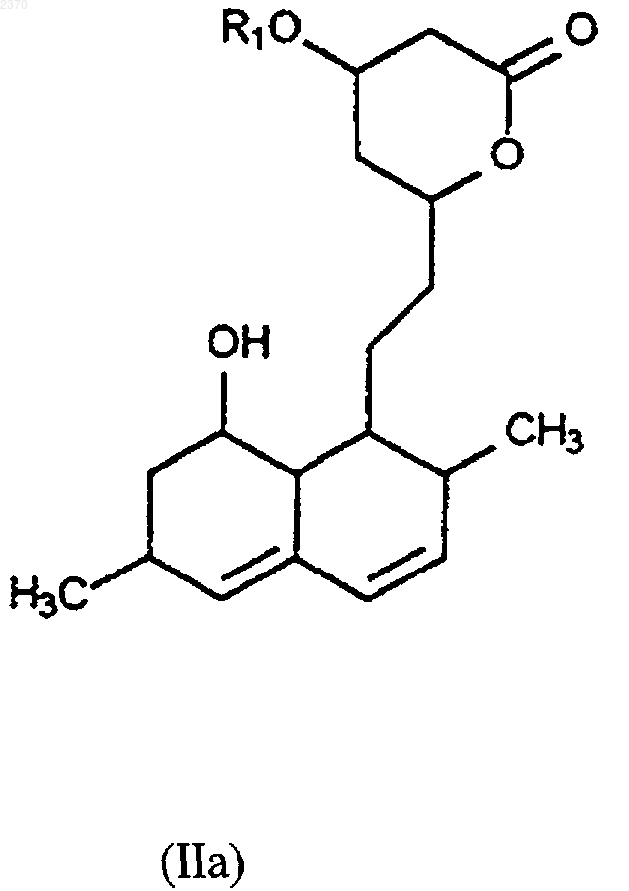
(b) ацилирование защищенного дигидроксилактона формулы (IIа) с получением соединения (I), где R1 означает защитную группу, и
(с) необязательное удаление защитной группы R1 с получением соединения (I), где R1 означает Н, и
в котором стадии (а) и/или (b) проводятся в присутствии N-метилимидазола.
2. Способ по п.1, отличающийся тем, что N-метилимидазол используется в количестве, достаточном для растворения дигидроксилактона (II) и защищенного дигидроксилактона (IIа) соответственно при температуре проведения реакции.
3. Способ по п.1 или 2, отличающийся тем, что защитная группа, используемая в качестве R1, представляет собой силильную группу и, в частности, триалкилсилильную группу.
4. Способ по любому из пп.1-3, отличающийся тем, что в качестве защитной группы R1 используется трет-бутилдиметилсилильная группа.
5. Способ по любому из пп.1-4, отличающийся тем, что на стадии (b) защищенный дигидроксилактон (IIа) ацилируют активированной формой кислоты формулы (III)
R-CO-OH (III)
и R является таким, как определено в п.1.
6. Способ по п.5, отличающийся тем, что в качестве активированной формы кислоты (III) используют галогенангидрид кислоты формулы (IIIa)
R-CO-галоген (IIIa)
или ангидрид кислоты формулы (IIIb)
(R-CO)2O (IIIb)
7. Способ по п.6, отличающийся тем, что в качестве галогенангидрида кислоты используется хлорангидрид кислоты.
8. Способ по любому из пп.1-7, отличающийся тем, что после завершения стадии (b) к реакционной смеси прибавляют алифатический спирт с 1-8 атомами углерода.
9. Способ по любому из пп.1-8, отличающийся тем, что в качестве алифатического спирта используется метанол.
10. Способ по любому из пп.1-9, отличающийся тем, что стадии (а) и (b) проводят как реакцию в одном сосуде без выделения защищенного дигидроксилактона (IIа).
11. Способ по любому из пп.1-10, отличающийся тем, что стадии (а) и/или (b) проводят при температуре от примерно 0 до примерно 30шС.
12. Способ по любому из пп.1-11, отличающийся тем, что R означает алкильную группу с 5 атомами углерода, предпочтительно СН3-СН2-С(СН3)2-.
Текст
1 Техническая область изобретения Настоящее изобретение относится к области органической химии, к способу получения ингибитора гидроксиметилглутарил-СоА-редуктазы - симвастатина и его производных. Симвастатин является полусинтетическим аналогом природного продукта ферментации ловастатина, который содержит 2-метилбутиратную боковую цепь в положении 8 гексагидронафталиновой циклической системы. Обнаружено, что замена 2-метилбутиратной группы на 2,2-диметилбутиратную группу приводит к более активным ингибиторам гидроксиметилглутарил-СоА-редуктазы (J. Med. Chem., 1986,29 (5), 849-852). Техническая проблема Ранее получение симвастатина и его производных было возможно только с низким выходом. Способам, соответствующим предшествующему уровню техники, свойственен тот недостаток, что после завершения реакции остаются большие количества неиспользованных исходных веществ. Эти исходные вещества, а также значительные количества образовавшихся нежелательных побочных продуктов приводят к затруднениям при выделении продукта. Таким образом, необходим способ, в котором эти затруднения преодолены. Предшествующий уровень техники изобретения Известные способы получения симвастатина и его производных можно, в основном,подразделить в соответствии с двумя используемыми синтетическими подходами, а именно,(А) с так называемой схемой переэтерификации и (В) с прямым метилированием метилбутиратной боковой цепи. Пример первого синтетического подхода описан в ЕР-В-33538. В нем раскрыт пятистадийный способ, который включает стадии (1) исчерпывающего омыления ловастатина; (2) перелактонизации; (3) селективного силилирования; (4) переацилирования; и (5) десилилирования. Опубликованные полные выходы, достигающиеся при этом способе, являются низкими,а именно, лишь 48% (J. Org. Chem. 56, 4929(1991. Это частично приписано равному 69% низкому выходу на стадии селективного силилирования (3). Кроме того, переацилирование(4) проводится при высокой температуре, равной 100 С, в течение длительного времени (1836 ч) в присутствии 4-пирролидинопиридина или диалкиламинопиридина. Такие условия проведения реакции приводят к получению значительного количества нежелательного побочного продукта (ненасыщенного лактона), образующегося в результате элиминирования третбутилдиметилсилилоксильного радикала, присутствующего в качестве защитной группы спирта, от -валеролактонового фрагмента. Кроме того, в конце реакции также остаются большие количества исходного дигидроксилак 002370 2 тона и неизрасходованного хлорангидрида кислоты. В ЕР-В-287340 раскрыт улучшенный способ получения антигиперхолестеринемических соединений, который включает реакцию подходящего хлорангидрида кислоты с бромидом щелочного металла, диалкиламинопиридином и полигидронафтиловым спиртом с получением соответствующего ацилированного продукта. Реакция проводится при относительно высокой температуре, равной 70 С, так что в количестве около 12% также образуется побочный продукт - ненасыщенный лактон. Кроме того, для использования в этом способе предпочтительным растворителем является пиридин, который небезопасен для окружающей среды и человека. Второй синтетический подход, прямое алкилирование метилбутиратной боковой цепи,раскрыт в ЕР-В-137445 и ЕР-В-299656. Эти способы включают использование алкиламида металла и метилгалогенида. Основным недостатком этих способов является загрязнение продукта значительным количеством непрореагировавших исходных веществ, например ловастатина. Поскольку симвастатин и ловастатин отличаются друг от друга только одной метильной группой, с помощью обычных методов разделения очень трудно выделить симвастатин из смеси, содержащей оба эти соединения. По этой причине обычно необходима дополнительная стадия очистки, например селективный гидролиз оставшегося ловастатина методом, раскрытым в WO 93/16188.N-Метилимидазол, также называемый 1 метилимидазолом, является известным соединением, используемым при ацетилировании гидроксисоединений уксусным ангидридом (см.Anal. Chem. 50, 1542-1545 (1978. Однако со стерически заторможенными спиртами эта реакция дает плохой выход. В случае третбутилового спирта выход составляет лишь 36%. Кроме того, в Anal. Chem. 52, 572 (1980) показано, что N-метилимидазол также можно использовать в качестве катализатора при ацетилировании полимеров с концевыми гидроксильными группами с помощью уксусного ангидрида. Подробное описание изобретения В соответствии с настоящим изобретением предоставляется способ получения соединения формулы (I) 3 где R означает алкильную группу с 1-12 атомами углерода иR1 означает защитную группу или Н,и этот способ включает(а) превращение дигидроксилактона формулы (II)(b) ацилирование защищенного дигидроксилактона формулы (IIа) с получением соединения (I), где R1 означает защитную группу, и(с) необязательное удаление защитной группы R1 с получением соединения (I), где R1 означает Н, и в котором стадии (а) и/или (b) проводятся в присутствии N-метилимидазола. Соединения формулы (I) являются эффективными антигиперхолестеринемическими соединениями и, в частности, включают симвастатин. В формуле (I) группа R может представлять собой разветвленную или линейную алкильную группу с 1-12 атомами углерода или циклоалкильную группу с 3-10 атомами углерода, предпочтительно алкильную группу с 5 атомами углерода, в особенности СН 3-СН 2-С(СН 3)2-. Подходящими примерами защитных группR1 являются группы, обычно используемые для селективной защиты гидроксильных групп, такие как силильные группы. Предпочтительными являются триалкилсилильные группы, такие как изопропилдиметилсилильная, (трифенилметил) диметилсилильная, трет-бутилдифенилсилильная, метилдиизопропилсилильная, трибензилсилильная, триизопропилсилильная, а особенно предпочтительным примером является трет-бутилдиметилсилильная группа. Неожиданно было показано, что соединения (I) можно получить с помощью процесса ацилирования, соответствующего настоящему изобретению, очень эффективным образом и с высоким выходом без образования значитель 002370 4 ных количеств нежелательного побочного продукта. Обнаружено, что особенно хорошие результаты получаются, когда N-метилимидазол присутствует на обеих стадиях процесса, (а) и(b). Таким образом, N-метилимидазол, видимо,действует в качестве катализатора не только на стадии защиты (а), но и на стадии ацилирования(b), что приводит к превосходному суммарному выходу. Дигидроксилактон (II), используемый на стадии (а), можно получить, например, путем гидролиза ловастатина методом, раскрытым в ЕР-В-33538. В случае введения силильной группы, такой как трет-бутилдиметильная защитная группа, выход на стадии (а) достигает практически 100%. Поскольку на стадии (а) побочный продукт практически не образуется, можно проводить стадии (а) и (b) как реакцию в одном сосуде без выделения образовавшегося защищенного дигидроксилактона (IIа). Эта предпочтительная реализация настоящего изобретения значительно упрощает получение целевого соединения (I). Также обнаружено, что из-за присутствия N-метилимидазола длительность протекания реакции (а) уменьшается и обычно составляет лишь от 1,5 до 4 ч.N-Метилимидазол предпочтительно использовать в количестве, достаточном для того,чтобы при выбранной температуре реакции растворялся дигидроксилактон (II) и защищенный дигидроксилактон (IIа) соответственно. Поэтому он может также служить растворителем. Ввиду возможности его использования на стадиях (а) и (b), нет необходимости заменять растворитель после завершения стадии (а), что весьма благоприятно при проведении синтеза в одном сосуде. В отличие от известного уровня техники,стадии (а) и/или (b) можно проводить при низких температурах, в частности в диапазоне от примерно 0 до примерно 30 С. Низкая температура реакции, в особенности при проведении реакции ацилирования (b), приводит к значительному снижению содержания побочных продуктов, таких как ненасыщенный лактон. В способах, соответствующих известному уровню техники, для проведения стадии ацилирования необходима температура, равная 100 или 70 С. Стадию ацилирования (b) предпочтительно проводить путем введения защищенного дигидроксилактона (IIа) в реакцию с подходящей активированной формой кислоты формулы (III)(III) Предпочтительными активированными формами являются ангидриды соответствующих кислот или их галогенангидриды. Эти галогенангидриды кислот и ангидриды кислот имеются в продаже или их можно получить из известных исходных веществ с использованием стандартных химических реакций. 5 Неожиданно было обнаружено, что обработка реакционной смеси, полученной после завершения реакции ацилирования (b), в значительной степени облегчается при добавлении к этой смеси алифатического спирта с 1-8 атомами углерода, в особенности метанола. Было предположено, что спирт взаимодействует с непрореагировавшей активированной кислотой(III) с образованием соответствующего сложного эфира, который легче удалить. На необязательной стадии (с) настоящего процесса защитную группу R1 удаляют обычными способами и получают соответствующее соединение формулы (I), где R1 означает Н, такое как симвастатин. Например, силильные защитные группы можно отщепить с помощью системы тетрабутиламмонийфторид/уксусная кислота, и соответствующая процедура описана в ЕР-В-33538, или путем использования эфирата трифторида бора, как это раскрыто в ЕР-А 444888. Предпочтительный способ проведения настоящего процесса иллюстрируется следующей последовательностью реакций, начинающейся с ловастатинаt-Bu - трет-бутил; Me - метил; nBu - нбутил; Ас - ацетил; THF - тетрагидрофуран. Ловастатин, используемый в этой последовательности реакций в качестве исходного вещества, имеется в продаже или его можно получить с помощью известных способов, например способов, раскрытых в ЕР-В-22478 или WO 97/05269. На первой стадии ловастатин гидролизуют в условиях, раскрытых в ЕР-В 33538, с получением дигидроксилактона (II). После введения силильной защитной группы и ацилирования в присутствии N-метилимидазола образуется соответствующее соединение (I). Его можно превратить в соединение (I) без защитной группы, где R1 означает Н, путем обработки с помощью системы тетрабутиламмонийфторид/уксусная кислота в тетрагидрофуране. Основными преимуществами настоящего способа по сравнению с известными способами являются высокие выходы продукта (I), обычно достигающие 90-95% (в расчете на дигидроксилактон (II, сниженное количество побочных продуктов, возможность проведения реакции в 6 одном сосуде и легкость удаления избытка ацилирующего реагента, что осуществляется путем прибавления спирта к реакционной смеси. Ниже настоящее изобретение иллюстрируется примерами. Примеры В этих примерах содержание определяют с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии). При описании спектров ЯМР использованы следующие обозначения: d - дублет, s синглет, m - мультиплет. Пример 1. Получение 6(R)-[2[8(S)-(2,2-диметилбутирилокси)-2(S),6(R)-диметил-1,2,6,7,8,8 а(R)-гексагидронафтил-1(S)]-этил]-4(R)-третбутилдиметилсилилокси-3,4,5,6-тетрагидро-2 Нпиран-2-она. 1,81 г (12 ммоль) трет-бутилдиметилхлорсилана прибавляют к раствору 3,2 г (10 ммоль) соответствующего дигидроксилактона формулы(II) в N-метилимидазоле и смесь перемешивают при комнатной температуре в атмосфере азота в течение 3,5 ч. Полученный раствор охлаждают до 0 С и в течение 20 мин прибавляют 5,5 мл(39 ммоль) 2,2-диметилбутирилхлорида. Смесь перемешивают в течение 1 ч при 0 С и затем в течение 42 ч при комнатной температуре. Прибавляют 7 мл метанола и смесь перемешивают в течение 1 ч. Полученную смесь разбавляют с помощью 250 мл бутилацетата и промывают 0,7% раствором НСl (300 мл) и насыщенным раствором NaCl (2 х 125 мл). Объединенные органические фазы сушат над безводным MgSO4,фильтруют и выпаривают летучие компоненты в вакууме, получая указанное соединение в виде светло-коричневого масла. 1 Н-ЯМР (300 МГц, CDCl3) в м.д. (главные пики): 5,97 (d, 1H, J=9,75 Гц), 5,75 (dd, 1 Н,J=9,75, 6,15 Гц), 5,43-5,52 (m, 1H), 5,26-5,35 (m,1H), 4,48-4,64 (m, 1H), 4,22-4,33 (m, 1H), 2,172,65 (m, 5H), 0,70-2,05 (m, 35H; содержащий два 3 Н синглета при 1,11 и 9 Н синглет при 0,85 м. д.), 0,06 (s, 3 Н), 0,05 (s, 3 Н). Чистота продукта, определенная с помощью ВЭЖХ, составляет 97-98,5% площади. Содержание ненасыщенного побочного продукта составляет менее 0,5%. Содержание продукта составляет 93%. Полученное соединение можно превратить в симвастатин путем удаления силильной защитной группы, осуществляемого стандартным образом. Пример 2 (сравнительный пример). Чтобы продемонстрировать превосходство способа, соответствующего настоящему изобретению, повторен способ, соответствующий известному уровню техники, раскрытый в примере 2 в ЕР-В-287340. Получение 6(R)-[2[8(S)-(2,2-диметилбутирилокси)-2(S),6(R)-диметил-1,2,6,7,8,8 а(R)-гексагидронафтил-1(S)]-этил]-4(R)-трет-бутилди 7 метилсилилокси-3,4,5,6-тетрагидро-2 Н-пиран-2 она. Бромид лития (2,08 г, 12 ммоль, безводный,подвергнутый сушке в вакууме в течение 4 суток при 135 С) как можно быстрее прибавляют в атмосфере N2 к раствору 2,2-диметилбутирилхлорида (1,62 мл, 12 ммоль) в безводном пиридине (7 мл). После снижения температуры до 25 С прибавляют раствор соответствующего дигидроксилактона, защищенного силильньми группами (2,604 г, 6 ммоль) и 4,4-диметиламинопиридина (0,147 г, 1,2 ммоль) в пиридине(7 мл). Смесь перемешивают при 70 С в течение 3,5 ч. Затем смесь охлаждают до комнатной температуры, выливают в Н 2 О (70 мл) и экстрагируют с помощью 2 х 70 мл этилацетата. Объединенные органические экстракты промывают с помощью 2 х 35 мл 1,2 н. раствора НСl, 35 мл насыщенного раствора NaHCO3, 35 мл насыщенного раствора NaCl, сушат над безводнымNa2SO4, фильтруют и выпаривают в вакууме,получая указанное соединение в виде светлокоричневого масла. 1 Н-ЯМР (300 МГц, CDCl3) в м.д. (главные пики): 5,97 (d, 1H, J=9,75 Гц), 5,75 (dd, 1H,J=9,75, 6,15 Гц), 5,43-5,52 (m, 1H), 5,26-5,35 (m,1H), 4,48-4,64 (m, 1H), 4,22-4,33 (m, 1H), 2,172,65 (m, 5H), 0,70-2,05 (m, 35H; содержащий два 3 Н синглета при 1,11 и 9 Н синглет при 0,85 м. д.), 0,06 (s, 3 Н), 0,05 (s, 3 Н). Чистота продукта, определенная с помощью ВЭЖХ, составляет лишь 83% площади, а содержание ненасыщенного побочного продукта составляет 0,7%. Кроме того, обнаружено 12% соответствующего защищенного дигидроксилактона (формула (IIа, что свидетельствует о том, что реакция ацилирования не протекала удовлетворительным образом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где R означает алкильную группу с 1-12 атомами углерода иR1 означает защитную группу или Н,и этот способ включает(а) превращение дигидроксилактона формулы (II) в защищенный дигидроксилактон формулы (IIа), где R1 означает защитную группу(b) ацилирование защищенного дигидроксилактона формулы (IIа) с получением соединения (I), где R1 означает защитную группу, и(с) необязательное удаление защитной группы R1 с получением соединения (I), где R1 означает Н, и в котором стадии (а) и/или (b) проводятся в присутствии N-метилимидазола. 2. Способ по п.1, отличающийся тем, чтоN-метилимидазол используется в количестве,достаточном для растворения дигидроксилактона (II) и защищенного дигидроксилактона (IIа) соответственно при температуре проведения реакции. 3. Способ по п.1 или 2, отличающийся тем,что защитная группа, используемая в качествеR1, представляет собой силильную группу и в частности триалкилсилильную группу. 4. Способ по любому из пп. от 1 до 3, отличающийся тем, что в качестве защитной группы R1 используется трет-бутилдиметилсилильная группа. 5. Способ по любому из пп. от 1 до 4, отличающийся тем, что на стадии (b) защищенный дигидроксилактон (IIа) ацилируют активированной формой кислоты формулы (III)(III) и R является таким, как определено в п.1. 6. Способ по п.5, отличающийся тем, что в качестве активированной формы кислоты (III) используют галогенангидрид кислоты формулыR-CO-галоген (IIIa) или ангидрид кислоты формулы (IIIb)(IIIb) 7. Способ по п.6, отличающийся тем, что в качестве галогенангидрида кислоты используется хлорангидрид кислоты. 8. Способ по любому из пп. от 1 до 7, отличающийся тем, что после завершения стадии(b) к реакционной смеси прибавляют алифатический спирт с 1-8 атомами углерода. 9. Способ по любому из пп. от 1 до 8, отличающийся тем, что в качестве алифатического спирта используется метанол. 10. Способ по любому из пп. от 1 до 9, отличающийся тем, что стадии (а) и (b) проводят как реакцию в одном сосуде без выделения защищенного дигидроксилактона (IIа). 10 11. Способ по любому из пп. от 1 до 10,отличающийся тем, что стадии (а) и/или (b) проводят при температуре от примерно 0 до примерно 30 С. 12. Способ по любому из пп. от 1 до 11,отличающийся тем, что R означает алкильную группу с 5 атомами углерода, предпочтительно СН 3-СН 2-С(СН 3)2-.
МПК / Метки
МПК: C07F 7/18, C07D 309/30
Метки: способ, симвастатина, производных, получения
Код ссылки
<a href="https://eas.patents.su/6-2370-sposob-polucheniya-simvastatina-i-ego-proizvodnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения симвастатина и его производных</a>
Предыдущий патент: Велосипед и подобный ему механизм
Следующий патент: Вакуумный высоковольтный выключатель
Случайный патент: [f-18]-меченая l-глутаминовая кислота, [f-18]-меченый l-глутамин, их производные и их применение, а также способ их получения










