Способ получения фармацевтических промежуточных соединений
Номер патента: 17115
Опубликовано: 28.09.2012
Авторы: Вайон Мария, Вольк Балаж, Баркоци Йосеф, Мольнар Энико, Лукач Дьюла, Мезеи Тибор, Суладьи Янош, Порч-Маккаи Марта
Формула / Реферат
1. Способ получения соединений общей формулы (II)

где R1 представляет собой атом фтора, хлора или С1-4алкоксигруппу,
при котором реактив Гриньяра, полученный из соединения общей формулы (V)
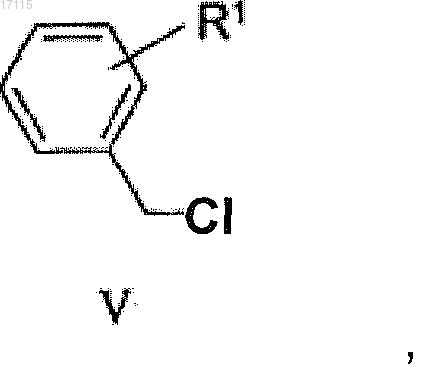
подвергают взаимодействию с соединением общей формулы (IV)
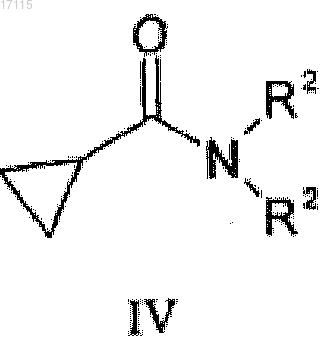
где R2 представляет собой C1-4алкильную группу с неразветвленной или разветвленной цепью.
2. Способ по п.1, где для получения реактива Гриньяра используют 1,0-1,5 мол.экв. магния из расчета на соединение формулы (V).
3. Способ по п.2, где используют 1,0-1,3 мол.экв. магния.
4. Способ по п.1, где в соединении формулы (IV) R2 представляет собой метильную группу.
5. Способ по п.1, где реактив Гриньяра подвергают взаимодействию с 0,7-1,1 мол.экв. соединения формулы (IV).
6. Способ по п.1, где реакцию проводят в растворителе типа простого эфира.
7. Способ по п.6, где реакцию проводят в диэтиловом эфире, трет-бутилметиловом эфире, диизопропиловом эфире, дибутиловом эфире, тетрагидрофуране или диоксане.
8. Способ по п.1, где реакцию проводят в диэтиловом эфире, трет-бутилметиловом эфире или диизопропиловом эфире.
9. Способ по п.1, где реакцию проводят при температуре 20-100°С.
10. Способ по п.9, где реакцию проводят при температуре кипения растворителя типа простого эфира.
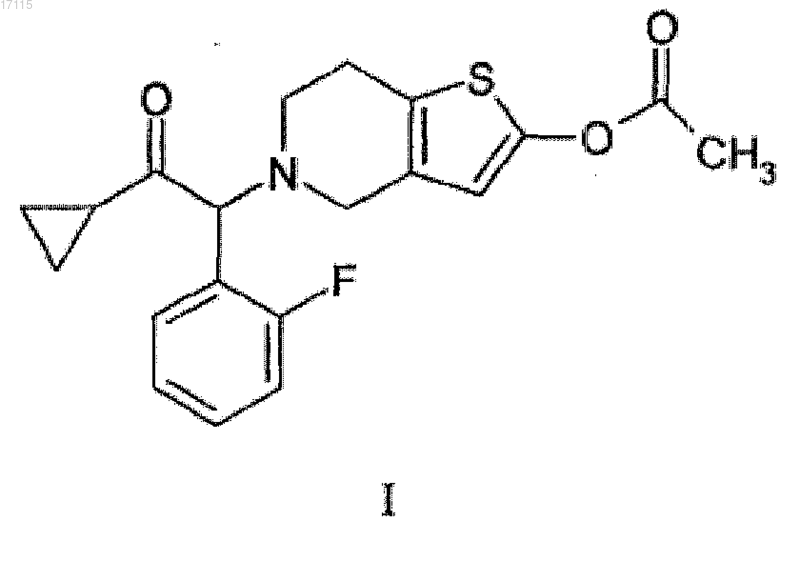
11. Способ получения прасугреля формулы (I) или его соли присоединения кислоты
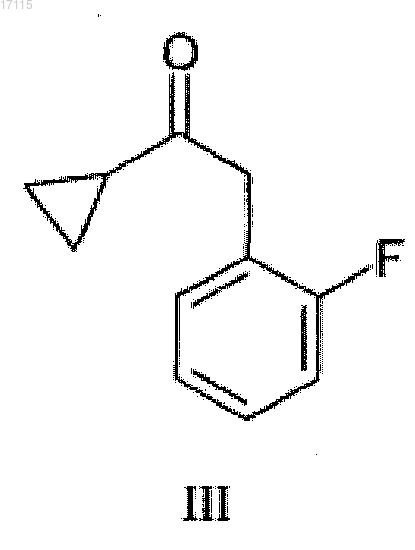
из соединения формулы (III), входящего в объем формулы (II)
в котором реактив Гриньяра, полученный из соединения общей формулы (V)
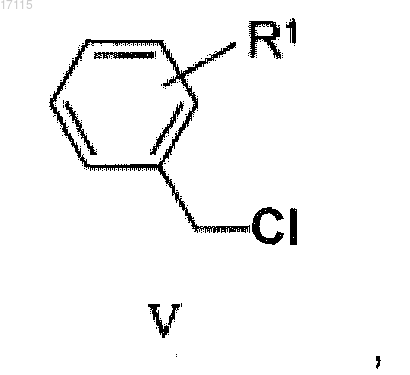
подвергают взаимодействию с соединением общей формулы (IV)
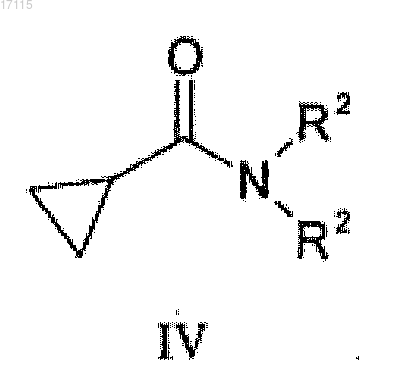
где R2 представляет собой С1-4 алкильную группу, обладающую неразветвленной или разветвленной цепью,
и из полученного соединения формулы (III)
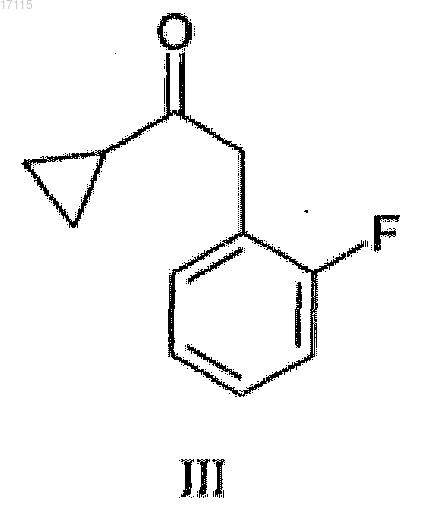
получают основание прасугрель или его соль присоединения кислоты.
Текст
СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ Изобретение относится к способу получения соединений циклопропилбензилкетона формулы (II),где R1 представляет собой атом фтора или хлора или C1-4 алкоксигруппу, путем взаимодействия реактива Гриньяра, полученного реакцией соединения формулы (V) с соединением формулы (IV),где R2 представляет C1-4 алкильную группу с неразветвленной или разветвленной цепью. Способ можно предпочтительно осуществлять в промышленном масштабе. Соединение формулы (II),где R1 представляет собой атом фтора в положении 2, является промежуточным соединением в процессе получения прасугреля, являющегося ингибитором тромбоцитов, используемого в терапии.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКД РЕСВЕНЬТАРШАШАГ (HU) 017115 Изобретение относится к способу получения соединений циклопропилбензилкетона общей формулы (II) взаимодействием с реактивом Гриньяра, полученного из соединений формулы (V) и диалкиламидных соединений циклопропанкарбоновой кислоты формулы (IV), применяемому предпочтительно в промышленном масштабе. Предпосылки создания изобретения Соединения циклопропилбензилкетона общей формулы (II) являются важными исходными веществами производных тетрагидротиенопиридина, используемых в терапии. Одним из наиболее важных представителей производных тетрагидротиенопиридина является соединение формулы (I), a именно 5-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4,5,6,7-тетрагидротиено[3,2-с]пиридин-2-илацетат,имеющий международное непатентованное название прасугрель, который применяется для предотвращения и лечения тромбоза и тромбоэмболии. Ингибитор тромбоцитов прасугрель, его производные и способ их получения описан впервые в патентах Венгрии 218785 и 211876. Цель настоящего изобретения относится к получению соединений циклопропилбензилкетона формулы (II) с высокой степенью чистоты, составляющих очень важную структурную часть указанных выше соединений. Способ хорошо применим в промышленном масштабе. В процессе получения прасугреля, а также соединений - эффективных ингибиторов тромбоцитов,обладающих сходной структурой, ключевыми промежуточными соединениями являются кетоновые соединения общей формулы (II), которые могут содержать различные заместители в ароматическом кольце. Наиболее важными представителями данных соединений являются галогензамещенные производные,особенно хлор- или фторзамещенные. Из литературы известны только несколько способов получения данных производных, данные способы весьма отдаленно относятся к промышленным масштабам производства. Согласно способу получения, описанному в патентах Венгрии 218785 и 211876, соединения циклопропилбензилкетона формулы (II) получают реакцией 2-фторбензилмагния бромида или 2-хлорбензилмагния бромида и циклопропанкарбонитрила. Реакцию проводят при температуре кипения диэтилового эфира и полученный комплекс гасят водным раствором хлорида аммония, продукт экстрагируют и очищают колоночной хроматографией. Выход способа составляет 70 или 69% соответственно. В патенте Венгрии 211876 также описаны другие способы, где соединение 2-фторбензилмагний галогенид подвергают взаимодействию, вместо циклопропанкарбонитрила, с хлорангидридом, например циклобутанкарбонилхлоридом. Реакцию выполняют при очень низкой температуре (-70 С) и неочищенный продукт получают экстракцией и очищают колоночной хроматографией. Выход способа очень низкий и составляет 39%. В указанной выше реакции Гриньяра для получения соединений формулы (II) возможно взаимодействие эфира, нитрила или хлорангидрида с 2 экв. реактива Гриньяра вместо 1 экв. Такие реакции снижают выход способа получения, в результате могут образовываться некоторые побочные продукты, содержащие гидроксильную группу. В способе получения, описанном в патентах Венгрии 218785 и 211876, реактив Гриньяра получают из бромопроизводных. Согласно настоящему изобретению в способе получения соединений циклопропилбензилкетона формулы (II) реактив Гриньяра получают из более подходящего и дешевого 2-фторбензилхлорида вместо 2-фторбензилбромида. Среди галогеновых производных использование хлорпроизводных более экономично, поскольку они являются более дешевыми и для реакции требуется меньшее количество, поскольку они обладают меньшим молекулярным весом по сравнению с производными брома. Способ получения, описанный в патенте Венгрии 211876, не подходит для получения лекарства в промышленных масштабах, поскольку очистка выполняется колоночной хроматографией, и данный способ не применим для получения больших количеств конечного продукта. Для очистки необходимо большое количество реагентов, поэтому способ является более дорогостоящим и, кроме того, вредным для окружающей среды. Другим недостатком реакций, известных из литературы, является то, что кислые хлориды и ангидриды - см. описание патента Венгрии 211876 - взаимодействуют с бензилмагния бромидом при очень низких температурах, от -70 до -50 С. Поэтому эти способы, помимо трудностей, вызванных очисткой путем колоночной хроматографии, являются неприменимыми для производства в промышленных масштабах и, кроме того, являются энергозатратными и дорогостоящими. В патенте США 5874581 описан способ получения соединений формулы (II), где 2 экв. 2-пропилмагния хлорида взаимодействуют с 2-фторуксусной кислотой в тетрагидрофуране, при температуре кипения растворителя. Полученный комплекс реагирует при температуре 5 С с этил- или метилциклопропанкарбоксилатом. Реакционную смесь перемешивают в течение 3 ч и добавляют соляную кислоту, далее смесь нейтрализуют, экстрагируют, упаривают и, наконец, фракции получают в вакууме. Недостатком способа, описанного в патенте США 5874581, является использование очень дорогостоящих исходных материалов и более 2 экв. реактива Гриньяра для синтеза. Выход реакции составляет 56%, чистота получаемого продукта не указана.-1 017115 Цель настоящего изобретения - избежать недостатков способов, описанных выше, и разработать экономичный простой способ получения с хорошим выходом, который будет позволять избежать стадии очистки колоночной хроматографией и который можно будет с успехом использовать для получения в промышленных масштабах. Указанные выше цели можно достичь с помощью способа по настоящему изобретению. Краткое описание изобретения Целью настоящего изобретения является способ получения соединений общей формулы (II) где R1 представляет собой атом фтора, хлора или С 1-4 алкоксигруппу,в котором реактив Гриньяра, полученный из соединения общей формулы (V) взаимодействует с соединением общей формулы (IV) где R2 представляет собой С 1-4 алкильную группу с неразветвленной или разветвленной цепью. Согласно настоящему изобретению для получения реактива Гриньяра предпочтительно использовать соединение формулы (V) и 1,0-1,5 мол.экв., предпочтительно 1,0-1,3 мол.экв. магния из расчета на соединение формулы (V), далее реактив Гриньяра взаимодействует с 0,7-1,1 мол.экв. соединения формулы (IV)."C1-4 алкоксигруппа" здесь означает такую функциональную алкильную разветвленную или неразветвленную группу, содержащую от 1 до 4 атомов углерода, которая связана с атомом кислорода. В способе в качестве производных диметиламида предпочтительно использовать соединения формулы (IV), где R2 представляет собой метильную группу. Согласно настоящему изобретению реакцию проводят в растворителе типа простого эфира, например диэтиловом эфире, трет-бутилметиловом эфире, диизопропиловом эфире, дибутиловом эфире, в тетрагидрофуране или в диоксане, предпочтительно реакцию проводят в диэтиловом эфире, третбутилметиловом эфире или диизопропиловом эфире, при температуре между 20 и 100 С, предпочтительно при температуре кипения (в точке кипения) растворителя типа простого эфира. Подробное описание изобретения Реакция реактивов Гриньяра с производными карбоновой кислоты хорошо известна и представляет собой часто используемый способ получения производных кетонов. Реакция Гриньяра протекает по радикальному механизму, поэтому во время реакции образуется большое количество побочных продуктов,например производных дибензила, и обычно некоторые другие продукты (толуол, производные спирта и т.д.) также образуются в результате восстановления. Согласно уровню техники существует вероятность взаимодействия сложного эфира, нитрила или хлорангидридных реагентов с 2 экв. реактива Гриньяра вместо 1 экв. Это существенно снижает выход реакции и приводит к получению побочных продуктов с гидроксильной группой. Неожиданно было обнаружено, что при взаимодействии диметиламида циклопропанкарбоновой кислоты формулы (IV), где R2 представляет собой метильную группу, с 2-фторбензилмагния хлоридом количество побочных продуктов, образующихся в результате реакции со вторым реагентом Гриньяра,существенно снижается. Реакцию выполняют при комнатной температуре, и соединение формулы (II) можно получить практически с количественным выходом.-2 017115 Согласно настоящему изобретению реактив Гриньяра получают из более дешевых производных 2-фторбензилхлор-производных, вместо бромосодержащих производных, и данный реактив обеспечивает хороший выход реакции с диалкиламидами циклопропанкарбоновой кислоты. Согласно экспериментам авторов изобретения, проведенным с другими производными циклопропанкарбоновой кислоты, продукт взаимодействия можно получить только с выходом 5-17%. При воспроизведении реакции по патентам Венгрии 218785 и 211876 (описанной в примере 10), где реагент 2-фторбензилмагния бром заменен 2-фторбензилмагния хлоридом, было обнаружено, что взаимодействие реактива Гриньяра в эфире с циклопропанкарбонилхлоридом при температуре -70 С приводит к получению только 5% продукта согласно данным ГХ/МС. В примере 11 взаимодействие с циклопропанкарбонитрилом при тех же условиях, но при более высокой температуре дает 16,5% продукта, помимо большого количества побочных продуктов. Другим преимуществом предлагаемого способа получения соединений формулы (II) из диалкиламида циклопропанкарбоновых кислот формулы (IV) является получение реактива Гриньяра из более дешевого хлорсодержащего бензильного производного. Получая реактив Гриньяра из подходящего бензилхлорида формулы (V), вызывавшего реакцию реактива Гриньяра с данным диалкиламидом циклопропанкарбоновой кислоты, выход реакции был вдвое выше по сравнению с реакцией, проводившейся с бромосодержащим производным реактива Гриньяра. Если реактив Гриньяра получают из 2-фторбензилхлорида, то можно добиться наибольшего выхода с диалкиламидом циклопропанкарбоновой кислоты среди всех производных диалкиламидов циклопропанкарбоновых кислот формулы (IV). Авторы изобретения изучали, имеют ли место сходные реакции наиболее подходящих диметиламидов циклопропанкарбоновых кислот с различными заместителями в ароматическом кольце с бензилмагния хлоридами. Было обнаружено, что реакцию можно осуществлять с очень высоким выходом со всеми изученными замещенными бензилхлоридов общей формулы (V), независимо от положения заместителя(орто-, мета- или пара). Выход способа получения по настоящему изобретению для синтеза соединений общей формулы составляет примерно 80%. Реакцию выполняли в растворителе типа простого эфира. Таким растворителем может быть диэтиловый эфир, трет-бутилметиловый эфир, диизопропиловый эфир, дибутиловый эфир, тетрагидрофуран или диоксан. Было обнаружено, что наиболее подходящим растворителем является диэтиловый эфир. Реакцию также можно легко выполнять в трет-бутилметиловом эфире, диизопропиловом эфире и дибутиловом эфире, которые являются менее воспламеняемыми. Способ по настоящему изобретению можно легко выполнять в промышленных масштабах, что позволяет легко увеличить объемы производства и не требует использования специальных условий или оборудования. Способ получения по настоящему изобретению оптимально выполнять в промышленных масштабах, условия реакции не являются экстремальными. Другим преимуществом изобретения является отсутствие необходимости использования токсичных, вредных для окружающей среды, коррозийных реагентов, а также технологий, требующих больших количеств растворителя (например, колоночной хроматографии) или очень низких температур (например, -78 С). Конечный продукт по настоящему изобретению, соединение формулы (III), который входит в объем общей формулы (II), представляет собой важное исходное соединение для используемых в фармацевтике производных тетрагидротиенопиридина. Прасугрель, соединение формулы (I), получают из соединения формулы (III), синтезированного по способу согласно настоящему изобретению хлорированием или бромированием соединения формулы(III) и полученное соединение затем подвергают реакции с 4,5,6,7-тетрагидротиено[2,3-с]пиридином согласно способу производства, описанному в патенте Венгрии 211876. В положении 2 тиофенового кольца оксогруппу получают способами, известными из уровня техники, и в конечном итоге получают прасугрель формулы (I) путем О-ацетилирования в щелочных условиях и, если желательно, переводят в соль присоединения кислоты. Примеры Далее изобретение иллюстрируется примерами, без ограничения объема настоящего изобретения. Пример 1. Получение диметиламида циклопропанкарбоновой кислоты [соединение формулы (IV),R2=Me]. В круглодонную колбу объемом 250 мл добавляли тионилхлорид (110 мл, 1,5 моль) и диметилформамид (1,5 мл) и при перемешивании при 25-30 С по каплям добавляли в течение 1,5 ч циклопропанкарбонилхлорид (90 мл, 1,14 моль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч до полного прекращения образования газа. Без дальнейшей обработки и очистки по каплям добавляли в течение 1,5 ч хлорангидрид в смесь измельченного льда (300 г), водного раствора гидроксида натрия(300 мл, 40 мас.%) и диметиламина гидрохлорид (186 г, 2,3 моль). Реакционную смесь перемешивали в течение 1 ч при 25 С. Полученный продукт экстрагировали дихлорметаном (2200 мл) и органический слой сушили над сульфатом магния, перегоняли и остаток отделяли в вакууме при давлении 10 мм рт.ст. (1333 Па). Пример 2. Получение диэтиламида циклопропанкарбоновой кислоты [соединение формулы (IV)R2=Et]. Получение выполняли способом, аналогичным примеру 1, с той разницей, что вместо диметиламингидрохлорида в реакционную смесь добавляли диэтиламингидрохлорид (252,1 г, 2,3 моль). Пример 3. Получение диизопропиламида циклопропанкарбоновой кислоты [соединение формулы(IV), R2=i-Pr]. Получение выполняли способом, аналогичным примеру 1, с той разницей, что вместо диметиламингидрохлорида в реакционную смесь добавляли диизопропиламингидрохлорид (252,1 г,2,3 моль). Пример 4. Получение циклопропил-2-фторбензилкетона [соединения формулы (III)]. Круглодонную колбу объемом 1000 мл заполняли магнием (10,7 г, 0,44 моль). К магнию добавляли йод (0,2 г), затем диэтиловый эфир (240 мл) и при кипячении с обратным холодильником в реакционную смесь добавляли раствор 2-фторбензилхлорида (47,8 мл, 0,4 моль) и диэтиловый эфир (80 мл). Смесь кипятили с обратным холодильником в течение 2 ч и при этой температуре добавляли раствор иметиламида циклопропанкарбоновой кислоты (36,2 г, 0,32 моль), полученный по примеру 1, и тетрагидрофуран (200 мл). Реакционную смесь кипятили в течение 0,5 ч и при охлаждении по каплям в смесь добавляли водный раствор соляной кислоты (160 мл, 1:1). Органический слой сушили, остаток перегоняли в вакууме. Пример 5. Получение циклопропил-2-фторбензилкетона [соединение формулы (III)]. Круглодонную колбу объемом 1000 мл заполняли магнием (10,7 г, 0,44 моль). К магнию добавляли йод (0,2 г), затем трет-бутилметиловый эфир (240 мл) и при кипячении в реакционную смесь добавляли раствор 2-фторбензилхлорида (47,8 мл, 0,4 моль) и трет-бутилметиловый эфир (80 мл). Смесь кипятили с обратным холодильником в течение 2 ч и при этой температуре добавляли раствор диметиламида циклопропанкарбоновой кислоты (36,2 г, 0,32 моль), полученный по примеру 1, и тетрагидрофуран (200 мл). Реакционную смесь кипятили в течение 0,5 ч и при охлаждении по каплям к смеси добавляли водный раствор соляной кислоты (160 мл, 1:1). Органический слой сушили, остаток перегоняли в вакууме. Пример 6. Получение циклопропил-2-фторбензилкетона [соединение формулы (III)]. В круглодонную колбу объемом 250 мл, заполненную магнием (2,67 г, 0,11 моль), добавляли йод(0,1 г), затем диэтиловый эфир (60 мл) и при кипячении в реакционную смесь добавляли раствор 2-фторбензилхлорида (11,9 мл, 0,1 моль) и диэтиловый эфир (20 мл). Смесь кипятили с обратным холодильником в течение 2 ч и при этой температуре добавили раствор диэтиламида циклопропанкарбоновой кислоты (11,3 г, 80 ммоль), полученный по примеру 2, и тетрагидрофуран (50 мл). Реакционную смесь кипятили в течение 0,5 ч и при охлаждении по каплям в смесь добавляли водный раствор соляной кислоты (40 мл, 1:1). Органический слой сушили, остаток перегоняли в вакууме. Пример 7. Получение циклопропил-2-фторбензилкетона [соединение формулы (III)]. Получение осуществляли по примеру 6 с той разницей, что реактив Гриньяра получали по примеру 3 с раствором диизопропиламида циклопропанкарбоновой кислоты (13,5 г, 80 ммоль) и тетрагидрофураном (50 мл) вместо диэтиламида циклопропанкарбоновой кислоты. Реакционную смесь перемешивали в течение 2 ч и при охлаждении к смеси по каплям добавляли водный раствор соляной кислоты (40 мл,1:1). Органический слой сушили, остаток перегоняли в вакууме. Пример 8. Получение циклопропил-4-хлорбензилкетона [соединение формулы (II), R1=4-Cl]. В круглодонную колбу объемом 500 мл, заполненную магнием (5,8 г, 0,24 моль), добавляли йод(0,1 г), затем диэтиловый эфир (120 мл) и при кипячении в реакционную смесь добавляли раствор 4-хлорбензилхлорида (32,2 г, 0,20 моль) и диэтиловый эфир (40 мл). Смесь кипятили в течение 1 ч и при этой температуре добавляли раствор диметиламида циклопропанкарбоновой кислоты (18,1 г, 0,16 моль) и тетрагидрофуран (80 мл). Реакционную смесь перемешивали в течение 0,5 ч и при охлаждении по каплям в смесь добавляли водный раствор соляной кислоты (80 мл, 1:1). Органический слой сушили, остаток (32 г) перегоняли в вакууме. Пример 9. Получение циклопропил-4-хлорбензилкетона [соединение формулы (II), R1=3-MeO]. В круглодонную колбу объемом 250 мл, заполненную магнием (4,9 г, 0,20 моль), добавляли йод(0,1 г), затем диэтиловый эфир (100 мл) и при кипячении в реакционную смесь добавляли раствор 3-метоксибензилхлорида (11,9 мл, 0,1 моль) и диэтиловый эфир (40 мл). Смесь кипятили в течение 1 ч и при этой температуре добавляли раствор диметиламида циклопропанкарбоновой кислоты (16,6 г,0,15 моль) и тетрагидрофуран (70 мл). Реакционную смесь перемешивали в течение 0,5 ч и при охлаждении по каплям в смесь добавляли водный раствор соляной кислоты (80 мл, 1:1). Органический слой сушили, остаток (32 г) перегоняли в вакууме. Пример 10. Получение циклопропил-2-фторбензилкетон [соединение формулы (III)]. В круглодонную колбу объемом 250 мл, заполненную магнием (2,67 г, 0,11 моль), добавляли йод(0,1 г), затем диэтиловый эфир (60 мл) и при кипячении в реакционную смесь добавляли раствор 2-фторбензилхлорида (11,9 мл, 0,1 моль) и диэтиловый эфир (20 мл). Смесь кипятили в течение 2 ч, затем охлаждали до -70 С и добавляли раствор циклопропанкарбонилхлорида (8,36 г, 80 ммоль) и тетрагидрофуран (50 мл), реакционную смесь оставляли нагреваться до комнатной температуры. Из реакционной среды отбирали образцы, промывали водным раствором хлорида аммония и исследовали способом ГХ/МС. Содержание реакционной смеси было следующим, %: Пример 11. Получение циклопропил-2-фторбензилкетон [соединение формулы (III)]. В круглодонную колбу объемом 250 мл, заполненную магнием (2,67 г, 0,11 моль), добавляли йод(0,1 г), затем диэтиловый эфир (60 мл) и при кипячении в реакционную смесь добавляли раствор 2-фторбензилхлорида (11,9 мл, 0,1 моль) и диэтиловый эфир (20 мл). Смесь кипятили в течение 2 ч, затем охлаждали до -50 С и добавляли раствор циклопропанкарбонитрила (5,4 г, 80 ммоль) и тетрагидрофуран (50 мл), реакционную смесь оставляли нагреваться до комнатной температуры. Из реакционной среды отбирали образцы, промывали водным раствором хлорида аммония и исследовали способом ГХ/МС. Содержание реакционной смеси было следующим, %: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений общей формулы (II) где R1 представляет собой атом фтора, хлора или С 1-4 алкоксигруппу,при котором реактив Гриньяра, полученный из соединения общей формулы (V) подвергают взаимодействию с соединением общей формулы (IV) где R2 представляет собой C1-4 алкильную группу с неразветвленной или разветвленной цепью. 2. Способ по п.1, где для получения реактива Гриньяра используют 1,0-1,5 мол.экв. магния из расчета на соединение формулы (V). 3. Способ по п.2, где используют 1,0-1,3 мол.экв. магния. 4. Способ по п.1, где в соединении формулы (IV) R2 представляет собой метильную группу. 5. Способ по п.1, где реактив Гриньяра подвергают взаимодействию с 0,7-1,1 мол.экв. соединения-6 017115 формулы (IV). 6. Способ по п.1, где реакцию проводят в растворителе типа простого эфира. 7. Способ по п.6, где реакцию проводят в диэтиловом эфире, трет-бутилметиловом эфире, диизопропиловом эфире, дибутиловом эфире, тетрагидрофуране или диоксане. 8. Способ по п.1, где реакцию проводят в диэтиловом эфире, трет-бутилметиловом эфире или диизопропиловом эфире. 9. Способ по п.1, где реакцию проводят при температуре 20-100 С. 10. Способ по п.9, где реакцию проводят при температуре кипения растворителя типа простого эфира. 11. Способ получения прасугреля формулы (I) или его соли присоединения кислоты из соединения формулы (III), входящего в объем формулы (II) в котором реактив Гриньяра, полученный из соединения общей формулы (V) подвергают взаимодействию с соединением общей формулы (IV) где R2 представляет собой С 1-4 алкильную группу, обладающую неразветвленной или разветвленной цепью,и из полученного соединения формулы (III) получают основание прасугрель или его соль присоединения кислоты.
МПК / Метки
МПК: C07C 45/68, C07C 49/577
Метки: промежуточных, соединений, получения, фармацевтических, способ
Код ссылки
<a href="https://eas.patents.su/8-17115-sposob-polucheniya-farmacevticheskih-promezhutochnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения фармацевтических промежуточных соединений</a>
Предыдущий патент: Производные n-(пиразол-3-ил)бензамида в качестве активаторов глюкокиназы
Следующий патент: Аварийная система поиска отцепленных парашютов
Случайный патент: Способ изготовления абсорбирующего изделия












