Новый способ синтеза прамипексола и его фармацевтически приемлемых солей
Номер патента: 15818
Опубликовано: 30.12.2011
Авторы: Зивец Матей, Зупет Рок, Коленц Иванка, Анзиц Борут, Гобец Станислав
Формула / Реферат
1. Способ получения прамипексола, включающий:
(i) реакцию 4,5,6,7-тетрагидробензо[d]тиазол-2,6-диамина формулы I

с нитро- или галогензамещенным или незамещенным арилсулфонилхлоридом формулы II
![]()
в результате которой получают промежуточное сульфонамидное соединение формулы III

(ii) реакцию промежуточного соединения формулы III с соединением формулы IV
![]()
где X можно выбрать из Cl, Br, I или других групп, способных к нуклеофильному замещению, таких как OTs (тозилат), OMs (мезилат),
в результате которой получают промежуточное соединение формулы V

(iii) преобразование промежуточного соединения формулы V в прамипексол посредством использования селективного реагента для отщепления сульфонильной защитной группы;
(iv) необязательное преобразование прамипексола в фармацевтически приемлемую соль.
2. Способ по п.1, где реакцию между промежуточными продуктами I и II проводят в присутствии основания.
3. Способ по п.1, где в качестве нитрозамещенного арилсульфонилхлорида формулы II применяют моно-, ди- или тринитрозамещенный бензолсульфонилхлорид.
4. Способ по п.1, где в качестве нитрозамещенного арилсульфонилхлорида формулы II применяют 2-нитробензолсульфонилхлорид.
5. Способ по п.1, где реакцию между промежуточным соединением III и соединением формулы IV проводят в присутствии основания.
6. Способ по п.1, где в качестве селективного реагента применяют тиол в присутствии основания или алкоксида.
7. Способ по п.6, где в качестве тиола применяют тиофенол или тиогликолевую кислоту в присутствии основания.
8. Способ по п.1, где способ представляет собой непрерывный процесс.
9. Соединение формулы III

где Ar представляет собой нитро- или галогензамещенный арил.
10. Соединение формулы V
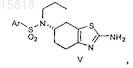
где Ar представляет собой нитро- или галогензамещенный арил.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента НОВЫЙ СПОСОБ СИНТЕЗА ПРАМИПЕКСОЛА И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ Настоящее изобретение относится к новому способу синтеза прамипексола, как показано на схеме синтеза, формулы I-VI. 015818 Область техники Настоящее изобретение принадлежит к области органической химии и относится к новому способу синтеза прамипексола и его фармацевтически приемлемых солей. Прамипексол, предпочтительно его дигидрохлорид моногидрат, является соединением, применяемым при лечении болезни Паркинсона. Техническая задача Существовала необходимость в новом экономичном способе, который бы обеспечил высокий выход и в то же время был бы промышленно применимым. Предшествующий уровень техники Прамипексол, имеющий химическое название S(-)-2-амино-4,5,6,7-тетрагидро-6-пропиламинобензотиазол, принадлежит к семейству биоизостеров гидрокситетралина и эрголина, которые разрабатывались в качестве антагонистов допаминовых рецепторов. Прамипексол применяют для лечения признаков и симптомов болезни Паркинсона и синдрома беспокойных ног. Прамипексол является объектом патента ЕР 186087, описывающего некоторые возможные способы его синтеза: а) реакцией циклогексанона формулы где R1 и R2 могут представлять собой Н, алкил, аллил и другие группы; б) реакцией циклогексанона формулы с формамидин дисульфидом; в) отщеплением защитной группы от соединения формулы где по меньшей мере один из R1', R2', R3', R4' представляет собой защитную аминогруппу; г) восстановлением ацильной или фенилацильной группы с применением гидрида металла в растворителе, вследствие чего образуется соответствующая алкильная или фенилалкильная группа; д) реакцией соединения формулы где по меньшей мере один из заместителей представляет собой атом водорода,с соединением формулы R5-Z, где R5 представляет собой алкил и Z представляет собой группу, способную к нуклеофильному замещению. Также имеется ряд патентов, описывающих разделение рацематов прамипексола, например ЕР 1318987, где описывается разделение диастереомерных солей кристаллизацией, WO 2006/003471, где описывается разделение хиральной хроматографией, WO 2006/012276, где описывается разделение жидкостной хроматографией, WO 2006/120268, где описывается разделение виннокислых производных. Способы получения прамипексола восстановительным аминированием промежуточного диаминсоединения формулы описываются в WO 2005/092871, WO 2006/003677, WO 2006/070349, WO 2006/097014. Способ по настоящему изобретению представляет собой новый изобретательский подход к решению аспектов синтеза, предлагающий высокую скорость преобразования промежуточных соединений, и способ, где нежелательные побочные продукты не образуются. Преимущество способа по настоящему изобретению состоит в том, что на всех стадиях сохраняется высокая оптическая чистота и рацемизация на любой стадии не происходит.-1 015818 Описание изобретения Объектом настоящего изобретения является способ получения прамипексола, включающий процесс синтеза, представленный на схеме 1. Схема 1 Способ по настоящему изобретению включает:(i) реакцию 4,5,6,7-тетрагидробензо[d]тиазол-2,6-диамина формулы I с нитро- или галогензамещенным или незамещенным арилсульфонилхлоридом формулы II, в результате которой получают промежуточное сульфонамидное соединение формулы III;(ii) реакцию промежуточного соединения формулы III с соединением формулы IV, где X можно выбрать из Cl, Br, I или других групп, способных к нуклеофильному замещению, таких как OTs, OMs, в результате которой получают промежуточное соединение формулы V;(iii) преобразование промежуточного соединения формулы V с селективным реагентом с целью отщепления сульфонильной защитной группы от прамипексола формулы VI;(iv) необязательно преобразование прамипексола в фармацевтически приемлемую соль. Способ может осуществляться непрерывно или периодически. Реакция соединения I с соединением II проводится в органическом растворителе в присутствии неорганического или органического основания. Органическое основание можно выбрать из группы третичных аминов, таких как триметиламин, триэтиламин, диизопропилэтиламин, три-н-пропиламин,три-н-бутиламин, N,N,N',N'-тетраметил-1,3-пропандиамин, N-метилморфолин, N,N'-диметилпиперазин,1,4-диазабицикло[2.2.2]октан, 1,5-диазабицикло[4.3.0]-5-нонен,; 1,8-диазабицикло[5.4.0]-7-ундецен; гетероциклических ароматических аминов, которые выбраны из пиридинов, пирролидинов, таких какN-метилпирролидин, диметилпирролидин, 4-диметиламинопиридин, коллидин, лютидин; предпочтительно триэтиламин. Неорганическое основание можно выбрать из гидроксидов щелочных и щелочноземельных металлов, таких как NaOH, KOH, LiOH, Mg(OH)2, карбонатов, гидрокарбонатов, четвертичных гидроксидов аммония, таких как тетрабутиламмоний гидроксид, тетраэтиламмоний гидроксид, или алкоксидов. Органический растворитель можно выбрать из кетонов, таких как ацетон, метилэтилкетон; простых эфиров, таких как THF (тетрагидрофуран), диэтиловый эфир; нитрилов, таких как ацетонитрил; амидов,таких как диметилацетамид, диметилформамид; пирролидонов, таких как н-метилпирролидон; галоидированных алканов, таких как метиленхлорид, хлороформ. Предпочтительно реакцию проводят таким образом, что нитрозамещенный арилсульфонилхлорид растворяют в растворителе, охлажденном до температуры от -20 до 10 С, предпочтительно ниже 0 С,затем добавляют основание и соединение формулы I и постепенно повышают температуру реакции до комнатной температуры. В качестве соединения формулы II применяют арилсульфонилхлорид, предпочтительно нитро- или галогензамещенный арилсульфонилхлорид. В качестве нитрозамещенного арилсульфонилхлорида можно применять моно-, ди- или тринитрозамещенные бензолсульфонилхлориды,такие как 2-нитробензолсульфонилхлорид,4-нитробензолсульфонилхлорид, 2,4-, 2,3-, 2,5-, 2,6-динитробензолсульфонилхлорид, 2,4,6-тринитросульфонилхлорид, предпочтительно 2-нитробензолсульфонилхлорид. В качестве галогензамещенных арилсульфонилхлоридов можно применять 4-Br-, 4-Cl- и 4-F-бензолсульфонилхлориды. Выделение промежуточного соединения формулы III проводят таким образом, что после обессоливания раствор упаривают досуха и остаток заливают водой, и после перемешивания выпадает желтый осадок, который необязательно можно промыть водой. Альтернативно, раствор можно упарить приблизительно до 1/3 объема, после чего можно добавить воду. Реакцию промежуточного соединения III с промежуточным соединением IV проводят в органическом растворителе в присутствии основания, необязательно в присутствии катализатора, такого как KI, в результате которой получают промежуточное соединение V.-2 015818 В качестве оснований можно применять органическое или неорганическое основание. В качестве органических оснований можно применять первичные, вторичные и третичные амины, такие как триэтиламин, диизопропиламин, метиламин, пиридин, пирролидин, пиперазин, пиримидин. Неорганическое основание можно выбрать из гидроксидов щелочных и щелочно-земельных металлов, таких какNaOH, КОН, LiOH, Mg(OH)2, карбонатов, таких как K2CO3, Cs2CO3, гидрокарбонатов, четвертичных гидроксидов аммония, таких как гидроксид тетрабутиламмония, гидроксид тетраэтиламмония, или алкоксидов, предпочтительно карбонат калия, карбонат цезия. В качестве растворителя можно применять кетоны, такие как ацетон, метилэтилкетон, диэтилкетон; простые эфиры, такие как THF, диэтиловый эфир, диоксан; нитрилы, такие как ацетонитрил, пропионитрил; спирты, такие как пропанол; амиды, такие как диметилацетамид, диметилформамид; пирролидоны,такие как N-метилпирролидон; ароматические углеводороды, такие как толуол, ксилол; сульфоксиды,такие как диметилсульфоксид. В качестве реагента формулы IV применяют бромистый пропил, йодистый пропил, хлористый пропил, пропилтозилат, пропилметансульфонат, пропилсульфат, предпочтительно бромистый пропил. Выделение промежуточного соединения формулы V проводят таким образом, что реакционную смесь обессоливают, после раствор упаривают досуха и остаток растворяют в дихлорметане. Данный раствор промывают водным щелочным раствором, насыщенным водным раствором NaCl и сушат надNa2SO4. После упаривания получают маслянистый продукт. Полученное промежуточное соединение V преобразуют в прамипексол с использованием реагента для селективного удаления арилсульфонильной группы. В качестве реагента для селективного удаления нитробензолсульфонильной группы применяют тиол в присутствии основания или алкоксида. В качестве тиола можно применять тиофенол, тиогликолевую кислоту, меркаптоэтанол, предпочтительно тиогликолевую кислоту. В качестве основания можно применять органическое или неорганическое основание. В качестве органических оснований могут применяться первичные, вторичные и третичные амины, такие как триметиламин, триэтиламин, диизопропилэтиламин, три-н-пропиламин,три-н-бутиламин, N,N,N',N'-тетраметил-1,3-пропандиамин, N-метилморфолин, N,N'-диметипиперазин,1,4-диазабицикло[2.2.2]октан,1,5-диазабицикло[4.3.0]-5-нонен; 1,8-диазабицикло[5.4.0]-7-ундецен; гетероциклические ароматические амины, выбранные из пиридинов, пирролидинов, таких какN-метилпирролидин, диметилпирролидин, 4-диметиламинопиридин, коллидин, лютидин; предпочтительно триэтиламин. В качестве неорганических оснований можно применять гидроксиды, предпочтительно гидроксид лития, карбонаты, гидрокарбонаты, алкоксиды щелочных или щелочно-земельных металлов, предпочтительно карбонат калия, карбонат цезия. В качестве алкоксида можно применять алкоксиды, такие как метоксиды, этоксиды, пропоксиды, предпочтительно метоксиды щелочных или щелочно-земельных металлов. Реакцию можно проводить в органическом растворителе, таком как кетоны, такие как ацетон,метилэтилкетон, диэтилкетон; простые эфиры, такие как THF, диэтиловый эфир, метилэтиловый эфир,диоксан, диметоксиэтан; нитрилы, такие как ацетонитрил, пропионитрил; амиды, такие как диметилацетамид, диметилформамид; пирролидоны, такие как N-метилпирролидон; ароматические углеводороды,такие как толуол, ксилол; сульфоксиды, такие как диметилсульфоксид, галогеналканы. Реакция протекает при температуре реакционной смеси от комнатной до температуры флегмы,предпочтительно при температуре 40-70 С. Предпочтительный вариант воплощения реакции по настоящему способу состоит в том, что реагент для удаления защитной группы предварительно активируют таким образом, что его (реагент) перемешивают вместе с основанием в течение от 10 мин до 1 ч, предпочтительно в течение 30 мин до добавления промежуточного соединения формулы V. В качестве исходного соединения I можно применять продукт, получаемый по любому способу, известному, например, из ЕР 186087, WO 2004/041797, ЕР 1731514. Исходное соединение можно также получить промышленным способом, раскрытым в CN 1772744, J. Med. Chem., 1987, vol. 30, no. 3, р. 494498, J. Het. Chem., 2000, vol. 37, no. 2, p. 405-409. Ход реакции обычно контролируют применением аналитических способов, таких как тонкослойная хроматография, HPLC (высокоэффективная жидкостная хроматография), газовая хроматография и т.п., и реакцию завершают при подтверждении отсутствия исходного соединения. Выделение проводят таким образом, что к смеси свободного основания прамипексола и растворителя добавляют в указанном порядке HCl в газообразной форме и раствор газообразного HCl в растворителе. Прамипексол кристаллизуется из раствора в виде дигидрохлорида гидрата. Растворителями, пригодными для выделения, являются спирты, предпочтительно метанол, этанол, изопропанол, 2-бутанол,сложные эфиры, предпочтительно метилацетат, этилацетат, кетоны, предпочтительно ацетон, третбутилметилкетон. Выделение прамипексола в форме дигидрохлорида можно проводить переосаждением при помощи антирастворителей. Продукт можно выделить лиофилизацией или быстрым упариванием водных растворов прамипексола дигидрохлорида. Прамипексол в виде дигидрохлорида гидрата перекристаллизовывают из спиртов или смеси спиртов, предпочтительно из метанола, с добавлением этанола.-3 015818 Прамипексол основание, полученное способом, являющимся объектом настоящего изобретения,дополнительно можно преобразовывать в дигидрохлорид способами, описанными в ЕР 186087,WO 2006/070349, ЕР 1318987, WO 2006/012276. Соединение, полученное способом, составляющим объект настоящего изобретения, можно применять в качестве терапевтически активного ингредиента, который вместе с терапевтически приемлемым носителем можно применить в качестве лекарственного средства. Оно может применяться для лечения симптомов, связанных с болезнью Паркинсона, а также для лечения синдрома беспокойных ног. Соединение, полученное по настоящему изобретению, можно включать в состав фармацевтической композиции, которая в дополнение к активному ингредиенту также содержит фармацевтически приемлемые адъюванты, которые, как правило, известны рядовым специалистам в фармации, описанные, например, в ЕР 1318987, WO 2006/015944, WO 2006/015942, WO 03/053402, IPCOM000145762D. В этих композициях средний размер частиц активного ингредиента может быть от 5 до 500 мкм, предпочтительно от 10 до 300 мкм, более предпочтительно от 50 до 170 мкм. Распределение частиц по размерам можно определять способом рассеяния при лазерном возбуждении, применяя, например, аппарат MalvernMastersizer 2000 Apparatus с синтетическим изопарафином Isopar L в качестве среды разбавления. Фармацевтическую композицию можно получить способами, известными рядовому специалисту в фармации, такими как прямое уплотнение, сухое гранулирование или мокрое гранулирование. Ход реакций и чистоту продуктов можно контролировать следующими двумя способами. а) Хроматографическая чистота. Высокоэффективная жидкостная хроматография, HPLC, способ процентных отношений. Колонка: Поток: приблизительно 1,0 мл/мин. Детектор: УФ, длина волны: 263 нм. Инжекция: 20 мкл. Температура: 25 С (комнатная температура). б) Энантиомерная чистота. Высокоэффективная жидкостная хроматография, HPLC. Метод измерения: % площади. Колонка: Chiralpack IA 2504,6 мм, размер частиц 5 мкм. Подвижная фаза: гексан/этанол/ДЭА (диэтиламин) в отношении 75/25/0,05. Температура колонки: 25 С. Поток: 0,8 мл/мин. Детектор: УФ, длина волны: 263 нм. Инжекция: 20 мкл. Альтернативно можно применять следующие хроматографические условия: Колонка: Chiralpack AD-H 2504,6 мм, размер частиц 5 мкм. Подвижная фаза: этанол/гексан/ДЭА в отношении 90/10/0,1. Температура колонки: 25 С. Поток: 0,5 мл/мин. Детектор: УФ, длина волны: 263 нм. Инжекция: 5 мкл. Настоящее изобретение иллюстрируется следующими примерами, не ограничивающими данное изобретение. Хлорангидрид орто-нитробензолсульфониловой кислоты (8,865 г, 40 ммоль) растворяли в 100 мл THF и при перемешивании охлаждали до -10 С (лед+соль). Затем добавляли сначала 3 экв. триэтиламина (Et3N) (120 ммоль, 16,8 мл) и затем также 1,1 экв. 4,5,6,7-тетрагидробензо[d]тиазол-2,6 диамина (7,605 г, 45 ммоль). Образовавшуюся суспензию при перемешивании постепенно нагревали до комнатной температуры и выдерживали до окончания реакции. В ходе реакции наряду с растворимым продуктом образовывался нерастворимый в THF Et3NH+Cl-, который по завершении реакции был отфильтрован под вакуумом, и реакционная смесь упаривалась досуха на роторном испарителе. В остаток выливали H2O (300 мм), в результате чего на дне круглодонной колбы образовалась оранжевая вязкая жидкость. После растирания стеклянной палочкой сформировался желтый осадок (N-(2-амино-4,5,6,7 тетрагидробензо[d]тиазол-6-ил)-2-нитробензолсульфонамид). Осадок отфильтровывали и промывали 100 мл холодного этилового эфира и сушили. Выход реакции составил 95%. Пример 2. Синтез N-(2-амино-4,5,6,7-тетрагидробензо[d]тиазол-6-ил)-2-нитро-N-пропилбензолсульфонамидаK2CO3 (2,856 г, 20 ммоль) суспендировали в ацетонитриле (40 мл) и при перемешивании нагревали до 60 С. Затем добавляли бромистый пропил (1,65 мл, 18 ммоль) и реакцию оставляли на ночь (ход реакции прослеживали подходящим способом). После завершения реакции присутствующий осадок отфильтровывали под вакуумом. Реакционную смесь упаривали досуха и остаток растворяли в дихлорметане (150 мл). Органическую фазу промывали 1 М NaOH (350 мл), насыщенным раствором NaCl (250 мл) и сушили над Na2SO4. После упаривания дихлорметана получали оранжевый маслянистый продукт N-(2-амино-4,5,6,7-тетрагидробензо[d]тиазол 6-ил)-2-нитро-N-пропилбензолсульфонамид. Способ В.N-(2-Амино-4,5,6,7-тетрагидробензо[d]тиазол-6-ил)-2-нитробензолсульфонамид (1,770 г, 5 ммоль),Cs2CO3 (3,909 г, 12 ммоль) и KI (0,415 г, 2,5 ммоль) суспендировали в ацетонитриле (40 мл) и нагревали до 60 С. Затем добавляли бромистый пропил (0,9 мл, 10 ммоль) и ход реакции прослеживали подходящим способом. Способ выделения был тот же, что и в способе А. Пример 3. Синтез N6-пропил-4,5,6,7-тетрагидробензо[d]тиазол-2,6-диаминаK2CO3 (2,073 г, 15 ммоль) суспендировали в 20 мл DMF (диметилформамида) (хранившегося над молекулярными ситами), добавляли тиогликолевую кислоту (SHCH2COOH, 0,6 мл, 7,5 ммоль) и перемешивали в течение 30 мин. Затем добавляли N-(2-амино-4,5,6,7-тетрагидробензо[d]тиазол-6-ил)-2-нитроN-пропилбензолсульфонамид (0,99 г, 2,5 ммоль), растворенный в 20 мл DMF, и реакцию оставляли на ночь. После завершения реакции упаривали DMF, в остаток выливали Н 2 О (100 мл) и 1 М NaOH(200 мл). Затем водную фазу промывали дихлорметаном (380 мл) и объединенные органические фракции сушили над Na2SO4. После упаривания растворителя получали маслянистый оранжево-красный остаток (возможно присутствие DMF). Способ В.LiOH (0,5 г, 20 ммоль) суспендировали в 20 мл DMF (хранившегося над молекулярными ситами),добавляли тиогликолевую кислоту (SHCH2COOH, 0,6 мл, 7,5 ммоль) и перемешивали в течение 30 мин. Затем добавляли раствор N-(2-амино-4,5,6,7-тетрагидробензо[d]тиазол-6-ил)-2-нитро-N-пропилбензолсульфонамида (0,99 г, 2,5 ммоль) в 20 мл DMF и реакцию оставляли на ночь (раствор окрашивался в красно-оранжевый цвет). После завершения реакции упаривали DMF, в остаток выливали Н 2 О (100 мл) и 1 М NaOH (200 мл). Затем водную фазу промывали дихлорметаном (380 мл) и объединенные органические фракции сушили над Na2SO4. После упаривания растворителя был получен маслянистый остаток оранжево-красного цвета.(S)-(-)-2-Амино-6-(N-пропиламино)-4,5,6,7-тетрагидротиазол (9,15 г, 43,28 ммоль) в круглодонной колбе вместимостью 500 мл растворяли в 30 мл этанола и добавляли воду (0,78 г, 43,33 ммоль). Раствор охлаждали на ледяной бане до 0 С и продували газообразный HCl(r), при этом выпадал белый осадок. Круглодонную колбу закрывали и реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующий день осадок отфильтровывали под вакуумом и промывали малым количеством безводного этанола. Осадок переносили в круглодонную колбу вместимостью 100 мл и добавляли безводный этанол (50 мл). Суспензию нагревали до 45 С и упаривали этанол на роторном испарителе. Процедуру повторяли еще два раза, чтобы вытеснить весь избыточный HCl(r). Продукт перекристаллизовывали метанолом: соль растворяли в метаноле (70 мл) при 45 С, упаривали приблизительно 40 мл метанола и добавляли 20 мл этанола. Охлаждали до комнатной температуры и образовавшийся осадок отфильтровывали под вакуумом, промывали некоторым количеством охлажденного безводного этанола и сушили в вакууме над Р 2 О 5 и NaOH. Выход: 11,631 г (89,01%). Пример 5. Синтез N-(2-амино-4,5,6,7-тетрагидробензо[d]тиазол-6-ил)-2-нитробензолсульфонамида Хлористый ангидрид 2-нитробензолсулфониловой кислоты (390 г, 1,76 моль) растворяли в 4 л THF. Раствор охлаждали приблизительно до -10 С. Добавляли триэтиламин (Et3N) (740 г, 7,313 моль) и(6S)-4,5,6,7-тетрагидробензотиазол-2,6-диамин (327 г, 1,932 моль). При смешивании суспензия нагревалась приблизительно до 25 С и реагировала при этой температуре в течение приблизительно 1 ч. Отфильтровывали осажденный триэтиламмоний хлорид (Et3NH+Cl-). Фильтрат концентрировали приблизительно до 1/3 объема и добавляли воду (2 л). Вновь отгоняли приблизительно 1/2 растворителя. Добавляли воду (2 л) и смесь охлаждали до около 25 С и перемешивали до около 1 ч. Осажденный продукт 6S)-N-(2-амино-4,5,6,7-тетрагидротиазол-6-ил)-2-нитробензолсульфонамид) отделяли фильтрованием или центрифугированием. Пример 6. Синтез (S)-(-)-2-амино-6-(N-пропиламино)-4,5,6,7-тетрагидро 6 ензо[d]тиазола дигидрохлорида гидрата В 4,1 л ацетонитрила суспендировали карбонат калия (1890 г, 13,675 моль), (6S)-N-(2-амино-4,5,6,7 тетрагидробензотиазол-6-ил)-2-нитробензолсульфонамид (590 г, 1,665 моль) и бромистый пропил(1,09 л, 12 моль). Смесь нагревали при перемешивании приблизительно до 60 С и перемешивали при этой температуре в течение около 12 ч. Смесь охлаждали до около 25 С. Бромид калия извлекали фильтрованием. Раствор концентрировали приблизительно до 1/4 объема (не превышая 60 С) и охлаждали до комнатной температуры. Добавляли хлористый метилен (2 л) и водный 1 М NaOH раствор (2,43 л) и смесь перемешивали приблизительно 30 мин. Фазы разделяли и водную фазу вновь промывали дихлорметаном (1,46 л). Органические фазы собирали и концентрировали до около 1/10 объема. Добавляли 0,83 л этанола и раствор концентрировали до 1/10 объема. Добавляли 3,35 л этанола и этанольный раствор (6S)-N-(2-амино-4,5,6,7-тетрагидробензотиазол-6-ил)-2-нитро-N-пропилбензолсульфонамида сохраняли для последующей реакции. Этанол (2,35 л) и LiOH (288 г, 12 моль) загружали в реактор и суспензию охлаждали до 0-5 С. В течение около 30 мин добавляли тиогликолевую кислоту (SHCH2COOH) (720 г, 7,816 моль) (температура не должна превышать 25 С). Суспензию нагревали до около 25 С и перемешивали в течение около 45 мин. Добавляли этанольный раствор (6S)-N-(2-амино-4,5,6,7-тетрагидробензотиазол-6-ил)-2-нитро-Nпропилбензолсульфонамида. Воздух в реакторе замещали азотом. Смесь нагревали приблизительно до 50 С и смешивали при этой температуре в течение около 4 ч. Смесь охлаждали приблизительно до 25 С и фильтровали. Фильтрат концентрировали при 40 С приблизительно до 1/4 объема и охлаждали до температуры окружающей среды. Добавляли дихлорметан (4,23 л) и водный 1 М раствор NaOH (2,53 л) и смесь перемешивали в течение около 30 мин. Фазы разделяли и водную фазу вновь промывали 4,23 л дихлорметана. Органические фазы, содержащие прамипексол, собирали и концентрировали приблизительно до 1/4 объема. Добавляли 5 л этанола. К этанольному раствору прамипексола добавляли воду (27,6 мл, 1,53 моль) и раствор охлаждали приблизительно до -10 С. В раствор вводили газообразный HCl(r) (200 г). Во время добавления газообразного HCl(r) температура раствора, и позднее суспензии, не должна превышать 25 С. После добавления суспензию нагревали приблизительно до 40 С и концентрировали до 2/3 объема. Добавляли 2,65 л этанола и суспензию концентрировали до 1/2 объема. Вновь добавляли 3,5 л этанола и концентрировали суспензию до 1/2 объема. Раствор охлаждали приблизительно до -15 С и продукт выделяли фильтрованием. Продукт сушили на воздухе при 25 С и окончательно при 40 С. с нитро- или галогензамещенным или незамещенным арилсулфонилхлоридом формулы II в результате которой получают промежуточное сульфонамидное соединение формулы III(ii) реакцию промежуточного соединения формулы III с соединением формулы IV где X можно выбрать из Cl, Br, I или других групп, способных к нуклеофильному замещению, таких как OTs (тозилат), OMs (мезилат),в результате которой получают промежуточное соединение формулы V(iii) преобразование промежуточного соединения формулы V в прамипексол посредством использования селективного реагента для отщепления сульфонильной защитной группы;(iv) необязательное преобразование прамипексола в фармацевтически приемлемую соль. 2. Способ по п.1, где реакцию между промежуточными продуктами I и II проводят в присутствии основания. 3. Способ по п.1, где в качестве нитрозамещенного арилсульфонилхлорида формулы II применяют моно-, ди- или тринитрозамещенный бензолсульфонилхлорид. 4. Способ по п.1, где в качестве нитрозамещенного арилсульфонилхлорида формулы II применяют 2-нитробензолсульфонилхлорид. 5. Способ по п.1, где реакцию между промежуточным соединением III и соединением формулы IV проводят в присутствии основания. 6. Способ по п.1, где в качестве селективного реагента применяют тиол в присутствии основания или алкоксида. 7. Способ по п.6, где в качестве тиола применяют тиофенол или тиогликолевую кислоту в присутствии основания. 8. Способ по п.1, где способ представляет собой непрерывный процесс. 9. Соединение формулы III
МПК / Метки
МПК: C07D 277/82
Метки: новый, солей, способ, приемлемых, прамипексола, фармацевтически, синтеза
Код ссылки
<a href="https://eas.patents.su/8-15818-novyjj-sposob-sinteza-pramipeksola-i-ego-farmacevticheski-priemlemyh-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ синтеза прамипексола и его фармацевтически приемлемых солей</a>
Предыдущий патент: Иммуногенная композиция, содержащая адъювант в виде эмульсии "масло в воде"
Следующий патент: Композиция, содержащая рутин и полиненасыщенную жирную кислоту, имеющая ингибирующую активность в отношении 5a-редуктазы
Случайный патент: Кофеварка со встроенным устройством для подачи пара












