Способы получения алкалоидов хиназолина
Номер патента: 9047
Опубликовано: 26.10.2007
Авторы: Хоффман Ханс-Райнер, Матуш Рудольф, Моорманн Йохим
Формула / Реферат
1. Способ получения соединения, имеющего следующую формулу (I)
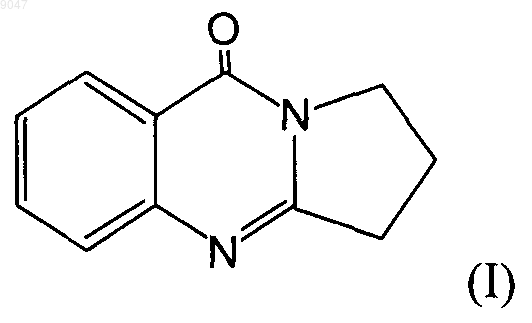
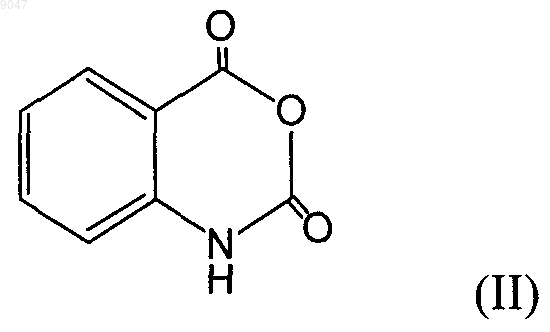
путем преобразования соединения, имеющего формулу (II), при помощи 2-пирролидона, отличающийся тем, что используется избыточное количество 2-пирролидона относительно соединения (II).
2. Способ по п.1, отличающийся тем, что на последующей стадии продукт (I) реакции выделяют непосредственно из реакционной смеси методом кристаллизации.
3. Способ по п.1 или 2, отличающийся тем, что используется 1,5-5 моль 2-пирролидона, в каждом случае относительно количества соединения (II).
4. Способ по п.1 или 2, отличающийся тем, что используется 2-4 моль 2-пирролидона, в каждом случае относительно количества соединения (II).
5. Способ по п.1 или 2, отличающийся тем, что используется 2,5-3,5 моль 2-пирролидона, в каждом случае относительно количества соединения (II).
6. Способ по любому из предшествующих пунктов, отличающийся тем, что преобразование осуществляют при температуре от 50 до 200шС.
7. Способ по п.6, отличающийся тем, что температуру реакционной смеси сначала повышают до 70-130шС, а затем до 140-200шС.
8. Способ по п.6, отличающийся тем, что температуру реакционной смеси сначала повышают до 80-120шС, а затем до 140-200шС.
9. Способ по п.6, отличающийся тем, что температуру реакционной смеси сначала повышают до 70-130шС, а затем до 150-190шС.
10. Способ по любому из предшествующих пп.7-9, отличающийся тем, что исходную температуру поддерживают в течение 0,5-2 ч, а последующую температуру поддерживают в течение 1-8 ч.
11. Способ по любому из пп.7-9, отличающийся тем, что исходную температуру поддерживают в течение 1-1,5 ч, а последующую температуру поддерживают в течение 2-5 ч.
12. Способ по пп.10 и 11, отличающийся тем, что после охлаждения реакционной смеси в нее вносят затравочные кристаллы соединения (I) и выдерживают при комнатной температуре в течение от 24 ч до 7 суток, чтобы произошла кристаллизация.
13. Способ по п.12, отличающийся тем, что температура составляет по крайней мере 25шС.
14. Способ по пп.12 и 13, отличающийся тем, что реакционную смесь выдерживают при температуре в течение от 50 до 100 ч, чтобы произошла кристаллизация.
15. Способ по любому из пп.12-14, отличающийся тем, что кристаллизацию осуществляют при температуре 30-70шС.
16. Способ по любому из пп.12-14, отличающийся тем, что кристаллизацию осуществляют при температуре 40-60шС.
17. Способ получения соединения, имеющего следующую формулу (III)
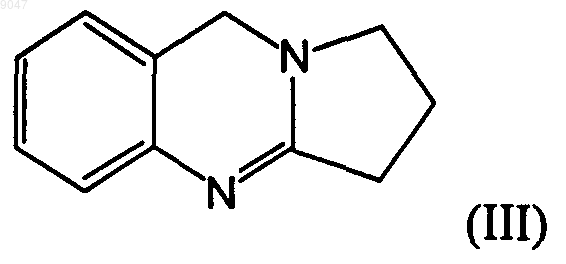
в ходе осуществления которого:
(A) получают соединение (I) способом по любому из пп.1-16;
(B) осуществляют восстановительную реакцию, продуктом которой является соединение (III) в виде соли;
(C) из соли высвобождают соединение (III).
18 Способ по п.17, отличающийся тем, что соединение (I) получают путем кристаллизации по любому из пп.2-16.
19. Способ по п.17 или 18, отличающийся тем, что восстановительную реакцию (стадия В) осуществляют в присутствии цинка и кислоты.
20. Способ по п.19, отличающийся тем, что соединение (I) сначала растворяют в ледяной уксусной кислоте, а затем добавляют цинк и соляную кислоту.
21. Способ по п.19, отличающийся тем, что соединение (I) в кристаллизованном виде сначала растворяют в ледяной уксусной кислоте, а затем добавляют цинк и соляную кислоту
22. Способ по п.20 или 21, отличающийся тем, что восстановительную реакцию осуществляют в присутствии водного раствора серной кислоты и цинковой пыли.
23. Способ по любому из пп.17-21, отличающийся тем, что после осуществления стадии (В) из реакционной смеси методом кристаллизации выделяют соединение (III) в виде соли.
24. Способ по любому из пп.17-23, отличающийся тем, что на стадии (С) соединение (III) высвобождают из соли путем добавления основания.
25. Способ по п.24, отличающийся тем, что основание представляет собой NaOH.
26. Способ по п.24 или 25, отличающийся тем, что стадию (С) осуществляют в условиях нагревания, при этом соединение (III), высвобожденное из соли, получают в расплавленном виде.
27. Способ по п.26, отличающийся тем, что соединение (III), находящееся в расплавленном виде, охлаждают и после застывания выделяют из водного щелочного раствора методом кристаллизации.
28. Способ получения соединения (III), начиная с соли названного соединения, отличающийся тем, что соединение (III) высвобождают и выделяют из соли путем добавлением основания, осуществляющегося в условиях нагревания и соединение (III) отделяют от соли в расплавленном виде в качестве свободного основания.
29. Способ по п.28, отличающийся тем, что соединение (III), находящееся в расплавленном виде, охлаждают и после застывания выделяют из водного щелочного раствора методом кристаллизации.
30. Способ получения соединения, имеющего формулу (III), отличающийся тем, что осуществляют следующие стадии:
восстанавливают упомянутое соединение (I) с целью получения соединения (III), при этом соединение (III) получают в виде соли;
добавляют основание с целью высвобождения из соли соединения (III) и его получения в жидком виде.
31. Применение соединения, имеющего формулу (I), полученного способом по любому из пп.1-16, для получения соединения, имеющего формулу (III), в виде свободного основания или соли.
Текст
009047 Настоящее изобретение относится к способам получения алкалоидов хиназолина, имеющих следующие формулы (I) и (III) Соединение (III) представляет собой 1,2,3,9-тетрагидропиррол [2,1-b]хиназолин. Данное соединение также известно под обычным названием дезоксипеганин и содержится в растениях семейства парнолистниковых. С учетом фармакологических свойств дезоксипеганина его относят к группе обратимо действующих ингибиторов холинестеразы. Помимо этого, он также действует как ингибитор моноаминоксидазы. Дезоксипеганин рассматривается в качестве лекарственного средства, используемого в терапевтических целях, например, для лечения наркомании и наркотической зависимости (DE-A 19906978), лечения болезни Альцгеймера (DE-A 19906975) или лечения никотиновой зависимости (DE-A 19906979). Соединение (I), известное под названием пеген-(9)-он-(8), является важным промежуточным продуктом синтеза дезоксипеганина и других алкалоидов хиназолина данного типа. Синтез пеген-(9)-она-(8)(краткое название: пегенон) может быть осуществлен способом, описанным у SPTH и PLATZER (Веr. 68 (1935), 2221-2224), путем преобразования ангидрида изатоновой кислоты с использованием эквимолярного количества пирролидона. После этого необходимо осуществить высоковакуумную дистилляцию при температуре от 140 до 160 С, чтобы отделить побочные продукты реакции. Данный способ применим лишь для получения малых количеств вещества (в пределах нескольких граммов), а не в промышленных масштабах. Согласно MORRIS, HANFORD и ADAMS (J. Amer. Chem. Soc. 52(1935), 951-954) пегенон (2,3 триметилен-4-хиназолон) получают (i) путем окисления дезоксивазицина при помощи перекиси водорода. Дезоксивазицин идентичен дезоксипеганину. В качестве альтернативы, (ii) пегенон получают методом многостадийного синтеза, в ходе которого -феноксибутирилхлорид вводят в реакцию с оаминобензамидом до образования соответствующего амида. После замыкания кольца под действием тепла происходит замещение феноксильной группы бромом, после чего посредством дальнейшего замыкания кольца получают 2,3-триметилен-4-хиназолон (= пегенон). Если для получения дезоксипеганина в качестве исходного компонента требуется пегенон, единственным, если таковые вообще существуют, способом, который следовало бы рассмотреть помимо упомянутого выше способа SPTH И PLATZER, является способ синтеза (ii), предложенный Morris и др. Тем не менее, данный способ является неэкономичным из-за большого числа стадий реакции. Дезоксипеганин предпочтительно получают методом выделения из руты сирийской (Peganum harmala) или методом синтеза. У MORRIS, HANFORD и ADAMS (в процитированном месте, стр. 953) описано получение дезоксивазицина (=дезоксипеганина) путем восстановления 2,3-(-гидрокситриметилен)-4-хиназолона или 2,3-(-хлотриметилен)-4-хиназолона с использованием ледяной уксусной кислоты и цинковой пыли (тип реакции: восстановительная реакция Клемменсена). После извлечения хлороформа продукт реакции выделяют методом кристаллизации из петролейного эфира. Недостатком в данном случае является тот факт, что исходные соединения гидрокситриметилен)-4-хиназолон или 2,3-(-хлотриметилен)-4 хиназолон должны быть синтезированы начиная с пеганина (=вазицина). Согласно SARGAZAKOV и др. (Химические природные соединения, 4 (1990), 506-507) гидрохлорид дезоксипеганина может быть получен путем циклоконденсации антраниловой кислоты с использованием 2-пирролидона, в результате чего получают гидрохлорид дезоксивазицина (гидрохлорид пегенона), и последующего восстановления данного промежуточного продукта в ходе реакции Клемменсена с целью получения гидрохлорида дезоксипеганина. Реакцию циклоконденсации осуществляют в присутствии трххлористого фосфора с использованием толуола в качестве растворителя. После осуществления как первой стадии (циклоконденсации), так второй стадии (восстановления) необходимо многократное извлечение хлороформа. В целом, для получения 2 кг гидрохлорида дезоксипеганина требуется около 50 л толуола и 80 л хлороформа. Способ синтеза, описанный у SARGAZAKOV и др., неэффективен по ряду причин. Выход реакции составляет всего около 50%, чистота полученного продукта (гидрохлорида дезоксипеганина) находится в пределах 94-95%. Данный способ требует большого количества органических растворителей, в особенности, толуола и хлороформа, а также трххлористого фосфора. Это неблагоприятно с точки зрения экологии, а также по соображениям безопасности и стоимости. Кроме того, данный способ требует больших затрат времени и труда, поскольку, чтобы обеспечить упомянутую степень чистоты, требуется осуществить несколько стадий извлечения хлороформа. С точки зрения применения дезоксипеганина в качестве-1 009047 лекарственного средства особо неблагоприятным является использование хлоруглеводородов. Дополнительным недостатком упомянутых выше известных способов синтеза является тот факт,что из-за высокой доли побочных продуктов реакции невозможно осуществить выделение продуктов реакции методами кристаллизации, вместо чего данную задачу решают лишь путем дорогостоящих стадий извлечения или высоковакуумной дистилляции. Таким образом, задачей настоящего изобретения является создание способов синтеза, позволяющих получать алкалоиды хиназолина, имеющие приведенные выше формулы (I) и (III), при этом такие способы обеспечивают выход и степень чистоты продукта, по меньшей мере, на уровне известных способов или на более высоком уровне; обеспечивают получение дезоксипеганина (III), применимого для изготовления лекарственных средств; преимущественно осуществляются без использования вредных для окружающей среды или здоровья веществ, в особенности органических растворителей; отличаются хорошим балансом сырья; являются причиной образования преимущественно только таких побочных продуктов, которые могут быть легко переработаны; могут быть осуществлены с использованием экономически эффективных исходных материалов; в целом обеспечивают более простое и экономически эффективное получение вышеупомянутых соединений в промышленном масштабе. Решение названных и других задач неожиданно обеспечено за счет способов по независимым пп.1,9, 18 и 20, а также дополнительных вариантов осуществления, описанных в зависимых пунктах. В п.1 заявлен способ по изобретению, в ходе осуществления которого соединение, имеющее формулу (II) (=ангидрид изатоновой кислоты) вводят в реакцию с 2-пирролидоном (=пирролидинон) с целью получения соединения, имеющего формулу (I). В ходе такой реакции используется избыточное количество 2-пирролидона относительно количества соединения (II). Это означает, что количество используемого пирролидона превышает эквимолярное количество. Предпочтительно, используется 1,5-5 моль, особо предпочтительно 2-4 моль и наиболее предпочтительно 2,5-3,5 моль пирролидона, при этом каждая из перечисленных величин приведена относительно количества использованного соединения (II). Неожиданным следствием этого является уменьшение образования нежелательных продуктов реакции и тот факт, что получаемый продукт (I) может быть легко кристаллизован. Кроме того, обеспечивается высокий выход (70%) и чистота продукта около 99% (по результатам ЯМР). Благодаря отличной кристаллизуемости продукта отпадает необходимость в дорогостоящих способах очистки, таких как высоковакуумная дистилляция. Поскольку очистка продукта может быть осуществлена простым способом путем кристаллизации, способ также легко осуществим в промышленных масштабах. В основу способа положено следующее уравнение, например, следующего вида: Реакцию осуществляют с использованием тепла, предпочтительно при температуре в диапазоне от 50 до 200 С. Предпочтительно, чтобы первоначальная температура находилась в диапазоне от 70 до 130 С, после чего температуру поддерживают в диапазоне от 140 до 200 С. Особо предпочтительно, чтобы первоначальная температура была в диапазоне от 80 до 120 С, а затем в диапазоне от 140 до 200 С. В соответствии с одним из предпочтительных вариантов выполнения изобретения первоначальную температуру поддерживают в диапазоне от 70 до 130 С, после чего температуру поддерживают в диапазоне от 150 до 190 С. Названную выше первоначальную температуру предпочтительно поддерживают в течение от 0,5 до 2 ч, особо предпочтительно от 1 до 1,5 ч после начала реакции. Названную выше последующую температуру предпочтительно поддерживают в течение от 1 до 8 ч, особо предпочтительно от 2 до 5 ч.-2 009047 Предпочтительно способ осуществляют с использованием пирролидона, к которому затем частями добавляют соединение (II). Особо желательно, что выделение продукта (I) происходило непосредственно из реакционной смеси методом кристаллизации. Для осуществления кристаллизации соединения (I) реакционную смесь охлаждают и вводят в нее затравочные кристаллы. Кристаллизация происходит при комнатной температуре, предпочтительно по меньшей мере 25 С, более предпочтительно от 30 до 70 С, наиболее предпочтительно от 40 до 60 С, за счет чего ускоряется процесс кристаллизации. Процесс кристаллизации занимает примерно от 24 ч до 7 суток, предпочтительно примерно от 50 до 100 ч. В полученных кристаллах содержится пирролидон. Настоящее изобретение также относится к способам получения дезоксипеганина (соединения,имеющего формулу III). Такие способы преимущественно состоят из трех стадий:(A) стадии, на которой получают соединение (I) способом по любому из пп.1-16;(B) стадии, на которой осуществляют восстановительную реакцию, продуктом которой является соединение (III) в виде соли;(C) стадии, на которой из соли высвобождают соединение (III). Протекание восстановительной реакции (реакции Клемменсена) можно отобразить, например, следующим образом: В данном случае соединение (III) получают в виде соли; в проиллюстрированном примере реакции соль тетрахлорцинковой кислоты получают, если восстановительная реакция протекает в присутствии ледяной уксусной кислоты, цинка и соляной кислоты. Особо предпочтительно, чтобы использованное исходное соединение (I) представляло собой продукт реакции, выделенный методом кристаллизации, при этом такой продукт реакции может быть получен описанными выше способами. В предпочтительном варианте осуществления изобретения восстановительную реакцию осуществляют с использованием ледяной уксусной кислоты, цинка (цинковой пыли) и соляной кислоты, для чего предпочтительно сначала растворяют соединение (I) в ледяной уксусной кислоте, а затем добавляют цинк и соляную кислоту. В другом предпочтительном варианте осуществления изобретения восстановительную реакцию осуществляют с добавлением цинка (цинковой пыли) и серной кислоты без использования ледяной уксусной кислоты. В результате получают сульфат водорода, имеющий формулу (III) Реакцию предпочтительно осуществляют при температуре примерно от 50 до 90 С, особо предпочтительно от 70 до 80 С; в целом реакция завершается примерно через 2-3 ч. После завершения реакции избыток цинка удаляют известными способами, например процеживанием. Полученную таким способом соль, имеющую формулу (III), выделяют простым и эффективным способом путем ее кристаллизации из реакционной смеси. Для этого в реакционную смесь вводят затравочные кристаллы. После завершения кристаллизации остающийся маточный раствор отделяют известными специалистам в данной области техники способами (например, сцеживанием). На упомянутой стадии (С) осуществления способов получения соединения, имеющего формулу(III), соль, полученную на стадии (В), затем преобразуют в свободное основание (III). Для этого в водный раствор соли обычно добавляют основание, предпочтительно NaOH. В особо предпочтительном варианте осуществления изобретения данную стадию осуществляют таким образом, чтобы получить высвобожденное основание в расплавленном состоянии. С этой целью реакцию осуществляют при температуре, превышающей точку плавления (86 С) свободного основания(III) (= дезоксипеганина), предпочтительно в диапазоне от 90 до 100 С. Находящееся в расплавленном состоянии основание выделяют из реакционной смеси простым способом, возможно, после застывания;-3 009047 применимые для этого способы известны специалистам в данной области техники. В дополнительном, особо предпочтительном варианте осуществления изобретения расплавленное основание (III) затем охлаждают и дают ему застыть. Застывшее вещество растворяют, чтобы получить насыщенный раствор; в качестве растворителя предпочтительно используют воду. Из насыщенного раствора, в который добавляют основание (предпочтительно NaOH), чтобы сделать его щелочным, методом последующей кристаллизации выделяют конечный продукт, представляющий собой дезоксипеганин с высокой степенью чистоты. Таким образом, изобретение также относится к способам получения дезоксипеганина (соединения,имеющего формулу (III, в ходе осуществления которых такое соединение выделяют из реакционной смеси в жидком виде. Более точно, изобретение относится к способам упомянутого выше типа, предусматривающих осуществление следующих стадий: стадии восстановления упомянутого соединения (I) с целью получения соединения (III), при этом соединение (III) получают в виде соли; стадии добавления основания с целью высвобождения из соли соединения (III) и его получения в жидком виде. Способы по изобретению обеспечивают простое и экономично получение упомянутых соединений(I, III) в количествах и со степенью чистоты, необходимой при изготовлении лекарственных средств. Особо желательным в данном случае является возможность не применять органические растворители. Далее способы по изобретению проиллюстрированы на примерах. Пример 1 (сравнительный пример). Получение пеген-(9)-она-(8) (аналог соединения, имеющего формулу (I путем преобразования пирролидона с использованием эквимолярного количества ангидрида изатоновой кислоты способом поSPTH И PLATZER (в процитированном месте, стр. 2221 и 2224). Два литра пирролидона и 4 кг ангидрида изатоновой кислоты (в молярном отношении 1:1,07) поместили в сосуд из хромированной стали (вместимостью 10 л) и при энергичном перемешивании нагрели до температуры 120 С до начала образования газа. Далее смесь в течение 10 мин нагрели до температуры 160 С и затем в течение 30 мин до температуры 190 С. 558 г (=3 моля) жидкой реакционной смеси,еще находящейся в горячем состоянии, поместили в 1-литровую колбу (NS 29). Смеси, оставшейся в стальном сосуде, дали застыть до образования черной, стеклообразной массы, не применимой для выделения пегенона. Из реакционной смеси (558 г), помещенной в колбу, методом высоковакуумной дистилляции с использованием дистилляционного испарителя, нагретого до 120 С, получили 117 г пегенона; данный результат соответствует выходу 21%. После рекристаллизации из эфира была определена точка плавления 11 С. Пример 2. Синтез пегенона (соединения, имеющего формулу (1. Один моль ангидрида изатоновой кислоты (соединения, имеющего формулу (I преобразовали с использованием 3 моль пирролидона. Для этого пирролидон поместили в нагреваемый сосуд из хромированной стали (30 л) и нагрели до температуры около 100 С, после чего частями добавляли ангидрид изатоновой кислоты при непрерывном перемешивании. Примерно через 1 ч все количество ангидрида изатоновой кислоты растворили в пирролидоне. После этого смесь в течение 5 ч нагрели до температуры 155-160 С (в процессе нагревания образовались СO2 и Н 2 О; см. выше), а затем в течение короткого времени нагрели до температуры 170-180 С. После охлаждения до температуры около 50 С в полученную таким способом массу внесли кристаллы пегенона и дали кристаллизоваться при комнатной температуре в течение около 50-100 ч. Процесс кристаллизации можно ускорить (до примерно 2-3 суток) за счет повышения температуры (по меньшей мере на 25 С). Маточный раствор отделили от кристаллов путем сцеживания. В пегенон было преобразовано в целом более 90% использованных исходных соединений. Выход кристаллизованного пегенона составил 40%; остальная часть пегенона растворена в пирролидоне. Полученные кристаллы пегенона все еще содержали 30 мол.% пирролидона по результатам ЯМР; чистота пегенона составляла около 99% по результатам ЯМР. Как вариант данного способа, исходные соединения были использованы в молярном отношении 1:2,5 (ангидрид изатоновой кислоты:пирролидон). За этот счет доля кристаллизованного пегенона может быть увеличена до примерно 55% при чистоте около 99%. Пример 3. а) Реакция Клемменсена восстановления соединения (I) Кристаллы пегенона, полученные согласно примеру 2 (2,% кг; содержание пирролидона - 15 мас.%; что соответствует 1,83 кг или 9,8 моль чистого пегенона) при температуре около 50 С растворили в 6,11(=100,4 моль) ледяной уксусной кислоты и поместили в сосуд из хромированной стали (50 л). Затем небольшими частями добавили 3,7 кг (=56,4 моль) цинковой пыли, при этом температуру реакционной смеси поддерживали на уровне около 60 С. Спустя примерно 1 ч небольшими частями в течение двух часов при непрерывном перемешивании добавили 43 л концентрированной НСl (32%; что соответст-4 009047 вует 121,74 моль). Затем (примерно через 4-5 ч) из реакционной смеси путем процеживания удалили избыток цинка. После внесения затравочных кристаллов методом кристаллизации было выделено около 66% соли дезоксипеганина. Остальной маточный раствор собрали методом испарения, после чего снова кристаллизовали 66% соли дезоксипеганина. В целом было получено около 90% соли дезоксипеганина в кристаллической форме.b) Высвобождение основания дезоксипеганина (соединение (III Кристаллы (2,5 кг), полученные описанным способом, растворили в горячей воде (около 11 л). Затем добавили NaOH (около 8 кг в таблетках), одновременно перемешивая и нагревая смесь до температуры 95-100 С. В результате был получен дезоксипеганин в расплавленном виде, который выделили из реакционной смеси. После застывания продукта его снова растворили в нагретой воды, чтобы получить насыщенный раствор, который при помощи NaOH сделали щелочным. Из такого насыщенного щелочного раствора методом кристаллизации выделили дезоксипеганин. Выход дезокспипеганина относительно соли дезоксипеганина превысил 90%, а его чистота составила 99% (по результатам ЯМР). Пример 4. Реакция Клемменсена восстановления соединения (I) (альтернативный способ) 175 г кристаллов пегенона (с содержанием пирролидона 30 мол.%; что соответствует 150 г пегенона; см. пример 2) смешали с 750 г (20%) H2SO4 и нагревали (примерно до 85 С) в течение около 30 мин при одновременно перемешивании. Затем постепенно добавили 260 г цинковой пыли (в течение около 2 ч). Спустя примерно 1 ч снова добавили H2SO4 (375 мл, 40%). Реакция завершилась в общей сложности примерно через 3 ч, и избыток цинка удалили путем процеживания. Аналогично примеру 3 а) полученную соль дезоксипеганина отделили от реакционной смеси методом кристаллизации. Высвобождение основания осуществили способом, описанным в примере 3b). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения, имеющего следующую формулу (I) путем преобразования соединения, имеющего формулу (II), при помощи 2-пирролидона, отличающийся тем, что используется избыточное количество 2-пирролидона относительно соединения (II). 2. Способ по п.1, отличающийся тем, что на последующей стадии продукт (I) реакции выделяют непосредственно из реакционной смеси методом кристаллизации. 3. Способ по п.1 или 2, отличающийся тем, что используется 1,5-5 моль 2-пирролидона, в каждом случае относительно количества соединения (II). 4. Способ по п.1 или 2, отличающийся тем, что используется 2-4 моль 2-пирролидона, в каждом случае относительно количества соединения (II). 5. Способ по п.1 или 2, отличающийся тем, что используется 2,5-3,5 моль 2-пирролидона, в каждом случае относительно количества соединения (II). 6. Способ по любому из предшествующих пунктов, отличающийся тем, что преобразование осуществляют при температуре от 50 до 200 С. 7. Способ по п.6, отличающийся тем, что температуру реакционной смеси сначала повышают до 70130 С, а затем до 140-200 С. 8. Способ по п.6, отличающийся тем, что температуру реакционной смеси сначала повышают до 80120 С, а затем до 140-200 С. 9. Способ по п.6, отличающийся тем, что температуру реакционной смеси сначала повышают до 70130 С, а затем до 150-190 С. 10. Способ по любому из предшествующих пп.7-9, отличающийся тем, что исходную температуру поддерживают в течение 0,5-2 ч, а последующую температуру поддерживают в течение 1-8 ч. 11. Способ по любому из пп.7-9, отличающийся тем, что исходную температуру поддерживают в течение 1-1,5 ч, а последующую температуру поддерживают в течение 2-5 ч. 12. Способ по пп.10 и 11, отличающийся тем, что после охлаждения реакционной смеси в нее вносят затравочные кристаллы соединения (I) и выдерживают при комнатной температуре в течение от 24 ч до 7 суток, чтобы произошла кристаллизация. 13. Способ по п.12, отличающийся тем, что температура составляет по крайней мере 25 С.-5 009047 14. Способ по пп.12 и 13, отличающийся тем, что реакционную смесь выдерживают при температуре в течение от 50 до 100 ч, чтобы произошла кристаллизация. 15. Способ по любому из пп.12-14, отличающийся тем, что кристаллизацию осуществляют при температуре 30-70 С. 16. Способ по любому из пп.12-14, отличающийся тем, что кристаллизацию осуществляют при температуре 40-60 С. 17. Способ получения соединения, имеющего следующую формулу (III)(A) получают соединение (I) способом по любому из пп.1-16;(B) осуществляют восстановительную реакцию, продуктом которой является соединение (III) в виде соли;(C) из соли высвобождают соединение (III). 18 Способ по п.17, отличающийся тем, что соединение (I) получают путем кристаллизации по любому из пп.2-16. 19. Способ по п.17 или 18, отличающийся тем, что восстановительную реакцию (стадия В) осуществляют в присутствии цинка и кислоты. 20. Способ по п.19, отличающийся тем, что соединение (I) сначала растворяют в ледяной уксусной кислоте, а затем добавляют цинк и соляную кислоту. 21. Способ по п.19, отличающийся тем, что соединение (I) в кристаллизованном виде сначала растворяют в ледяной уксусной кислоте, а затем добавляют цинк и соляную кислоту 22. Способ по п.20 или 21, отличающийся тем, что восстановительную реакцию осуществляют в присутствии водного раствора серной кислоты и цинковой пыли. 23. Способ по любому из пп.17-21, отличающийся тем, что после осуществления стадии (В) из реакционной смеси методом кристаллизации выделяют соединение (III) в виде соли. 24. Способ по любому из пп.17-23, отличающийся тем, что на стадии (С) соединение (III) высвобождают из соли путем добавления основания. 25. Способ по п.24, отличающийся тем, что основание представляет собой NaOH. 26. Способ по п.24 или 25, отличающийся тем, что стадию (С) осуществляют в условиях нагревания, при этом соединение (III), высвобожденное из соли, получают в расплавленном виде. 27. Способ по п.26, отличающийся тем, что соединение (III), находящееся в расплавленном виде,охлаждают и после застывания выделяют из водного щелочного раствора методом кристаллизации. 28. Способ получения соединения (III), начиная с соли названного соединения, отличающийся тем,что соединение (III) высвобождают и выделяют из соли путем добавлением основания, осуществляющегося в условиях нагревания и соединение (III) отделяют от соли в расплавленном виде в качестве свободного основания. 29. Способ по п.28, отличающийся тем, что соединение (III), находящееся в расплавленном виде,охлаждают и после застывания выделяют из водного щелочного раствора методом кристаллизации. 30. Способ получения соединения, имеющего формулу (III), отличающийся тем, что осуществляют следующие стадии: восстанавливают упомянутое соединение (I) с целью получения соединения (III), при этом соединение (III) получают в виде соли; добавляют основание с целью высвобождения из соли соединения (III) и его получения в жидком виде. 31. Применение соединения, имеющего формулу (I), полученного способом по любому из пп.1-16,для получения соединения, имеющего формулу (III), в виде свободного основания или соли.
МПК / Метки
МПК: C07D 487/04
Метки: хиназолина, получения, алкалоидов, способы
Код ссылки
<a href="https://eas.patents.su/7-9047-sposoby-polucheniya-alkaloidov-hinazolina.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения алкалоидов хиназолина</a>
Предыдущий патент: Способ выделения оксазола
Следующий патент: Ингибитор белка резистентности рака молочной железы (bcrp)
Случайный патент: Способ покрытия труб











