Ингибитор белка резистентности рака молочной железы (bcrp)
Номер патента: 9048
Опубликовано: 26.10.2007
Авторы: Айяма Рицуо, Йосида Ох, Хасимото Сусуке, Сугимото Йосиказу, Нагаока Масато, Мацузаки Такеси, Фурута Томио, Хатано Хироси, Нисияма Юкико, Ямазаки Риута
Формула / Реферат
1. Производное дифенилакрилонитрила, представленное формулой (1), или его соль в качестве ингибитора белка резистентности рака молочной железы
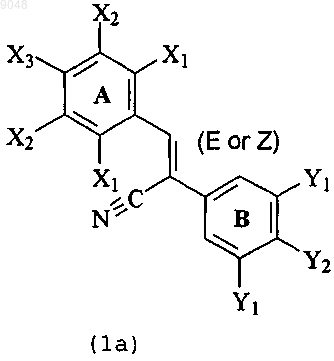
где X1 в кольце А является атомом водорода, гидроксильной группой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NHCOCH3), С2-С8-ацилоксигруппой, метоксиэтоксиметоксигруппой или С1-С8-алкоксигруппой;
Х2 является атомом водорода, гидроксильной группой, С1-С8-алкоксигруппой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NHCOCH3), С2-С8-ацилоксигруппой, метоксиэтоксиметоксигруппой, метилендиоксигруппой или С1-С4-алкильной группой;
Х3 является атомом водорода, гидроксильной группой, С2-С8-ацилоксигруппой, С1-С8-алкоксигруппой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NHCOCH3), цианогруппой, формильной группой (-СНО), -COOR1 (R1 - атом водорода, С1-С4-алкильная группа),
-О(СН2)nCOOR2 (n - 1-7; R2 - атом водорода, С1-С4-алкильная группа), -OOCCH2CH2COOR3 (R3 - атом водорода, С1-С4-алкил, (Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил, гликопиранозильная группа), С2-С8-галогенацилоксигруппой, метилендиоксигруппой, фосфатной группой
(-ОР(О)(ОН)2) и ее солью, сульфатной группой (-OSO3H) и ее солью, гликопиранозильной группой и ее солью, фосфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или метоксиэтоксиметоксигруппой,
Y1 в кольце В является атомом водорода, С2-С8-ацилоксигруппой, трифторметильной группой или С1-С8-алкоксигруппой;
Y2 является атомом водорода, гидроксильной группой, С2-С8 ацилоксигруппой, метоксиэтоксиметоксигруппой, -COOR1 (R1 - атом водорода, С1-С4-алкильная группа), -О(СН2)nCOOR2 (n - 1-7; R2 - атом водорода, С1-С4-алкильная группа), -OOCCH2CH2COOR3 (R3 - атом водорода, С1-С4-алкил, (Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил, гликопиранозильная группа), С2-С8-галогенацилоксигруппой, метилендиоксигруппой, фосфатной группой (-ОР(О)(ОН)2) или ее солью, сульфатной группой (-OSO3H) или ее солью, гликопиранозильной группой и ее солью, фосфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или C1-С8-алкоксигруппой.
2. Производное дифенилакрилонитрила, представленное формулой (1), или его соль в качестве ингибитора белка резистентности рака молочной железы
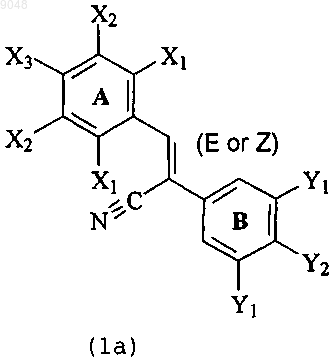
где X1 в кольце А является атомом водорода, гидроксильной группой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NНСОСН3), С2-С8-ацилоксигруппой, метоксиэтоксиметоксигруппой или С1-С8-алкоксигруппой, метоксиэтоксиметоксигруппой или С2-С8-алкоксигруппой;
Х2 является атомом водорода, гидроксильной группой, С1-С8-алкоксигруппой, атомом галогена, нитрогруппой, ацетиламиногруппой (-NHCOCH3), С2-С8-ацилоксигруппой, метоксиэтоксиметоксигруппой, метилендиоксигруппой или С1-С4-алкильной группой;
Х3 является атомом водорода, гидроксильной группой, С2-С8-ацилоксигруппой, С1-С8-алкоксигруппой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NHCOCH3), цианогруппой, формильной группой (-СНО), -COOR1 (R1 - атом водорода, С1-С4-алкильная группа),
-О(СН2)nCOOR2 (n - 1-7; R2 - атом водорода, С1-С4-алкильная группа), -ООССН2СН2СОOR3 (R3 - атом водорода, С1-С4-алкил, (Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил, гликопиранозильная группа), С2-С8-галогенацилоксигруппой, метилендиоксигруппой, фосфатной группой
(-ОР(О)(OН)2) и ее солью, сульфатной группой (-OSO3H) и ее солью, гликопиранозильной группой и ее солью, фосфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или метоксиэтоксиметоксигруппой,
Y1 в кольце В является атомом водорода, С2-С8-ацилоксигруппой, трифторметильной группой или С1-С8-алкоксигруппой;
Y2 является атомом водорода, гидроксильной группой,С2-С8-ацилоксигруппой, метоксиэтоксиметоксигруппой, -COOR1 (R1 - атом водорода, С1-С4-алкильная группа), -О(СН2)nCOOR2 (n - 1-7; R2 - атом водорода, С1-С4-алкильная группа), -ООССН2СН2СОOR3 (R3 - атом водорода, С1-С4-алкил, (Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил, гликопиранозильная группа), С2-С8-галогенацилоксигруппой, метилендиоксигруппой, фосфатной группой (-ОР(О)(OН)2) или ее солью, сульфатной группой (-OSO3H) или ее солью, гликопиранозильной группой и ее солью, фосфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или С1-С8-алкоксигруппой.
3. Производное дифенилакрилонитрила по п.1 или 2 или его соль в качестве агента для преодоления резистентности к противораковым лекарственным средствам или агента, улучшающего действие противоракового лекарственного средства.
4. Производное дифенилакрилонитрила по п.1 или 2 или его соль в качестве противоракового лекарственного средства для лечения рака, причем указанное лекарственное средство содержит противораковое лекарственное средство, которое может служить в качестве субстрата для белка резистентности рака молочной железы, и производное дифенилакрилонитрила по п.1 или 2 или его соль.
5. Производное дифенилакрилонитрила или его соль, выбранное из группы, включающей в себя следующие соединения:
(Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил;
4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенил[1,4']бипиперидинил-1'-карбоксилат;
4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилацетат;
(Z)-2-(3,4-диметоксифенил)-3-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2-гидроксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3-метоксифенил)акрилонитрил;
(Z)-3-(3,4-дигидроксифенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-гидрокси-2-метоксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3,5-диметилфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-этокси-4-гидроксифенил)акрилонитрил;
(Z)-2-(4-бутоксифенил)-3-(4-гидроксифенил)акрилонитрил;
(Z)-3-(4-гидроксифенил)-2-(3,4,5-триметоксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил;
4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]бензонитрил;
(Z)-3-(2,3-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-3-(2,4-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-3-(2,5-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-3-(3,4-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-3-(3,5-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2,3,4-трифторфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2,3,5-трифторфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2,3,6-трифторфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2,4,5-трифторфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3,4,5-трифторфенил)акрилонитрил;
(Z)-3-(2,6-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-нитрофенил)акрилонитрил;
(Z)-3-(4-аминофенил)-2-(3,4-диметоксифенил)акрилонитрил;
этил-[4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенокси]ацетат;
метил-4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]бензоат;
(Z)-2-(3,4-диметоксифенил)-3-(2-нитрофенил)акрилонитрил;
(Z)-3-(4-хлор-3-нитрофенил)-2-(3,4-диметоксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2-фтор-5-нитрофенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-этокси-3-нитрофенил)акрилонитрил;
4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилметилсукцинат;
4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилэтилсукцинат;
бис{4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенил}сукцинат;
(Z)-2-(3,4-диметоксифенил)-3-(4-b-D-глюкопиранозилфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3-нитрофенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(6-нитробензо[1,3]диоксол-5-ил)акрилонитрил;
(Z)-3-(3,4-диметоксифенил)-2-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрил;
(Z)-2-(3,5-бис(трифторметил)фенил)-3-(4-гидроксифенил)акрилонитрил;
(Е)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-b-мальтозилфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2-этокси-5-нитрофенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-гидрокси-4-нитрофенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-b-мальтотриозилфенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-фтор-2-гидроксифенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-[3-фтор-4-(2-метоксиэтоксиметокси)фенил]акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-фтор-4-гидроксифенил)акрилонитрил;
моно-{4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенил}фосфат;
4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]фенилацетат;
(Z)-2-(3,4-диметоксифенил)-3-(4-формилфенил)акрилонитрил;
4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]-2-этоксифенилацетат;
4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]-2-фторфенилацетат;
4-[(Z)-2-циано-2-(3,4,5-триметоксифенил)винил]фенилацетат;
этил-7-[4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенокси]гептаноат;
4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]фенил-8-бромоктаноат;
(Z)-3-(3-аминофенил)-2-(3,4-диметоксифенил)акрилонитрил;
моно-{4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]-2-метоксифенил}фосфат;
моно-{4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенил}фосфат;
моно-{4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]-2-метоксифенил}фосфат;
N-[3-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенил]ацетамид;
(Z)-2-(3,4-диметоксифенил)-3-[4-(6-фосфо-b-D-глюкопиранозил)фенил]акрилонитрил;
моно-{4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенил}сульфат;
(Z)-2-(3,4-диметоксифенил)-3-[4-(6-фосфо-b-D-глюкопиранозил)фенил]акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(2-гидрокси-5-нитрофенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(4-фтор-3-нитрофенил)акрилонитрил;
(Z)-2-(3,4-диметоксифенил)-3-(3-гидрокси-4,5-диметоксифенил)акрилонитрил и
(Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3,5-диметоксифенил)акрилонитрил.
Текст
009048 Область техники Данное изобретение относится к ингибитору белка резистентности рака молочной железы (BCRP). Уровень техники Серьезные проблемы, связанные с химиотерапией рака, включают в себя природную резистентность к противораковым лекарственным средствам, что сводит на нет действие противоракового лекарственного средства с самого начала терапии рака и развитие приобретенной резистентности к противораковому лекарственному средству (например, снижение эффективности лекарственного средства, вызванное его долговременным непрерывным введением). Преодоление такой резистентности к противораковым лекарственным средствам рассматривается как средство улучшения эффективности химиотерапии рака, поэтому были предприняты попытки разъяснить различные механизмы резистентности. В частности, считается что экспрессия переносчика лекарственного средства, который активно переносит противораковое лекарственное средство из раковых клеток, тем самым снижая количество внутриклеточной аккумуляции лекарственного средства, играет важную роль в таком механизме резистентности. В частности, считается, что Р-гликопротеин, который представляет собой переносчик лекарственного средства, открытый в 1970-х гг., и который кодирован MDR1-геном, является мощной целевой молекулой агента преодоления мультилекарственной резистентности, так как этот белок вызывает перекрестную резистентность к множеству противораковых лекарственных средств, имеющих различные химические структуры и механизмы действия. Однако постепенно выяснили, что переносчик лекарственного средства, отличный от Р-гликопротеина, также связан с механизмом резистентности к противораковым лекарственным средствам, и возникла необходимость в развитии агента, преодолевающего резистентность, целью которого является такой переносчик лекарственного средства. В таких условиях в 1998 г. был открыт белок резистентности рака молочной железы (BCRP), который представляет собой переносчик лекарственного средства, принадлежащий к группе, которая называется надсемейство переносчиков кассеты АТФ-связывания (ABC), к которому также принадлежит Ргликопротеин (см. Proc. Natl. Acad. Sci. USA 95, 15665-15670 (1998. BCRP имеет структуру, включающую только одну кассету АТФ-связывания, в отличие от Р-гликопротеина или другого переносчика лекарственного средства, которые имеют две кассеты АТФ-связывания. BCRP глубоко вовлечен в механизм резистентности к ингибитору топоизомеразы I (например, иринотекану гидрохлориду (СРТ-11) или топотекану) или к ингибитору топоизомеразы II (например, митоксантрону). Между тем было выяснено,что BCRP имеет субстратную специфичность, отличную от специфичности Р-гликопротеина, так какBCRP не действует, например, на паклитаксел или винкристин, которые выделяются Р-гликопротеином,и BCRP вовлечен в выделение производного кампотецина (например, СРТ-11 или 7-этил-10 гидроксикампотецин (SN-38: активный метаболит СРТ-11, который редко выделяется внеклеточно Ргликопротеином (см. Cancer Res. 59, 5938-5946 (1999. Кроме того, считают, что BCRP вовлечен в ограничение биодоступности перорально вводимого противоракового лекарственного средства (см. J. ClinOncol. 20, 2943-2950 (2002. С учетом вышесказанного возникает необходимость в развитии ингибитораBCRP, который будет обладать эффектом преодоления резистентности к противораковым лекарственным средствам, которая не преодолевается обычными агентами преодоления резистентности, и улучшать биодоступность противоракового лекарственного средства. До настоящего времени было разработано множество ингибиторов Р-гликопротеина для целей преодоления резистентности к противораковым лекарственным средствам. Однако так как было представлено только несколько специфичных к BCRP ингибиторов, и считается, что такие ингибиторы имеют неудовлетворительное BCRP-ингибирующее действие, все еще существует необходимость в лекарственном средстве, которое обладает более мощным BCRP-ингибирующим действием (см. Mol. Cancer. Ther. 1, 427-434 (2002. Неожиданно было обнаружено, что некоторые производные дифенилакрилонитрила обладают противораковым действием (см. J. Med. Chem. 41, 3022-3032 (1998. Однако производные дифенилакрилонитрила, обладающие эффектом преодоления резистентности к противораковым лекарственным средствам или эффектом ингибирования BCRP, еще не известны. Объектом данного изобретения является ингибитор BCRP. Описание изобретения Для достижения указанной выше цели авторы данного изобретения исследовали множество соединений с помощью колонии раковых клеток, резистентность к противораковым лекарственным средствам которых была получена благодаря BCRP, и обнаружили, что производные дифенилакрилонитрила, представленные следующей формулой (1), обладают мощным BCRP-ингибирующим действием. Данное изобретение составлено на основе этого открытия. Таким образом, в данном изобретении представлен ингибитор BCRP, содержащий в качестве активного ингредиента производное дифенилакрилонитрила, представленное следующей формулой (1),или его соль[где каждый из 8 R, которые являются одинаковыми или разными, является атомом водорода, гидроксильной группой, нитрогруппой, аминогруппой, ацетиламиногруппой (-NHCOCH3-группой), цианогруппой (-CN-группой), формильной группой (-СНО-группой), -COOR1 (R1 является водородом или С 1 С 4-алкилом), -О(СН 2)nCOOR2 (n = 1-7; R2 является водородом или С 1-С 4-алкилом), -OOCCH2CH2COOR3(R3 является водородом, С 1-С 4-алкилом или гликопиранозилом), С 1-С 8-алкоксигруппой, С 1-С 4 алкильной группой, атомом галогена, С 1-С 4-алкоксигруппой, С 2-С 8-ацилоксигруппой, С 2-С 8 галогенацилоксигруппой, метилендиоксигруппой, трифторметильной группой, фосфатной группой (например, -OР(О)(ОН)2) или ее солью, сульфатной группой (например, -OSO3H) или ее солью, гликопиранозильной группой или ее солью, фосфатным сложным эфиром гликопиранозильной группы или его солью, сульфатным сложным эфиром гликопиранозильной группы или пиперидинопиперидинокарбонилоксигруппой]; агент для преодоления резистентности к противораковым лекарственным средствам; и агент, улучшающий действие противоракового лекарственного средства. В данном изобретении также представлено противораковое лекарственное средство, содержащее указанный выше ингибитор BCRP, и противораковое лекарственное средство, которое может служить в качестве субстрата для BCRP. Краткое описание чертежей На фиг. 1 представлен уровень резистентности линии клеток A549/SN-38-4 к SN-38 (А) или к митоксантрону (В); на фиг. 2 представлены результаты RT-PCR-анализа экспрессии мРНК различных переносчиков лекарственных средств в линии клеток А 549 и линии клеток A549/SN-38; на фиг. 3 показаны результаты количественного анализа RT-PCR в режиме реального времени экспрессии мРНК BCRP (А) и MRP2 (В) в линии клеток А 549 и линии клеток A549/SN-38; на фиг. 4 показано количество SN-38 (А) или SN-38-глюкуронида (В), аккумулированное в линии клеток А 549 и линии клеток A549/SN-38; на фиг. 5 показано действие производного дифенилакрилонитрила (соединение 1) по преодолению резистентности к SN-38 (А) и резистентности к митоксантрону (9 В) в линии клеток A549/SN-38-4; на фиг. 6 показано действие производных дифенилакрилонитрила [соединение 1 (А), соединение 3(В), соединение 4 (С), соединение 5 (D), соединение 7 (Е) и соединение 13 (F)] по преодолению резистентности к SN-38 в линии клеток P388/BCRP; на фиг. 7 показано действие производного дифенилакрилонитрила (соединение 1) в отношении повышения аккумуляции SN-38 в линии клеток P388/BCRP; на фиг. 8 показано действие различных производных дифенилакрилонитрила в отношении повышения аккумуляции SN-38 в линии клеток MFC-7. Наилучшие способы осуществления данного изобретения Используя действие по преодолению резистентности как показателя, авторы данного изобретения исследовали множество соединений в колониях раковых клеток, резистентность которых к противораковым лекарственным средствам вызвана BCRP, и обнаружили что производные дифенилакрилонитрила,представленные формулой (1), обладают сильным ингибирующим BCRP действием. В формуле (1) особые примеры С 1-С 4-алкильных групп, обозначенных R, включают в себя метил,этил, н-пропил, изопропил и н-бутил; где метил и этил являются особенно предпочтительными. Особые примеры С 1-С 8-алкоксигрупп включают в себя метокси, этокси, н-пропокси, изопропокси и нбутоксигруппы; где особенно предпочтительными являются метокси, этокси и н-бутокси. Особые примеры атомов галогена включают в себя фтор, хлор, бром и йод; где особенно предпочтительными являются фтор, хлор и бром. С 1-С 4-Алкоксигруппы предпочтительно включают в себя С 1-С 2 алкоксигруппы; где особенно предпочтительной является метоксиэтоксиметоксигруппа. Особые примеры С 2-С 8-ацилоксигрупп включают в себя ацетокси, пропионилокси и бутилилокси. Особые примеры-COOR1-группы включают в себя карбокси, метоксикарбонил и этоксикарбонил; где особенно предпочтительным является метоксикарбонил. Особые примеры группы -О(СН 2)nCOOR2 (n = 1-7) включают в себя -ОСН 2 СООС 2 Н 5, -О(СН 2)2 СООС 2 Н 5 и -О(СН 2)6 СООС 2 Н 5. Особые примеры группы-OOССН 2 СН 2 СOO-тетраацетилглюкопиранозил. Особые примеры С 2-С 8-галогенацилоксигрупп вклю-2 009048 чают в себя Вr(СН 2)7 СОО-группу. Особые примеры гликопиранозильной группы включают в себя -Dглюкопиранозил, -мальтозил, -мальтотриозил и -D-2-деокси-2-аминоглюкопиранозил; где особенно предпочтительными являются -D-глюкопиранозил, -мальтозил и -мальтотриозил. Указанные выше производные дифенилакрилонитрила могут образовывать фармакологически приемлемые соли при добавлении, например, натрия, калия или гидрохлорида, и такие фармакологически приемлемые соли также попадают в объем данного изобретения. Производные дифенилакрилонитрила могут существовать в виде сольватов, и такие сольваты также попадают в объем данного изобретения. Более того, производные дифенилакрилонитрила могут иметь изомеры, и такие изомеры и смеси, содержащие любые из изомеров, также попадают в объем данного изобретения. В одном из предпочтительных вариантов данного изобретения производное дифенилакрилонитрила представлено формулой (1 а)(-ОР(О)(OН)2) или ее солью, сульфатной группой (-OSO3H) или ее солью, гликопиранозильной группой или солью сложного эфира, фосфатным сложным эфиром гликопиранозильной группы или его солью,сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или метоксиэтоксиметоксигруппой;Y1 в кольце В является атомом водорода, С 2-С 8-ацилоксигруппой, трифторметильной группой или С 1-С 8-алкоксигруппой;Y2 является атомом водорода, гидроксильной группой, С 2-С 8-ацилоксигруппой, метоксиэтоксиметоксигруппой, -COOR1 (R1 = атом водорода, С 1-С 4-алкильная группа), -О(СН 2)nCOOR2 (n = 1-7; R2 = атом водорода, С 1-С 4-алкильная группа), -ООССН 2 СН 2 СОOR3 (R3 = атом водорода, С 1-С 4-алкил, (Z)-2(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрил, гликопиранозильная группа), С 2-С 8-галогенацилоксигруппой, метилендиоксигруппой, фосфатной группой (-ОР(О)(OН)2) или ее солью, сульфатной группой (-OSO3H) или ее солью, гликопиранозильной группой или солью сложного эфира, фосфатным сложным эфиром гликопиранозильной группы или его солью, сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или С 1-С 8 алкоксигруппой]. В особенно предпочтительном варианте соединения формулы (1 а)X1 в кольце А является атомом водорода, гидроксильной группой, ацетоксигруппой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NНСОСН 3) или метоксигруппой; Х 2 является атомом водорода, гидроксильной группой, метоксигруппой, этоксигруппой, ацетоксигруппой, атомом галогена, нитрогруппой, ацетиламиногруппой (-NНСОСН 3), метилендиоксигруппой или метильной группой; Х 3 является атомом водорода, гидроксильной группой, ацетоксигруппой, метоксигруппой, атомом галогена, нитрогруппой, аминогруппой, ацетиламиногруппой (-NHCOCH3), метилендиоксигруппой, гликопиранозильной группой и ее солью, фосфатным сложным эфиром гликопиранозильной группы или его солью, сульфатным сложным эфиром гликопиранозильной группы и солью сложного эфира, фосфатной группой (-ОР(О)(ОН)2) или ее солью, сульфатной группой (-OSO3H) или ее солью, гликопиранозильной группой или солью сложного эфира, пиперидинопиперидинокарбонилоксигруппой или метоксиэтокси-3 009048 метоксигруппой,Y1 в кольце В является атомом водорода, трифторметильной группой или метоксигруппой;Y2 является атомом водорода, гидроксильной группой, метоксиэтоксиметоксигруппой, ацетоксигруппой или метоксигруппой. Кольцо А предпочтительно является моно- - тризамещенным кольцом. Если кольцо А является монозамещенным кольцом, замещение предпочтительно во 2, 3 или 4 положении; если оно является дизамещенным кольцом, замещение предпочтительно во 2,3, 3,4 или 3,5 положениях и для тризамещенного кольца замещение предпочтительно в 3,4,5 положениях. Кольцо В предпочтительно является моно- - тризамещенным кольцом. Если кольцо В является монозамещенным кольцом, замещение предпочтительно в 4 положении; если оно является дизамещенным кольцом, замещение предпочтительно в 3,4 положениях и для тризамещенного кольца замещение предпочтительно в 3,4,5 положениях. Предпочтительные с другой точки зрения соединения, представленные формулой (1 а) в соответствии с данным изобретением, в качестве кольца А содержат следующее: 4-гидроксифенил, 2 гидроксифенил, 4-пиперидинопиперидинокарбонилоксифенил, 4-ацетоксифенил, 4-метоксиэтоксиметоксифенил, 4-гидрокси-3-метоксифенил, 3,4-дигидроксифенил, 3-гидрокси-2-метоксифенил, 3,5 диметил-4-гидроксифенил, 4-гидрокси-3-этоксифенил, 4-бромфенил, 2-фторфенил, 3-фторфенил, 4 фторфенил, 2,3-дифторфенил, 2,4-дифторфенил, 2,5-дифторфенил, 2,6-дифторфенил, 3,4-дифторфенил,3,5-дифторфенил, 2,3,4-трифторфенил, 2,3,5-трифторфенил, 2,3,6-трифторфенил, 2,4,5-трифторфенил,3,4,5-трифторфенил, 4-нитрофенил, 3-нитрофенил, 2-нитрофенил, 4-цианофенил, 4-аминофенил, 3 аминофенил, 4-метоксикарбонилфенил, 4-хлор-3-нитрофенил, 2-фтор-5-нитрофенил, 3-этокси-4-нитрофенил, 4-ООССН 2 СН 2 СООСН 3-фенил, 4-ООССН 2 СН 2 СООС 2 Н 5-фенил, 4D-глюкопиранозилфенил, 4 гидрокси-3-нитрофенил, 3,4-метилендиокси-6-нитрофенил, 3,4-диметоксифенил, 4 мальтозилфенил, 4-мальтотриозилфенил, 2-этокси-5-нитрофенил, 3-гидрокси-4-нитрофенил, 3-фтор-2-гидроксифенил, 3 фтор-4-метоксиэтоксиметоксифенил, 3-фтор-4-гидроксифенил, 4-ОР(О)(ONa)2-фенил, 4-формилфенил,4-ацетокси-3-этоксифенил, 4-ацетокси-3-фторфенил, 4-OOС(СН 2)7 Вr-фенил, 3-метокси-4-ОР(О)(ONa)2 фенил, 4-ОР(О)(ОН)2-фенил, 3-метокси-4-ОР(О)(ОН)2-фенил, 4-ацетиламинофенил, 4D-глюкозо-6'OР(О)(ONa)2)фенил, 4-OSO3H-N(С 2 Н 5)3-фенил, 4-(-D-глюкозо-6'-ОР(О)(ОН)2)фенил. 2-гидрокси-5 нитрофенил и 4-фтор-3-нитрофенил; и в качестве кольца В содержат следующее: 4-н-бутоксифенил, 3,4 диметоксифенил, 3,4,5-триметоксифенил, 4-гидроксифенил, 4-метоксиэтоксиметоксифенил, 4-ацетоксифенил и 3,5-бис-трифторметилфенил при условии, что соединения, в которых оба кольца А и В являются 4-гидроксифенилом, исключены. Среди таких соединений особенно предпочтительными являются следующие соединения:(Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3,5-диметоксифенил)акрилонитрил. Производные дифенилакрилонитрила (1) или их соли в соответствии с данным изобретением могут,например, быть получены по следующей схеме реакции. где R имеет значения, описанные выше. То есть бензальдегид (2) и бензилцианид (3) подвергают реакции конденсации с получением производного дифенилакрилонитрила (1). Однако если целевым соединением является производное дифенилакрилонитрила (1), в котором R является гидроксильной группой, R-защищенный бензальдегид (2) и Rзащищенный бензилцианид (3) (где защитная группа может быть, например, метоксиметоксигруппой,метоксиэтоксиметоксигруппой, метилтиометоксигруппой, тетрагидропиранилоксигруппой, циклопропилметоксигруппой, бензилоксигруппой, триметилсилилоксигруппой или трет-бутилдиметилсилилоксигруппой) подвергают реакции конденсации с последующим удалением защитных групп. Реакцию конденсации предпочтительно проводят в присутствии основания, такого как алкоксид натрия, гидроксид натрия или гидроксид калия. Если применяется алкоксид натрия, реакцию конденсации проводят в спиртовом растворителе, таком как метанол или этанол, при температуре от комнатной до температуры кипения, если применяется гидроксид натрия, реакцию конденсации проводят в смеси воды и инертного растворителя, такого как метиленхлорид или хлороформ, с добавлением четвертичной аммониевой соли или подобного соединения. После завершения реакции конденсации защитную группу гидроксигруппы удаляют. Удаление предпочтительно проводят гидролизом в присутствии, например, хлористо-водородной кислоты, серной кислоты, уксусной кислоты, п-толуолсульфоновой кислоты или трифторуксусной кислоты. Также защиту с бензилоксигруппы предпочтительно снимают каталитическим гидрированием в присутствии катализатора, такого как палладий на угле или оксид платины. Соединение дифенилакрилонитрила в соответствии с данным изобретением может вводиться как таковое. Альтернативно, если не снижается эффект в соответствии с данным изобретением, соединение дифенилакрилонитрила может быть смешано с носителем, который обычно применяют для получения лекарственных средств, таким как диспергирующая добавка или наполнитель, и может применяться в виде инъекции или пероральной формы, такой как порошок, раствор, капсулы, суспензия, эмульсия, сироп, эликсир, гранулы, пилюли, таблетки, пастилки или лимонад. Примеры таких носителей включают растворимые в воде моносахариды, олигосахариды и полисахариды, такие как маннит, лактоза и декстрин; гелеобразующие или растворимые в воде целлюлозы, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и метилцеллюлоза; абсорбирующие воду и плохо растворяемые в воде целлюлозы, такие как кристаллическая целлюлоза, -целлюлоза, поперечно-сшитая натрий карбоксиметилцеллюлоза и их производные; абсорбирующие воду и плохо растворяемые в воде полисахариды, такие как гидроксипропиловый крахмал, карбоксиметиловый крахмал,поперечно-сшитый крахмал, амилоза, амилопектин, пектин и их производные; абсорбирующие воду и плохо растворяемые в воде смолы, такие как гуммиарабик, трагакантовая смола, глюкоманнан и их производные; поперечно-сшитые виниловые полимеры, такие как поливинилпирролидон, поперечно-сшитая полиакриловая кислота и их соли; поперечно-сшитый поливиниловый спирт, полигидроксиэтилметакрилат и их производные; и жиры, образующие молекулярный агрегат (например, липосомы), такие как фосфолипид и холестерин. Если соединение дифенилакрилонитрила в соответствии с данным изобретением имеет низкую растворимость, соединение может быть подвергнуто солюбилизации. Примеры методик солюбилизации включают методики, которые обычно применяются к лекарственным средствам, такие как методика, в которой поверхностно-активное вещество (например, простой эфир полиоксиэтилена и спирта, сложный эфир полиоксиэтилена и ацила, сложный эфир сорбитана и ацила или эфир полиоксиэтилена, сорбитана и ацила) добавляют к соединению дифенилакрилонитрила, и методика, в которой применяют растворимый в воде полимер (например, полиэитиленгликоль). При желании может применяться, например, методика получения растворимой соли соединения дифенилакрилонитрила или методика получения клатратного соединения с применением циклодекстрина или подобного материала. Методики солюбилизации могут быть соответствующим образом выбраны согласно целевому соединению дифенилакрилонитрила. Ингибитор BCRP может применяться в качестве агента преодоления резистентности к противораковым лекарственным средствам при злокачественных заболеваниях, в которых BCRP-опосредованная резистентность возникает вследствие введения противоракового лекарственного средства. В то же время,ингибитор BCRP может применяться в качестве агента, улучшающего эффективность противоракового-6 009048 лекарственного средства при злокачественных заболеваниях, в которых экспрессируется BCRP и которые имеют низкую чувствительность к противораковым лекарственным средствам. Никаких определенных ограничений не существует для целевого противоракового лекарственного средства агента преодоления резистентности к лекарственному средству или агента, улучшающего эффективность противоракового лекарственного средства, содержащего ингибитор BCRP в качестве активного ингредиента, при условии, что противораковое лекарственное средство может применяться в качестве субстрата для BCRP(далее может быть обозначено как BCRP субстрат). Примеры таких противораковых лекарственных средств включают в себя ингибиторы топоизомеразы I, такие как иринотекан гидрохлорид/СРТ-11 (активный метаболит: SN-38) и топотекан; ингибиторы топоизомеразы II, такие как митоксантрон, доксорубицин, даунорубицин, бизантрен и этопозид; и антифолаты, такие как метотрексат. Доза ингибитора BCRP в соответствии с данным изобретением может быть соответствующим образом определена в соответствии, например, со способом введения или симптомами пациента. Ежедневная доза для взрослого пациента предпочтительно составляет от 1 мг до 10 г, более предпочтительно от 100 мг до 10 г, особенно предпочтительно от 500 мг до 10 г. Никаких определенных ограничений не наложено на соотношение между противораковым лекарственным средством и ингибитором BCRP, предпочтительные соотношения варьируются в зависимости, например, от типа применяемого противоракового лекарственного средства и ингибитора. Если, например, в качестве противоракового лекарственного средства применяется иринотекан гидрохлорид, массовое соотношение противоракового лекарственного средства к ингибитору BCRP предпочтительно составляет от 1:1 до 1:500, особенно предпочтительно от 1:1 до 1:100, более предпочтительно от 1:1 до 1:10. В табл. 1 показаны некоторые особые примеры производных дифенилакрилонитрила, которые могут применяться в соответствии с данным изобретением. Таблица 1 Примеры Далее изобретение более подробно объясняется с помощью примеров, которые не должны считаться ограничивающими данное изобретение. Пример 1. Получение производного дифенилакрилонитрила. Если производное дифенилакрилонитрила синтезируют из исходного материала, имеющего гидроксильную группу (производного бензальдегида или производного бензилцианида), во-первых, гидроксильную группу защищают, используя описанную ниже методику защиты; далее, полученный продукт подвергают процессу конденсации и, наконец, защитную группу удаляют по методике снятия защиты. Если применяется исходный материал, не имеющий гидроксильной группы, исходный материал подвергают процессу конденсации без защиты. Процесс получения 1. Процесс защиты гидроксильной группы производного бензальдегида или производного бензилцианида.MEM = метоксиэтоксиметил Х=-СНО, CH2CN В реакционном сосуде производное бензальдегида или производное бензилцианида, имеющее гидроксильную группу, растворяют в тетрагидрофуране при перемешивании. Реакционный сосуд охлаждают на льду и постепенно добавляют гидрид натрия (содержание: 60%, суспендированный в масле) в количестве, зависящем от числа гидроксильных групп (например, 1,2 экв. (в расчете на -ОН) для одной гидроксильной группы или 2,4 экв. для двух гидроксильных групп). Затем на реакционный сосуд помещают трубку с хлоридом кальция. После прекращения образования водорода добавляют 2 метоксиэтоксиметилхлорид в количестве, зависящем от числа гидроксильных групп (например, 1 экв. (в- 11009048 расчете на -ОН) для одной гидроксильной группы или 2 экв. для двух гидроксильных групп). Далее добавляют диизопропиламин в количестве, стехиометрически эквивалентном добавленному 2 метоксиэтоксиметилхлориду. Полученную смесь кипятят с обратным холодильником в течение 2 ч, при этом трубка с хлоридом кальция находится на реакционном сосуде. После охлаждения полученного продукта нерастворимое вещество удаляют фильтрованием. Полученный раствор в тетрагидрофуране концентрируют досуха при пониженном давлении. Концентрированный продукт разделяют между хлороформом и насыщенным раствором соли. В слой хлороформа добавляют водный раствор гидроксида натрия и полученную смесь разделяют. Полученный слой хлороформа дважды промывают водой. Слой хлороформа сушат над безводным сульфатом натрия и затем концентрируют досуха при пониженном давлении. С помощью хроматографии на колонке с силикагелем концентрированный продукт элюируют гексаном/хлороформом - хлороформом. Полученную фракцию концентрируют с получением маслянистого продукта. Процесс получения 2. Процесс конденсации производного бензальдегида и производного бензилцианида. Процесс А. Производное бензальдегида и производное бензилцианида в стехиометрически эквивалентных количествах помещают в реакционный сосуд и в него добавляют этанол. Далее на контейнер помещают трубку с хлоридом кальция и производные растворяют в этаноле при перемешивании. Отдельно в контейнере, содержащем н-гексан, взвешивают металлический натрий, постепенно добавляют натрий в контейнер, содержащий этанол, и на него помещают трубку с хлоридом кальция. После полного растворения натрия в этаноле полученный раствор этоксида натрия добавляют в реакционный сосуд. Реакционную смесь кипятят с обратным холодильником в течение одного часа. Затем реакционную смесь охлаждают до комнатной температуры и к смеси добавляют воду с последующим удалением этанола выпариванием при пониженном давлении. Полученный остаток разделяют между хлороформом и насыщенным раствором соли. К отделенному слою хлороформа добавляют насыщенный раствор соли и полученную смесь разделяют. Отделенный слой хлороформа сушат над безводным сульфатом натрия, с последующей фильтрацией. К полученному фильтрату добавляют незначительное количество силикагеля для проведения хроматографии на колонке, встряхивают и фильтруют. Растворитель удаляют выпариванием при пониженном давлении. Полученный продукт растворяют в этаноле и к полученному раствору добавляют соответствующее количество активированного угля. Полученную смесь фильтруют с помощью слоя целлита и фильтрат концентрируют. Осажденные кристаллы производного дифенилакрилонитрила фильтруют при пониженном давлении. Эту процедуру повторяют три раза и полученные кристаллы отделяют. Осажденные кристаллы дважды перекристаллизовывают из изопропанола. Полученные кристаллы промывают гексаном и затем сушат. Процесс В. Производное бензальдегида и производное бензилцианида в стехиометрически эквивалентных количествах помещают в реакционный сосуд и растворяют в количестве метиленхлорида, достаточном для растворения сырого материала. К полученному раствору добавляют воду (от 10 до 20 мл),гидроксид натрия (1,2 экв.), вместе с хлоридом метилтриоктиламмония (1,5 экв.), с последующим перемешиванием при комнатной температуре в течение 4 ч. После завершения реакции к полученной реакционной смеси добавляют метиленхлорид и рассол, смесь разделяют на фазы и органический слой сушат над безводным сульфатом натрия и затем фильтруют с последующим концентрированием фильтрата. Полученный остаток перекристаллизовывают из изопропанола. Процесс получения 3. Процесс снятия защиты с ОН-защищенного производного дифенилакрилонитрила. Производное дифенилакрилонитрила, имеющее защищенную гидроксильную группу, растворяют в этаноле и к полученному раствору добавляют незначительное количество концентрированной соляной кислоты с последующим перемешиванием в течение целого дня и ночи. Осажденные кристаллы отделяют при пониженном давлении. Полученные кристаллы перекристаллизовывают из изопропанола. Далее подробно описано получение производных дифенилакрилонитрила и результаты их анализа. Получение (Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрила (соединение 1).- 12009048 Гидроксильную группу 4-гидроксибензальдегида (24,9 г) защищают с помощью 2-метоксиэтоксиметилхлорида (24,4 г) согласно процессу получения 1 с получением 4-метоксиэтоксиметоксибензальдегида (33,5 г, выход 80%). Полученный таким образом 4-метоксиэтоксиметоксибензальдегид (21,0 г) и 3,4-диметоксибензил цианид (17,7 г) подвергают конденсации согласно процессу А процесса получения 2 с получением (Z)-2-(3,4-диметоксифенил)-3-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрила (29,1 г, выход 86%). Отдельно 4-метоксиэтоксиметоксибензальдегид (4,1 г), который получен по описанной выше методике, и 3,4-диметоксибензил цианид (3,4 г) подвергают конденсации согласно процессу В процесса получения 2 с получением (Z)-2-(3,4 диметоксифенил)-3-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрила (5,2 г, выход 73%). Полученный таким образом (Z)-2-(3,4-диметоксифенил)-3-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрил (10,2 г) подвергают снятию защиты согласно процессу получения 3 с получением целевого продукта (6,22 г, выход 74%). Бледно-желтый кристаллический порошок, МС (APCI, m/z): 282 (МН+),1(Z)-2-(3,4-Диметоксифенил)-3-(4-гидроксифенил)акрилонитрил (соединение 1) (0,28 г) и 4-пиперидинопиперидинокарбонилхлорид (0,23 г) растворяют в пиридине (5 мл) и полученный раствор перемешивают в течение дня и ночи. После завершения реакции полученную реакционную смесь добавляют в воду (200 мл) и осажденный продукт очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (0,38 г, выход 79%). Бледно-желтые кристаллы, МС (APCI, m/z): 476 (МН+),1 Н-ЯМР (ДМСО-d6)1,47 (3 Н, м), 1,75 (2 Н, м), 2,49 (5 Н, м), 2,85 (1 Н, ушир.т), 3,01 (1 Н, ушир.т),3,71 (1 Н, м), 3,79 (3 Н, с), 3,84 (3 Н, с), 4,03 (1 Н, ушир.д), 4,17 (1 Н, ушир.д), 6,89 (2 Н, д, J=9 Гц), 7,07 (1 Н,д, J=8 Гц), 7,26 (1 Н, дд, J=2 Гц, 8 Гц), 7,27 (2 Н, д, J=8 Гц), 7,33 (1 Н, д, J=2 Гц), 7,91 (2 Н, д, J=8 Гц), 7,95(1 Н, с). Получение 4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилацетата (соединение 3). Соединение 1 (0,28 г) ацетилируют уксусным ангидридом с пиридином обычным методом с получением целевого продукта (0,30 г, выход 95%). Белые кристаллы, МС (APCI, m/z): 324 (МН+),1H-ЯМР (CDCl3)2,33 (3 Н, с), 3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (2 Н, д, J=9 Гц), 7,14 (1 Н, д, J=9 Гц),7,20 (1 Н, д, J=2 Гц), 7,25 (1 Н, дд, J=2 Гц, 9 Гц), 7,40 (1 Н, с), 7,89 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрила (соединение 4). Указанное в заголовке соединение получают конденсацией по методике получения соединения 1. Бледно-желтые кристаллы, МС (APCI, m/z): 370 (МН+),1 Н-ЯМР (ДMCO-d6)3,40 (3 Н, с), 3,56 (2 Н, т, J=8 Гц), 3,84 (2 Н, т, J=8 Гц), 3,88 (3 Н, с), 3,92 (3 Н, с),5,35 (2 Н, с), 6,87 (2 Н, д, J=9 Гц), 7,14 (1 Н, д, J=8 Гц), 7,28 (1 Н, дд, J=2 Гц, 8 Гц), 7,29 (2 Н, д, J=8 Гц), 7,40(1 Н, д, J=2 Гц), 7,92 (2 Н, д, J=8 Гц), 7,99 (1 Н, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-гидроксифенил)акрилонитрила (соединение 5). Гидроксильную группу 3-гидроксибензальдегида (1,5 г) защищают с помощью 2-метоксиэтоксиметилхлорида (1,4 г) в соответствии с процессом получения 1 с получением 3-метоксиэтоксиметоксибензальдегида (2,0 г, выход 76%). Полученный 3-метоксиэтоксиметоксибензальдегид (1,9 г) и 3,4-диметоксибензил цианид (1,6 г) конденсируют в соответствии с процессом А процесса получения 2 с получением метоксиэтоксиметоксиформы (далее обозначенной как МЭМ-форма) целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,2 г выход 48%). Бледно-желтый кристаллический порошок, МС (APCI, m/z): 282 (МН+),1 Н-ЯМР (ДMCO-d6)3,82 (3 Н, с), 3,87 (3 Н, с), 5,35 (2 Н, с), 6,89 (1 Н, дд, J=8 Гц, 3 Гц), 7,07 (1 Н, д,J=8 Гц), 7,25-7,37 (5 Н, перекрывающийся м), 7,87 (1 Н, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(2-гидроксифенил)акрилонитрила (соединение 6). Гидроксильную группу 2-гидроксибензальдегида (3,0 г) защищают с помощью 2-метоксиэтоксиметилхлорида (3,1 г) в соответствии с процессом получения 1 с получением 2-метоксиэтоксиметоксибензальдегида (3,7 г, выход 70%). Полученный 2-метоксиэтоксиметоксибензальдегид (2,0 г) и 3,4-диметоксибензил цианид (1,7 г) конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,4 г, выход 52%). Бледно-желтый кристаллический порошок, МС (APCI, m/z): 282 (МН+),1 Н-ЯМР (ДМСО-d6)3,81 (3 Н, с), 3,85 (3 Н, с), 7,87 (1 Н, дд, J=8 Гц, 1 Гц), 7,92 (1 Н, ушир.с), 6,93J=7 Гц, 1 Гц), 7,87 (1 Н, дд, J=8 Гц, 2 Гц), 7,93 (1 Н, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3-метоксифенил)акрилонитрила (соединение 7). Гидроксильную группу 4-гидрокси-3-метоксибензальдегида (1,4 г) защищают с помощью 2 метоксиэтоксиметилхлорида (1,7 г) в соответствии с процессом получения 1 с получением 3-метокси-4 метоксиэтоксиметоксибензальдегида (0,8 г, выход 31%). Полученный 3-метокси-4-метоксиэтоксиметоксибензальдегид (0,8 г) и 3,4-диметоксибензил цианид (0,6 г) конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (0,5 г, выход 51%). Бледно-желтые кристаллы, МС (APCI, m/z): 312 (МН+),1 Н-ЯМР (CDCl3)3,92 (3 Н, с), 3,96 (3 Н, с), 3,99 (3 Н, с), 5,94 (1 Н, с), 6,90 (1 Н, д, J=8 Гц), 6,96 (2 Н, д,J=8 Гц), 7,12 (1 Н, с), 7,22 (2 Н, перекрывающийся м), 7,33 (1 Н, с), 7,73 (1 Н, с). Получение (Z)-3-(3,4-дигидроксифенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 8). Гидроксильную группу 3,4-дигидроксибензальдегида (2,0 г) защищают с помощью 2 метоксиэтоксиметилхлорида (3,6 г) в соответствии с процессом получения 1 с получением 3,4 бис(метоксиэтоксиметокси)бензальдегида (3,6 г, выход 89%). Полученный 3,4-бис(метоксиэтоксиметокси)бензальдегид (3,5 г) и 3,4-диметоксибензил цианид (2,0 г) конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,6 г, выход 50%). Желтые кристаллы, МС (APCI, m/z): 298 (МН+),1 Н-ЯМР (ДМСО-d6)3,85 (3 Н, с), 3,92 (3 Н, с), 6,85 (1 Н, д, J=8 Гц), 6,94 (2 Н, д, J=8 Гц), 7,22 (3 Н, м),7,48 (1 Н, д, J=2 Гц), 7,49 (1 Н, с), 7,70 (1 Н, с), 9,33 (1 Н, с), 7,69 (1 Н, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-гидрокси-2-метоксифенил)акрилонитрила (соединение 9). Гидроксильную группу 2-метокси-3-гидроксибензальдегида (2,0 г) защищают с помощью 2 метоксиэтоксиметилхлорида (3,6 г) в соответствии с процессом получения 1 с получением 2,4 бис(метоксиэтоксиметокси)бензальдегида (4,5 г, количественный выход). Полученный 2,4 бис(метоксиэтоксиметокси)бензальдегид (4,0 г) и 3,4-диметоксибензил цианид (2,2 г) конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (2,5 г, выход 67%). Желтые кристаллы, МС (APCI, m/z): 312 (МН+),1H-ЯMP (ДМСО-d6)3,32 (3 Н, с), 3,80 (3 Н, с), 3,84 (3 Н, с), 7,05 (2 Н, м) , 7,24 (1 Н, дд, J=2 Гц, 8 Гц),7,28 (1 Н, д, J=2 Гц), 7,38 (1 Н, дд, J=2 Гц, 8 Гц), 7,49 (1 Н, с), 7,76 (1 Н, с), 9,36 (2 Н, ушир.с). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3,5-диметилфенил)акрилонитрила (соединение 10). Гидроксильную группу 3,5-диметил-4-гидроксибензальдегида (2,3 г) защищают с помощью 2 метоксиэтоксиметилхлорида (3,4 г) в соответствии с (процессом получения 1) с получением 3,5-диметил 4-метоксиэтоксиметоксибензальдегида (2,7 г, выход 62%). Полученный 3,5-диметил-4-метоксиэтоксиметоксибензальдегид (2,0 г) и 3,4-диметоксибензил цианид (1,5 г) конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,5 г, выход 57%). Бледно-желтые кристаллы, МС (APCI, m/z): 310 (МН+),1 Н-ЯМР (CDCl3)2,30 (6 Н, с), 3,92 (3 Н, с), 3,95 (3 Н, с), 6,89 (2 Н, д, J=8 Гц), 7,12 (1 Н, с), 7,20 (1 Н,дд, J=2 Гц, 8 Гц), 7,27 (1 Н, д, J=8 Гц), 7,56 (2 Н, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-этокси-4-гидроксифенил)акрилонитрила (соединение 11). Гидроксильную группу 3-этокси-4-гидроксибензальдегида (2,0 г) защищают с помощью 2-метоксиэтоксиметилхлорида (1,5 г) в соответствии с процессом получения 1 с получением 3-этокси-4-метоксиэтоксиметоксибензальдегида (2,8 г, выход 91%). Полученный 3-этокси-4-метоксиэтоксиметоксибензальдегид (2,8 г) и 3,4-диметоксибензил цианид (2,0 г) конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,35 г, выход 37%). Бледно-желтые кристаллы, МС (APCI, m/z): 326 (МН+),1 Н-ЯМР (CDCl3)1,49 (3 Н, т, J=8 Гц), 3,92 (3 Н, с), 3,95 (3 Н, с), 4,22 (2 Н, д, J=8 Гц), 6,90 (2 Н, дд,J=2 Гц, 8 Гц), 6,96 (2 Н, д, J=8 Гц), 7,11 (1 Н, д, J=2 Гц), 7,22 (1 Н, дд, J=2 Гц, 8 Гц), 7,32 (1 Н, с), 7,72 (2 Н, д,J=2 Гц). Получение (Z)-3-(4-бромфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 12).- 14009048 4-Бромбензальдегид (2,0 г) и 3,4-диметоксибензил цианид (1,9 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (2,9 г, выход 78%). Желтые кристаллы, МС (APCI, m/z): 346 (МН 2), 344 (МН+); 1 Н-ЯМР (CDCl3)3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (2 Н, д, J=9 Гц), 7,26 (2 Н, перекрывающийся м), 7,35(1 Н, с), 7,59 (2 Н, д, J=9 Гц), 7,73 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-фторфенил)акрилонитрила (соединение 13). 3-Фторбензальдегид (2,0 г) и 3,4-диметоксибензил цианид (2,9 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (0,7 г, выход 15%). Бледно-желтые кристаллы, МС (APCI, m/z): 284 (МН+),1 Н-ЯМР (CDCl3)3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (1 Н, д, J=10 Гц), 7,11 (1 Н, дд, J=2 Гц, 14 Гц), 7,24(1 Н, д, J=2 Гц), 7,27 (1 Н, дд, J=2 Гц, 10 Гц), 7,38 (1 Н, с), 7,42 (1 Н, дд, J=8 Гц, 14 Гц), 7,60 (1 Н, дд, J=8 Гц,14 Гц). Получение (Z)-2-(4-бутоксифенил)-3-(4-гидроксифенил)акрилонитрила (соединение 14). 4-Гидроксибензил цианид (5,0 г) и 1-бромбутан (5,7 г) растворяют в диметилформамиде (100 мл) и к полученному раствору добавляют карбонат калия (6,2 г) с последующим нагреванием при температуре 80 С в течение 1 ч, тем самым давая осуществиться реакции. После завершения реакции полученную реакционную смесь охлаждают и затем разделяют между насыщенным раствором соли и этилацетатом. Полученный слой этилацетата сушат над безводным сульфатом натрия и концентрируют. Концентрированный продукт очищают хроматографией на колонке с силикагелем, применяя гексан/этилацетат (4:1), с получением 4-бутоксибензил цианида (5,1 г, выход 70%). Полученный 4-бутоксибензил цианид (2,0 г) и 4-метоксиэтоксиметоксибензальдегид (2,2 г), полученный в процессе получения соединения 1, конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (0,7 г, выход 23%). Бледно-желтый кристаллический порошок, МС (APCI, m/z): 294 (МН+),1H-ЯМР (ДMCO-d6)0,94 (3 Н, т, J=10 Гц), 1,44 (2 Н, секстет, J=10 Гц), 1,71 (2 Н, квинтет, J=10 Гц),4,00 (2 Н, т, J=10 Гц), 6,88 (2 Н, д, J=9 Гц), 7,03 (2 Н, д, J=9 Гц), 7,62 (2 Н, д, J=2 Гц), 7,73 (1 Н, с), 7,82 (2 Н,д, J=9 Гц). Получение (Z)-3-(4-гидроксифенил)-2-(3,4,5-триметоксифенил)акрилонитрила (соединение 15). 3,4,5-Триметоксибензил цианид (1,9 г) и 4-метоксиэтоксиметоксибензальдегид (2,0 г), полученный в процессе получения соединения 1, конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,2 г, выход 41%). Желтые кристаллы, МС (APCI, m/z): 312 (МН+),1 Н-ЯМР (CDCl3)3,89 (3 Н, с), 3,93 (6 Н, с), 6,06 (1 Н, ушир.с), 6,84 (2 Н, с), 6,94 (2 Н, д, J=12 Гц), 7,39(1 Н, с), 7,82 (2 Н, д, J=12 Гц). Получение (Z)-2,3-бис-(4-гидроксифенил)акрилонитрила (соединение 16). 4-Гидроксибензилцианид (4,3 г) и 2-метоксиэтоксиметилхлорид (4,1 г) подвергают реакции в соответствии с процессом получения 1 с получением 4-метоксиэтоксиметоксибензил цианида (5,4 г, выход 75%). Полученный 4-метоксиэтоксиметоксибензил цианид (2,1 г) и 4-метоксиэтоксиметоксибензальдегид (2,0 г), полученный в процессе получения соединения 1, конденсируют в соответствии с процессом А процесса получения 2 с получением МЭМ-формы целевого продукта. Далее защитную группу удаляют из МЭМ-формы в соответствии с процессом получения 3 с получением целевого продукта (1,1 г, выход 49%). Бледные желто-зеленые кристаллы, МС (APCI, m/z): 238 (МН+),1 Н-ЯМР (ДМСО-d6)6,87 (1 Н, д, J=9 Гц), 6,89 (1 Н, д, J=2 Гц, 9 Гц), 7,53 (1 Н, д, J=9 Гц), 7,67 (1 Н,с), 7,79 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрила, натриевой соли (соединение 17). Соединение 1 (281 мг) растворяют в этаноле. К полученному раствору добавляют водный раствор гидроксида натрия (в количестве, стехиометрически эквивалентном количеству соединения 1) с последующим перемешиванием при комнатной температуре. Полученную смесь концентрируют при пониженном давлении и осажденные кристаллы отделяют фильтрацией с последующей перекристаллизацией с получением целевого продукта (270 мг, выход 90%). Бледно-желтые кристаллы, МС (APCI, m/z): 280 (M-Na+),1 Н-ЯМР (ДMCO-d6)3,76 (3 Н, с), 3,82 (3 Н, с), 6,19 (1 Н, д, J=9 Гц), 6,96 (1 Н, д, J=9 Гц), 7,05 (1 Н, дд,J=2 Гц, 9 Гц), 7,11 (1 Н, д, J=2 Гц), 7,41 (1 Н, с), 7,58 (1 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-фторфенил)акрилонитрила (соединение 18). 4-Фторбензальдегид (620 мг) и 3,4-диметоксибензил цианид (880 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (1,02 г, выход 72%). Желтоватые кристаллы, МС (APCI, m/z): 283 (М-),- 15009048 1 Н-ЯМР (CDCl3)3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (1 Н, д, J=9 Гц), 7,11-7,18 (2 Н, м), 7,13 (1 Н, д, J=2 Гц), 7,25 (1 Н, дд, J=2 Гц, 9 Гц), 7,39 (1 Н, с), 7,84-7,90 (2 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-нитрофенил)акрилонитрила (соединение 19). 4-Нитробензальдегид (760 мг) и 3,4-диметоксибензил цианид (890 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (1,31 г, выход 85%). Желтоватые кристаллы, МС (APCI, m/z): 310 (М-),1H-ЯMP (CDCl3)3,95 (3 Н, с), 3,98 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,17 (1 Н, д, J=2 Гц), 7,32 (1 Н, дд,J=2 Гц, 9 Гц), 7,47 (1 Н, с), 8,01 (2 Н, д, J=9 Гц), 8,32 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(2-фторфенил)акрилонитрила (соединение 20). 2-Фторбензальдегид (620 мг) и 3,4-диметоксибензил цианид (880 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (562 мг, выход 40%). Желтоватые кристаллы, МС (APCI, m/z): 283 (М-),1H-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,93 (1 Н, д, J=8 Гц), 7,11-7,18 (1 Н, м), 7,17 (1 Н, д, J=2 Гц), 7,23-7,29 (1 Н, м), 7,29 (1 Н, дд, J=2 Гц, 8 Гц), 7,37-7,45 (1 Н, м), 7,66 (1 Н, с), 8,20-8,25 (1 Н, м). Получение 4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]бензонитрила (соединение 21). 4-Цианобензальдегид (1,97 г) и 3,4-диметоксибензил цианид (1,80 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (3,33 г, выход 77%). Желтоватые кристаллы, МС (APCI, m/z): 290 (М-),1H-ЯМР (CDCl3)3,95 (3 Н, с), 3,97 (3 Н, с), 6,94 (1 Н, д, J=8 Гц), 7,16 (1 Н, д, J=2 Гц), 7,30 (1 Н, дд,J=2 Гц, 9 Гц), 7,43 (1 Н, с), 7,75 (2 Н, д, J=9 Гц), 7,95 (2 Н, д, J=9 Гц). Получение (Z)-3-(2,3-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 22). 2,3-Дифторбензальдегид (426 мг) и 3,4-диметоксибензил цианид (532 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (813 мг, выход 90%). Желтоватые кристаллы, МС (APCI, m/z): 301 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,94 (1 Н, д, J=9 Гц), 7,17 (1 Н, д, J=2 Гц), 7,17-7,28 (2 Н,м), 7,31 (1 Н, дд, J=2 Гц, 9 Гц), 7,62 (1 Н, с), 7,95-8,01 (1 Н, м). Получение (Z)-3-(2,4-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 23). 2,4-Дифторбензальдегид (142 мг) и 3,4-диметоксибензил цианид (177 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (92 мг, выход 31%). Желтоватые кристаллы, МС (APCI, m/z): 301 (М-),1 Н-ЯМР (CDCl3)3,94, (3 Н, с), 3,97 (3 Н, с), 6,88-6,94 (1 Н, м), 6,93 (1 Н, д, J=8 Гц), 6,98-7,04 (1 Н, м),7,15 (1 Н, д, J=2 Гц), 7,28 (1 Н, дд, J=2 Гц, 8 Гц), 7,57 (1 Н, с), 8,21-8,28 (1 Н, м). Получение (Z)-3-(2,5-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 24). 2,5-Дифторбензальдегид (1,42 г) и 3,4-диметоксибензил цианид (1,77 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (2,20 г, выход 73%). Желтоватые кристаллы, МС (APCI, m/z): 301 (M-),1H-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,93 (1 Н, д, J=9 Гц), 7,07-7,14 (2 Н, м), 7,16 (1 Н, д, J=2 Гц), 7,30 (1 Н, д, J=2 Гц, 9 Гц), 7,58 (1 Н, с), 7,92-7,98 (1 Н, м). Получение (Z)-3-(3,4-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 25). 3,4-Дифторбензальдегид (426 мг) и 3,4-диметоксибензил цианид (532 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (780 мг, выход 86%). Желтоватые кристаллы, МС (APCI, m/z): 301 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,96 (3 Н, с), 6,93 (1 Н, д, J=8 Гц), 7,13 (1 Н, д, J=2 Гц), 7,25 (1 Н, дд,J=2 Гц, 8 Гц), 7,21-7,29 (1 Н, м), 7,32 (1 Н, с), 7,57-7,62 (1 Н, м), 7,71-7,78 (1 Н, м). Получение (Z)-3-(3,5-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 26). 3,5-Дифторбензальдегид (1,42 г) и 3,4-диметоксибензил цианид (1,77 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (2,10 г, выход 69%). Желтоватые кристаллы, МС (APCI, m/z): 301 (М-),1H-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,84-6,91 (1 Н, м), 6,93 (1 Н, д, J=9 Гц), 7,13 (1 Н, д, J=2 Гц), 7,27 (1 Н, дд, J=2 Гц, 8 Гц), 7,32 (1 Н, с), 7,36-7,43 (1 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(2,3,4-трифторфенил)акрилонитрила (соединение 27). 2,3,4-Трифторбензальдегид (160 мг) и 3,4-диметоксибензил цианид (177 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (90 мг, выход 30%). Желтоватые кристаллы, МС (APCI, m/z): 319 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,94 (1 Н, д, J=9 Гц), 7,05-7,14 (1 Н, м), 7,15 (1 Н, д, J=2 Гц), 7,29 (1 Н, дд, J=2 Гц, 8 Гц), 7,52 (1 Н, с), 7,93-8,02 (1 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(2,3,5-трифторфенил)акрилонитрила (соединение 28). 2,3,5-Трифторбензальдегид (320 мг) и 3,4-диметоксибензил цианид (354 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (536 мг, выход 84%). Желтоватые кристаллы, МС (APCI, m/z): 319 (M-),1 Н-ЯМР (CDCl3)3,95 (3 Н, с), 3,97 (3 Н, с), 6,94 (1 Н, д, J=8 Гц), 6,95-7,05 (1 Н, м), 7,16 (1 Н, д, J=2- 16009048 Гц), 7,31 (1 Н, дд, J=2 Гц, 8 Гц), 7,56 (1 Н, с), 7,71-7,77 (1 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(2,3,6-трифторфенил)акрилонитрила (соединение 29). 2,3,6-Трифторбензальдегид (320 мг) и 3,4-диметоксибензил цианид (354 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (549 мг, выход 86%). Желтоватые кристаллы, МС (APCI, m/z): 319 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,96 (3 Н, с), 6,94 (1 Н, д, J=9 Гц), 6,93-6,99 (1 Н, м), 7,17 (1 Н, д, J=2 Гц), 7,17 (1 Н, д, J=2 Гц), 7,18-7,26 (1 Н, м), 7,27 (1 Н, с), 7,32 (1 Н, дд, J=2 Гц, 8 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(2,4,5-трифторфенил)акрилонитрила (соединение 30). 2,4,5-Трифторбензальдегид (160 мг) и 3,4-диметоксибензил цианид (177 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (80 мг, выход 26%). Желтоватые кристаллы, МС (APCI, m/z): 319 (М-),1H-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,93 (1 Н, д, J=9 Гц), 6,99-7,06 (1 Н, м), 7,14 (1 Н, д, J=2 Гц), 7,28 (1 Н, дд, J=2 Гц, 9 Гц), 7,51 (1 Н, с), 8,07-8,16 (1 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(3,4,5-трифторфенил)акрилонитрила (соединение 31). 3,4,5-Трифторбензальдегид (160 мг) и 3,4-диметоксибензил цианид (177 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (60 мг, выход 19%). Желтоватые кристаллы, МС (APCI, m/z): 319 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,96 (3 Н, с), 6,93 (1 Н, д, J=9 Гц), 7,11 (1 Н, д, J=2 Гц), 7,25 (1 Н, с),7,26 (1 Н, дд, J=2 Гц, 9 Гц), 7,48-7,56 (1 Н, м). Получение (Z)-3-(2,6-дифторфенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 32). 2,6-Дифторбензальдегид (284 мг) и 3,4-диметоксибензил цианид (354 мг) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (358 мг, выход 40%). Желтоватые кристаллы, МС (APCI, m/z): 301 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,96 (3 Н, с), 6,93 (1 Н, д, J=9 Гц), 6,98-7,05 (2 Н, дд, м), 7,17 (1 Н, д, J=2 Гц), 7,31 (1 Н, дд, J=2 Гц, 9 Гц), 7,32 (1 Н, с), 7,33-7,42 (1 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-нитрофенил)акрилонитрила (соединение 33). 3-Нитробензальдегид (3,02 г) и 3,4-диметоксибензил цианид (3,54 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (6,01 г, выход 97%). Желтоватые кристаллы, МС (APCI, m/z): 310 (М-),1 Н-ЯМР (CDCl3)3,95 (3 Н, с), 3,98 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,17 (1 Н, д, J=2 Гц), 7,31 (1 Н, дд,J=2 Гц, 9 Гц), 7,49 (1 Н, с), 7,68 (1 Н, т, J=8 Гц), 8,27 (1 Н, ддд, J=1 Гц, 2 Гц, 8 Гц), 8,33 (1 Н, ддд, J=1 Гц, 2 Гц, 8 Гц), 8,56 (1 Н, т, J=2 Гц). Получение (Z)-3-(4-аминофенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 34). Соединение 19 растворяют в уксусной кислоте. К полученному раствору добавляют порошок цинка и полученную смесь перемешивают в течение 4 ч. Смесь концентрируют досуха при пониженном давлении с последующей очисткой с применением колонки с силикагелем с получением целевого продукта(760 мг, выход 95%). Желтоватые кристаллы, МС (APCI, m/z): 281 (МН+),1 Н-ЯМР (CDCl3)3,91 (3 Н, с), 3,95 (3 Н, с), 6,71 (2 Н, д, J=9 Гц), 6,90 (1 Н, д, J=9 Гц), 7,11 (1 Н, д, J=2 Гц), 7,20 (1 Н, дд, J=2 Гц, 8 Гц), 7,29 (1 Н, с), 7,75 (2 Н, д, J=9 Гц). Получение этил-[4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенокси]ацетата (соединение 35). Соединение 1 (281 мг) и этилхлорацетат (245 мг) растворяют в ацетоне и к полученному раствору добавляют карбонат калия с последующим кипячением с обратным холодильником в течение 3 ч. Полученную смесь фильтруют и нерастворенное вещество удаляют из смеси. Полученный фильтрат концентрируют досуха при пониженном давлении с последующей перекристаллизацией с получением целевого продукта (124 мг, выход 34%). Белые кристаллы, МС (APCI, m/z): 368 (МН+),1(2 Н, д, J=9 Гц). Получение метил-4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]бензоата (соединение 36). Метил-4-формилбензоат (1,64 г) и 3,4-диметоксибензил цианид (1,77 г) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (0,97 г, выход 30%). Бледно-желтые кристаллы, МС (APCI, m/z): 323 (М-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,95 (3 Н, с), 3,97 (3 Н, с), 6,94 (1 Н, д, J=9 Гц), 7,16 (1 Н, д, J=2 Гц),7,30 (1 Н, дд, J=2 Гц, 9 Гц), 7,46 (1 Н, с), 7,92 (2 Н, д, J=9 Гц), 8,12 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(2-нитрофенил)акрилонитрила (соединение 37). 2-Нитробензальдегид (1,51 г) и 3,4-диметоксибензил цианид (1,77 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (2,59 г, выход 84%). Желто-оранжевые кристаллы, МС (APCI, m/z): 310 (М-),1 Н-ЯМР (CDCl3)3,95 (3 Н, с), 3,97 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,19 (1 Н, д, J=2 Гц), 7,33 (1 Н, дд,- 17009048J=2 Гц, 9 Гц), 7,62 (1 Н, ушир.т), 7,78 (1 Н, ушир.т), 7,93 (1 Н, с), 7,94 (1 Н, д, J=8 Гц,), 8,24 (1 Н, д, J=8 Гц). Получение (Z)-3-(4-хлор-3-нитрофенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 38). 4-Хлор-3-нитробензальдегид (557 мг) и 3,4-диметоксибензил цианид (532 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (372 мг, выход 36%). Бледно-желтые кристаллы, МС (ESI, m/z): 343 (М-Н-),1H-ЯMP (CDCl3)3,95 (3 Н, с), 3,97 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,14 (1 Н, д, J=2 Гц), 7,29 (1 Н, дд,J=2 Гц, 9 Гц), 7,38 (1 Н, с), 7,66 (1 Н, д, J=9 Гц), 8,15 (1 Н, дд, J=2 Гц, 9 Гц) , 8,23 (1 Н, д, J=2 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(2-фтор-5-нитрофенил)акрилонитрила (соединение 39). 2-Фтор-5-нитробензальдегид (85 мг) и 3,4-диметоксибензил цианид (89 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (24 мг, выход 15%). Бледно-желтые кристаллы, МС (APCI, m/z): 328 (М-),1H-ЯМР (CDCl3)3,95 (3 Н, с), 3,98 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,18 (1 Н, дд, J=2 Гц), 7,31 (1 Н, д,J=9 Гц), 7,34 (1 Н, д, J=2 Гц, 9 Гц), 7,57 (1 Н, с), 8,32 (1 Н, ддд, J=3 Гц, 4 Гц, 9 Гц), 9,08 (1 Н, дд, J=3 Гц, 6 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-этокси-3-нитрофенил)акрилонитрила (соединение 40). 4-Этокси-3-нитробензальдегид (586 мг) и 3,4-диметоксибензил цианид (532 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (425 мг, выход 40%). Желто-оранжевые кристаллы, МС (ESI, m/z): 354 (М-),1 Н-ЯМР (CDCl3)1,52 (3 Н, т, J=7 Гц), 3,95 (3 Н, с), 3,97 (3 Н, с), 4,27 (2 Н, кв., J=7 Гц), 6,94 (1 Н, д,J=9 Гц), 7,12 (1 Н, д, J=2 Гц), 7,16 (1 Н, д, J=9 Гц), 7,25 (1 Н, дд, J=2 Гц, 9 Гц), 7,34 (1 Н, с), 8,16 (1 Н, д, J=2 Гц), 8,26 (1 Н, дд, J=2 Гц, 9 Гц). Получение 4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилметилсукцината (соединение 41). Соединение 1 (50 мг) и хлорид монометилового эфира янтарной кислоты (44 мкл) растворяют в пиридине (1 мл) с последующим перемешиванием в течение дня и ночи. После завершения реакции полученную реакционную смесь концентрируют досуха при пониженном давлении, очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (63 мг, выход 90%). Бледно-желтые кристаллы, МС (APCI, m/z): 396 (МН+),1 Н-ЯМР (CDCl3)2,77 (2 Н, дд, J=6 Гц, 7 Гц), 2,92 (2 Н, дд, J=6 Гц, 7 Гц), 3,74 (3 Н, с), 3,93 (3 Н, с),3,96 (3 Н, с), 6,92 (1 Н, д, J=8 Гц), 7,14 (1 Н, д, J=2 Гц), 7,21 (2 Н, д, J=9 Гц), 7,26 (1 Н, дд, J=2 Гц, 8 Гц), 7,40(1 Н, с), 7,89 (2 Н, д, J=9 Гц). Получение 4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилэтилсукцината (соединение 42). Соединение 1 (50 мг) и хлорид моноэтилового эфира янтарной кислоты (51 мкл) растворяют в пиридине (1 мл) с последующим перемешиванием в течение дня и ночи. После завершения реакции полученную реакционную смесь концентрируют досуха при пониженном давлении с последующей очисткой хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (73 мг, выход 90%). Бледно-желтые кристаллы, МС (APCI, m/z): 410 (МН+),1 Н-ЯМР (CDCl3)1,29 (3 Н, т, J=7 Гц), 2,75 (2 Н, дд, J=6 Гц, 8 Гц), 2,91 (2 Н, дд, J=6 Гц, 8 Гц), 3,93(3 Н, с), 3,97 (3 Н, с), 4,20 (2 Н, дд, J=7 Гц, 14 Гц), 6,92 (1 Н, д, J=9 Гц), 7,14 (1 Н, д, J=2 Гц), 7,21 (2 Н, д, J=9 Гц), 7,26 (1 Н, дд, J=2 Гц, 9 Гц), 7,40 (1 Н, с), 7,90 (2 Н, д, J=9 Гц). Получение бис 4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилсукцината (соединение 43). Соединение 1 (50 мг) и сукцинилдихлорид (20 мкл) растворяют в пиридине (1 мл) с последующим перемешиванием в течение дня и ночи. После завершения реакции полученную реакционную смесь концентрируют досуха при пониженном давлении, очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (56 мг, выход 98%). Бледно-желтые кристаллы, МС (EI, m/z): 644 (М+),1 Н-ЯМР (CDCl3)3,05 (4 Н, с), 3,93 (6 Н, с), 3,96 (6 Н, с), 6,92 (2 Н, д, J=9 Гц), 7,14 (2 Н, д, J=2 Гц),7,23 (4 Н, д, J=9 Гц), 7,26 (2 Н, дд, J=2 Гц, 9 Гц), 7,41 (2 Н, с), 7,91 (4 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4D-глюкопиранозилфенил)акрилонитрила (соединение 44). Соединение 1 (1,71 г) растворяют в ацетоне и к полученному раствору добавляют -Dацетобромглюкозу (10,0 г) и карбонат калия (3,57 г) с последующим кипячением/нагреванием с обратным холодильником в течение дня и ночи при энергичном перемешивании. Полученную смесь фильтруют, удаляя нерастворимое вещество. Фильтрованный продукт промывают хлороформом и смешивают с полученным выше фильтратом, и полученную смесь концентрируют досуха при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, применяя систему хлороформ/метанол. Очищенный продукт суспендируют в безводном метаноле и к полученной суспензии по каплям добавляют 28% NaOMe с последующим перемешиванием при комнатной температуре в течение 0,5 ч. К полученной смеси добавляют воду и смесь нейтрализуют ионообменной смолой (сульфоновая кислота - +Н тип). Смолу удаляют фильтрацией и смесь концентрируют досуха при пониженном давле- 18009048 нии с последующей очисткой хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (696 мг, выход 26%). Бледно-желтые кристаллы, МС (EI, m/z): 443 (М+),1 Н-ЯМР (ДМСО-d6)3,21 (1 Н, т, J=9 Гц), 3,31 (1 Н, т, J=9 Гц), 3,35 (1 Н, т, J=9 Гц), 3,44 (1 Н, м), 3,50(140 мг) снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (72 мг, выход 60%). Желто-оранжевые кристаллы, МС (APCI, m/z): 327 (МН+),1H-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,94 (1 Н, д, J=9 Гц), 7,13 (1 Н, д, J=2 Гц), 7,27 (1 Н, дд,J=2 Гц, 9 Гц), 7,28 (1 Н, д, J=9 Гц) , 7,36 (1 Н, с), 8,29 (1 Н, дд, J=2 Гц, 9 Гц), 8,51 (1 Н, д, J=2 Гц), 10,77 (1 Н,с). Получение (Z)-2-(3,4-диметоксифенил)-3-(6-нитробензо[1,3]диоксол-5-ил)акрилонитрила (соединение 46). 6-Нитропиперонал (195 мг) и 3,4-диметоксибензил цианид (177 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (124 г, выход 35%). Бледно-желтые кристаллы, МС (ESI, m/z): 354 (M-),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,96 (3 Н, с), 6,21 (2 Н, с), 6,94 (1 Н, д, J=9 Гц), 7,17 (1 Н, д, J=2 Гц),7,28 (1 Н, с), 7,30 (1 Н, дд, J=2 Гц, 9 Гц), 7,72 (1 Н, с), 7,88 (1 Н, с). Получение (Z)-3-(3,4-диметоксифенил)-2-[4-(2-метоксиэтоксиметокси)фенил]акрилонитрила (соединение 47). Гидроксильную группу 4-гидроксибензил цианида (26,63 г) защищают с применением 2-метоксиэтоксиметилхлорида (24,42 г) в соответствии с процессом получения 1 с получением МЭМ-формы (24,39 г, выход 55%). Полученную МЭМ-форму (22,13 г) и 3,4-диметоксибензальдегид (16,62 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (29,79 г, выход 81%). Бледно-желтые кристаллы, МС (APCI, m/z): 370 (МН+),1(2 Н, с), 6,92 (1 Н, д, J=8 Гц), 7,11 (1 Н, д, J=9 Гц), 7,34 (1 Н, дд, J=2 Гц, 8 Гц), 7,38 (1 Н, с), 7,58 (1 Н, д, J=9 Гц), 7,69 (1 Н, д, J=2 Гц). Получение (Z)-3-(3,4-диметоксифенил)-2-(4-гидроксифенил)акрилонитрила (соединение 48). Защитную группу соединения 47 (18,45 г) удаляют в соответствии с процессом получения 3 с получением целевого продукта (8,38 г, выход 60%). Бледно-желтые кристаллы, МС (APCI, m/z): 282 (МН+),1 Н-ЯМР (CDCl3)3,94 (3 Н, с), 3,97 (3 Н, с), 6,90 (1 Н, д, J=9 Гц), 6,92 (1 Н, д, J=8 Гц), 7,33 (1 Н, дд,J=2 Гц, 8 Гц), 7,34 (1 Н, с), 7,54 (1 Н, д, J=9 Гц), 7,67 (1 Н, д, J=2 Гц). Получение (Z)-2-(3,5-бис(трифторметил)фенил)-3-(4-гидроксифенил)акрилонитрила (соединение 49). 4-Метоксиэтоксиметоксибензальдегид (420 мг) и 3,5-бис(трифторметил)фенилацетонитрил (506 мг) конденсируют в соответствии с процессом А процесса получения 2 и с полученного продукта снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (122 мг, выход 17%). Бледно-желтые кристаллы, МС (ESI, m/z): 356 (М-Н-),1 Н-ЯМР (CDCl3)6,96 (2 Н, ушир.д), 7,57 (1 Н, с), 7,87 (1 Н, с), 7,91 (2 Н, ушир.д), 8,06 (2 Н, с). Получение (Е)-2-(3,4-диметоксифенил)-3-(4-гидроксифенил)акрилонитрила (соединение 50). Соединение 1 (100 мг) растворяют в ацетонитриле и полученный раствор подвергают фотореакции с применением ртутной лампы высокого давления. Полученную реакционную смесь концентрируют досуха при пониженном давлении с последующей очисткой на колонке с силикагелем с получением целевого продукта (41 мг, выход 41%). Бледно-желтые кристаллы, МС (APCI, m/z): 282 (МН+),1- 19009048 Соединение 1 (224 мг) растворяют в ацетоне и к полученному раствору добавляют -D-ацетоброммальтозу (2,23 г) и карбонат калия (468 мг) с последующим кипячением/нагреванием с обратным холодильником в течение дня и ночи при энергичном перемешивании. Полученную смесь фильтруют с удалением нерастворимого вещества. Фильтрованный продукт промывают хлороформом и смешивают с полученным выше фильтратом, полученную смесь концентрируют досуха при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем с применением хлороформа/метанола. Очищенный продукт суспендируют в безводном метаноле и к полученной суспензии по каплям добавляют 28% NaOMe с последующим перемешиванием при комнатной температуре в течение 0,5 ч. К полученной смеси добавляют воду и смесь нейтрализуют ионообменной смолой (сульфоновая кислота-+Н тип). Смолу удаляют фильтрацией, смесь концентрируют досуха при пониженном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (195 мг, выход 27%). Бледно-желтые кристаллы, МС (ESI, m/z): 604 (М-Н-),1 Н-ЯМР (ДMCO-d6)3,11 (1 Н, т, J=9 Гц), 3,28 (1 Н, дд, J=4 Гц, 10 Гц), 3,81 (3 Н, с), 3,86 (3 Н, с), 5,05(1 Н, д, J=8 Гц), 5,09 (1 Н, д, J=3 Гц), 7,07 (1 Н, д, J=9 Гц), 7,18 (2 Н, д, J=9 Гц), 7,25 (1 Н, дд, J=2 Гц, 9 Гц),7,29 (1 Н, д, J=2 Гц), 7,84 (1 Н, с), 7,89 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(2-этокси-5-нитрофенил)акрилонитрила (соединение 52). 2-Этокси-5-нитробензальдегид (390 мг) и 3,4-диметоксибензил цианид (354 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (319 мг, выход 45%). Желто-оранжевые кристаллы, МС (ESI, m/z): 354 (М-),1 Н-ЯМР (CDCl3)1,52 (3 Н, т, J=7 Гц), 3,95 (3 Н, с), 3,97 (3 Н, с), 4,24 (2 Н, кв., J=7 Гц), 6,95 (1 Н, д,J=9 Гц), 7,00 (1 Н, д, J=9 Гц), 7,17 (1 Н, д, J=2 Гц), 7,30 (1 Н, дд, J=2 Гц, 9 Гц), 7,70 (1 Н, с), 8,29 (1 Н, дд, J=3 Гц, 9 Гц), 8,92 (1 Н, дд, J=3 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-гидрокси-4-нитрофенил)акрилонитрила (соединение 53). Гидроксильную группу 3-гидрокси-4-нитробензальдегида (0,67 г) защищают с применением 2 метоксиэтоксиметилхлорида (0,50 г) в соответствии с процессом получения 1 с получением МЭМ-формы(0,97 г, выход 95%). Полученную МЭМ-форму (944 мг) и 3,4-диметоксибензил цианид (673 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением (Z)-2-(3,4-диметоксифенил)-3[3-(2-метоксиэтоксиметокси)-4-нитрофенил]акрилонитрила (515 мг, выход 34%). С полученного (Z)-2(3,4-диметоксифенил)-3-[3-(2-метоксиэтоксиметокси)-4-нитрофенил]акрилонитрила (350 мг) снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (267 мг, выход 97%). Желто-оранжевые кристаллы, МС (ESI, m/z): 325 (М-Н-),1 Н-ЯМР (CDCl3)3,95 (3 Н, с), 3,97 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,16 (1 Н, д, J=2 Гц), 7,321 (1 Н, дд,J=2 Гц, 9 Гц), 7,37 (1 Н, с), 7,52 (1 Н, дд, J=2 Гц, 9 Гц), 7,56 (1 Н, д, J=2 Гц), 8,12 (1 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4 мальтотриозилфенил)акрилонитрила (соединение 54). Соединение 1 (791 мг) растворяют в ацетоне, к полученному раствору добавляют -Dацетоброммальтотриозу (11,1 г) и карбонат калия (1,11 г) с последующим кипячением/нагреванием с обратным холодильником в течение дня и ночи при энергичном перемешивании. Полученную смесь фильтруют с удалением нерастворимого вещества. Фильтрованный продукт промывают хлороформом и смешивают с полученным выше фильтратом и полученную смесь концентрируют досуха при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол. Очищенный продукт суспендируют в безводном метаноле и к полученной суспензии по каплям добавляют 28% NaOMe с последующим перемешиванием при комнатной температуре в течение 0,5 ч. К полученной смеси добавляют воду и смесь нейтрализуют ионообменной смолой (сульфоновая кислота-+Н тип). Смолу удаляют фильтрацией и смесь концентрируют досуха при пониженном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол с получением целевого продукта (368 мг, выход 17%). Бледно-желтые кристаллы, МС (ESI, m/z): 766 (М-Н-),1 Н-ЯМР (ДМСO-d6)3,07 (1 Н, т, J=9 Гц), 3,25 (1H, дд, J=4 Гц, 9 Гц), 3,81 (1 Н, с), 3,86 (1 Н, с), 5,02- 20009048 снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (140 мг, выход 29%). Бледно-желтые кристаллы, МС (APCI, m/z): 300 (МН+),1 Н-ЯМР (CDCl3)3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (1 Н, д, J=9 Гц), 6,93-6,99 (1 Н, м), 7,12-7,17 (1 Н, м),7,18 (1 Н, д, J=2 Гц), 7,30 (1 Н, дд, J=2 Гц, 9 Гц), 7,80 (1 Н, с), 7,93 (1 Н, д, J=8 Гц). Получение (Z)-2,3-бис-(3,4-диметоксифенил)акрилонитрила (соединение 56). 3,4-Диметоксибензальдегид (1,00 г) и 3,4-диметоксибензил цианид (1,07 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (1,75 г, выход 89%). Бледно-желтые кристаллы, МС (APCI, m/z): 326 (МН+),1 Н-ЯМР (CDCl3)3,93 (3 Н, с), 3,95 (3 Н, с), 3,97 (3 Н, с), 3,98 (3 Н, с), 6,91 (1 Н, д, J=9 Гц), 6,93 (1 Н, д,J=9 Гц), 7,13 (1 Н, д, J=2 Гц), 7,24 (1 Н, дд, J=2 Гц, 9 Гц), 7,35 (1 Н, с), 7,36 (1 Н, дд, J=2 Гц, 9 Гц), 7,67 (1 Н,д, J=2 Гц). Получение (Z)-3-(3-аминофенил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 57). Соединение 33 (1,80 г) растворяют в уксусной кислоте. К полученному раствору добавляют порошок цинка и смесь перемешивают в течение 4 ч. Смесь концентрируют досуха при пониженном давлении и очищают на колонке с силикагелем с получением целевого продукта (1,30 г, выход 80%). Бледно-желтые кристаллы, МС (APCI, m/z): 281 (МН+),1 Н-ЯMP (CDCl3)3,81 (2 Н, ушир.с), 3,93 (3 Н, с), 3,96 (3 Н, с), 6,75 (1 Н, ддд, J=1 Гц, 2 Гц, 9 Гц), 6,92(4,98 г, выход 78%). Полученную МЭМ-форму (4,98 г) и 3,4-диметоксибензил цианид (3,87 г) конденсируют в соответствии с процессом А процесса получения 2 с получением целевого продукта (6,55 г, выход 78%). Бледно-желтые кристаллы, МС (APCI, m/z): 284 (М-СН 2 ОСН 2 СН 2 ОСН 3-),1 Н-ЯМР (CDCl3)3,38 (3 Н, с), 3,56-3,60 (2 Н, м), 3,87-3,91 (2 Н, м), 3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (1 Н,д, J=8 Гц), 7,12 (1 Н, д, J=2 Гц), 7,24 (1 Н, дд, J=2 Гц, 8 Гц), 7,30 (1 Н, т, J=9 Гц), 7,31 (1 Н, с), 7,56 (1 Н, дд,J=2 Гц, 9 Гц), 7,60 (1 Н, дд, J=2 Гц, 12 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(3-фтор-4-гидроксифенил)акрилонитрила (соединение 59). С соединения 58 (6,00 г) снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (4,44 г, выход 96%). Бледно-желтые кристаллы, МС (APCI, m/z): 298 (М-Н-),1 Н-ЯМР (CDCl3+CD3OD)3,93 (3 Н, с), 3,96 (3 Н, с), 6,93 (1 Н, д, J=8 Гц), 7,01 (1 Н, т, J=9 Гц), 7,12(1 Н, д, J=2 Гц), 7,22 (1 Н, дд, J=2 Гц, 8 Гц), 7,32 (1 Н, с), 7,51 (1 Н, дд, J=2 Гц, 9 Гц), 7,69 (1 Н, дд, J=2 Гц, 12 Гц). Получение моно-4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилфосфата натрия (соединение 60). Соединение 70 (103 мг) растворяют в этаноле и к полученному раствору добавляют метоксид натрия с последующим перемешиванием в течение 12 ч. Полученную смесь концентрируют досуха при пониженном давлении и затем полученный продукт растворяют в воде. Полученный раствор промывают этилацетатом и полученный водный слой сушат вымораживанием с получением целевого продукта (112 мг, выход 97%). Бледно-желтые кристаллы, МС (ESI, m/z): 360 (M-2Na+H-),1H-ЯМР (D2O)3,71 (3 Н, с), 3,75 (3 Н, с), 6,88 (1 Н, д, J=8 Гц), 6,99 (1 Н, д, J=2 Гц), 7,07 (1 Н, дд, J=2 Гц, 8 Гц), 7,22 (2 Н, д, J=8 Гц), 7,43 (1 Н, с), 7,70 (2 Н, д, J=8 Гц). Получение 4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]фенилацетата (соединение 61). Соединение 48 (1,41 г) ацетилируют уксусным ангидридом и пиридином обычным способом с получением целевого продукта (1,52 г, выход 94%). Белые кристаллы, МС (APCI, m/z): 324 (МН+),1H-ЯМР (CDCl3)2,33 (3 Н, с), 3,95 (3 Н, с), 3,98 (3 Н, с), 6,93 (1 Н, д, J=8 Гц), 7,18 (2 Н, д, J=9 Гц),7,35 (1 Н, дд, J=2 Гц, 8 Гц), 7,42 (1 Н, с), 7,67 (2 Н, д, J=9 Гц), 7,71 (1 Н, д, J=2 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-формилфенил)акрилонитрила (соединение 62). 4-Диэтоксиметилбензальдегид (4,16 г) и 3,4-диметоксибензил цианид (3,54 г) конденсируют в соответствии с процессом А процесса получения 2 с получением (Z)-3-(4-диэтоксиметилфенил)-2-(3,4 диметоксифенил)акрилонитрила (6,54 г, выход 89%). Полученный (Z)-3-(4-диэтоксиметилфенил)-2-(3,4 диметоксифенил)акрилонитрил (1,84 г) растворяют в метаноле и к полученному раствору добавляют воду и 2 н. серную кислоту с последующим перемешиванием, с получением целевого продукта (1,20 г, вы- 21009048 ход 82%). Бледно-желтые кристаллы, МС (APCI, m/z): 294 (МН+),1 Н-ЯМР (CDCl3)3,95 (3 Н, с), 3,98 (3 Н, с), 6,95 (1 Н, д, J=9 Гц), 7,17 (1 Н, д, J=2 Гц), 7,32 (1 Н, дд,J=2 Гц, 9 Гц), 7,48 (1 Н, с), 7,97 (2 Н, д, J=9 Гц), 8,02 (2 Н, д, J=9 Гц), 10,06 (1 Н, с). Получение 4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]-2-этоксифенилацетата (соединение 63). Соединение 11 (1,30 г) ацетилируют уксусным ангидридом и пиридином обычным способом с получением целевого продукта (1,19 г, выход 81%). Белые кристаллы, МС (APCI, m/z): 368 (МН+),1H-ЯМР (CDCl3)1,44 (3 Н, т, J=7 Гц), 2,34 (3 Н, с), 3,94 (3 Н, с), 3,97 (3 Н, с), 4,16 (2 Н, кв., J=7 Гц),6,93 (1 Н, д, J=9 Гц), 7,11 (1 Н, д, J=8 Гц), 7,13 (1 Н, д, J=2 Гц), 7,26 (1 Н, дд, J=2 Гц, 8 Гц), 7,31 (1 Н, д, J=2 Гц, 8 Гц), 7,37 (1 Н, с), 7,69 (1 Н, д, J=2 Гц). Получение 4-[(Z)-1-циано-2-(3,4-диметоксифенил)винил]-2-фторфенил ацетата (соединение 64). Соединение 59 (1,20 г) ацетилируют уксусным ангидридом и пиридином обычным способом с получением целевого продукта (1,26 г, выход 92%). Желтоватые кристаллы, МС (APCI, m/z): 298 (М-СОСН 3-),1 Н-ЯМР (CDCl3)2,37 (3 Н, с), 3,94 (3 Н, с), 3,97 (3 Н, с), 6,93 (1 Н, д, J=9 Гц), 7,13 (1 Н, д, J=2 Гц),7,22 (1 Н, д, J=8 Гц), 7,27 (1 Н, д, J=2 Гц, 9 Гц), 7,35 (1 Н, с), 7,62-7,67 (1 Н, м), 7,72 (1 Н, дд, J=2 Гц, 11 Гц). Получение 4-[(Z)-2-циано-2-(3,4,5-триметоксифенил)винил]фенилацетата (соединение 65). Соединение 15 (1,20 г) ацетилируют уксусным ангидридом и пиридином обычным способом с получением целевого продукта (1,27 г, выход 93%). Белые кристаллы, МС (APCI, m/z): 352 (М-Н-),1H-ЯМР (CDCl3)2,34 (3 Н, с), 3,89 (3 Н, с), 3,94 (6 Н, с), 6,87 (2 Н, с), 7,22 (2 Н, д, J=9 Гц), 7,43 (1 Н,с), 7,91 (2 Н, д, J=9 Гц). Получение этил-7-[4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенокси]гептаноата (соединение 66). Соединение 1 (200 мг) растворяют в диметилсульфоксиде и к полученному раствору добавляют безводный карбонат калия с последующим перемешиванием при комнатной температуре в течение 1 ч. Затем к полученной смеси добавляют этил-7-бромгептаноат (169 мг) и смесь перемешивают. Карбонат калия отфильтровывают и полученный фильтрат выливают в ледяную воду. К полученной смеси добавляют соляную кислоту для доведения рН до 3, затем дважды смесь экстрагируют хлороформом. Полученный слой хлороформа промывают насыщенным раствором соли и затем сушат над безводным сульфатом натрия. Сульфат натрия отфильтровывают, фильтрат концентрируют досуха при пониженном давлении с последующей перекристаллизацией с получением целевого продукта (223 мг, выход 72%). Желтоватые кристаллы, МС (ESI, m/z): 437 (М-),1 Н-ЯМР (CDCl3)1,26 (3 Н, т, J=7 Гц), 1,37-1,45 (2 Н, м), 1,46-1,55 (2 Н, м), 1,63-1,71 (2 Н, м), 1,781,86 (2 Н, м), 2,32 (2 Н, т, J=7 Гц), 3,93 (3 Н, с), 3,96 (3 Н, с), 4,02 (2 Н, т, J=7 Гц), 4,13 (2 Н, кв., J=7 Гц), 6,91(1 Н, д, J=9 Гц), 6,95 (2 Н, д, J=9 Гц), 7,13 (1 Н, д, J=2 Гц), 7,23 (1 Н, дд, J=2 Гц, 9 Гц), 7,36 (1 Н, с), 7,85 (2 Н,д, J=9 Гц). Получение 4-[(Z)-1-циано-2-(3,4-триметоксифенил)винил]фенил-8-бромоктаноата (соединение 67). Соединение 1 (1,41 г), 8-бромоктановую кислоту (1,78 г) и п-толуолсульфоновую кислоту (1,90 г) растворяют в толуоле и полученный раствор кипятят с обратным холодильником в течение 10 ч. Раствор концентрируют, затем очищают хроматографией на колонке с силикагелем с получением целевого продукта (0,72 г, выход 34%). Бледно-желтые кристаллы, МС (APCI, m/z): 486 (МН+),1H-ЯМР (CDCl3)1,35-1,55 (6 Н, м), 1,74-1,82 (2 Н, м), 1,84-1,92 (2 Н, м), 2,59 (2 Н, т), 3,42 (2 Н, т),3,93 (3 Н, с), 3,96 (3 Н, с), 6,93 (1 Н, д, J=9 Гц), 7,14 (1 Н, д, J=2 Гц), 7,19 (2 Н, д, J=9 Гц), 7,26 (1 Н, дд, J=2 Гц, 9 Гц), 7,41 (1 Н, с), 7,90 (2 Н, д, J=9 Гц). Получение (Z)-3-(3-аминофенил)-2-(3,4-диметоксифенил)акрилонитрила, гидрохлорида (соединение 68). Соединение 57 (500 мг) суспендируют в хлористо-водородной кислоте (1,1 экв.), к полученной суспензии добавляют и растворяют в ней 1,4-диоксан и ацетонитрил. Реакционную смесь концентрируют досуха при пониженном давлении с последующей перекристаллизацией с получением целевого продукта(соединение 69). Соединение 71 (119 мг) растворяют в этаноле, к полученному раствору добавляют метоксид натрия с последующим перемешиванием в течение 12 ч. Смесь концентрируют досуха при пониженном давлении и затем полученный продукт растворяют в воде. Раствор промывают этилацетатом и полученный- 22009048 водный слой сушат вымораживанием с получением целевого продукта (130 мг, выход 98%). Бледно-желтые кристаллы, МС (ESI, m/z): 390 (M-2Na+H-),1 Н-ЯМР (D2O)3,64 (3 Н, с), 3,67 (3 Н, с), 3,69 (3 Н, с), 6,83 (1 Н, д, J=9 Гц), 6,97 (1 Н, д, J=2 Гц), 7,02(1 Н, дд, J=2 Гц, 9 Гц), 7,14 (1 Н, дд, J=2 Гц, 9 Гц), 7,36 (1 Н, д, J=9 Гц), 7,39 (1 Н, с), 7,43 (1 Н, д, J=2 Гц). Получение моно-4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилфосфата (соединение 70). Соединение 1 (100 мг) и 4-(диметиламино)пиридин (5 мг) растворяют в ацетонитриле (700 мкл) и затем охлаждают до температуры -10 С. Затем к полученному раствору добавляют четыреххлористый углерод (171 мкл) и диизопропилэтиламин (129 мкл) и полученную смесь перемешивают в течение 0,5 ч. Затем к смеси добавляют дибензилфосфит (117 мкл) с последующим перемешиванием в течение 12 ч. После завершения реакции к полученной реакционной смеси добавляют 0,5 М дигидрофосфат калия и затем промывают этилацетатом. Полученный органический слой концентрируют досуха при пониженном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол. Очищенный продукт растворяют в дихлорметане и к полученному раствору добавляют бромтриметилсилан с последующим перемешиванием при температуре 0 С в течение 2 ч. После завершения реакции к полученной реакционной смеси добавляют воду и смесь перемешивают в течение 1 ч. Смесь промывают этилацетатом и полученный водный слой сушат вымораживанием с получением целевого продукта (103 мг, выход 80%). Бледно-желтые кристаллы, МС (ESI, m/z): 360 (М-Н-),1 Н-ЯМР (ДМСО-d6)3,81 (3 Н, с), 3,86 (3 Н, с), 7,06 (1 Н, д, J=9 Гц), 7,25 (1 Н, дд, J=2 Гц, 9 Гц), 7,30(2 Н, д, J=8 Гц), 7,31 (1 Н, д, J=2 Гц), 7,88 (1 Н, с), 7,89 (2 Н, д, J=8 Гц). Получение моно-4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]-2-метоксифенилфосфата (соединение 71). Соединение 7 (111 мг) и 4-(диметиламино)пиридин (5 мг) растворяют в ацетонитриле (700 мкл) и охлаждают до температуры -10 С. К полученному раствору добавляют четыреххлористый углерод (171 мкл) и диизопропилэтиламин (129 мкл) и смесь перемешивают в течение 0,5 ч. Затем к смеси добавляют дибензилфосфит (117 мкл) с последующим перемешиванием в течение 12 ч. После завершения реакции к полученной реакционной смеси добавляют 0,5 М дигидрофосфат калия и затем промывают этилацетатом. Полученный органический слой концентрируют досуха при пониженном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол. Очищенный продукт растворяют в дихлорметане и к полученному раствору добавляют бромтриметилсилан с последующим перемешиванием при температуре 0 С в течение 2 ч. После завершения реакции к полученной реакционной смеси добавляют воду и смесь перемешивают в течение 1 ч. Полученную смесь промывают этилацетатом и водный слой сушат вымораживанием с получением целевого продукта (119 мг, выход 85%). Бледно-желтые кристаллы, МС (ESI, m/z): 390 (М-Н-),1 Н-ЯМР (ДМСО-d6)3,81 (3 Н, с), 3,85 (3 Н, с), 3,86 (3 Н, с), 7,08 (1 Н, д, J=9 Гц), 7,26 (1 Н, дд, J=2 Гц,9 Гц), 7,33 (1 Н, д, J=2 Гц), 7,42 (1 Н, д, J=9 Гц), 7,48 (1 Н, дд, J=2 Гц, 9 Гц), 7,66 (1 Н, д, J=2 Гц), 7,93 (1 Н, с). Получение N-[3-[2-циано-2-(3,4-диметоксифенил)винил]фенил]ацетамида (соединение 72). Соединение 57 (50 мг) ацетилируют уксусным ангидридом и пиридином обычным методом с получением целевого продукта (48 мг, выход 84%). Желтоватые кристаллы, МС (ESI, m/z): 323 (МН+),1 Н-ЯМР (CDCl3)2,21 (3 Н, с), 3,93 (3 Н, с), 3,96 (3 Н, с), 6,92 (1 Н, д, J=9 Гц), 7,14 (1 Н, д, J=2 Гц),7,25 (1 Н, дд, J=2 Гц, 9 Гц), 7,40 (1 Н, т, J=8 Гц), 7,41 (1 Н, с), 7,52 (1 Н, ушир.д), 7,61 (2 Н, ушир.д), 8,01 (1 Н,ушир.с). Получение (Z)-2-(3,4-диметоксифенил)-3-[4-(6-фосфоD-глюкопиранозил)фенил]акрилонитрила(соединение 73). Соединение 44 (100 мг) и (2,2,2-трихлорэтил)фосфорхлоридат (256 мг) растворяют в пиридине (2 мл) и полученный раствор перемешивают в течение 2 ч. После завершения реакции полученную реакционную смесь концентрируют досуха при пониженном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол. Очищенный продукт растворяют в смеси пиридин-уксусная кислота (4:1) и к полученному раствору добавляют порошок цинка (140 мг) с последующим перемешиванием в течение 2 ч. После завершения реакции полученную реакционную смесь концентрируют досуха при пониженном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол, с получением целевого продукта (83 мг, выход 70%). Бледно-желтые кристаллы, МС (ESI, m/z): 522 (МН+),1 Н-ЯМР (ДМСО-d6)3,80 (3 Н, с), 3,83 (3 Н, с), 4,98 (1 Н, д, J=7 Гц), 7,05 (1 Н, д, J=9 Гц), 7,14 (2 Н, д,J=9 Гц), 7,22 (1 Н, дд, J=2 Гц, 9 Гц), 7,29 (1 Н, д, J=2 Гц), 7,85 (1 Н, с), 7,88 (2 Н, д, J=9 Гц). Получение серной кислоты моно-4-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фенилэфира триэтиламмониевой соли (соединение 74). Соединение 1 (100 мг) супендируют в хлороформе (10 мл), к полученной суспензии добавляют триэтиламин (516 мкл) и комплекс триоксид серы-пиридин (588 мг) с последующим перемешиванием в течение 2 ч. После завершения реакции полученную реакционную смесь концентрируют досуха при пони- 23009048 женном давлении и очищают хроматографией на колонке с силикагелем с применением системы хлороформ/метанол, получая целевой продукт (160 мг, выход 97%). Бледно-желтые кристаллы, МС (ESI, m/z): 360 (М-(С 2 Н 5)3NH-),1(1 Н, д, J=9 Гц), 7,27 (2 Н, м), 7,39 (2 Н, д, J=9 Гц), 7,69 (1 Н, с), 7,90 (2 Н, д, J=9 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-[4-(6-фосфоD-глюкопиранозил)фенил]акрилонитрила,натриевой соли (соединение 75). Соединение 73 (83 мг) растворяют в этаноле и к полученному раствору добавляют метоксид натрия с последующим перемешиванием в течение 12 ч. Полученную смесь концентрируют досуха при пониженном давлении и затем полученный продукт растворяют в воде. Полученный раствор промывают этилацетатом и полученный водный слой сушат вымораживанием с получением целевого продукта (81 мг, выход 90%). Бледно-желтые кристаллы, МС (ESI, m/z): 522 (M-2Na+H-),1(1,10 г, выход 65%). Полученную МЭМ-форму (510 мг) и 3,4-диметоксибензил цианид (354 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением (Z)-2-(3,4-диметоксифенил)-3[2-(2-метоксиэтоксиметокси)-5-нитрофенил]акрилонитрила (330 мг, выход 40%). С полученного (Z)-2(3,4-диметоксифенил)-3-[2-(2-метоксиэтоксиметокси)-5-нитрофенил]акрилонитрила (200 мг) снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (87 мг, выход 55%). Желто-оранжевые кристаллы, МС (ESI, m/z): 327 (М-Н-),1H-ЯМР (CDCl3)3,95 (3 Н, с), 3,96 (3 Н, с), 6,97 (1 Н, д, J=9 Гц), 7,31 (1 Н, д, J=2 Гц), 7,32 (1 Н, дд,J=2 Гц, 9 Гц), 7,49 (1 Н, д, J=9 Гц), 7,85 (1 Н, с), 8,38 (1 Н, дд, J=2 Гц, 9 Гц), 8,49 (1 Н, д, J=2 Гц). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-фтор-3-нитрофенил)акрилонитрила (соединение 77). 4-Фтор-3-нитробензальдегид (507 мг) и 3,4-диметоксибензил цианид (532 мг) конденсируют в соответствии с процессом В процесса получения 2 с получением целевого продукта (485 мг, выход 30%). Желто-оранжевые кристаллы, МС (ESI, m/z): 325 (М-Н-),1(1,60 г) снимают защиту в соответствии с процессом получения 3 с получением дешевого продукта (0,74 г, выход 56%). Желтоватые кристаллы, МС (APCI, m/z): 342 (МН+),1 Н-ЯМР (CDCl3)3,93 (3 Н, с), 3,95 (3 Н, с), 3,96 (3 Н, с), 3,98 (3 Н, с), 6,92 (1 Н, д, J=9 Гц), 6,97 (1 Н, д,J=2 Гц), 7,13 (1 Н, д, J=2 Гц), 7,24 (1 Н, дд, J=2 Гц, 9 Гц), 7,27 (1 Н, д, J=2 Гц), 7,29 (1 Н, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-гидрокси-3,5-диметоксифенил)акрилонитрила (соединение 79). Гидроксильную группу 4-гидрокси-3,5-диметоксибензальдегида (2,44 г) защищают с применением 2-метоксиэтоксиметилхлорида (1,67 г) в соответствии с процессом получения 1 с получением МЭМформы (3,40 г, выход 94%). Полученную МЭМ-форму (3,40 г) и 3,4-диметоксибензил цианид (2,23 г) конденсируют в соответствии с процессом А процесса получения 2 с получением (Z)-3-[3,5-диметокси-4(2-метоксиэтоксиметокси)фенил]-2-(3,4-диметоксифенил)акрилонитрила (3,53 г, выход 65%). С полученного (Z)-3-[3,5-диметокси-4-(2-метоксиэтоксиметокси)фенил]-2-(3,4-диметоксифенил)акрилонитрила(0,35 г) снимают защиту в соответствии с процессом получения 3 с получением целевого продукта (0,25 г, выход 90%). Желтоватые кристаллы, МС (APCI, m/z): 342 (МН+),1H-ЯМР (CDCl3)3,93 (3 Н, с), 3,97 (ЗН, с), 3,97 (6 Н, с), 6,92 (1 Н, д, J=9 Гц), 7,13 (1 Н, д, J=2 Гц),7,22 (2 Н, с), 7,24 (1 Н, дд, J=2 Гц, 9 Гц), 7,32 (1 Н, с). Пример 2. Получение линии клеток А 549 с резистентностью к SN-38.- 24009048 Линию клеток А 549 - немелкоклеточного рака легких человека - субкультивируют при 5% СО 2 и температуре 37 С с применением среды Ham F-12, содержащей 10% FBS, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина (10% FBS/Ham F-12). Резистентные к SN-38 клетки А 549 выбирают субкультивированием клеток А 549 в среде в течение двух месяцев, постепенно повышая концентрацию SN-38 в среде(от 4 до 10 нг/мл). Затем полученные клетки А 549 с резистентностью к SN-38 клонируют путем ограниченного разбавления с получением шести клонированных линий клеток А 549 с резистентностью к SN-38(A549/SN-38-1 до 6). Пример 3. Тест на чувствительность к противораковому лекарственному средству линии клетокA549/SN-38. Линию клеток А 549 и каждую из A549/SN-38-1 до 6 суспендируют в 10% FBS/Ham F-12 и полученную суспензию инокулируют в 96-луночный микропланшет с последующим культивированием при 5%CO2 и температуре 37 С в течение ночи. Затем в каждую лунку добавляют раствор противоракового лекарственного средства в FBS/Ham F-12 (50 мкл) с последующим культивированием при 5% CO2 и температуре 37 С в течение 48 ч. После завершения культивирования количество жизнеспособных клеток подсчитывают с применением реагента для подсчета жизнеспособных клеток [TetraColor ONE (торговое наименование), продукт Seikagaku Corporation] согласно инструкции по применению. В табл. 2 и на фиг. 1 представлена чувствительность линии клеток А 549 и шести линий клеток A549/SN-38 к различным противораковым лекарственным средствам. IC50 соответствует концентрации противоракового лекарственного средства, требуемой для 50% ингибирования роста клеток. Относительное значение резистентности получают делением IС 50 для линии клеток A549/SN-38 на IС 50 для линии клеток А 549. Чем больше относительное значение резистентности, тем выше уровень приобретенной резистентности. Линии клетокA549/SN-38 демонстрируют особенно сильную резистентность к SN-38 и митоксантрону, которые являются субстратами BCRP. Таблица 2 Пример 4. RT-PCR-анализ линии клеток A549/SN-38. Проводили RT-PCR для анализа экспрессии мРНК переносчика лекарственного средства в клетках линии А 549, шести линий клеток A549/SN-38 и линии клеток рака молочной железы человека MCF-7,которые, как известно, экспрессируют BCRP. Общее количество РНК экстрагировали из клеток с применением реагента экстракции РНК [ISOGEN (торговое наименование), продукт Nippon Gene Co., Ltd.] и проводили RT-PCR с применением реагента RT-PCR [Ready To Go RT-PCR Beads (торговое наименование), продукт Amersham pharmacia biotech] и теплового датчика циклов [iCycler (торговое наименование), продукт BIO-RAD] согласно прилагаемой инструкции по применению (общее количество РНК: 0,5 мкг). Полученный продукт PCR подвергали электрофорезу с применением 2% геля агарозы и затем окрашивали бромидом этидия для последующего определения на трансиллюминаторе. Кроме того, проводили RT-PCR в режиме реального времени с применением реагента для проведения RT-PCR в режиме реального времени [SYBR Green RT-PCR reagents (торговое наименование), продукт Applied Biosystems] и системы определения последовательности [ABI PRISM 7000 (торговое наименование), продукт AppliedBiosystems] согласно прилагаемой инструкции по применению для количественного анализа (общее количество РНК: 0,1 мкг). PCR-праймеры, соответствующие BCRP, MDR1, MRP1, MRP2, MRP3 и G3PDH(эндогенные контрольные гены), создавали на основе следующих известных базовых последовательностей мРНК (инвентарные номера AF098951, AF016535, L05628, U63970, AF009670 и М 33197) соответственно. На фиг. 2 показаны результаты RT-PCR, а на фиг. 3 показаны результаты RT-PCR в режиме ре- 25009048 ального времени. Экспрессия BCRP значительно повышается во всех шести линиях клеток A549/SN-38 по сравнению с линией клеток А 549. Наоборот, никакой значительной разницы не отмечено в уровне экспрессии MPR2 (субстратом которого является SN-38, который также является субстратом BCRP) между линией клеток А 549 и линиями клеток A549/SN-38. Также никакой значительной разницы не отмечено между уровнем экспрессии других переносчиков лекарственных средств между линией клеток А 549 и линией клеток A549/SN-38. Эти результаты позволят предположить, что BCRP вовлечен в механизм резистентности к противораковым лекарственным средствам в линиях клеток A549/SN-38. С помощью указанного выше анализа RT-PCR экспрессия BCRP была обнаружена в линии клеток рака молочной железы человека MCF-7. Кроме исследований экспрессии указанных выше переносчиков лекарственных средств изучали экспрессию топоизомеразы-I, топоизомеразы-II, Всl-2, Вах или IB С помощью вестерн-блоттинга, и изучали активность топоизомеразы-I на основе реакции релаксации ДНК. Однако не было получено данных, позволяющих предположить, что эти белки вовлечены в механизм резистентности к противораковым лекарственным средствам в линиях клеток A549/SN-38. Пример 5. Количество противоракового лекарственного средства, аккумулирующееся в линии клеток A549/SN-38. Линию клеток А 549 или линию клеток A549/SN-38 (4106 клеток/мл) суспендировали в 10%FBS/RPMI1640 (1 мл) и к полученной суспензии добавляли раствор SN-38 в ДМСО (1 мкл, конечная концентрация 300 нг/мл) с последующей инкубацией при температуре 37 С в течение 60 мин. Затем проводили центрифугирование (2 С, 1400xg, 1 мин), и полученную надосадочную жидкость удаляли. К осажденным таким образом клеткам добавляли охлажденный на льду PBS и клетки повторно в нем суспендировали с последующим центрифугированием (2 С, 1400 хg, 1 мин) для промывания клеток. Снова проводили промывание с последующим добавлением PBS (375 мкл) и клетки обрабатывали ультразвуком. К обработанным ультразвуком клеткам добавляли метанол (375 мкл) и 10% раствор сульфата цинка (15 мкл) и полученную смесь перемешивали с последующим центрифугированием (2 С, 12500 хg, 5 мин) и сбором надосадочной жидкости. Собранную надосадочную жидкость распределяли в белом 96-луночном микропланшете для измерения интенсивности флуоресценции (200 мк/лунку) и затем определяли количество SN-38 и SN-38-глюкуронида, содержащегося в надосадочной жидкости, с применением микропланшетного флуориметра [SPECTRA max GEMINI XS (торговое наименование), продукт Molecular Devices] (SN-38: длина волны возбуждения 380 нм, длина волны эмиссии 560 нм; SN-38-глюкуронид: длина волны возбуждения 370 нм, длина волны эмиссии 430 нм), тем самым получая количество внутриклеточной аккумуляции SN-38 и глюкуронида. Как понятно из результатов, представленных на фиг. 4, количество SN-38, аккумулированного в клетках линии A549/SN-38-4, составляет около 1/5 от количестваSN-38, аккумулированного в клетках линии А 549. Результаты показывают, что BCRP вовлечен в механизм резистентности к противораковым лекарственным средствам в линиях клеток A549/SN-38. Наоборот, SN-38-глюкуронид практически не был обнаружен в клетках обеих линий А 549 и A549/SN-38-4, что показывает, что глюкуронидирование не вовлечено в механизм резистентности противораковым лекарственным средствам. Пример 6. Действие производного дифенилакрилонитрила по преодолению резистентности к противораковым лекарственным средствам в линии клеток A549/SN-38-4. Действие производного дифенилакрилонитрила на BCRP-опосредованную резистентность противораковым лекарственным средствам изучали с применением линии клеток рака легких человекаA549/SN-38-4, которая приобрела резистентность к противораковым лекарственным средствам через экспрессию BCRP. Линию клеток рака легких человека А 549 или линию клеток рака легких человекаA549/SN-38-4 суспендировали в 10% FBS/Han F-12 и полученную суспензию инокулировали в 96 луночный микропланшет с последующим культивированием при 5% CO2 и температуре 37 С в течение ночи (2103 клеток/50 мкл/лунка). Затем в каждую лунку добавляли раствор 10% FBS/Ham F-12 (25 мкл),содержащий производное дифенилакрилонитрила и SN-38 или митоксантрон, с последующим культивированием при 5% СО 2 и температуре 37 С в течение 48 ч. После завершения культивирования количество жизнеспособных клеток рассчитывали с применением TetraColor ONE согласно прилагаемой инструкции по применению. На фиг. 5 показано действие производного дифенилакрилонитрила (соединение 1) по преодолению резистентности SN-38 или резистентности митоксантрону, и в табл. 3 показано действие по преодолению резистентности к SN-38 каждого тестированного производного дифенилакрилонитрила, выраженное как EC50. EC50 соответствует концентрации производного дифенилакрилонитрила,требуемой для 50% снижения значения относительной резистентности. Значение относительной резистентности получали делением IC50 (например, концентрации противоракового лекарственного средства,требуемой для 50% ингибирования роста клеток) для линии клеток A549/SN-38-4 на IC50 для линии клеток А 549. Чем больше значение относительной резистентности, тем выше уровень приобретенной резистентности. Результаты показывали, что каждое из производных дифенилакрилонитрила обладает мощным действием по преодолению резистентности к SN-38 или резистентности митоксантрону в линии клеток A549/SN-38. Когда концентрация производного дифенилакрилонитрила попадает в интервал, где наблюдается зависимость преодоления резистентности к противораковому лекарственному средству от- 26009048 концентрации производного, производное дифенилакрилонитрила само по себе не влияет на рост линии клеток А 549 и линии клеток A549/SN-38. Результаты позволяли предположить, что производное дифенилакрилонитрила в соответствии с данным изобретением ингибирует BCRP и преодолевает резистентность раковых клеток к противораковым лекарственным средствам. Таблица 3 Пример 7. Действие производного дифенилакрилонитрила по улучшению чувствительности линии клеток MCF-7 к противораковому лекарственному средству. Действие производного дифенилакрилонитрила на чувствительность раковых клеток к противораковому лекарственному средству изучали с применением линии клеток рака молочной железы человекаMCF-7, которая, как известно, экспрессирует BCRP (Blood 99, 3763-3770 (2002. Линию клеток MCF-7 суспендировали в 10% FBS/RPMI1640 и полученную суспензию инокулировали в 96-луночный микропланшет с последующим культивированием при 5% СО 2 и температуре 37 С в течение ночи (3103 клеток/50 мкл/лунка). Затем в каждую лунку добавляли раствор производного дифенилакрилонитрила и SN38 в 10% FBS/RPMI1640 (25 мкл) с последующим культивированием при 5% CO2 и температуре 37 С в течение 48 ч. После завершения культивирования количество жизнеспособных клеток рассчитывали с применением TetraColor ONE согласно прилагаемой инструкции по применению. В табл. 4 показано изменение чувствительности линии клеток MCF-7 к SN-38, вызванное производным дифенилакрилонитрила, выраженное через значения IС 50 (т.е. концентрации SN-38, требуемой для 50% ингибирования роста клеток). Результаты показывают, что каждое из производных дифенилакрилонитрила улучшает чувствительность линии клеток MCF-7 к SN-38. Когда концентрация производного дифенилакрилонитрила попадает в интервал, где наблюдается зависимость улучшения чувствительности к SN-38 от концентрации производного, производное дифенилакрилонитрила само по себе не влияет на рост линии клеток MCF-7. Результаты позволяют предположить, что производное дифенилакрилонитрила в соответствии с данным изобретением ингибирует BCRP и улучшает чувствительность раковых клеток к противораковым лекарственным средствам. Пример 8. Действие производного дифенилакрилонитрила по преодолению резистентности к противораковому лекарственному средству в линии клеток трансдуцированной человеческим BCRP лейкемии мышей Р 388. Линию клеток лейкемии мышей Р 388 или линию клеток, трансдуцированных человеческим BCRPfor Cancer Research), суспендировали в 10% FBS/RPMI1640 и полученную суспензию инокулировали в 96-луночный микропланшет (1104 клеток/50 мкл/лунка). Затем в каждую лунку добавляли раствор производного дифенилакрилонитрила и SN-38 в 10% FBS/RPMI1640 (25 мкл) с последующим культивированием при 5% CO2 и температуре 37 С в течение 48 ч. После завершения культивирования количество жизнеспособных клеток рассчитывали с применением TetraColor ONE согласно прилагаемой инструкции по применению. Результаты показаны на фиг. 6. Результаты показывают, что каждое из тестируемых производных дифенилакрилонитрила обладает мощным действием по преодолению резистентности кSN-38 в линии клеток P388/BCRP. Наоборот, производное дифенилакрилонитрила не влияет на чувствительность линии клеток Р 388 к SN-38. Результаты демонстрируют, что производное дифенилакрилонитрила в соответствии с данным изобретением обладает BCRP ингибирующим действием. Пример 9. Действие производного дифенилакрилонитрила на мультилекарственную резистентность линии клеток MES-SA/Dx5. Линию клеток рака матки человека MES-SA или линию клеток MES-SA/Dx5, которые получили мультилекарственную резистентность посредством чрезмерной экспрессии Р-гликопротеина [Cancer Res. 45, 4091-4096 (1985)], суспендировали в 10% FBS/DMEM и полученную суспензию инокулировали в 96 луночный микропланшет с последующим культивированием при 5% CO2 и температуре 37 С в течение ночи (3103 клеток/50 мкл/лунка). Затем в каждую лунку добавляли раствор производного дифенилакрилонитрила и паклитаксела в 10% FBS/DMEM (25 мкл), с последующим культивированием при 5% СО 2 и температуре 37 С в течение 48 ч. После завершения культивирования количество жизнеспособных клеток рассчитывали с применением TetraColor ONE согласно прилагаемой инструкции по применению. В табл. 5 показано действие каждого из тестированных производных дифенилакрилонитрила на мультилекарственную резистентность, выраженное в EC50. EC50 соответствует концентрации производного дифенилакрилонитрила, требуемой для 50% снижения значения относительной резистентности. Результаты показывают, что если концентрация производного дифенилакрилонитрила попадает в интервал, применяемый при тестировании, производное не влияет на резистентность к паклитакселу в линии клетокMES-SA/Dx5. Кроме того, производное дифенилакрилонитрила само по себе не влияет на рост линии клеток MES-SA и линии клеток MES-SA/Dx5. Результаты показывают, что производное дифенилакрилонитрила в соответствии с данным изобретением не воздействует на Р-гликопротеин и имеет специфичность к BCRP. Пример 10. Действие производного дифенилакрилонитрила на количество противоракового лекарственного средства, аккумулирующееся в линиях клеток, экпрессирующих BCRP. Линию клеток Р 388, или линию клеток P388/BCRP (1107 клеток/мл), или линию клеток MCF-7(3106 клеток/мл) суспендировали в 10% FBS/RPMI1640 (1 мл) и к полученной суспензии добавляли производное дифенилакрилонитрила и SN-38 (конечная концентрация 500 нг/мл) с последующим инкубированием при температуре 37 С в течение 60 мин. Затем проводили центрифугирование (2 С, 1400 хg,1 мин), и полученную надосадочную жидкость удаляли. К осажденным таким образом клеткам добавляли охлажденный на льду 10% FBS/RPMI1640 и клетки повторно в нем суспендировали с последующим центрифугированием (2 С, 1400xg, 1 мин) для промывания клеток. Снова проводили промывание с последующим добавлением PES (375 мкл) и клетки обрабатывали ультразвуком. К обработанным ультразвуком клеткам добавляли метанол (375 мкл) и 10% раствор сульфата цинка (15 мкл) и полученную смесь перемешивали с последующим центрифугированием (2 С, 12500 хg, 5 мин) и сбором надосадочной жидкости. Собранную надосадочную жидкость распределяли в белом 96-луночном микропланшете для измерения интенсивности флуоресценции (200 мк/лунку) и затем определяли количество SN-38, содержащегося в надосадочной жидкости с применением микропланшетного флуориметра (SN-38: длина волны возбуждения 380 нм, длина волны эмиссии 560 нм), тем самым получая количество внутриклеточной аккумуляции SN-38. Как понятно из результатов, представленных на фиг. 7, производное дифенилакрилонитрила в соответствии с данным изобретением увеличивает количество SN-38, аккумулированное в клетках линии P388/BCRP. Кроме того, из результатов, представленных на фиг. 8, видно, что производное дифенилакрилонитрила в соответствии с данным изобретением увеличивает количество SN-38, аккумулированное в клетках линии MCF-7. Результаты позволяли предположить, что производное дифенилакрилонитрила в соответствии с данным изобретением ингибирует BCRP и повышает количество аккумулированного внутри клетки противоракового лекарственного средства. Пример 11. Действие производного дифенилакрилонитрила по преодолению резистентности к противораковым лекарственным средствам in vivo. Применяли группы шестинедельных самок мышей CDF1, каждая из которых состоит из 5 мышей. Линию клеток Р 388 или линию клеток P388/BCRP (1106 клеток/мышь) имплантировали в полость брюшины каждой мыши. Начиная с одного дня и до десяти дней после имплантации опухоли, вводят производное дифенилакрилонитрила и иринотекан гидрохлорид (СРТ-11) внутрибрюшинно один раз в день(общее количество введений 10). До введения производное дифенилакрилонитрила растворяли или суспендировали в физиологическом растворе или смеси этанола, полиоксиэтилен (20) сорбитанмоноолеата[Tween 80 (торговое наименование), продукт Tokyo Kasei Kogyo Co., Ltd.] и 5% глюкозы (этанол/Tween 80/5% глюкоза = 5:5:90 или 5:7,5:87,5), а СРТ-11 растворяли в физиологическом растворе. Контрольной группе мышей вводят только растворитель. Для оценки противоракового действия производного дифенилакрилонитрила рассчитывали степень выживания Т/С (%), исходя из продолжительности жизни мышей в днях с имплантированной опухолью, с применением следующей формулы: Степень выживания Т/С (%)=(средняя продолжительность жизни мышей в днях в группе с лечением) (средняя продолжительность жизни мышей в днях в контрольной группе)100 Результаты показаны в табл. 6, 7 и 8. Результаты показывают, что производное дифенилакрилонитрила в соответствии с данным изобретением ингибирует BCRP in vivo и обладает эффектом преодоления резистентности противораковым лекарственных средствам.
МПК / Метки
МПК: A61P 35/00, A61K 31/7034, A61P 43/00, C07H 15/203, A61K 31/277, C07C 255/37
Метки: bcrp, молочной, белка, резистентности, ингибитор, рака, железы
Код ссылки
<a href="https://eas.patents.su/30-9048-ingibitor-belka-rezistentnosti-raka-molochnojj-zhelezy-bcrp.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибитор белка резистентности рака молочной железы (bcrp)</a>
Предыдущий патент: Способы получения алкалоидов хиназолина
Следующий патент: Четвертичные хелидониновые и алкалоидные производные, способ их получения и их применение в производстве лекарственных средств
Случайный патент: Способ осаждения тонких пленок посредством лазерной абляции












