Способ получения r-альфа-пропил-пиперониламина и его аналогов, промежуточные продукты, используемые в этом способе.
Номер патента: 1207
Опубликовано: 25.12.2000
Авторы: Вальтермир Роберт Юджин, Анзалоне Луиджи, Ли Хью-Йин
Формула / Реферат
1. Способ получения R-a-пропил-пиперониламина формулы I:
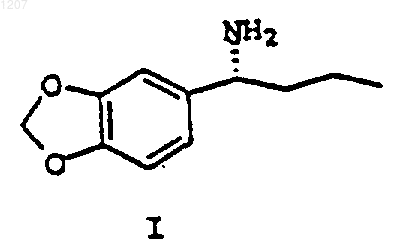
или его стереоизомера, или соли, включающий:
(а) взаимодействие соединения формулы II:
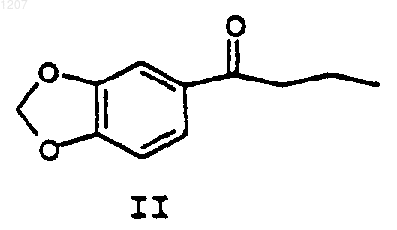
с хиральным метилбензиламином с получением соединения формулы III:

или его стереоизомера, где R выбирают из Н, ОН и ОСН3;
(b) гидрирование полученного соединения формулы III или его стереоизомера, или соли в присутствии Ra-Ni (Ni Ренея) с получением соединения формулы IV:
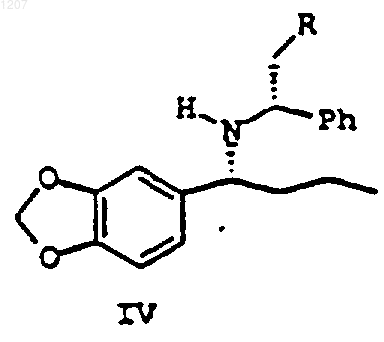
или его диастереомера, или соли, где гидрирование проводят в условиях, выбираемых из
(bi) давление водорода около 0,0007-0,703 кг/см2 (0,01-10 пси) при одной и той же температуре от 0-100шС в течение около 2-30 ч или 0,703-210,9 кг/см2 (10-3000 пси) при одной и той же температуре от 60 до 80шС в течение около 2-30 ч; или
(bii) давление водорода около 0,0007-210,9 кг/см2 (0,01-3000 пси) при одной температуре в течение около 2-8 ч и другой температуре в течение около 2-24 ч, где первая температура составляет от 0-35шС и вторая температура составляет от 50-100шС; и
(с) гидрирование соединения формулы IV или его стереоизомера или соли в присутствии палладия на угле и растворителя, выбранного из спирта, карбоновой кислоты, дикарбоновой кислоты, ароматической карбоновой кислоты и их смесей, с образованием соединения формулы I или его стереоизомера,или соли;
при условии, что соединение формулы IV, гидрированное на стадии (с), не является бромистоводородной солью.
2. Способ по п.1, где на стадии (а) хиральный метилбензиламин является R-a-метилбензиламином, на стадии (b) R является Н, и на стадии (с) R является Н и растворитель выбирают из C1-3спирта, С2-4карбоновой кислоты и их смесей.
3. Способ по п.2, где гидрирование на стадии (b) проводят в условиях (bi) при давлении водорода 0,0007-0,703 кг/см2 (0,01-10 пси); и
гидрирование на стадии (с) проходит в смеси C1-3спирта и С2-4кислоты, где спирт и кислота присутствуют в соотношении от 30:1 до 1:10.
4. Способ по п.3, где стадию гидрирования (bi) проводят при давлении водорода 0,0007-0,141 кг/см2 (0,01-2 пси) при температуре от 20 до 60шС в течение от 3-24 ч; и
на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1.
5. Способ по п.4, где стадию гидрирования (bi) проводят при давлении водорода 0,0007-0,070 кг/см2 (0,01-1 пси) при температуре, выбираемой из температуры окружающей среды или от 50 до 60шС, в течение от 3-12 ч; и
стадию гидрирования (с) проводят в этаноле и уксусной кислоте в соотношении от 20:1 до 8:1.
6. Способ по п.4, где стадию гидрирования (bi) проводят при давлении водорода 0,0007-0,070 кг/см2 (0,01-1 пси) при температуре, выбираемой из температуры окружающей среды или от 50 до 60шС, в течение от 3-12 ч; и
стадию гидрирования (с) проводят в метаноле и уксусной кислоте в соотношении от 20:1 до 8:1.
7. Способ по п.3, где на стадии (с) присутствует от 1 до 4 эквивалентов кислоты, исходя из количества соединения IV.
8. Способ по п.3, где на стадии (с) присутствует около 2 эквивалентов кислоты, исходя из количества соединения IV.
9. Способ по п.2, где стадию гидрирования (b) проводят в условиях (bi) при давлении водорода 0,703-70,3 кг/см2 (10-1000 пси) при температуре от 60 до 80шС в течение 3-24 ч.
10. Способ по п.9, где стадию гидрирования (bi) проводят при давлении водорода 3,515-35,15 кг/см2 (50-500 пси).
11. Способ по п.1, где стадию гидрирования (b) проводят в условиях (bii); и
стадию гидрирования (с) проводят в смеси C1-3спирта и C2-4кислоты, где спирт и кислота присутствуют в соотношении от 30:1 до 1:10.
12. Способ по п.11, где стадию гидрирования (bii) проводят при давлении водорода от 3,515-35,15 кг/см2 (50-500 пси) при первой температуре от 20-30шС в течение 3-6 ч и второй температуре 60-80шС в течение 6-18 ч; и
на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1.
13. Способ по п.12, где стадию гидрирования (bii) проводят при давлении водорода от 3,515-35,15 кг/см2 (50-500 пси) при первой температуре от 20-30шС в течение 3-6 ч и второй температуре 60-80шС в течение 10-15 ч; и
на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1.
14. Способ по п.13, где стадию гидрирования (bii) проводят при давлении водорода от 7,03-21,09 кг/см2 (100-300 пси) при первой температуре, которая является температурой окружающей среды, в течение около 3, 4, 5 или 6 ч и второй температуре 65-75шС в течение около 10, 11, 12, 13, 14 или 15 ч; и стадию гидрирования (с) проводят в этаноле и уксусной кислоте при соотношении от 20:1 до 8:1.
15. Способ по п.13, где стадию гидрирования (bii) проводят при давлении водорода от 7,03-21,09 кг/см2 (100-300 пси) при первой температуре, которая является температурой окружающей среды, в течение около 3, 4, 5 или 6 ч и второй температуре 65-75шС в течение около 10, 11, 12, 13, 14 или 15 ч; и стадию гидрирования (с) проводят в метаноле и уксусной кислоте при соотношении от 20:1 до 8:1.
16. Способ по п.11, где на стадии (с) присутствует от около 1 до 4 эквивалентов кислоты, исходя из количества соединения IV.
17. Способ по п.11, где на стадии (с) присутствует около 2 эквивалентов кислоты, исходя из количества соединения IV.
18. Способ получения R-a-пропил-пиперониламина формулы I:
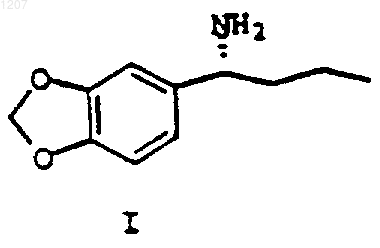
или его стереоизомера, или соли, включающий:
(d) взаимодействие соединения формулы V:
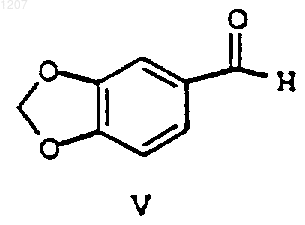
с хиральным метилбензиламином с образованием соединения формулы VI:
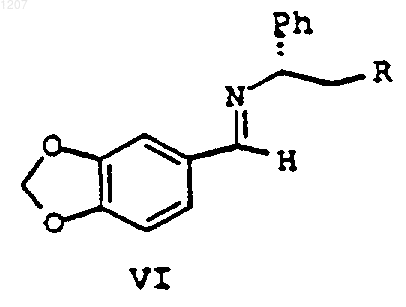
или его стереоизомера или соли, где R является Н, ОН или ОСН3;
(е) взаимодействие полученного соединения формулы VI или его стереоизомера, или соли с аллилмагний бромидом в растворителе
с образованием соединения формулы VII:
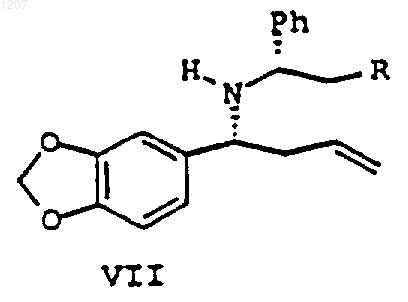
или его диастереоизомера или соли, где R является Н, ОН или ОСН3 и диастереомерный избыток составляет, по крайней мере, 75%; и
(f) гидрирование полученного соединения формулы VII или его диастереомера, или соли в присутствии палладия на угле в С1-3спирте и С2-4карбоновой кислоте с образованием соединения формулы I или его стереоизомера, или соли;
при условии, что на стадии (е) не присутствует цериевый реагент.
19. Способ по п.18, где хиральный метилбензиламин на стадии (d) является S-фенилглицинолом и R является ОН на стадиях (е) и (f).
20. Способ по п.19, где на стадии (е) диастереомерный избыток составляет, по крайней мере, 85%; и на стадии (f) спирт выбирают из метанола и этанола, и кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 10:1 до 1:10.
21. Способ по п.20, где на стадии (е) диастереомерный избыток составляет, по крайней мере, 90%; и
на стадии (f) спирт является этанолом, и соотношение спирта и кислоты составляет от 10:1 до 1:1.
22. Способ по п.20, где на стадии (е) диастереомерный избыток составляет, по крайней меЁх, 90%; и
на стадии (f) спирт является метанолом, и соотношение спирта и кислоты составляет от 10:1 до 1:1.
23. Способ по п.19, где на стадии (е) в качестве растворителя используют тетрагидрофуран.
24. Соединение формулы IV:
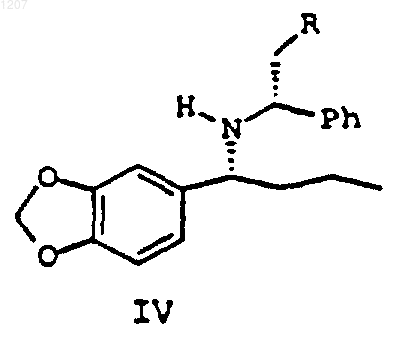
где R выбирают из Н, ОН и ОСН3, или его стереоизомеры, или соли.
25. Соединение по п.24, где R является Н.
26. Соединение по п.25, где соединение формулы IV представляет собой соль миндальной кислоты.
27. Соединение формулы VII:
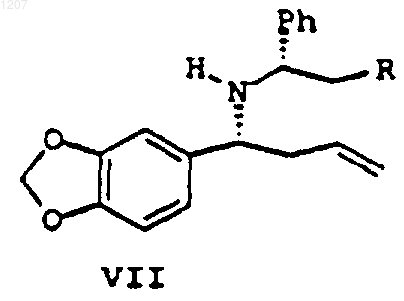
где R выбирают из Н, ОН и ОСН3, или его стереоизомеры,или соли.
28. Соединение по п.27, где R является ОН.
29. Соединение по п.28, где соединение формулы VII представляет собой соль винной кислоты.
Текст
1 Область техники Данное изобретение, в основном, относится к способу получения Rпропил-пиперониламина и его аналогов, которые используются в качестве промежуточных соединений при получении ингибиторов эластазы, и промежуточных соединений при получении Rпропил-пиперониламина. Уровень техники селективный, нетоксичный, перорально активный ингибитор человеческой эластазы, в настоящий момент оценивают для лечения кистозного фиброза. Следовательно, для проведения исследований по разработке препарата необходимы большие количества (EI). Описаны синтетические пути получения соединений, подобных (EI); см., например, ЕР 0 481 671, в котором предполагается, что (EI) может быть образован реакцией присоединения замещенной циклической лактамной части (EI) с Rпропил-пиперонилом через карбонильную связь. Rпропил-пиперониламин, хиральный амин, может поэтому быть важным промежуточным соединением в этом процессе, если известен эффективный, имеющий промышленные масштабы способ получения.Humphrey и др. в патенте U.S.5 149 838 предлагают образование (R)-1-(бензо[]фуран 5-ил)-1-аминобутана из 5-бромбензо[]фурана. Описанный способ включает в качестве последней стадии превращение (S)-1-(бензо[]фуран 5-ил)-1-бутанола в (R)-1-(бензо[]фуран-5-ил)1-аминобутан в условиях Mitsonobu. К сожалению, при использовании процесса Mitsonobu для синтеза R- или Sпропил-пиперониламина, промежуточного соединения, используемого для получения соединений, подобныхEI, преобладали побочные реакции и стереохимические потери.Bringmann и др. в DE 3 819 438 описывают образование хиральных аминов взаимодействием арил-замещенных кетонов с хиральным метилбензиламином, гидрированием полученного имина над Ra-Ni при 1-200 бар и температуре от 20 до 60 С и удалением фенэтильной группы гидрированием над Pd/C при 1-200 бар и температуре от 20 до 50 С. Bringmann и др. в Tetr.Lett. 1989, 30(3), 317 отмечают снижение количества хиральных иминов, образованных с использованием Sметилбензиламина, гидриро 001207Bringmann и др. в Synlett 1990, 253 отмечают снижение количества хиральных иминов, образованных с использованием Sметилбензиламина, гидрированием при 60 бар с Pd/C или сAnn. Chem. 1990, 795 описывают в деталях гидрогенолиз N-(1-фенилэтил)-1-арилэтиламинов с использованием либо водорода и палладия на угле в течение трех недель, либо формиата аммония и палладия на угле. Тем не менее, авторы данного изобретения обнаружили, что гидрогенолиз (R)-N-[1-(1,3-бензодиоксол-5-ил)бутилиден]метилбензол-метанамина с использованием методик, описанных у Bringmann и др.,был либо очень медленным, либо сопровождался рацемизацией Rпропил-пиперониламина.Eleveld и др., J. Оrg. Chem. 1986, 51, 3635,описывают гидрирование хиральных иминов, в частности, N-(метил(о-метокси)бензилиден)-метилбензиламина. Гидрирование с Pd/C и водородом при давлении 3 кг/см 2 позволяет получить более чем 90% ди (диастереомерный избыток) SS изомера. Для сравнения, соответствующий м-метоксиимин позволяет получить только 67% ди. Высокий уровень ди, полученный при использовании о-метоксисоединения, объясняют пространственным затруднением, обусловленным о-метоксигруппой. Понятно, что R- и S-пропил-пиперониламины содержат только малкоксигруппы. Таким образом, методикаEleveld и др. не предполагает быть использованной для получения R- и Sпропилпиперониламинов.Ukaji и др., Chem. Lett. 1991, 173, отмечают, что взаимодействие эфиров оксима с аллилмагний бромидом дает незначительную диастереоселективность. Если эфир оксима разделяют на его Е и Z изомеры, то аллилмагний бромид,объединенный с хлоридом церия, дает ди в интервале от 50 до 72%. Основываясь на данном источнике, потребность в хлориде церия может возникнуть, если в качестве промежуточной стадии при образовании R- или Sпропилпиперониламина используют реакцию Гриньяра. Тем не менее, добавления хлорида церия обычно избегают, и показатель 50-72% ди является довольно низким.Wu и др., J. Оrg. Chem. 1991, 56, 1340, описывают диастереоселективное добавление реактивов Гриньяра (например, метила, этила и бутила) к 2-арил-1,3-оксазолидинам. Снова отмечают трихлорид церия как увеличивающий диастереоселективность добавления реактивов Гриньяра. Добавление метилмагний бромида к п-метоксифенил-4-фенил-1,3-оксазолидину дает высокую диастереоселективность, но только с 45% выходом. Такой низкий уровень выхода неприемлем для промышленных целей. 3 Гриньяра к хиральным алифатическим иминам,производным от (R)-O-метилфенилглицинола. Однако, используется трихлорид церия. Удаление фенилглицинола достигается гидрированием над гидроксидом палладия в этилацетате. Основываясь на приведенных выше статьях, можно заметить, что трудно эффективно получать R- и Sпропил-пиперониламины в больших количествах без использования нежелательных реактивов. Таким образом, желательно найти новую методику синтеза для производства Rпропил-пиперониламина и его аналогов в промышленных масштабах. Описание изобретения Соответственно, одним объектом данного изобретения является новый способ получения соединения формулы I: или его стереоизомеров или солей. Другим объектом данного изобретения являются новые соединения формул IV и VII, определенных ниже, которые используются в качестве промежуточных для соединений формулы I. Эта и другие цели, которые станут очевидными из последующего подробного описания,могут быть достигнуты, используя открытие,сделанное авторами данного изобретения о том,что соединение формулы I или его стереоизомеры или соли образуются с высоким выходом при использовании региоселективного способа,включающего: с хиральным метилбензиламином с получением соединения формулы III:(b) гидрирование соединения формулы III или его стереоизомера, или соли в присутствииRa-Ni с получением соединения формулы IV: или его диастереомера, или соли, где гидрирование проводят в условиях, выбираемых из(bi) давление водорода около 0,0007-210,9 кг/см 2 (0,01-3000 пси) при одной и той же температуре; или(bii) давление водорода около 0,0007-210,9 кг/см 2 (0,01-3000 пси) при одной температуре и другой температуре, большей чем первая температура; и(c) гидрирование полученного соединения формулы IV или его стереоизомера, или соли с образованием соединения формулы I или его стереоизомера, или соли; или с хиральным метилбензиламином с образованием соединения формулы VI: или его стереоизомера или соли, где R является Н, ОН или ОСН 3;(е) взаимодействие полученного соединения формулы VI или его стереоизомера, или соли с аллилмагний бромидом с образованием соединения формулы VII: или его диастереоизомера, или соли, где R является Н, ОН или ОСН 3; и(f) гидрирование полученного соединения формулы VII или его диастереомера, или соли в присутствии палладия на угле с образованием соединения формулы I или его стереоизомера,или соли. Подробное описание изобретения[1] Таким образом, в первом варианте,данное изобретение относится к способу получения соединения формулы I: или его стереоизомера или соли, включающему: с хиральным метилбензиламином с получением соединения формулы III:(b) гидрирование полученного соединения формулы III или его стереоизомера, или соли в присутствии Ra-Ni с получением соединения формулы IV; или его диастереомера или соли, где гидрирование проводят в условиях, выбираемых из(bi) давление водорода около 0,0007-0,703 кг/см 2 (0,01-10 пси) при одной и той же температуре от 0-100 С в течение около 2-30 ч или 0,703-210,9 кг/см 2 (10-3000 пси) при одной и той же температуре от 60 до 80 С в течение около 230 ч; или(bii) давление водорода около 0,0007-210,9 кг/см 2 (0,01-3000 пси) при одной температуре в течение около 2-8 ч и другой температуре в течение около 2-24 ч первая температура от 035 С и вторая температура от 50-100 С; и(с) гидрирование полученного соединения формулы IV или его стереоизомера, или соли в присутствии палладия на угле и растворителя,выбранного из спирта, карбоновой кислоты,дикарбоновой кислоты, ароматической карбоновой кислоты и их смесей, с образованием соединения формулы I или его стереоизомера или соли; при условии, что соединение формулы IV,гидрированное на стадии (с), не является бромистоводородной солью.Rметилбензиламином, на стадии (b) R является Н, и на стадии (с) R является Н и растворитель выбирают из C1-3 спирта, С 2-4 карбоновой кислоты и их смесей.(bi); и гидрирование на стадии (с) проходит в смеси C1-3 спирта и С 2-4 кислоты, где спирт и кислота присутствуют в соотношении от 30:1 до 1:10.[4] В еще более предпочтительном варианте, стадия гидрирования (bi) проходит при давлении водорода 0,0007-0,141 кг/см 2 (0,01-2 пси) при температуре от 20 до 60 С в течение от 3-24 ч; и на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1.[5] В более предпочтительном варианте,стадия гидрирования (bi) проходит при давлении водорода 0,0007-0,070 кг/см 2 (0,01-1 пси) при температуре, выбираемой из температуры окружающей среды или от 50 до 60 С, в течение от 3-12 ч; и стадия гидрирования (с) проходит в этаноле и уксусной кислоте в соотношении от 20:1 до 8:1.[6] В другом предпочтительном варианте,стадия гидрирования (bi) проходит при давлении водорода 0,0007-0,070 кг/см 2 (0,01-1 пси) при температуре, выбираемой из температуры окружающей среды или от 50 до 60 С, в течение от 3-12 ч; и стадия гидрирования (с) проходит в метаноле и уксусной кислоте в соотношении от 20:1 до 8:1.[7] В другом более предпочтительном варианте, на стадии (с) присутствует от 1 до 4 эквивалентов кислоты, исходя из количества соединения IV.[8] В другом более предпочтительном варианте, на стадии (с) присутствует около 2 эквивалентов кислоты, исходя из количества соединения IV.[9] В еще более предпочтительном варианте, стадия гидрирования (b) проходит в условиях (bi) с давлением водорода 0,703-70,3 кг/cм 2(10-1000 пси) при температуре от 60 до 80 С в течение 3-24 ч.[10] В другом предпочтительном варианте,стадия гидрирования (bi) проходит при давлении водорода 3,515-35,15 кг/см 2 (50-500 пси).[11] В другом более предпочтительном варианте, стадия гидрирования (b) проходит в условиях (bii); и стадия гидрирования (с) проходит в смеси C1-3 спирта и С 2-4 кислоты, где спирт и кислота присутствуют в соотношении от 30:1 до 1:10.[12] В более предпочтительном варианте,стадия гидрирования (bii) проходит при давлении водорода от 3,515-35,15 кг/см 2 (50-500 пси) при первой температуре от 20-30 С в течение 36 ч и второй температуре 60-80 С в течение 6-18 ч; и на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1.[13] В более предпочтительном варианте,стадия гидрирования (bii) проходит при давлении водорода от 3,515-35,15 кг/см 2 (50-500 пси) при первой температуре от 20-30 С в течение 36 ч и второй температуре 60-80 С в течение 1015 ч; и на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1.[14] В дальнейшем предпочтительном варианте, стадия гидрирования (bii) проходит при давлении водорода от 7,03-21,09 кг/см 2 (100-300 пси) при первой температуре, которая является температурой окружающей среды, в течение около 3, 4, 5 или 6 ч и второй температуре 65 7 75 С в течение около 10, 11, 12, 13, 14 или 15 ч; и стадия гидрирования (с) проходит в этаноле и уксусной кислоте и соотношении от 20:1 до 8:1.[15] В дальнейшем предпочтительном варианте, стадия гидрирования (bii) проходит при давлении водорода от 7,03-21,09 кг/см 2 (100-300 пси) при первой температуре, которая является температурой окружающей среды, в течение около 3, 4, 5 или 6 ч и второй температуре 6575 С в течение около 10, 11, 12, 13, 14 или 15 ч; и стадия гидрирования (с) проходит в метаноле и уксусной кислоте и соотношении от 20:1 до 8:1.[16] В другом более предпочтительном варианте, на стадии (с) присутствует от около 1 до 4 эквивалентов кислоты, исходя из количества соединения IV.[17] В другом еще более предпочтительном варианте, на стадии (с) присутствует около 2 эквивалентов кислоты, исходя из количества соединения IV.[18] Во втором варианте, данное изобретение относится к способу синтеза соединения формулы I:[19] В более предпочтительном варианте,хиральный метилбензиламин на стадии (d) является S-фенилглицинолом и R является ОН на стадиях (е) и (f).[20] В другом более предпочтительном варианте, на стадии (е) диастереомерный избыток составляет, по крайней мере, 85%; и на стадии(f) спирт выбирают из метанола и этанола и кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 10:1 до 1:10.[21] В другом более предпочтительном варианте, на стадии (е) диастереомерный избыток составляет, по крайней мере, 90%; и на стадии(f) спирт является этанолом, и соотношение спирта и кислоты составляет от 10:1 до 1:1.[22] В другом более предпочтительном варианте, на стадии (е) диастереомерный избыток составляет, по крайней мере, 90%; и на стадии(f) спирт является метанолом, и соотношение спирта и кислоты составляет от 10:1 до 1:1.[23] В более предпочтительном варианте,на стадии (е) в качестве растворителя используют тетрагидрофуран.[24] В третьем варианте, данное изобретение относится к новым соединениям формулы или его стереоизомера или соли, включающему: с хиральным метилбензиламином с образованием соединения формулы VI: или его стереоизомера,или соли, где R является Н, ОН или ОСН 3;(е) взаимодействие полученного соединения формулы VI или его стереоизомера, или соли с аллилмагний бромидом с образованием соединения формулы VII: или его диастереоизомера, или соли, где R является Н, ОН или ОСН 3, и диастереомерный избыток составляет, по крайней мере, 75%; и(f) гидрирование соединения формулы VII или его диастереомера, или соли в присутствии палладия на угле в C1-3 спирте и С 2-4 карбоновой кислоте с образованием соединения формулы I или его стереоизомера, или соли; при условии,что на стадии (е) не присутствует цериевый реагент.[26] В другом предпочтительном варианте соединение формулы IV является солью миндальной кислоты.[27] В четвертом варианте данное изобретение относится к новым соединениям формулы[29] В другом более предпочтительном варианте соединение формулы VII является солью винной кислоты. Реакции данных способов синтеза проходят в подходящих растворителях, если нет других указаний, которые могут быть легко выбраны любым специалистом в области органического синтеза, указанные подходящие растворители, в основном, являются любыми растворителями, которые не реагируют с исходными материалами (реагентами), промежуточными со 9 единениями или продуктами реакции при температурах, при которых проходят реакции, например, температурах, которые могут изменяться от температуры замерзания растворителя до температуры кипения растворителя. Данные реакции могут проходить в одном растворителе или смеси более чем одного растворителя. В зависимости от конкретной стадии реакции,могут быть выбраны подходящие для конкретной стадии реакции растворители. Подходящие эфирные растворители включают: диметоксиметан, тетрагидрофуран, 1,3 диоксан, 1,4-диоксан, фуран, диэтиловый эфир,этиленгликоль диметиловый эфир, этиленгликоль диэтиловый эфир, диэтиленгликоль диметиловый эфир, диэтиленгликоль диэтиловый эфир, триэтиленгликоль диметиловый эфир или трет-бутил метиловый эфир."Стабильное соединение" или "стабильная структура" означают соединение, которое является достаточно стойким при выделении из реакционной смеси до приемлемой степени чистоты и при приготовлении в виде эффективного терапевтического агента. Описанные здесь соединения могут иметь асимметрические центры. Все хиральные, диастереомерные и рацемические формы включены в объем данного изобретения. Геометрические изомеры олефинов, C=N двойные связи и подобные могут присутствовать в описанных здесь соединениях, и все указанные стабильные изомеры представлены в данном изобретении. Должно быть понятным, что определенные соединения данного изобретения содержат асимметрически замещенный атом углерода и могут быть выделены в виде оптически активных или рацемических форм. Кроме того, понятно, что цис- и транс-геометрические изомеры соединений данного изобретения описаны и могут быть выделены в виде смеси изомеров или как отдельные изомерные формы. Все хиральные,диастереомерные, рацемические формы и все геометрические изомерные формы структуры включены в данное изобретение, если специфическая стереохимия или изомерная форма не отмечена особо. Соли, в данном случае, являются солями соединений, которые взаимодействовали с органическими, хиральными или ахиральными,или неорганическими кислотами. Примеры хиральных и ахиральных органических кислот,хорошо известных специалистам в данной области, включают, но не ограничиваются ими,миндальную кислоту, винную кислоту, щавелевую кислоту и п-толуолсульфокислоту. Примеры неорганических кислот, хорошо известных специалистам в данной области, включают, но не ограничиваются ими, соляную кислоту, фосфорную кислоту и серную кислоту. В данном случае спирт предпочтительно является C1-3 спиртом, который представляет метанол, этанол, н-пропанол и изопропанол, 001207 10 предпочтительно метанол или этанол. Карбоновая кислота или дикарбоновая кислота представляет С 2-4 карбоновую или дикарбоновую кислоту, примеры которой включают, но не ограничиваются ими, уксусную кислоту, пропионовую кислоту, масляную кислоту, щавелевую кислоту, малоновую кислоту и янтарную кислоту, предпочтительно уксусную кислоту. Ароматическая карбоновая кислота представляет карбоновые кислоты, прикрепленные к фенильному кольцу, например, бензойную кислоту. Соотношение спирта и кислоты в данном случае является соотношением объема к объему. Хиральный метилбензиламин в данном случае является либо R, либо S стереоизомером следующей структуры: где R является Н, ОН или ОСН 3. Примеры включают, но не ограничиваются ими, R-метилбензиламин, Sметилбензиламин, Sфенилглицинол и R-фенилглицинол, предпочтительно Rметилбензиламин или S-фенилглицинол. Цериевый реагент в данном случае включает цериевые соединения, известные специалистам в данной области, используемые в качестве хелатирующего агента для кислоты Льюиса при добавлении реактива Гриньяра. Причем полезность определяется как обеспечение повышенной селективности добавлением реактива Гриньяра по сравнению с реакциями, где цериевый реагент не используется. Такие цериевые реагенты включают inter alia хлорид церия, а также органоцериевые реагенты. Данное изобретение рассматривается как применимое на практике для, по крайней мере,мультиграммовых масштабов, килограммовых масштабов, мультикилограммовых масштабов и промышленных масштабов. Мультиграммовый масштаб в данном случае является предпочтительно масштабом, где, по крайней мере, один исходный материал присутствует в количестве 10 г или более, более предпочтительно, по крайней мере, 50 г или более, даже более предпочтительно, по крайней мере, 100 г или более. Мультикилограммовый масштаб в данном случае означает масштаб, при котором используется более чем один килограмм, по крайней мере,одного исходного материала. Промышленный масштаб в данном случае означает такой масштаб, который отличается от лабораторного масштаба и которого достаточно для того, чтобы обеспечить продукт в количестве, достаточном для проведения клинических тестов или поставки покупателям. Высокий выход, в том смысле как он используется здесь, означает общий выход про 11 дукта из исходных материалов, по крайней мере, 45% от теоретического, предпочтительно 50%, более предпочтительно 55% и даже более предпочтительно 60%. Синтез При помощи примеров и без ограничений,данное изобретение может быть далее понятно из схемы 1, представленной ниже. Эта схема детализирует основной способ получения соединения формулы I или его стереоизомера, или фармацевтических солей из соединений формул Для соединения I гидрохлоридной солью является соединение Iа. Для соединения IV SR диастереомером является соединение IVa, солью миндальной кислоты является соединениеIVb и гидрохлоридной солью является соединение IVc. Для соединения VII солью винной кислоты является соединение VIIa и SS диастереомером является соединение VIIb. Указанная выше схема (R=H, ОН или ОСН 3) и следующее описание относится только к Rпропил-пиперониламину. Однако, как понятно любому специалисту в данной области,данное изобретение может быть использовано для получения как R, так и S энантиомеров в зависимости от того, какой энантиомер хирального амина используется или на стадии а, или на стадии d. Таким образом, указанная выше схема и дальнейшее описание не ограничено только получением Rпропил-пиперониламина, но также в основном описывает синтез R- и S-пропил-пиперониламина. В первом варианте, данное изобретение относится к способу получения соединения формулы I посредством стадий а, b и с, показанных выше. Соединение II может быть получено известными способами из известных исходных материалов. Например, 1,3-бензодиоксол, который коммерчески доступен от Aldrich ChemicalCompany, может быть легко превращен в соединение II путем взаимодействия с масляным ан 001207 12 гидридом в дихлорэтане в присутствии газообразного ВF3. Стадия а: Имин III может быть образован из кетонаII путем взаимодействия соединения II с хиральным метилбензиламином в присутствии триэтиламина, тетрахлорида титана и толуола при кипячении с обратным холодильником. Предпочтительно, в качестве хирального амина используют Rметилбензиламин. Специалистам в данной области будет понятно, что для того, чтобы получить соединение III, если R является ОН или ОСН 3, необходимо использовать соответствующим образом замещенный R-метилбензиламин. Предпочтительно используют, по крайней мере, стехиометрическое количество хирального амина, основанное на количестве кетона II. Избыток хирального амина может быть использован для увеличения выхода или снижения времени реакции. Для образования имина III из кетона II должны быть использованы другие условия удаления воды, известные специалистам в данной области. Ожидается получение смеси Е и Z изомеров соединения III,хотя Е изомер должен доминировать. Стадия b: Селективное гидрирование соединения III с получением соединения IV проводят, используя Ra-Ni в качестве катализатора. Предпочтительно, от 1 до 15 мас.% катализатора, основываясь на количестве используемого соединенияIII, более предпочтительно, от 5 до 10 мас.%, и еще более предпочтительно, около 10 мас.%. Растворители, которые могут быть использованы на этой стадии, включают, но не ограничиваются ими, тетрагидрофуран, метанол, этанол и толуол. Предпочтительно, в качестве растворителя используют этанол или метанол. Может быть использована комбинация растворителей. Например, может быть использован толуол и этанол в соотношении 1:9. Может быть использовано большее или меньшее количество толуола, например, от 10:1 до 1:10, но, в основном,при повышении объема толуола реакция замедляется. Стадия b может быть начата при одной и той же температуре или при двух температурах,и температура может находиться в интервале от-78 С до 150 С, предпочтительно от 0 до 100 С. Предпочтительно, если используют одну температуру, она должна составлять от 0 до 70 С, более предпочтительно, от 20 до 60 С, и еще более предпочтительно, температура окружающей среды или 50, 51, 52, 53, 54, 55, 56, 57,58, 59 или 60 С. Если используют одну температуру, давление водорода предпочтительно должно находиться в интервале от 0,0007-0,703 кг/см 2 (0,01-10 пси), более предпочтительно 0,0007-0,141 кг/см 2 (0,01-2 пси) и еще более предпочтительно 0,007-0,07 кг/см 2 (0,01-1 пси). Предпочтительное время реакции, если исполь 13 зуют одну температуру, составляет от 2 до 30 ч,более предпочтительно от 3 до 24 ч и еще более предпочтительно 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 ч. Целью использования низкого давления водорода (например,0,703 кг/см 2 (10 пси для восстановления при одной температуре является то, что, как обнаружено, повышение давления приводит к снижению стереоселективности. Как описано далее в примере 1, диастереоселективность 86 достигается гидрогенолизом при давлении водорода 0,07 кг/см 2 (1 пси) при температуре окружающей среды. Для сравнения, при использовании тех же условий, но повышении давления водорода до 3,515 кг/см 2 (50 пси), диастереоселективность падает до 75%. Стадия b также может быть начата при одной температуре при более высоком давлении водорода, если температура составляет от 60 до 100 С, предпочтительно от 60 до 80 С, более предпочтительно 60, 62, 64, 66, 68, 70, 72, 74, 76,78 или 80 С. При этих температурах может быть использовано давление водорода от 0,703 до 210,9 кг/см 2 (10-3000 пси), предпочтительно 0,703-70,3 кг/см 2 (10-1000 пси) и более предпочтительно от 3,515 до 35,15 кг/см 2 (50-500 пси). Предпочтительно время реакции, если используют одну температуру, составляет от 2 до 30 ч,более предпочтительно от 3 до 24 ч, еще более предпочтительно 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 ч. Как отмечено выше, высокие уровни давления водорода могут быть полезными, поскольку загрузка катализатора может быть уменьшена,по сравнению с загрузкой в реакциях при низком давлении. Если используют две температуры, реакцию проводят в две стадии. Первая стадия предпочтительно проводится при температуре от 0 до 35 С, более предпочтительно от 20 до 30 С, еще более предпочтительно при температуре окружающей среды. Первая стадия предпочтительно проводится в течение 2-8 ч, более предпочтительно 3-6 ч, и еще более предпочтительно в течение 3, 4, 5 или 6 ч. Вторая стадия предпочтительно проводится при температуре от 40 до 100 С, более предпочтительно от 60 до 80 С, еще более предпочтительно от 65 до 75 С и еще более предпочтительно при температуре 65, 66, 67, 68, 69, 70, 71, 72, 73, 74 или 75 С. Вторая стадия предпочтительно проходит в течение 2-24 ч, более предпочтительно в течение 6-18 ч, еще более предпочтительно в течение 10-15 ч, и еще более предпочтительно в течение 10, 11, 12, 13, 14 или 15 ч. Давление водорода предпочтительно находится в интервале от 0,0007 до 210,9 кг/см 2 (0,01-3000 пси), более предпочтительно 3,515-35,15 кг/см 2 (50-500 пси), еще более предпочтительно 7,03-21,09 кг/см 2 (100-300 пси). Как может определить любой специалист в данной области, в промышленном производстве предпочтительно использовать давление водорода более чем 0,703 кг/см 2(10 пси). Это позволяет загружать меньшее количество катализатора и упрощает или, по крайней мере, делает аппараты легко доступными, что помогает сэкономить средства. Предпочтительно, после прохождения первой стадии, реакционную смесь нагревают до температуры второй стадии. Нагревание может проводиться по методикам, известным специалистам в данной области. Обнаружено, что диастереоселективность,получаемая в данной двухтемпературной стадии гидрирования, может считаться подтверждением того, что количество anti-имина III уменьшается гораздо быстрее, чем syn-имина при использовании никеля Ренея/Н 2. Так как Kas и Кsa в значительной степени зависят от температуры,простое повышение температуры может привести к тому, что syn-имин изомеризуется в antiимин, количество которого затем стремительно уменьшается. Это иллюстрируется следующей схемой. При начале реакции гидрогенолиза при температуре окружающей среды снижается количество присутствующего преобладающегоanti-имина. Затем температуру поднимают, что способствует взаимному превращению двух изомеров. Как только образуется anti-имин, его количество начинает стремительно уменьшаться. Таким образом получают высокую диастереоселективность. Диастереомерный избыток ди (RR по отношению к SR для соединений IV и IVa, соответственно), получаемый на стадии с, составляет предпочтительно, по крайней мере, 80%(100% является максимумом), более предпочтительно, по крайней мере, 85% и еще более предпочтительно, по крайней мере, 90%. Время реакции зависит от ряда переменных, включая давление водорода, растворитель и температуру. Реакция может контролироваться при помощи обычной методики ВЭЖХ для определения момента, когда гидрирование имина будет завершено. После образования соединения IV его диастереомерная чистота может быть увеличена образованием соли с органической кислотой. Например, сырое или неочищенное соединениеIV может быть диастереомерно очищено растворением в ацетонитриле, включающем Sминдальную кислоту, и отделением осажденной соли миндальной кислоты. Могут быть использованы любые кислоты, известные специалистам в данной области, включая хиральные и ахиральные кислоты (например, щавелевая кислота) и неорганические кислоты, которые образуют соль в виде кристаллов. Стадия с: На стадии с может быть использовано либо свободное основание соединения IV, либо его соль, например, соль миндальной кислоты. Отмечено, что определенные соли ограничивают эффективность этой стадии и не должны использоваться. Например, НВr соль соединения IV создает трудности при дебензилировании и предпочтительно не должна использоваться. Так как стадия с включает дополнительную стадию гидрирования с использованием различных катализаторов, но определенных растворителей, будет полезным избегать образования соли и продолжения непосредственно стадии с. Такая методика позволяет одновременно минимизировать использование растворителя и потери продукта при кристаллизации. Предпочтительно, катализатор удаляют в промежутках между стадиями, что позволяет ре циркулировать катализатор. Превращение соединения IV в соединениеI достигается гидрированием соединения IV,предпочтительно при температуре окружающей среды, используя Pd/C, предпочтительно 10%Pd/C, в качестве катализатора. Предпочтительно от 5 до 25 мас.% катализатора, основываясь на количестве используемого соединения IV, более предпочтительно от 10 до 20 мас.% и еще более предпочтительно около 15 мас.% Давление водорода должно быть предпочтительно в пределах от 0,0007 до 70,3 кг/см 2 (0,01-1000 пси), более предпочтительно от 0,703 до 14,06 кг/см 2(10-200 пси). В качестве растворителя предпочтительно используют смесь спирта, выбранного из метанола, этанола и изопропилового спирта,и карбоновой кислоты, выбранной из уксусной кислоты и пропионовой кислоты, более предпочтительно этанола и уксусной кислоты или метанола и уксусной кислоты. Спирты и кислоты могут быть использованы по отдельности. Соотношение спирта и кислоты предпочтительно составляет от 30:1 до 1:10, более предпочтительно от 30:1 до 1:1 и еще более предпочтительно от 20:1 до 8:1. Также предпочтительно использовать от 1 до 4 эквивалентов кислоты,основываясь на количестве соединения IV, более предпочтительно 2 эквивалента кислоты. Как и в стадии b, время реакции зависит от выбранных внешних переменных. Удаление фенэтана может контролироваться при помощи стандартной методики ВЭЖХ. Предпочтительно, стадия с должна проходить в течение от 2 до 48 ч, более предпочтительно от 4 до 9 ч. Эи(энантиомерный избыток) соединения I, получаемый на этой стадии, предпочтительно составляет, по крайней мере, 70%, более предпочтительно, по крайней мере, 85%. При образовании соединения I может быть полезным образование его НСl соли (Iа) для увеличения его эи. Соединение I, полученное после гидрирования в присутствии палладия на угле, может быть растворено в толуоле, изопропиловом спирте или их смеси, и его НСl соль осаждается при добавлении либо водного НСl,либо НСl в изопропиловом спирте. Энантиомерный избыток (эи) соединения Iа может быть далее увеличен при помощи ресуспендирования в изопропиловом спирте и н-гептане. Предпочтительно, к раствору соединения I в толуоле добавляют 5-6 N НСl в изопропиловом спирте. Во втором варианте данное изобретение относится к способу получения соединения формулы I посредством стадий d, e и f, представленных ниже. Стадия d: Соединение V, пиперонал, известно и является коммерчески доступным от AldrichChemical Company. Образование имина VI может быть осуществлено взаимодействием соединения V и подходящего хирального амина в условиях удаления воды. Предпочтительно, реакцию проводят с S-фенилглицинолом (еслиR=OH), п-толуолсульфоновой кислотой и толуолом при кипячении с обратным холодильником, оборудованным ловушкой Дина-Старка. Предпочтительно, используют, по крайней мере,стехиометрическое количество хирального амина, основываясь на количестве альдегида. Избыток хирального амина может быть использован для увеличения выхода или снижения времени реакции. Специалистам в данной области должно быть понятно, что для получения соединенияVI, если R является Н или ОСН 3, необходимо использовать соответствующий метилбензиламин. Также могут быть использованы и другие условия удаления воды, известные специалистам в данной области. Так же как и соединениеIII, предполагается, что Е изомер соединения V является доминирующим, если возможно образование обоих изомеров. Стадия e: Используя хлорид аллилмагния, который может быть доступен от Aldrich Chemical Company или может быть получен по методикам,известным специалистам в данной области, соединение VI может быть превращено в соединение VII. Эта реакция проходит с высокой диастереоселективностью и высоким выходом(около 72-82%). Ди, полученный в данной реакции, предпочтительно составляет, по крайней мере, 75%, более предпочтительно, по крайней мере, 85% и еще более предпочтительно, по крайней мере, 90%. Необходимо, по крайней мере, стехиометрическое количество реактива Гриньяра, основанное на имине. Предпочти 17 тельно, избыток реактива Гриньяра используют для поддержания реакции. Например, может быть использован 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5 или более кратный избыток реактива Гриньяра,предпочтительно в 2,5 раза. Могут быть использованы стандартные растворители для реактива Гриньяра, известные специалистам в данной области, например, эфиры, как определено выше, предпочтительно ТГФ. Температура, предпочтительная при добавлении реактива Гриньяра, находится в интервале от 20 до 30 С, более предпочтительно около температуры окружающей среды. Из-за природы реактива Гриньяра необходимо медленно добавить реактив Гриньяра, охладить реакционную смесь или то и другое поддерживать при предпочтительной температуре. Время реакции предпочтительно составляет от 1 до 5 ч, более предпочтительно 2-3 ч. Предпочтительно, на стадии (е) исключают хелатирующие кислоту Льюиса агенты, такие как цериевые реагенты (например, хлорид церия). Данные условия позволяют осуществлять диастереоселективную доставку аллильной группы без необходимости присутствия хелатирующих кислоту Льюиса агентов, таких какZnCl2, TiCl4, BF3-O(Et)2, CuI, CuBr2-S(СН 3)2 и реагентов церия (например, СеСl3) для повышения селективности. При добавлении реактива Гриньяра цериевые реагенты обычно используют в качестве хелатирующих агентов, повышающих селективность. К сожалению, цериевых реагентов обычно избегают при промышленном производстве из-за трудностей в обращении с ними. Поэтому данная стадия добавления, в которой избегают использования цериевых реагентов, имеет преимущества перед подобными стадиями. описанными в литературе и отмеченными в разделе данного описания, которые требуют использования цериевых или других хелатирующих кислоту Льюиса агентов для повышения селективности реактива Гриньяра. При образовании соединения VII его количество может быть увеличено взаимодействием с органической кислотой с образованием соли,которая осаждается и может быть легко выделена. Например, соединение VII может быть растворено в ацетонитриле, изопропиловом спирте или этилацетате, предпочтительно в ацетонитриле, и может быть добавлена винная кислота,щавелевая кислота или яблочная кислота, предпочтительно винная кислота. Предпочтительно, тартрат соединения VII получают в ацетонитриле, так как он легко осаждается из ацетонитрила. Ди соединения VII может быть также повышен кристаллизацией свободного основания, предпочтительно из этилацетата и н-гептана. Для данной реакции не используют ни пропилмагний хлорид, ни пропиллитий хлорид. Использование пропилмагний хлорида приводит к низкому выходу, приблизительно 50%. 18 Использование пропиллитий хлорида дает только 60% ди. Таким образом, ни один из этих реагентов не обеспечивает желаемый выход и диастереоселективность. Стадия f: Гидрирование соединения VII в присутствии палладия на угле, предпочтительно 10%(R=OH) и образованию соединения I. Предпочтительно, используют от 5 до 25% масс. катализатора, основываясь на количестве соединенияVI, более предпочтительно от 10 до 20% масс. и еще более предпочтительно около 15% масс. Предпочтительно, используемое давление водорода составляет от 0,007 до 0,703 кг/см 2 (0,1-10 пси), более предпочтительно от 0,07 до 0,352 кг/см 2 (1-5 пси) и еще более предпочтительно 0,141, 0,211 или 0,281 кг/см 2 (2, 3 или 4 пси). Предпочтительна температура окружающей среды. Ход реакции может контролироваться при помощи ВЭЖХ. Предпочтительно время гидрирования составляет от 24 до 48 ч. В качестве растворителя предпочтительно используют смесь спирта, выбранного из метанола, этанола и изопропилового спирта, и карбоновой кислоты, выбранной из уксусной кислоты и пропионовой кислоты, предпочтительно этанола и уксусной кислоты или метанола и уксусной кислоты. Соотношение спирта и кислоты предпочтительно составляет от 10:1 до 1:10, более предпочтительно от 10:1 до 1:1 и еще более предпочтительно от 8:1 до 3:1. Олефиновая связь в пропенильной цепочке восстанавливается практически мгновенно, что дает '"восстановленное" соединение VII, которое затем подвергается дебензилированию. Может быть добавлен дополнительный катализатор для уверенности в завершении превращения соединения VII в соединение I. При образовании соединения I может быть полезным получение его НСl соли. СоединениеI, полученное в результате гидрирования в присутствии палладия на угле, может быть растворено в толуоле, изопропиловом спирте или их смеси, и его НСl соль осаждается в результате добавления либо водного НСl, либо НСl в изопропиловом спирте. Эи соединения I может быть повышен перекристаллизацией из изопропилового спирта и н-гептана. Предпочтительно,в раствор соединения I в толуоле добавляют 6N НСl в изопропиловом спирте. Полученное твердое вещество затем выделяют. Другие особенности данного изобретения станут понятными из последующих описаний экспериментов, которые даны для иллюстрации данного изобретения и не должны пониматься как ограничивающие объем данного изобретения.(R)-N-[1-(1,3 бензодиоксол-5-ил)бутилиден]метил-бензолметанамина (III) (R=H). 22-литровую колбу с верхним перемешиванием, водным конденсатором, входом для азота, 2-литровой капельной воронкой, термометром загружают последовательно соединением II (R=H) (1 кг, 5,2 М), толуолом (10 л), R-(+)-метилбензиламином (816 мл, 6,35 М) и триэтиламином (1836 мл, 13,2 М) и охлаждают до 5 С. Медленно добавляют раствор хлорида титана (IV) (320 мл в 1 л толуола) через 2 литровую капельную воронку при энергичном перемешивании до тех пор, пока температура не достигнет 15 С. Добавление продолжается 1-2 ч. После завершения добавления реакционную массу перемешивают при комнатной температуре в течение 1 ч и затем нагревают до мягкого кипения с обратным холодильником (111 С) при энергичном перемешивании в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют через целит для удаления твердого вещества (TiO2 и Et3NHCl) и осадок на фильтре промывают толуолом (4 л). Раствор толуола промывают холодным 10%NaOH (1 х 2,5 л) и насыщенным водным раствором NaCl (2 х 2 л). Раствор сушат над сульфатом натрия и концентрируют в вакууме с получением масла (1524 г, 96,2% масс., выход 95%). Стадия b: получение [R-(R, R)]-N-(1'фенилэтилпропил-1,3-бензодиоксол-5 метанамин (S)гидроксибензолацетата (IVb)Ra-Ni (влажный, 500 г) в 10 л этанола гидрируют барботированием через нее водорода при комнатной температуре в течение 5-16 ч и затем при 50-60 С в течение еще 5 ч. Катализатор отфильтровывают и промывают этанолом (1,5 л). Фильтрат концентрируют на роторном испарителе с образованием соединения IV в виде масла(1280 г), которое затем кристаллизуют с Sминдальной кислотой (836 г, 5,5 М) в 6 л ацетонитрила. Твердое вещество фильтруют и промывают 2 л холодного ацетонитрила и 2 л холодного гептана с образованием соединения IVb(1784 г, 99,4 мас.%, выход 80%). Стереоселективность стадии b сравнивают с полученной при использовании методик с различными катализаторами, температурами и давлением водорода. В качестве растворителя используют этанол во всех случаях, за исключением D, где используют ТГФ. Результаты показаны в таблице 1. Как можно видеть, гидрирование при высоком давлении без высокой температуры(сравнительный пример А) приводит к более чем двойной потере диастереоселективности по сравнению с данным изобретением. Кроме того,замена Ra-Ni на либо Pd/C (сравнительные примеры С и D), либо NaBH4 (сравнительный пример В) также приводит к потере диастереоселективности. Стадия b также может проводиться без выделения соединения IV. Избегая выделения соединения IV, ограничивают потери продукта изза кристаллизации, а также ограничивают необходимость в дополнительном растворителе. Альтернативная стадия b: получение [R(R, R)]-N-[1'-фенилэтилпропил-1,3-бензодиоксол-5-метанамина (IV) (R=H). Суспензию соединения III (15 г) и Ra-Ni(влажный, 2,2 г) в 140 мл этанола гидрируют при давлении водорода (10,55 кг/см 2 (150 пси) ) при комнатной температуре в течение 6 ч и затем при 70 С в течение еще 14 ч. Катализатор отфильтровывают и промывают этанолом (20 мл) с получением раствора соединения IV (12,8 г, 85%) в приблизительно 150 мл этанола. Стадия с: получение гидрохлорида (R)-пропил-1,3-бензодиоксол-5-метанамина (Ia). 22-литровую колбу с верхним перемешиванием, дисперсной трубкой и термопарой загружают последовательно соединением IV(10%) (50% воды) (450 г) и этанолом (7 л). Газообразный водород барботируют через реакционную смесь в течение 24-26 ч при перемешивании и катализатор затем отфильтровывают. Фильтрат концентрируют в вакууме до небольшого объема и растворяют в толуоле (10 л). Раствор толуола промывают 10% NaOH (1 х 10 л и 1 х 5 л) и водой (3 х 3 л). Затем добавляют водный концентрированный НСl (36-38%, 450 мл) и получают суспензию. Фильтруют твердое вещество и промывают остаток на фильтре холодным толуолом (2 л) с получением соединения Ia Тестировали различные условия для стадии с. Результаты показаны в таблице 2 ниже. Таблица 2. Стереоселективное дебензилирование Сравнительные примеры А и В проводят с использованием условий, описанных у Bringmann и др. в Leibigs Ann. Chem. 1990, 795, стр. 799. Как видно, ни одна из этих методик не была полезной, так как полученный продукт частично рацемизировался (сравнительный пример А) или получали слишком низкий выход (сравнительный пример В). Пример 2. Получение гидрохлорида (R)-пропил-1,3-бензодиоксол-5-метанамина (Iа).(R)-N-[1-(1,3-бензодиоксол-5-ил)бутилиден]метилбензолметанамин,полученный согласно стадии а примера 1 из 500 г соединения II (R=H) и 816 мл R-(+)метилбензиламина, растворяют в этаноле (6 л) с Ra-Ni (250 г,влажная суспензия) и гидрируют при 23 С в течение 5 ч и затем при 60-65 С в течение еще 5 ч. Катализатор отфильтровывают и промывают этанолом (0,5 л). К раствору этанола добавляют 0,5 л уксусной кислоты и Pd/C (10%) (50% воды) (250 г). Газообразный водород барботируют через раствор в течение 23 ч при перемешивании и катализатор затем отфильтровывают. Фильтрат концентрируют в вакууме до небольшого объема и растворяют в толуоле (5 л). Раствор толуола промывают 10% NaOH (1 х 3 л и 1 х 2 л) и водой (2 х 1,5 л). Затем добавляют НСl в изопропиловом спирте (5-6N, 0,7 л) и получают суспензию. Фильтруют твердое вещество и промывают остаток на фильтре холодным толуолом (2 л) с получением неочищенного продукта (97,2% эи), который ресуспендируют в изопропиловом спирте (2 л) и н-гептане (4 л). Твердое вещество фильтруют и промывают нгептаном (2 л) с получением соединения Ia(VI) (R=OH). Раствор пиперонала (2,3 кг), (D)-фенилглицинола (2,1 кг) и п-толуолсульфоновой кислоты (2,5 г) в толуоле (13 л) кипятят с обратным холодильником, используя ловушку ДинаСтарка. Сразу же отделяют воду и продолжают ее отделять во время всей реакции. Как только соберут теоретическое количество воды (свыше трех или четырех часов), реакционную смесь анализируют при помощи 1H ЯМР. Реакционную смесь охлаждают до температуры от около 80 до 85 С. Медленно добавляют гептан (8 л) и полученный раствор далее охлаждают до 5-10 С, выстаивают в течение около 1 ч. Во время охлаждения наблюдается осаждение осадка, когда температура достигает отметки около 60 С. Продукт выделяют фильтрованием и сушат в вакууме при температуре от 50 до 55 С до постоянного веса с получением 3,8 кг соединения VI (R=OH) (95%) в виде кристаллического твердого вещества. 1H ЯМР данного продукта идентичен 1H ЯМР подлинного образца. Стадия е: получение тартрата (R)- -1,3 бензодиоксол-5-ил)-3-бутенил)амино)бензолэтанола (VIIa) (R=OH). 2 М раствор аллилмагний хлорида в ТГФ(9,4 л) по каплям добавляют к холодному раствору (10-15 С) соединения VI (R=OH) (2,02 кг) в ТГФ (9,5 л) в течение около 2 ч. Скорость добавления контролируется с целью поддержания температуры ниже 30 С. Полученную смесь выстаивают в течение около 1 ч, охлаждают до температуры от 5 до 10 С и охлаждают медленным добавлением 30% водной уксусной кислоты (14 л) при сохранении температуры ниже 30 С. Органическую фазу отделяют и обрабатывают 20% водным раствором NaOH до тех пор,пока рН не стабилизируется на отметке около 8. Слои разделяют и органический раствор промывают 10% водным раствором NaCl и концентрируют до масла при пониженном давлении(89,5% ди). К изоляту в виде соли винной кислоты добавляют ацетонитрил (15 л) с последующим добавлением винной кислоты (1 экв.,1,1 кг). Смесь нагревают до температуры 5055 С, выстаивают около 1 ч и медленно охлаждают до температуры окружающей среды в течение от 2 до 4 ч. После выстаивания в течение от 1 до 2 ч при этой температуре, продукт фильтруют, промывают ацетонитрилом (приблизительно 10 л) и сушат до постоянного веса в вакууме при температуре 45-50 С с получением соли винной кислоты соединения VII(R=OH) (2,6 кг, 82%) в виде белого твердого вещества (99,8% ди). Стадия f: получение гидрохлорида (R)-пропил-1,3-бензодиоксол-5-метанамина (Iа). Дегазированный раствор соединения VIIa(R=OH) (2,5 кг) в метаноле (9 л) и уксусной кислоте (5 л) превращают под давлением в суспензию "влажного" 10% палладия на угле (около 50% воды, 0,8 кг) в метаноле (9 л) уксусной кислоте (4,5 л). Полученную суспензию гидрируют при давлении водорода от 0,07 до 0,211 кг/см 2 (1-3 пси) и температуре окружающей среды в течение 48 ч. Образцы берут для анализа. Ход реакции контролируют при помощи ВЭЖХ. Как только реакция завершится, отработанный катализатор удаляют фильтрованием и промывают метанолом. Объединенные фильтраты концентрируют при пониженном давлении до остатка, который разделяют между толуолом(4 л) и 1N водным раствором НС 1 (около 5 л). Водную фазу отделяют и подщелачивают до рН 13 при помощи 30% водного раствора NaOH в присутствии толуола (7 л). Слои разделяют и водный слой экстрагируют толуолом (5 л). Объединенные органические растворы промывают 20% водным NaCl и пропускают через слой целита. Раствор толуола затем охлаждают до 1015 С и медленно добавляют раствор 6N НСl в изопропаноле (1,1 экв) с такой скоростью, чтобы поддерживать температуру ниже 20 С. Полученную суспензию выстаивают в течение 1 ч при комнатной температуре и затем фильтруют. Твердое вещество промывают толуолом и сушат в вакуумной печи при температуре от 50 до 55 С до постоянного веса с получением 2,05 кг(82% выход) соединения I в виде белого, легкого твердого вещества с превосходной энантиомерной чистотой (99,5% эи) и определенным мас.% (98% при помощи ВЭЖХ). Очевидно, что для данных методик возможны различные модификации и вариации данного изобретения. Поэтому должно быть понятно, что в рамках прилагаемых пунктов формулы изобретения изобретение может быть практически шире, чем описано здесь. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения пиперониламина формулы I: с хиральным метилбензиламином с получением соединения формулы III:(b) гидрирование полученного соединения формулы III или его стереоизомера, или соли в присутствии Ra-Ni (Ni Ренея) с получением соединения формулы IV: или его диастереомера, или соли, где гидрирование проводят в условиях, выбираемых из(bi) давление водорода около 0,0007-0,703 кг/см 2 (0,01-10 пси) при одной и той же температуре от 0-100 С в течение около 2-30 ч или 0,703-210,9 кг/см 2 (10-3000 пси) при одной и той же температуре от 60 до 80 С в течение около 230 ч; или(bii) давление водорода около 0,0007-210,9 кг/см 2 (0,01-3000 пси) при одной температуре в течение около 2-8 ч и другой температуре в течение около 2-24 ч, где первая температура составляет от 0-35 С и вторая температура составляет от 50-100 С; и(с) гидрирование соединения формулы IV или его стереоизомера или соли в присутствии палладия на угле и растворителя, выбранного из спирта, карбоновой кислоты, дикарбоновой кислоты, ароматической карбоновой кислоты и их смесей, с образованием соединения формулы I или его стереоизомера,или соли; при условии, что соединение формулы IV,гидрированное на стадии (с), не является бромистоводородной солью. 2. Способ по п.1, где на стадии (а) хиральный метилбензиламин является Rметилбензиламином, на стадии (b) R является Н, и на стадии (с) R является Н и растворитель выбирают из C1-3 спирта, С 2-4 карбоновой кислоты и их смесей. 3. Способ по п.2, где гидрирование на стадии (b) проводят в условиях (bi) при давлении водорода 0,0007-0,703 кг/см 2 (0,01-10 пси); и гидрирование на стадии (с) проходит в смеси C1-3 спирта и С 2-4 кислоты, где спирт и кислота присутствуют в соотношении от 30:1 до 1:10. 4. Способ по п.3, где стадию гидрирования(bi) проводят при давлении водорода 0,00070,141 кг/см 2 (0,01-2 пси) при температуре от 20 до 60 С в течение от 3-24 ч; и на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является ук 25 сусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1. 5. Способ по п.4, где стадию гидрирования(bi) проводят при давлении водорода 0,00070,070 кг/см 2 (0,01-1 пси) при температуре, выбираемой из температуры окружающей среды или от 50 до 60 С, в течение от 3-12 ч; и стадию гидрирования (с) проводят в этаноле и уксусной кислоте в соотношении от 20:1 до 8:1. 6. Способ по п.4, где стадию гидрирования(bi) проводят при давлении водорода 0,00070,070 кг/см 2 (0,01-1 пси) при температуре, выбираемой из температуры окружающей среды или от 50 до 60 С, в течение от 3-12 ч; и стадию гидрирования (с) проводят в метаноле и уксусной кислоте в соотношении от 20:1 до 8:1. 7. Способ по п.3, где на стадии (с) присутствует от 1 до 4 эквивалентов кислоты, исходя из количества соединения IV. 8. Способ по п.3, где на стадии (с) присутствует около 2 эквивалентов кислоты, исходя из количества соединения IV. 9. Способ по п.2, где стадию гидрирования(b) проводят в условиях (bi) при давлении водорода 0,703-70,3 кг/см 2 (10-1000 пси) при температуре от 60 до 80 С в течение 3-24 ч. 10. Способ по п.9, где стадию гидрирования (bi) проводят при давлении водорода 3,51535,15 кг/см 2 (50-500 пси). 11. Способ по п.1, где стадию гидрирования (b) проводят в условиях (bii); и стадию гидрирования (с) проводят в смесиC1-3 спирта и C2-4 кислоты, где спирт и кислота присутствуют в соотношении от 30:1 до 1:10. 12. Способ по п.11, где стадию гидрирования (bii) проводят при давлении водорода от 3,515-35,15 кг/см 2 (50-500 пси) при первой температуре от 20-30 С в течение 3-6 ч и второй температуре 60-80 С в течение 6-18 ч; и на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1. 13. Способ по п.12, где стадию гидрирования (bii) проводят при давлении водорода от 3,515-35,15 кг/см 2 (50-500 пси) при первой температуре от 20-30 С в течение 3-6 ч и второй температуре 60-80 С в течение 10-15 ч; и на стадии гидрирования (с) спирт выбирают из метанола и этанола, кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 30:1 до 1:1. 14. Способ по п.13, где стадию гидрирования (bii) проводят при давлении водорода от 7,03-21,09 кг/см 2 (100-300 пси) при первой температуре, которая является температурой окружающей среды, в течение около 3, 4, 5 или 6 ч и второй температуре 65-75 С в течение около 10,11, 12, 13, 14 или 15 ч; и стадию гидрирования(с) проводят в этаноле и уксусной кислоте при соотношении от 20:1 до 8:1. 15. Способ по п.13, где стадию гидрирования (bii) проводят при давлении водорода от 7,03-21,09 кг/см 2 (100-300 пси) при первой температуре, которая является температурой окружающей среды, в течение около 3, 4, 5 или 6 ч и второй температуре 65-75 С в течение около 10,11, 12, 13, 14 или 15 ч; и стадию гидрирования(с) проводят в метаноле и уксусной кислоте при соотношении от 20:1 до 8:1. 16. Способ по п.11, где на стадии (с) присутствует от около 1 до 4 эквивалентов кислоты,исходя из количества соединения IV. 17. Способ по п.11, где на стадии (с) присутствует около 2 эквивалентов кислоты, исходя из количества соединения IV. 18. Способ получения Rпропил-пиперониламина формулы I: с хиральным метилбензиламином с образованием соединения формулы VI: или его стереоизомера или соли, где R является Н, ОН или ОСН 3;(е) взаимодействие полученного соединения формулы VI или его стереоизомера, или соли с аллилмагний бромидом в растворителе с образованием соединения формулы VII: или его диастереоизомера или соли, где R является Н, ОН или ОСН 3 и диастереомерный избыток составляет, по крайней мере, 75%; и(f) гидрирование полученного соединения формулы VII или его диастереомера, или соли в присутствии палладия на угле в С 1-3 спирте и С 2-4 карбоновой кислоте с образованием соединения формулы I или его стереоизомера, или соли; при условии, что на стадии (е) не присутствует цериевый реагент. 19. Способ по п.18, где хиральный метилбензиламин на стадии (d) является S-фенилглицинолом и R является ОН на стадиях (е) и(f). 20. Способ по п.19, где на стадии (е) диастереомерный избыток составляет, по крайней мере, 85%; и на стадии (f) спирт выбирают из метанола и этанола, и кислота является уксусной кислотой, и соотношение спирта и кислоты составляет от 10:1 до 1:10. 21. Способ по п.20, где на стадии (е) диастереомерный избыток составляет, по крайней мере, 90%; и на стадии (f) спирт является этанолом, и соотношение спирта и кислоты составляет от 10:1 до 1:1. 22. Способ по п.20, где на стадии (е) диастереомерный избыток составляет, по крайней мере, 90%; и на стадии (f) спирт является метанолом, и соотношение спирта и кислоты составляет от 10:1 до 1:1. 23. Способ по п.19, где на стадии (е) в качестве растворителя используют тетрагидрофуран. где R выбирают из Н, ОН и ОСН 3, или его стереоизомеры, или соли. 25. Соединение по п.24, где R является Н. 26. Соединение по п.25, где соединение формулы IV представляет собой соль миндальной кислоты. 27. Соединение формулы VII: где R выбирают из Н, ОН и ОСН 3, или его стереоизомеры,или соли. 28. Соединение по п.27, где R является ОН. 29. Соединение по п.28, где соединение формулы VII представляет собой соль винной кислоты.
МПК / Метки
МПК: C07D 317/58
Метки: получения, этом, аналогов, способ, продукты, r-альфа-пропил-пиперониламина, используемые, способе, промежуточные
Код ссылки
<a href="https://eas.patents.su/15-1207-sposob-polucheniya-r-alfa-propil-piperonilamina-i-ego-analogov-promezhutochnye-produkty-ispolzuemye-v-etom-sposobe.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения r-альфа-пропил-пиперониламина и его аналогов, промежуточные продукты, используемые в этом способе.</a>
Предыдущий патент: Способ получения дикетоновых соединений
Следующий патент: Устройство для нанесения покрытий
Случайный патент: Инъекционное устройство












