Синтез производных тиофена
Номер патента: 3088
Опубликовано: 26.12.2002
Авторы: Лау Патрик Х., Февиг Томас Л., Филлипс Венделл Г.
Формула / Реферат
1. Способ получения замещенного тиофенового соединения, имеющего формулу
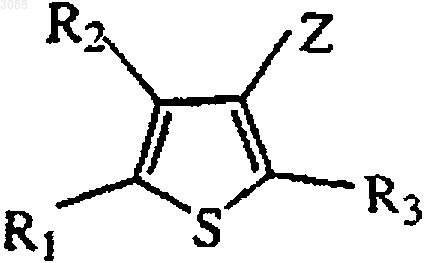
где R1 и R2 независимо выбирают из группы, состоящей из Н, C1-6алкила, арила, замещенного алкила или арила и R1 и R2 могут объединяться с образованием кольца, содержащего 5-7 атомов;
R3 выбирают из группы, состоящей из Н, C1-6алкила, арила и их замещенных производных;
Z представляет CN или CO2R4, где R4 выбирают из группы, состоящей из C1-6алкила, арила и их замещенных производных, Н, Na, Li, К и NH4+;
включающий
(а) (1) взаимодействие меркаптокетона, имеющего формулу
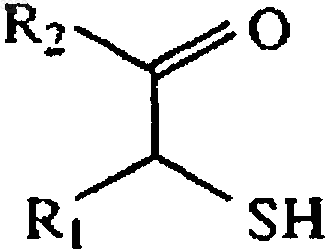
где R1 и R2 имеют значения, определенные выше, с акриловым соединением, имеющим формулу
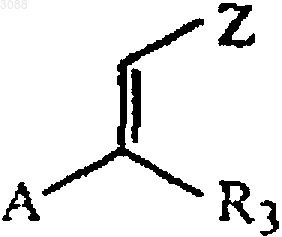
где R3 определен выше,
А выбирают из группы, состоящей из C1-4алкокси, в присутствии эффективного количества основания в качестве катализатора;
(b) ароматизацию путем обработки кислотой; и
(c) выделение замещенного тиофенового продукта.
2. Способ по п.1, где меркаптокетон получают путем
(а) взаимодействия галогенкетона, имеющего формулу
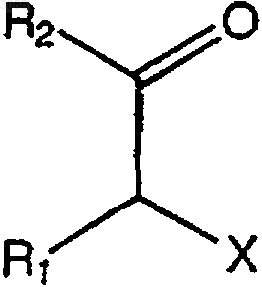
где R1 и R2 имеют значения, определенные в п.1,
Х представляет подходящую отщепляемую группу, такую как галоген (Сl, Вr, I) или метансульфонилоксигруппу, с NaSH в водноорганической двухфазной системе растворителей; и
(b) выделения меркаптокетона в виде раствора в органическом растворителе.
3. Способ по п.2, где органический раствор меркаптокетона сушат путем азеотропной перегонки или путем контактирования с осушителем.
4. Способ по п.1, где указанный основной катализатор является алкоголятом.
5. Способ по п.4, где указанный алкоголят выбирают из группы, состоящей из метилата натрия, трет-амилата натрия, трет-амилата калия и трет-бутилата калия.
6. Способ по п.1, где реакцию осуществляют в присутствии углеводородного растворителя.
7. Способ по п.1, где реакцию осуществляют при температуре между примерно 0-50шС.
8. Способ по п.1, где количество указанного основного катализатора составляет примерно 0,025-0,2 эквивалента относительно количества меркаптокетона.
9. Способ по п.1, где стадия (b) включает добавление эффективного количества водной кислоты к продукту реакции со стадии (а) для превращения любого замещенного тетрагидротиофена в эквивалентный замещенный тиофен; и где стадия (с) включает стадии
(с) (1) фазового отделения органической части смеси водной кислоты и продукта реакции со стадии (b);
(с) (2) упаривания любого присутствующего углеводородного растворителя для получения неочищенного тиофенового продукта; и
(с) (3) перегонки неочищенного тиофенового продукта со стадии (2) для получения очищенного тиофенового продукта.
10. Способ по п.1, где стадия (а) дополнительно включает стадии
(а) (2) добавления разбавленной серной кислоты к продукту реакции (а) (1);
(а) (3) добавления этилацетата к объединенным серной кислоте и продукту реакции со стадии (а) (2);
(а) (4) фазового отделения органической части смеси этилацетата, серной кислоты и продукта реакции, полученной на стадии (а) (3); и
(а) (5) промывания органической фазы, отделенной на стадии (а) (4), водным рассолом, высушивания промытой органической фазы сульфатом натрия и упаривания этилацетата и любого присутствующего углеводородного растворителя для получения смеси замещенного тетрагидротиофена и замещенного тиофена;
где стадия (b) включает обработку смеси замещенного тетрагидротиофена и замещенного тиофена, полученной на стадии (а) (5), водной НСl для превращения замещенного тетрагидротиофена в замещенный тиофен;
и где стадия (с) включает стадии:
(с) (1) добавления воды и этилацетата к смеси замещенного тиофена и водной НСl со стадии (а) (6);
(с) (2) фазового отделения органической части смеси вода-этилацетат-НСl-тиофен со стадии (с) (1); и
(с)(3) промывания органической части, отделенной на стадии (с) (2), насыщенным водным NaHCO3, высушивания Na2SO4 и упаривания этилацетата для получения замещенного тиофенового продукта.
11. Тетрагидротиофен, имеющий формулу
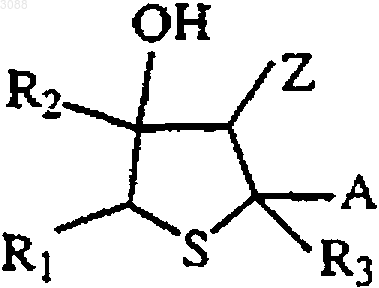
где R1 и R2 независимо выбирают из группы, состоящей из Н, C1-6алкила, арила, замещенных алкила или арила, и R1 и R2 могут объединяться с образованием кольца, содержащего 5-7 атомов;
R3 выбирают из группы, состоящей из Н, C1-6алкила, арила и их замещенных производных;
Z представляет CN или CO2R4, где R4 выбирают из группы, состоящей из С1-6алкила, арила и их замещенных производных, Н, Na, Li, К и NH4+; и
А представляет С1-4алкоксигруппу.
Текст
1 Предпосылки изобретения Данное изобретение относится, главным образом, к синтезу замещенных тиофенов и, в частности, к 3-карбометокси-4,5-диметилтиофену, который является промежуточным продуктом для семейства фунгицидов. В другом аспекте, данное изобретение относится к новому соединению, которое является предшественником тиофеновых промежуточных продуктов. Одним фунгицидом, который может быть получен из промежуточного продукта, является 4,5-диметил-N-2-пропенил-2-(триметилсилил)3-тиофенкарбоксамид, который заявлен как новое соединение в патенте US5,486,621. Там приведено два способа получения такого соединения. Другой способ описан в патенте US5,498,630, который касается в более полном общем виде борьбы с выпреванием растений путем применения фунгицида. Один родственный тиофеновый фунгицид описан в примере 271 вместе со способом получения такого соединения. Описан ряд способов получения тиофеновых соединений. Один способ, который имеет отношение к способу данного изобретения, описан, например, в SYNLETT, ноябрь 1995, стр. 1143, G.М.Сорроlа, R.E.Damon и H.Yu. Этот способ предусматривает взаимодействие альфамеркаптокетона с фосфорзамещенным акрилатом в присутствии основания с образованием замещенного дигидротиофенового кольца, из которого может быть получено соответствующее ароматическое тиофеновое кольцо. Считалось, что присутствие фосфорсодержащего радикала в 2-м положении было необходимо для осуществления реакции циклоприсоединения. Обнаружено, что это не требуется, но когда 3-е положение замещено, возможна реакция в присутствии определенных оснований. Новый способ может быть использован для получения тиофеновых колец, имеющих различные заместители, включая таковые целевого соединения,как показано в описании ниже. Краткое изложение сущности изобретения В одном аспекте предметом данного изобретения является новый способ образования замещенных тиофеновых колец и производных,таких как фунгициды, патента US5,486.621. Новый способ предусматривает взаимодействие альфа-меркаптокетона, такого как 3-меркапто-2 бутанон, полученного in situ из -галогенкетона,такого как 3-хлор-2-бутанон, с акрилатом, таким как метил-3-метоксиакрилат, в присутствии основного алкоголята, такого как NaOMe, при растворении в апротонном растворителе, например толуоле. Продуктом реакции является замещенный тетрагидротиофен, который может быть превращен в ароматический тиофен путем обработки кислотой. В основном реакция может быть записана следующим образом: где R1 и R2 независимо выбраны из водорода,алкила, арила, их замещенных производных и кольца, образованного из R1 и R2, содержащего 5-7 атомов; Х представляет подходящую отщепляемую группу, такую как галоген (Сl, Вr, I) или метансульфонилокси; R3 представляет член группы водорода, алкила, арила и их замещенных производных; Z представляет CN илиCO2R4, где R4 выбран из группы, состоящей из алкила и арила и их замещенных производных,Н, Na, Li, K и NH4+; и А представляет алкоксигруппу, предпочтительно C1-C6 линейную или разветвленную алкоксигруппу. В другом аспекте предметом данного изобретения является способ получения фунгицидного 4,5-диметил-N-2-пропенил-2-(триметилсилил)-3-тиофенкарбоксамида и родственных соединений, в которых пропенильная группа заменена C2-C4 разветвленной или линейной алкильной цепью. В еще одном аспекте предметом данного изобретения является предшественник тиофенового промежуточного продукта, как показано на схематической диаграмме реакции, приведенной выше. Описание иллюстративных воплощений Атом серы в замещенное тиофеновое соединение поставляется меркаптокетоном,имеющим формулу где R1 и R2 определены выше. Предпочтительные соединения будут определяться замещениями, которые требуются для тиофена в 4-м и 5-м положениях. В свою очередь, они могут быть замещениями, желательными в фунгициде или другом соединении,для которых тиофен является промежуточным продуктом. Альтернативно R1 и R2 могут быть выбраны для облегчения их замены заместителями, которые желательны в конечном химическом продукте. В предпочтительном воплощении R1 и R2 являются метилом. Примеры других меркаптокетонов включают, но не ограничиваются, соединения Меркаптокетоны, такие как использованные в данном изобретении, известны в литературе. Их обычно получают путем обработки соответствующих галогенкетонов (Eur. J. Med.Fatome) в растворителях NaSH или другими источниками серы, или из кетонов путем обработки аммиаком и элементарной серой (LiebigsThiel и I. Kalzendorf). В некоторых случаях, таких как с 3-меркапто-2-бутаноном, выход выделенных меркаптанов низкий в результате разложения продуктов в процессе очистки. Для целей данного изобретения было найдено, что меркаптокетоны, такие как 3-меркапто-2 бутанон, могут быть получены из галогенкетонов, таких как 3-хлор-2-бутанон, в двухфазной системе растворителей, содержащей воду и неполярный органический растворитель,такой как толуол или гептан, в присутствииNaSH. Целевой меркаптокетон затем выделяют с высоким выходом и чистотой в виде раствора в органическом растворителе после разделения фаз, избегая при этом разложения, связанного с очисткой. Вода может быть удалена из раствора меркаптокетона различными способами, такими, как азеотропная перегонка или контактирование раствора с осушителями, такими как молекулярные сита, хлорид кальция или сульфат натрия, до взаимодействия с акриловым соединением. Акрилаты Вторым соединением, которое прибавляют к меркаптокетону для получения замещенного тиофена, является акриловое соединение формулы где R3 и Z имеют значения, определенные выше,А выбирают из группы, состоящей из алкоксигрупп. Считается, что в 2-ом положении необходим фосфорсодержащий радикал, чтобы обеспечить образование тиофенового кольца. Найдено, однако, что реакция может быть проведена с хорошими выходами тиофенового кольца,если радикал А находится в 3-ем положении и в качестве катализатора используется эффективное основание. Примерами реакционноспособных радикалов А являются алкоксигруппы. В предпочтительном воплощении А является метоксигруппой. Примеры реакционноспособных акриловых соединений включают, но не ограничиваются Тетрагидротиофеновый предшественник Продукт реакции меркаптокетона и акрилового соединения, описанный выше, является замещенным тиофеном где R1, R2, R3 и Z имеют значения, указанные выше. При определенных условиях продукт полностью или частично может быть соответствующим тетрагидротиофеном, то есть включая все его стереоизомеры. Его считают новым соединением. Он может быть превращен в тиофен путем реакции с кислотой, как будет показано в обсуждении ниже. Условия реакции Реакцию -галогенкетона с NaSH проводят в двухфазной водно/органической системе растворителей. Так, готовят раствор 1-1,25 эквивалента NaSH в воде (10-30 вес.%) и объединяют его с органическим растворителем, таким как толуол или гептан (2-4 эквивалента) в инертной атмосфере при сильном перемешивании. При добавлении -галогенкетона температуру смеси поддерживают между примерно 0 С и примерно 30 С. Когда реакция заканчивается (0,5-4 ч) фазам дают возможность разделиться и нижнюю,водную фазу отбрасывают. Верхнюю органическую фазу затем сушат путем азеотропной перегонки (30-50 С, 100-600 мм рт.ст.) или путем контактирования с осушителем, таким как молекулярные сита, хлорид кальция или сульфат натрия, в течение достаточного времени (от 15 мин до 3 ч). Реакцию меркаптокетона и акрилового соединения проводят в присутствии основного катализатора. Примерами основных катализаторов являются алкоголяты, такие как метилат натрия, трет-амилат натрия, трет-амилат калия и трет-бутилат калия; сильные аминовые основания, такие как диазабициклоундецен; гидрид натрия и гидроксиды щелочных металлов. Основание предпочтительно является алкоголятом. Обычно количество основного катализатора составляет примерно 0,025-0,2 эквивалента по отношению к количеству меркаптокетона. Обнаружено, что большие количества основного катализатора дает тиофен, хотя выходы ниже. В предпочтительных условиях продукт содержит значительную часть тетрагидротиофена. Хотя это и не обсуждается как существенное, реакция будет проводиться, если реагенты растворены в растворителе, предпочтительно углеводородном растворителе, таком как толуол, или другом апротонном растворителе, таком как хлорбензол, гептан или ксилол. Реакция может быть проведена при температурах в пределах примерно 0-50 С. Обработку продукта реакции кислотой для превращения любого тетрагидротиофена в тиофен предпочтительно проводят при примерно 0-50 С. 5 Выделение замещенного тиофена из реакционной смеси может быть произведено, по меньшей мере, двумя способами. Во-первых,тетрагидротиофен выделяют путем отделения его от реакционной смеси и затем взаимодействия его с кислотой для превращения в тиофен. По второму способу тетрагидротиофен реагирует с кислотой in-situ с последующим выделением продукта в виде тиофена. Первый способ выделения будет включать,по меньшей мере, следующие стадии. К реакционной смеси добавляют разбавленную серную кислоту, чтобы нейтрализовать реакционную смесь. Затем добавляют растворитель, такой как этилацетат, и воду и органическую фазу разделяют. Органическую фазу, которая содержит продукт реакции, промывают водным рассолом. После этого промытую органическую фазу сушат, например, путем контактирования с сульфатом натрия и растворитель упаривают, получая смесь замещенного тетрагидротиофена и замещенного тиофена. Эту смесь обрабатывают водной кислотой, такой как концентрированная НСl, 50%-ная Н 2SO4 или 50%-ная фосфорная кислота, или безводной кислотой, такой как безводная метансульфокислота, для превращения тетрагидротиофена в тиофен. После этой реакции стадии, описанные выше, могут быть повторены для выделения тиофенового продукта. По второму способу замещенный тетрагидротиофен превращают in situ в тиофен до начала первого отделения. Сначала к реакционной смеси добавляют водную кислоту, такую как концентрированная НСl или 50%-ная H2SO4 для превращения тетрагидротиофена в тиофен. Затем водную и органическую фазы разделяют и растворитель упаривают. Наконец, сырой продукт может быть перегнан для получения очищенного замещенного тиофена. Тиофеновые промежуточные продукты Продуктом данного изобретения является замещенный тиофен, который является промежуточным продуктом для получения семейства основанных на тиофене фунгицидов, описанных в патенте US5,498,630, и, в частности 4,5 диметил-N-2-пропенил-2-(триметилсилил)-3 тиофенкарбоксамида, описанного и заявленного в патенте US5,486,621. Содержание каждого из этих патентов дано здесь в качестве ссылки. Такие фунгициды применимы для борьбы с выпреванием растений, вызываемым почвенными грибками Gaeumannomyces graminis. Эти грибки заражают корни определенных растений, в частности хлебных злаков, таких как пшеница и ячмень. Тиофеновые промежуточные продукты представлены формулойR3, который в исходном акриловом соединении предпочтительно представляет водород, должен быть заменен триметилсилильным радикалом или другим желаемым заместителем. Это может быть достигнуто путем обработки вышеуказанного тиофенового промежуточного продукта,где Z представляет CO2Li, сильным основанием,с последующей обработкой триметилсилилхлоридом. Обычно Z может быть радикалом сложного эфира карбоновой кислоты. Таким образом, гидролиз радикала сложного эфира карбоновой кислоты до соответствующей Li-соли с последующим силилированием, как описано выше, и последующим превращением в амид стандартными способами дают предпочтительный фунгицид. Пример 1. Водный NaSH (1,1 эквивалента) разбавляли водой до образования 23,5%-ного раствора по весу. Этот раствор объединяли с 3 эквивалентами толуола в инертной атмосфере при сильном перемешивании и охлаждали до 5 С. К смеси добавляли один эквивалент 3-хлор-2 бутанона с такой скоростью, чтобы поддерживать температуру ниже 10 С. Это потребовало 2 ч. После добавления смесь перемешивали при 5-10 С до тех пор, пока по данным ГХ смеси не было обнаружено полное потребление хлорбутанона (от 15 мин до 1 ч). Перемешивание прекращали и фазам давали возможность разделиться. После стояния в течение 15 мин водную фазу сливали и обрабатывали отбеливателем для окисления и дезодорирования соединений серы. Верхнюю, органическую фазу, содержащую около 25% по весу 3-меркапто-2-бутанона,сушили над активированным молекулярным ситом 4 А (около 35 г/кг раствора) в течение 1 ч. Раствор 3-меркапто-2-бутанона затем декантировали из молекулярного сита в реакционный сосуд для следующей стадии. Пример 2. Толуольный раствор 3-меркапто-2 бутанона с предыдущей стадии (613 г примерно 25%-ного раствора) помещали в чистый сухой реактор вместе с 15 г метил-3-метоксиакрилата. Смесь нагревали до 25 С, сильно перемешивали и сразу обрабатывали твердым метилатом натрия (8,5 г, около 0,1 экв.). Оставшийся метил-3 метоксиакрилат (151 г) добавляли с такой скоростью, чтобы поддерживалась температура при или ниже 35 С (2 ч). Полученную смесь оставляли охлаждаться до комнатной температуры и перемешивали 21 ч. К смеси добавляли концентрированную соляную кислоту (88 г) за 30 мин так, чтобы температура не превышала 35 С. Полученную смесь тщательно перемешивали 2 ч, затем обрабатывали 73 г воды и перемешивали еще 10 мин. Фазы оставили разделяться. После стояния в течение 10 мин водную фазу сли 7 вали из реактора, а верхнюю, содержащую продукт фазу промывали 100 г 5%-ного раствора бикарбоната натрия. После перемешивания в течение 15 мин фазам дали разделиться. Нижнюю водную фазу сливали из реактора, а верхнюю, содержащую продукт фазу переносили в перегонную колбу. Толуол отгоняли на 5-ти тарелочной дистилляционной колонне при 100 мм рт.ст. После отбора небольшой фракции,содержащей толуол и другие низкокипящие примеси, продукт 3-карбометокси-4,5-диметилтиофен, был перегнан через колонну при 50 мм рт.ст. Было отобрано всего 202,4 г продукта с чистотой 98,8% по данным весового процентного анализа. Это соответствует выходу 77% в расчете на 3-хлор-2-бутанон и 82% в расчете на метил-3-метоксиакрилат. Пример 3. По одному эквиваленту каждого из 3 меркапто-2-бутанона и метил-3-метоксиакрилата растворяли в толуоле и добавляли 0,1 эквивалента NaOMe в качестве катализатора. Реакцию проводили при комнатной температуре в атмосфере азота 3-4 ч. Затем смесь выливали в разбавленную серную кислоту и экстрагировали этилацетатом. Органическую фазу промывали рассолом и затем сушили над сульфатом натрия,фильтровали и упаривали. Продукт был тетрагидротиофеновым предшественником, описанным выше, то есть 2-метокси-3-карбометокси-4 гидрокси-4'-метил-5-метилтетрагидротиофеном. Тетрагидротиофеновый предшественник обрабатывали концентрированной НСl при комнатной температуре при быстром перемешивании. Через 5 мин смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным NаНСО 3, сушили надNaSO4, фильтровали и упаривали при комнатной температуре на роторном испарителе, выделяя ароматический тиофеновый продукт, 3 карбометокси-4,5-диметилтиофен. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения замещенного тиофенового соединения, имеющего формулу где R1 и R2 независимо выбирают из группы,состоящей из Н, C1-6 алкила, арила, замещенного алкила или арила, и R1 и R2 могут объединяться с образованием кольца, содержащего 5-7 атомов; где R3 определен выше,А выбирают из группы, состоящей из C1-4 алкокси, в присутствии эффективного количества основания в качестве катализатора;(b) ароматизацию путем обработки кислотой; и(c) выделение замещенного тиофенового продукта. 2. Способ по п.1, где меркаптокетон получают путем где R1 и R2 имеют значения, определенные в п.1,Х представляет подходящую отщепляемую группу, такую как галоген (Сl, Вr, I) или метансульфонилоксигруппу, с NaSH в водноорганической двухфазной системе растворителей; и(b) выделения меркаптокетона в виде раствора в органическом растворителе. 3. Способ по п.2, где органический раствор меркаптокетона сушат путем азеотропной перегонки или путем контактирования с осушителем. 4. Способ по п.1, где указанный основной катализатор является алкоголятом. 5. Способ по п.4, где указанный алкоголят выбирают из группы, состоящей из метилата натрия, трет-амилата натрия, трет-амилата калия и трет-бутилата калия. 6. Способ по п.1, где реакцию осуществляют в присутствии углеводородного растворителя. 7. Способ по п.1, где реакцию осуществляют при температуре между примерно 0-50 С. 8. Способ по п.1, где количество указанного основного катализатора составляет примерно 0,025-0,2 эквивалента относительно количества меркаптокетона. 9. Способ по п.1, где стадия (b) включает добавление эффективного количества водной кислоты к продукту реакции со стадии (а) для превращения любого замещенного тетрагидротиофена в эквивалентный замещенный тиофен; и где стадия (с) включает стадии(с) (1) фазового отделения органической части смеси водной кислоты и продукта реакции со стадии (b);(с) (2) упаривания любого присутствующего углеводородного растворителя для получения неочищенного тиофенового продукта; и(с) (3) перегонки неочищенного тиофенового продукта со стадии (2) для получения очищенного тиофенового продукта. 10. Способ по п.1, где стадия (а) дополнительно включает стадии(а) (2) добавления разбавленной серной кислоты к продукту реакции (а) (1);(а) (3) добавления этилацетата к объединенным серной кислоте и продукту реакции со стадии (а) (2);(а) (4) фазового отделения органической части смеси этилацетата, серной кислоты и продукта реакции, полученной на стадии (а) (3); и(а) (5) промывания органической фазы, отделенной на стадии (а) (4), водным рассолом,высушивания промытой органической фазы сульфатом натрия и упаривания этилацетата и любого присутствующего углеводородного растворителя для получения смеси замещенного тетрагидротиофена и замещенного тиофена; где стадия (b) включает обработку смеси замещенного тетрагидротиофена и замещенного тиофена, полученной на стадии (а) (5), водной НСl для превращения замещенного тетрагидротиофена в замещенный тиофен; и где стадия (с) включает стадии(с) (1) добавления воды и этилацетата к смеси замещенного тиофена и водной НСl со стадии (а) (6);(с) (2) фазового отделения органической части смеси вода-этилацетат-НСl-тиофен со стадии (с) (1); и(с)(3) промывания органической части, отделенной на стадии (с) (2), насыщенным водным NaHCO3, высушивания Na2SO4 и упаривания этилацетата для получения замещенного тиофенового продукта. 11. Тетрагидротиофен, имеющий формулу где R1 и R2 независимо выбирают из группы,состоящей из Н, C1-6 алкила, арила, замещенных алкила или арила, и R1 и R2 могут объединяться с образованием кольца, содержащего 5-7 атомов;
МПК / Метки
МПК: C07D 333/38
Метки: тиофена, синтез, производных
Код ссылки
<a href="https://eas.patents.su/6-3088-sintez-proizvodnyh-tiofena.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез производных тиофена</a>
Предыдущий патент: Производные аденозина
Следующий патент: Синтетические фунгицидные смеси на основе производных n-фенилникотинамида и бензимидазолов или высвобождающих их предшественников
Случайный патент: Устройство и способ соединения гибких труб встык










