Производные аденозина
Номер патента: 3087
Опубликовано: 26.12.2002
Формула / Реферат
1. Соединение формулы (I)
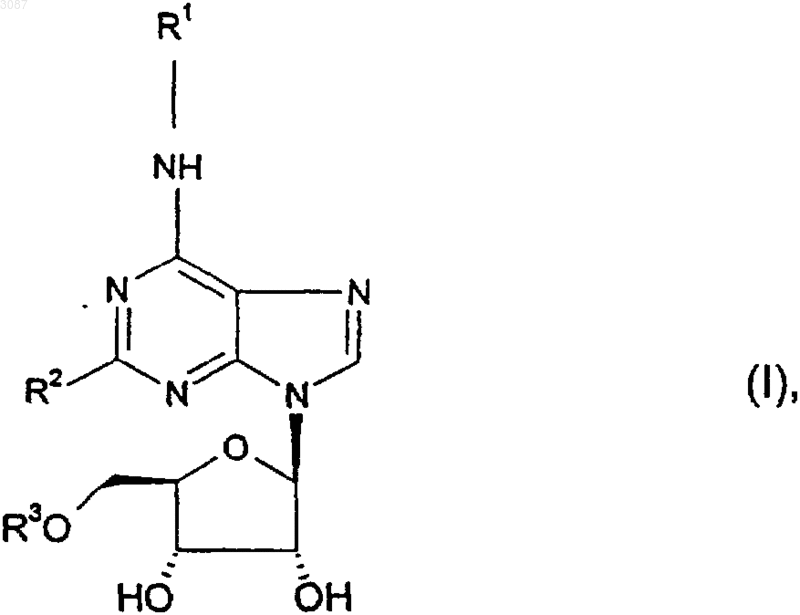
где R2 представляет собой С1-4алкил, галоген или водород;
R3 представляет собой прямую или разветвленную алкильную группу из 1-6 атомов углерода;
R1 представляет собой группу, выбранную из
1) -(С1-3алкилен)n-(С3-7)циклоалкила или мостикового (С4-7)циклоалкила, причем указанная циклоалкильная группа возможно замещена одним или двумя заместителями, выбранными из ОН, галогена, -(С1-3)алкокси, где n представляет собой 0 или 1;
2) алифатической гетероциклической группы из 5-6-членных колец, содержащих один гетероатом, выбранный из О, N или S, возможно замещенной (С1-4)алкилом, -СO2-(С1-4)алкилом или =O;
3) прямого или разветвленного С1-6алкила, возможно включающего в себя один или два О, S(=O)2 или N, замещенные в пределах алкильной цепи, причем указанный алкил возможно замещен одной или двумя следующими группами: фенил, галоген, гидрокси или NН2;
4) бензоконденсированного гетероцикла

в котором В представляет собой 5- или 6-членное гетероциклическое ароматическое кольцо, содержащее один гетероатом О, N или S, причем данный бензоконденсированный гетероцикл присоединен через кольцевой атом кольца А, а кольцо В возможно замещено -СО2(С1-4алкилом);
5) фенильной группы, возможно замещенной одним или двумя заместителями, выбранными из -галогена, -(С1-6алкилен)n-ОН, -(С2-6алкенил)n-ОН, -(O)m-(С1-6алкилен)n-CO2Rc, -(O)m-(С2-6алкенил)n-СO2Rc, тетразолила, возможно замещенного С1-4алкилом, где m и n представляют собой 0 или 1, и Rc представляет собой водород или С1-4алкил;
при условии, что когда R3 представляет собой С1-6алкил, R2 представляет собой С1-4алкил, R1 не может представлять собой фенил, возможно замещенный одним или более чем одним заместителем, выбранным из галогена, -CO2Rc и -ORc;
и его соли и сольваты, в частности его физиологически приемлемые сольваты и соли.
2. Соединение по п.1, в котором R3 представляет собой C1-3алкил.
3. Соединение по п.2, в котором R3 представляет собой метил или этил.
4. Соединение по п.3, в котором R3 представляет собой метил.
5. Соединение по любому из пп.1-4, в котором R2 представляет собой водород, метил или галоген.
6. Соединение по п.5, в котором R2 представляет собой водород или метил.
7. Соединение по любому из пп.1-6, в котором R1 представляет собой -(С1-3алкилен)n-С5-7циклоалкил, где n представляет собой 0 или 1, возможно замещенный одним или двумя заместителями, выбранными из галогена, C1-3алкокси и ОН, или незамещенный.
8. Соединение по п.7, в котором циклоалкильная группа является незамещенной или монозамещенной фтором.
9. Соединение по п.7 или 8, в котором n представляет собой нуль.
10. Соединение по любому из пп.1-6, в котором R1 представляет собой замещенную или незамещенную алифатическую гетероциклическую группу, причем в случае наличия замещения заместитель выбирают из группы, состоящей из С1-4алкила, -СO2-(С1-4алкила) или =O.
11. Соединение по п.10, в котором заместителем является -СO2-(С1-4алкил) или метил.
12. Соединение по п.11, в котором алифатическая гетероциклическая группа не замещена, или заместителем является -СO2-(С1-4алкил), и в тех случаях, когда гетероатомом является N, заместитель присоединен непосредственно к кольцевому атому N.
13. Соединение по любому из пп.10-12, в котором гетероциклическое кольцо является 6-членным.
14. Соединение по п.13, в котором кольцо содержит один гетероатом N, О или S.
15. Соединение по любому из пп.1-6, в котором R1 представляет собой прямой либо разветвленный алкил из 1-6 атомов углерода, возможно включающий в себя один или два S(=O)2, О или N, замещенные в данной цепи, причем алкил возможно дополнительно замещен одной или двумя группами, выбранными из ОН, фенила и фтора.
16. Соединение по любому из пп.1-6, в котором R1 представляет собой фенильную группу, замещенную одним или двумя заместителями, выбранными из галогена, -(O)m-(С1-6алкилен)n-СO2Rc, -(O)m-(C2-6алкенил)n-СO2Rc, -(С1-6алкилен)n-ОН и -(С2-6алкенил)n-ОН.
17. Соединение по п.16, в котором фенильная группа является дизамещенной по 2, 4 положениям.
18. Соединение по п.17, в котором оба заместителя представляют собой галоген.
19. Соединение по п.18, в котором заместитель по 2 положению представляет собой фтор и заместитель по 4 положению представляет собой фтор.
20. Соединение по пп.1-6, в котором R1 представляет собой фенильную группу, замещенную 5-тетразолильной группой, и эта группа сама возможно замещена С1-4алкилом.
21. Соединение по любому из пп.1-6, в котором R1 представляет собой бензоконденсированный гетероцикл
в котором В является фурановым кольцом, возможно замещенным -СО2(С1-4алкилом).
22. Соединение по п.21, в котором фурановое кольцо замещено по 2 положению.
23. Соединение по п.1, выбранное из
5'-O-метил-N-(тетрагидрофуран-3R-ил)аденозина,
N-(2R-гидрокси-(R)-циклопентил)-5'-O-метиладенозина,
5'-O-метил-N-(тетрагидропиран-4-ил)аденозина,
N-(2S-метокси-(S)-циклопентил)-5'-O-метиладенозина,
5'-O-метил-N-(2S-метилтетрагидрофуран-3R-ил)аденозина,
N-(3-хлор-4-гидроксифенил)-5'-O-метиладенозина,
5'-O-метил-N-(1R-метил-2-фенилэтил)аденозина,
N-трет-бутил-5'-O-метиладенозина,
N-(2S-фтор-(S)-циклопентил)-5'-O-метиладенозина,
N-(2,3-дигидроксипропиламино)-5'-O-метиладенозина,
N-rel-[(1S,4R)-бицикло[2.2.1]гепт-2R-ил]-5'-O-метиладенозина,
4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9Н-пурин-6-иламино]-пиперидин-1-карбоновой кислоты этилового эфира,
5'-O-метил-N-[4-(2-метил-2Н-тетразол-5-ил)фенил]аденозина,
3-{4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9Н-пурин-6-иламино]фенил}-(Е)-акриловой кислоты,
N-(4-гидроксиметилфенил)-5'-O-метиладенозина,
{4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9Н-пурин-6-иламино]фенокси}уксусной кислоты,
5-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9Н-пурин-6-иламино]бензофуран-2-карбоновой кислоты метилового эфира,
5'-O-метил-N-(тетрагидротиопиран-4-ил)аденозина,
N-rel-[(1R,5R)-бицикло[3.2.0]гепт-6S-ил]-5'-O-метиладенозина,
4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-2-метил-9Н-пурин-6-иламино]пиперидин-2-она,
5'-O-метил-N-(1S-метоксиметил-2-метилпропил)аденозина,
N-(2-гидрокси-1R-метилэтил)-5'-O-метиладенозина,
N-(2-фтор-1R-метилэтил)-5'-O-метиладенозина,
N-(1S-фторметил-2-метоксиэтил)-5'-O-метиладенозина,
N-(3-аминопропил)-5'-O-метиладенозина,
2-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-2-метил-9Н-пурин-6-иламино]этансульфоновой кислоты метиламида,
N-циклопентил-2-метил-5'-O-метиладенозина,
N-циклопропилметил-2-метил-5'-O-метиладенозина.
24. Соединение по любому из пп.1-23 со слабой или отсутствующей активностью в отношении А3-рецептора.
25. Применение соединения по любому шч пп.1-24 в качестве терапевтического средства.
26. Фармацевтическая композиция, содержащая соединение по любому из пп.1-24 вместе с фармацевтическим носителем и/или эксципиентом.
27. Применение соединения по любому из пп.1-24 для производства лекарства для лечения пациента, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений, либо страдающего от ишемической болезни сердца, заболевания периферических сосудов или удара или восприимчивого к ним, либо страдающего от боли, расстройства ЦНС или приступов апноэ во сне.
28. Способ лечения пациента, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений, либо страдающего от ишемической болезни сердца, заболевания периферических сосудов или удара или восприимчивого к ним, либо страдающего от боли, расстройства ЦНС или приступов апноэ во сне, при котором вводят терапевтически эффективное количество соединения по любому из пп.1-24.
29. Способ получения соединения по любому из пп.1-24, при котором соединение формулы (II)
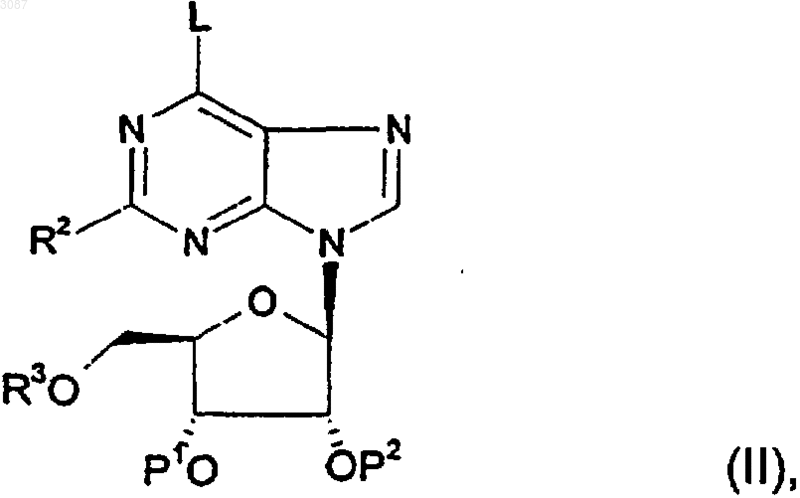
в котором L представляет собой уходящую группу, P1 и Р2 представляют собой защитные группы или Н, приводят во взаимодействие с соединением R1NH2 или его солью в щелочных условиях; при этом R1, R2 и R3 определены в п.1.
Текст
1 Настоящее изобретение относится к новым производным аденозина, к способам их получения, к содержащим их фармацевтическим композициям и к их применению в медицине. Таким образом, согласно данному изобретению предложены соединения формулы (I),которые являются агонистами к аденозиновому А 1-рецепторуR3 представляет собой прямую или разветвленную алкильную группу, состоящую из 16 атомов углерода;(1) -(алк)n-(С 3-7)циклоалкила, включая соединенный мостиковой связью циклоалкил,причем указанная циклоалкильная группа возможно замещена одним или более чем одним заместителем, выбранным из ОН, галогена,-(С 1-3)алкокси, в котором (алк) представляет собой C1-3 алкилен, и n является 0 или 1;(2) алифатической гетероциклической группы, состоящей из (4-6)-членных колец, содержащих, по меньшей мере, один гетероатом,выбранный из О, N или S, возможно замещенной одним или более чем одним заместителем,выбранным из группы,состоящей из-(С 1-3)алкила, -СO2-(С 1-4)алкила, -CO(C1-3 алкила), -S(=O)n-(С 1-3 алкила), -CONRaRb (где Ra и Rb независимо представляют собой Н или С 1-3 алкил) или =O; и в тех случаях, когда в гетероциклическом кольце находится атом серы, указанный атом серы возможно замещен (=O)n, где n является 1 или 2;(3) прямого или разветвленного С 1-12 алкила, возможно включающего в себя одну или более чем одну группу О, S(=O)n (где n является 0, 1 или 2) или N, замещенную в пределах алкильной цепи, причем указанный алкил возможно замещен одной или более чем одной из следующих групп: фенил, галоген, гидрокси илиNRaRb, где Ra и Rb оба представляют собой С 1-3 алкил или водород;(4) конденсированного бициклического ароматического кольца в котором В представляет собой 5- или 6 членную гетероциклическую ароматическую группу, содержащую 1 или более чем один атом О, N или S, причем данное бициклическое коль 003087 2 цо присоединено к атому азота формулы (I) через кольцевой атом кольца А, а кольцо В возможно замещено -CO2-(C1-3 алкилом);(5) фенильной группы, возможно замещенной одним или более чем одним заместителем, выбранным из галогена, -SО 3 Н, -(алк)nОН,-(алк)n-циано, -(O)n-С 1-6 алкила (возможно замещенного одним или более чем одним галогеном), -(алк)n-нитро, -(O)m-(алк)n-СO2Rc, -(aлк)nCONRcRd, -(алк)n-СОRc, -(aлк)n-SORe, -(алк)n-(aлк)n-SO2NRcRd,-(алк)nОRc,SO2Re,e-(алк)n(СО)mNНSO2R , -(aлк)n-NHCORc, -(алк)nNRcRd, где m и n являются 0 или 1, а алк представляет собой C1-6 алкиленовую группу или С 2-6 алкенильную группу;(6) фенильной группы, замещенной 5- или 6-членной гетероциклической ароматической группой, причем указанная гетероциклическая ароматическая группа возможно замещена С 1-3 алкилом или NRcRd;Rc и Rd каждый может независимо представлять собой водород или C1-3 алкил либо как часть группы NRcRd, Rc и Rd вместе с атомом азота могут образовывать 5- или 6-членное гетероциклическое кольцо, возможно содержащее другие гетероатомы, причем это гетероциклическое кольцо может быть возможно замещено дополнительно одной или более чем одной С 1-3 алкильной группой;Re представляет собой C1-3 алкил; при условии, что когда R3 представляет собой C1-6 алкил, R2 является C1-3 алкилом, R1 не может представлять собой фенил, возможно замещенный одним или более чем одним заместителем, выбранным из галогена, С 1-3 алкила,трифторметила,нитро,циано,-CO2Rc,c d-CONR R , -COR , -SOR , -SO2R , -SО 3 Н,-SO2NRcRd, -ORc, -NHSO2Re, -NHCORc и -NRcRd; и их соли и сольваты, в частности, их физиологически приемлемые сольваты и соли. Удобно, что аденозин-А 1-агонисты общей формулы (I), представленной выше, проявляют большую активность по отношению к аденозиновому рецептору, чем к другим подтипам аденозинового рецептора, в частности, к A3. Еще более конкретно, данные соединения проявляют слабую активность или не проявляют активности в отношении аденозинового А 3-рецептора. Следует понимать, что поскольку R1 и/или 2R в соединениях формулы (I) содержат один или более чем один асимметричный атом углерода, данное изобретение охватывает все диастереоизомеры соединений формулы (I) и их смеси. В других отношениях стереохимическая конфигурация соединений по изобретению представляется такой, как изображена выше на формуле (I). Использованный здесь термин алкил означает алкильную группу с прямой или разветвленной цепью. Примеры подходящих алкильных групп в пределах R1 и R2 включают в себя 3 метил, этил, н-пропил, изо-пропил, н-бутил,втop-бутил, тpeт-бутил и 2,2-диметилпропил. Использованный здесь термин С 2-6 алкенил означает алкенильную группу с прямой или разветвленной цепью, содержащую от 2 до 6 атомов углерода. Аллил представляет собой пример подходящей С 2-6 алкенильной группы. Использованный здесь термин алкилен означает алкиленовую группу с прямой или разветвленной цепью, содержащую 1-6 атомов углерода, например метилен. Термин галоген означает фтор, хлор,бром или иод. Под алифатической гетероциклической группой понимается циклическая группа из 4-6 атомов углерода, в которой один или более чем один атом углерода заменен(ы) гетероатомами,независимо выбранными из азота, кислорода или серы. Эта группа возможно может быть замещена, как определено здесь выше. Термин гетероциклическая ароматическая группа относится к ароматической моно- или бициклической кольцевой системе, содержащей от 5 до 10 атомов углерода, в которой один или более чем один атом углерода заменен(ы) гетероатомами, независимо выбранными из азота,кислорода или серы, причем кольцевая система возможно может быть замещена, как определено здесь выше. Фармацевтически приемлемые соли соединений формулы (I) включают в себя соли,полученные из фармацевтически приемлемых неорганических и органических кислот. Примеры подходящих кислот включают в себя соляную, бромисто-водородную, серную, азотную,перхлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2 сульфоновую и бензолсульфоновую кислоты. Особенно подходящей фармацевтически приемлемой солью соединений формулы (I) является соль гидрохлорид. Другие кислоты, как например щавелевая, не являясь сами по себе фармацевтически приемлемыми, могут быть использованы в качестве промежуточных соединений при получении соединений по изобретению и их фармацевтически приемлемых солей, полученных присоединением кислоты. Сольватами могут быть, например гидраты.C1-3 алкильную группу, в особенности метильную или этильную группу, более предпочтительно метильную.R2 предпочтительно представляет собой водород, метил или галоген, более предпочтительно водород или метил. Удобно, что R1 может представлять собой(алк)n-С 5-7 циклоалкил, включая соединенный мостиковой связью циклоалкил, где n является 0 4 или 1, и указанный циклоалкил либо замещен,по меньшей мере, одним заместителем, выбранным из галогена, в частности фтора,-(С 1-3)алкокси, в частности метокси и ОН, либо не замещен вовсе. Предпочтительно в случае,когда есть замещение, заместителем является фтор, а циклоалкил является однозамещенным. Предпочтительно n есть нуль. С другой стороны, R1 может представлять собой замещенную или незамещенную алифатическую гетероциклическую группу, причем в случае наличия замещения заместитель выбирают из группы, состоящей из С 1-3 алкила,=O,-СО-(С 1-3)алкила,-(СO2)-(С 1-4)алкила,-S(=O)n-(С 1-3)алкила (где n является 1 или 2),CONRaRb, где Ra и Rb такие, как определено здесь выше, и в тех случаях, когда в кольце находится гетероатом S, этот S возможно замещен(=O)n, где n является 1 или 2. Более предпочтительно, когда заместители представляют собой-СO2-С(1-4)алкил или метил. Удобно, когда алифатическая гетероциклическая группа не замещена или, в том случае,когда заместителем является -СO2-(С 1-4)алкил,гетероатом представляет собой N, и заместитель непосредственно присоединен к указанному кольцевому атому азота. Гетероциклическое кольцо предпочтительно является 6-членным и более предпочтительно содержит только один гетероатом N, О или S. С другой стороны, R1 может представлять собой прямой или разветвленный алкил из 1-6 атомов углерода, возможно включающий в себя,по меньшей мере, одну группу S(=O)2, О или N,замещенную в пределах цепи. Алкильная группа может быть удобным образом дополнительно замещена, по меньшей мере, одной группой,выбранной из ОН, фенила и фтора, либо быть незамещенной. С другой стороны, R1 может представлять собой фенильную группу, которая замещена одним или более чем одним заместителем, выбранным из ОН, галогена, (O)m(алк)nСO2Rc и-(алк)nОН. Предпочтительно фенил является дизамещенным по 2,4-положениям. Оба заместителя предпочтительно представляют собой галоген, более конкретно, фтор и хлор. Например, конкретная предпочтительная комбинация представляет собой 2-фторо и 4-хлоро. С другой стороны, R1 представляет собой фенильную группу, замещенную 5-тетразолильной группой, эта группа сама по себе независимо замещена C1-3 алкилом. С другой стороны, R1 представляет собой конденсированную группу в которой В представляет собой фурановое кольцо, причем указанное фурановое кольцо 5 возможно замещено -СO2(С 1-3)алкилом более предпочтительно по 2-положению. Должно быть ясно, что настоящее изобретение охватывает все комбинации конкретных и предпочтительных групп, упомянутых выше. Конкретные соединения по изобретению включают в себя 5'-O-метил-N-(тетрагидрофуран-3R-ил)аденозин,N-(2R-гидрокси-(R)-циклопентил)-5'-Oметиладенозин,5'-O-метил-N-(тетрагидропиран-4-ил)аденозин,N-(2S-метокси-(S)-циклопентил)-5'-Oметиладенозин,5'-O-метил-N-(2S-метилтетрагидрофуран 3R-ил)-аденозин,N-(3-хлор-4-гидроксифенил)-5'-O-метиладенозин,5'-O-метил-N-(1R-метил-2-фенилэтил)аденозин,N-трет-бутил-5'-O-метиладенозин,N-(2S-фтор-(S)-циклопентил)-5'-O-метиладенозин,N-(2,3-дигидроксипропиламино)-5'-Oметиладенозин,N-rеl-[(1S,4R)-бицикло[2.2.1]гепт-2R-ил]5'-O-метиладенозин,4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6-иламино]пиперидин-1-карбоновой кислоты этиловый эфир,5'-O-метил-N-[4-(2-метил-2 Н-тетразол-5 ил)фенил]аденозин,3-4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6 иламино]фенил-(Е)-акриловую кислоту,N-(4-гидроксиметилфенил)-5'-O-метиладенозин,4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6-иламино]феноксиуксусную кислоту,5-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6-иламино] бензофуран-2-карбоновой кислоты метиловый эфир,5'-O-метил-N-(тетрагидротиопиран-4-ил) аденозин,N-rеl-[(1R,5R)-бицикло[3.2.0]гепт-6S-ил]5'-O-метиладенозин,4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-2-метил-9 Н-пурин-6 иламино]пиперидин-2-он,5'-O-метил-N-(1S-метоксиметил-2-метилпропил)аденозин,N-(2-гидрокси-1R-метилэтил)-5'-O-метиладенозин,N-(2-фтор-1R-метилэтил)-5'-O-метиладенозин,N-(1S-фтopмeтил-2-мeтoкcиэтил)-5'-Oмeтилaдeнoзин,N-(3-аминопропил)-5'-O-метиладенозин, 003087 6 2-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-2-метил-9 Н-пурин-6 иламино]этансульфоновой кислоты метиламид,N-циклопентил-2-метил-5'-O-метиладенозин,N-циклопропилметил-2-метил-5'-O-метиладенозин. Соединения по изобретению применяются в качестве ингибиторов липолиза, т.е. они уменьшают концентрации свободных жирных кислот в плазме. Следовательно, данные соединения могут быть использованы при лечении гиперлипидемий. Более того, вследствие их антилиполитической активности данные соединения обладают способностью к снижению повышенных уровней глюкозы, инсулина и кетоновых тел в крови и поэтому могут представлять ценность при терапии диабета. Поскольку антилиполитические агенты обладают гиполипидемической и гипофибриногенемической активностью, данные соединения также могут показывать антиатеросклеротическую активность. Антилиполитическая активность соединений по изобретению была продемонстрирована по их способности снижать концентрацию неэтерифицированных жирных кислот (NEFA) у голодных кроликов при пероральном дозировании согласно способу, описанному Р. Strong et al. вClinical Science (1993), 84, 663-669. В дополнение к их антилиполитическому действию соединения по изобретению могут независимо воздействовать на сердечную деятельность путем снижения частоты сердечных сокращений и сердечной проводимости. Таким образом, данные соединения могут быть использованы в терапии ряда сердечнососудистых расстройств, например сердечных аритмий, в частности после инфаркта миокарда,и стенокардии. Более того, соединения по изобретению полезны в качестве кардиопротекторных агентов, имеющих применение при лечении ишемической болезни сердца. Использованный здесь термин ишемическая болезнь сердца включает в себя повреждение, связанное как с ишемией, так и с реперфузией миокарда, например связанное с аортокоронарным шунтированием(CABG), чрескожной катеторной коронаропластикой (РТСА), кардиоплегией, острым инфарктом миокарда, тромболизом, стабильной и нестабильной стенокардией и хирургическим вмешательством на сердце, включая, в частности, трансплантацию сердца. Вдобавок, соединения по изобретению полезны для лечения ишемического повреждения других органов. Соединения по изобретению могут также быть ценными при лечении других расстройств, возникающих как результат широко распространенного атероматозного заболевания, например заболевания периферических сосудов (PVD) и удара. 7 Кроме того, данные соединения могут ингибировать высвобождение ренина и таким образом быть полезными в терапии гипертензии и сердечной недостаточности. Соединения также могут быть полезны в качестве агентов ЦНС(например как снотворные, седативные средства, аналгетики и/или противосудорожные средства, в частности находящие применение при лечении эпилепсии). Вдобавок, соединения по изобретению могут найти применение при лечении приступов апноэ во сне. Соединение формулы (I) и его фармацевтически приемлемые соли, полученные присоединением кислоты, полезны в качестве аналгетиков. Следовательно, они полезны для лечения или предотвращения боли. Они могут использоваться для улучшения состояния реципиента,обычно человека, страдающего от боли. Они могут применяться для облегчения боли у реципиента. Таким образом, соединение формулы (I) и его фармацевтически приемлемые соли, полученные присоединением кислоты, могут быть использованы в качестве предупреждающего аналгетика для лечения острой боли, такой как скелетно-мышечная боль, боль после операции и при хирургическом вмешательстве, хронической боли, такой как хроническая боль воспалительного характера (например при ревматоидном артрите и остеоартрите), невропатической боли (например, постгерпетической невралгии,невропатиях, связанных с диабетом, невралгии тройничного нерва и симпатически поддерживаемой боли) и боли, связанной с раком и фибромиалгией. Соединение формулы (I) также может быть использовано при лечении или предотвращении боли, связанной с мигренью, головной болью, обусловленной давлением, и гистаминовыми головными болями, и боли,связанной с функциональными кишечными расстройствами (например IBS), боли грудной клетки несердечного происхождения и неязвенной диспепсии. Согласно изобретению предложено соединение формулы (I) или его физиологически приемлемые соль либо сольват для использования в терапии и, в частности, при лечении субъекта человека или животного, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений и сердечной проводимости,либо указанная терапия включает в себя лечение ишемической болезни сердца, заболевания периферических сосудов и удара, либо это субъект страдает от расстройства ЦНС, приступов апноэ во сне или от боли. Согласно еще одному аспекту изобретения предложен способ лечения человека или животного, страдающего от состояния, при котором полезным является уменьшение концентрации 8 свободных жирных кислот в плазме или снижение частоты сердечных сокращений и сердечной проводимости, либо страдающего от ишемической болезни сердца, заболевания периферических сосудов и удара или восприимчивого к ним, либо страдающего расстройством ЦНС,или страдающего от приступов апноэ во сне,или страдающего от боли; при котором субъекту вводят эффективное количество соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата. Что касается вышеупомянутого лечения ишемии, то согласно совершенно неожиданному аспекту настоящего изобретения было обнаружено, что не только введение соединения формулы (I) до развития ишемии обеспечивает защиту от инфаркта миокарда, но защита также обеспечивается, если соединение формулы (I) вводят после ишемического события и перед реперфузией. Это означает, что способы по настоящему изобретению применимы не только тогда, когда ишемия планируется или ожидается, например при хирургическом вмешательстве на сердце, но также в случаях внезапной или неожиданной ишемии, например сердечного приступа и нестабильной стенокардии. Ясно, что ссылка на лечение включает в себя неотложное лечение или профилактику,равно как и облегчение установленных симптомов. Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая, по меньшей мере, одно соединение формулы (I) или его фармацевтически приемлемую соль либо сольват вместе с фармацевтическим носителем и/или эксципиентом. Согласно другому аспекту изобретения предложена фармацевтическая композиция, содержащая в качестве активного ингредиента, по меньшей мере, одно соединение формулы (I) или его фармацевтически приемлемую соль либо сольват вместе с фармацевтическим носителем и/или эксципиентом, для применения в терапии и, в частности, для лечения человека или животного, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений и сердечной проводимости, либо страдающего от ишемической болезни сердца, заболевания периферических сосудов и удара или восприимчивого к ним, либо страдающего от расстройства ЦНС, приступов апноэ во сне или от боли. Кроме того, согласно настоящему изобретению предложен способ получения фармацевтической композиции, при котором смешивают,по меньшей мере, одно соединение формулы (I) или его физиологически приемлемую соль либо сольват вместе с фармацевтически приемлемым носителем и/или эксципиентом. Композиции по изобретению могут быть изготовлены для местного, перорального, 9 трансбуккального, парентерального или ректального введения либо в форме, подходящей для введения посредством ингаляции или инсуффляции. Предпочтительно пероральное введение. Композиции могут быть выполнены с возможностью для непрерывного высвобождения. Фармацевтическая композиция для местного введения может быть удобным образом представлена в форме трансдермального пластыря. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты, например крахмальный клей или поливинилпирролидон; наполнители, например лактозу, микрокристаллическую целлюлозу или кукурузный крахмал; смазывающие вещества, например стеарат магния или стеариновую кислоту; разрыхлители,например картофельный крахмал, кроскармелозы натриевую соль или крахмальный гликолят натрия; либо увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть изготовлены с покрытием согласно способам,хорошо известным специалистам. Пероральные жидкие препараты могут быть в форме, например водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров либо могут быть представлены в виде сухого продукта для разведения в воде или в другом подходящем наполнителе перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сироп сорбита, метилцеллюлозу или карбоксиметилцеллюлозу; эмульгаторы, например моноолеат сорбитана; неводные наполнители (которые могут включать в себя пищевые масла), например пропиленгликоль или этиловый спирт; и консерванты, например метил-или пропил-п-гидроксибензоаты либо сорбиновую кислоту. Кроме того, препараты могут содержать буферные соли, корригенты, красители и подсластители (например, маннит), как целесообразно. Композиции для трансбуккального введения могут иметь форму таблеток или лепешек,приготовленных традиционным образом. Соединения формулы (I) могут быть приготовлены для парентерального введения посредством болюсной инъекции или непрерывной инфузии и могут быть представлены в стандартной лекарственной форме в ампулах или в упаковках для многократного приема с добавленным консервантом. Композиции также могут находиться в таких формах, как суспензии, растворы или эмульсии в масляных или водных наполнителях, и могут содержать такие вспомогательные агенты, как суспендирующие, стабилизирующие и/или диспергирующие агенты. С другой стороны, активный ингредиент может быть в порошкообразной форме для разведения 10 в подходящем наполнителе, например стерильной апирогеннной воде, перед применением. Соединения формулы (I) могут быть приготовлены в виде суппозиториев, например содержащих такие традиционные основы для суппозиториев, как масло какао или другие глицериды. Предполагаемая доза соединения по изобретению для введения человеку (с массой приблизительно 70 кг) составляет от 1 мг до 2 г,предпочтительно от 1 до 100 мг активного ингредиента на стандартную дозу, которая может быть введена, например, от 1 до 4 раз в сутки. Ясно, что может оказаться необходимым внести соответствующие изменения в данную дозировку в зависимости от возраста и состояния пациента. Дозировка также будет зависеть от способа введения. Кроме того, согласно еще одному аспекту изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемых соли либо сольвата для производства лекарства для лечения субъекта - человека или животного, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений и сердечной проводимости, либо страдающего от ишемической болезни сердца, заболевания периферических сосудов (PVD) или удара или восприимчивого к ним, либо страдающего от расстройства ЦНС, приступов апноэ во сне или от боли. Соединения формулы (I) и их физиологически приемлемые соли либо сольваты могут быть получены с помощью способов, описанных здесь далее, причем указанные способы составляют еще один аспект изобретения. В последующем описании группы R1, R2 и R3 такие, как определены для соединений формулы(I), если не установлено по-другому. Согласно первому общему способу (А) соединение формулы (I) может быть получено путем взаимодействия соединения формулы (II) в котором L представляет собой уходящую группу, такую как атом галогена (например,атом хлора), а Р 1 и Р 2 представляют собой водород или подходящую защитную группу (например, ацетильную), с соединением формулыR1NH2 или его солью в щелочных условиях. Соединения формулы (II) могут быть использованы для получения соединений формулы (I) путем непосредственного взаимодействия с группой R1NH2 или в отсутствие, или в при 11 сутствии растворителя, такого как спирт (например, низший алканол, такой как изопропанол, трет-бутанол или 3-пентанол), эфир (например, тетрагидрофуран или диоксан), замещенный амид (например, диметилформамид),галогенированный углеводород (например хлороформ) или ацетонитрил, предпочтительно при повышенной температуре (например, вплоть до температуры дефлегмации растворителя) в присутствии подходящего акцептора кислоты, например неорганических оснований, таких как карбонат натрия или калия, либо органических оснований, таких как триэтиламин, диизопропилэтиламин или пиридин. Этой реакции может предшествовать или за ней может следовать, где целесообразно, удаление in situ защитных групп Р 1 и Р 2. Например,когда Р 1 и Р 2 представляют собой ацетил, это может быть осуществлено с помощью амина,такого как аммиак или трет-бутиламин, в растворителе, таком как метанол. Соединения формулы (II) могут быть получены путем взаимодействия соединения формулы (III) в котором Р 3 представляет собой подходящую защитную группу, например С 1-3 алкил или ацетил), а Р 1, Р 2 и R3 такие, как определены выше, с соединением формулы (IV) где L и R2 такие, как определено выше. Удобным образом реакцию осуществляют в подходящем растворителе, таком как ацетонитрил, в присутствии силилирующего агента,такого как триметилсилилтрифторметансульфонат, и основания, такого как диазабицикло[5.4.0.]ундец-7-ен (DBU). С другой стороны,соединение формулы (IV) сначала может быть силилировано подходящим силилирующим агентом, таким как гексаметилдисилазан, с последующим взаимодействием силилированного промежуточного соединения с соединением формулы (III) и подходящей кислотой Льюиса,например триметилсилилтрифторметансульфонатом, в подходящем растворителе, таком как ацетонитрил. Соединения формулы (IV) либо известны специалистам, либо могут быть получены из известных соединений, используя способы, аналогичные использованным для получения известных соединений формулы (IV). Соединения формулы (III) могут быть получены из альтернативно защищенных соединений путем замены альтернативных защитных групп на Р 1 и Р 2; например в том случае, когда 12 Р 1 и Р 2 представляют собой ацетил, соединения формулы (III) могут быть получены из соединений формулы (V), в которых Р 4 и Р 5 представляют собой С 1-3 алкил, а Р 3 такая, как определена выше, путем катализируемого кислотой удаления алкилидиновой защитной группы, например с помощью хлористого водорода в метаноле, с последующим in situ ацилированием, например уксусным ангидридом в присутствии основания,такого как пиридин, в растворителе, таком как дихлорметан. Соединения формулы (V) представляют собой известные соединения или получаются с помощью способов, аналогичных способам,используемым специалистами для получения известных соединений формулы V. Специалистам ясно, что ацетильная группа в любых соединениях, упомянутых выше, могла бы быть заменена любой подходящей защитной группой,например другими эфирами. Аналогичными способами соединения формул (I) или (II) также могут быть получены из соединений, в которых алкилидиновые группы, определенные как Р 4 и Р 5, заменяют Р 1 и Р 2. Эта реакция представляет собой замену одной защитной группы на другую, и такие реакции известны специалистам. Еще один способ (Б) заключается в превращении соединения формулы (I) в другое соединение формулы (I) посредством изменения в нем группы R1, R2 или R3. Некоторые соединения формул (II), (III),(IV) и (V) представляют собой новые промежуточные соединения и составляют еще один аспект настоящего изобретения. Соединения формулы R1NH2 являются либо известными соединениями, либо могут быть получены из известных соединений с использованием традиционных методик. Определенные оптические изомеры соединения формулы (I) могут быть получены с помощью традиционных способов, например путем синтеза из исходного материала с соответствующей асимметрией с использованием любого из способов, описанных здесь, или, где целесообразно, путем разделения смеси изомеров соединения формулы (I) с помощью традиционных способов, например фракционной кристаллизацией или хроматографией. В описанных выше общих способах полученное соединение формулы (I) может существовать в форме соли, удобно в форме фармацевтически приемлемой соли. Где желательно, такие соли могут быть превращены в соответствующие свободные основания с использованием традиционных способов. 13 Фармацевтически приемлемые полученные присоединением кислоты соли соединений формулы (I) могут быть получены взаимодействием соединения формулы (I) с соответствующей кислотой в присутствии подходящего растворителя, такого как ацетонитрил, ацетон, хлороформ, этилацетат или спирт (например, метанол, этанол или изопропанол). Фармацевтически приемлемые полученные присоединением основания соли соединений формулы (I) могут быть получены аналогичным образом путем обработки раствора соединения формулы (I) подходящим основанием. Кроме того, фармацевтически приемлемые соли могут быть получены из других солей, включая другие фармацевтически приемлемые соли соединений формулы (I), используя традиционные способы. Далее изобретение иллюстрируется следующими не ограничивающими промежуточными соединениями и примерами. Температура дается в С. Стандартные условия ВЭЖХ представляют собой следующие. Колонка для стандартной автоматизированной препаративной ВЭЖХ, условия и элюент. Автоматизированную препаративную высокоэффективную жидкостную хроматографиюSupelco ABZ + колонку 5 мкм размером 10022 мм (внутренний диаметр) с элюированием смесью растворителей, состоящей из (1) 0,1% муравьиная кислота в воде и (2) 0,05% муравьиная кислота в ацетонитриле, причем элюент выражают в виде процентного содержания (2) в смеси растворителей, при скорости потока 4 мл в минуту. Если не установлено иначе, используют элюент в виде градиента 0-95% (2) в продолжение 20 мин. Система ЖХ/МС (время пробега 5,5 мин). Данная система использует ABZ + PLUS,колонку 3,3 см 4,6 мм (внутренний диаметр),элюирование растворителями: А - 0,1% (о/о) муравьиная кислота; и Б - смесь 95:5 ацетонитрил:вода + 0,07% (о/о) муравьиная кислота, при скорости потока 1,5 мл в минуту. Используют следующий градиентный протокол: 100% А в течение 0,2 мин; смеси А+Б, градиентный профиль 0-100% Б в продолжение 3,5 мин; выдерживание при 100% Б в течение 1 мин; возврат к 100% А в продолжение 0,2 мин. В этой системе используется platform-спектрометр для определения микромасс со способом ионизации электрораспылением, переключением положительных и отрицательных ионов, в интервале масс 80-1000 а.м.е. Система ВЭЖХ. Система аналитической ВЭЖХ использует колонку BDS-C18 5 мкм 5591, элюирование смесью ацетонитрила в воде, начиная от 30% 14 ацетонитрил/вода и увеличивая до 60% ацетонитрила, в продолжение 10 мин со скоростью потока 1,0 мл/мин. В данной системе используется регистрация с помощью детектора на основе диода при длине волны 226 нм в УФ. Флэш-хроматографию осуществляют на силикагеле Мерк (Merck 9385) или на оксиде алюминия Мерк (Merck 1077). Промежуточное соединение 1. 4R-Ацетокси-5-метокси-2R-метоксиметилтетрагидрофуран-3R-иловый эфир уксусной кислоты. Ацетилхлорид (29,4 мл) добавляют к метанолу (1806 мл), добавляют (3 аR,4R,6R,6 аR)-4 метокси-6-метоксиметил-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол [Gudmundsson et al.;J. Med. Chem. (1997) 40(S), 785-793] (90,3 г) и смесь кипятят с обратным холодильником в течение 5 дней, в продолжение которых метанол постоянно отгоняют и заменяют свежим метанолом для того, чтобы довести реакцию до состояния, близкого к завершению. Добавляют пиридин (117 мл) и метанол заменяют на этилацетат путем отгонки растворителя и замены этилацетатом до тех пор, пока растворитель не перестанет отгоняться при 76C. Объем уменьшают до 400 мл, смесь охлаждают до 22C, добавляют уксусный ангидрид (136 мл) и смесь перемешивают при 22C в течение 16 ч. Смесь вливают в насыщенный водный бикарбонат натрия (500 мл) и добавляют твердый бикарбонат натрия до значения рН 7. После перемешивания в течение 30 мин производят отделение водного слоя, который дополнительно экстрагируют этилацетатом. Объединенные органические слои высушивают (МgSO4), упаривают invacuo и азеотропно отгоняют с толуолом. Дистилляция при 0,042 мбар (4,2 Па) дает указанное в заголовке соединение в виде бесцветного масла (43,6 г). ТСХ SiO2 [изогексан:этилацетат, 1:1] 2 пятна (- и -аномеры), Rf = 0,6; 0,7. Промежуточное соединение 2. 4R-Ацетокси-2R-(6-хлорпурин-9-ил)-5R-метоксиметилтетрагидрофуран-3R-иловый эфир уксусной кислоты. 6-Хлорпурин (3,53 г), 1,1,1,3,3,3-гексаметилдисилазан (12 мл) и толуол (40 мл) кипятят с обратным холодильником в атмосфере азота в течение 105 мин. Растворитель удаляютin vacuo. Остаток переводят в безводный ацетонитрил (50 мл), обрабатывают 4R-ацетокси-5 метокси-2R-метоксиметилтетрагидрофуран-3Rиловым эфиром уксусной кислоты (2,00 г) и триметилсилилтрифторметансульфонатом (1,9 мл), затем кипятят с обратным холодильником в течение 4,5 ч. Полученный раствор охлаждают до 20, вливают в 8%-й раствор бикарбоната натрия и экстрагируют этилацетатом. Органические экстракты высушивают (MgSO4), упаривают in vacuo и остаток очищают флэшхроматографией на силикагеле с элюированием смесью циклогексан-этилацетат (градиент 5:1 15 3:1), что позволяет получить указанное в заголовке соединение (2,3 г). Масс-спектр m/z 385 (MH+). Промежуточное соединение 3. 6-Хлор-9(6R-метоксиметил-2,2-диметилтетрагидро(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-9 Нпурин. 6-Хлор-9-[2,3-O-(1-метилэтилиден)Dрибофуранозил]-9 Н-пурин [Н Guilford, РО Larsson, К Mosbach, Chem. Scr., 1972, 2(4), 165-170](6,0 г) растворяют в безводном диоксане (150 мл) и в течение 10 мин при комнатной температуре порциями добавляют гидрид натрия (60%ую суспензию в масле; 0,75 г). Смесь перемешивают в течение 0,5 ч и добавляют безводный хлорид бензилтриэтиламмония (1,5 г). Через следующие 0,25 ч добавляют диметилсульфат (3 мл; 4,0 г; 31,6 ммоль) и перемешивание продолжают в течение ночи, получая слегка мутный раствор. После суммарных 24 ч добавляют уксусную кислоту (1,5 мл), раствор упаривают досуха и полученное масло распределяют между водой и этилацетатом. Объединенные органические фазы высушивают и концентрируют invacuo. Остаток очищают флэш-хроматографией на силикагеле с элюированием смесью циклогексан-этилацетат (1:1), что позволяет получить указанное в заголовке соединение в виде бесцветного масла (2,5 г). ТСХ SiO2 [ЕtOАс:циклогексан, 2:1] Rf = 0,50. Промежуточное соединение 3 (альтернативный способ). 6-Хлор-9-(6R-метоксиметил 2,2-диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-9 Н-пурин. Смесь 6-хлор-9-[2,3-O-(1-метилэтилиден)-D-рибофуранозил]-9 Н-пурина (0,50 г), оксида серебра (I) (0,40 г) и метилиодида (10 мл) в ацетоне (10 мл) перемешивают при температуре дефлегмации в течение 4 ч, затем оставляют при комнатной температуре на 40 ч. Смесь повторно кипятят с обратным холодильником в течение 6 ч и затем оставляют охлаждаться до комнатной температуры на 16 ч. Осадок фильтруют через(от 2:1 до 1:1), что позволяет получить указанное в заголовке соединение в виде бесцветного масла (151 мг). ТСХ SiO2 [ЕtOАс:циклогексан, 1:1] Rf = 0,2. Промежуточное соединение 4. (2R,3R,4S,5R)-2-(6-Хлорпурин-9-ил)-5-метоксиметилтетрагидрофуран-3,4-диол. Холодную трифторуксусную кислоту (6 мл) добавляют к 6-хлор-9-(6R-метоксиметил 2,2-диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-9 Н-пурину (1,5 г), охлажденному во льду. Добавляют воду (0,6 мл) и смесь перемешивают при 4C в течение 3 ч. Хо 003087 16 лодный раствор порциями добавляют к холодному 8%-му бикарбонату натрия (40 мл) и смесь подщелачивают добавлением твердого бикарбоната натрия. Смесь экстрагируют этилацетатом и экстракты высушивают и концентрируютin vacuo, получая указанное в заголовке соединение в виде пены белого цвета (1,3 г; 98 %). ТСХ SiO2 [ЕtOАс:циклогексан, 1:2] Rf = 0,20. Промежуточное соединение 5. (1R,2R)-2[9-(6R-Метоксиметил-2,2-диметилтетрагидро(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-9 Нпурин-6-иламино]циклопентанол. Раствор 6-хлор-9-(6R-метоксиметил-2,2 диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3] диоксол-4R-ил)-9 Н-пурина (350 мг), (1R,транс)2-гидроксициклопентиламина гидрохлорида(155 мг) и N,N-диизопропилэтиламина (0,61 мл) в изопропаноле (5 мл) перемешивают при температуре дефлегмации в атмосфере азота в течение 18 ч. Реакционную смесь концентрируютin vacuo и остаток очищают флэшхроматографией на силикагеле с элюированием смесью толуол:этанол:триэтиламин (90:10:1),получая пену белого цвета (395 мг). ТСХ SiO2 [толуол:этанол:триэтиламин,90:10:1] Rf = 0,41. Промежуточное соединение 6. Метиловый эфир 4-[9-(6R-метоксиметил-2,2-диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4Rил)-9 Н-пурин-6-иламино]бензойной кислоты. Раствор 6-хлор-9-(6R-метоксиметил-2,2 диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3] диоксол-4R-ил)-9 Н-пурина (1,0 г), метил-4 аминобензоата (1,11 г) и N,N-диизопропилэтиламина (1,54 мл) в изопропаноле (25 мл) перемешивают при температуре дефлегмации в атмосфере азота. Через 6 дней и 13 дней добавляют еще две порции диизопропилэтиламина(1,03 мл). После суммарных 17 дней раствор концентрируют и очищают флэш-хроматографией на силикагеле с элюированием смесью этилацетагциклогексан (1:2). Это дает указанное в заголовке соединение в виде пены белого цвета (668 мг). ТСХ SiO2 [ЕtOАс:циклогексан, 1:2] Rf = 0,11. Промежуточное соединение 7. 4-[9-(6RМетоксиметил-2,2-диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-9 Н-пурин 6-иламино]фенилметанол. Раствор метилового эфира 4-[9-(6Rметоксиметил-2,2-диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3]диоксол-4R-ил)-9 Н-пурин 6-иламино]бензойной кислоты (100 мг) в ТГФ(5 мл) добавляют к суспензии алюмогидрида лития (10 мг) в ТГФ (4 мл) в атмосфере азота. Полученную смесь перемешивают при комнатной температуре в течение 3 ч. В течение 6 ч добавляют еще две порции (0,705 ммоль) алюмогидрида лития. По прошествии суммарных 21 ч реакцию в реакционной смеси останавливают 17 добавлением воды (0,05 мл), раствора гидроксида натрия (3 н.; 0,05 мл), затем снова воды (0,15 мл). Смесь перемешивают в течение 1 ч, твердое вещество отделяют фильтрованием (hyflo) и промывают метанолом. Фильтрат и промывки концентрируют in vacuo, получая твердое вещество желтого цвета. Его очищают флэшхроматографией на силикагеле с элюированием смесью циклогексан:этилацетат (1:9), получая указанное в заголовке соединение в виде масла желтого цвета (33 мг). ТСХ, диоксид кремния [ЕtOАс] Rf = 0,30. Промежуточное соединение 8. 4R-Ацетокси-2R-(6-хлор-2-метилпурин-9-ил)-5R-метоксиметилтетрагидрофуран-3R-иловый эфир уксусной кислоты. 6-Хлор-2-метил-9 Н-пурина гидрохлорид(18,4 г) добавляют при 20C к перемешиваемому раствору 4R-ацетокси-5-метокси-2R-метоксиметилтетрагидрофуран-3R-илового эфира уксусной кислоты (промежуточное соединение 1) (20,0 г) в ацетонитриле (200 мл). Добавляют 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (34,2 мл) в виде двух порций, поддерживая температуру при 155C. После перемешивания в течение 5 мин при 20C в течение 3 мин по каплям добавляют триметилсилилтрифторметансульфонат (73,7 мл), поддерживая температуру при 20C. Смесь нагревают до 60C в течение 2 ч и с помощью канюли переносят в воду (400 мл),содержащую карбонат калия (84 г). Смесь экстрагируют этилацетатом (4100 мл), органические слои промывают 0,5 М соляной кислотой(200 мл) и водным карбонатом калия, высушивают (MgSO4) и упаривают in vacuo. Масляный остаток очищают хроматографией на силикагеле с элюированием этилацетатом и перекристаллизацией из этилацетата, получая указанное в заголовке соединение (16,5 г). ТСХ SiO2 [этилацетат:циклогексан, 1:1] Rf(31 мл) по каплям добавляют к охлажденной во льду суспензии гидрида натрия (60%-й суспензии в масле; 1,09 г) в безводном диметилформамиде (8 мл). Полученную суспензию перемешивают при комнатной температуре в течение 2 ч,повторно охлаждают до 0C и обрабатывают иодметаном (0,82 мл). Реакционную смесь перемешивают при комнатной температуре в течение 20 ч, добавляют уксусную кислоту (1,54 мл) и перемешивание продолжают в течение следующих 24 ч. Растворитель удаляют под вакуумом и остаток очищают флэш-хроматографией на колонке с диоксидом кремния с элюированием смесью дихлорметан/метанол/аммиак(от 97:3:0,5 до 95:5:0,5), получая указанное в заголовке соединение (1,16 г) в виде светлокоричневой пены. ТСХ SiO2 [дихлорметан/метанол/аммиак,90:10:1] Rf = 0,38. Промежуточное соединение 10. 1-(6-Хлор 2-метил-9 Н-пурин-9-ил)-1-дезокси-5-O-метил 2,3-O-(1-метилэтилиден)D-рибофураноза. Оксихлорид фосфора (0,8 мл) добавляют к смеси промежуточного соединения 9 (1,16 г) и 4-диметиламинопиридина (462 мг) в безводном ацетонитриле (15 мл), который затем перемешивают при температуре дефлегмации в течение 2,75 ч. Охлажденный раствор концентрируют под вакуумом и остаток подщелачивают,используя 2 н. карбонат натрия (75 мл). Водную смесь экстрагируют этилацетатом (х 2) и объединенные органические экстракты высушивают(Na2SO4) и концентрируют до масла коричневого цвета,которое очищают флэшхроматографией на колонке с диоксидом кремния с элюированием смесью циклогексан/ этилацетат (1:1), получая указанное в заголовке соединение (436 мг) в виде бесцветного масла. ТСХ SiO2 (циклогексан/этилацетат, 1:1) Rf= 0,29. Промежуточное соединение 11. 1-(6-Хлор 2-метил-9 Н-пурин-9-ил)-1-дезокси-5-O-метил-D-рибофураноза. Охлажденное во льду промежуточное соединение 2 (415 мг) обрабатывают охлажденной во льду смесью трифторуксусной кислоты (4,2 мл) и воды (0,42 мл) и реакционную смесь перемешивают при 0C в течение 1,5 ч. Избыток трифторуксусной кислоты удаляют под вакуумом и остаток очищают флэш-хроматографией на колонке с диоксидом кремния (Merck 9385,дихлорметан/метанол/аммиак, 130:10:1), получая указанное в заголовке соединение (276 мг) в виде твердого вещества белого цвета. ТСХ, диоксид кремния (дихлорметан/метанол/аммиак, 90:10:1) Rf = 0,48. В альтернативном способе промежуточное соединение 11 синтезируют согласно следующей далее методике. трет-Бутиламин (3,5 мл) добавляют к охлажденной суспензии 4R-ацетокси-2R-(6-хлор 2-метилпурин-9-ил)-5R-метоксиметилтетрагидрофуран-3R-илового эфира уксусной кислоты (промежуточное соединение 8) (4,75 г) в метаноле (53 мл) и смесь перемешивают при 0C в течение 1,5 ч. Смесь фильтруют, остаток промывают метанолом и высушивают in vacuo при 50C, получая указанное в заголовке соединение в виде порошка белого цвета (0,9 г). Концентрирование маточных жидкостей in vacuo и растирание остатка с диизопропиловым эфиром (25 мл) дополнительно дает указанное в заголовке соединение (2,6 г) в виде порошка белого цвета. Пример 1. 5'-O-Метил-N-(тетрагидрофуран-3R-ил)аденозин.(0,27 мл) и изопропанола (5 мл) нагревают при температуре дефлегмации в течение 24 ч и затем охлаждают до комнатной температуры. Добавляют диоксид кремния (Merck 7734) и смесь концентрируют in vacuo. Твердый остаток очищают флэш-хроматографией на силикагеле с элюированием смесью этилацетат:метанол(19:1). Полученное твердое вещество белого цвета перекристаллизовывают из этилацетата,чтобы получить указанное в заголовке соединение в виде порошка белого цвета (90 мг). Анализ. Обнаружено: С, 50,3; Н, 5,9; N,19,5. C15H21N5O50,3H2O соответствует: С, 50,5; Н, 6,1; N, 19,6%. Т.п. = 179-180 С. Все соединения из следующих далее примеров получают из промежуточного соединения 4 способами, аналогичными изложенному в примере 1, используя продолжительность взаимодействия и стехиометрию в зависимости от реакционной способности амина. Пример 2. 5'-O-Метил-N-(тетрагидропиран-4-ил)аденозин. Анализ. Обнаружено: С, 52,7; Н, 6,5; N,18,9. C16H23N5O5 соответствует: С, 52,6; Н, 6,3;(235 мг) охлаждают в ледяной бане, затем обрабатывают охлажденной во льду смесью трифторуксусная кислота:вода (10:1; 2,75 мл). Через 1 ч раствор концентрируют in vacuo и остаток очищают флэш-хроматографией на силикагеле с элюированием смесью дихлорметан:метанол: аммиак (94:6:1, затем 90:10:1). Неочищенный продукт растирают с теплым этилацетатом, затем с холодным эфиром, получая указанное в заголовке соединение в виде твердого вещества белого цвета (130 мг). Анализ. Обнаружено: С, 52,8; Н, 6,6; N,19,2. C16H23N5O5 соответствует: С, 52,6; Н, 6,3;N-(3-Аминопропил)-5'-Oметиладенозин. Это соединение получают аналогично соединению из примера 17. Анализ. Обнаружено: С, 45,6; Н, 6,2; N,21,6. С 20 Н 25N5O41,7 Н 2O соответствует: С, 45,6; Н, 6,9; N, 22,7%. ЖХ/МС: Rt = 1,69 мин; масс-спектр m/z 339 (MH+). Пример 19.N-трет-Бутил-5'-O-метиладенозин. 4R-Ацетокси-2R-(6-хлорпурин-9-ил)-5Rметоксиметилтетрагидрофуран-3R-иловый эфир уксусной кислоты (1,15 г) растворяют в метаноле (15 мл), охлаждают до 0-5 и добавляют трeтбутиламин (10 мл). Раствор оставляют при температуре 0-5C на 1 ч, затем упаривают досухаin vacuo, что позволяет получить твердое вещество белого цвета (0,99 г), которое очищают флэш-хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (99:1-4:1),что позволяет получить промежуточное соединение 2 в виде твердого вещества белого цвета,а также указанное в заголовке соединение в виде твердого вещества белого цвета (44 мг). Масс-спектр m/z 338 (МH+). ЯМР CDCl3 8.28(1H, s, CH), 8.04(1H, s,CH), 6.5(1H, vшир.s, ОН), 6.0(1H, d, CH),5.82(1H, шир.s, ОН), 4.5-4.35(3 Н, m, 3 хСН),3.8-3.55(3 Н, шир.s+m, NH+CH2), 3.38(3 Н, s,OMe), 1.57(9 Н, s, t-But). Пример 20. N-(2S-Фтор-(S)-циклопентил)5'-O-метиладенозин. 4R-Ацетокси-2R-(6-хлорпурин-9-ил)-5Rметоксиметилтетрагидрофуран-3R-иловый эфир уксусной кислоты (50 мг), (1S,2S)-2-фторциклопентиламина гидрохлорид (71 мг) и диизопропилэтиламин (0,14 мл) нагревают при 80 в изопропаноле (5 мл) в reactivial в течение 17 ч. Раствор упаривают в токе азота и очищают автопрепаративной ВЭЖХ, что позволяет полу 003087 22 чить указанное в заголовке соединение в виде бесцветного твердого вещества (33 мг). Масс-спектр m/z 368 (МН+). ЯМР d4-МеОD 8.4(1H, s, CH), 8.3(1H,s, CH), 6.08(1H, d, CH), 5.05(1H, dm, CH, JFCH ,50 Гц), 4.70(1H, br, CH), 4.56(1H, t,CH), 4.32(1H, t, CH), 4.2(1H, m, CH), 3.69(2 Н, m, CH2), 3.45 (3 Н, s, -OMe), 2.4-1.65 (6 Н, m,3 хСН 2). Следующие далее соединения получают из промежуточного соединения 20 аналогично способам из примера 20. Пример 21. N-(2,3-Дигидроксипропиламино)-5'-O-метиладенозин. Масс-спектр m/z 356 (МН+). ЯМР d4-MeOD 8.33(1H, s, CH), 8.26(4,0 мл) и воду (0,4 мл) добавляют к охлажденному во льду 4-[9-(6R-метоксиметил-2,2 диметилтетрагидро-(3 аR,6 аR)-фуро[3,4-d][1,3] диоксол-4R-ил)-9 Н-пурин-6-иламино]фенил метанолу (370 мг) и перемешивают в течение 1,5 ч. Этот материал затем по каплям добавляют к охлажденному во льду раствору бикарбоната натрия (8%-му; 40 мл) и добавляют дополнительное количество бикарбоната натрия до тех пор, пока значение рН не установится в интервале от 8 до 9. Смесь экстрагируют этилацетатом, органические слои объединяют, высушивают (Na2SO4) и концентрируют, получая твердое вещество белого цвета (300 мг). Его очищают флэш-хроматографией на силикагеле с элюированием смесью дихлорметан:метанол: 23 0,88 аммиак (923:70:7), получая указанное в заголовке соединение в виде твердого вещества белого цвета. ТСХ SiO2 [дихлорметан:метанол:0,88 аммиак (923:70:7)] Rf = 0,14. ЖХ/МС: Rt = 2,23 мин; масс-спектр m/z 338 (МН+). Пример 25. 2-[9-(3R,4S-Дигидрокси-5Rметоксиметилтетрагидрофуран-2R-ил)-2-метил 9 Н-пурин-6-иламино]этансульфоновой кислоты метиламид. Смесь 1-(6-хлор-2-метил-9 Н-пурин-9-ил)1-дезокси-5-O-метилD-рибофуранозы (0,15 г) и гидрохлорида метиламида 2-аминоэтансульфоновой кислоты (0,13 г) в изопропаноле (12 мл), содержащем диизопропилэтиламин (0,3 мл), перемешивают при 95C в течение 42 ч в атмосфере азота. Раствор затем охлаждают до комнатной температуры и концентрируют invacuo, получая смолу желтого цвета (0,47 г),которую дважды очищают флэш-хроматографией на силикагеле с элюированием смесью дихлорметан:этанол:аммиак (100:8:1-75:8:1) и смесью дихлорметан:этанол:аммиак (100:8:1),получая указанное в заголовке соединение (52 мг) в виде твердого вещества бледно-желтой окраски. Масс-спектр m/z 417 (MH+). Анализ. Обнаружено: С, 42,6; Н, 5,6; N,19,6. C15H24N6O6S соответствует: С, 43,3; Н, 5,8;N, 20,2%. Следующие далее соединения получают из 1-(6-хлор-2-метил-9 Н-пурин-9-ил)-1-дезокси-5O-метилD-рибофуранозы способами, аналогичными способам из примера 26. Пример 26. 4-[9-(3R,4S-Дигидрокси-5Rметоксиметилтетрагидрофуран-2R-ил)-2-метил 9 Н-пурин-6-иламино]пиперидин-2-он. ТСХ SiO2 [СН 2 Сl2:МеОН:880NН 3, 94:6:1]Rf = 0,21. ЖХ/МС: Rt = 2,28 мин; масс-спектр m/z 364 (MH+). Пример 28. N-Циклопропилметил-2-метил 5'-O-метиладенозин. 4R-Ацетокси-2R-(6-хлор-2-метилпурин-9 ил)-5R-метоксиметилтетрагидрофуран-3R-иловый эфир уксусной кислоты (50 мг), циклопропилметиламин (0,043 мл) и диизопропилэтиламин (0,13 мл) нагревают до температуры дефлегмации в изопропаноле (5 мл) в течение 120 ч. По охлаждении до комнатной температуры к реакционной смеси добавляют метанольный раствор аммиака (4 мл), встряхивают и оставляют на 1 день. Растворитель упаривают в токе азота и остаток очищают твердофазной экстрак 003087 24 цией (5 г картридж Varian Bondelut, аминопропилсвязанная фаза), получая указанное в заголовке соединение (32 мг) в виде твердого вещества белого цвета. Масс-спектр m/z 350 (МН+). ЯМР d4-MeOD 8.25(1H, s, CH), 6.08(1 Н, d, CH), 4.57(1 Н, t, CH), 4.34(1H, t, CH),4.2(1H, m, CH), 3.7(2 Н, m, CH2), 3.48(5 Н,m+s, CH2+OMe), 2.5(3 Н, s, -СН 3), 1.2(1 Н, m,CH), 0.65-0.28(4 Н, 2xm, 2xCH2). Эксперименты с репортерным геном Активность агонистов измеряют на клетках яичников китайского хомячка (СНО), содержащих CRE/SPAP/HYG-репортерный генHYG = гигромицин; SPAP = секреторная щелочная фосфатаза плаценты), который при стимуляции уровней цАМФ продуцирует SPAP. Используют клеточную линию, стабильно коэкспрессирующую человеческий аденозиновый А 1-рецептор. Клетки высевают в 96-луночные планшеты со средой культивирования и инкубируют при 37 С в течение 1 ч. Для измерения активности в нужные лунки добавляют агонисты в концентрациях, лежащих в интервале 10-10-10-5 M. Через 15 мин уровни цАМФ стимулируют посредством добавления максимальной концентрации форсколина (forskolin). Далее все клетки инкубируют в течение еще 5 ч при 37 С и охлаждают до комнатной температуры, после чего добавляют субстрат для фосфатазы (пнитрофенолфосфат, pNPP), который расщепляется до окрашенного реагента, и 96-луночные планшеты анализируют с помощью планшетного анализатора. Из таких анализов может быть рассчитана концентрационная зависимость ингибирования агонистом стимулируемого форсколином продуцирования SPAP. Одним из тестируемых в каждом 96-луночном планшете агонистов является стандартный неселективный агонист, N-этилкарбоксамидоаденозин (NECA),и активность всех тестируемых агонистов выражают относительно активности стандарта в виде NECA.(ECR = отношение равносильных концентраций относительно NECA = 1). Результаты Таблица 1 Биологические данные. ECR для А 1-, А 3 рецепторов в тесте с репортерным геном Пример А 1R3 представляет собой прямую или разветвленную алкильную группу из 1-6 атомов углерода;R1 представляет собой группу, выбранную из 1) -(С 1-3 алкилен)n-(С 3-7)циклоалкила или мостикового (С 4-7)циклоалкила, причем указанная циклоалкильная группа возможно замещена одним или двумя заместителями, выбранными из ОН, галогена, -(С 1-3)алкокси, где n представляет собой 0 или 1; 2) алифатической гетероциклической группы из 5-6-членных колец, содержащих один гетероатом, выбранный из О, N или S, возможно замещенной (С 1-4)алкилом, -СO2-(С 1-4)алкилом или =O; 3) прямого или разветвленного С 1-6 алкила,возможно включающего в себя один или два О,S(=O)2 или N, замещенные в пределах алкильной цепи, причем указанный алкил возможно замещен одной или двумя следующими группами: фенил, галоген, гидрокси или NН 2; 4) бензоконденсированного гетероцикла в котором В представляет собой 5- или 6 членное гетероциклическое ароматическое кольцо, содержащее один гетероатом О, N илиS, причем данный бензоконденсированный гетероцикл присоединен через кольцевой атом кольца А, а кольцо В возможно замещено-СО 2(С 1-4 алкилом); 5) фенильной группы, возможно замещенной одним или двумя заместителями, выбранными из -галогена, -(С 1-6 алкилен)n-ОН, -(С 2-6 алкенил)n-ОН,-(O)m-(С 1-6 алкилен)n-CO2Rc,-(O)m-(С 2-6 алкенил)n-СO2Rc, тетразолила, возможно замещенного С 1-4 алкилом, где m и n представляют собой 0 или 1, и Rc представляет собой водород или С 1-4 алкил; 26 при условии, что когда R3 представляет собой С 1-6 алкил, R2 представляет собой С 1-4 алкил, R1 не может представлять собой фенил,возможно замещенный одним или более чем одним заместителем, выбранным из галогена,-CO2Rc и -ORc; и его соли и сольваты, в частности его физиологически приемлемые сольваты и соли. 2. Соединение по п.1, в котором R3 представляет собой C1-3 алкил. 3. Соединение по п.2, в котором R3 представляет собой метил или этил. 4. Соединение по п.3, в котором R3 представляет собой метил. 5. Соединение по любому из пп.1-4, в котором R2 представляет собой водород, метил или галоген. 6. Соединение по п.5, в котором R2 представляет собой водород или метил. 7. Соединение по любому из пп.1-6, в котором R1 представляет собой -(С 1-3 алкилен)n-С 5-7 циклоалкил, где n представляет собой 0 или 1,возможно замещенный одним или двумя заместителями, выбранными из галогена, C1-3 алкокси и ОН, или незамещенный. 8. Соединение по п.7, в котором циклоалкильная группа является незамещенной или монозамещенной фтором. 9. Соединение по п.7 или 8, в котором n представляет собой нуль. 10. Соединение по любому из пп.1-6, в котором R1 представляет собой замещенную или незамещенную алифатическую гетероциклическую группу, причем в случае наличия замещения заместитель выбирают из группы, состоящей из С 1-4 алкила, -СO2-(С 1-4 алкила) или =O. 11. Соединение по п.10, в котором заместителем является -СO2-(С 1-4 алкил) или метил. 12. Соединение по п.11, в котором алифатическая гетероциклическая группа не замещена, или заместителем является -СO2-(С 1-4 алкил),и в тех случаях, когда гетероатомом является N,заместитель присоединен непосредственно к кольцевому атому N. 13. Соединение по любому из пп.10-12, в котором гетероциклическое кольцо является 6 членным. 14. Соединение по п.13, в котором кольцо содержит один гетероатом N, О или S. 15. Соединение по любому из пп.1-6, в котором R1 представляет собой прямой либо разветвленный алкил из 1-6 атомов углерода, возможно включающий в себя один или два S(=O)2,О или N, замещенные в данной цепи, причем алкил возможно дополнительно замещен одной или двумя группами, выбранными из ОН, фенила и фтора. 16. Соединение по любому из пп.1-6, в котором R1 представляет собой фенильную группу, замещенную одним или двумя заместителями, выбранными из галогена, -(O)m-(С 1-6 27 алкилен)n-СO2Rc,-(O)m-(C2-6 алкенил)n-СO2Rc,-(С 1-6 алкилен)n-ОН и -(С 2-6 алкенил)n-ОН. 17. Соединение по п.16, в котором фенильная группа является дизамещенной по 2, 4 положениям. 18. Соединение по п.17, в котором оба заместителя представляют собой галоген. 19. Соединение по п.18, в котором заместитель по 2 положению представляет собой фтор и заместитель по 4 положению представляет собой фтор. 20. Соединение по пп.1-6, в котором R1 представляет собой фенильную группу, замещенную 5-тетразолильной группой, и эта группа сама возможно замещена С 1-4 алкилом. 21. Соединение по любому из пп.1-6, в котором R1 представляет собой бензоконденсированный гетероцикл в котором В является фурановым кольцом, возможно замещенным -СО 2(С 1-4 алкилом). 22. Соединение по п.21, в котором фурановое кольцо замещено по 2 положению. 23. Соединение по п.1, выбранное из 5'-O-метил-N-(тетрагидрофуран-3R-ил)аденозина,N-(2R-гидрокси-(R)-циклопентил)-5'-Oметиладенозина,5'-O-метил-N-(тетрагидропиран-4-ил) аденозина,N-(2S-метокси-(S)-циклопентил)-5'-Oметиладенозина,5'-O-метил-N-(2S-метилтетрагидрофуран 3R-ил)аденозина,N-(3-хлор-4-гидроксифенил)-5'-O-метиладенозина,5'-O-метил-N-(1R-метил-2-фенилэтил) аденозина,N-трет-бутил-5'-O-метиладенозина,N-(2S-фтор-(S)-циклопентил)-5'-O-метиладенозина,N-(2,3-дигидроксипропиламино)-5'-Oметиладенозина,N-rel-[(1S,4R)-бицикло[2.2.1]гепт-2R-ил]5'-O-метиладенозина,4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6-иламино] пиперидин-1-карбоновой кислоты этилового эфира,5'-O-метил-N-[4-(2-метил-2 Н-тетразол-5 ил)фенил]аденозина,3-4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6 иламино]фенил-(Е)-акриловой кислоты,N-(4-гидроксиметилфенил)-5'-O-метиладенозина,4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6-иламино]феноксиуксусной кислоты, 003087 28 5-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-9 Н-пурин-6-иламино] бензофуран-2-карбоновой кислоты метилового эфира,5'-O-метил-N-(тетрагидротиопиран-4-ил) аденозина,N-rel-[(1R,5R)-бицикло[3.2.0]гепт-6S-ил]5'-O-метиладенозина,4-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-2-метил-9 Н-пурин-6 иламино]пиперидин-2-она,5'-O-метил-N-(1S-метоксиметил-2-метилпропил)аденозина,N-(2-гидрокси-1R-метилэтил)-5'-O-метиладенозина,N-(2-фтор-1R-метилэтил)-5'-O-метиладенозина,N-(1S-фторметил-2-метоксиэтил)-5'-Oметиладенозина,N-(3-аминопропил)-5'-O-метиладенозина,2-[9-(3R,4S-дигидрокси-5R-метоксиметилтетрагидрофуран-2R-ил)-2-метил-9 Н-пурин-6 иламино]этансульфоновой кислоты метиламида,N-циклопентил-2-метил-5'-O-метиладенозина,N-циклопропилметил-2-метил-5'-O-метиладенозина. 24. Соединение по любому из пп.1-23 со слабой или отсутствующей активностью в отношении А 3-рецептора. 25. Применение соединения по любому из пп.1-24 в качестве терапевтического средства. 26. Фармацевтическая композиция, содержащая соединение по любому из пп.1-24 вместе с фармацевтическим носителем и/или эксципиентом. 27. Применение соединения по любому из пп.1-24 для производства лекарства для лечения пациента, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений, либо страдающего от ишемической болезни сердца,заболевания периферических сосудов или удара или восприимчивого к ним, либо страдающего от боли, расстройства ЦНС или приступов апноэ во сне. 28. Способ лечения пациента, страдающего от состояния, при котором полезным является уменьшение концентрации свободных жирных кислот в плазме или снижение частоты сердечных сокращений, либо страдающего от ишемической болезни сердца, заболевания периферических сосудов или удара или восприимчивого к ним, либо страдающего от боли, расстройства ЦНС или приступов апноэ во сне, при котором вводят терапевтически эффективное количество соединения по любому из пп.1-24. 29. Способ получения соединения по любому из пп.1-24, при котором соединение формулы (II) 30 в котором L представляет собой уходящую группу, P1 и Р 2 представляют собой защитные группы или Н, приводят во взаимодействие с соединением R1NH2 или его солью в щелочных условиях; при этом R1, R2 и R3 определены в п.1.
МПК / Метки
МПК: A61K 31/7076, C07H 19/167, A61P 9/10
Метки: аденозина, производные
Код ссылки
<a href="https://eas.patents.su/16-3087-proizvodnye-adenozina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные аденозина</a>
Предыдущий патент: Полипептиды lag-3v1, lag-3v2 и lag-3v3 и кодирующие их кднк
Следующий патент: Синтез производных тиофена
Случайный патент: Способ уведомления при невозможности установить вызов и система для его осуществления в сетях сотовой связи












