Синтез альфа-хлор- или фторкетонов.
Номер патента: 1935
Опубликовано: 22.10.2001
Авторы: Тилльер Ричард Д., Фрей Лайза Ф., Доллинг Ульф Х., Тшаен Дэвид М.
Формула / Реферат
1. Способ получения a -хлор- или фторкетона формулы I

где Y представляет хлор или фтор и А представляет углеродный нуклеофил, являющийся необязательно замещенным фенилом, 3,4-диметоксифенилом, бензофуранилом, фуранилом, имидазолилом, индолилом, изотиазолилом, пиразинилом, пиразолилом, пиридилом, пиримидилом, пирролилом, тиазолилом, тиенилом, триазолилом, C1-10-алкилом, С2-3-алкенилом, С2-3-алкинилом, включающий
(а) взаимодействие металлорганического реагента формулы II
А - М (II)
где М представляет Li или Mg, с соединением формулы III

где Х представляет -NR(OR1), R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С3-6-циклоалкилом, или необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы, C1-3-алкила, С2-3-алкенила и С2-3-алкинила, в органическом апротонном растворителе, и
(б) взаимодействие без дополнительной очистки продукта со стадии (а) с водным раствором кислоты G с получением фазы органического апротонного растворителя, содержащей соединение формулы I, и водной фазы растворителя, содержащей соединение формулы III'
HNR(OR1)ъG (III')
2. Способ по п.1, в котором Y является хлором и кислоту G выбирают из группы, состоящей из хлористо-водородной, бромисто-водородной, серной, метансульфоновой, толуолсульфоновой, фосфорной кислоты.
3. Способ по п.1, в котором органический апротонный растворитель выбран из группы, состоящей из диэтилового эфира, ди-н-бутилового и диизопентилового эфиров, анизола, циклических эфиров, таких как тетрагидропиран, 4-метил-1,3-диоксан, тетрагидрофурфурилметиловый эфир, этиловый эфир, фуран и тетрагидрофуран или их смесь.
4. Способ по п.1, в котором углеродный нуклеофил является необязательно замещенным фенилом, 3,4-диметоксифенилом, бензофуранилом, тиенилом, С1-10-алкилом, С2-3-алкенилом, С2-3-алкинилом, где заместитель выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и C1-3-алкила.
5. Способ по п.1, в котором R и R1 каждый выбирают из линейного или разветвленного С1-3-алкила, С3-6-циклоалкила или они необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и C1-3-алкила.
6. Способ по п.1, в котором соединение формулы I представляет
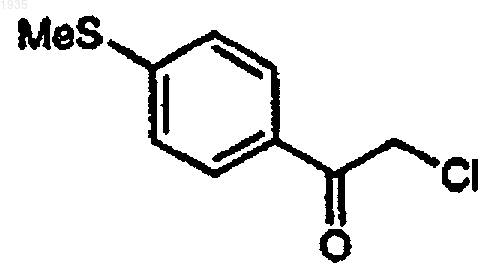
соединение формулы II представляет
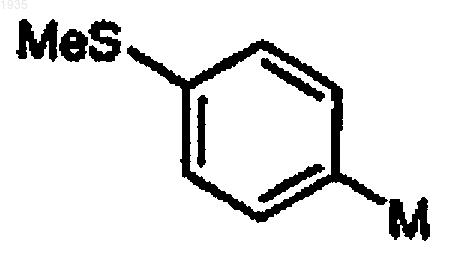
и Х представляет собой -NСН3(ОСН3).
7. Способ получения соединения формулы III
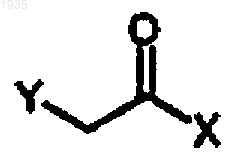
где Х представляет собой -NR(OR1), Y представляет хлор или фтор и R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С3-6-циклоалкилом или необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и C1-3-алкила, включающий ацилирование гидрохлорида HNR(OR1) хлорацетилхлоридом в двухфазной смеси водного основания и нереакционноспособного водонерастворимого органического растворителя с получением соединения формулы III.
8. Способ по п.7, в котором Y представляет хлор и основание выбирают из группы, состоящей из пиридина, три-С1-3-алкиламина, гидроксида натрия, гидроксида калия, карбоната натрия, бикарбоната натрия, карбоната калия и бикарбоната калия.
9. Способ по п.7, в котором R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С3-6-циклоалкилом или необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и C1-3-алкила.
10. Способ по п.7, в котором нереакционноспособный водонерастворимый органический растворитель включает толуол, метил-трет-бутиловый эфир, гексан, гептан, метиленхлорид, дихлорэтан, дихлорбензол, монохлорбензол или их смесь, но не ограничивается ими.
11. Способ получения соединения формулы III
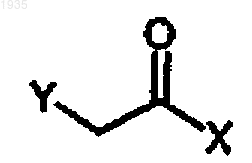
где Х представляет собой -NR(OR1), Y представляет хлор или фтор и R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С3-6-циклоалкилом или необязательно замещены С1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы,-ОН, метоксигруппы, аминотиогруппы и C1-3-алкила, включающий отделение от продукта реакционной стадии (б) водной фазы растворителя по п.1, причем указанная водная фаза растворителя содержит соединение формулы III'
HNR(OR1)-G (III1)
где G представляет собой кислоту, и взаимодействие без дополнительной очистки водной фазы растворителя с хлорацетилхлоридом в двухфазной смеси водного K2СО3 и МТВЕ или толуола с получением соединения формулы III.
12. Способ по п.11, где Y является хлором и кислоту G выбирают из группы, состоящей из хлористо-водородной, бромисто-водородной, серной, метансульфоновой, толуолсульфоновой, фосфорной кислоты.
13. Способ по п.11, в котором R и R1, каждый независимо, являются линейным или разветвленным С1-3-алкилом, С3-6-циклоалкилом или необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и С1-3-алкила.
14. Способ получения a-хлор или фторкетона формулы I
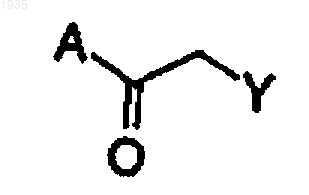
где Y представляет хлор или фтор и А представляет углеродный нуклеофил, являющийся необязательно замещенным фенилом, 3,4-диметоксифенилом, бензофуранилом, фуранилом, имидазолилом, индолилом, изотиазолилом, пиразинилом, пиразолилом, пиридилом, пиримидилом, пирролилом, тиазолилом, тиенилом, триазолилом, C1-10-алкилом, С2-3-алкенилом, С2-3-алкинилом, включающий
(а) взаимодействие металлорганического реагента формулы II
А - М (II)
где М представляет Li или Mg, с соединением формулы III

где X представляет -NR(OR1), R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С3-6-циклоалкилом или необязательно замещены С1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и С1-3-алкила, в органическом апротонном растворителе, и
(б) взаимодействие без дополнительной очистки продукта со стадии (а) с водным раствором кислоты G с получением фазы органического апротонного растворителя, содержащей соединение формулы I, и водной фазы растворителя, содержащей соединение формулы III'
HNR(OR1)ъG (III1),
отделение органической фазы с получением соединения формулы I и ацилирование водной фазы, содержащей гидрохлорид HNR(OR1), хлорацетилхлоридоь т двухфазной смеси водного основания и нереакционноспособного водонерастворимого органического растворителя с получением соединения формулы III, где двухфазную смесь разделяют и проводят реакцию с соединением формулы II, чтобы непрерывно повторять получение соединения формулы I.
Текст
1 Предпосылки создания изобретения Данная заявка относится к усовершенствованному способу получения -хлоркетонов,таких как 4-(метилтио)-2-хлорацетофенон, соединений, которые являются промежуточными соединениями, пригодными для получения определенных нестероидных противовоспалительных средств. См., например, WO 95/00501,опубликованную 5 января 1995 г., которая включена в описание как ссылка. Синтез -хлоркетонов, таких как 4(метилтио)-2-хлорацетофенон 1, возможен путем ацилирования по ФриделюКрафтсу тиоанизола производными хлоруксусной кислоты и путем прямого галогенирования 4-(метилтио)ацетофенона, однако оба этих подхода являются проблематичными. Например, в то время как ацилирование тиоанизола по Фриделю-Крафтсу с применением ацетилхлоридаAlCl2 является эффективным способом (выход 90%, 100:1 пара:орто), использование АlСl3 хлорацетилхлорида таковым не является (выход 40%, 3:1 пара:орто). Ситуация не улучшается путем изменения кислоты Льюиса, растворителя или путем применения других производных хлоруксусной кислоты. Аналогично, прямое галогенирование 4-(метилтио)-ацетофенона сопровождается образованием (обычно 10%) дигалогенированного кетона, который трудно удалить путем кристаллизации. Более того, многие литературные регламентированные методики синтеза кетонов на основе ацилирования металлорганических реагентов обычно неприменимы для синтеза галогенированных кетонов. Cм. ComprehensiveOrganic Synthesis, Pergamon 1991, т. 1, 397 и Friour G., Cahiez G., Normant J.F., Synthesis 37,1984, или ванадийорганические реагенты - Hirao Т., Misu D., Yao K., Agawa Т., Tetrahedron Lett. 929, 1986. Не удивительно то, что реакции металлорганических реагентов 2 (М = Li, MgBr,ZnBr/Cl, MnCl и т.д.) с разнообразными производными хлоруксусной кислоты 3 (например хлорангидрид, ангидрид, имидазолид и нитрил кислоты) привели к 1 с низким выходом, в основном вследствие сверхприсоединения и/или енолизации продукта реагентом. К удивлению, был найден новый и эффективный синтез 1 и других -хлоркетонов путем реакции N-метокси-N-метилхлорацетамида 3b с металлорганическими реагентами. Краткое изложение сущности изобретения Изобретение относится к способу получения -хлор или -фторкетонов, таких как 4 001935(метилтио)-2-хлорацетофенон, соединений, которые являются промежуточными соединениями, пригодными для получения нестероидных противовоспалительных средств. Подробное описание изобретения Изобретение представляет собой усовершенствованный способ получения хлоркетонов или -фторкетонов, включая 4(метилтио)-2-хлорацетофенон, соединений, которые являются промежуточными соединениями, пригодными для получения нестероидных противовоспалительных средств. По одному аспекту изобретение относится к способу получения -хлор- или фторкетона формулы I где Y представляет хлор или фтор, и А представляет углеродный нуклеофил, включающему:(а) взаимодействие металлорганического реагента формулы II А-М(II) где М представляет Li или Мg, с соединением формулы III,где Х представляет - NR(OR1), R и R,1 каждый независимо, являются линейным или разветвленным C1-3-алкилом, С 3-6-циклоалкилом, образуют кольцо или необязательно замещены C1-3 алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из числа F, Cl, Вr, метилтио, -ОН, метоксигруппы,аминотиогруппы и C1-3-алкила, в органическом апротонном растворителе, и(б) взаимодействие, без дополнительной очистки, продукта со стадии (а) с водным раствором кислоты G, с получением фазы органического апротонного растворителя, содержащей соединение формулы I, и водной фазы растворителя, содержащей соединение формулы III'(III') В предпочтительном аспекте данного изобретения Y является хлором. Водную и органическую фазы можно разделить путем стандартных средств разделения жидкость/жидкость, таких как декантация или центрифугирование. Для целей данного описания кислота G включает хлористо-водородную, бромистоводородную, серную, метансульфоновую, толуолсульфоновую, фосфорную кислоту и т.п., но не ограничивается ими. Для целей данного описания органический апротонный растворитель включает эфирные растворители, включающие диэтиловый эфир,ди-н-бутиловый и диизопентиловый эфиры,анизол, циклические эфиры, такие как тетрагидропиран, 4-метил-1,3-диоксан, тетрагидрофур 3 фурилметиловый эфир, этиловый эфир, фуран и тетрагидрофуран, но не ограничиваются ими. Для целей данного описания углеродный нуклеофил А определен так, что он включает необязательно замещенный:(1) фенил,(2) 3,4-диметоксифенил,(3) бензофуранил,(4) фуранил,(5) имидазолил,(6) индолил,(7) изотиазолил,(8) пиразинил,(9) пиразолил,(10) пиридил,(11) пиримидил,(12) пирролил,(13) тиазолил,(14) тиенил,(15) триазолил,(16) C1-10-алкил,(17) С 2-3-алкенил,(18) С 2-3-алкинил,где заместитель выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы, C1-3-алкила, С 2-3-алкенила и С 2-3 алкинила. Реакционной стадии (а) дают возможность протекать до тех пор, пока она не будет по существу завершена в течение 10 мин-3 ч. Мольное отношение соединения формулы II к соединению формулы III обычно составляет 1:1 или более (то есть избыточное количество соединения формулы II), предпочтительно от 1:1 до 1,2:1. Реакцию можно проводить при температуре от -30 до 20 С, предпочтительно от 0 до 10 С. Реакционной стадии (б) дают возможность протекать до тех пор, пока она не будет по существу завершена в течение 5 мин-3 ч, обычно порядка 15 мин. Мольное отношение кислоты к соединению формулы III обычно составляет 1:1 или более (избыток кислоты); предпочтительно от 1:1 до 1,2 : 1. Реакцию можно проводить при температуре от -10 до 20 С, предпочтительно от 0 до 5 С. В рамках данного аспекта существует вариант способа, в котором соединение формулы I представляет собой и Х представляет собой -NСН 3(ОСН 3). По второму аспекту изобретение относится к способу получения соединения формулы III 4 где Х представляет собой -NR(OR1), где R и R1 описаны выше, включающему ацилирование гидрохлорида HNR(OR1) хлорацетилхлоридом в двухфазной смеси водного основания и нереакционноспособного водонерастворимого органического растворителя с получением соединения формулы III. Для целей данного описания, основание включает как органические основания, включая пиридин, три-С 1-3-алкиламин, так и неорганические основания, включая гидроксид натрия,гидроксид калия, карбонат или бикарбонат натрия, или карбонат или бикарбонат калия. Для целей данного описания, нереакционноспособные водонерастворимые органические растворители включают толуол, метил-третбутиловый эфир (МТВЕ), гексан, гептан, метиленхлорид, дихлорэтан, дихлорбензол, монохлорбензол, но не ограничиваются ими. Реакции позволяют протекать до тех пор,пока она не будет по существу завершена в течение 5 мин-1 ч. Мольное отношение HNR(OR1) к хлорацетилхлориду обычно составляет 1:1 или более (то есть, избыток хлорацетилхлорида); предпочтительно от 1,1:1 до 1,2:1. Реакцию проводят при температуре от -10 до 20 С, предпочтительно от 0 до 5 С. Предпочтительная методика получения соединения формулы III включает отделение от продукта реакционной стадии (б) водной фазы растворителя, причем указанная водная фаза растворителя содержит соединение формулы III', и взаимодействие, без дополнительной очистки, водной фазы растворителя с хлорацетилхлоридом в двухфазной смеси водного К 2 СО 3 и МТВЕ или толуола с получением соединения формулы III. Реакции позволяют протекать до тех пор,пока она не будет по существу завершена в течение 5-50 мин. Мольное отношение соединения III' к К 2 СО 3 обычно составляет от 1:2 до 1:3(то есть, избыток основания); предпочтительно 1:2.5. Концентрация хлорацетилхлорида в органическом растворителе (МТВЕ или толуоле) составляет 0,2-0,5 М, предпочтительно 0,5 М. Отношение органического растворителя к водному раствору составляет от 1:1 до 2:1 (избыток органического растворителя), предпочтительно 1:1. Реакцию проводят при температуре от -10 до 5 С, предпочтительно от 0 до 5 С. Одна из целей изобретения заключалась в том, чтобы разработать практичный синтез амида 3b. Сообщалось о неводном ацилированииN,Oдиметилгидроксиламина хлорацетилхлоридом. См. Nuzillard J.-M., Boumendjel G., Massiot G.,Tetrahedron Lett., 30 (29) 3779, 1989. Это осуществляли посредством ацилирования гидрохлорида N,O-диметилгидроксиламина хлорацетилхлоридом с использованием двухфазной смеси водного К 2 СО 3 и толуола/МТВЕ. Высокочистый(95%) после удаления растворителя (когда в качестве растворителя использовали МТВЕ). В крупномасштабных опытах амид 3b (полученный с использованием толуола как растворителя) использовали непосредственно в виде раствора в толуоле (после азеотропной сушки) для реакций с металлорганическими реагентами. Реакция амида 3b с реактивом Гриньяра 2 а(1 М раствор в ТГФ, 1,2 экв., получен из 4 бромтиоанизола) протекала чисто и быстро в ТГФ (реакция была завершена за 1,5 ч при 25 С) с получением, после водной обработки (2 н. НСl), 4-(метилтио)-2-хлорацетофенона 1 с выходом 90%. [Выход определяли путем количественного анализа ВЭЖХ органического слоя после обработки, в сравнении со стандартным раствором подвергнутого хроматографии кетона 1]. Не наблюдалось сверхприсоединения, и единственными значительными ( 0,5%) побочными продуктами были те, которые производились при получении реактива Гриньяра. Побочные продукты при образовании реактива Гриньяра включали соответствующий фенол (окисление) и биарил (гомосочетание). Количество первого было значительно снижено путем обезгаживания растворителя для реакции, и для гашения использовали НСl. Неочищенный продукт кристаллизовали из смеси толуол-гексан (1:2) с получением 1 с 80% выходом (чистота 98% согласно анализу ВЭЖХ). Недостаток, который обычно связан с применением N-метокси-N-метиламидов для синтеза кетонов, заключается в высокой стоимости гидрохлорида N,O-диметилгидроксиламина. Хотя водная обработка регенерируетN,O-диметилгидроксиламин (или его гидрохлоридную соль), существует немного, если существует, сообщений относительно его извлечения из водного экстракта. Теперь возможно рециклирование данного соединения путем прямого ацилирования N,O-диметилгидроксиламина в водном экстракте хлорацетилхлоридом. Таким образом, после обработки (водн. НСl) водный экстракт реагировал с хлорацетилхлоридомК 2 СО 3 с получением амида 3 чистым образом(выход 80% на основе изначально использованного гидрохлорида N,O-диметилгидроксиламина). Этот материал повторно использовали в реакциях с реактивом Гриньяра 2 а с получением 1 без потерь в выходе или в чистоте продукта. Последующие примеры предназначены для того, чтобы проиллюстрировать, а не ограничить изобретение, в том виде, как оно здесь описано. Пример 1. Методика получения 4(метилтио)-2-хлорацетофенона (1) 6 Раствор N-метокси-N-метилхлорацетамида 3b (26,8 г, 195 ммоль) в толуоле (250 мл, см. ссылку 9) разбавляют обезгаженным ТГФ (530 мл) и смесь охлаждают до 0 С. В течение 30 мин (температура раствора 5 С) через канюлю добавляют раствор реактива Гриньяра 2 а (240 мл 1 М раствора в ТГФ, 1,2 экв.) и смесь перемешивают при 25 С в течение 1,5 ч. Густую суспензию через канюлю переносят в холодную(0 С) обезгаженную водную 2 н. НСl (250 мл,2,5 экв.) и слои разделяют. Органический слой промывают соляным раствором (100 мл), сушат(MgSO4), фильтруют и концентрируют (до примерно 75 мл). Добавляют гексаны (150 мл) и смесь перемешивают в течение 2 ч. Суспензию фильтруют, твердое вещество промывают гексанами и сушат с получением 32,9 г (80% от гидрохлорида N,O-диметилгидроксиламина) 1,желтого твердого вещества. 1H-ЯМР (CDCl3, 300 МГц)2,53 (с, 3 Н),4,67 (с, 2 Н), 7,28 (д, 2 Н, J=8,5 Гц), 7,87 (д, 2 Н,J=8,6 Гц); 13 С ЯМР (CDCl3, 75 МГц)14,69, 45,77,125,07, 128,95, 130,35, 147,48, 190,16. Водный слой добавляют к двухфазной смеси К 2 СО 3 (79 г, 570 ммоль) в Н 2 О (200 мл) и МТВЕ (500 мл) c получением густой суспензии. Энергично перемешиваемую смесь охлаждают до -5 С и в течение 5 мин добавляют хлорацетилхлорид (19,6 мл, 246 ммоль) (температура раствора 1 С). Смесь нагревают до 15 С в течение 30 мин, слои разделяют и водный слой экстрагируют МТВЕ (5 х 100 мл). Объединенные органические экстракты концентрируют с получением 22,7 г (80% в расчете на 20 г изначально использованного гидрохлорида N,Oдиметилгидроксиламина)амида 3b. Этот материал был спектроскопически и согласно анализу ВЭЖХ идентичен 3b, полученному из свежего гидрохлорида N,O-диметилгидроксиламина. Перечисленные как примеры 2-6 (таблицаI) реакции проводили с использованием методики из примера 1 с надлежащей заменой реагента 2. Таблица 1 7 1. Выход выделенного вещества после хроматографии; 2. Выходы в скобках соответствуют реакциям, включающим литийорганические реагенты; 3. Реакцию проводили при -10 С в течение 45 мин. Пример 2. Раствор N-метокси-N-метилхлорацетамида 3b (1,65 г, 12 ммоль) в толуоле (15 мл) разбавляют обезгаженным ТГФ (27 мл) и смесь охлаждают до 0 С. В течение 30 мин (температура раствора 5 С) через канюлю добавляют раствор реактива Гриньяра (14,4 мл 1 М раствора в ТГФ, 1.2 экв., получен из реакции 4-бром-1,2(метилендиокси)бензола с Мg в ТГФ) и смесь перемешивают при 25 С в течение 2,5 ч. Смесь через канюлю переносят в холодную (0 С) обезгаженную водную 2 н. НСl (35 мл, 5,8 экв.), разбавляют толуолом (10 мл) и слои разделяют. Органический слой промывают соляным раствором (20 мл), сушат (MgSO4), фильтруют и концентрируют с получением продукта с выходом 83%. Раствор 4-бром-1,2-(метилендиокси)бензола (2,2 мл, 18 ммоль) в обезгаженном ТГФ (50 мл) охлаждают до -78 С и добавляют н-BuLi-20 С. Смесь через канюлю переносят в холодную(0 С) обезгаженную водную 2 н. НСl (37,5 мл, 5,0 экв.), разбавляют этилацетатом (20 мл) и слои разделяют. Органический слой промывают соляным раствором (20 мл), сушат (MgSO4),фильтруют и концентрируют с получением продукта с выходом 76%. 1 Н-ЯМР (СDСl3, 30 МГц)4,62 (с, 2 Н), 6,06 (с, 2 Н), 6,86 (д, 1 Н, J=8,1 Гц),7,41 (д, 1 Н, J=1,8 Гц), 7,54 (м, 1 Н); 13 С-ЯМР(CDCl3)45,76, 102,16, 108,17, 108,26, 125,08,128,91, 148,49, 152,59, 189,28. Примеры 3-5. По методикам примеров 1 и 2 с использованием реагентов, перечисленных в таблице 1,был получен соответствующий продукт. Пример 6. Раствор фенилацетилена (2,0 мл, 18 ммоль) в обезгаженном ТГФ (30 мл) охлаждают до -78 С и добавляют н-BuLi (11,3 мл 1,6 М раств., 1,5 экв.). После перемешивания в течение 20 мин раствору позволяют нагреться до -20 С. Медленно добавляют раствор N-метокси-N-метилхлорацетамида 3b(1,65 г, 12 ммоль) в обезгаженном ТГФ 13 мл), и смесь выдерживают 15 мин при -20 С, а затем 45 мин - при -10 С. Смесь через канюлю переносят в холодную (0 С) обезгаженную водную 2 н. НСl (35 мл, 5,8 экв.), разбавляют этилацетатом (10 мл) и слои разделяют. Органический слой промывают соляным раствором (20 мл), 001935 8 сушат (МgSO4), фильтруют и концентрируют. После хроматографии на силикагеле (97:3 гексаны:этилацетат) выделяют соединение с выходом 86%. 1H ЯМР (CVDc13, 300 МГц)4,33 (с,2 Н), 7,41 (м, 2 Н), 7,51 (м, 1 Н), 7,62 (м, 2 Н); 13 С ЯМР (CDCl3)49,53, 85,55, 95,40, 119,22,128,79 (2 С), 131,46, 133,40 (2 С), 178,89. Эта химия была распространена на получение -монофторкетонов путем реакции металлорганических реагентов с N-метокси-Nметилфторацетамидом (5). Например, фенацилфторид (6) был получен с выходом 88% путем реакции c 5 фенилмагнийбромидом. Могут быть возможны многие другие направления развития этой химии.N-метокси-N-метилхлорацетамида 3b и показано, что данное соединение чистым образом реагирует с реактивом Гриньяра и литийорганическими реагентами с получением монохлоркетонов с высоким выходом. Способность рециклировать N,O-диметилгидроксиламин высокоэффективным образом повышает эффективность затрат и делает данную методику особенно привлекательной для крупномасштабного синтеза. Пример 7. Получение N-метокси-Nметилхлорацетамида (3b). К холодному (0 С) перемешиваемому раствору К 2 СО 3 (62,4 г, 450 ммоль) в Н 2 О (250 мл) последовательно добавляют гидрохлорид N,Oдиметилгидроксиламина (20 г, 205 ммоль) и органический растворитель (250 мл, толуол или МТВЕ). Полученную двухфазную смесь охлаждают до -5 С и в течение 5 мин добавляют хлорацетилхлорид (19,6 мл, 246 ммоль), температуру раствора поддерживают ниже 0 С. Энергично перемешиваемой смеси позволяют нагреться до 15 С в течение 30 мин, слои разделяют и водный слой экстрагируют органическим растворителем (3 х 100 мл, толуол или МТВЕ). Объединенные органические экстракты концентрируют(МТВЕ в качестве растворителя) с получением амида 3b (26,8 г, 95%) в виде белого твердого вещества. В альтернативном случае, объединенные органические экстракты (толуол используют в качестве растворителя) концентрируют до 250 мл, чтобы провести азеотропную сушку (содержание воды 100 мкг/мл), и раствор 3b непосредственно используют в реакциях с металлорганическими реагентами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения -хлор- или фторкетона формулы I 9 где Y представляет хлор или фтор и А представляет углеродный нуклеофил, являющийся необязательно замещенным фенилом, 3,4 диметоксифенилом, бензофуранилом, фуранилом, имидазолилом, индолилом, изотиазолилом,пиразинилом, пиразолилом, пиридилом, пиримидилом, пирролилом, тиазолилом, тиенилом,триазолилом, C1-10-алкилом, С 2-3-алкенилом, С 23-алкинилом, включающий(а) взаимодействие металлорганического реагента формулы II АМ (II) где М представляет Li или Mg, с соединением формулы III где Х представляет -NR(OR1), R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С 3-6-циклоалкилом, или необязательно замещены C1-3-алкоксигруппой,фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы,C1-3-алкила, С 2-3-алкенила и С 2-3-алкинила, в органическом апротонном растворителе, и(б) взаимодействие без дополнительной очистки продукта со стадии (а) с водным раствором кислоты G с получением фазы органического апротонного растворителя, содержащей соединение формулы I, и водной фазы растворителя, содержащей соединение формулы III'(III') 2. Способ по п.1, в котором Y является хлором и кислоту G выбирают из группы, состоящей из хлористо-водородной, бромистоводородной, серной, метансульфоновой, толуолсульфоновой, фосфорной кислоты. 3. Способ по п.1, в котором органический апротонный растворитель выбран из группы,состоящей из диэтилового эфира, ди-нбутилового и диизопентилового эфиров, анизола, циклических эфиров, таких как тетрагидропиран, 4-метил-1,3-диоксан, тетрагидрофурфурилметиловый эфир, этиловый эфир, фуран и тетрагидрофуран или их смесь. 4. Способ по п.1, в котором углеродный нуклеофил является необязательно замещенным фенилом, 3,4-диметоксифенилом, бензофуранилом, тиенилом, С 1-10-алкилом, С 2-3-алкенилом,С 2-3-алкинилом, где заместитель выбирают из F,Cl, Вr, метилтиогруппы, -ОН, метоксигруппы,аминотиогруппы и C1-3-алкила. 5. Способ по п.1, в котором R и R1 каждый выбирают из линейного или разветвленного С 13-алкила, С 3-6-циклоалкила или они необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы,-ОН, метоксигруппы, аминотиогруппы и C1-3 алкила. 6. Способ по п.1, в котором соединение формулы I представляет соединение формулы II представляет и Х представляет собой -NСН 3(ОСН 3). 7. Способ получения соединения формулыIII где Х представляет собой -NR(OR1), Y представляет хлор или фтор и R и R1, каждый независимо, являются линейным или разветвленнымC1-3-алкилом, С 3-6-циклоалкилом или необязательно замещены C1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы,-ОН, метоксигруппы, аминотиогруппы и C1-3 алкила, включающий ацилирование гидрохлорида HNR(OR1) хлорацетилхлоридом в двухфазной смеси водного основания и нереакционноспособного водонерастворимого органического растворителя с получением соединения формулы III. 8. Способ по п.7, в котором Y представляет хлор и основание выбирают из группы, состоящей из пиридина, три-С 1-3-алкиламина, гидроксида натрия, гидроксида калия, карбоната натрия, бикарбоната натрия, карбоната калия и бикарбоната калия. 9. Способ по п.7, в котором R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С 3-6-циклоалкилом или необязательно замещены C1-3-алкоксигруппой,фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и C1-3-алкила. 10. Способ по п.7, в котором нереакционноспособный водонерастворимый органический растворитель включает толуол, метил-третбутиловый эфир, гексан, гептан, метиленхлорид, дихлорэтан, дихлорбензол, монохлорбензол или их смесь, но не ограничивается ими. 11. Способ получения соединения формулы III где Х представляет собой -NR(OR1), Y представляет хлор или фтор и R и R1, каждый независимо, являются линейным или разветвленнымC1-3-алкилом, С 3-6-циклоалкилом или необязательно замещены С 1-3-алкоксигруппой, фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы,ОН, метоксигруппы, аминотиогруппы и C1-3 алкила, включающий отделение от продукта реакционной стадии (б) водной фазы растворителя по п.1, причем указанная водная фаза растворителя содержит соединение формулы III'HNR(OR1)G где G представляет собой кислоту, и взаимодействие без дополнительной очистки водной фазы растворителя с хлорацетилхлоридом в двухфазной смеси водного K2 СО 3 и МТВЕ или толуола с получением соединения формулы III. 12. Способ по п.11, где Y является хлором и кислоту G выбирают из группы, состоящей из хлористо-водородной,бромисто-водородной,серной, метансульфоновой, толуолсульфоновой,фосфорной кислоты. 13. Способ по п.11, в котором R и R,1 каждый независимо, являются линейным или разветвленным С 1-3-алкилом, С 3-6-циклоалкилом или необязательно замещены C1-3-алкоксигруппой, фенилом,замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и С 1-3-алкила. 14. Способ получения -хлор или фторкетона формулы I где Y представляет хлор или фтор и А представляет углеродный нуклеофил, являющийся необязательно замещенным фенилом, 3,4 диметоксифенилом, бензофуранилом, фуранилом, имидазолилом, индолилом, изотиазолилом,пиразинилом, пиразолилом, пиридилом, пиримидилом, пирролилом, тиазолилом, тиенилом,триазолилом, C1-10-алкилом, С 2-3-алкенилом, С 23-алкинилом, включающий(а) взаимодействие металлорганического реагента формулы II 12 АМ (II) где М представляет Li или Mg, с соединением формулы III где X представляет -NR(OR1), R и R1, каждый независимо, являются линейным или разветвленным C1-3-алкилом, С 3-6-циклоалкилом или необязательно замещены С 1-3-алкоксигруппой,фенилом, замещенным фенилом, где заместитель в фениле выбирают из F, Cl, Вr, метилтиогруппы, -ОН, метоксигруппы, аминотиогруппы и С 1-3-алкила, в органическом апротонном растворителе, и(б) взаимодействие без дополнительной очистки продукта со стадии (а) с водным раствором кислоты G с получением фазы органического апротонного растворителя, содержащей соединение формулы I, и водной фазы растворителя, содержащей соединение формулы III'(III1),отделение органической фазы с получением соединения формулы I и ацилирование водной фазы, содержащей гидрохлорид HNR(OR1),хлорацетилхлоридом в двухфазной смеси водного основания и нереакционноспособного водонерастворимого органического растворителя с получением соединения формулы III, где двухфазную смесь разделяют и проводят реакцию с соединением формулы II, чтобы непрерывно повторять получение соединения формулы I.
МПК / Метки
МПК: C07C 45/00
Метки: альфа-хлор, фторкетонов, синтез
Код ссылки
<a href="https://eas.patents.su/7-1935-sintez-alfa-hlor-ili-ftorketonov.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез альфа-хлор- или фторкетонов.</a>
Предыдущий патент: Способ борьбы с микозом рыб и одноклеточными эктопаразитами.
Следующий патент: Способ измерения характеристик поглощающего объекта и устройство для его осуществления
Случайный патент: Соединения и композиции в качестве ингибиторов катепсина











