Способ получения производного тетразола
Номер патента: 4633
Опубликовано: 24.06.2004
Авторы: Петеньи Эндрене, Крейдл Янош, Веркне Папп Эва, Надьне Багди Юдит, Фаркаш Йенёме, Фишер Янош, Балло Илдико, Хегедюш Иштван, Цибула Ласло, Дойчне Юхас Ида, Немеш Андраш
Формула / Реферат
1. Способ синтеза лозартана калия формулы (I)
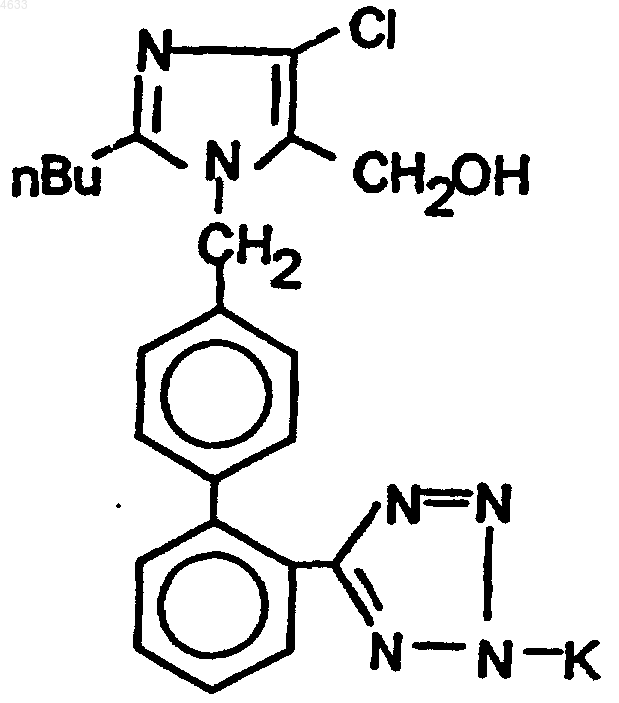
имеющего химическое название 2-н-бутил-4-хлор-1-[(2'-(тетразол-5-ил)-1,1'-бифенил-4-ил)метил]имидазол-5-метанол калия, с использованием в качестве исходного соединения 2-н-бутил-4-хлор-1-[(2'-(2-трифенилметил-2H-тетразол-5-ил)-1,1'-бифенил-4-ил)метил]-1H-имидазол-5-метанол формулы (III)
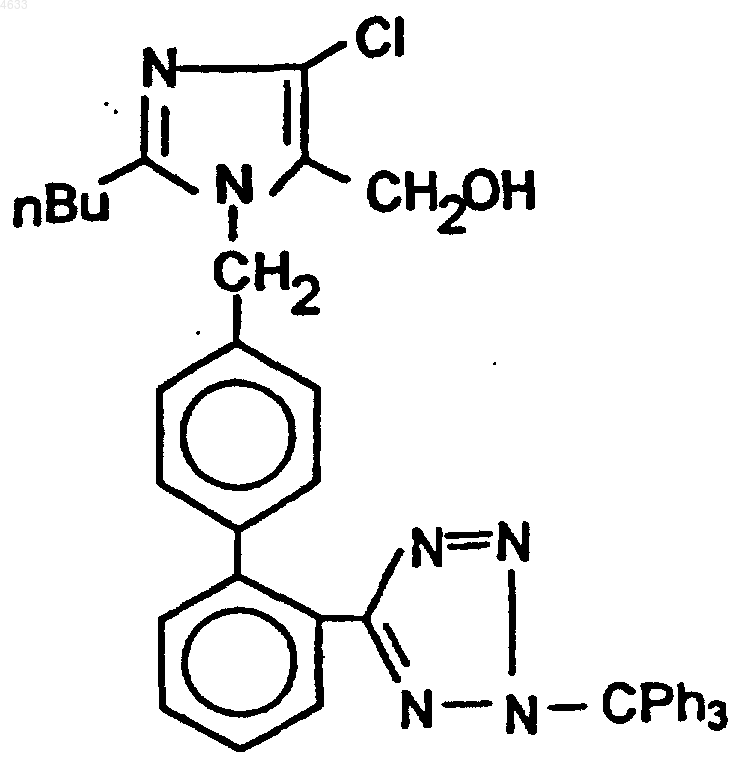
отличающийся тем, что проводят реакцию соединения формулы (III) в среде спирта формулы R-OH (VI), где R представляет собой C1-C4 линейную алкильную группу, с 0,1-1 эквивалентом гидроксида калия и конечный продукт реакции формулы (I) выделяют после кристаллиазции при замене растворителя на апротонный или слабопротонный растворитель.
2. Способ по п.1, отличающийся тем, что в качестве спирта используют метанол.
3. Способ по п.1 или 2, отличающийся тем, что реакцию проводят при температуре 50-80шC.
4. Способ по любому из пп.1, 2 и 3, отличающийся тем, что в качестве биполярного апротонного растворителя для кристаллизации конечного продукта используют ацетонитрил.
5. Способ по любому из пп.1, 2 и 3, отличающийся тем, что в качестве апротонного растворителя для кристаллизации конечного продукта используют линейные, или разветвленные, или циклические алифатические углеводороды.
6. Способ по любому из пп.1, 2 и 3, отличающийся тем, что в качестве протонного растворителя для кристаллизации конечного продукта используют втор-бутанол.
Текст
1 Настоящее изобретение относится к способу синтеза известного производного тетразола формулы (I) Рассматриваемое производное тетразола,известное как лозартан калия, химическое название которого калиевая соль 2-н-бутил-4 хлор-1-[(2'-тетразол-5-ил)-1,1'-бифенил-4-ил)метил]имидазол-5-метанола, представляет собой активный ингредиент современных антигипертензивных средств, антагонистов рецептора ангиотензина II. Согласно публикациям заявок РСТ WO 93/10106 и WO 95/17396, лозартан калия может быть синтезирован из соответствующего производного кислоты формулы (II) в результате реакции с гидроксидом калия. Соединение формулы (II) может быть получено детритилированием трифенилметил (или тритил)защищенного соединения формулы (III) Отщепление тритильной группы проводят в соответствии с известными методиками детритилирования - действием сильных минеральных кислот (хлористо-водородной или серной кислот). Образовавшийся тритиловый спирт формулы (IV) удаляют из реакционной смеси путем фильтрации или экстракции, перекристаллизованную и выделенную кислоту превращают в лозартан калия в водной среде в присутствии катиона калия (гидроксид калия или катионообменная смола), и образовавшееся соединение перекристаллизовывают после обработки органическим растворителем при удалении воды азеотропной дистилляцией. Для кристаллизации в качестве растворителя используют изопропанол или смесь циклогексана и изопропанола. В примерах упомянутых выше заявок на патент детритилирование проводят с использованием водного раствора хлористо-водородной кислоты или водного раствора серной кислоты в присутствии тетрагидрофурана или ацетонитрила. Общий выход лозартана калия составляет 72 или 80% в расчете на производное кислоты формулы (II), которое выделяют с помощью сложных способов. Недостатком рассматриваемого способа является то, что превращение можно проводить только в две стадии, отщепле 004633 2 ние тритильной группы протекает под действием раствора сильной, обладающей коррозионным действием, минеральной кислоты хлористо-водородной или серной кислоты - и желательный лозартан калия выделяют с низким выходом после добавления водного раствора гидроксида калия с использованием сложных операций: азеотропной дистилляции. Известно, что в ходе синтеза других производных бифенилтетразолила, например, согласно патенту США 5 281 603, отщепление тритильной защитной группы осуществляют под действием каталитического количества кислоты в среде органических растворителей. Согласно другому известному способу,например, тому, который раскрыт в патенте США 5 281 604, тритильную группу тетразолилхиназолинонового производного отщепляют в результате кипячения с обратным холодильником в смеси из метанола и тетрагидрофурана в течение 18 ч. Очищенное кислотное производное тетразола получают после концентрации реакционной смеси с помощью сложного метода колоночной хроматографии с низким выходом. Из такого производного тетразола известными методами могут быть получены желаемые соли. В связи с вышеизложенным можно сделать вывод, что в соответствии с известными способами, лозартан калия формулы (I) получают во всех случаях из выделенной и очищенной лозартановой кислоты формулы (II), которую получают после детритилирования под действием каталитического количества кислоты. Цель настоящего изобретения заключается в разработке способа, который устраняет недостатки известных многостадийных способов, с помощью которого по простой технологии может быть получен высококачественный продукт. Авторы изобретения обнаружили, что если тритил защищенный 2-н-бутил-4-хлор-1-[(2'-(2 трифенилметил-2 Н-тетразол-5-ил)-1,1'-бифенил-4-ил)метил]-1 Н-имидазол-5-метанол формулы (III) обрабатывают эквимолярным количеством гидроксида калия в С 1-С 4 спирте, то могут быть получены тритилалкиловый эфир формулы (V), содержащий алкоксигруппу и лозартан калия формулы (I). Если реакцию проводят при температуре кипения с обратным холодильником в течение нескольких часов, то желаемый продукт может быть получен практически с количественным выходом.R= C1-C4 линейная алкильная группа. Авторы изобретения неожиданно обнаружили, что такая новая, катализируемая основанием, реакция протекает очень быстро, и продукт реакции может быть получен с высоким 3 выходом. В ходе реакции детритилирования спирт образует алкоксианион, который обеспечивает образование тритилалкилового эфира. Простые эфиры формулы (V) обладают очень низкой растворимостью в спиртах с короткой углеродной цепью и, в связи с этим, могут быть удалены фильтрацией. Дополнительные исследования показали,что реакция протекает даже в том случае, если производное тритила формулы (III) обрабатывают 0,1-1 эквивалентом гидроксида калия в среде спирта с короткой углеродной цепью. В рассматриваемом случае детритилирование протекает с хорошим выходом - также с образованием тритилалкилового эфира - и образуется смесь соединений, отвечающих формулам (I) и(II). Если реакционную смесь обрабатывают спиртовым раствором, содержащим эквивалентное количество гидроксида калия в расчете на соединение формулы (II), калиевая соль формулы (I) образуется немедленно. В соответствии с упомянутыми выше фактами, настоящее изобретение относится к синтезу лозартана калия формулы (I), который имеет химическое название 2-н-бутил-4-хлор-1-[(2'-(2 тетразол-5-ил)-1,1'-бифенил-4-ил)метил]имидазол-5-метанол калия из 2-н-бутил-4-хлор-1-[(2'(2-трифенилметил-2 Н-тетразол-5-ил)-1,1'-бифенил-4-ил)метил]-1 Н-имидазол-5-метанола формулы (III), по реакции соединения (III) в среде спирта формулы (VI), в которой R представляет собой C1-C4 линейную алкильную группу, с 0,11 эквивалентом гидроксида калия, причем конечный продукт реакции, отвечающий формуле(I), выделяют после кристаллизации при замене используемого растворителя на апротонный или слабопротонный растворитель.R - ОН VI В способе, согласно настоящему изобретению, в качестве спирта предпочтительно использовать метанол. Реакцию предпочтительно проводить при 20-100 С, более предпочтительно при 50-80 С. Апротонный диполярный растворитель,используемый для кристаллизации конечного продукта, предпочтительно представляет собой ацетонитрил, или в качестве апротонного растворителя можно использовать алифатические углеводороды с линейной или разветвленной углеродной цепью или циклические алифатические углеводороды, так же как в других случаях,в качестве протонного растворителя можно использовать вторичный бутиловый спирт. Данную реакцию можно проводить в любом С 1-С 4 спирте нормального строения, однако, если углеродная цепь более длинная, то для детритилирования требуется большее количество времени и достигается меньший выход целевого продукта. Наиболее предпочтительные условия проведения реакции достигаются при использовании метанола. В этом случае через 4 несколько часов проведения реакции может быть достигнут выход порядка 95%. Если н-бутанол используют в реакции превращения (III)(I) при 80 С в течение 15-20 ч,то может быть достигнут выход целевого продукта выше 80%. Неполярный тритилалкиловый эфир формулы (V), полученный в качестве побочного продукта, обладает низкой растворимостью в используемом спирте и, вследствие этого, может быть удален из реакционной среды, главным образом, путем фильтрации. Лозартан калия высокой чистоты может быть выделен из спиртового фильтрата в результате замены растворителя с высоким выходом. После выпаривания спирта путем дистилляции для перекристаллизации также могут быть использованы апротонные неполярные растворители (например, циклогексан, гептан), слабопротонные вторичные спирты, такие как втор-бутанол и, что является неожиданным, апротонный диполярный ацетонитрил. Исходный материал 2-н-бутил-4-хлор-1[(2'-(2-трифенилметил-2 Н-тетразол-5-ил)-1,1'бифенил-4-ил)метил]-1 Н-имидазол-5-метанол формулы (III) может быть синтезирован в соответствии со способом, описанным в литературе:J. Med, Chem, 1991, 34, 2525-2547, и J, Org,Chem, 1994, 59, 6391-6394. Преимущества способа, согласно настоящему изобретению, могут быть суммированы следующим образом: тритиловый спирт формулы (IV), образующийся в качестве побочного продукта в известной реакции кислотного детритилирования в водной среде, представляет собой полярный продукт и поэтому может быть отделен от также полярного лозартана калия лишь при существенных потерях желаемого соединения. В известных способах для отделения соединения формулы (II) от образовавшегося тритилового спирта необходимо использование трудоемких операций (экстракция, фильтрация). Согласно заявленному способу, можно избежать проведения трудной стадии азеотропной дистилляции, которая проводится после получения соли калия в водной среде. Другое преимущество заявленного способа состоит в том, что после катализируемой основанием реакции детритилирования, которая протекает в среде спиртов с короткой цепью,предпочтительно в метаноле, практически с количественным выходом, почти на порядок отличающиеся значения растворимости между полученным тритилалкиловым эфиром и полярным лозартаном калия в надлежащим образом выбранном апротонном растворителе, делают возможным выделение чистого нерастворимого соединения формулы (I) с высоким выходом без образования соединения формулы (II) . Настоящее изобретение иллюстрируется следующими примерами, не ограничивающими область изобретения: 5 Пример 1. Синтез лозартана калия формулы (I). В 500 мл колбе в атмосфере азота в течение 30 мин при температуре кипения с обратным холодильником нагревали смесь 175 мл сухого метанола, 20 г (0,026 моля) сольвата 2-нбутил-4-хлор-1-[(2'-(2-трифенилметил-2 Н-тетразол-5-ил)-1,1'-бифенил-4-ил)метил]-1 Н-имидазол-5-метанола и метилизобутилкетона и 1,46 г(0,026 моля) гидроксида калия в 25 мл метанола. После кипячения с обратным холодильником в течение 4 ч реакционную смесь охлаждали до комнатной температуры, обрабатывали 0,6 г древесного угля и фильтровали. Полученный фильтрат концентрировали до объема 30-35 мл при пониженном давлении и после добавления 85 мл ацетонитрила вновь концентрировали до объема 30-35 мл. После добавления еще 85 мл ацетонитрила полученный раствор концентрировали до объема 60-65 мл. Суспензию перемешивали при температуре 0-(+)2 С в течение 2 ч,осажденные кристаллы отфильтровывали, трижды промывали 30 мл холодного ацетонитрила и сушили при 70 С с образованием 11,5 г (94%) указанного в заглавии соединения. Т.пл.: 262-264 С. Пример 2. Синтез лозартана калия формулы (I). В 500 мл колбе в атмосфере азота в течение 3 ч при температуре кипения с обратным холодильником нагревали смесь 180 мл сухого метанола, 20 г (0,026 моля) сольвата 2-н-бутил 4-хлор-1-[(2'-(2-трифенилметил-2 Н-тетразол-5 ил)-1,1'-бифенил-4-ил)метил]-1 Н-имидазол-5 метанола и метилизобутилкетона и 0,1 г(0,00178 моля) гидроксида калия. Реакционную смесь охлаждали до комнатной температуры и после добавления 1,35 г (0,0241 моля) гидроксида калия в 10 мл метанола обрабатывали 0,5 г древесного угля и полученную смесь фильтровали. Фильтрат концентрировали до объема 30 мл при пониженном давлении и после добавления 80 мл ацетонитрила вновь концентрировали до объема 35 мл. После добавления дополнительного количества ацетонитрила (85 мл) полученную суспензию охлаждали до 0 С, осажденные кристаллы отфильтровывали после 1 часового перемешивания, дважды промывали 30 мл холодного ацетонитрила и сушили при 70 С с образованием 11,3 г (93,4%) указанного в заглавии соединения. Т.пл.: 261-263 С. Пример 3. Синтез лозартана калия формулы (I). Смесь, содержащую 200 мл сухого этанола, 20 г (0,026 моля) сольвата 2-н-бутил-4-хлор 1-[(2'-(2-трифенилметил-2 Н-тетразол-5-ил)-1,1'бифенил-4-ил)метил]-1 Н-имидазол-5-метанола и метилизобутилкетона и 1,45 г (0,026 моля) гидроксида калия, в течение 9 ч кипятили с обратным холодильником в колбе емкостью 500 мл, обрабатывали 0,5 г древесного угля и 6 фильтровали. Полученный фильтрат концентрировали до объема 30 мл при пониженном давлении и после добавления 150 мл ацетонитрила вновь концентрировали до объема 60 мл. Полученную суспензию перемешивали при 0 С в течение 1 ч, осажденные кристаллы отфильтровывали, дважды промывали 25 мл холодного ацетонитрила и сушили при 70 С с образованием 10,6 г (88%) указанного в заглавии соединения. Т.пл.: 262-264 С. Пример 4. Синтез лозартана калия формулы (I). Смесь, содержащую 100 мл н-бутанола,7,64 г (0,01 моля) сольвата 2-н-бутил-4-хлор-1[(2'-(2-трифенилметил-2 Н-тетразол-5-ил)-1,1'бифенил-4-ил)метил]-1 Н-имидазол-5-метанола и метилизобутилкетона и 0,56 г (0,01 моля) гидроксида калия, в течение 20 ч перемешивали при 80 С в колбе емкостью 250 мл, обрабатывали 0,5 г древесного угля и фильтровали. Полученный фильтрат концентрировали до объема 10 мл при пониженном давлении и после добавления 100 мл ацетонитрила вновь концентрировали до объема 60 мл. Полученную суспензию перемешивали при 0 С в течение 1 ч, осажденные кристаллы отфильтровывали, дважды промывали 25 мл холодного ацетонитрила и сушили при 70 С с образованием 3,78 г (82%) указанного в заглавии соединения. Т.пл.: 263-265 С. Пример 5. Синтез лозартана калия формулы (I). Смесь, содержащую 200 мл сухого метанола, 20 г (0,026 моля) сольвата 2-н-бутил-4 хлор-1-[(2'-(2-трифенилметил-2 Н-тетразол-5 ил)-1,1'-бифенил-4-ил)метил]-1 Н-имидазол-5 метанола и метилизобутилкетона и 1,45 г (0,026 моля) гидроксида калия, в течение 3 ч кипятили с обратным холодильником в колбе емкостью 500 мл, обрабатывали 0,4 г древесного угля и фильтровали при комнатной температуре. Полученный фильтрат концентрировали до объема 30 мл при пониженном давлении и после добавления 160 мл гептана вновь концентрировали до объема 130 мл. Полученную суспензию перемешивали при 0 С в течение 2 ч, осажденные кристаллы отфильтровывали, промывали холодным гептаном и сушили при 70 С с образованием 11,3 г (92,5%) указанного в заглавии соединения. Т.пл.: 263-265 С. Пример 6. Синтез лозартана калия формулы (I). Метанольный фильтрат, полученный по методике примера 5, концентрировали до объема 30 мл при пониженном давлении и после добавления 150 мл гексана вновь концентрировали до объема 100 мл. Полученную суспензию перемешивали в течение 1 ч при 0 С, осажденные кристаллы фильтровали, промывали холод 7(94,1%) указанного в заглавии соединения. Т.пл.: 262-264 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза лозартана калия формулы (I) имеющего химическое название 2-н-бутил-4 хлор-1-[(2'-(тетразол-5-ил)-1,1'-бифенил-4 ил)метил]имидазол-5-метанол калия, с использованием в качестве исходного соединения 2-нбутил-4-хлор-1-[(2'-(2-трифенилметил-2 Нтетразол-5-ил)-1,1'-бифенил-4-ил)метил]-1 Нимидазол-5-метанол формулы (III)R-ОН (VI), где R представляет собой C1-С 4 линейную алкильную группу, с 0,1-1 эквивалентом гидроксида калия и конечный продукт реакции формулы (I) выделяют после кристаллиазции при замене растворителя на апротонный или слабопротонный растворитель. 2. Способ по п.1, отличающийся тем, что в качестве спирта используют метанол. 3. Способ по п.1 или 2, отличающийся тем,что реакцию проводят при температуре 50-80 С. 4. Способ по любому из пп.1, 2 и 3, отличающийся тем, что в качестве биполярного апротонного растворителя для кристаллизации конечного продукта используют ацетонитрил. 5. Способ по любому из пп.1, 2 и 3, отличающийся тем, что в качестве апротонного растворителя для кристаллизации конечного продукта используют линейные, или разветвленные, или циклические алифатические углеводороды. 6. Способ по любому из пп.1, 2 и 3, отличающийся тем, что в качестве протонного растворителя для кристаллизации конечного продукта используют втор-бутанол. отличающийся тем, что проводят реакцию соединения формулы (III) в среде спирта формулы
МПК / Метки
МПК: C07D 403/10, A61P 9/12, A61K 31/41
Метки: способ, получения, производного, тетразола
Код ссылки
<a href="https://eas.patents.su/5-4633-sposob-polucheniya-proizvodnogo-tetrazola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производного тетразола</a>
Предыдущий патент: Ингибиторы агрегации амилоидных белков, их применение (варианты), композиция на их основе и способ визуализации амилоидных отложений
Следующий патент: Лечение и диагностика рака
Случайный патент: Эритроциты, имеющие ферментативно уменьшенный уровень экспрессии антигена группы крови системы аво, способ их получения и применение









